van Dijk SM, Hallensleben NDL, van Santvoort HC,等。急性胰腺炎:随机试验的最新进展。肠道。2017;66(11):2024 - 32。https://doi.org/10.1136/gutjnl-2016-313595.
文章中科院PubMed谷歌学者
卢格A, Waldron RT, Mareninova OA,等。人胰腺腺泡细胞:离体胰腺炎的蛋白质组学特征、生理反应和细胞器紊乱。中国生物医学工程学报。2017;26(4):344 - 344。https://doi.org/10.1016/j.ajpath.2017.08.017.
文章中科院PubMed公共医学中心谷歌学者
郭晓明,李志强,李志强,等。胰腺炎发病机制的研究进展。中国胃肠杂志。2016;32(5):429-35。https://doi.org/10.1097/MOG.0000000000000301.
文章中科院PubMed公共医学中心谷歌学者
Lankisch PG, Apte M, Banks PA。急性胰腺炎[发表于Lancet. 2015;386(10008):2058]。柳叶刀》。2015;386(9988):85 - 96。https://doi.org/10.1016/s0140 - 6736 (14) 60649 - 8.
文章PubMed谷歌学者
范圣沃特,巴克尔,布伦,等。保守和微创方法治疗坏死性胰腺炎可改善预后。胃肠病学。2011;141(4):1254 - 63。https://doi.org/10.1053/j.gastro.2011.06.073.
文章PubMed谷歌学者
彭建勇,周志强,李志强,等。内镜干预优于微创手术治疗感染性坏死性胰腺炎:随机试验的荟萃分析Dig Endosc. 2020;32(3): 298-308。https://doi.org/10.1111/den.13470.
文章PubMed谷歌学者
张志刚,张志刚,张志刚,等。器官衰竭和感染性坏死特征对坏死性胰腺炎死亡率的影响肠道。2019;68(6):1044 - 51。https://doi.org/10.1136/gutjnl-2017-314657.
文章中科院PubMed谷歌学者
张志刚,张志刚,张志刚,等。重症急性胰腺炎的临床评估和管理:21世纪的多学科方法。中国医药科学,2019;23(2):771-87。https://doi.org/10.26355/eurrev_201901_16892.
文章中科院PubMed谷歌学者
魏建文,黄凯,杨超,等。非编码rna在表观遗传学中的调控作用(综述)。中国农业科学,2017;37(1):3-9。https://doi.org/10.3892/or.2016.5236.
文章PubMed谷歌学者
苗波,齐文杰,张文生,等。miR-148a通过下调IL-6/STAT3信号通路抑制蓝素诱导的急性胰腺炎自噬Pancreatology。2019;19(4):557 - 65。https://doi.org/10.1016/j.pan.2019.04.014.
文章中科院PubMed谷歌学者
Saliminejad K, Khorram Khorshid HR, Soleymani Fard S,等。microRNAs概述:生物学,功能,治疗和分析方法。中国生物医学工程学报。2019;34(5):544 - 544。https://doi.org/10.1002/jcp.27486.
文章中科院PubMed谷歌学者
Pham H, Rodriguez CE, Donald GW,等。miR-143降低胰腺癌细胞COX-2 mRNA的稳定性和表达。生物化学学报。2013;39(1):6-11。https://doi.org/10.1016/j.bbrc.2013.08.042.
文章中科院PubMed公共医学中心谷歌学者
李霞,姜伟,甘勇,等。外泌体microrna在胰腺癌治疗中的应用及其研究进展。胰腺。2021;50(1):劲旅。https://doi.org/10.1097/MPA.0000000000001713.
文章PubMed谷歌学者
杨东东,王志强,王志强,等。炎症和抗炎治疗中的信号通路。中国医药杂志,2018;24(14):1449-84。https://doi.org/10.2174/1381612824666180327165604.
文章中科院PubMed谷歌学者
马丽霞,王晓明,王晓明,等。TGFβ受体抑制剂galunisertib与胰腺癌患者的炎症和重塑相关蛋白有关。中国医药杂志,2019;43(5):975-91。https://doi.org/10.1007/s00280-019-03807-4.
文章中科院PubMed谷歌学者
疾病的炎症理论。越来越多的人认识到慢性炎症在许多疾病中至关重要,这为治疗开辟了新的途径。EMBO报告2012;13(11):968-70。https://doi.org/10.1038/embor.2012.142.
文章中科院PubMed公共医学中心谷歌学者
姜松,闫伟,王色,等。巨噬细胞中Let-7 microRNA对Tet2转录后调控的双重机制美国国家科学研究院。116(25): 12416 - 2019; 21。https://doi.org/10.1073/pnas.1811040116.
文章中科院PubMed公共医学中心谷歌学者
李志强,李志强,等。MicroRNA let-7通过控制A20 (NF-κB通路的抑制剂)调节对结核分枝杆菌感染的免疫应答。细胞宿主微生物。2015;17(3):345-56。https://doi.org/10.1016/j.chom.2015.01.007.
文章中科院PubMed谷歌学者
丁勇,王林,赵强,等。MicroRNA-93通过靶向TLR4/NF-κB信号通路抑制骨关节炎软骨细胞凋亡和炎症。中华分子医学杂志,2019;43(2):779-90。https://doi.org/10.3892/ijmm.2018.4033.
文章中科院PubMed谷歌学者
周伟,苏林,段X,等。MicroRNA-21下调炎症和抑制牙周炎。中华免疫杂志2018;101:608-14。https://doi.org/10.1016/j.molimm.2018.05.008.
文章中科院PubMed公共医学中心谷歌学者
潘y,惠X,胡RLC,等。脂肪细胞分泌的外泌体microRNA-34a抑制M2巨噬细胞极化促进肥胖诱导的脂肪炎症。中国临床医学杂志。2019;29(2):834-49。https://doi.org/10.1172/JCI123069.
文章PubMed公共医学中心谷歌学者
鞠敏,刘波,何红,等。MicroRNA-27a通过调节TLR4/MyD88/NF-κB通路抑制炎症和细胞凋亡,缓解lps诱导的小鼠急性肺损伤。细胞周期,2018;17(16):2001-18。https://doi.org/10.1080/15384101.2018.1509635.
文章中科院PubMed公共医学中心谷歌学者
赵晓军,于宏伟,杨永忠,等。水杨酸苷通过增加miR-200a调控Keap1/Nrf2通路来预防果糖诱导的肝脏炎症和脂质沉积[发表在Redox Biol. 2019 Apr;22:101101]。氧化还原生物学,2018;18:124-37。https://doi.org/10.1016/j.redox.2018.07.002.
文章中科院PubMed公共医学中心谷歌学者
林欣,林强。MiRNA-495-3p通过靶向IL5RA减弱TNF-α诱导的人髓核细胞凋亡和炎症。43炎症。2020;(5):1797 - 805。https://doi.org/10.1007/s10753-020-01254-5.
文章中科院PubMed谷歌学者
梁颖,谢娟,车东,等。MiR-124-3p通过靶向p65帮助预防急性呼吸窘迫综合征。生物科学通报2020;40(5):BSR20192132。https://doi.org/10.1042/BSR20192132.
文章PubMed公共医学中心谷歌学者
张安,王刚,贾林,等。外泌体介导的microRNA-138和血管内皮生长因子通过核因子-κB信号通路介导炎症和凋亡在子宫内膜异位症中的作用中华分子医学杂志,2019;43(1):358-70。https://doi.org/10.3892/ijmm.2018.3980.
文章中科院PubMed谷歌学者
金东,阮春华,李俊,等。糖皮质激素的抗炎作用是由Foxp3+调节性T细胞通过mir -342依赖机制介导的。免疫力。2020;53 (3):581 - 596. - e5。https://doi.org/10.1016/j.immuni.2020.07.002.
文章中科院PubMed公共医学中心谷歌学者
龙旭,姚旭,姜青,等。富含miR-873a-5p的星形胶质细胞来源的外泌体通过小胶质细胞表型调节抑制创伤性脑损伤后的神经炎症。神经炎症杂志,2020;17(1):89。https://doi.org/10.1186/s12974-020-01761-0.
文章中科院谷歌学者
郑玲,苏娟,张震,等。红芪苷通过影响肺上皮细胞分泌miRNA-146a外泌体调节肺泡巨噬细胞炎症通路科学通报2020;10(1):20750。https://doi.org/10.1038/s41598-020-77448-6.
文章中科院PubMed公共医学中心谷歌学者
蔡刚,蔡刚,周华,等。间充质干细胞来源的外泌体miR-542-3p抑制炎症并预防脑梗死中国生物医学工程学报。2021;12(1):2。https://doi.org/10.1186/s13287-020-02030-w.
文章中科院PubMed公共医学中心谷歌学者
赖宁,吴东,梁涛,等。全身外泌体miR-193b-3p递送可减轻小鼠蛛网膜下腔出血后早期脑损伤的神经炎症。神经炎症杂志,2020;17(1):74。https://doi.org/10.1186/s12974-020-01745-0.
文章中科院谷歌学者
王勇,沈松,李忠,等。MIR-140-5p通过靶向骨关节炎中的HMGB1影响软骨细胞增殖、凋亡和炎症。炎症研究,2020;69(1):63-73。https://doi.org/10.1007/s00011-019-01294-0.
文章中科院PubMed谷歌学者
尚杰,王玲,谭玲,等。MiR-27a-3p过表达通过靶向FOXO3和抑制NAPDH/ROS的激活来缓解脂多糖诱导的肺泡上皮细胞的炎症和凋亡。生物化学与生物物理学报。2020;533(4):723-31。https://doi.org/10.1016/j.bbrc.2020.07.126.
文章中科院PubMed谷歌学者
李文杰,李志强,李志强,等。重症急性胰腺炎:手术指征及治疗。中华外科杂志,2018;26(3):521-35。https://doi.org/10.1007/s00423-020-01944-6.
文章PubMed谷歌学者
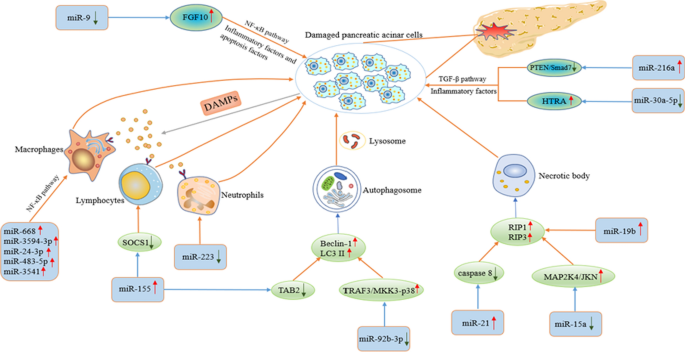
沈艳,薛超,尤刚,等。miR-9通过调控FGF10和NF-κB信号通路减轻青色素诱导的急性胰腺炎的炎症反应和细胞凋亡。中华兽医杂志,2021;22(2):795。https://doi.org/10.3892/etm.2021.10227.
文章中科院PubMed公共医学中心谷歌学者
张健,宁旭,崔伟,等。转化生长因子(TGF) β诱导的microRNA-216a通过Akt和TGF-β通路促进小鼠急性胰腺炎。中国地质大学学报(自然科学版),2015;https://doi.org/10.1007/s10620-014-3261-9.
文章中科院PubMed谷歌学者
炎症中的核因子NF-kappaB途径。中国生物医学工程学报。2009;1(6):a001651。https://doi.org/10.1101/cshperspect.a001651.
文章中科院PubMed公共医学中心谷歌学者
帕金斯ND。NF-κB亚基在癌症中的多种复杂作用。中华癌症杂志,2012;12(2):121-32。https://doi.org/10.1038/nrc3204.
文章中科院PubMed谷歌学者
金洪辉,杨晓军,赵坤林,等。罗布桃苷通过抑制NLRP3炎症小体激活和NF-κB信号通路缓解急性胰腺炎肺损伤国际免疫药监学杂志2019;75:105821。https://doi.org/10.1016/j.intimp.2019.105821.
文章中科院PubMed谷歌学者
韩东,李娟,王华,等。环状RNA circMTO1作为microRNA-9的海绵抑制肝细胞癌的进展。肝脏病学。2017;66(4):1151 - 64。https://doi.org/10.1002/hep.29270.
文章中科院PubMed谷歌学者
吴勇,唐勇,谢松,等。嵌合肽超分子纳米颗粒用于胰腺癌中plectin-1靶向miRNA-9的递送。开展。2020;10(3):1151 - 65。https://doi.org/10.7150/thno.38327.
文章中科院PubMed公共医学中心谷歌学者
陈震,陈勇,潘林,等。大成气汤通过抑制HMGB1介导的NF-κB和P38 MAPK信号通路来减轻重症急性胰腺炎的炎症反应。细胞物理与生物化学。2015;37(4):1379-89。https://doi.org/10.1159/000430403.
文章中科院PubMed谷歌学者
赵颖,王辉,陆敏,等。胰腺腺泡细胞利用mirna作为细胞间通讯的介质,参与调节胰腺炎相关巨噬细胞的激活。Mediat inflammation . 2016;2016:6340457。https://doi.org/10.1155/2016/6340457.
文章中科院谷歌学者
王志强,王志强,等。抑制转化生长因子β信号可以终止青色素诱导的胰腺炎,并消除高青色素浓度下的限制性刺激。肠道。2007;56(5):685 - 92。https://doi.org/10.1136/gut.2006.105833.
文章中科院PubMed谷歌学者
徐志贺,李志刚,李志刚,等。脑小血管疾病蛋白HTRA1通过切割proTGF-β1控制TGF-β1的数量。胡文杰,2011;20(9):1800-10。https://doi.org/10.1093/hmg/ddr063.
文章中科院PubMed谷歌学者
王丽娟,王丽娟,等。TGF-β通过调节巨噬细胞功能限制IL-33的产生并促进结肠炎的解决。中华免疫杂志2011;41(7):2000-9。https://doi.org/10.1002/eji.201041135.
文章中科院PubMed公共医学中心谷歌学者
向宏,陶旭,夏松,等。大黄素通过microrna -30a-5p介导的抑制高温需求A/转化生长因子β 1炎症信号通路缓解牛磺胆酸钠诱导的胰腺腺泡细胞损伤。前沿免疫,2017;8:1488。https://doi.org/10.3389/fimmu.2017.01488.
文章中科院PubMed公共医学中心谷歌学者
姜仁,马丽泽,蔡海杰,等。急性胰腺炎细胞死亡与DAMPsMol Med. 2014;20(1): 466-77。https://doi.org/10.2119/molmed.2014.00117.
文章中科院PubMed公共医学中心谷歌学者
霍奎,马立克,高雷利克,等。急性胰腺炎无菌性炎症反应。胰腺。2012;41(3):353 - 7。https://doi.org/10.1097/MPA.0b013e3182321500.
文章中科院PubMed公共医学中心谷歌学者
王志强,王志强,等。Th17/Treg平衡改变和IL-1β反应失调影响实验性自身免疫性关节炎的易感性/耐药性。中国免疫病原学杂志,2015;28(3):318-28。https://doi.org/10.1177/0394632015595757.
文章中科院PubMed谷歌学者
王东,唐敏,宗平,等。MiRNA-155在严重急性胰腺炎中通过靶向SOCS1调节Th17/Treg比例。前沿物理。2018;9:686。https://doi.org/10.3389/fphys.2018.00686.
文章PubMed公共医学中心谷歌学者
宋敏,王勇,周鹏,等。MicroRNA-361-5p通过损害核因子ia依赖的Hes1下调,促进白介素- 17a分泌,从而加重急性胰腺炎。中华医学杂志,2016;29(2):344 - 344。https://doi.org/10.1021/acs.jmedchem.1c01110.
文章中科院PubMed谷歌学者
戴世杰,刘志强,李志强,等。miR-29a/b1缺失促进急性胰腺炎的炎症和纤维化。JCI Insight, 2021;6(19):e149539。https://doi.org/10.1172/jci.insight.149539.
文章PubMed公共医学中心谷歌学者
李志强,李志强。自噬基因的生物学功能:疾病视角。细胞。2019;176(1 - 2):11-42。https://doi.org/10.1016/j.cell.2018.09.048.
文章中科院PubMed公共医学中心谷歌学者
郭国强,王志强,王志强,等。自噬作为癌症治疗的分子靶点。中国医药科学,2019;134:116-37。https://doi.org/10.1016/j.ejps.2019.04.011.
文章中科院PubMed谷歌学者
张志刚,张志刚,张志刚,等。线粒体功能障碍,通过自噬受损,导致内质网应激,脂质代谢失调和动物模型中的胰腺炎。胃肠病学。2018;154(3):689 - 703。https://doi.org/10.1053/j.gastro.2017.10.012.
文章中科院PubMed谷歌学者
梅青,曾勇,黄超,等。雷帕霉素通过恢复自噬通量和抑制内质网应激缓解高甘油三酯血症相关的急性胰腺炎43炎症。2020;(4):1510 - 23所示。https://doi.org/10.1007/s10753-020-01228-7.
文章中科院PubMed谷歌学者
万杰,杨鑫,任勇,等。抑制miR-155在实验性胰腺炎小鼠模型中减少受损的自噬并改善预后。细胞死亡,2019;10(4):303。https://doi.org/10.1038/s41419-019-1545-x.
文章中科院PubMed公共医学中心谷歌学者
孙华,田娟,李娟。MiR-92b-3p通过靶向TRAF3和抑制MKK3-p38通路改善青色素诱导的AR42J细胞炎症和自噬。《免疫药物学杂志》2020;88:106691。https://doi.org/10.1016/j.intimp.2020.106691.
文章中科院PubMed谷歌学者
李志强,李志强,李志强,等。抗生素治疗急性胰腺炎胰腺坏死感染的临床观察。Cochrane数据库系统Rev. 2010;2010(5):CD002941。https://doi.org/10.1002/14651858.CD002941.pub3.
文章公共医学中心谷歌学者
Garg PK, Meena D, Babu D,等。急性胰腺炎后假性囊肿和壁性坏死的内镜与腹腔镜引流:一项随机试验。中华外科杂志2020;34(3):1157-66。https://doi.org/10.1007/s00464-019-06866-z.
文章PubMed谷歌学者
王晓燕,王晓燕,王晓燕,等。胰腺炎细胞死亡:半胱天冬酶保护坏死性胰腺炎。中国生物医学工程学报。2006;26(6):366 - 366。https://doi.org/10.1074/jbc.M511276200.
文章中科院PubMed谷歌学者
马X,康克林,李峰,等。致癌microRNA miR-21促进小鼠调节坏死。Nat community . 2015;6:7151。https://doi.org/10.1038/ncomms8151.
文章PubMed谷歌学者
胡明明,张宏伟,付强,等。MicroRNA-19b在急性坏死性胰腺炎腺泡坏死中的作用华中科技大学学报(医学版),2016;36(2):221-5。https://doi.org/10.1007/s11596-016-1570-2.
文章中科院PubMed谷歌学者
甄杰,陈伟,刘勇,等。黄芩苷通过调控miR-15a来预防JNK信号通路参与的急性胰腺炎。中华医学杂志,2021;49(1):147-61。https://doi.org/10.1142/S0192415X21500087.
文章中科院PubMed谷歌学者
里皮G,瓦伦蒂诺M, Cervellin G.急性胰腺炎的实验室诊断:在寻找圣杯。危重症临床实验室,2012;49(1):18-31。https://doi.org/10.3109/10408363.2012.658354.
文章中科院PubMed谷歌学者
刘鹏,夏林,张伟林,等。血清microRNAs作为急性胰腺炎诊断和预后的生物标志物的鉴定。Pancreatology。2014;14(3):159 - 66。https://doi.org/10.1016/j.pan.2014.03.019.
文章中科院PubMed谷歌学者
王志强,王志强,王志强,等。血液浓度是坏死性胰腺炎的早期危险因素。中华胃肠病杂志。1998;93(11):2130-4。https://doi.org/10.1111/j.1572-0241.1998.00608.x.
文章中科院PubMed谷歌学者
毛eq,费杰,彭一波,等。在严重急性胰腺炎患者中,快速血液稀释与脓毒症和死亡率增加相关。中华医学杂志,2010;29(3):344 - 344。
中科院PubMed谷歌学者
kutznierz - cabala B, Nowak E, Sporek M,等。血清中独特的miR-551-5p和内皮特异性miR-126a-5p水平可以区分急性胰腺炎早期患者。Pancreatology。2015;15(4):344 - 51。https://doi.org/10.1016/j.pan.2015.05.475.
文章中科院PubMed谷歌学者
安峰,詹强,夏敏,等。从中度到重度高甘油三酯血症诱导的急性胰腺炎:循环mirna发挥潜在的生物标志物作用。PLoS ONE。2014; 9 (11): e111058。https://doi.org/10.1371/journal.pone.0111058.
文章中科院PubMed公共医学中心谷歌学者
卢小刚,康旭,詹伯林,等。循环miRNAs作为与急性肺损伤相关的严重急性胰腺炎的生物标志物。世界胃肠杂志,2017;23(41):7440-9。https://doi.org/10.3748/wjg.v23.i41.7440.
文章中科院PubMed公共医学中心谷歌学者
循环microRNA-146a和microRNA-146b有可能作为急性胰腺炎治疗和预后的标志物。欧洲医学与药物科学2020;24(24):12770-80。https://doi.org/10.26355/eurrev_202012_24177.
文章PubMed谷歌学者
miR-192-5p在非酒精性脂肪肝急性胰腺炎患者中的表达异常及其在急性胰腺炎进展中的作用生物科学通报2020;40(5):BSR20194345。https://doi.org/10.1042/BSR20194345.
文章PubMed公共医学中心谷歌学者
单燕,孔伟,朱安,等。miR-372水平升高与高脂血症急性胰腺炎患者的疾病进展相关。中华医学杂志2020;19(6):3845-50。https://doi.org/10.3892/etm.2020.8609.
文章中科院PubMed公共医学中心谷歌学者
高敏,边娥,李华,等。急性胰腺炎患者循环miR-29a上调,与疾病严重程度和不良预后呈正相关。中国科学。2018;34(10):931-6。
PubMed谷歌学者
陆鹏,王峰,吴娟,等。血清miR-7、miR-9、miR-122和miR-141升高是急性胰腺炎的非侵袭性生物标志物。Dis marker . 2017;2017:7293459。https://doi.org/10.1155/2017/7293459.
文章中科院PubMed公共医学中心谷歌学者
胡林,韩东,于东,等。循环血液miR-155和miR-21促进急性胰腺炎的发展,可用于评估胰腺炎的风险分层。中华卫生杂志,2021;2021:2064162。https://doi.org/10.1155/2021/2064162.
文章PubMed公共医学中心谷歌学者
石楠,邓林,陈伟,等。microRNA-127是急性胰腺炎合并肺损伤的新型生物标志物吗?疾病标记。2017;2017:1204295。https://doi.org/10.1155/2017/1204295.
文章中科院PubMed公共医学中心谷歌学者
张XX,邓LH,陈文文,等。循环microRNA 216作为早期识别严重急性胰腺炎的标志。中华医学杂志,2017;36(2):344 - 344。https://doi.org/10.1016/j.amjms.2016.12.007.
文章PubMed谷歌学者
Hines OJ, Pandol SJ。重症急性胰腺炎的处理。BMJ。2019; 367: l6227。https://doi.org/10.1136/bmj.l6227.
文章PubMed谷歌学者
王倩,刘珊,韩忠。miR-339-3p通过靶向TNF受体相关因子3调控AR42J细胞青色素诱导的急性胰腺炎。开放生命科学,2020;15(1):912-22。https://doi.org/10.1515/biol-2020-0084.
文章中科院PubMed公共医学中心谷歌学者
Ge W, Goga A, He Y,等。miR-802在早期胰腺炎和胰腺癌发生过程中抑制腺泡-导管重编程。胃肠病学。2022;162(1):269 - 84。https://doi.org/10.1053/j.gastro.2021.09.029.
文章中科院PubMed谷歌学者
朱顺丰,陈文文,向杰,等。中药六和丹软膏与微米六和丹软膏在急性胰腺炎大鼠体内的药代动力学和药效学比较。循证补体交替医学2014;2014:389576。https://doi.org/10.1155/2014/389576.
文章PubMed公共医学中心谷歌学者
王杰,郭勇,李桂兰.中国中药标准化现状。循证补体交替医学2016;2016:9123103。https://doi.org/10.1155/2016/9123103.
文章PubMed公共医学中心谷歌学者
王琼,W依平,Y金林,等。中草药治疗急性胰腺炎。Cochrane Database Syst Rev. 2005;1:CD003631。https://doi.org/10.1002/14651858.CD003631.pub2.
文章谷歌学者
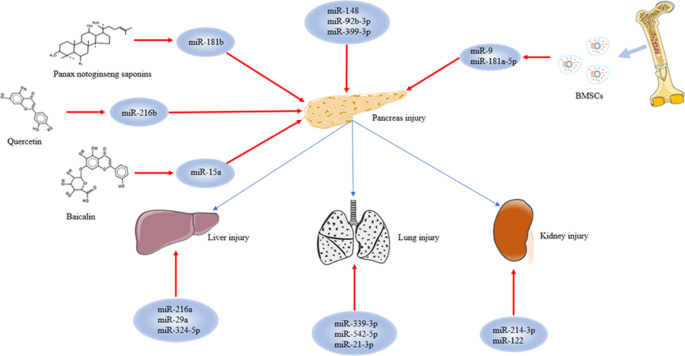
刘文伟,魏睿,苏MX,等。三七总皂苷通过上调miR-181b表达,调控mTOR/Akt和caspase-3信号通路,对大鼠重症急性胰腺炎的影响中国生物医学工程学报。2018;18(1):51。https://doi.org/10.1186/s12906-018-2118-8.
文章中科院PubMed公共医学中心谷歌学者
盛斌,赵林,臧欣,等。槲皮素通过靶向MAP2K6和NEAT1调控miR-216b抑制青紫素诱导的急性胰腺炎。Inflammopharmacology。2021;29(2):549 - 59。https://doi.org/10.1007/s10787-020-00767-7.
文章中科院PubMed谷歌学者
杨建军,王建军,王志强。间充质干细胞:免疫回避,而不是免疫特权。生物技术学报。2014;32(3):252-60。https://doi.org/10.1038/nbt.2816.
文章中科院PubMed公共医学中心谷歌学者
付旭,刘刚,哈利姆A,等。间充质干细胞迁移与组织修复。细胞。2019;8(8):784。https://doi.org/10.3390/cells8080784.
文章中科院公共医学中心谷歌学者
钱东,宋刚,马智,等。MicroRNA-9修饰的骨髓间充质干细胞(BMSCs)通过诱导血管生成修复大鼠严重急性胰腺炎(SAP)。中国生物医学工程杂志,2018;9(1):282。https://doi.org/10.1186/s13287-018-1022-y.
文章中科院PubMed公共医学中心谷歌学者
钱东,魏刚,徐超,等。骨髓间充质干细胞(BMSCs)通过分泌靶向NF-κB1/p50基因的microRNA-9修复大鼠急性坏死性胰腺炎。科学通报2017;7(1):581。https://doi.org/10.1038/s41598-017-00629-3.
文章中科院PubMed公共医学中心谷歌学者
李海海,何兴华,宋建峰,等。骨髓源性间充质干细胞通过分泌miR-181a-5p靶向PTEN/Akt/TGF-β1信号通路修复严重急性胰腺炎手机信号。2020;66:109436。https://doi.org/10.1016/j.cellsig.2019.109436.
文章中科院PubMed谷歌学者
吴小明,季kq,王海燕,等。MicroRNA-339-3p通过Akt/mTOR信号通路调节Anxa3缓解严重急性胰腺炎相关急性肺损伤小鼠的炎症和水肿并抑制肺微血管内皮细胞凋亡[撤回:J cell Biochem. 2021 Nov;122 Suppl 1:S107]。中国生物医学工程学报,2018;29(4):344 - 344。https://doi.org/10.1002/jcb.26859.
文章中科院PubMed谷歌学者
何仁强,李新军,梁林,等。miR-542-5p在NSCLC中的抑制作用:来自临床数据的证据和使用小鸡绒毛膜模型的体内验证。癌症杂志,2017;17(1):655。https://doi.org/10.1186/s12885-017-3646-1.
文章中科院PubMed公共医学中心谷歌学者
吴晓明,姬kq,王海海,等。microRNA-542-5p通过p21激活激酶1的负调控抑制丝裂原激活蛋白激酶信号通路,保护严重急性胰腺炎小鼠的急性肺损伤[撤回:J Cell Biochem. 2021 Nov;122 Suppl 1:S117]。中国生物医学工程学报,2019;29(1):349 - 349。https://doi.org/10.1002/jcb.27356.
文章中科院PubMed谷歌学者
王涛,姜林,魏霞,等。MiR-21-3p通过激活TRP信号通路加重急性出血性坏死性胰腺炎大鼠损伤生物医学药学,2018;107:1744-53。https://doi.org/10.1016/j.biopha.2018.08.164.
文章中科院PubMed谷歌学者
闫泽,臧波,龚霞,等。MiR-214-3p加重高脂血性胰腺炎并发急性肾损伤引起的肾损害和炎症。生命科学2020;241:117118。https://doi.org/10.1016/j.lfs.2019.117118.
文章中科院PubMed谷歌学者
李志刚,李志刚,李志刚,等。炎症诱导的microRNA 122的表达和分泌导致肾源性红细胞生成素和贫血的血液水平降低。胃肠病学。2016;151(5):999 - 1010。https://doi.org/10.1053/j.gastro.2016.07.031.
文章中科院PubMed谷歌学者
韩悠悠,王春春,杨林,等。急性胰腺炎患者外周血microRNA 216a、324-5p和29a表达的意义及其与肝损伤的相关性中华医学学报。2020;100(27):2126-31。https://doi.org/10.3760/cma.j.cn112137-20200103-00016.
文章中科院PubMed谷歌学者