Palfree RG。尿激酶型纤溶酶原激活物受体是Ly-6超家族的成员。今日免疫。1991;12(5):170。
文章中科院PubMed谷歌学者
gpi -锚定分子Ly-6超家族的出现。细胞生物学杂志,1991;15(9):769-77。
文章中科院PubMed谷歌学者
Stoppelli MP, Corti A, Soffientini A, Cassani G, Blasi F, Assoian RK。人尿激酶纤溶酶原激活物氨基端片段与U937单核细胞上的特定受体的分化增强结合。美国国家科学研究院。1985; 82(15): 4939 - 43。
文章中科院PubMed公共医学中心谷歌学者
Vassalli JD, bachino D, Belin D. Mr 55,000形式的人纤溶酶原激活物尿激酶的细胞结合位点。中国生物医学工程学报,2005;30(1):344 - 344。
文章中科院PubMed谷歌学者
Nielsen LS, Kellerman GM, Behrendt N, Picone R, Danø K, Blasi F.一种55000-60000 Mr受体蛋白尿激酶型纤溶酶原激活剂。人肿瘤细胞系的鉴定及部分纯化。中国生物医学工程学报。1988;26(5):344 - 344。
文章中科院PubMed谷歌学者
Ploug M, Rønne E, Behrendt N, Jensen AL, Blasi F, Danø K.尿激酶纤溶酶原激活物的细胞受体。糖基-磷脂酰肌醇羧基末端处理及膜锚定。中国生物化学杂志,2001;26(3):326 - 326。
文章中科院PubMed谷歌学者
埃利斯V,斯库利MF,卡卡尔VV。由单链尿激酶型纤溶酶原激活剂引起的纤溶酶原激活。U937单核细胞增强。中国生物医学工程学报。1989;26(4):339 - 339。
文章中科院PubMed谷歌学者
李志强,李志强,李志强,等。受体结合尿激酶对纤溶酶原活化的影响。细胞相关受体和分离受体的动力学研究。中国生物化学杂志,2001;26(4):339 - 339。
文章中科院PubMed谷歌学者
Behrendt N, Rønne E, Danø k尿激酶受体的结构和功能,一种在细胞表面控制纤溶酶原激活的膜蛋白。中国生物化学杂志。1995;36(5):369 - 369。
中科院PubMed谷歌学者
尿激酶受体(uPAR)和uPAR相关蛋白(uPARAP/Endo180):在组织重塑过程中参与基质翻转的膜蛋白。中国生物化学杂志,2004;36(2):103-36。
文章中科院PubMed谷歌学者
Cooper F, Overmiller AM, Loder A, Brennan-Crispi DM, McGuinn KP, Marous MR, Freeman TA, Riobo-Del Galdo NA, Siracusa LD, Wahl JR 3rd,等。Dsg2增加uPAR分泌促进皮肤伤口愈合。中国皮肤病杂志。2018;38(11):2470-9。
文章中科院PubMed公共医学中心谷歌学者
Genua M, D 'Alessio S, Cibella J, Gandelli A, Sala E, Correale C, Spinelli A, Arena V, Malesci A, Rutella S,等。尿激酶纤溶酶原激活物受体(uPAR)控制肠道炎症中的巨噬细胞吞噬作用。肠道。2015;64(4):589 - 600。
文章中科院PubMed谷歌学者
程勇,Hall TR,徐旭,容毅,Souza D,郑杰,Schiele F, Hoffmann M, Mbow ML, Garnett JP,等。针对uPA-uPAR相互作用改善炎症性肠病肠道上皮屏障完整性生物医学杂志。2022;75:103758。
文章PubMed谷歌学者
马泽华,马泽华,马泽华。人滋养层对尿激酶受体表达的影响。组织化学和超微结构分析。科学通报。1994;21(3):392-400。
中科院PubMed谷歌学者
Stephens RW, Pöllänen J, Tapiovaara H, Leung KC, Sim PS, Salonen EM, Rønne E, Behrendt N, Danø K, Vaheri a .原尿激酶和纤溶酶原在人肉瘤细胞上的激活:具有表面结合反应物的蛋白水解系统。中国生物医学工程学报,2001;29(5):344 - 344。
文章中科院PubMed谷歌学者
犁EF,迈尔斯洛杉矶。纤溶酶原受体在细胞周蛋白水解中的介导作用。中国生物医学工程学报,2001;32(3):344 - 344。
文章中科院PubMed谷歌学者
Hahn-Dantona E, Ramos-DeSimone N, Sipley J, Nagase H, French DL, Quigley JP。在肿瘤细胞模型中,由纤溶酶/MMP-3级联激活proMMP-9。金属蛋白酶组织抑制剂的调节作用。南京大学学报(自然科学版),1999;
文章中科院PubMed谷歌学者
Legrand C, Polette M, Tournier JM, de Bentzmann S, Huet E, Monteau M, Birembaut P. uPA/纤溶酶系统介导的MMP-9激活与支气管上皮细胞迁移有关。科学通报,2001;26(2):326 - 326。
文章中科院PubMed谷歌学者
Ramos-DeSimone N, Hahn-Dantona E, Sipley J, Nagase H, French DL, Quigley JP。基质金属蛋白酶-9 (MMP-9)通过聚合纤溶酶/基质溶血素-1级联增强肿瘤细胞侵袭。中国生物医学工程学报,1999;26(4):516 - 516。
文章中科院PubMed谷歌学者
裴卓卓,黄建平,陈建平,陈建平,陈建平,等。生长板软骨细胞胞外基质中转化生长因子β - 1释放和活化的研究进展。内分泌学。1999;140(12):5806 - 16。
文章中科院PubMed谷歌学者
Park JE, Keller GA, Ferrara N.血管内皮生长因子(VEGF)异构体:分化沉积到上皮下细胞外基质和细胞外基质结合VEGF的生物活性。Mol生物细胞。1993;4(12):1317-26。
文章中科院PubMed公共医学中心谷歌学者
魏勇,DA华尔兹,Rao N, Drummond RJ, Rosenberg S, Chapman HA。尿激酶受体作为vitronectin粘附受体的鉴定。中国生物化学杂志,1994;69(51):32380-8。
文章中科院PubMed谷歌学者
Kugler MC, Wei Y, Chapman HA。尿激酶受体和整合素相互作用。中国医药杂志,2003;9(19):1565-74。
文章中科院PubMed谷歌学者
魏勇,Eble JA,王泽,Kreidberg JA, Chapman HA。尿激酶受体通过与integrin alpha3beta1相互作用促进beta1整合素功能。分子生物学杂志,2001;12(10):2975-86。
文章中科院PubMed公共医学中心谷歌学者
魏y, czzekay RP, Robillard L, Kugler MC,张飞,Kim KK,熊jp, Humphries MJ, Chapman HA。尿激酶受体结合对alpha5beta1整合素构象和功能的调控。中国生物医学工程学报,2005;29(3):344 - 344。
文章中科院PubMed公共医学中心谷歌学者
Tarui T, Mazar AP, Cines DB, Takada Y.尿激酶型纤溶酶原激活物受体(CD87)是整合素的配体,介导细胞-细胞相互作用。中国生物医学工程学报,2001;26(6):369 - 369。
文章中科院PubMed谷歌学者
卡里罗MV,德尔·维奇奥S,卡波佐利M,弗兰科P,丰塔纳L,赞内蒂A,波蒂G,达乌托G,塞尔瓦托M,斯托佩利MP。尿激酶受体与α (v)beta5 vitronectin受体相互作用,促进乳腺癌中尿激酶依赖性细胞迁移。癌症杂志1999;59(20):5307-14。
中科院PubMed谷歌学者
刘丹,Aguirre Ghiso J, Estrada Y, Ossowski L. EGFR是一种尿激酶受体启动信号的换能器,是人癌在体内生长所必需的。中华癌症杂志,2002;1(5):445-57。
文章中科院PubMed谷歌学者
Aguirre Ghiso JA。抑制尿激酶受体激活的FAK信号在体内诱导人癌细胞休眠。致癌基因。2002;21(16):2513 - 24。
文章PubMed谷歌学者
Aguirre-Ghiso JA, Liu D, Mignatti A, Kovalski K, Ossowski L.尿激酶受体和纤维连接蛋白调节ERK(MAPK)和p38(MAPK)活性比值,决定癌细胞在体内的增殖或休眠。Mol生物细胞,2001;12(4):863-79。
文章中科院PubMed公共医学中心谷歌学者
Ma Z, Thomas KS, Webb DJ, Moravec R, Salicioni AM, Mars WM, Gonias SL.低密度脂蛋白受体相关蛋白对Rac1激活的调控。中国生物医学工程学报,2002;29(6):457 - 457。
文章中科院PubMed公共医学中心谷歌学者
杨晓燕,李晓燕,李晓燕。pdgfr - β介导人血管平滑肌细胞中尿激酶诱导信号通路的研究进展。中国生物医学工程学报。2005;24(10):1787-97。
文章中科院PubMed公共医学中心谷歌学者
刘凯,范军,吴洁。寿司重复蛋白X-linked 2通过尿激酶型纤溶酶原激活物受体依赖的整合素avβ3/黏附激酶途径促进血管生成。药物发现杂志,2017;11(4):212-7。
文章中科院PubMed谷歌学者
Resnati M, Pallavicini I, Wang JM, Oppenheim J, Serhan CN, Romano M, Blasi F.尿激酶纤溶受体激活G蛋白偶联趋化受体FPRL1/LXA4R。美国国家科学研究院。2002, 99(3): 1359 - 64。
文章中科院PubMed公共医学中心谷歌学者
韩倩,冷杰,卞东,马汉尼旺C,卡彭卡,潘志凯,韩娟,黄森。Rac1-MKK3-p38-MAPKAPK2通路促进侵袭性乳腺癌细胞尿激酶纤溶酶原激活物mRNA稳定性。中国生物医学工程学报,2002;27(5):529 - 529。
文章中科院PubMed谷歌学者
柯舍尼克Y,埃哈特M,赫夫纳格P,海因里希PC,宾德BR。尿激酶受体与JAK1/STAT1信号通路的组成部分相关,并导致该通路在人肾上皮肿瘤细胞系tl -598中受体聚类时被激活。中国生物医学工程学报,2001;29(4):344 - 344。
文章中科院PubMed谷歌学者
Bifulco K, Longanesi-Cattani I, Gala M, Di Carluccio G, Masucci MT, Pavone V, Lista L, Arra C, Stoppelli MP, Carriero MV。尿激酶受体的可溶性形式通过其Ser促进血管生成88-Arg-Ser-Arg-Tyr92趋化现象的序列。中华血液学杂志,2010;8(12):2789-99。
文章中科院PubMed谷歌学者
Rossi FW, Prevete N, Rivellese F, Napolitano F, Montuori N, Postiglione L, Selleri C, de Paulis A.肥大细胞中的尿激酶/尿激酶受体系统:其与fMLF受体功能相互作用的影响。Transl Med UniSa。2016; 15:34-41。
PubMed公共医学中心谷歌学者
Olson D, Pöllänen J, h ø yr - hansen G, Rønne E, Sakaguchi K, Wun TC, Appella E, Danø K, Blasi F.尿激酶-纤溶酶原激活物抑制剂1型复合体的内化是由尿激酶受体介导的。中国生物医学工程学报。1992;26(3):339 - 339。
文章中科院PubMed谷歌学者
聂克杰,李志刚,李志刚,李志刚,李志刚。uPA内化后尿激酶受体再循环的研究进展。杨晓东,王晓明,2004;16(10):419 - 419。
文章中科院PubMed公共医学中心谷歌学者
捷克RP,库梅尔TA,奥兰多RA,法夸尔MG。占用的尿激酶受体(uPAR)与LDL受体相关蛋白的直接结合是uPAR内吞作用和调节细胞表面尿激酶活性所必需的。分子生物学杂志,2001;12(5):1467-79。
文章中科院PubMed公共医学中心谷歌学者
Fisher JL, Field CL, Zhou H, Harris TL, Henderson MA, Choong PF.尿激酶纤溶酶原激活物系统基因在人乳腺癌及其骨转移中的表达增加-正常乳腺组织,非侵袭性和侵袭性癌及骨转移的比较。乳腺癌治疗与治疗。2000;21(1):1 - 12。
文章中科院PubMed谷歌学者
何超,何鹏,刘丽萍,朱玉生。纤溶酶原激活物系统在高转移和低转移人肺癌细胞中的表达分析。中华肿瘤学杂志,2001;29(3):344 - 344。
文章中科院PubMed谷歌学者
Dohn LH, Pappot H, Iversen BR, Illemann M, Høyer- hansen G, Christensen IJ, Thind P, Salling L, von der Maase H, Laerum OD。尿路上皮性膀胱癌患者uPAR的表达模式——可能的临床意义。PLoS ONE。2015; 10 (8): e0135824。
文章PubMed公共医学中心谷歌学者
Mabrouk RA, Ali-Labib R.乳腺癌和卵巢癌患者血清中尿激酶纤溶酶原激活物受体和c-erbB-2的检测。临床生化杂志,2003;36(7):537-43。
文章中科院PubMed谷歌学者
木村S, D 'Andrea D, Iwata T, Foerster B, Janisch F, Parizi MK, Moschini M, Briganti A, Babjuk M, Chlosta P,等。非转移性前列腺癌中尿激酶型纤溶酶原激活物系统的表达。世界泌尿学杂志,2020;38(10):2501-11。
文章中科院PubMed谷歌学者
森田Y,林Y,王y,金楠T,铃木S,川崎K,大田K,山本M,斋藤Y,伊藤H,等。尿激酶型纤溶酶原激活物受体在肝细胞癌中的表达。肝脏病学。1997;25(4):856 - 61。
文章中科院PubMed谷歌学者
Pyke C, Ralfkiaer E, Rønne E, Høyer-Hansen G, Kirkeby L, Danø K.人结肠癌尿激酶纤溶酶原激活物受体的免疫组化检测。组织病理学,1994;24(2):131 - 8。
文章中科院PubMed谷歌学者
Cantero D, Friess H, Deflorin J, Zimmermann A, Bründler MA, Riesle E, Korc M, Büchler MW。胰腺癌中尿激酶纤溶酶原激活物及其受体的增强表达。中华肿瘤学杂志,1997;30(3):388-95。
文章中科院PubMed公共医学中心谷歌学者
洪思,Park IC, Son YS, Lee SH, Kim BG, Lee JI, Lee TW,郭永华,Min YI, Hong WS。尿激酶型纤溶酶原激活物、受体和抑制剂在胃腺癌组织中的表达。中华医学杂志1996;11(1):33-7。
文章中科院PubMed公共医学中心谷歌学者
山本M, Sawaya R, Mohanam S, Rao VH, Bruner JM, Nicolson GL, Rao JS。尿激酶型纤溶酶原激活物受体在人脑胶质瘤中的表达和定位。癌症决议1994;54(18):5016-20。
中科院PubMed谷歌学者
Graf M, Reif S, Hecht K, Pelka-Fleischer R, Pfister K, Schmetzer H.急性髓系白血病(AML)尿激酶纤溶酶原激活物受体(UPA-R)高表达与预后不良相关。中华血液学杂志,2005;29(1):1 - 5。
文章中科院PubMed谷歌学者
寿汉林,曹东,董晓华,方强,徐宝林,费建平。骨髓尿激酶纤溶酶原激活物受体水平与多发性骨髓瘤的进展相关。中华医学杂志,2016;31(3):155-60。
文章PubMed谷歌学者
Pierga JY, Bonneton C, Magdelénat H, Vincent-Salomon A, Nos C, Boudou E, Pouillart P, Thiery JP, de Cremoux P.乳腺癌患者骨髓分离微转移细胞尿激酶型纤溶酶原激活物受体(uPAR)表达的实时定量PCR检测。中华肿瘤学杂志,2005;29(2):339 - 339。
文章中科院PubMed谷歌学者
Hildenbrand R, Schaaf A, Dorn-Beineke A, Allgayer H, Sütterlin M, Marx A, Stroebel P.肿瘤间质是人乳腺癌中主要表达uPA-, uPAR-, pai -1的组织:预后影响。组织病理学杂志,2009;24(7):869-77。
中科院PubMed谷歌学者
Boonstra MC, Verbeek FP, Mazar AP, Prevoo HA, Kuppen PJ, van de Velde CJ, Vahrmeijer AL, Sier CF.肿瘤相关基质细胞中uPAR表达与结直肠癌患者预后相关:一项TMA研究BMC癌症杂志,2014;14:269。
文章PubMed公共医学中心谷歌学者
de Geus SW, Baart VM, Boonstra MC, Kuppen PJ, Prevoo HA, Mazar AP, Bonsing BA, Morreau H, van de Velde CJ, Vahrmeijer AL,等。胰腺癌中尿激酶纤溶酶原激活物受体表达对预后的影响:恶性与基质细胞。生物标记研究。2017;12:1177271917715443。
PubMed公共医学中心谷歌学者
唐春春,希尔ML, Brumwell AN, Chapman HA,魏勇。肺癌细胞通过尿激酶和尿激酶受体的信号通路需要与beta1整合素相互作用。中国生物医学工程学报,2008;29(4):344 - 344。
文章中科院PubMed谷歌学者
戈麦斯-贾科亚E,三宅M,古迪逊S,罗瑟CJ。针对纤溶酶原激活物抑制剂-1抑制血管生成和肿瘤生长在人癌异种移植模型。中华癌症杂志,2013;12(12):2697-708。
文章中科院PubMed公共医学中心谷歌学者
Gogineni VR, Gupta R, Nalla AK, Velpula KK, Rao JS。uPAR和组织蛋白酶B shRNA在xiap依赖通路中阻碍TGF-β1驱动的脑膜瘤细胞增殖和侵袭。细胞死亡,2012;3(12):e439。
文章中科院PubMed公共医学中心谷歌学者
Yanamandra N, Konduri SD, Mohanam S, Dinh DH, Olivero WC, Gujrati M, Nicolson GL, obbeyeseke M, Rao JS。尿激酶型纤溶酶原激活物受体(uPAR)下调诱导人胶质母细胞瘤细胞caspase介导的细胞死亡。临床经验转移。2001;18(7):611-5。
文章谷歌学者
Matheis F, Heppt MV, Graf SA, Düwell P, Kammerbauer C, Aigner A, Besch R, Berking C.免疫刺激和uPAR抑制双功能方法在黑色素瘤中显示出强大的抗肿瘤活性。中华医学杂志,2016;36(12):2475-84。
文章中科院PubMed谷歌学者
刚迪,甘胡库里N,丁DH,古吉拉提M,饶杰。下调uPAR和uPA激活caspase介导的细胞凋亡,抑制PI3K/AKT通路。中华肿瘤学杂志,2007;31(1):19-27。
中科院PubMed谷歌学者
拉古H,贡迪CS,丁DH,古吉拉提M,饶JS。特异性抑制uPA/uPAR可通过抑制Notch-1受体的切割和转运来减弱胶质母细胞瘤细胞和异种移植的侵袭。摩尔癌症。2011;10:130。
文章中科院PubMed公共医学中心谷歌学者
鲍尔TW,刘w,范f, Camp ER,杨A, Somcio RJ, Bucana CD, Callahan J, Parry GC, Evans DB,等。在人胰腺癌细胞中靶向尿激酶纤溶酶原激活物受体抑制c-Met和胰岛素样生长因子- i受体介导的小鼠肿瘤的迁移和侵袭和原位生长。癌症杂志2005;65(17):7775-81。
文章中科院PubMed谷歌学者
Subramanian R, Gondi CS, Lakka SS, Jutla A, Rao JS。sirna介导的同时下调uPA及其受体抑制乳腺癌细胞血管生成和侵袭性引发细胞凋亡。中华肿瘤学杂志,2006;28(4):831-9。
中科院PubMed谷歌学者
李超,曹珊珊,刘震,叶霞,陈玲,孟S. rnai介导的uPAR下调通过ERK通路协同靶向HER2在乳腺癌细胞中的作用。中华癌症杂志,2010;27(7):1507-16。
文章中科院PubMed谷歌学者
Huber MC, Mall R, Braselmann H, Feuchtinger A, Molatore S, Lindner K, Walch A, Gross E, Schmitt M, Falkenberg N等人uPAR通过直接与uPA和IGF1R相互作用增强三阴性乳腺癌的恶性潜能。BMC Cancer, 2016;16:615。
文章PubMed公共医学中心谷歌学者
unsell M, Chilla A, Pausz C, Mawas R, Breuss J, Zielinski C, Schabbauer G, Prager GW。uPAR下调内皮细胞中PTEN的表达,促进血管生成。中华血液病杂志,2015;14(2):379-89。
文章中科院PubMed谷歌学者
拉古H,那拉AK,贡迪CS,古吉拉特邦M,丁DH,拉奥JS。在内皮细胞和胶质母细胞瘤细胞中,uPA和uPAR shRNA通过增强SVEGFR1的分泌来抑制血管生成,而不依赖于GM-CSF,但依赖于TIMP-1。中国生物医学杂志,2012;6(1):33-47。
文章中科院PubMed谷歌学者
Herkenne S, Paques C, Nivelles O, Lion M, Bajou K, Pollenus T, Fontaine M, Carmeliet P, Martial JA, Nguyen NQ,等。uPAR与VEGFR2的相互作用促进了vegf诱导的血管生成。科学通报,2015;8(403):ra117。
文章PubMed谷歌学者
人类癌症中的尿激酶纤溶酶原激活物系统:其预后和预测作用的概述。中华血液病杂志,2018;18(12):2020-36。
文章PubMed谷歌学者
Shariat SF, Roehrborn CG, McConnell JD, Park S, Alam N, Wheeler TM, Slawin KM。尿激酶系统中纤溶酶原激活的循环水平与前列腺癌的存在、侵袭、进展和转移的关系。中华临床杂志,2007;25(4):349-55。
文章中科院PubMed谷歌学者
熊野M, Miyake H, Muramaki M, Furukawa J, Takenaka A, Fujisawa M.前列腺癌中尿激酶型纤溶酶原激活物系统的表达与根治性前列腺切除术患者临床病理结果的相关性。中国泌尿外科杂志,2009;27(2):180-6。
文章中科院PubMed谷歌学者
Memarzadeh S, Kozak KR, Chang L, Natarajan S, Shintaku P, Reddy ST, Farias-Eisner R.尿激酶纤溶酶原激活物受体:子宫内膜癌预后的生物标志物。美国国家科学研究院。2002; 99(16): 10647 - 52。
文章PubMed公共医学中心谷歌学者
De Vries TJ, Mooy CM, Van Balken MR, Luyten GP, Quax PH, Verspaget HW, Weidle UH, Ruiter DJ, Van Muijen GN。葡萄膜黑素瘤纤溶酶原激活系统组成的临床病理研究。中华病毒学杂志,1995;17(1):59-67。
文章中科院PubMed谷歌学者
杨建林,Seetoo DQ,王勇,Ranson M, Berney CR, Ham JM, Russell PJ, Crowe PJ。大肠癌中尿激酶型纤溶酶原激活物及其受体:转移和癌症特异性生存的独立预后因素和潜在的治疗靶点。中华癌症杂志,2000;39(5):431-9。
文章中科院PubMed谷歌学者
Halamkova J, Kiss I, Pavlovsky Z, Tomasek J, Jarkovsky J,切赫Z, Tucek S, Hanakova L, Moulis M, zavrellova J,等。纤溶酶原激活物系统与结直肠癌患者肿瘤分级及治疗反应的临床意义赘生物。58 2011;(5):377 - 85。
文章中科院PubMed谷歌学者
Dubuisson L, Monvoisin A, Nielsen BS, Le Bail B, Bioulac-Sage P, Rosenbaum J.尿激酶型纤溶酶原激活物及其受体在人肝细胞癌中的表达和细胞定位。中华流行病学杂志,2000;19(2):190 - 5。
文章中科院PubMed谷歌学者
郑强,唐志,吴震,石东,宋华。纤溶酶原激活物1抑制剂(PAI-1)在肝细胞癌中的作用。中华外科学报。1998;36(8):474-6。
中科院PubMed谷歌学者
郑强,唐志,吴卓。肝细胞癌中尿激酶型纤溶酶原激活物(uPA)、uPA受体(uPA- r)及抑制剂(PA I -1)表达与肿瘤侵袭转移及预后的关系。中华中流杂志。1998;20(1):57-9。
中科院PubMed谷歌学者
陈强,费杰,吴玲,姜珍,吴颖,郑勇,陆刚。肺癌患者血清中组织蛋白酶B、组织蛋白酶L、胱氨酸抑素C、尿激酶纤溶酶原激活物及尿激酶纤溶酶原激活物受体的检测。生态学报,2011;2(4):693-9。
文章中科院PubMed公共医学中心谷歌学者
Almasi CE, Drivsholm L, Pappot H, Høyer- hansen G, Christensen IJ。尿激酶纤溶酶原激活物受体的I区释放-一种小细胞肺癌的新肿瘤标志物。学院。2013, 121(3): 189 - 96。
文章中科院PubMed谷歌学者
Salden M, Splinter TA, Peters HA, Look MP, Timmermans M, van Meerbeeck JP, Foekens JA。非小细胞肺癌切除术中尿激酶型纤溶酶原激活物系统的研究。中国科学。2000;11(3):327-32。
文章中科院PubMed谷歌学者
Beyer BC, Heiss MM, Simon EH, Gruetzner KU, Babic R, Jauch KW, Schildberg FW, Allgayer H.胃癌中尿激酶系统表达:对独立患者系列的预后影响,以及术前活检和肠化生标本中预测价值的首次证据。癌症。2006;106(5):1026 - 35。
文章中科院PubMed谷歌学者
Plebani M, Herszènyi L, Carraro P, De Paoli M, Roveroni G, Cardin R, Tulassay Z, Naccarato R, Farinati F.尿激酶型纤溶酶原激活物受体在胃癌中的组织表达和预后作用。临床经验转移。1997;15(4):418-25。
文章中科院PubMed谷歌学者
Baker EA, Leaper DJ, Hayter JP, Dickenson AJ。口腔鳞状细胞癌中的纤溶酶原激活物系统。中华口腔颌面外科杂志,2007;45(8):623-7。
文章中科院PubMed谷歌学者
Seddighzadeh M, Steineck G, Larsson P, Wijkström H, Norming U, Onelöv E, Linder S. UPA和UPAR的表达与膀胱肿瘤的临床病程相关。中华肿瘤学杂志,2002;29(5):529 - 529。
文章中科院PubMed谷歌学者
膀胱癌:uPAR表达提示尿路上皮癌预后较差。自然科学进展。2015;12(3):120。
PubMed谷歌学者
Hau AM, Leivo MZ, Gilder AS, Hu JJ, Gonias SL, Hansel DE.膀胱癌mTORC2激活受尿激酶受体(uPAR)调控。手机信号,2017;29:96-106。
文章中科院PubMed谷歌学者
王丹,王涛。尿激酶型激活因子(uPA)和uPA受体(uPAR)在喉鳞癌中的表达及临床意义。林创二言后科杂志。2005;19(12):529-31。
PubMed谷歌学者
Lanza F, Castoldi GL, Castagnari B, Todd RF 3rd, Moretti S, Spisani S, Latorraca A, Focarile E, Roberti MG, Traniello S.尿激酶型纤溶酶原激活物受体在正常和急性白血病细胞中的表达和功能作用中华血液学杂志,1998;23(1):1 - 3。
文章中科院PubMed谷歌学者
Gutova M, Najbauer J, Gevorgyan A, Metz MZ, wy, Shih CC, Aboody KS。小细胞肺癌中upar阳性耐药细胞的鉴定。PLoS ONE。2007; 2 (2): e243。
文章PubMed公共医学中心谷歌学者
Cortes-Dericks L, Carboni GL, Schmid RA, Karoubi G.恶性胸膜间皮瘤中推测的癌症干细胞对顺铂和培美曲塞具有耐药性。中华肿瘤学杂志,2010;37(2):437-44。
中科院PubMed谷歌学者
黄卓,王玲,王艳,卓艳,李红,陈娟,陈伟。CD147的过表达与头颈部鳞状细胞癌细胞的化疗耐药有关。中华口腔病理学杂志,2013;42(7):541-6。
文章中科院PubMed谷歌学者
李志刚,李志刚,李志刚,李志刚,等。在雌激素缺乏的情况下,尿激酶受体信号为雌激素受体表达的乳腺癌细胞提供选择优势。细胞信号,2012;24(9):1847-55。
文章中科院PubMed公共医学中心谷歌学者
周健,郭凯,吴震,杨东,李军,常明,宋勇,曾华,李林,胡军,等。PLAUR通过EGFR/p-AKT/survivin信号通路对吉非替尼产生耐药性。细胞物理与生物化学。2018;47(5):1909-24。
文章中科院PubMed谷歌学者
CRISPR/Cas9系统靶向uPAR降低恶性肿瘤和多药耐药。Front Oncol, 2019;9:80。
文章中科院PubMed公共医学中心谷歌学者
Laurenzana A, Margheri F, Biagioni A, Chillà A, Pimpinelli N, Ruzzolini J, Peppicelli S, Andreucci E, Calorini L, Serratì S,等。EGFR/uPAR相互作用可作为药物靶点克服黑色素瘤细胞vemurafenib获得性耐药。EBioMedicine。2019; 39:194 - 206。
文章PubMed公共医学中心谷歌学者
LeBeau AM, Sevillano N, King ML, Duriseti S, Murphy ST, Craik CS, Murphy LL, VanBrocklin HF。临床前乳腺癌获得性耐药模型中尿激酶纤溶酶原激活物受体的成像。开展。2014;4(3):267 - 79。
文章PubMed公共医学中心谷歌学者
Mazar AP, Ahn RW, O 'Halloran TV。开发针对尿激酶纤溶酶原激活物受体(uPAR)的新疗法,并将其转化为临床。药理学杂志,2011;17(19):1970-8。
文章中科院PubMed公共医学中心谷歌学者
Ploug M, Østergaard S, Gårdsvoll H, Kovalski K, Holst-Hansen C, Holm A, Ossowski L, Danø K.尿激酶受体的肽源拮抗剂。通过组合化学的亲和成熟,功能表位的鉴定,以及对癌细胞内循环的抑制作用。生物化学,2001;40(40):12157 - 68。
文章中科院PubMed谷歌学者
郭y, Higazi AA, Arakelian A, Sachais BS, Cines D, Goldfarb RH, Jones TR, Kwaan H, Mazar AP, Rabbani SA。来自尿激酶纤溶酶原激活物(uPA)非受体结合区的肽可以抑制肿瘤进展和血管生成,并诱导肿瘤细胞在体内死亡。王晓明,王晓明。2000;14(10):1400-10。
文章中科院PubMed谷歌学者
林Y,彭N,李J,壮族H,华佐。复方雷公藤甲素协同增强尿激酶氨基端片段的抗肿瘤活性。摩尔癌症。2013;12:54。
文章中科院PubMed公共医学中心谷歌学者
王敏,Löwik DW, Miller AD, Thanou M.利用自组装纳米颗粒靶向尿激酶纤溶酶原激活物受体。生物偶联化学,2009;20(1):32-40。
文章中科院PubMed谷歌学者
Burgle M, Koppitz M, Riemer C, Kessler H, König B, Weidle UH, Kellermann J, Lottspeich F, Graeff H, Schmitt M,等。合成肽抑制尿激酶型纤溶酶原激活物(uPA)与其受体(uPAR)的相互作用。生物化学,1997;32(3-4):231-7。
中科院PubMed谷歌学者
Magdolen V, Bürgle M, de Prada NA, Schmiedeberg N, Riemer C, Schroeck F, Kellermann J, Degitz K, Wilhelm OG, Schmitt M,等。Cyclo 19,31[D-Cys19]-uPA19-31是一种有效的尿激酶型纤溶酶原激活剂与其受体(CD87)相互作用的竞争性拮抗剂。生物化学,2001;382(8):1197-205。
文章中科院PubMed谷歌学者
Sato S, Kopitz C, Schmalix WA, Muehlenweg B, Kessler H, Schmitt M, Krüger A, Magdolen V.高亲和尿激酶衍生环肽抑制尿激酶/尿激酶受体相互作用:对肿瘤生长和扩散的影响。中国科学(d辑),2002;
文章中科院PubMed谷歌学者
狄锡文,魏勇,张磊,饶nk,徐华,陈震,刘强,Rosenberg S, Chapman HA。尿激酶受体-整合素相互作用位点的鉴定。整合素功能的混杂调节。中国生物医学工程学报,2000;26(4):344 - 344。
文章中科院PubMed谷歌学者
Ghosh S, Johnson JJ, Sen R, Mukhopadhyay S, Liu Y, Zhang F, Wei Y, Chapman HA, Stack MS.尿型纤溶酶原激活因子受体- α 3beta1整合素在蛋白酶调控通路中的功能相关性。中国生物化学杂志,2006;
文章中科院PubMed谷歌学者
van der Pluijm G, Sijmons B, Vloedgraven H, van der Bent C, Drijfhout JW, Verheijen J, Quax P, Karperien M, Papapoulos S, Löwik C.尿激酶受体/整合素复合物在体内参与人乳腺癌黏附和进展的功能。中华民国病理学杂志。2001;39(3):971-82。
文章PubMed公共医学中心谷歌学者
Alexander RA, Prager GW, Mihaly-Bison J, Uhrin P, Sunzenauer S, Binder BR, Schütz GJ, Freissmuth M, Breuss JM。vegf诱导的内皮细胞迁移需要尿激酶受体(uPAR)依赖性整合素再分配。中国生物医学工程学报,2012;29(1):344 - 344。
文章中科院PubMed谷歌学者
Degryse B, Resnati M, czzekay RP, Loskutoff DJ, Blasi F.尿激酶受体的结构域2包含一个具有内在信号活性的整合素相互作用表位:一种新的整合素抑制剂的产生。中国生物医学工程学报,2005;26(2):344 - 344。
文章中科院PubMed谷歌学者
Furlan F, Eden G, Archinti M, Arnaudova R, Andreotti G, Citro V, Cubellis MV, Motta A, Degryse B.来自尿激酶受体的D2A-Ala肽在体外和体内具有抗肿瘤作用。肽。2018;101:17-24。
文章中科院PubMed谷歌学者
Bifulco K, Longanesi-Cattani I, Gargiulo L, Maglio O, Cataldi M, De Rosa M, Stoppelli MP, Pavone V, Carriero MV。一种尿激酶受体拮抗剂,通过阻断甲酰基肽受体来抑制细胞迁移。中国科学(d辑:自然科学),2008;
文章中科院PubMed谷歌学者
Carriero MV, Longanesi-Cattani I, Bifulco K, Maglio O, Lista L, Barbieri A, Votta G, Masucci MT, Arra C, Franco R,等。基于结构设计的尿激酶型纤溶酶原激活物受体衍生肽抑制细胞迁移和肺转移。中华癌症杂志2009;8(9):2708-17。
文章中科院PubMed谷歌学者
Carriero MV, Bifulco K, Minopoli M, Lista L, Maglio O, Mele L, Di Carluccio G, De Rosa M, Pavone V. UPARANT:一种尿激酶受体衍生的vegf驱动血管生成肽抑制剂,具有增强的稳定性和体外和体内效力。中华肿瘤杂志,2014;13(5):1092-104。
文章中科院PubMed谷歌学者
Yousif AM, Minopoli M, Bifulco K, Ingangi V, Di Carluccio G, Merlino F, Motti ML, Grieco P, Carriero MV。尿激酶受体衍生的ser-arg-ser-arg-tyr肽的环化产生了单核细胞跨内皮迁移的有效抑制剂。PLoS ONE。2015; 10 (5): e0126172。
文章PubMed公共医学中心谷歌学者
Minopoli M, Botti G, Gigantino V, Ragone C, Sarno S, Motti ML, Scognamiglio G, Greggi S, Scaffa C, Roca MS,等。靶向甲酰基肽受体1型防止卵巢癌细胞粘附到间皮和随后的侵袭。中国临床癌症杂志,2019;38(1):459。
文章PubMed公共医学中心谷歌学者
Tressler RJ, Pitot PA, Stratton JR, Forrest LD, zhus, Drummond RJ, Fong S, Doyle MV, Doyle LV, Min HY, Rosenberg S.尿激酶受体拮抗剂:肿瘤生长在体内模型的发现和应用。学院。1999, 107(1): 168 - 73。
文章中科院PubMed谷歌学者
Bu X, Khankaldyyan V, Gonzales-Gomez I, Groshen S, Ye W,卓S, Pons J, Stratton JR, Rosenberg S, Laug WE。种特异性尿激酶受体配体主要通过抗血管生成机制减少胶质瘤生长和增加生存率。科学通报。2004;34(6):667-78。
文章中科院PubMed谷歌学者
Khanna M, Wang F, Jo I, Knabe WE, Wilson SM, Li L, Bum-Erdene K, Li J, Sledge GW, Khanna R,等。靶向多种构象会导致uPAR·uPA蛋白-蛋白相互作用的小分子抑制剂,从而阻止癌细胞侵袭。中国生物化学杂志,2011;6(11):1232-43。
文章中科院PubMed公共医学中心谷歌学者
Mani T, Wang F, Knabe WE, Sinn AL, Khanna M, Jo I, Sandusky GE, Sledge GW Jr, Jones DR, Khanna R,等。uPAR·uPA相互作用的小分子抑制:乳腺癌转移的合成、生化、细胞、体内药代动力学及疗效研究生物医学杂志,2013;21(7):2145-55。
文章中科院PubMed公共医学中心谷歌学者
徐东,K Bum-Erdene, Si Y, Zhou D, Ghozayel MK, Meroueh SO。模拟小分子拮抗剂紧密蛋白质-蛋白质复合物的分子间相互作用。ChemMedChem。2017; 12(21): 1794 - 809。
文章中科院PubMed公共医学中心谷歌学者
徐D, K Bum-Erdene, Leth JM, Ghozayel MK, Ploug M, Meroueh SO。构象选择对uPAR·uPA相互作用的小分子抑制。ChemMedChem。2021年,16(2):377 - 87。
文章中科院PubMed谷歌学者
刘东,周东,王波,王晓峰,王晓峰。一类新的正交型uPAR·uPA小分子拮抗剂是uPAR·vitronectin相互作用的变构抑制剂。中国生物化学杂志,2015;10(6):1521-34。
文章中科院PubMed公共医学中心谷歌学者
林志刚,李志刚,王志刚,王志刚,王志刚,王志刚。化学工程学报。2020;29(3):388 - 388。
文章中科院PubMed公共医学中心谷歌学者
周敏,周敏,张志伟,等。uPAR/alpha5beta1 -整合素相互作用的计算机辅助鉴定:一种预防转移的新范式。PLoS ONE。2009年,4 (2):e4617。
文章PubMed公共医学中心谷歌学者
Rea VE, Lavecchia A, Di Giovanni C, Rossi FW, Gorrasi A, Pesapane A, de Paulis A, Ragno P, Montuori N.发现新的小分子靶向尿激酶受体的玻璃凝集素结合位点,阻止癌细胞侵袭。中华癌症杂志,2013;12(8):1402-16。
文章中科院PubMed谷歌学者
连生,李淑娟,李淑娟,王志强,王志强,王志强。血红素加氧酶-1介导的十二碳六烯酸对12- o - 14 -乙酰卡酰磷诱导的人内皮细胞的抑制作用。Front Pharmacol. 2020;11: 577302。
文章中科院PubMed公共医学中心谷歌学者
瓦列拉,李C,金N,帕诺斯卡尔蒂斯-摩塔利A,霍尔WA。白喉毒素融合蛋白DTAT靶向人胶质母细胞瘤的尿激酶型纤溶酶原激活物受体。中华肿瘤学杂志,2002;29(8):597-606。
文章中科院PubMed谷歌学者
Ramage JG, Vallera DA, Black JH, Aplan PD, Kees UR, Frankel AE。白喉毒素/尿激酶融合蛋白(DTAT)对表达CD87的白血病细胞有选择性毒性。Leuk Res. 2003;27(1): 79-84。
文章中科院PubMed谷歌学者
黄娟,袁东,刘东,李娟,李勇,霍尔瓦,李波。抗血管生成靶向免疫毒素DTAT和DTAT对多形性胶质母细胞瘤的疗效观察。中南大学学报,2014;39(1):1 - 5。
PubMed谷歌学者
霍尔WA,瓦雷拉DA。抗血管生成靶向毒素对多形性胶质母细胞瘤的疗效。神经外科焦点。2006;20(4):E23。
文章PubMed谷歌学者
Todhunter DA, Hall WA, Rustamzadeh E, Shu Y, Doumbia SO, Vallera DA。在小鼠异种移植模型中靶向人IL-13受体(IL-13R)和尿激酶型纤溶酶原激活物受体(uPAR)的双特异性免疫毒素(DTAT13)。蛋白质工程学报,2004;17(2):157-64。
文章中科院PubMed谷歌学者
蔡佳佳,吴珊珊,陈华,舒燕,Ohlfest JR, Vallera DA。一种新的双特异性配体定向毒素,旨在同时靶向人胶质母细胞瘤细胞上的EGFR和肿瘤新生血管上的uPAR。中华神经外科杂志,2011;39(2):344 - 344。
文章中科院PubMed谷歌学者
Waldron NN, Oh S, Vallera DA。EGFR和uPAR在头颈部鳞状细胞癌小鼠模型中的双特异性靶向。口腔医学杂志,2012;48(12):1202-7。
文章中科院PubMed公共医学中心谷歌学者
Schappa JT, Frantz AM, Gorden BH, Dickerson EB, Vallera DA, Modiano JF。血管肉瘤及其肿瘤干细胞亚群可被表皮生长因子和尿激酶受体靶向的毒素有效杀伤。中华肿瘤学杂志,2013;33(8):344 - 344。
文章中科院PubMed公共医学中心谷歌学者
Oh F, Todhunter D, Taras E, Vallera DA, Borgatti a .利用双特异性配体定向毒素靶向EGFR和uPAR治疗人类横纹肌肉瘤、骨肉瘤和卵巢腺癌。临床药物学杂志2018;10:113-21。
PubMed公共医学中心谷歌学者
Pilbeam K, Wang H, Taras E, Bergerson RJ, Ettestad B, DeFor T, Borgatti A, Vallera DA, Verneris MR.利用靶向尿激酶和表皮生长因子受体的双特异性配体免疫毒素靶向儿童肉瘤。Oncotarget。2017;9(15):11938 - 47。
文章PubMed公共医学中心谷歌学者
Borgatti A, Koopmeiners JS, Sarver AL, Winter AL, Stuebner K, Todhunter D, Rizzardi AE, Henriksen JC, Schmechel S, Forster CL,等。通过EGFR和uPAR双特异性靶向治疗安全有效的肉瘤中华肿瘤杂志,2017;16(5):956-65。
文章中科院PubMed公共医学中心谷歌学者
Errico Provenzano A, Posteri R, Giansanti F, Angelucci F, Flavell SU, Flavell DJ, Fabbrini MS, Porro D, Ippoliti R, Ceriotti A,等。基于saporin的抗肿瘤upar靶向嵌合体ATF-SAP的结构设计和发酵策略优化。微细胞科学。2016;15(1):194。
文章PubMed公共医学中心谷歌学者
Zuppone S, Assalini C, Minici C, Bertagnoli S, Branduardi P, Degano M, Fabbrini MS, Montorsi F, Salonia A, Vago R.基于saporin的upar靶向嵌合体ATF-SAP的抗肿瘤潜力。科学通报2020;10(1):2521。
文章中科院PubMed公共医学中心谷歌学者
Vine KL, Indira Chandran V, Locke JM, Matesic L, Lee J, Skropeta D, Bremner JB, Ranson M.靶向尿激酶和转铁蛋白受体的新型抗有丝分裂n -烷lisatin细胞毒素偶联物导致癌细胞选择性死亡并降低肿瘤生长。中国癌症杂志。2012;12(1):64-73。
文章中科院PubMed谷歌学者
王志强,刘志强,王志强,王志强。一种尿激酶激活的重组白喉毒素靶向粒细胞-巨噬细胞集落刺激因子受体对人急性髓系白血病细胞具有选择性细胞毒性。血。2004;104(7):2143 - 8。
文章中科院PubMed谷歌学者
Rajagopal V, Kreitman RJ。与尿激酶受体结合的重组毒素具有细胞毒性,而不需要与α(2)-巨球蛋白受体结合。中国生物医学工程杂志,2000;29(11):766 - 766。
文章中科院PubMed谷歌学者
Mertens HD, Kjaergaard M, Mysling S, Gårdsvoll H, Jørgensen TJ, Svergun DI, Ploug M.一种灵活的多域结构驱动尿激酶型纤溶酶原激活物受体(uPAR)的功能。中国生物医学工程学报,2012;
文章中科院PubMed公共医学中心谷歌学者
林玲,Gårdsvoll黄青,黄敏,黄敏。基于结构工程的尿激酶与其受体相互作用的物种选择性:对临床前癌症治疗的意义。中国生物医学工程学报,2010;29(4):344 - 344。
文章中科院PubMed公共医学中心谷歌学者
Metrangolo V, Ploug M, Engelholm LH。尿激酶受体(uPAR)作为靶向癌症治疗的“特洛伊木马”:挑战与机遇。癌症。2021;13(21):5376。
文章中科院PubMed公共医学中心谷歌学者
Tyndall JD, Kelso MJ, Clingan P, Ranson M.针对纤溶酶原激活系统的肽和小分子:针对乳腺癌的预防性抗转移药物。中华癌症杂志2008;3(1):1 - 13。
文章中科院PubMed谷歌学者
魏晨,Möller CC, Altintas MM,李j, Schwarz K, Zacchigna S,谢林,Henger A, Schmid H, Rastaldi MP,等。尿激酶受体对肾屏障功能的影响。中华外科杂志,2008;14(1):55-63。
文章中科院PubMed谷歌学者
Boonstra MC, Verspaget HW, Ganesh S, Kubben FJ, Vahrmeijer AL, van de Velde CJ, Kuppen PJ, Quax PH, Sier CF.尿激酶受体(uPAR)在癌症患者中的临床应用。中国医药杂志,2011;17(19):1890-910。
文章中科院PubMed谷歌学者
尿激酶纤溶酶原激活物受体(uPAR)作为癌症诊断和治疗的靶点。抗癌药物。2001;12(5):387-400。
文章中科院PubMed谷歌学者
袁春,郭震,余松,姜林,黄敏。uPAR抑制剂的开发:阻断uPAR与伙伴的相互作用。现代药物发现。2021;26(4):1076-85。
文章中科院PubMed谷歌学者
李东,刘松,单华,康培平,李卓。尿激酶纤溶酶原激活物受体(uPAR)靶向核成像与放射性核素治疗。开展。2013;3(7):507 - 15。
文章PubMed公共医学中心谷歌学者
Ngo JC,姜林,林志,袁超,陈忠,张旭,余辉,王杰,林玲,黄敏。uPA/uPAR系统治疗干预的结构基础。Curr Drug Targets. 2011;12(12): 1729-43。
文章中科院PubMed谷歌学者
陈志,林林,怀青,黄敏。药物发现的挑战——以尿激酶受体抑制为例。梳理化学高通量筛。2009;12(10):961-7。
文章中科院PubMed公共医学中心谷歌学者
Kriegbaum MC, Persson M, Haldager L, Alpízar-Alpízar W, Jacobsen B, Gårdsvoll H, Kjaer A, Ploug M.尿激酶受体(uPAR)的合理靶向:拮抗剂和非侵入性成像探针的发展。Curr Drug Targets. 2011;12(12): 1711-28。
文章中科院PubMed谷歌学者
基于尿激酶受体(uPAR)配体的重组毒素在人类癌症治疗中的应用。药理学杂志,2011;17(19):1979-83。
文章PubMed谷歌学者
哦,F,莫迪亚诺JF,巴卡诺瓦V,瓦雷拉DA。在实体肿瘤中使用配体靶向毒素双特异性靶向EGFR和尿激酶受体(uPAR)。生物分子。2020;10(6):956。
文章中科院公共医学中心谷歌学者
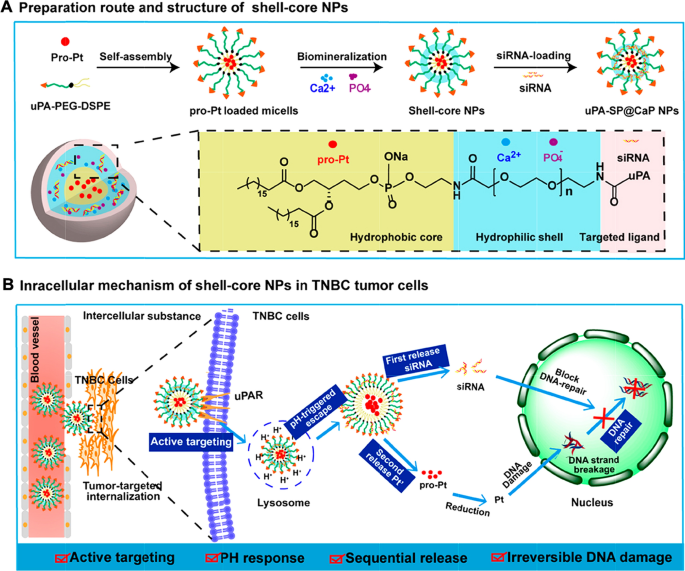
董艳,廖浩,傅慧,于娟,郭强,王强,段艳。ph敏感壳核平台阻断DNA修复通路扩增三阴性乳腺癌不可逆DNA损伤。计算机应用技术。2019;11(42):38417-28。
文章中科院PubMed谷歌学者
杨林,曹忠,Sajja HK,毛华,王林,耿华,徐辉,姜涛,Wood WC,聂松,等。受体靶向磁性氧化铁纳米颗粒的开发,用于有效的药物递送和肿瘤成像。中国生物医学工程学报。2008;4(4):439-49。
文章中科院PubMed公共医学中心谷歌学者
Miller-Kleinhenz J,郭鑫,钱伟,周华,Bozeman EN,朱林,季欣,王亚,Styblo T, O 'Regan R,等。使用肽偶联超小纳米颗粒药物载体的双靶向Wnt和uPA受体抑制化疗耐药乳腺癌中的癌症干细胞表型。生物材料。2018;152:47 - 62。
文章中科院PubMed谷歌学者
李光勇,钱伟平,王磊,王亚,史丹利CA,萨蒂西M,聂松,毛海,杨林。吉西他滨控释治疗性纳米粒在胰腺癌靶向治疗及MRI中的应用。生物化学学报。2013;29(3):379 - 379。
文章中科院PubMed公共医学中心谷歌学者
高宁,钱伟,王琳,陈华,Lipowska M, Staley CA,王亚,毛海,杨林。肿瘤穿透治疗纳米颗粒增强腹腔内给药后靶向和图像引导的药物输送。开展。2017;7(6):1689 - 704。
文章中科院PubMed公共医学中心谷歌学者
Ahmed MS, Bin Salam A, Yates C, william K, Jaynes J, Turner T, Abdalla MO.用于前列腺癌治疗和成像的双受体靶向多功能氧化铁纳米颗粒给药系统。中国生物医学工程学报,2017;
文章中科院谷歌学者
Park JY, Shin Y, Won WR, Lim C, Kim JC, Kang K, Husni P, Lee ES, youys, Oh KT。AE147肽偶联纳米载体靶向过表达upar癌细胞的研究。国际纳米医学杂志。2021;16:537 - 49。
文章谷歌学者
Belfiore L, Saunders DN, Ranson M, Vine KL。N-烷基利辛脂质体靶向乳腺癌中的尿激酶纤溶酶原激活物系统。制药学。2020;12(7):641。
文章中科院公共医学中心谷歌学者
洪艳,车胜,惠波,杨艳,王霞,张霞,强燕,马慧。阿霉素与姜黄素联合治疗肺癌:基于靶向前药、pH敏感的纳米药物。生物医学,2019;112:108614。
文章中科院PubMed谷歌学者
翟斌,陈鹏,王伟,刘松,冯杰,段涛,项勇,张锐,张敏,韩旭,等。一个ATF24肽功能化β-榄香烯纳米脂质载体联合顺铂治疗膀胱癌中华癌症杂志2020;17(3):676-92。
文章中科院PubMed公共医学中心谷歌学者
Devulapally R, Sekar NM, Sekar TV, Foygel K, Massoud TF, Willmann JK, Paulmurugan R.聚合物纳米颗粒介导的抗mir -10b和抗mir -21共递送实现三阴性乳腺癌治疗。中国生物医学工程学报。2015;29(3):344 - 344。
文章中科院PubMed公共医学中心谷歌学者
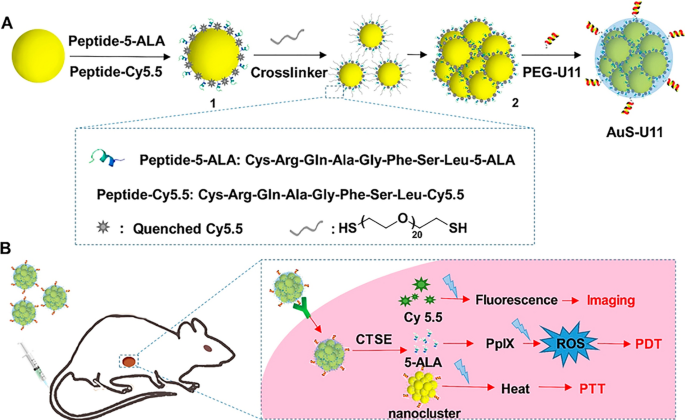
李红,王萍,邓艳,曾敏,唐颖,朱文华,程艳。金纳米团簇结合活性靶向、酶触发释放和光动力治疗胰腺导管腺癌。生物材料。2017;139:30-8。
文章中科院PubMed谷歌学者
杜曼斯德,福村D, Jain RK。癌症的光动力疗法。中华癌症杂志,2003;3(5):380-7。
文章中科院PubMed谷歌学者
王凯,张颖,王娟,袁安,孙敏,吴娟,胡艳。自组装ir780负载转铁蛋白纳米颗粒用于肿瘤成像、靶向和PDT/PTT治疗。科学代表2016;6:27421。
文章PubMed公共医学中心谷歌学者
李锐,郑凯,胡鹏,陈震,周松,陈杰,袁超,陈松,郑伟,马娥,等。一种用于光学成像和治疗的新型肿瘤靶向药物载体。开展。2014;4(6):642 - 59。
文章中科院PubMed公共医学中心谷歌学者
生物学报。2015;23:116-26。
文章中科院PubMed谷歌学者
李松,袁超,陈杰,陈东,陈忠,陈伟,闫松,胡鹏,薛娟,李锐,等。纳米颗粒与癌细胞表面的尿激酶受体结合,引发纳米颗粒分解和货物释放。开展。2019;9(3):884 - 99。
文章PubMed公共医学中心谷歌学者
陈震,徐鹏,陈杰,陈辉,胡萍,陈鑫,林林,黄燕,郑凯,周松,等。酞菁锌与尿激酶氨基端片段偶联用于肿瘤靶向光动力治疗。生物学报,2014;10(10):4257-68。
文章中科院PubMed谷歌学者
于珊,黄刚,袁锐,陈涛。一种具有近红外激光响应药物释放特性的uPAR靶向纳米平台,用于三阴性乳腺癌的三模态成像和协同光热化疗。生物科学通报2020;8(2):720-38。
文章中科院PubMed谷歌学者
胡欣,Mandika C,何玲,尤勇,常勇,王娟,陈涛,朱霞。高效光热化疗宫颈癌的尿激酶型纤溶酶原激活物受体靶向异质结构的构建,实现同时抗癌和抗血管生成。中国生物医学工程学报。2019;29(3):366 - 366。
文章中科院谷歌学者
左娟,霍敏,王玲,李娟,陈勇,熊萍。光子热声动力纳米治疗口腔鳞状细胞癌。[J] .化工学报。2020;8(39):9084-93。
文章中科院谷歌学者
胡勇,迟超,王松,王磊,梁鹏,刘峰,尚伟,王伟,张峰,李松,等。胰腺癌的临床干预与介入光热治疗的比较研究。中国医学工程学报,2017;29(33):1700448。
文章谷歌学者
高晓明,李志强,李志强,等。溶瘤病毒:一类新的免疫治疗药物。新药发现,2015;14(9):642-62。
文章中科院PubMed公共医学中心谷歌学者
金艳,童春,张娟,中村T, Iankov I, Russell SJ, Merchan JR.一种新型溶瘤麻疹病毒的肿瘤和血管靶向性。癌症杂志2009;69(4):1459-68。
文章中科院PubMed公共医学中心谷歌学者
杨静,王晓明,王晓明,王晓明,等。uPAR重定向麻疹病毒在肿瘤模型中的体外安全性、生物分布及抗肿瘤作用。基因科学。2014;21(3):289-97。
文章中科院PubMed公共医学中心谷歌学者
杨静,王晓明,王晓明,等。uPAR重定向麻疹病毒在乳腺癌模型中的抗转移作用。乳腺癌治疗与治疗。2015;29(1):1 - 8。
文章PubMed谷歌学者
杨静,查维兹V, Ban Y, Acquavella N, El-Ashry D, Pronin A,陈x, Merchan JR.上par重定向溶瘤病毒间质选择性靶向乳腺癌的分子效应。中国生物医学杂志,2017;15(10):1410-20。
文章中科院PubMed公共医学中心谷歌学者
杨静,查维兹V, Khatwani N, Ban Y, Espejo AP,陈霞,Merchan JR.双基质和肿瘤靶向溶瘤麻疹病毒的体内抗肿瘤活性。癌症基因研究。2020;27(12):910-22。
文章PubMed公共医学中心谷歌学者
Lakka SS, Rajagopal R, Rajan MK, Mohan PM, Adachi Y, Dinh DH, Olivero WC, Gujrati M, Ali-Osman F, Roth JA,等。腺病毒介导的反义尿激酶型纤溶酶原激活物受体基因转移减少非小细胞肺癌细胞系肿瘤细胞的侵袭和转移。临床癌症杂志2001;7(4):1087-93。
中科院PubMed谷歌学者
Nalabothula N, Lakka SS, Dinh DH, Gujrati M, Olivero WC, Rao JS。义p16和反义uPAR双强子结构抑制血管生成并诱导胶质瘤细胞死亡。中华肿瘤学杂志,2007;30(3):669-78。
中科院PubMed谷歌学者
Gondi CS, Lakka SS, Yanamandra N, Siddique K, Dinh DH, Olivero WC, Gujrati M, Rao JS。反义uPAR和反义uPA的表达来自双强子腺病毒结构,可抑制胶质瘤细胞侵袭、肿瘤生长和血管生成。致癌基因。2003;22岁(38):5967 - 75。
文章中科院PubMed谷歌学者
Gondi CS, Lakka SS, Yanamandra N, Olivero WC, Dinh DH, Gujrati M, Tung CH, Weissleder R, Rao JS。腺病毒介导的反义尿激酶纤溶酶原激活物受体和反义组织蛋白酶B的表达抑制胶质瘤中的肿瘤生长、侵袭和血管生成。癌症决议2004;64(12):4069-77。
文章中科院PubMed谷歌学者
饶文杰,陈建平,陈建平,陈建平,等。腺病毒介导的反义uPAR和MMP-9对非小细胞肺癌细胞侵袭、血管生成、肿瘤生长和转移的抑制作用。中华癌症杂志2005;4(9):1399-408。
文章中科院PubMed公共医学中心谷歌学者
Nozaki S, Endo Y, Nakahara H, Yoshizawa K, Hashiba Y, kawashi S, Tanaka A, Nakagawa K, Matsuoka Y, Kogo M,等。以尿激酶型纤溶酶原激活物受体为靶点抑制口腔癌侵袭转移。口腔医学杂志,2005;41(10):971-7。
文章中科院PubMed谷歌学者
Gondi CS, Lakka SS, Dinh DH, Olivero WC, Gujrati M, Rao JS。rnai介导的组织蛋白酶B和uPAR抑制导致胶质瘤细胞侵袭、血管生成和肿瘤生长减少。致癌基因。2004;23(52):8486 - 96。
文章中科院PubMed谷歌学者
Gondi CS, Lakka SS, Dinh DH, Olivero WC, Gujrati M, Rao JS。在裸鼠腹腔注射针对尿激酶型纤溶酶原激活物(uPA)受体和uPA的发夹rna表达质粒可延缓血管生成并抑制颅内肿瘤生长。临床癌症杂志2007;13(14):4051-60。
文章中科院PubMed公共医学中心谷歌学者
Kondraganti S, Gondi CS, McCutcheon I, Dinh DH, Gujrati M, Rao JS, Olivero WC。rnai介导的脑膜瘤细胞尿激酶纤溶酶原激活物及其受体的下调抑制了肿瘤的侵袭和生长。中华医学杂志,2006;28(6):1353-60。
中科院PubMed谷歌学者
高兰拉B,苏瑟卡S,饶杰,帕特尔J,冈迪CS。抑制uPAR-uPA系统可以抑制胰腺癌细胞的血管生成、侵袭和体内肿瘤的发展。中华肿瘤杂志,2011;9(4):377-89。
文章中科院PubMed谷歌学者
Rysenkova KD, Semina EV, Karagyaur MN, Shmakova AA, Dyikanov DT, Vasiluev PA, Rubtsov YP, Rubina KA, Tkachuk VA. CRISPR/Cas9 nickase介导的靶向尿激酶受体基因抑制成神经细胞瘤细胞增殖。Oncotarget。2018;9(50):29414 - 30。
文章PubMed公共医学中心谷歌学者
Biagioni A, Laurenzana A, Chillà A, Del Rosso M, Andreucci E, Poteti M, Bani D, Guasti D, Fibbi G, Margheri F. uPAR敲除导致黑色素瘤和结肠癌细胞系深度糖酵解和OXPHOS重编程。细胞。2020;9(2):308。
文章中科院公共医学中心谷歌学者
Biagioni A, Chillà A, Del Rosso M, Fibbi G, Scavone F, Andreucci E, Peppicelli S, Bianchini F, Calorini L, Li Santi A,等。CRISPR/Cas9 uPAR基因敲除在黑素瘤和结肠癌细胞系中导致肿瘤生长抑制、EGFR下调和茎性标志物诱导。前沿工程。2021;11:663225。
文章PubMed公共医学中心谷歌学者
LeBeau AM, Duriseti S, Murphy ST, Pepin F, Hann B, Gray JW, VanBrocklin HF, Craik CS重组人抗uPAR靶向治疗侵袭性乳腺癌。中国癌症杂志,2013;33(7):2070-81。
文章中科院PubMed公共医学中心谷歌学者
Harel ET, Drake PM, Barfield RM, Lui I, Farr-Jones S, Van 't Veer L, Gartner ZJ, Green EM, Lourenço AL,程y,等。靶向尿激酶受体(uPAR)的抗体药物偶联物可能成为侵袭性乳腺癌的治疗方法。抗体。2019;8(4):54。
文章中科院公共医学中心谷歌学者
Duriseti S, Goetz DH, Hostetter DR, LeBeau AM, Wei Y, Craik CS。抗尿激酶纤溶酶原激活物受体(uPAR)抗体显著抑制uPAR介导的细胞信号转导和迁移。中国生物医学工程学报,2010;29(3):344 - 344。
文章中科院PubMed公共医学中心谷歌学者
范布伦II G,格雷MJ,达拉斯NA,夏L,林SJ,范F,马扎尔AP,埃利斯LM。以尿激酶纤溶酶原激活物受体为靶点的单克隆抗体可损害人肝结直肠癌的生长。癌症。2009;115(14):3360 - 8。
文章PubMed谷歌学者
Rabbani SA, Ateeq B, Arakelian A, Valentino ML, Shaw DE, Dauffenbach LM, Kerfoot CA, Mazar AP.一种抗尿激酶纤溶酶原激活物受体抗体(ATN-658)在体外和体内阻止前列腺癌侵袭、迁移、生长和实验性骨骼转移。瘤。2010;12(10):778 - 88。
文章中科院PubMed公共医学中心谷歌学者
Kenny HA, Leonhardt P, Ladanyi A, Yamada SD, Montag A, Im HK, Jagadeeswaran S, Shaw DE, Mazar AP, Lengyel E.靶向尿激酶纤溶酶原激活物受体抑制卵巢癌转移。临床癌症杂志,2011;17(3):459-71。
文章中科院PubMed谷歌学者
Mahmood N, Arakelian A, Khan HA, Tanvir I, Mazar AP, Rabbani SA。uPAR抗体(huATN-658)和Zometa可减少乳腺癌生长和骨骼病变。Bone res 2020;8:18。
文章中科院PubMed公共医学中心谷歌学者
李燕,Parry G,陈玲,Callahan JA, Shaw DE, Meehan EJ, Mazar AP,黄敏。一种抗尿激酶纤溶酶原激活物受体(uPAR)抗体的晶体结构和结合表位。中华分子生物学杂志,2007;36(4):339 - 344。
文章中科院PubMed谷歌学者
List K, Høyer-Hansen G, Rønne E, Danø K, Behrendt N.不同的机制参与了抗体介导的配体与尿激酶受体结合的抑制:基于生物传感器技术的研究。中华免疫杂志1999;22(1-2):125-33。
文章中科院PubMed谷歌学者
Pass J, Jögi A, Lund IK, Rønø B, Rasch MG, Gårdsvoll H, Lund LR, Ploug M, Rømer J, Danø K,等。在基因缺陷小鼠中产生的抗小鼠uPA受体的小鼠单克隆抗体:在体外和体内抑制受体介导的uPA活性。中华血液病杂志,2007;29(6):344 - 344。
文章中科院PubMed谷歌学者
李赫,崔怡,玄淑敏,张碧,金兆忠,李海杰,殷志勇,金鸿柱,尹ss,李ds,等。肝细胞生长因子/c-Met信号在调节尿激酶纤溶酶原激活物对人肝细胞癌侵袭性的作用:一个潜在的治疗靶点。临床分析。2008;25(1):89-96。
文章中科院PubMed谷歌学者
Zhao B, Gandhi S, Yuan C, Luo Z, Li R, Gårdsvoll H, de Lorenzi V, Sidenius N, Huang M, Ploug M.稳定SMB结合位点的柔性域间铰链区域使uPAR进入其封闭构像。中国生物医学杂志,2015;26 (6 Pt B): 1389-403。
文章中科院PubMed谷歌学者
Wahid B, Ali A, Rafique S, Waqar M, Wasim M, Wahid K, Idrees M.肿瘤免疫治疗策略综述。免疫疗法。2018;10(11):999 - 1010。
文章中科院PubMed谷歌学者
Morgan MA, Schambach A.工程CAR-T细胞改善实体瘤的功能。前沿免疫。2018;9:2493。
文章PubMed公共医学中心谷歌学者
纽维克K,奥布莱恩S,穆恩E,阿尔贝尔达SM。CAR - T细胞治疗实体瘤。2017; 68:139-52。
文章中科院PubMed谷歌学者
洪m, club JD,陈yy。设计CAR-T细胞用于下一代癌症治疗。中国癌症杂志,2020;38(4):473-88。
文章中科院PubMed谷歌学者
王玲,杨蓉,赵玲,张霞,徐涛,崔敏。基于uPAR结合片段设计嵌合抗原受体触发对表达uPAR的卵巢癌细胞的抗肿瘤作用。生物医学,2019;117:109173。
文章中科院PubMed谷歌学者
Amor C, Feucht J, Leibold J, Ho YJ, Zhu C, Alonso-Curbelo D, Mansilla-Soto J, Boyer JA, Li X, Giavridis T,等。Senolytic CAR - T细胞逆转衰老相关病理。大自然。2020;583(7814):127 - 32。
文章中科院PubMed公共医学中心谷歌学者
Uvyn A, De Geest BG。多价抗体招募大分子:将增强的结合亲和力与增强的先天免疫杀伤联系起来。ChemBioChem。2020; 21(21): 3036 - 43。
文章中科院PubMed公共医学中心谷歌学者
张旭东,张志强,张志强。将尿激酶重新编程为一种招募抗体的抗癌剂。中国生物化学杂志,2012;7(2):316-21。
文章中科院PubMed谷歌学者
Rullo AF, Fitzgerald KJ, Muthusamy V, Liu M, Yuan C, Huang M, Kim M, Cho AE, Spiegel DA。重新设计转移性癌症的免疫反应:针对尿激酶受体的抗体招募小分子。中国化学工程学报,2016;36(11):366 - 366。
文章中科院PubMed公共医学中心谷歌学者
胡晓文,段海峰,高海林,潘玉生,李彦明,奚燕,赵瑞生,尹林,李建峰,陈海鹏,等。ATF-Fc抑制肿瘤生长和转移,一种靶向尿激酶受体的工程抗体。中华癌症杂志2008;7(5):651-9。
文章中科院PubMed谷歌学者
周浩,王辉,于刚,王震,郑晓霞,段宏,孙娟。工程抗体样分子ATF-Fc与曲妥珠单抗协同抑制人乳腺癌异种移植瘤小鼠模型肿瘤生长和侵袭。生态学报,2017;14(5):5189-96。
PubMed公共医学中心谷歌学者
Hinshaw DC, Shevde LA。肿瘤微环境天生地调节癌症的进展。癌症决议2019;79(18):4557-66。
文章中科院PubMed公共医学中心谷歌学者