摘要
糖尿病(DM)目前影响全球4.63亿人,是一种以糖代谢受损为特征的慢性疾病,由胰腺β细胞的损失或功能障碍引起,前者在1型糖尿病(T1DM)中占主导地位,后者在2型糖尿病(T2DM)中占主导地位。由于胰岛β细胞功能障碍或丧失导致胰岛素分泌受损是不同类型糖尿病的基础,研究的重点是从人类多能干细胞(hPSC)中生成胰岛β细胞,作为补偿胰岛素缺乏的潜在细胞来源。然而,许多在体外将hPSCs分化为表达胰岛素的β细胞的方法产生的hPSCs衍生的β细胞要么表型不成熟,如葡萄糖刺激胰岛素分泌受损(GSIS),要么对GSIS的反应弱于尸体胰岛。在胰腺β细胞中,线粒体在耦合葡萄糖代谢和胰岛素胞吐中起着核心作用,从而确保了GSIS的精细控制。β细胞线粒体代谢和功能的缺陷损害了这种代谢耦合。在本综述中,我们强调了线粒体在β细胞的代谢分泌偶联中的作用,并总结了线粒体在糖尿病β细胞功能障碍中的意义的证据。如何靶向线粒体功能可能是一个新的和有趣的策略,以进一步完善分化方案,生成成熟的和功能的hpsc衍生的β细胞,其GSIS特征类似于人类尸体胰岛,用于药物筛选或潜在的细胞治疗。
简介
糖尿病(DM)是一种以绝对或相对胰岛素缺乏引起的糖代谢受损为特征的慢性疾病。糖尿病的发病率和流行率在全球急剧上升。虽然糖尿病有许多不同类型,但两种主要类型的糖尿病是1型糖尿病(T1DM)和2型糖尿病(T2DM)。T1DM的特征是内分泌胰腺(朗格汉斯胰岛)内产生胰岛素的β细胞的选择性自身免疫破坏,而更常见的类型是T2DM,其结果是外周组织胰岛素抵抗和β细胞功能障碍[1,2,3.].根据国际糖尿病联合会(www.idf.org),全球成人糖尿病患者估计为4.63亿人,这一数字预计将在未来25年内增加,到2040年达到约7亿人(IDF糖尿病地图集第9版)www.diabetesatlas.org).目前全球每11个成年人中就有1人患有糖尿病,其中10%患有T1DM [4].更重要的是,与糖尿病相关的微血管(视网膜病变、肾病、神经病变)和大血管(冠心病、心肌梗死和中风)并发症成本极高且难以管理,这对西方和发展中国家来说都是一个重大的社会、医疗和财政挑战[5,6,7,8,9].目前T1DM的药物治疗主要依靠每日外源性胰岛素注射控制血糖或全胰腺和胰岛细胞移植作为替代方法[10].胰岛移植方法受到供体组织严重缺乏和组织排斥的潜在风险的限制[11].从人诱导多能干细胞(hiPSCs)中生成可移植的人β细胞是干细胞治疗的未来目标。此外,来自糖尿病患者的hipsc来源的β细胞对于更好地了解疾病及其进展也至关重要[12].为了达到这一目标,需要大量的努力来有效和重复地将hPSCs分化为胰岛素表达β细胞,使用多阶段定向分化方案,概括胰腺发育的特定阶段。然而,分化尝试并不总是产生有功能的胰岛素表达β细胞,相反,不同的β细胞表现出不成熟的表型,对葡萄糖刺激的胰岛素分泌(GSIS)反应受损。体内和体外研究都强调了线粒体活性和ß-cell功能之间的关键联系[13,14].有趣的是,在糖尿病患者和胰岛素抵抗性iPSC中,β细胞线粒体的功能和形态损伤与胰岛素分泌缺陷有关[15,16].因此,线粒体功能缺陷可能导致在hpsc来源的胰腺β细胞中观察到不成熟的表型。
对于2型糖尿病,尽管由该疾病引起的健康问题的严重性已得到充分认识[17],这种疾病的发病机制仍然是个谜。20世纪60年代的开创性工作已经证明,当β细胞不能释放适当数量的胰岛素以应对葡萄糖时,T2DM就会演变[18,19].后来,随后的研究结果将T2DM或非胰岛素依赖型糖尿病定义为一种代谢综合征,其特征为胰岛素抵抗和胰腺β细胞功能进行性丧失或两者兼有[20.,21].目前,胰岛素分泌缺陷已成为T2DM的主要致病因素[22],改变了许多治疗和管理T2DM的研究方法。因此,许多工作都是为了寻找最佳的分化方案,以生成hscs衍生的胰岛素表达胰腺β细胞,作为未来潜在的细胞来源。
人们一致认为,线粒体代谢是胰腺β细胞胰岛素分泌的主要决定因素。更具体地说,线粒体通过产生ATP介导β细胞对细胞外葡萄糖的反应,并启动一系列事件,最终导致胰岛素的释放,而线粒体氧化代谢的破坏会损害GSIS [23,24].线粒体在控制β细胞质量方面也起着关键作用。因此,线粒体功能障碍导致线粒体膜电位的改变,从而导致线粒体介导的凋亡[25].现有数据表明,细胞凋亡的增加是T1DM和T2DM患者胰岛β细胞质量损失的基础,对胰岛素分泌产生负面影响[26,27].总的来说,所有这些数据都表明线粒体是胰岛素分泌受损的主要参与者。因此,β细胞线粒体成为糖尿病研究的重要靶点也就不足为奇了。在本综述中,我们将首先简要描述胰岛和β细胞,其次说明线粒体及其在胰腺β细胞生理学中的作用,然后提供当前关于线粒体在糖尿病中β细胞功能障碍中的作用的见解,因此,如何针对线粒体动态和功能可能是一种新的有趣的策略,以改善体外分化为成熟和功能的hpsc衍生的胰腺β细胞用于糖尿病治疗。
什么是人胰岛?
1869年,一名医科学生保罗·朗格汉斯发现胰腺中存在一群细胞,称为胰岛,尽管它们的功能尚不清楚[28].从宏观上看,胰腺是一种未配对的胃肠道腺体,形状细长,呈黄粉红色,粘稠度由软到硬,取决于该器官的纤维化和脂肪堆积比例,具有外分泌-内分泌混合功能。外分泌细胞(占胰腺的98%)向十二指肠释放消化酶,而内分泌细胞(占胰腺的1-2%)形成称为朗格汉斯胰岛的细胞群,向门静脉释放营养生成的激素。成人胰岛包含四种主要的内分泌细胞类型:α细胞、β细胞、δ细胞、γ细胞或胰腺多肽细胞和第五种细胞类型,即Epsilon (ε)或Ghrelin细胞,最近已被描述[29]每一种都会释放出不同的激素(表1).除了表达激素外,不同胰岛细胞类型也可通过特定的相关转录因子来区分[30.)(表1).朗格汉斯岛在人体中起着至关重要的作用,因为这篇综述的范围,我们将只关注β细胞及其产生的负责维持葡萄糖稳态的激素(即胰岛素)。β细胞是胰岛中最突出的细胞类型。相对β细胞质量估计在55-75%之间,这取决于所使用的形态测量技术和所分析样品的类型[31,32].从出生到成年,β细胞的数量不断增加[31,33].成年β细胞是异质的,主要有两种不同的群体:“领导者”β细胞占β细胞总数的不到10%,具有起搏器特性,“追随者”β细胞占90% [34].β细胞合成并分泌胰岛素,这是一种51个氨基酸的肽,对细胞吸收营养至关重要。胰岛素具有很强的降糖作用,弗雷德里克·班廷(Frederick Banting)在1920年的发现极大地奠定了我们对古埃及人糖尿病的认识,其临床应用是20世纪医学的重大突破之一。
线粒体的结构:一个独特的和动力的细胞
线粒体是一种双膜结合的胞内细胞器,存在于大多数真核细胞中。一个真核细胞含有数百个线粒体[35].线粒体被称为细胞的发电站,因为它们产生细胞所需的大部分能量或ATP。它们有自己的环状基因组(mtDNA),只携带37个基因,其中13个基因编码氧化磷酸化(OXPHOS)电子传递链的蛋白质,其余的编码2 rRNA和22 tRNA [36].线粒体DNA是母体遗传并独立于宿主基因组复制的,但绝大多数调节线粒体结构、生物发生和功能的蛋白质由核基因组编码并导入线粒体。例如,mtDNA的转录和复制是由细胞核DNA编码的线粒体转录因子A (TFAM)调控的[37],表明细胞核和线粒体之间存在明显复杂的双向调节。线粒体的直径为0.5 ~ 1 μ m,但它们的大小和结构在不同的细胞类型之间和细胞内都有很大的差异[38].此外,哺乳动物细胞中线粒体的数量因生物体、组织和细胞类型的不同而有很大差异。例如,成熟的红细胞没有线粒体[39],而某些体细胞(成纤维细胞)则含有> 2000个线粒体[40].线粒体在结构上由四个执行特殊功能的隔室组成。这些隔室包括:(i)外膜,其中包含大量被称为孔蛋白的完整蛋白质结构,允许离子和小分子自由扩散;(ii)膜间空间,质子在其中积聚并产生电化学梯度;(iii)内膜,其中只有氧气,CO可以自由渗透2和H2O.它还允许三磷酸腺苷(ATP)的运输,并包含电子传递链的亚单位复合物;和(iv)丙酮酸和脂肪酸氧化以及三羧酸(TCA)循环发生的基质。由内膜内折形成的嵴的存在使线粒体具有其特有的形态。线粒体是高度动态的细胞器,其形态受融合和裂变周期的调控,统称为线粒体动力学[41].线粒体在不同的细胞过程中起着许多作用,其中最重要的作用是为细胞活动提供能量。42].
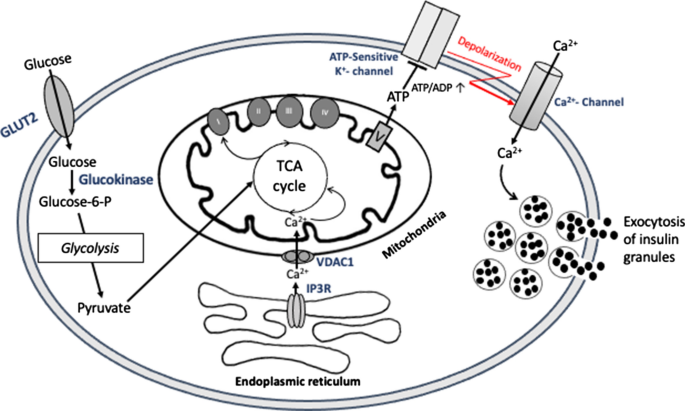
葡萄糖刺激胰岛素分泌中线粒体和糖酵解合作的共识模型
葡萄糖是几乎所有哺乳动物细胞(包括胰腺β细胞)的基本代谢底物和主要能量来源。胰腺β细胞感知血糖和其他分泌素(如神经递质和循环激素)的变化,并根据我们身体的需要调节胰岛素分泌。
在健康的β细胞中,葡萄糖激酶的活性在很大程度上控制葡萄糖感测。43]和线粒体氧化产生ATP [44,45].因此,葡萄糖代谢和胰岛素胞吐之间的紧密耦合是生理调节分泌反应所必需的。β细胞的超微结构检查表明,线粒体通常与分泌胰岛素颗粒非常接近,这可能促进代谢-分泌偶联[46].葡萄糖通过葡萄糖转运体(啮齿动物中的GLUT2;在人体中主要是GLUT1),并通过葡萄糖激酶的磷酸化而保留在细胞内,从而启动糖酵解[47]由于β细胞中乳酸脱氢酶活性极低,以丙酮酸为主要最终产物[48],而不是大多数组织。丙酮酸被导入线粒体,在那里它为三羧酸(TCA)循环提供养分。TCA循环激活诱导电子通过NADH和FADH从TCA循环中间产物转移到呼吸链2随后通过氧化磷酸化(OXPHOS)产生ATP,导致细胞质ATP/ADP比值增加。这就关闭了atp敏感的K+通道,产生膜去极化打开电压依赖性钙2 +通道:钙的流入增加了胞质钙2 +引发胰岛素胞吐(图;1).这个所谓的经典K三磷酸腺苷通道依赖通路是胰腺β细胞GSIS中线粒体耦合和糖酵解合作的最佳特征机制。此外,线粒体在GSIS中的重要作用由线粒体膜电位之间的显著正相关(ΔΨ米)及GSIS [49]以及在OXPHOS被抑制时完全抑制GSIS [50].有趣的是,有证据表明,在阈值以下的葡萄糖水平,β细胞K三磷酸腺苷通道打开导致细胞膜超极化和电压门控钙关闭2 +通道,从而阻止胰岛素分泌[51].在对高血糖的反应中,β细胞K三磷酸腺苷通道依赖的胰岛素胞外机制启动(图;2).有证据表明,葡萄糖可以独立地放大胰岛素分泌K三磷酸腺苷渠道(52].K中的分子三磷酸腺苷不依赖通道刺激胰岛素分泌的是活性氧(ROS)、谷氨酸、柠檬酸和苹果酸,以及cAMP、NADPH、长链酰基辅酶a衍生物[53,54,55,56].这些被称为代谢偶联因子的分子本身不能诱导胰岛素分泌,但被认为可以放大胰岛素分泌。它们在胞质钙升高中的作用2 +超过了生成GSIS所必需的ATP。此外,在缺乏葡萄糖的情况下,脂肪酸可被代谢产生ATP并维持胰岛素分泌的基础水平[57,58].脂肪酸似乎可以通过质膜自由扩散到胰腺β细胞[59]在那里,它们被酰基辅酶a合成酶(ACS)转化为长链酰基辅酶a,并通过肉碱棕榈酰转移酶1 (CPT-1)进入线粒体进行β-氧化[59].由此产生的乙酰辅酶a随后在TCA循环中被氧化,产生足够β细胞存活和基础胰岛素分泌的ATP。当细胞外葡萄糖浓度升高时,脂肪酸氧化被抑制,糖酵解发生[60,61].然而,脂肪酸对GSIS的影响与链长和不饱和程度直接相关,其中长链脂肪酸(如棕榈酸或亚油酸)在葡萄糖刺激下会急剧改善胰岛素释放,但会慢性减少胰岛素释放。
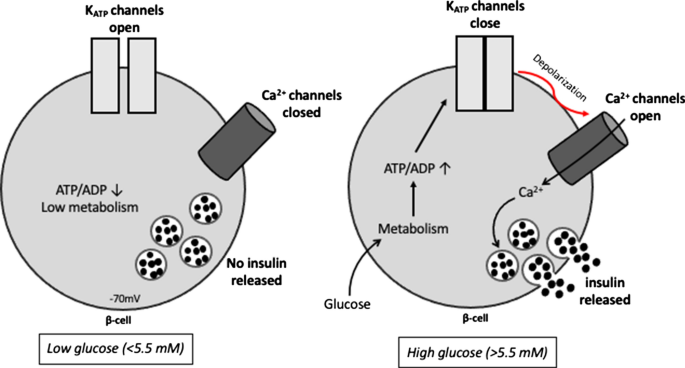
改编自坎特利等人。[112]
低糖和高糖刺激胰岛素分泌概述。在基础血糖水平(左图),atp敏感K+渠道(K三磷酸腺苷通道)在胰腺β细胞保持开放,维持膜超极化,Ca2 +通道关闭和抑制胰岛素分泌。血糖升高(右图)诱导氧化磷酸化和ATP的产生,导致K蛋白的关闭三磷酸腺苷通道,质膜去极化,钙流入导致胞质钙增加2 +引发胰岛素胞吐:即所谓的经典K三磷酸腺苷channel-dependent通路
β细胞线粒体在糖尿病中的作用
线粒体功能障碍是人类病理的重要因素,据估计,线粒体DNA (mtDNA)突变导致约1%的所有类型的糖尿病[62],而且常常不被临床医生所发现。在胰腺β细胞中,线粒体在耦合葡萄糖代谢和胰岛素胞吐中起着核心作用,从而确保严格控制GSIS。因此,线粒体功能的任何缺陷都会损害这种代谢耦合,并最终促进糖尿病。有趣的是,β细胞线粒体的功能和形态损伤已被认为是糖尿病相关胰岛素分泌缺陷的关键因素[15].在INS-1细胞中,暴露于2 μM的无机砷(根据流行病学研究,无机砷是最广泛的环境糖尿病因子之一)可通过抑制氧依赖性线粒体代谢而不改变非线粒体呼吸来减少GSIS [63].线粒体在糖尿病发病机制中的关键作用得到了以下发现的支持:人类mtDNA突变,以及小鼠胰腺β细胞特异性敲除TFAM,导致糖尿病[62,64].有趣的是,在从7 - 9周龄tfam突变小鼠分离的胰岛中进行的代谢分泌偶联的体外生理研究显示线粒体膜电位的超极化降低(ΔΨ米)、受损Ca2 +信号和降低的GSIS [62].此外,mtDNA缺失的小鼠胰腺β细胞系MIN6葡萄糖无反应,表现出葡萄糖、亮氨酸和磺酰脲类药物诱导的胰岛素分泌受损,并以线粒体缺陷为特征[65,66,67]表明mtDNA缺失引起的线粒体功能障碍与GSIS受损有关。事实上,线粒体DNA突变的影响在有丝分裂率低、ATP产量高的组织中最为明显,如胰岛细胞。病理生理学上,总共有54种已知的mtDNA突变(缺失、替换和点突变)与糖尿病的发展有关[68].其中,最常遇到的是亮氨酸tRNA编码基因bp3243 (A3243G)位置的A - G取代[69].有这种突变的患者GSIS受损。由于mtDNA的传播方式影响大约1%的一般人口,因此该病是母系遗传的[69]和高达10%的T1DM患者[70].尽管A3243G突变诱导的孕产妇糖尿病的发病机制尚未完全阐明,但大多数研究指出,β细胞功能障碍和胰岛素分泌障碍成为这些患者比胰岛素抵抗更突出的特征[71].此外,A3243G点突变导致O2与线粒体形态改变相关的消耗和ATP生成[72].此外,葡萄糖激酶(GCK)基因的点突变导致2型成熟型青年糖尿病(MODY2),这是一种常染色体显性遗传模式的单基因糖尿病[73].GCK(己糖激酶IV)是一种在胰腺β细胞中表达的葡萄糖传感器,是葡萄糖代谢的关键酶,催化葡萄糖转化为葡萄糖-6-磷酸,从而控制GSIS。有研究报道,β细胞GCK活性降低是MODY2高血糖的主要原因,因为β细胞缺乏GCK的小鼠在表型上与GCK整体敲除的动物相似[74].这些小鼠要么全身缺乏GCK,要么只在β细胞中缺乏GCK,在出生后3天内死于严重的糖尿病。除了MODY2, MODY3,这种遗传性疾病最常见的形式,已经与转录因子肝细胞核因子-1 α (HNF1 α)的突变有关。HNF1-a控制多个涉及胰腺β细胞功能的基因,特别是代谢-分泌耦合。小鼠HNF-1a基因缺失导致糖尿病[75].机制上,在β细胞中,HNF-1a基因突变导致营养诱导的线粒体ATP生成受损,线粒体膜电位和细胞内钙减少2 +继而导致GSIS功能失调[76,77].
线粒体是高度动态的细胞器,具有异质网络的功能。它们的形态受融合和裂变的协调循环调控,统称为“线粒体动力学”[78].调控线粒体融合和裂变的蛋白质已经被发现。在哺乳动物中,融合主要由丝裂蛋白1 (Mfn1)、丝裂蛋白2 (Mfn2)和视神经萎缩蛋白1 (Opa1)调控,而裂变则由Fis1、Drp1和线粒体膜裂变因子(MFF)介导[79,80,81].据报道,线粒体动力学有助于线粒体质量控制和包括胰腺β细胞在内的许多系统的功能[82,83].线粒体动力学在维持β细胞线粒体稳态方面的意义源于糖尿病动物模型中线粒体形态受损的研究[54].最近的数据表明,β细胞通常含有线粒体的丝状网络,但当线粒体长期融合或破裂时,GSIS就会受损[84] [85].此外,T2D患者死后胰腺β细胞中观察到异常的线粒体动态[15].线粒体动力学蛋白在β细胞功能调节中的作用已通过在β细胞系中使用遗传工具进行了研究[86].因此,在INS-1细胞中过表达Drp1或Fis1可降低GSIS [85,87].尽管分子机制尚未完全了解,但这些研究强调了线粒体动力学和形态变化如何影响影响胰腺β细胞胰岛素分泌功能的途径的关键作用。理解控制线粒体动态的分子机制对于破译线粒体形状如何满足或与β细胞功能相关至关重要。
er -线粒体通讯在控制GSIS中的作用
细胞器间通信是细胞生物学的一个新兴方面,据报道,这种网络的性质允许代谢根据细胞的需要进行适应。重要的是,ER和线粒体不再被认为是细胞中的单个细胞器,因为它们以高度动态和调节的方式物理相互作用,形成特定的微域,称为线粒体相关膜(MAM) [88].细胞器接触部位不涉及膜融合,但通过“蛋白质桥”介导[89].MAM在细胞Ca中起着核心作用2 +体内平衡(90,91]最近,er -线粒体相互作用已被证明可能调节线粒体功能的几个方面,包括线粒体动力学,氧化代谢[91,92]和凋亡[93].这些功能大多与钙紧密相连2 +线粒体的状态,自Ca2 +从内质网转移到线粒体是调节线粒体能量代谢的关键(因为TCA循环中的三种酶是Ca2 +依赖性),从而影响ATP合成:抑制或缺乏转移导致ATP水平下降[94];因此,MAM可以被视为许多器官中激素和营养信号的重要枢纽。直到最近几十年,er -线粒体相互作用被描述最多的功能是脂质生物合成,这表明MAM在脂质代谢中的作用[95,96,97].重要的是,导致脂质稳态破坏的er -线粒体偶联改变通常与肥胖、T2DM、非酒精性脂肪性肝病(NAFLD)等代谢相关疾病的发病机制有关[98,99,One hundred.].这种亚细胞通讯现在已经被整合到糖尿病中ER和线粒体的参与中。在这方面,最近的证据报告了糖尿病患者ER-线粒体通讯错误与β细胞功能障碍之间的关联[101].从机制上看,ER-线粒体沟通障碍促进线粒体功能障碍、ER应激、Ca改变2 +从而导致糖尿病患者胰岛素作用和分泌的改变[102].此外,用棕榈酸盐处理诱导内质网应激可显著减少小鼠Min6-B1 β细胞系的内质网线粒体串音,并改变GSIS [101].总的来说,这些证据强调了MAM在营养调节信号通路中控制葡萄糖和胰岛素稳态的重要性,并表明靶向MAM结构和功能可能是糖尿病管理和生成全功能hscs衍生β细胞的新策略。
线粒体在hipsc衍生胰腺细胞功能中的作用
已知β细胞通过增加线粒体氧化ATP的产生促进葡萄糖刺激胰岛素分泌(GSIS) [54,103],表明线粒体活性的增加是GSIS所需的细胞成分。尽管胰腺β细胞线粒体在受损的GSIS和DM中的作用已经得到了很好的证实,但它在hscs来源的胰腺β细胞的成熟和功能中的作用仍然知之甚少。目前T1DM的药物治疗主要依靠每日注射外源性胰岛素控制血糖或全胰腺和胰岛细胞移植作为替代方法[10].胰岛移植方法受到供体组织严重缺乏和组织排斥的潜在风险的限制[11].从胚胎干细胞(hESC)和诱导多能干细胞(hiPSC)中生成可移植的人β细胞是干细胞治疗学的最终目标。然而,通过体外分化方案产生的大多数hscs衍生的β细胞(表达胰岛素的β细胞)表达已知的成年β细胞标志物,但功能不完全成熟[34].大量研究发现PDX1、NKX6.1、MAFA等转录因子在未成熟β细胞的功能成熟过程中发挥重要作用[104].任何这些关键因素的缺失或异常表达导致产生类似于表型不成熟的胎儿细胞的hpsc衍生β细胞[104].在功能上,线粒体NADH穿梭体的不成熟导致胎儿、新生儿和新再生的β细胞无法分泌胰岛素以应对葡萄糖[105].NADH穿梭系统是糖酵解与线粒体能量代谢激活耦合以触发GSIS的关键。由于线粒体在β细胞功能中起着重要和关键的作用,功能缺陷的线粒体NADH穿梭系统可能是不成熟和无功能分化的hscs来源的β细胞生成的基础。此外,体外获得的所有表达胰岛素的hscs来源的β细胞都不能完全再现体外观察到的人类尸体胰岛的胰岛素分泌。就胰岛素分泌量而言,它们在体外GSIS反应中没有达到与尸体胰岛相当的效果[106].在尸胰岛中,对葡萄糖挑战的反应大约是基础分泌的10倍,而在hpsc来源的β-簇中,尽管每个细胞的线粒体质量相同,但仅观察到增加了2.2倍[106],提示分化的hscs来源的β细胞可能具有代谢功能障碍的线粒体。有趣的是,线粒体中无杂合循环的减少已被确定为与hscs来源的β细胞中GSIS减少相关的潜在机制[106].因此,适当的线粒体功能是β细胞刺激分泌耦合的基石。众所周知,β细胞在出生后功能成熟,包括获得适当分泌胰岛素以应对葡萄糖的能力[107,108].从新生小鼠中分离的胰岛始终表现出受损的GSIS [109]可能归因于关键代谢基因的普遍低活性和表达,包括线粒体膜穿梭体(甘油磷酸,苹果酸-天冬氨酸,丙酮酸-柠檬酸和丙酮酸-苹果酸穿梭体),通过糖酵解衍生的NADH被再氧化。此外,利用线粒体甘油醛3-磷酸脱氢酶(GPDH) cDNA增加胎鼠胰岛中NADH穿梭酶活性显著改善GSIS [105].这表明NADH穿梭体的不成熟导致胎儿β细胞GSIS受损。此外,雌激素相关受体(ERRs)的三个副链之一ERRγ的诱导,已知可驱动激活线粒体氧化磷酸化的转录网络,电子传递链和GSIS所需的ATP生产,改善新生儿胰岛和ipsc衍生的β样细胞的胰岛素分泌[109].此外,最近有报道称,GLP-1类似物艾塞那肽通过其线粒体功能促进作用,增强弗里德里奇共济失调患者特异性iPSC的GSIS [110].这些结果强烈提示代谢活性线粒体在诱导功能β细胞的关键作用。大多数微分协议[111试图用小分子来激活或抑制谱系规范信号的关键转录因子来模拟发育事件可能不足以完全促进分化和成熟。事实上,GSIS所需的其他因素,如代谢活性线粒体的诱导,也可能是成熟以实现体外hsc衍生β细胞功能所必需的。总的来说,所有这些发现都表明,靶向线粒体功能可能是进一步完善分化方案的缺失拼图,以生成成熟且功能完善的hpsc衍生β细胞,其GSIS特征类似于人类尸体胰岛,用于药物筛选或未来可能用于细胞治疗。
结论
由于胰腺β细胞功能障碍或缺失,与糖尿病相关的胰岛素分泌受损涉及多种机制。然而,有证据表明ß-cell线粒体代谢和功能障碍导致糖尿病患者胰岛素分泌缺陷。在这篇综述中,我们强调了线粒体ß-cell在糖代谢与胰岛素胞外分泌耦合中的作用,并总结了线粒体在糖尿病患者β细胞功能障碍、胰岛素分泌缺陷以及体外生成的具有不成熟表型的hscs衍生ß-细胞中的作用。因此,对于专注于开发β细胞替代策略以用于潜在的糖尿病治疗或药物筛选的研究,靶向线粒体功能可能是一种新的有趣的方法,可以进一步完善分化方案,以生成成熟且功能完善的hpsc衍生的β细胞,其GSIS特征类似于人类尸体胰岛。
数据和材料的可用性
不适用。
引用:
Atkinson MA, Bluestone JA, Eisenbarth GS, Hebrok M, Herold KC, Accili D, Pietropaolo M, Arvan PR, Von Herrath M, Markel DS, Rhodes CJ。1型糖尿病是如何发展的?:the notion of homicide or beta-cell suicide revisited. Diabetes. 2011;60:1370–9.
PrayGod G, Filteau S, Range N, Kitilya B, Kavishe BB, Ramaiya K, Jeremiah K, Rehman AM, Changalucha J, Olsen MF,等。坦桑尼亚西北部成年人中β细胞功能障碍和胰岛素抵抗与糖尿病前期和糖尿病的关系:一项横切面研究。热带医学国际卫生,2021;26:45 - 43。
Eizirik DL, Pasquali L, Cnop M. 1型和2型糖尿病的胰腺β细胞:不同的失败途径。内分泌杂志2020;16:349-62。
郑勇,雷士生,胡方锋。2型糖尿病及其并发症的全球病因学和流行病学。内分泌杂志2018;14:88-98。
糖尿病微血管和大血管并发症的性别差异。临床科学(伦敦)。2017; 131:833-46。
Dal Canto E, Ceriello A, Ryden L, Ferrini M, Hansen TB, Schnell O, Standl E, Beulens JW。糖尿病作为心血管危险因素:宏观和微血管并发症的全球趋势概述。欧洲心脏病杂志2019;26:25-32。
Bommer C, Heesemann E, Sagalova V, mann - goehler J, Atun R, Barnighausen T, Vollmer S. 20-79岁成人糖尿病的全球经济负担:一项疾病成本研究。《柳叶刀》糖尿病内分泌杂志2017;5:423-30。
普拉迪帕R,莫汉V.印度2型糖尿病及其并发症的患病率和国家的经济成本。中华临床医学杂志,2017;
Bener A, Kim EJ, Mutlu F, Eliyan A, Delghan H, Nofal E, Shalabi L, Wadi N.卡塔尔人口水平导致的糖尿病负担:一个新兴的公共卫生问题。糖尿病代谢综合征,2014;8:216-20。
皮卡JC。胰岛素泵治疗1型糖尿病。中华医学杂志(英文版)2012;
松本,下田。临床胰岛移植从异基因向异种移植的现状。糖尿病杂志。2020;12:33 - 41。
Maxwell KG, Millman JR.糖尿病患者ipsc来源β细胞的应用。Cell Rep Med. 2021;2:10 00238。
El-Assaad W, Joly E, Barbeau A, Sladek R, Buteau J, Maestre I, Pepin E, Zhao S, Iglesias J, Roche E, Prentki M.糖脂毒性改变脂质分配,导致线粒体功能障碍、胆固醇、神经酰胺沉积和活性氧的产生。内分泌学。2010;151:3061 - 73。
郭诗诗,朴克思。线粒体DNA变异在糖尿病发病机制中的作用。前沿生物科学(Landmark Ed)。2016; 21:1151 - 67。
Anello M, Lupi R, Spampinato D, Piro S, Masini M, Boggi U, Del Prato S, Rabuazzo AM, Purrello F, Marchetti P. 2型糖尿病患者胰腺β细胞线粒体功能和形态改变。Diabetologia。2005;48:282-9。
Burkart AM, Tan K, Warren L, Iovino S, Hughes KJ, Kahn CR, Patti ME。人诱导多能干细胞的胰岛素抵抗降低了线粒体的大小和功能。科学代表2016;6:22788。
美国糖尿病协会。糖尿病在美国的经济后果。糖尿病护理。1998;21:296-309。
Bagdade JD, Bierman EL, Porte D Jr.基础胰岛素水平在糖尿病和非糖尿病受试者胰岛素对葡萄糖反应评估中的意义。《临床投资》,1967;46:1549-57。
Simpson RG, Benedetti A, Grodsky GM, Karam JH, Forsham PH.胰岛素释放早期。糖尿病。1968;17:684 - 92。
Donath MY, Shoelson SE。2型糖尿病是一种炎症性疾病。中华免疫杂志2011;11:98-107。
李志强,李志强,李志强。胰岛素抵抗在糖尿病中的应用前景。世界干细胞杂志。2021;13:21 1 - 35。
Ashcroft FM, Rorsman P.糖尿病和β细胞:过去十年。细胞。2012;148:1160 - 71。
Nicholas LM, Valtat B, Medina A, Andersson L, Abels M, Mollet IG, Jain D, Eliasson L, Wierup N, Fex M, Mulder H.线粒体转录因子B2对胰腺β细胞的线粒体和细胞功能至关重要。Mol Metab. 2017; 6:651-63。
在健康和疾病中转录β细胞线粒体。Mol Metab. 2017; 6:1040-51。
熊山,穆涛,王刚,姜霞。哺乳动物线粒体介导的细胞凋亡。蛋白质细胞。2014;5:37 - 49。
莫恩ASM,巴特勒AE。1型和2型糖尿病中β细胞身份的改变。2019;19:83。
巴特勒AE,詹森J,邦纳-威尔S,里策尔R,里扎RA,巴特勒PC。2型糖尿病患者β细胞缺乏和β细胞凋亡增加糖尿病。2003;52:102-10。
Barach JH。保罗·朗格汉斯(1847-1888年)糖尿病。1952;1:411-3。
Wierup N, Svensson H, Mulder H, Sundler F.饥饿素细胞:一种新的发育调节胰岛细胞在人胰腺。Regul Pept. 2002; 107:63-9。
Dassaye R, Naidoo S, Cerf ME。转录因子对胰腺器官发生、分化和成熟的调控。小岛。2016;8:13-34。
沃克JT,桑德斯DC,布里索瓦M,鲍尔斯AC。人体胰岛:具有巨大影响的迷你器官。Endocr Rev. 2021; 42:605-57。
王玉娟,刘超,高玲,刘超,联合H, AtkinsonPowers MAAC, Feldman MD, Naji A.多重原位成像细胞术对型糖尿病患者内分泌胰腺和免疫系统的分析。Cell Metab, 2019。https://doi.org/10.1016/j.cmet.2019.01.003.
Meier JJ, Butler AE, Saisho Y, Monchamp T, Galasso R, Bhushan A, Rizza RA, Butler PC。β细胞复制是人类出生后β细胞群扩大的主要机制。糖尿病。2008;57:1584 - 94。
Bourgeois S, Sawatani T, Van Mulders A, De Leu N, Heremans Y, Heimberg H, Cnop M, Staels W.使用干细胞衍生的β细胞实现糖尿病的功能性治疗:我们到了吗?细胞。2021;10:191。
Okie JG, Smith VH, Martin-Cereceda M.生命的主要进化转变,代谢尺度和线粒体和叶绿体的数量和大小。Proc生物科学2016;283:20160611。
华莱士。人和小鼠线粒体疾病。科学。1999;283:1482-8。
Bonekamp NA, Jiang M, Motori E, Garcia Villegas R, Koolmeister C, Atanassov I, Mesaros A, Park CB, Larsson NG。高水平的TFAM在体内抑制哺乳动物线粒体DNA转录。生命科学联盟。2021;4:e202101034。
王晓明,王晓明,王晓明,王晓明。非酒精性脂肪肝患者巨型线粒体的三维超微结构研究。科学通报2021;11:3319。
张忠文,程杰,徐峰,陈晔,杜剑杰,袁敏,朱峰,徐晓春,袁森。红细胞挤压细胞核和线粒体抗氧化应激。IUBMB Life. 2011; 63:560-5。
Bogenhagen DF。线粒体DNA类核结构。生物化学学报(英文版);2012;19(2):914 - 20。
李文杰,李志强,李志强。线粒体膜动力学的细胞生物学研究。细胞生物学,2020;21:204-24。
Papa S, Martino PL, Capitanio G, Gaballo A, De Rasmo D, Signorile A, Petruzzella V.哺乳动物线粒体氧化磷酸化系统。中国生物医学杂志,2012;942:3-37。
Matschinsky FM,威尔逊DF。葡萄糖激酶在葡萄糖稳态中的核心作用:在朗格汉斯胰岛中证明该酶存在50年后的展望。前沿物理。2019;10:148。
线粒体功能与胰岛素分泌。中国生物医学工程学报,2013;
Wiederkehr A, Wollheim CB。线粒体信号驱动胰腺β细胞分泌胰岛素。中国生物医学杂志,2012;
Wollheim CB。调节胰岛素分泌的β细胞线粒体:II型糖尿病的新罪魁祸首。Diabetologia。2000;43:265 - 77。
Iynedjian PB。哺乳动物葡萄糖激酶的分子生理学研究。中国生物医学工程学报(英文版);2009;
Sekine N, Cirulli V, Regazzi R, Brown LJ, Gine E, tamari - rodriguez J, Girotti M, Marie S, MacDonald MJ, Wollheim CB,等。胰腺β细胞乳酸脱氢酶低,线粒体甘油磷酸脱氢酶高。在营养感测方面的潜在作用。中国生物化学杂志,1994;
Spacek T, Santorova J, Zacharovova K, Berkova Z, Hlavata L, Saudek F, Jezek P.胰岛素瘤胰岛素- 1e细胞葡萄糖刺激胰岛素分泌与呼吸和线粒体膜电位升高相关。中国生物化学杂志。2008;40:1522-35。
Mishra A, Liu S, Promes J, Harata M, Sivitz W, Fink B, Bhardwaj G, O 'Neill BT, Kang C, Sah R,等。β细胞中外围磷脂2的下调会在营养压力下损害胰岛素分泌,并损害线粒体。JCI Insight, 2021;6:e144341。
王志强,王志强,王志强,等。小鼠胰腺β细胞钙通道活性的研究。南京大学学报(自然科学版)1989;
Chan CB, MacPhail RM。fa/fa Zucker大鼠离体胰岛胰岛素分泌的KATP通道依赖和-独立通路生物化学,1996;74:403-10。
Maechler P. β细胞的谷氨酸通路和胰岛素分泌的控制。糖尿病临床研究。2017;131:149-53
李志强,李志强,李志强,等。胰腺β细胞线粒体功能障碍的研究。内分泌代谢杂志2012;23:477-87。
Antinozzi PA, Ishihara H, Newgard CB, Wollheim CB。线粒体代谢设定燃料刺激胰岛素分泌的最大限度的胰腺β细胞模型:四种燃料分泌素的调查。生物化学学报。2002;277:11746-55。
Farfari S, Schulz V, Corkey B, Prentki M.胰腺β细胞中葡萄糖调节的无平衡失调和崩溃失调:胰岛素分泌中丙酮酸/柠檬酸穿梭的可能含义。糖尿病。2000;49:718-26。
Deeney JT, Gromada J, Hoy M, Olsen HL, Rhodes CJ, Prentki M, Berggren PO, Corkey BE。长链酰基辅酶a的急性刺激增强了胰岛素分泌细胞(HIT T-15和NMRI β细胞)的胞吐。中国生物化学杂志,2000;
Yaney GC, Corkey BE。胰腺β细胞的脂肪酸代谢和胰岛素分泌。Diabetologia。2003;46:1297 - 312。
汉密尔顿JA,坎普F.自由脂肪酸是如何在细胞膜中运输的?是通过蛋白质还是通过脂质的自由扩散?糖尿病。1999;48:2255 - 69。
Corkey BE, Glennon MC, Chen KS, Deeney JT, Matschinsky FM, Prentki M.丙二酰辅酶A在葡萄糖刺激胰岛素分泌中的作用。生物化学学报。1989;26(2):366 - 366。
脂肪酸和酮体对肥胖高血糖小鼠离体胰岛胰岛素生物合成的影响。Horm Metab Res. 1975; 7:385-9。
Silva JP, Kohler M, Graff C, Oldfors A, Magnuson MA, Berggren PO, Larsson NG。线粒体糖尿病的组织特异性敲除小鼠的胰岛素分泌受损和β细胞损失。Nat Genet, 2000; 26:336-40。
Dover EN, Beck R, Huang MC, Douillet C, Wang Z, Klett EL, Styblo M.亚砷酸钠和甲基硅钠抑制INS-1 832/13 β细胞线粒体代谢和葡萄糖刺激胰岛素分泌。2018; 92:693-704。
Maassen JA, LM TH, Van Essen E, Heine RJ, nijpel G, Jahangir Tafrechi RS, Raap AK, Janssen GM, Lemkes HH。线粒体糖尿病:分子机制和临床表现。糖尿病。2004;53(增刊1):S103-109。
苏岛A,井上K,高井D,金子M,石原H,冈Y,隼JI。在小鼠胰腺β细胞系MIN6中,葡萄糖刺激胰岛素分泌的调节需要线粒体DNA。中国生物化学杂志,1996;21(2):344 - 344。
鹤zoe K,荒木E,古川N, shirrotani T,松本K,金子K,元岛H,吉人K,白上A,岸川H,等。线粒体dna缺失的胰腺β细胞系的创建和特征:葡萄糖、亮氨酸和磺酰脲类药物诱导胰岛素分泌受损。糖尿病。1998;47:621-31。
Kennedy ED, Maechler P, Wollheim CB。线粒体DNA缺失对INS-1细胞代谢分泌偶联的影响。糖尿病。1998;47:374 - 80。
Dabravolski SA, Orekhova, Baig MS, Bezsonov EE, Starodubova AV, Popkova TV, Orekhov AN。线粒体突变和慢性炎症在糖尿病中的作用。中国药理学杂志,2021;
墨菲R,特布尔DM,沃克M,哈特斯利AT。与3243A>G线粒体点突变相关的母系遗传性糖尿病和耳聋(MIDD)的临床特征、诊断和治疗糖尿病医学。2008;25:383-99。
李文杰,李华威,帕默JP,朴克勤,李鸿杰,朴智勇,洪sk,李九。典型和非典型I型糖尿病韩国受试者的胰岛细胞自身免疫和线粒体DNA突变Diabetologia。2001;44:2187 - 91。
Maassen JA, Janssen GM, Hartt LM。线粒体糖尿病的分子机制研究。安医学2005;37:213-21。
van den Ouweland JM, Maechler P, Wollheim CB, Attardi G, Maassen JA。线粒体DNA中含有tRNA(Leu)(UUR)突变的线粒体的功能和形态异常,这些突变来自于母体遗传性糖尿病和耳聋(MIDD)和进行性肾脏疾病患者。Diabetologia。1999;42:485 - 92。
青少年成熟型糖尿病(MODY):目前诊断和治疗的观点。《糖尿病代谢综合征》2019;12:1047-56。
Postic C, Magnuson MA。葡萄糖激酶(GK)在维持葡萄糖稳态中的作用。Cre-loxP技术对基因的特异性破坏。中华民国糖尿病杂志1999;1:115-24。
Pontoglio M, Sreenan S, Roe M, Pugh W, Ostrega D, Doyen A, Pick AJ, Baldwin A, Velho G, Froguel P,等。肝细胞核因子1缺失小鼠胰岛素分泌缺陷。《投资管理》,1998;10(1):17 - 19。
杨震,吴世生,郑涛,王世杰,陆海军,向坤。中国人糖尿病转录因子1基因突变的遗传学和临床特征。中华学刊。2007;24:157-61。
王华,马赫勒P, Hagenfeldt KA, Wollheim CB。HNF-1alpha功能的显性阴性抑制导致胰岛素基因转录缺陷和胰腺β细胞系代谢-分泌耦合受损。中国科学院学报(自然科学版),1998;
李志强,李志强,李志强,等。线粒体动力学研究进展。生物化学学报。2018;62:341-60。
Santel A, Frank S, Gaume B, Herrler M, Youle RJ, Fuller MT. Mitofusin-1蛋白是哺乳动物细胞线粒体融合的普遍表达介质。中国生物医学工程学报,2003;
Kim IS, Silwal P, Jo EK。Mitofusin 2,线粒体动力学和先天免疫之间的关键协调器。毒性。2021;12:2273 - 84。
Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, arnaun - pelloquin L, Davezac N, Mils V, Miquel MC,等。神经退行性变和神经元可塑性中的线粒体融合/裂变动力学。神经生物学杂志2016;90:3-19。
斯泰尔斯,史瑞海。β细胞的线粒体动力学和形态。临床内分泌代谢杂志2012;26:725-38。
Whitley BN, Engelhart EA, Hoppins S.线粒体动力学及其作为治疗靶点的潜力。线粒体。2019;49:269 - 83。
Molina AJ, Wikstrom JD, Stiles L, Las G, Mohamed H, Elorza A, Walzer G, Twig G, Katz S, Corkey BE, Shirihai OS。线粒体网络保护β细胞免受营养诱导的凋亡。糖尿病。2009;58:2303-15。
Park KS, Wiederkehr A, Kirkpatrick C, Mattenberger Y, Martinou JC, Marchetti P, Demaurex N, Wollheim CB。线粒体裂变/融合基因对胰岛素释放细胞代谢-分泌偶联的选择性作用。生物化学学报。2008;283:33347-56
Reinhardt F, Schultz J, Waterstradt R, Baltrusch S. Drp1保护线粒体网络对葡萄糖刺激的胰腺β细胞胰岛素分泌很重要。生物化学生物物理学报,2016;474:646-51。
Schultz J, Waterstradt R, Kantowski T, Rickmann A, Reinhardt F, Sharoyko V, Mulder H, Tiedge M, Baltrusch S. Fis1的精确表达对β细胞的葡萄糖反应性很重要。中国内分泌杂志,2016;230:81-91。
Herrera-Cruz MS, Simmen T.超过60年的线粒体相关膜(MAMs)结构的发现和描述。Adv Exp医学生物学,2017;997:13-31。
王志强,王志强,王志强,等。内质网-线粒体接触学研究进展。细胞生物学,2018;28:523-40。
Marchi S, Bittremieux M, Missiroli S, Morganti C, Patergnani S, Sbano L, Rimessi A, Kerkhofs M, Parys JB, Bultynck G,等。内质网-线粒体通过Ca(2+)信号:线粒体相关膜(MAMs)的重要性。Adv Exp医学生物学,2017;997:49-67。
Romero-Garcia S, Prado-Garcia H.线粒体钙:细胞过程在稳态和癌症中的运输和调节(综述)。国际医学杂志,2019;54:15 15 - 67。
田谷浩,王志强,王志强,等。线粒体相关膜对线粒体动力学和自噬的调控。Adv Exp医学生物学,2017;997:33-47。
Verfaillie T, Rubio N, Garg AD, Bultynck G, Rizzuto R, Decuypere JP, Piette J, Linehan C, Gupta S, Samali A, Agostinis P.基于ros的内质网应激后,ER-线粒体接触位点需要PERK来传递细胞凋亡。细胞死亡差异。2012;19:19 80 - 91。
丹顿RM。钙离子对线粒体脱氢酶的调控。生物化学学报2009;1787:1309-16。
万斯我。哺乳动物细胞中的MAM(线粒体相关膜):脂质及其外物。生物化学学报。2014;1841:595-609。
万斯我。哺乳动物细胞中磷脂的合成和转运。交通。2015;16:1-18。
万斯我。细胞器间膜接触部位:脂质代谢的意义。生物学指导,2020;15:24。
王娟,何伟,蔡普军,陈福辉,叶梅,郭娟,苏忠。非酒精性脂肪肝内质网与线粒体相互作用的研究。脂质健康杂志2020;19:72。
李志强,李志强,李志强,等。线粒体相关膜(MAMs)的结构和生理病理作用。细胞钙。2021;94:102343。
Lopez-Crisosto C, Bravo-Sagua R, Rodriguez-Pena M, Mera C, Castro PF, Quest AF, Rothermel BA, Cifuentes M, Lavandero S. er -线粒体错传与代谢疾病。生物化学学报,2015;
Thivolet C, Vial G, Cassel R, Rieusset J, Madec AM。2型糖尿病患者β细胞内质网-线粒体相互作用的减少。PLoS ONE。2017; 12: e0182027。
内质网-线粒体通讯在2型糖尿病中的作用。中国生物医学杂志,2017;997:171-86。
彭志强,王志强,王志强。燃料诱导胰岛素分泌的代谢信号通路研究。Cell Metab, 2013; 18:162-85。
孙志勇,于泰勇,姜晓霞,王伟。未成熟β细胞的功能成熟:1型糖尿病干细胞治疗的障碍。世界干细胞杂志。2021;13:193-207。
谭超,杜贝,涂杰,布朗萨。NADH穿梭在葡萄糖诱导的胎儿β细胞胰岛素分泌中的作用。糖尿病。2002;51:2989 - 96。
Davis JC, Alves TC, Helman A, Chen JC, Kenty JH, Cardone RL, Liu DR, Kibbey RG, Melton DA。体外干细胞来源的β细胞的葡萄糖反应被糖酵解的瓶颈所抑制。Cell rep 2020;31:107623。
Lavine RL, Chick WL, Like AA, Makdisi TW。新生和成年小鼠的葡萄糖耐量和胰岛素分泌。糖尿病。1971;20:134-9。
Bliss CR, Sharp GW。糖诱导胰岛素在年轻大鼠胰岛释放:时间依赖性增强和2-溴硬脂酸盐的作用。医学杂志。1992;263:E890-896。
吉原E,魏哲,林春春,方山,Ahmadian M,木田Y,曾涛,戴Y,于涛,Liddle C,等。ERRgamma对于具有治疗功能的葡萄糖反应β细胞的代谢成熟是必需的。Cell Metab. 2016; 23:622-34。
Igoillo-Esteve M, Oliveira AF, Cosentino C, Fantuzzi F, Demarez C, Toivonen S, Hu A, Chintawar S, Lopes M, Pachera N,等。艾塞那肽诱导frataxin表达并改善fredrich共济失调的线粒体功能。JCI Insight, 2020。https://doi.org/10.1172/jci.insight.134221.
Millman JR, Xie C, Van Dervort A, Gurtler M, Pagliuca FW, Melton DA。1型糖尿病患者干细胞来源的β细胞的产生。Nat Commun, 2016;7:11463。
坎特利J,阿什克罗夫特FM。问与答:胰岛素分泌和2型糖尿病:为什么β细胞失效?BMC生物学2015;13:33。
确认
不适用。
资金
卡塔尔国家图书馆提供的开放获取资金。这项工作得到了卡塔尔生物医学研究所,哈马德·本·哈利法大学,卡塔尔基金会内部拨款(BR01)给Heba H. A . A . Al-Siddiqi博士的支持。
作者信息
作者及隶属关系
贡献
AD撰写稿件,NAA绘制图形,RA查阅文献并编辑稿件,HHAAA审阅并编辑稿件。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
所有作者都审阅了手稿的最终版本,并批准出版。
相互竞争的利益
所有作者都宣称他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
戴安,A., Al-Shukri, N.A., Bin Abdul Mu-u-min, R.。et al。糖尿病中的β细胞线粒体:hpsc衍生胰腺β细胞生成过程中缺失的一块拼图?翻译医学杂志20.163(2022)。https://doi.org/10.1186/s12967-022-03327-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-022-03327-5
关键字
- β细胞
- 胰腺
- 线粒体
- 糖尿病
- hPSC-derivedβ肽
- 分化
- 葡萄糖刺激胰岛素分泌(GSIS)