- 审查gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
外泌体作为RNA传递的生物激发纳米载体:制备和应用gydF4y2Ba
转化医学杂志gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba,文章号:gydF4y2Ba125gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
纳米载体作为药物/生物分子递送系统在近几十年来得到了显著的发展。考虑到纳米载体的稳定性、合理的递送效率和安全性,在这些递送系统的成功临床应用中存在几个障碍。这些挑战鼓励药物递送研究人员建立具有更长的循环时间、高稳定性和高兼容性的创新纳米载体。外泌体是通过各种细胞释放的细胞外纳米大小的囊泡。这些囊泡作为纳米载体,由于其对受体细胞的天然亲和力以及在细胞之间穿梭基因、脂质、蛋白质和rna的固有能力,具有克服基因和药物传递中遇到的一些障碍的巨大潜力。到目前为止,关于外泌体给药的研究已经有很多有价值的研究,但关于RNA,尤其是mRNA的给药研究非常有限。由于基于mrna的疫苗和疗法最近在各种疾病中特别突出,由于这些核酸的大尺寸和破坏性,找到合适的传递系统是至关重要的。这就是为什么我们要看看外泌体的独特特征及其分离和加载方法,以接受这个想法,即外泌体介导的基于mrna的疗法将在不久的将来被引入作为一种非常有效的疾病治疗策略。gydF4y2Ba
图形抽象gydF4y2Ba
简介gydF4y2Ba
外泌体是具有DNA、编码rna、非编码rna、脂质和蛋白质等特殊成分的细胞外膜性囊泡[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].这些内吞膜衍生的囊泡可以向靶细胞传递各种信号,从而介导新的细胞间通信机制[gydF4y2Ba3.gydF4y2Ba].在分子尺度研究中,外泌体含有磷脂酶和脂类相关蛋白、参与多泡体(MVBs)生物合成的蛋白(TSG101, Alix)、参与膜转运和融合的蛋白(flotillin, GTPases, annexin)、热休克蛋白(即Hsp90, Hsc70)和四胱甘肽(CD82, CD81, CD63, CD9) [gydF4y2Ba5gydF4y2Ba].到目前为止,外泌体已经检测到4500种不同的蛋白质,通常是通过质谱(MS) [gydF4y2Ba6gydF4y2Ba],很可能是细胞间通讯的货物。除上述蛋白质外,膜性囊泡还富含与筏子有关的特殊脂类,如具有饱和脂肪酰基和长链的磷酸甘油酸、鞘脂、神经酰胺和胆固醇(主要是B淋巴细胞来源的外泌体)[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].gydF4y2Ba
以前的报道已经证明外泌体来源于体内的各种液体[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba]和各种细胞系[gydF4y2Ba11gydF4y2Ba]含有RNA分子,特别是mrna和miRNAs,可分别翻译成蛋白质或调节受体细胞中蛋白质的表达,[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].目前的深度测序研究表明,膜性囊泡具有多种RNA货物,包括长度为25-250个核苷酸的全长RNA,如tRNA和miRNA,以及rRNA、mRNA等长RNA片段,尽管mRNA分子以全长类型出现[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].gydF4y2Ba
外泌体在原始组织或细胞中发挥着多方面的作用,以促进病毒等病原体的移动[gydF4y2Ba22gydF4y2Ba]和朊病毒从一个细胞转移到另一个细胞[gydF4y2Ba23gydF4y2Ba],诱导肿瘤发生[gydF4y2Ba24gydF4y2Ba],凝固[gydF4y2Ba25gydF4y2Ba]、炎症[gydF4y2Ba26gydF4y2Ba],血管生成[gydF4y2Ba4gydF4y2Ba],程序性细胞死亡[gydF4y2Ba27gydF4y2Ba]、抗原呈递[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba28gydF4y2Ba],改善免疫反应,并清除碎片分子[gydF4y2Ba29gydF4y2Ba].有趣的是,外泌体已被证明能够实现信号传递和细胞间通信,并传递蛋白质和rna等大分子信息[gydF4y2Ba1gydF4y2Ba].在过去的几十年里,人们对这些膜性囊泡的兴趣大大增加,从体内作用到进一步的用途,如在治疗、生物标志物开发和诊断方面的应用(根据其蛋白质和RNA含量的测定)[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].gydF4y2Ba
由于其在转化研究中的潜在应用,这些囊泡在各种疾病和健康中的作用引起了许多实地研究的关注[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].这些emv,特别是间充质干细胞(MSCs)来源的外泌体在肾脏疾病、伤口愈合、肝脏疾病、神经退行性和自身免疫性疾病、糖尿病、脊髓损伤和其他疾病中发挥着重要作用。此外,与合成纳米颗粒相比,外泌体作为一种新型的基因和药物载体,具有毒性小、能够跨越生物屏障和逃避单核吞噬系统(MPS)等优点,已经引起了广泛的关注[gydF4y2Ba33gydF4y2Ba].因此,用药物或生物分子装载外泌体的高效程序是未来取得突破的先决条件[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].尽管一些研究已经阐明了外泌体的检测、分离和表征及其在药物输送中的应用[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba],外泌体作为生物激发纳米载体在rna治疗中的制备和应用还未被探索。在本研究中,讨论了外泌体的分离和生产及其在RNA分子递送中的临床应用的最新研究进展。我们发现,外泌体具有独特的性质和安全性,可以为研究人员开发高效的mRNA传递系统开辟一条新的途径。因此,建立用于临床应用的大规模rna负载外泌体值得进一步重视。gydF4y2Ba
生物起源gydF4y2Ba
外泌体的生物发生始于早期核内体的生成,通过胞内膜向内出芽,随后是核内体膜的第二次出芽。第二次出芽导致晚期核内体的产生。这些包括腔内囊泡(ILV)在内的内小体被称为多泡体。这些体要么遵循内吞途径产生外泌体,要么与溶酶体融合降解[gydF4y2Ba25gydF4y2Ba].在内胚体膜向内出芽的过程中,蛋白质、miRNA、mRNA和DNA片段通过非常特定的蛋白质复合物合并到形成的囊泡中。最后,通过ILV与质膜的融合,外泌体被释放到细胞外空间[gydF4y2Ba26gydF4y2Ba].gydF4y2Ba
外泌体来源gydF4y2Ba
“外泌体”一词首次出现于20世纪80年代,指由具有外泌酶活性的细胞系释放的囊泡[gydF4y2Ba34gydF4y2Ba].实际上,它指的是网织红细胞分化过程中分泌的囊泡[gydF4y2Ba35gydF4y2Ba],而emv据报道通过树突细胞(dc)和B淋巴细胞通过相似的途径分泌[gydF4y2Ba24gydF4y2Ba].近年来,一些非造血/造血起源的细胞类型,如少突胶质细胞、肠上皮细胞、雪旺细胞、神经元、血小板、细胞毒性T细胞和肥大细胞,已被证明可以释放emv [gydF4y2Ba29gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].此外,在人体的各种液体中也发现了囊泡,如胆汁[gydF4y2Ba37gydF4y2Ba]、脑脊液[gydF4y2Ba28gydF4y2Ba]、羊水[gydF4y2Ba38gydF4y2Ba]、腹水[gydF4y2Ba39gydF4y2Ba]、母乳[gydF4y2Ba40gydF4y2Ba]、尿液[gydF4y2Ba41gydF4y2Ba],精液[gydF4y2Ba42gydF4y2Ba],唾液[gydF4y2Ba43gydF4y2Ba]和血[gydF4y2Ba44gydF4y2Ba].gydF4y2Ba
干细胞来源的外泌体gydF4y2Ba
近年来,利用干细胞修复人体组织的努力在再生医学领域引起了相当大的关注[gydF4y2Ba23gydF4y2Ba].许多像诱导多能干细胞(iPSCs)、胚胎干细胞(ESCs)和间充质干细胞(MSCs)等在细胞增殖和分化方面具有相当潜力的干细胞已被用于修复人体组织[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].研究发现,SCs以旁分泌方式排出许多产物,从而导致其相关影响。这些产物由细胞外囊泡、细胞因子和各种生长因子组成[gydF4y2Ba23gydF4y2Ba].通过SCs释放的emv通常被指出为外泌体、脱落囊泡、微粒、细胞来源的囊泡和微囊泡[gydF4y2Ba46gydF4y2Ba].SCs分泌的外泌体在无细胞再生医学中具有相当大的潜力。例如,吉宾斯等人[gydF4y2Ba47gydF4y2Ba]表明来自SCs的外泌体可以包裹特定的mirna来调节各种细胞过程。这为基于emv的肌肉骨骼疾病治疗方法提供了机会,因为miRNA分子在疾病的预防和进展中具有重要功能。gydF4y2Ba
饮食来源衍生的外泌体gydF4y2Ba
emv及其货物可以从膳食资源中分离出来,如牛奶。这些囊泡和细胞糖蛋白对于肠道摄取是必不可少的。相当一部分源自牛奶的囊泡积聚在脑组织中[gydF4y2Ba47gydF4y2Ba].乳源性emv中未被吸收的部分引起胃肠道微生物种群的改变[gydF4y2Ba47gydF4y2Ba].emv及其货物的饮食排放导致循环rna的损失,并诱导一些特性,如改变免疫反应,生育力丧失,嘌呤代谢物增加,认知功能丧失[gydF4y2Ba23gydF4y2Ba].总的来说,从牛奶中提取的外泌体符合食品中生物活性成分的定义。在一项应用研究中,Reif等[gydF4y2Ba48gydF4y2Ba]提供的证据表明,乳源性外泌体对正常胎儿结肠上皮细胞具有不同的生物学功效,而结肠肿瘤细胞则依赖于mirna。因此,他们认为,外泌体在不影响肿瘤细胞的情况下对正常细胞具有积极的疗效,这是其作为婴儿配方奶粉营养补充剂的一个有前景的安全方面。gydF4y2Ba
植物细胞来源的外泌体gydF4y2Ba
来自非动物生物的外泌体仍然被低估,尽管动物来源的外泌体越来越多地进入感兴趣的研究领域,但我们对它们的理解仍在扩大[gydF4y2Ba23gydF4y2Ba].这是由于缺乏一个切实可行的、简单的可视化、纯化和分离程序。外泌体来自gydF4y2Ba槲寄生专辑gydF4y2BalgydF4y2Ba小长春花gydF4y2BaL。,gydF4y2Ba烟草gydF4y2BaL.,用差速离心加琼脂糖凝胶电泳分离得到。据称电泳与差速离心相结合可以提高外泌体的分离[gydF4y2Ba49gydF4y2Ba].wowith和Melzig成功地从植物的干燥物质中纯化了外泌体。此外,外泌体可以从多余的染料和小的带电杂质中分离出来,因为污染物可以通过凝胶基质,而外泌体则留在孔内而不进入凝胶。[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].gydF4y2Ba
癌细胞来源的外泌体gydF4y2Ba
根据癌细胞相对于正常细胞释放更多ev的事实,发现(1)外泌体的主动分泌具有功能性感官,但尚不清楚它们是抑癌还是促癌[gydF4y2Ba51gydF4y2Ba];(2)外泌体可作为肿瘤诊断的标志物[gydF4y2Ba23gydF4y2Ba].有趣的是,研究发现肿瘤间质和癌细胞之间外泌体交换引起的相互作用可以促进癌micrornas(如miR375、miR16、miR15、miR1和let7)以及癌基因(如LMP-1、Melan-A/Mart-1、HER2、CEA和β-catenin)从一个细胞转移到另一个细胞,导致靶细胞发生新的编程[[gydF4y2Ba4gydF4y2Ba].癌细胞来源的emv在治疗、转移和肿瘤发生中的功能作用和分子组成逐渐被破译[gydF4y2Ba23gydF4y2Ba].Kalluri和LeBleu在癌细胞来源的外泌体方面阐明了潜在的治疗方法和最新成就[gydF4y2Ba4gydF4y2Ba].gydF4y2Ba
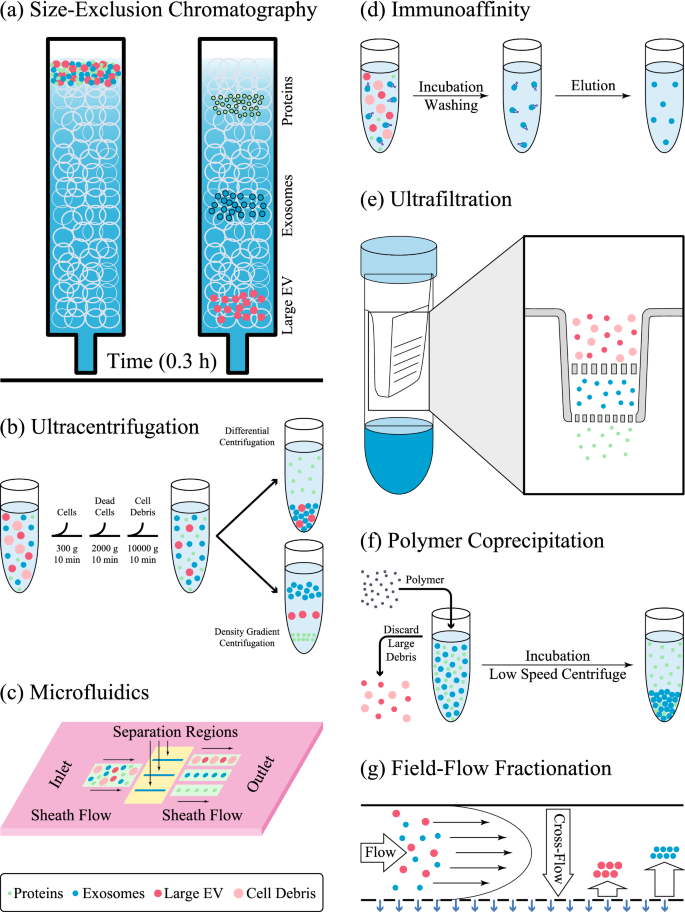
外泌体的分离纯化方法gydF4y2Ba
随着科学技术的飞速发展,许多分离外泌体的方法已经被开发出来。每种方法都施加外泌体的特定特征,如它们的表面蛋白质、大小、形状和密度,以促进它们的分离[gydF4y2Ba22gydF4y2Ba].表中总结了一些隔离程序及其隔离机制以及该方法的缺点和优点gydF4y2Ba1gydF4y2Ba和无花果。gydF4y2Ba1gydF4y2Ba.目前还没有有效的外泌体分离方法,现有的方法要么遇到蛋白质和非外泌体囊泡污染的问题,要么由于需要特殊设备而非常昂贵[gydF4y2Ba52gydF4y2Ba].基于亲缘关系的方法非常纯粹;然而,其高成本和低产量阻碍了其在外泌体纯化中的广泛应用。研究人员认为,两种方法的结合可以提高分离的外泌体的效率和纯度[gydF4y2Ba53gydF4y2Ba].场流分馏方法由于其可扩展性和对外泌体特定亚群的分离而受到特别关注[gydF4y2Ba54gydF4y2Ba].然而,在临床应用中需要进一步改进。gydF4y2Ba
外泌体分离方法示意图。gydF4y2Ba一个gydF4y2Ba尺寸排除色谱法根据尺寸分离颗粒,由于缺乏蛋白质污染和大规模纯化外泌体的能力,是获得大体积外泌体的最常用方法之一。gydF4y2BabgydF4y2Ba超离心分离,尽管依赖于昂贵的设备,已广泛用于分离基于大小和沉淀性质或密度在蔗糖梯度外泌体。gydF4y2BacgydF4y2Ba基于微流体的方法依赖于物理性质,如大小和密度,或化学性质,如与外泌体表面抗原的结合。gydF4y2BadgydF4y2Ba在免疫亲和方法中,基于外泌体与抗体或磁性纳米颗粒的特异性结合来捕获外泌体。因此,表面化学性质在这些技术中至关重要。gydF4y2BaegydF4y2Ba在超滤中,颗粒通过过滤器离心,并根据过滤器的孔径进行分离。gydF4y2BafgydF4y2Ba在聚合物共沉淀法中,基于空间位阻,聚乙二醇将颗粒聚在一起形成团块,通过低速离心容易析出。gydF4y2BaggydF4y2Ba在场流分馏中,颗粒积聚在膜的不同位置取决于它们的大小。当扩散力和横流力平衡时发生分离gydF4y2Ba
大量纯化和制备细胞外囊泡的程序包括外泌体沉淀[gydF4y2Ba55gydF4y2Ba],超滤[gydF4y2Ba56gydF4y2Ba]、蔗糖密度梯度超离心和差速超离心[gydF4y2Ba30.gydF4y2Ba].在一项制备大规模mrna负载外泌体的研究中,使用了两种差分超离心和密度梯度超离心方法来纯化外泌体。观察到,两种方法的mRNA回收率相似。同时,密度梯度过滤法中使用的化学物质可能无法完全去除。此外,当使用差分超离心时,更多的rna集中在外泌体部分。因此,差分超离心被选为纯化外泌体的较好的方法[gydF4y2Ba57gydF4y2Ba].gydF4y2Ba
将RNA装载到外泌体的方法gydF4y2Ba
外泌体是rna的天然细胞间转运体,在体内起着不同的作用。由于其固有的特性,这些emv在基因治疗中可以比经典的核酸传递载体更有效地转染rna [gydF4y2Ba63gydF4y2Ba].尽管有许多好处,但基于外泌体的RNA传递受到限制,因为生成足够数量的RNA负载外泌体用于体内应用在技术上具有挑战性[gydF4y2Ba45gydF4y2Ba,gydF4y2Ba64gydF4y2Ba].首先,只有少数细胞源被观察到可以释放足够数量的外泌体,用于临床转译[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba].其次,为了产生临床剂量的emv,需要将大量细胞培养物孵育多日,然后进行RNA分离和加载,才能最终获得富含基因的囊泡。尽管在胰腺癌临床前模型中,通过电穿孔技术将siRNA和shRNA质粒后插入外泌体在抑制致癌靶点方面表现出比合成纳米载体更强的治疗效果[gydF4y2Ba66gydF4y2Ba],将mrna等大型rna装载到外泌体在技术上仍然具有挑战性[gydF4y2Ba67gydF4y2Ba].在此,我们小组讨论了几种将RNA分子合并到外泌体中用于治疗应用和转录操作的方法。这些方法包括引导特征序列、电穿孔、转染供体细胞、用特定试剂转染、产生混合外泌体-脂质体和细胞纳米孔[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba63gydF4y2Ba,gydF4y2Ba68gydF4y2Ba].在一些加载方法中,如电穿孔、脂质体-外泌体杂交以及用特定试剂转染,首先从适当的来源纯化外泌体,然后将RNA分子加载到其结构中。然而,在其他技术中,如签名序列的引导和转染供体细胞,细胞被用来通过工程外泌体产生细胞来装载核酸。因此,这些细胞分泌的外泌体将包含所需的RNA分子。gydF4y2Ba
签名序列的引导gydF4y2Ba
主动包装核酸作为将核酸装载到emv的方法之一,引起了研究者的关注[gydF4y2Ba63gydF4y2Ba].蛋白质与特殊rna结合的活性包装被用于在工程哺乳动物细胞中产生外泌体[gydF4y2Ba22gydF4y2Ba].通过转染和改造产生外泌体的细胞,研究人员已经能够利用细胞潜能将过氧化氢酶mRNA装载到外泌体中。根据他们的研究结果,外泌体可以将mRNA运送到脑细胞,并显著减弱帕金森病的神经毒性和神经炎症的影响[gydF4y2Ba69gydF4y2Ba].外泌体富集rna (eRNAs)的保守序列也被提出作为执行活性包装的程序。作者提出,外泌体富集的rna可能拥有一个特殊的共同序列,将rna定向到外泌体作为gydF4y2Ba独联体gydF4y2Ba元素。结果表明,只有3个基序是潜在的特征序列。这些发现有助于我们理解候选mRNA对外泌体的选择性靶向,为未来的治疗研究提供参考[gydF4y2Ba63gydF4y2Ba,gydF4y2Ba70gydF4y2Ba].gydF4y2Ba
电穿孔gydF4y2Ba
长期以来,电穿孔被认为是一种高效、快速的将siRNAs和miRNAs加载到细胞外囊泡的方法。Jing-Hung Wang等人证明电穿孔法适用于将siRNA加载到外泌体中。同时,对于mRNA的装载也不充分,因为与未电穿孔的外泌体相比,进入电穿孔外泌体的mRNA较少,这表明mRNA仍未内化。因此,他们使用了一种新的方法,包括用质粒类型转染293FT细胞,将HChrR6 mRNA插入外泌体[gydF4y2Ba71gydF4y2Ba].研究人员将神经元特异性肽RVG与外泌体膜蛋白Lamp2b融合在一起[gydF4y2Ba60gydF4y2Ba]在另一项研究中。sirna被装载到纯化的外泌体中,通过电穿孔技术使这些细胞外囊泡靶向神经元细胞[gydF4y2Ba22gydF4y2Ba].gydF4y2Ba
此外,Alvarez-Erviti等人报道通过电穿孔法制备的装载bace1靶向siRNA的外泌体可以被运送到患者的大脑中治疗阿尔茨海默病[gydF4y2Ba65gydF4y2Ba].总的来说,通过电穿孔转染核酸外泌体是简单的,但其效力和效率都不高。这一过程需要在转染前后对细胞外囊泡进行纯化和分离。高速离心可能破坏外泌体,降低样品质量。研究还发现,重复纯化可导致外泌体的丢失[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba63gydF4y2Ba].事实上,电穿孔仅限于一些rna,而mirna、shrna和mrna不能通过这种方法加载到外泌体[gydF4y2Ba72gydF4y2Ba].gydF4y2Ba
转染供体细胞gydF4y2Ba
在这种方法中,亲代细胞转染siRNAs和miRNAs,随后通过亲代细胞释放到外泌体[gydF4y2Ba63gydF4y2Ba].研究发现,过表达miR126的脂肪SCs分泌外泌体参与了缓解心肌缺血性急性损伤的治疗任务[gydF4y2Ba73gydF4y2Ba].转染miR-214 inhibitor的HEK293T细胞释放的外泌体显示出逆转胃癌顺铂耐药的能力[gydF4y2Ba71gydF4y2Ba].另一项研究发现,转染siRNA的SGC-7901和HEK293T细胞以及释放的装载HGF siRNA的外泌体能够抑制癌症/血管细胞的迁移和生长[gydF4y2Ba62gydF4y2Ba].此外,Sun等人用IRESLuc报告质粒转染HEK293T细胞,并证明每100个外泌体装载约50-70个mRNA拷贝[gydF4y2Ba74gydF4y2Ba].在Vakhshiteh的研究中发现,间充质干细胞过表达后装载mir -34a的外泌体比脂质体更有效地抑制乳腺癌细胞的增殖[gydF4y2Ba75gydF4y2Ba].然而,这种方法受到包装不当、缺乏特异性和细胞毒性的限制[gydF4y2Ba63gydF4y2Ba].gydF4y2Ba
用特定试剂转染gydF4y2Ba
用特异性试剂转染被提出作为外泌体装载核酸的另一种方法。通过超离心技术从HeLa细胞系中获得外泌体。然后将脂质体结合的siRNA AF488与细胞外囊泡孵育25分钟。转染后清洗混合物并超滤。加载sirna的细胞外囊泡与靶细胞一起培养1天。最后,作者提出可以通过使用特定试剂转染将外源siRNA分子引入受体细胞。这种方法的主要缺点是外泌体不能从脂质体中分离出来,而且不清楚转染是脂质体还是外泌体的结果[gydF4y2Ba76gydF4y2Ba,gydF4y2Ba77gydF4y2Ba].gydF4y2Ba
最近,System Biosciences Co.开发了一种用于外泌体传递的商业试剂盒,即Exo-Fect™外泌体转染试剂盒[gydF4y2Ba75gydF4y2Ba].该公司声称,研究人员可以利用Exo-Fect将外泌体变成运载工具,使小分子、dna(包括质粒)和rna插入到分离的外泌体中。他们的试剂盒有几个特点,包括:(1)将各种生物分子直接引入孤立的外泌体:代谢物和其他小分子;包括质粒在内的dna;rna包括mRNAs、miRNAs和siRNAs;(2)易于使用,装载过程简单快捷[gydF4y2Ba75gydF4y2Ba].gydF4y2Ba
生成与脂质体的杂交外泌体gydF4y2Ba
将CRISPR/Cas定向到宿主细胞对体内基因组编辑至关重要。然而,外泌体内包装核酸的性能很低。由于脂质体颗粒是人工制造的,而且药物可以装载在这些结构中,因此它们在当今的制药工业中得到了广泛应用。虽然脂质体颗粒被用作纳米载体,但这些纳米囊泡的主要挑战是它们在细胞进入和药物传递方面的低效率,而外泌体是这方面的专家。然而,外泌体中所载药物和核酸的数量很少。在这方面,研究人员试图通过简单地培养两个纳米颗粒并诱导膜融合来形成一种称为脂质体-外泌体杂化的新结构,以克服单独使用这些纳米载体中的任何一种的困难[gydF4y2Ba78gydF4y2Ba,gydF4y2Ba79gydF4y2Ba,gydF4y2Ba80gydF4y2Ba].Lin等人开发了混合外泌体-脂质体,他们发现这些混合纳米颗粒(NPs)可以有效地将CRISPR-Cas9表达载体包装为大型质粒。作者证实了间充质干细胞可以内吞并表达这些杂交NPs。脂质体不具有单独转染SCs的能力。因此,外泌体-脂质体的混合NPs被证明可以有效地在SCs中递送CRISPR-Cas9系统,提出了该方法在未来mRNA封装中的有效应用[gydF4y2Ba81gydF4y2Ba].gydF4y2Ba
细胞纳米孔:加速外泌体释放gydF4y2Ba
细胞-纳米穿孔方法首次用于大规模生产含有治疗性mRNA分子的外泌体[gydF4y2Ba57gydF4y2Ba].Yang等人用质粒转染不同的细胞,用局灶性/瞬态电动机刺激细胞,诱导含有转录mRNA的emv分泌。这一过程可以产生55倍以上的囊泡,并使外泌体mRNA转录物增加1000倍,即使是从低水平EMVs释放的细胞中,并且没有对源细胞进行基因修饰[gydF4y2Ba57gydF4y2Ba].因此,细胞纳米孔方法使得囊泡作为一种潜在的mRNA载体应用于需要转录操作的用途。gydF4y2Ba
外泌体的治疗应用gydF4y2Ba
具有内在治疗活性的外泌体gydF4y2Ba
外泌体在20世纪80年代首次被发现时,并没有预测到其巨大的治疗和生物医学潜力[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].这些膜性囊泡通过将其内容物(如蛋白质、mrna和miRNAs)传递到靶细胞,参与细胞间的通信,细胞间有或没有直接接触。此外,外泌体影响病理和生理过程。由于这些重要的特性,外泌体可以增强神经系统中的运动和神经功能,允许多次静脉给药而无任何副作用,穿越血脑屏障,减少炎症。这些膜性囊泡在许多病理疾病的诊断和预后中起着至关重要的作用,如许多心肺疾病、肾脏和肝脏疾病、神经退行性疾病和癌症[gydF4y2Ba82gydF4y2Ba].gydF4y2Ba
目前的研究表明,来自不同来源的外泌体是一种新的治疗工具。gydF4y2Ba
MSCs-derived液gydF4y2Ba
mscs来源的外泌体已在糖尿病、肾脏疾病、皮肤疾病、胃肠疾病、肝脏疾病、肌肉骨骼疾病、神经疾病、心血管疾病和呼吸疾病等疾病模型中进行了分析[gydF4y2Ba32gydF4y2Ba].这些囊泡通过改善细胞外基质重塑促进组织再生。它们阻止了促炎细胞因子的产生,从而产生抗炎作用[gydF4y2Ba83gydF4y2Ba].mscs来源的外泌体被发现具有其亲本细胞的细胞保护和免疫调节活性[gydF4y2Ba84gydF4y2Ba].研究表明,从间充质干细胞中获得的外泌体可以通过保护糖尿病动物认知受损的星形胶质细胞和神经元的氧化损伤来增强认知能力[gydF4y2Ba85gydF4y2Ba].mscs来源的外泌体也可以减少心肌再灌注/缺血模型的梗死面积[gydF4y2Ba86gydF4y2Ba,gydF4y2Ba87gydF4y2Ba].GATA-4过表达的mscs来源外泌体减少心肌细胞凋亡并增加心肌细胞存活[gydF4y2Ba88gydF4y2Ba].骨髓间充质干细胞分离的囊泡被发现可以预防不同类型的疾病,如脑损伤、缺氧源性肺动脉高压和缺血损伤[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba86gydF4y2Ba,gydF4y2Ba89gydF4y2Ba].这些mscs来源的外泌体显示出神经修复的影响,例如在II型糖尿病大鼠中增加髓鞘和轴突密度,减少血脑屏障出血和渗漏[gydF4y2Ba90gydF4y2Ba].gydF4y2Ba
与mscs来源的囊泡相似,由心脏祖细胞、ESCs和iPSCs分泌的外泌体具有治疗作用[gydF4y2Ba91gydF4y2Ba].静脉注射链脲佐菌素治疗大鼠尿scs分离外泌体可减少细胞凋亡和尿白蛋白,增加肾小球内皮细胞生长,提示外泌体可作为治疗糖尿病肾病的一种新方法[gydF4y2Ba92gydF4y2Ba].gydF4y2Ba
含牛奶提取液gydF4y2Ba
乳源性外泌体具有一些良好的特性,包括在胃消化过程中保持完整,可通过胃肠道内吞作用进入血液循环,将其蛋白质和miRNA内容物转移到免疫细胞,进而调节免疫反应和生长[gydF4y2Ba93gydF4y2Ba].此外,牛牛奶来源的外泌体可以减轻关节炎[gydF4y2Ba94gydF4y2Ba].乳外泌体也可作为口服给药的载体。Agrawal等报道了口服紫杉醇外泌体比静脉给药的毒性和副作用更小[gydF4y2Ba95gydF4y2Ba].gydF4y2Ba
DC-derived液gydF4y2Ba
皮内/皮下注射dc源性外泌体可稳定客观肿瘤反应或其他疾病[gydF4y2Ba96gydF4y2Ba].含有肿瘤抗原的dc衍生囊泡可诱导癌症特异性T细胞反应[gydF4y2Ba97gydF4y2Ba].来自树突状细胞(DC)的外泌体比DC细胞表现出更显著的抗肿瘤抗体产生能力。由于dc衍生外泌体的膜结构中存在MHC I / II类,研究人员认为,在不久的将来,这些囊泡将被用作一种非常有效的疫苗接种平台[gydF4y2Ba98gydF4y2Ba].gydF4y2Ba
Tumor-derived液gydF4y2Ba
肿瘤细胞源性外泌体通过刺激调节性T细胞和免疫抑制性骨髓源性抑制细胞、抑制DC分化和NK细胞毒性以及诱导T细胞凋亡来诱导免疫抑制[gydF4y2Ba99gydF4y2Ba,gydF4y2BaOne hundred.gydF4y2Ba].而来自应激条件下肿瘤细胞的外泌体,除了含有肿瘤抗原外,还含有更多的热休克蛋白(HSPs),可以诱导抗肿瘤免疫应答。例如,B16BL6小鼠黑色素瘤起源的外泌体与黑色素瘤抗原孵育可以诱导特定的t细胞反应并抑制癌症生长[gydF4y2Ba101gydF4y2Ba].gydF4y2Ba
外泌体作为药物载体gydF4y2Ba
自外泌体被发现以来,由于其独特的特性,如稳定性、肿瘤靶向性和生物相容性,已被潜在地用作各种疾病和癌症的药物载体[gydF4y2Ba102gydF4y2Ba].在体内和体外,使用aferin、阿霉素和紫杉醇加载的外泌体缓慢释放这些药物,抑制肺肿瘤生长gydF4y2Ba,gydF4y2Ba有效(gydF4y2Ba103gydF4y2Ba].此外,当这些药物装载到外泌体中时,它们的IC50值比它们作为游离药物使用时要低。EL-4小鼠淋巴瘤分离外泌体装载姜黄素抑制的促炎细胞因子,如IL-6和TNF-α [gydF4y2Ba104gydF4y2Ba].与全身给药相比,在装载阿霉素的外泌体中获得了较低水平的心脏毒性以及较高浓度的细胞内阿霉素[gydF4y2Ba105gydF4y2Ba].同样,在使用紫杉醇包裹的外泌体时,MDR肺转移也记录了细胞毒性和高肿瘤性[gydF4y2Ba61gydF4y2Ba].gydF4y2Ba
外泌体介导的RNA疗法gydF4y2Ba
rna是大的生物分子,在体内传递有问题。一些输送系统,如阳离子聚合物颗粒[gydF4y2Ba106gydF4y2Ba],树状分子[gydF4y2Ba107gydF4y2Ba]和阳离子脂质体[gydF4y2Ba108gydF4y2Ba,gydF4y2Ba109gydF4y2Ba的提议。然而,由于脱靶问题以及稳定性和安全性不足,这些载体不适合应用于临床实践[gydF4y2Ba110gydF4y2Ba].外泌体作为脂质双分子层封闭的纳米级细胞外囊泡,由于其对受体细胞的天然亲和力以及在细胞之间穿梭DNA和RNA的固有能力,可作为潜在的核酸载体[gydF4y2Ba4gydF4y2Ba].到目前为止,基于外泌体的纳米载体已经被证实可以递送多种rna,包括mRNA、siRNA和mirna,用于治疗不同的疾病和各种癌症[gydF4y2Ba67gydF4y2Ba)(表gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
外泌体作为siRNA传递的载体gydF4y2Ba
siRNA是一种具有多阴离子性质的生物大分子,导致被动摄取不良。此外,由于核酸酶降解的可能性,将裸siRNA注入体循环是不可能的。外泌体已被证明是siRNA包封的理想纳米载体,因为它们的结构由磷脂双分子层包围的中空水核组成,以及它们在血液中的稳定性和固有的靶向特性[gydF4y2Ba111gydF4y2Ba].El-Andaloussi等人提出了一种利用外泌体在体内/体外将siRNA分子传递到小鼠大脑的方法,该方法产生了有希望的输出[gydF4y2Ba112gydF4y2Ba].此外,Alvarez-Erviti等人利用小鼠自身来源的树突状外泌体将BACE1和GAPDH sirna通过小鼠血脑屏障传递。他们观察到,在静脉注射后,装载BACE1和GAPDH基因的外泌体极大地抑制了小鼠大脑中的基因表达和β-淀粉样蛋白的产生[gydF4y2Ba65gydF4y2Ba].Wahlgren等人观察到,人血浆分离的装载siRNA的外泌体成功靶向淋巴细胞和单核细胞,并最终使MAPK1基因沉默。他们还证明了装载siRNA的外泌体共定位于靶细胞的细胞质。此外,富含RAS52和RAD51 sirna的外泌体诱导纤维肉瘤细胞死亡,表明外泌体可作为基于RNAi的基因治疗的载体。需要注意的是,在体外研究中,靶细胞比在体内更容易摄取emv [gydF4y2Ba76gydF4y2Ba,gydF4y2Ba113gydF4y2Ba].最近,研究人员表明,通过装载sirna的mscs来源的外泌体沉默CTGF基因有效地减少了脊髓损伤区域的炎症和神经元凋亡。此外,有研究表明,将miRNA加载到外泌体结构中,可以容易地诱导一些过程,如促进癌细胞凋亡、调节脂质代谢、促进血管生成等[gydF4y2Ba114gydF4y2Ba].gydF4y2Ba
外泌体作为miRNA传递的载体gydF4y2Ba
miRNA是一种低分子量的小分子,除了易于转染到外泌体外,还能在外泌体内保持稳定,因此能够长距离移动而不被血液中的核酸酶降解[gydF4y2Ba115gydF4y2Ba].研究表明,通过将miRNA加载到外泌体结构中,可以很容易地诱导促进癌细胞凋亡、调节脂质代谢和促进血管生成等过程[gydF4y2Ba116gydF4y2Ba].Ohno等人将含有miRNA let-7a的ge11靶向外泌体递送到过表达egf的小鼠乳腺肿瘤中。针对ge11的外泌体显示出比对照组更高的肿瘤抑制能力。此外,转染miRNA的供体细胞来源的外泌体抑制了癌细胞[gydF4y2Ba72gydF4y2Ba].有报道称,miR-122在脂肪间充质干细胞外泌体中过表达可增加小鼠模型的化疗敏感性并抑制肿瘤生长[gydF4y2Ba117gydF4y2Ba].同样,mir146b富集的外泌体能够抑制EGFR并阻止胶质瘤大鼠的肿瘤生长[gydF4y2Ba118gydF4y2Ba].此外,在体外实验中,富含mir -451/144的心脏祖细胞来源外泌体通过增强H9c2细胞中的心肌细胞存活来促进心脏保护gydF4y2Ba,gydF4y2Ba在体内心肌再灌注/缺血模型中[gydF4y2Ba119gydF4y2Ba].gydF4y2Ba
此外,其他形式的RNAi,如miRNA抑制剂和miRNA模拟物可以加载到emv中。Mahati等人显示,来自人脐带血间充质干细胞的(ScFv)修饰外泌体可用于将miR-26a模拟的抗肿瘤作用传递到gpc3阳性的肝细胞癌细胞中,且无副作用。[gydF4y2Ba120gydF4y2Ba].外泌体miRNA传递在靶向多个过程时尤其有用,例如在癌症的情况下[gydF4y2Ba121gydF4y2Ba,gydF4y2Ba122gydF4y2Ba]和阿尔茨海默病(miR29) [gydF4y2Ba123gydF4y2Ba].gydF4y2Ba
外泌体作为信使rna传递的载体gydF4y2Ba
最近报道了外泌体介导的mRNA传递用于COVID-19疫苗接种。Tsai等人验证了外泌体在体内和体外将预期mRNA传递到宿主细胞的应用,并进一步具体地开发了LSNME-SW1疫苗,该疫苗激活了对COVID-19的广泛免疫[gydF4y2Ba124gydF4y2Ba].脂质纳米颗粒(LNP)目前被认为是最安全、最有效的mRNA传递系统之一,该脂质组合物已被用于辉瑞- biontech和Moderna mRNA疫苗。然而,最近的一些研究声称,装载mRNA的外泌体在体外向靶细胞传递mRNA方面比装载mRNA的LNPs更有效[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba124gydF4y2Ba,gydF4y2Ba125gydF4y2Ba].此外,研究发现携带mrna的外泌体可以增加pten缺陷胶质瘤小鼠的存活率,增强肿瘤抑制作用,并恢复肿瘤抑制功能[gydF4y2Ba68gydF4y2Ba].在另一项研究中,研究表明,装载由靶细胞中相应miRNAs翻译激活的工程mRNA的外泌体可以提高疗效,同时减少脱靶摄取[gydF4y2Ba74gydF4y2Ba].上述结果表明,外泌体是基因传递的重要工具,其安全性比基于聚合物的颗粒、阳离子脂质和病毒载体的外泌体要高[gydF4y2Ba126gydF4y2Ba].gydF4y2Ba
外泌体RNA传递的挑战gydF4y2Ba
基于RNA的治疗的主要挑战是血液循环中RNA结构的不稳定性,由于它们被核酸酶快速去除和它们的高免疫原性;[gydF4y2Ba134gydF4y2Ba],为了克服这个问题,各种各样的纳米载体被引入[gydF4y2Ba135gydF4y2Ba].一些运载工具,如聚合物,由于毒性而无法开发,[gydF4y2Ba136gydF4y2Ba],而脂质体等其他药物由于装载效率和穿透细胞的能力较差,在体内的效率不高[gydF4y2Ba137gydF4y2Ba,gydF4y2Ba138gydF4y2Ba].脂质纳米颗粒(LNPs)具有低毒和极高的mRNA向靶细胞传递效率,近年来引起了所有研究人员的兴趣[gydF4y2Ba139gydF4y2Ba,gydF4y2Ba140gydF4y2Ba].另一方面,根据一些证据,外泌体似乎是LNPs的有力竞争者[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba125gydF4y2Ba].由于其良好的生物相容性、低免疫原性和跨越血脑屏障等生物屏障的能力,它们作为RNA传递载体具有许多优势[gydF4y2Ba141gydF4y2Ba,gydF4y2Ba142gydF4y2Ba].尽管有这些好处,但外泌体的大规模生产和纯化,以及RNA装载的标准和有效方法,都是极其困难和重大的问题。gydF4y2Ba
大规模外泌体生产gydF4y2Ba
在临床中使用外泌体的主要挑战之一是缺乏获得批准的大规模细胞培养和生产具有恒定特征和特性的外泌体的方法。细胞培养基中使用的血清中存在外泌体,去除外泌体对细胞增殖的影响,从而影响细胞来源的外泌体的性质和生物学,这在外泌体的大规模生产中造成了严重的问题[gydF4y2Ba143gydF4y2Ba,gydF4y2Ba144gydF4y2Ba].gydF4y2Ba
外来体净化gydF4y2Ba
目前常用的几乎所有外泌体纯化方法要么纯度较低,如基于体积排除聚合物的方法,由于其他非外泌体污染物的共沉淀,要么产量低、成本高,如超离心和基于免疫亲和力的方法。目前还没有基于纯度和可扩展性的完美净化技术。因此,这是使用外泌体作为传递系统的另一个主要问题[gydF4y2Ba143gydF4y2Ba].最近,人们希望利用切向流过滤(TFF)方法进行可重复的大规模外泌体纯化[gydF4y2Ba145gydF4y2Ba].因此,应制定有效的外泌体纯化方法和良好生产规范(GMP)指南[gydF4y2Ba144gydF4y2Ba].gydF4y2Ba
外来体分析gydF4y2Ba
非常精确和可靠的技术是必不可少的表征和检测,以确保输送系统的质量。由于外泌体的尺寸较小(40 ~ 200 nm)以及关于其结构和表面成分的信息不足,外泌体的分析和表征过程面临着重大障碍[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba146gydF4y2Ba].gydF4y2Ba
长RNA装载gydF4y2Ba
外泌体在传递miRNA和siRNA方面非常成功,不像mRNA,由于它们的长度和电荷,mRNA很难被外泌体装载。本研究中提到了一些mRNA的加载方法,但在外泌体中加载mRNA还需要进一步的研究才能获得更令人满意和实用的结果[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba147gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
外泌体是细胞外囊泡的一个亚群,与其他药物纳米载体相比,外泌体作为药物/生物分子载体具有以下几个优点,包括装载不同货物和跨越不可渗透的生物屏障的能力,通过内吞作用或膜融合促进货物的细胞内化,半衰期和循环时间长,免疫原性低,体积小[gydF4y2Ba4gydF4y2Ba].这些生物激发的纳米载体可以运送许多货物,如蛋白质、小分子和核酸,如DNA、siRNA、miRNA和mRNA [gydF4y2Ba22gydF4y2Ba].mRNA在疾病治疗和疫苗生产中发挥着至关重要的作用,而外泌体由于其独特的性质,可以为研究人员开发安全高效的mRNA传递系统开辟新的途径[gydF4y2Ba148gydF4y2Ba].尽管大量证据表明脂质纳米颗粒(LNPs)对mRNA的转移是高效的,但一些研究表明,外泌体比LNPs更稳定,免疫原性更低[gydF4y2Ba52gydF4y2Ba].最近的体外研究表明,通过外泌体转移基于CRISPR/ cas9的RNA报告系统比LNP更令人满意[gydF4y2Ba125gydF4y2Ba].然而,由于在临床中使用外泌体的各种挑战,这种极其稳定和高效的纳米载体尚未用于治疗[gydF4y2Ba144gydF4y2Ba].其中一个主要问题是缺乏一种标准和可靠的外泌体纯化方法[gydF4y2Ba149gydF4y2Ba].虽然已经采取了几种策略将短核酸如siRNA、shRNA和DNA加载到外泌体中[gydF4y2Ba66gydF4y2Ba,gydF4y2Ba68gydF4y2Ba,gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba,gydF4y2Ba74gydF4y2Ba],将大型mrna高效封装到外泌体仍然是一个挑战。因此,建立用于临床应用的大规模rna负载外泌体值得进一步重视。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
不适用。gydF4y2Ba
缩写gydF4y2Ba
- AAT:gydF4y2Ba
-
Alpha-1-antitrypsingydF4y2Ba
- AATD:gydF4y2Ba
-
α -1抗胰蛋白酶缺乏gydF4y2Ba
- CD:gydF4y2Ba
-
胞嘧啶脱氨酶gydF4y2Ba
- 阿霉素:gydF4y2Ba
-
阿霉素gydF4y2Ba
- 促红细胞生成素:gydF4y2Ba
-
编码促红细胞生成素gydF4y2Ba
- ExoPAC:gydF4y2Ba
-
口服紫杉醇的外泌体gydF4y2Ba
- 电动汽车:gydF4y2Ba
-
细胞外囊泡gydF4y2Ba
- 5-FC:gydF4y2Ba
-
5-FluorocytosinegydF4y2Ba
- 2 fdu:gydF4y2Ba
-
2ʹFluoro-deoxyuridinegydF4y2Ba
- 研究者用:gydF4y2Ba
-
5 -氟尿嘧啶gydF4y2Ba
- HepG2:gydF4y2Ba
-
人肝细胞系gydF4y2Ba
- 5 hmc:gydF4y2Ba
-
5-HydroxymethylcytidinegydF4y2Ba
- 诊断:gydF4y2Ba
-
在体外转录的mRNA中gydF4y2Ba
- imDCs:gydF4y2Ba
-
未成熟的树突细胞gydF4y2Ba
- LGP2:gydF4y2Ba
-
遗传生理实验室2gydF4y2Ba
- 多功能车辆总线:gydF4y2Ba
-
Multi-vesicular身体gydF4y2Ba
- MDA5:gydF4y2Ba
-
黑色素瘤分化相关蛋白5gydF4y2Ba
- 5商务部:gydF4y2Ba
-
5-MethoxycytidinegydF4y2Ba
- 商务:gydF4y2Ba
-
平均血小板体积gydF4y2Ba
- 信使rna:gydF4y2Ba
-
信使rnagydF4y2Ba
- msc:gydF4y2Ba
-
间充质干细胞gydF4y2Ba
- MVs:gydF4y2Ba
-
微泡gydF4y2Ba
- PLT:gydF4y2Ba
-
血小板计数gydF4y2Ba
- PRRs:gydF4y2Ba
-
模式识别受体gydF4y2Ba
- 红细胞表面:gydF4y2Ba
-
红细胞gydF4y2Ba
- RBCEVs:gydF4y2Ba
-
红细胞胞外囊泡gydF4y2Ba
- RIG-1:gydF4y2Ba
-
维甲酸诱导蛋白1gydF4y2Ba
- RLRs:gydF4y2Ba
-
RIG-I-like受体gydF4y2Ba
- TFs:gydF4y2Ba
-
转录因子gydF4y2Ba
- TLR:gydF4y2Ba
-
toll样受体gydF4y2Ba
- UPRT:gydF4y2Ba
-
尿嘧啶phosphoribosyltransferasegydF4y2Ba
- UTR:gydF4y2Ba
-
翻译区gydF4y2Ba
- VEGF-A:gydF4y2Ba
-
血管内皮生长因子- agydF4y2Ba
参考文献gydF4y2Ba
Vlassov AV, Magdaleno S, Setterquist R, Conrad R.外泌体:目前对其组成、生物学功能以及诊断和治疗潜力的认识。生物化学与生物物理学报。2012;1820(7):940-8。gydF4y2Ba
Schorey JS, Harding CV。细胞外囊泡和传染病:旧故事的新复杂性。中华临床医学杂志,2016;26(4):1181-9。gydF4y2Ba
佩格特尔DM,古尔德SJ。液。生物化学。2019;88(1):487-514。gydF4y2Ba
Kalluri R, LeBleu VS.外泌体的生物学、功能和生物医学应用。科学。2020;367:6478。gydF4y2Ba
Subra C, Grand D, Laulagnier K, Stella A, Lambeau G, Paillasse M,等。外泌体负责囊泡介导的可激活磷脂酶和前列腺素的跨细胞转运。中国生物医学工程学报,2010;29(4):339 - 339。gydF4y2Ba
Mathivanan S, Simpson RJ。ExoCarta:外泌体蛋白质和RNA的概要。蛋白质组学,2009;9(21):4997 - 5000。gydF4y2Ba
Subra C, Laulagnier K, Perret B, Record M.外泌体脂质组学在多泡体水平上揭示脂质分选。Biochimie。2007;89(2):205 - 12所示。gydF4y2Ba
张勇,刘勇,刘宏,唐文辉。外泌体:生物起源、生物学功能和临床潜力。细胞生物学,2019;9(1):1 - 18。gydF4y2Ba
张志刚,张志刚,张志刚,张志刚,等。来自人类唾液的外泌体作为microRNA生物标志物的来源。口腔科学2010;16(1):34-8。gydF4y2Ba
Rabinowits G, Gerçel-Taylor C, Day JM, Taylor DD, Kloecker GH。外泌体microRNA:肺癌的诊断标志物。临床肺癌。2009;10(1):42-6。gydF4y2Ba
Skog J, Würdinger T, Van Rijn S, Meijer DH, Gainche L, Curry WT,等。胶质母细胞瘤微泡运输促进肿瘤生长的RNA和蛋白质,并提供诊断生物标志物。细胞生物学杂志,2008;10(12):1470-6。gydF4y2Ba
Ratajczak J, Wysoczynski M, Hayek F, Janowska-Wieczorek A, Ratajczak M.膜源性微囊泡:细胞间通信的重要和被低估的介质。白血病。2006;20(9):1487 - 95。gydF4y2Ba
Valadi H, Ekström K, Bossios A, Sjöstrand M, Lee JJ, Lötvall JO。外泌体介导的mrna和microRNAs转移是一种新的细胞间遗传交换机制。中国生物医学工程学报。2007;9(6):654-9。gydF4y2Ba
NoltetHoen EN, Buermans HP, Waasdorp M, Stoorvogel W, Wauben MH, Hoen PA。来自免疫细胞来源的囊泡的RNA深度测序揭示了具有潜在调节功能的小非编码RNA生物型的选择性合并。中国生物医学工程学报,2012;40(18):9272-85。gydF4y2Ba
Aslan C, Kiaie SH, Zolbanin NM, Lotfinejad P, Ramezani R, Kashanchi F, Jafari R.用于mRNA传递的外泌体:一种具有障碍和希望的新型生物治疗策略。生物工程学报。2021;21(1):1 - 2。gydF4y2Ba
Bellingham SA, Coleman BM, Hill AF.小RNA深度测序揭示了朊病毒感染神经元细胞外泌体释放的独特miRNA特征。中国生物医学工程学报,2012;40(21):10937-49。gydF4y2Ba
李丽娟,李志强,张志强,等。外泌体的提取和RNA谱分析方法。世界医学杂志。2013;3(1):11。gydF4y2Ba
张敏,臧霞,王敏,李忠,乔敏,胡辉,等。基于外泌体的纳米载体作为生物激发和多功能药物传递载体:最新进展和挑战。中国化学工程学报。2019;7(15):2421-33。gydF4y2Ba
谢吉曼,谢泽杰,李敏,张志强,等。完整的外泌体工作流程解决方案:从分离到RNA货物的表征。BioMed Res Int. 2013;2013:89。gydF4y2Ba
Sabzehzari, Naghavi M.植物mirna:一种对植物生物技术有益的分子。基因。2019;683:28-34。gydF4y2Ba
杨晓明,张晓明,张晓明,等。药用植物代谢产物的生物合成调控。基因。2019;682:13-24。gydF4y2Ba
masouri L, Yousefi H, Aref AR, MohammadAhadi A, Molaei F, Alahari SK.外泌体:肿瘤转移和耐药的组成、生物发生和机制。中华肿瘤杂志2019;18(1):75。gydF4y2Ba
王伟,尹涛,王宁,杜康,王勇,等。外泌体作为药物传递系统的最新进展。纳米生物技术,2018;16(1):1 - 13。gydF4y2Ba
李志强,李志强,李志强,等。使用新型无细胞疫苗:树突状细胞衍生外泌体根除已建立的小鼠肿瘤。中华外科杂志,1998;4(5):594-600。gydF4y2Ba
细胞外囊泡和外泌体:生物学和病理生物学。肝;2020.1022 - 7页。gydF4y2Ba
Khatun Z, Bhat A, Sharma S, Sharma A.阐明外泌体多样性:生物物理和分子表征方法。纳米医学。2016;11(17):2359 - 77。gydF4y2Ba
安达卢西SE, Mäger I,布雷克菲尔德XO,伍德MJ。细胞外囊泡:生物学和新兴治疗机会。中国医药科学。2013;12(5):347-57。gydF4y2Ba
Vella L, Sharples R, Lawson V, Masters C, Cappai R, Hill a .朊病毒包装外泌体与PrP加工的新途径有关。中华病理学杂志,2007;21(5):582-90。gydF4y2Ba
Théry C, Ostrowski M, Segura E.膜囊泡作为免疫反应的载体。中华免疫杂志2009;9(8):581-93。gydF4y2Ba
Théry C, Amigorena S, Raposo G, Clayton A.细胞培养上清液和生物液中外泌体的分离和表征。细胞生物学杂志,2006;30(1):322。gydF4y2Ba
Doeppner TR, Herz J, Görgens A, Schlechter J, Ludwig A- k, Radtke S,等。细胞外囊泡改善脑卒中后神经再生,预防脑卒中后免疫抑制。中国生物医学工程杂志,2015;4(10):1131-43。gydF4y2Ba
Willis GR, Kourembanas S, Mitsialis SA。面向基于外泌体的治疗:隔离、异质性和适合目的的效力。前沿心血管医学,2017;4:63。gydF4y2Ba
安达卢西,拉卡尔,Mäger I,伍德MJ。外泌体用于跨越生物屏障的靶向siRNA传递。中国医药杂志,2013;26(3):391-7。gydF4y2Ba
张志刚,张志刚,张志刚。膜外酶在微囊泡形态下的脱落。生物化学与生物物理学报。1981;645(1):63-70。gydF4y2Ba
潘炳涛,滕坤,吴超,Adam M, Johnstone RM。绵羊网织细胞中转铁蛋白受体外化的电子显微镜证据。中国生物医学工程学报,2005;29(3):344 - 344。gydF4y2Ba
李志强,李志强。外泌体囊泡载体在细胞间通讯中的应用。中国生物医学工程学报。2009;21(4):575-81。gydF4y2Ba
Masyuk AI, Huang BQ, Ward CJ, Gradilone SA, Banales JM, Masyuk TV,等。胆道外泌体通过与初生纤毛的相互作用影响胆管细胞的调节机制和增殖。中华胃肠病杂志,2010;29(4):489 - 497。gydF4y2Ba
张志刚,张志刚,张志刚,张志刚,等。妊娠中期羊水中含有热休克蛋白的外泌体。中华重免疫杂志,2008;39(1):12-7。gydF4y2Ba
范文杰,王志强,王志强,等。恶性积液和免疫原性肿瘤来源的外泌体。柳叶刀》。2002;360(9329):295 - 305。gydF4y2Ba
Admyre C, Johansson SM, Qazi KR, Filén J-J, Lahesmaa R, Norman M,等。具有免疫调节功能的外泌体存在于人类母乳中。中华免疫杂志2007;179(3):1969-78。gydF4y2Ba
皮斯坤,沈瑞芳,马。人类尿液中外泌体的鉴定和蛋白质组学分析。自然科学进展,2004;29(3):349 - 349。gydF4y2Ba
Aalberts M, van Dissel-Emiliani FM, van Adrichem NP, van Wijnen M, Wauben MH, Stout TA,等。鉴定不同人群的前列腺小体,差异表达前列腺干细胞抗原,膜联蛋白A1,和GLIPR2在人。中国生物医学工程学报。2012;86(3):82。gydF4y2Ba
小川Y,三浦Y,原野A, Kanai-Azuma M, Akimoto Y, Kawakami H,等。人全唾液中两种外泌体的蛋白质组学分析。生物医药通报,2011;34(1):13-23。gydF4y2Ba
Caby M-P, Lankar D, Vincendeau-Scherrer C, Raposo G, Bonnerot C.外泌体样囊泡存在于人血浆中。国际免疫杂志2005;17(7):879-87。gydF4y2Ba
杨荣文,赖荣荣,张波,谭世峰,尹勇,德巴杰,等。间充质干细胞:用于药物传递的外泌体的高效大规模生产者。中国医药杂志,2013;26(3):336-41。gydF4y2Ba
Burke J, Kolhe R, Hunter M, Isales C, Hamrick M, Fulzele S.干细胞来源的外泌体:一种潜在的骨科替代治疗药物。干细胞杂志,2016;2016:89。gydF4y2Ba
周峰,吴东,周锋。乳源性外泌体及其代谢调控。生物科学。2019;7:245-62。gydF4y2Ba
Reif S, Shiff YE, Golan-Gerstl R.乳源性外泌体(MDEs)在mirna依赖的方式下对正常胎儿结肠上皮细胞与结肠肿瘤细胞具有不同的生物学作用。中华医学杂志2019;17(1):1 - 10。gydF4y2Ba
沃斯E,梅尔齐格MF。来自新鲜和干燥植物的胞外囊泡-使用凝胶电泳同时纯化和可视化。国际分子生物学杂志,2019;20(2):357。gydF4y2Ba
Patel GK, Khan MA, Zubair H, Srivastava SK, Singh S, Singh AP.使用培养上清对最佳产量、纯度和下游应用的外泌体分离方法的比较分析。科学通报2019;9(1):1 - 10。gydF4y2Ba
李丽娟,李丽娟。肿瘤细胞来源的外泌体:瓶中的信息。生物化学学报,2012;1826(1):103-11。gydF4y2Ba
Lundberg S, Karlsson E, Dahlberg H, Glansk M, Larsson S, Larsson S,等。外泌体和脂质纳米颗粒-靶向药物递送的未来[学生论文];2020.gydF4y2Ba
斯塔姆J,巴特尔S,比肖夫R,沃尔特斯JC。联合富集方法分离胞外囊泡。J色谱仪B. 2021;1169:122604。gydF4y2Ba
Sitar S, kejjar A, Pahovnik D, Kogej K,图谢克-Žnidarič M, Lenassi M,等。非对称流场流分馏外泌体的尺寸表征和定量。中国化学杂志,2015;37(4):344 - 344。gydF4y2Ba
牛铮,庞铁磊,刘伟,李强,程荣,杨伟。基于聚合物的沉淀保存了子宫内膜细胞系细胞外囊泡的生物活性。PLoS ONE。2017; 12 (10): e0186534。gydF4y2Ba
序列过滤:一种分离功能性细胞外囊泡的温和方法。胞外囊泡:施普林格;2017.33-41页。gydF4y2Ba
杨震,史军,谢军,王勇,孙军,刘涛,等。通过细胞纳米孔大规模生成功能mrna包封外泌体。中国生物医学工程学报,2020;4(1):69-83。gydF4y2Ba
Lozano-Ramos I, Bancu I, Oliveira-Tercero A,亚美尼亚议员,Menezes-Neto A, Portillo HAD等。尿液样本中基于尺寸排除色谱的细胞外囊泡富集。中国生物医学工程学报。2015;4(1):27369。gydF4y2Ba
刘C,郭J,田F,杨N,燕F,丁Y, et al。用微流体粘弹性流从细胞外囊泡中无场分离外泌体。中国生物医学工程学报,2017;11(7):6968-76。gydF4y2Ba
刘策,金G,金敏,朴D,姜海杰,李敏,等。免疫亲和珠直接提取外泌体中microrna的方法。中国生物化学杂志,2012;gydF4y2Ba
金女士,Haney MJ,赵杨,Mahajan V, Deygen I, Klyachko NL,等。外泌体包膜紫杉醇克服癌细胞耐多药的研究进展。纳米医学。2016;12(3):655 - 64。gydF4y2Ba
张慧,王勇,白敏,王杰,朱凯,刘荣,等。外泌体作为纳米粒子通过递送肝细胞生长因子sirna抑制胃癌肿瘤生长和血管生成。中国癌症杂志,2018;39(3):629-41。gydF4y2Ba
刘超,苏超。治疗性外泌体的设计策略及应用进展。开展。2019;9(4):1015 - 28。gydF4y2Ba
Stewart MP, Sharei A, Ding X, Sahay G, Langer R, Jensen KF。细胞内给药的体外和体外策略。自然。2016;538(7624):183 - 92。gydF4y2Ba
李志强,李志强,李志强,李志强。通过系统注射靶向外泌体将siRNA传递到小鼠大脑。中国生物工程学报。2011;29(4):341-5。gydF4y2Ba
Kamerkar S, LeBleu VS, Sugimoto H, Yang S, Ruivo CF, Melo SA,等。外泌体促进胰腺癌中致癌KRAS的靶向治疗。自然。2017;546(7659):498 - 503。gydF4y2Ba
邬文敏,范忠忠,郭云云,吴少林,马伟,彭波,等。利用红细胞胞外囊泡有效的RNA药物传递。地理学报。2018;9(1):1 - 15。gydF4y2Ba
杨涛,范涛,赖林,等。利用天然脑内皮细胞分泌的外泌体纳米泡在斑马鱼体内递送小干扰RNA抑制血管内皮生长因子治疗脑癌。中国生物医学工程学报,2017;19(2):475-86。gydF4y2Ba
Kojima R, Bojar D, Rizzi G, Charpin-El Hamri G, El-Baba MD, Saxena P,等。由脑内植入细胞产生的设计外泌体为帕金森病的治疗提供治疗货物。地理学报。2018;9(1):1 - 10。gydF4y2Ba
Batagov AO, Kuznetsov VA, Kurochkin IV.分泌rna中富集的核苷酸模式的鉴定,作为假设的顺式作用元件,靶向外泌体纳米囊泡。纽约:施普林格;2011.gydF4y2Ba
王金华,Forterre AV,赵j, Frimannsson DO, Delcayre A, Antes TJ,等。抗her2 scfv定向的细胞外囊泡介导的基于mrna的基因传递通过前药激活抑制her2阳性人乳腺肿瘤异种移植的生长。中华肿瘤杂志,2018;17(5):1133-42。gydF4y2Ba
大野S- i, Takanashi M, Sudo K,上田S,石川A,松山N,等。系统注射靶向EGFR的外泌体向乳腺癌细胞传递抗肿瘤microRNA。生物化学学报,2013;21(1):185-91。gydF4y2Ba
罗强,郭东,刘刚,陈刚,杭敏,金敏。mir -126过表达adscs外泌体在缓解急性心肌缺血损伤中的作用。中国生物医学工程学报。2017;44(6):2105-16。gydF4y2Ba
孙伟,邢晨,赵玲,赵萍,杨刚,袁磊。超声辅助外泌体传递组织响应mRNA增强疗效和最小化脱靶效应。《Mol Ther Nucleic Acids》2020;20:558-67。gydF4y2Ba
Vakhshiteh F, Rahmani S, Ostad SN, Madjd Z, Dinarvand R, Atyabi F.来自mir -34a过表达间充质干细胞的外泌体抑制体外肿瘤生长:一种药物输送的新方法。生命科学,2021;26:118871。gydF4y2Ba
Shtam TA, Kovalev RA, Varfolomeeva EY, Makarov EM, Kil YV, Filatov MV。外泌体是外源性siRNA到体外人类细胞的天然载体。通信学报。2013;11(1):1 - 10。gydF4y2Ba
李世平,林志祥,姜晓宇,于晓宇。外泌体负载和合成外泌体模拟物作为潜在的治疗工具。药物学报,2018;39(4):542-51。gydF4y2Ba
佐藤YT,梅崎K,泽田S,向井S- a,佐佐木Y,原田N,等。用膜融合脂质体工程杂交外泌体。科学通报2016;6(1):21933。gydF4y2Ba
李永杰,吴建勇,刘娟,徐伟,邱霞,黄松,等。用于转化纳米医学的人工外泌体。中国生物医学工程学报。2021;19(1):242。gydF4y2Ba
Evers MJW, van de Wakker SI, de Groot EM, de Jong OG, Gitz-François JJJ, Seinen CS,等。胞外囊泡-脂质体混合纳米颗粒的功能性siRNA传递。Adv Healthcare Mater. 2021; 11:10 101202。gydF4y2Ba
林勇,吴娟,顾伟,黄勇,童志,黄磊,等。外泌体-脂质体混合纳米颗粒在msc中递送CRISPR/Cas9系统。中国生物医学工程学报,2018;5(4):1700611。gydF4y2Ba
Beuzelin D, Kaeffer B.外泌体和mirna负载的仿生纳米载体,重点关注其预防与代谢综合征相关的2型糖尿病的潜力。前沿免疫。2018;9:2711。gydF4y2Ba
娄刚,陈震,郑明,刘颖。间充质干细胞来源的外泌体作为肝病治疗的新策略。中国生物医学杂志,2017;49(6):e346。gydF4y2Ba
Baglìo SR, Devescovi V, Granchi D, Baldini N.成骨分化期间人骨髓间充质干细胞的MicroRNA表达谱揭示了miR-31对Osterix的调控。基因。2013;527(1):321 - 31所示。gydF4y2Ba
中野M,长石K, Konari N,齐藤Y,千健治T,水雪Y,等。骨髓来源的间充质干细胞通过外泌体转移到受损的神经元和星形胶质细胞来改善糖尿病诱导的认知障碍。科学通报2016;6(1):1 - 14。gydF4y2Ba
赖崇荣,李敏敏,施宁斯克,周安,陈涛,等。MSC分泌的外泌体减轻心肌缺血/再灌注损伤。中国生物医学工程学报,2010;4(3):214-22。gydF4y2Ba
张志刚,张志刚,张志刚,张志刚,等。间充质干细胞来源的外泌体增加ATP水平,降低氧化应激,激活PI3K/Akt通路,增强心肌活力,防止心肌缺血/再灌注损伤后的不良重塑。中国生物医学工程学报,2013;10(3):301-12。gydF4y2Ba
于波,金华伟,龚敏,王杰,Millard RW,王勇,等。GATA-4过表达间充质干细胞分泌的外泌体可作为抗凋亡microRNAs的储存库,用于心脏保护。国际心脏病杂志2015;182:349-60。gydF4y2Ba
李C, Mitsialis SA, Aslam M, Vitali SH, Vergadi E, Konstantinou G,等。外泌体介导间充质间质细胞对缺氧诱导的肺动脉高压的细胞保护作用。循环。2012;126(22):2601 - 11所示。gydF4y2Ba
张磊,李强,张晓明,李志强,等。血管性痴呆大鼠模型中的白质损伤和类淋巴功能障碍。神经生物学杂志。2017;50:96-106。gydF4y2Ba
Vrijsen KR, Maring JA, Chamuleau SA, Verhage V, Mol EA, Deddens JC,等。来自心肌细胞祖细胞和间充质干细胞的外泌体通过EMMPRIN刺激血管生成。Adv Healthcare Mater. 2016;5(19): 2555-65。gydF4y2Ba
蒋志忠,刘永明,牛鑫,殷建勇,胡波,郭树才,等。人类尿液来源的干细胞分泌的外泌体可以预防大鼠I型糖尿病的肾脏并发症。干细胞研究。2016;7(1):1 - 13。gydF4y2Ba
Samuel M, Chisanga D, Liem M, Keerthikumar S, Anand S, Ang c S,等。来自初乳的牛奶源外泌体富含与免疫反应和生长有关的蛋白质。科学通报2017;7(1):5933。gydF4y2Ba
Arntz OJ, Pieters BC, Oliveira MC, Broeren MG, Bennink MB, de Vries M,等。口服牛乳衍生的细胞外囊泡可减轻两种小鼠模型的关节炎。中国生物医学工程学报,2015;29(3):344 - 344。gydF4y2Ba
阿格拉瓦尔,阿齐尔,杰亚巴兰,斯宾塞,贝克,BW,等。用于口服紫杉醇的牛奶源外泌体。纳米医学。2017;13(5):1627 - 36。gydF4y2Ba
杨晓东,杨晓东,张晓明,等。来自树突状细胞的临床级外泌体的生产和表征。中华免疫杂志,2002;27(2):319 - 319。gydF4y2Ba
André F, Chaput N, Schartz NE, Flament C, Aubert N, Bernard J,等。外泌体作为有效的无细胞肽基疫苗。I.树突状细胞来源的外泌体将功能性MHC类I/肽复合物转移到树突状细胞。中华免疫杂志,2004;29(4):339 - 339。gydF4y2Ba
姚艳,付超,周玲,米Q-S,姜爱林。肿瘤免疫治疗的外泌体研究进展。2012.13(15):366 - 366。gydF4y2Ba
Gutiérrez-Vázquez C, Villarroya-Beltri C, Mittelbrunn M, Sánchez-Madrid F.细胞外囊泡在免疫细胞-细胞相互作用中的转移。中国生物医学工程杂志,2013;gydF4y2Ba
Kiaie SH, Sanaei MJ, Heshmati M, Asadzadeh Z, Azimi I, Hadidi S, Jafari R, Baradaran B.胰腺癌靶向免疫治疗中的免疫检查点:临床发展的新希望。药物学报,2021;11(5):1083-97。gydF4y2Ba
Morishita M, Takahashi Y, Matsumoto A, Nishikawa M, Takakura Y.利用具有免疫刺激CpG DNA的基因工程肿瘤细胞来源的外泌体共递送基于外泌体的肿瘤抗原-佐剂。生物材料。2016;111:55 - 65。gydF4y2Ba
Patil SM, Sawant SS, Kunda NK。外泌体作为药物传递系统:简要概述和进展更新。欧洲制药生物制品。2020;154:259-69。gydF4y2Ba
穆纳加拉,阿齐尔,杰亚巴兰,古普塔。用于药物传递的牛乳源外泌体。中华癌症杂志,2016;36(1):348 - 61。gydF4y2Ba
孙东,庄旭,向旭,刘勇,张松,刘超,等。一种新型的纳米颗粒给药系统:姜黄素的抗炎活性被包裹在外泌体中时增强。分子化学,2010;18(9):1606-14。gydF4y2Ba
Hadla M, Palazzolo S, Corona G, Caligiuri I, Canzonieri V, Toffoli G,等。外泌体在乳腺癌和卵巢癌小鼠模型中增加阿霉素的治疗指数。纳米医学。2016;11(18):2431 - 41。gydF4y2Ba
张超,陆俊杰,葛强,张超,陈杰,Klibanov AM。聚乙烯亚胺的完全去酰基化显著提高其基因传递效率和特异性到小鼠肺。中国科学:自然科学,2005;26(2):339 - 344。gydF4y2Ba
张敏,张敏,张晓明,张晓明,张晓明,张晓明。siRNA递送的内阳离子聚氨基胺PAMAM-OH树状大分子:四元化程度和癌症靶向的影响。Biomacromol。2009;10(2):258 - 66。gydF4y2Ba
矢野J,平林K,中川S-I,山口T,野川M, Kashimori I,等。小干扰RNA/阳离子脂质体复合物在小鼠癌症模型中的抗肿瘤活性。临床癌症杂志2004;10(22):7721-6。gydF4y2Ba
Sioud M, Sørensen DR.阳离子脂质体介导sirna在成年小鼠中的传递。生物化学与生物物理学报,2003;32(4):344 - 344。gydF4y2Ba
Kesharwani P, Gajbhiye V, Jain NK。用于递送小干扰RNA的纳米载体综述。生物材料。2012;33(29):7138 - 50。gydF4y2Ba
徐林,王志强,王志强。siRNA传递到癌细胞的外泌体的制备。中国机械工程学报,2018;gydF4y2Ba
El-Andaloussi年代,李Y, Lakhal-Littleton年代,李J ?萧和Y,嘉丁纳C, et al。外泌体介导的siRNA在体外和体内的传递。Nat protocol . 2012;7(12):2112。gydF4y2Ba
Wahlgren J, Karlson TDL, Brisslert M, Vaziri Sani F, Telemo E, Sunnerhagen P,等。血浆外泌体可将外源性短干扰RNA传递给单核细胞和淋巴细胞。中国生物工程学报,2012;40(17):e130。gydF4y2Ba
黄伟,曲敏,李玲,刘涛,林敏,余霞。msc外泌体中SiRNA沉默CTGF基因对脊髓损伤大鼠运动恢复的影响。中国生物医学工程学报,2017;12(1):334。gydF4y2Ba
Munir J, Yoon JK, Ryu S.治疗性mirna富集细胞外囊泡:目前的方法和未来展望。细胞。2020;9(10):2271。gydF4y2Ba
方志,张旭,黄红,吴娟。基于外泌体的miRNA传递策略在疾病治疗中的应用。中国化学杂志,2021。gydF4y2Bahttps://doi.org/10.1016/j.cclet.2021.11.050gydF4y2Ba.gydF4y2Ba
娄刚,宋旭,杨峰,吴松,王杰,陈忠,等。来自mir -122修饰的脂肪组织来源的间充质干细胞的外泌体增加了肝细胞癌的化学敏感性。中华血液病杂志,2015;8(1):1 - 11。gydF4y2Ba
Katakowski M, Buller B, Zheng X, Lu Y, Rogers T, Osobamiro O,等。表达miR-146b的骨髓基质细胞外泌体抑制胶质瘤生长。中华癌症杂志,2013;35(1):201-4。gydF4y2Ba
陈玲,王勇,潘勇,张玲,沈超,秦刚,等。心脏祖细胞来源的外泌体保护缺血心肌免受急性缺血/再灌注损伤。中国生物工程学报。2013;26(3):366 - 366。gydF4y2Ba
Mahati S, Fu X, Ma X,张红,肖玲。外泌体纳米系统转染miR-26a抑制肝细胞癌的增殖。癌症。2021;8:847。gydF4y2Ba
Godlewski J, Nowicki MO, Bronisz A, Williams S, Otsuki A, Nuovo G,等。microRNA-128靶向Bmi-1癌基因/干细胞更新因子抑制胶质瘤增殖和自我更新。罐头决议2008;68(22):9125-30。gydF4y2Ba
Kefas B, Godlewski J, Comeau L, Li Y, Abounader R, Hawkinson M,等。microRNA-7抑制表皮生长因子受体和Akt通路,并在胶质母细胞瘤中下调。罐头决议2008;68(10):3566-72。gydF4y2Ba
Bettens K, Brouwers N, Engelborghs S, Van Miegroet H, De Deyn PP, Theuns J,等。APP和BACE1 miRNA遗传变异在阿尔茨海默病风险中没有主要作用。胡木,2009;30(8):1207-13。gydF4y2Ba
蔡世杰,郭超,阿泰娜,高世杰。外泌体介导的mRNA传递用于SARS-CoV-2疫苗接种。bioRxiv。2020.gydF4y2Ba
Murphy DE, DE Jong OG, Evers MJW, Nurazizah M, Schiffelers RM, Vader P.天然或合成RNA递送:细胞外囊泡和合成纳米颗粒的化学计量学比较。纳米工程学报。2021;21(4):1888-95。gydF4y2Ba
栾霞,陈红,袁红,孙东。外泌体作为药物传递的精细生物纳米平台。药物学报,2017;38(6):754-63。gydF4y2Ba
刘勇,李东,刘震,周勇,楚东,李霞,等。外泌体介导靶向传递阿片受体Mu siRNA治疗吗啡复发。科学通报2015;5(1):1 - 10。gydF4y2Ba
Munoz JL, Bliss SA, Greco SJ, Ramkissoon SH, Ligon KL, Rameshwar P.间充质干细胞来源的外泌体将功能性anti-miR-9传递到多形性胶质母细胞瘤细胞赋予了化学敏感性。Mol ther nucleic Acids. 2013;2:e126。gydF4y2Ba
Fonsato V, Collino F, Herrera MB, Cavallari C, Deregibus MC, Cisterna B,等。人肝干细胞来源的微泡通过递送抗肿瘤microRNAs抑制SCID小鼠肝癌的生长。中国生物医学工程杂志,2012;30(9):1985-98。gydF4y2Ba
张勇,李林,于娟,朱东,张勇,李霞,等。微泡介导的转化生长因子β1 siRNA抑制小鼠肿瘤生长。生物材料,2014,35(14):4390 - 400。gydF4y2Ba
Banizs AB, Huang T, Dryden K, Berr SS, Stone JR, Nakamoto RK,等。内皮细胞外泌体作为小干扰核糖核酸传递载体的体外评估。国际纳米医学杂志,2014;9:423。gydF4y2Ba
周伟,周勇,陈旭,宁涛,陈宏,郭强,等。胰腺癌靶向外泌体增强免疫治疗和肿瘤微环境重编程。生物材料。2021;268:120546。gydF4y2Ba
Rezaei R, Baghaei K, Amani D, Piccin A, Hashemi SM, Asadzadeh Aghdaei H,等。外泌体介导的功能活性miRNA-375-3p模拟物调节结肠癌细胞的上皮间充质转化(EMT)。生命科学,2021;39:119035。gydF4y2Ba
Wadhwa A, Aljabbari A, Lokras A, Foged C, Thakur A.基于mrna的疫苗交付中的机遇和挑战。制药学。2020;12(2):102。gydF4y2Ba
吴智,李涛。纳米颗粒介导的信使RNA疫苗的细胞质递送:挑战和未来展望。Pharm Res. 2021;38(3): 473-8。gydF4y2Ba
王志强,王志强,王志强,等。聚合物纳米颗粒的安全性和毒性研究。纳米技术医学2021;9:156-73。gydF4y2Ba
van der Koog L, Gandek TB, Nagelkerke a .脂质体和细胞外囊泡作为药物传递系统:成分、药代动力学和功能化的比较。高级医疗保健硕士。2021;11:21 2100639。gydF4y2Ba
Hatakeyama H, Akita H, Harashima H.聚乙二醇的困境:脂质体聚乙二醇化的优点和缺点,系统基因和核酸传递到肿瘤。生物医药通报,2013;36(6):892-9。gydF4y2Ba
侯霞,Zaks T, Langer R,董颖。脂质纳米颗粒的mRNA传递。科学通报,2018;6(12):1078-94。gydF4y2Ba
侯霞,Zaks T, Langer R,董颖。脂质纳米颗粒的mRNA传递。Nat Rev Mater. 2021; 89:1-17。gydF4y2Ba
Palazzolo S, Bayda S, Hadla M, Caligiuri I, Corona G, Toffoli G,等。有机纳米材料用于癌症治疗的临床翻译:专注于聚合物纳米颗粒,胶束。脂质体与外泌体curmed chemistry, 2018;25(34): 4224-68。gydF4y2Ba
宋华,刘波,董波,徐洁,周华,那生,等。基于外泌体的天然产物在癌症治疗中的应用。前沿细胞发展生物学。2021;9:366。gydF4y2Ba
何超,郝艳,王玲,李玲,朱刚。基于细胞源的细胞外囊泡给药系统的展望与挑战。药物输送。2020;27(1):585-98。gydF4y2Ba
Colao IL, Corteling R, Bracewell D, Wall I.制造外泌体:一个有前途的治疗平台。中华医学杂志,2018;24(3):242-56。gydF4y2Ba
李俊华,何德华,高海坤,尹杰,金海坤,陈振荣,等。从脂肪组织来源的间充质干细胞/基质细胞中可重复大规模分离外泌体及其在急性肾损伤中的应用中华分子化学杂志,2020;21(13):4774。gydF4y2Ba
Herrmann IK, Wood MJA, Fuhrmann G.细胞外囊泡作为下一代药物传递平台。纳米技术。2021;16(7):748-59。gydF4y2Ba
金俊,宋勇,朴昌,崔昌。用于生产治疗性外泌体的平台技术和人细胞系。细胞外囊泡循环核酸。2021;2(1):3-17。gydF4y2Ba
Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA疫苗——疫苗学的新时代。新药研究。2018;17(4):261-79。gydF4y2Ba
路德维希N,怀特塞德TL,莱切特TE。健康和疾病中外泌体分离和分析的挑战。中华分子化学杂志,2019;20(19):4684。gydF4y2Ba
确认gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
不适用。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
构思与稿件设计:RR, SHK。数据收集:AA, RB, EAD, SHK。稿件撰写:AA, RB, SHK。图形设计和再生:EAD和SHK。做了重要修订,并确认了最终修订:RR, RJ。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Amiri, A., Bagherifar, R., Ansari Dezfouli, E.。gydF4y2Baet al。gydF4y2Ba外泌体作为RNA传递的生物激发纳米载体:制备和应用。gydF4y2Ba翻译医学杂志gydF4y2Ba20.gydF4y2Ba, 125(2022)。https://doi.org/10.1186/s12967-022-03325-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12967-022-03325-7gydF4y2Ba
关键字gydF4y2Ba
- 药物输送系统gydF4y2Ba
- NanocarriergydF4y2Ba
- 细胞外囊泡gydF4y2Ba
- 外来体gydF4y2Ba
- RNA运输gydF4y2Ba