样本采集
这项研究得到了德克萨斯大学西南医学中心机构审查委员会的批准。所有在Parkland Memorial Hospital (Dallas, TX)和William P. Clements Jr. University Hospital (Dallas, TX)接受治疗的胃腺癌患者均被纳入研究。所有入组患者均提供书面知情同意书。
肿瘤组织通过内镜活检、胃切除术和转移部位活检获得。生成PDX的样品立即放入无菌磷酸盐缓冲盐水中,并在冰上运输到小鼠手术设备中进行植入。转录组学分析的样品立即置于RNAlater (Invitrogen)中,在4°C下至少24小时,然后转移到- 80°C。
老鼠
所有小鼠均按照德克萨斯大学西南医学中心机构动物护理和使用委员会的指导方针进行处理。NSG和裸鼠均来自Jackson实验室。
PDX的生成、传递、存储和再激活
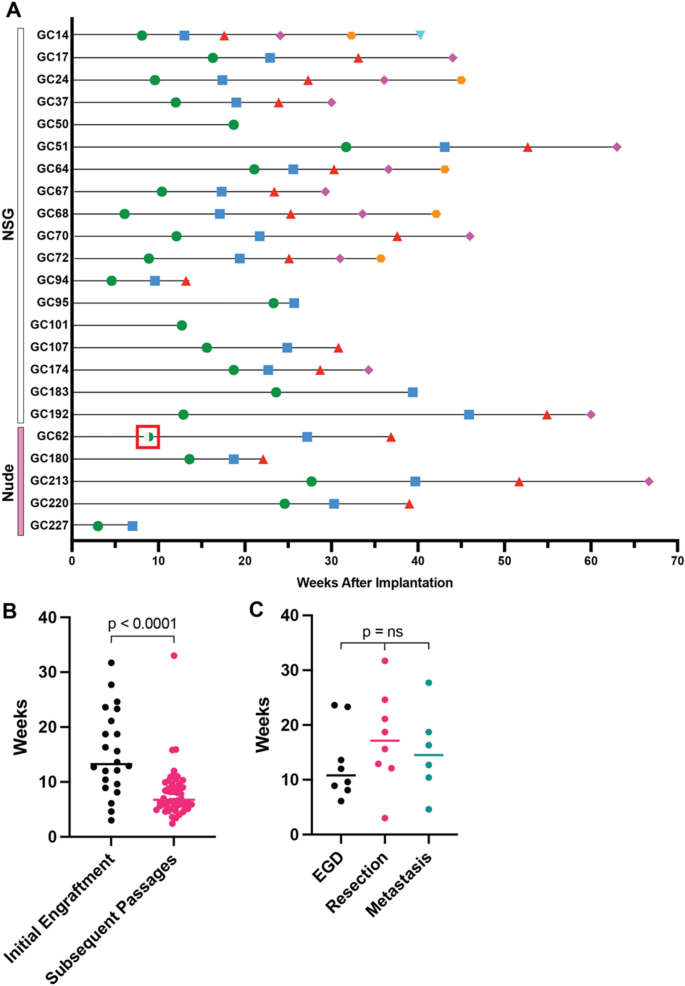
食管胃十二指肠镜(EGD)活检获得的样本(每1-3毫米3.转移部位活检(1-3毫米)3.手术切除(3-5 mm)3.)包被Matrigel Matrix(康宁生命科学),植入受体小鼠侧翼皮下间隙。当肿瘤最大直径达到1.5 cm或观察到肿瘤上的皮肤坏死时传代。我们认为,如果肿瘤生长到直径至少1.5厘米,并在传递到第二个受体小鼠后生长,则建立PDX系。传代时,将肿瘤从皮下组织中切除并分裂,然后:(1)传代到新小鼠的侧翼,(2)在4%多聚甲醛中固定以进行组织学评估,(3)保存在10%二甲亚砜(DMSO) + 90%胎牛血清中,并浸泡在液氮中以备将来使用。为了使冷冻的PDX组织恢复活力,将组织在37°C水浴中加热60 s,然后以与新鲜样品相同的方式植入。复活后,小鼠的维持方式与最初植入异种移植物的小鼠相同。
Lenvatinib测试
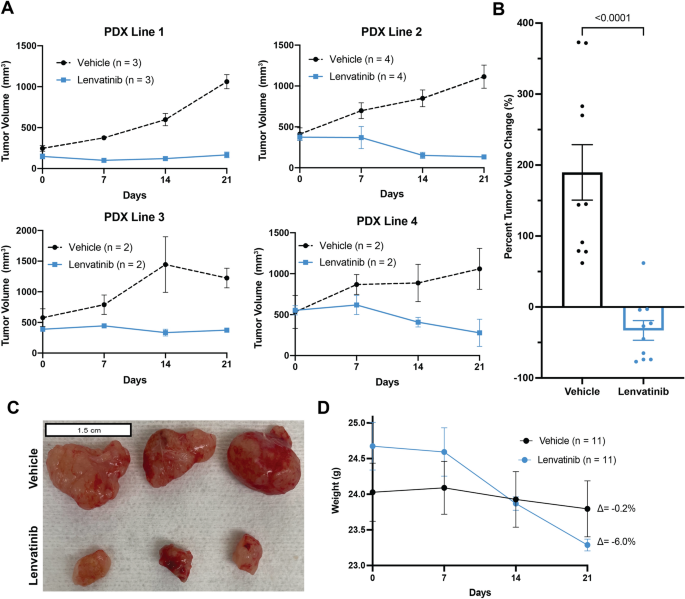
选择4个PDX品系进行药物检测。当肿瘤体积达到300 - 500mm时3.,小鼠随机接受药物递送载体(DMSO与玉米油混合)或lenvatinib (MedChemExpress;cat #HY-10981)每日口服灌胃10mg /kg。在基线时测量肿瘤尺寸,此后每周由盲法观察者测量一次。21天后,对所有小鼠实施安乐死。肿瘤体积计算公式为(π/6) ×长×宽2。[22肿瘤体积变化百分比(%Δv)肿瘤),从所有肿瘤的基线计算。小鼠每周称重。
组织学,免疫组织化学和免疫荧光
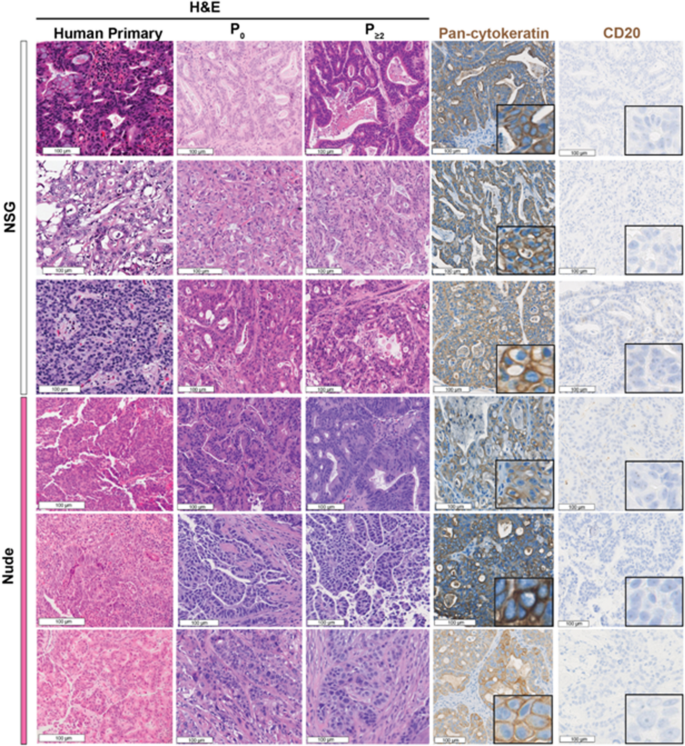
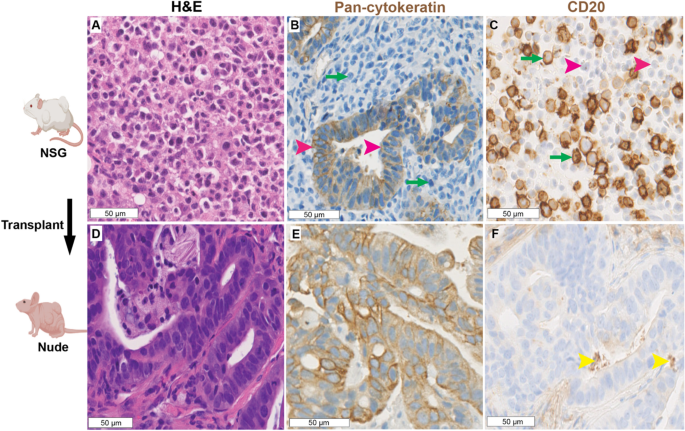
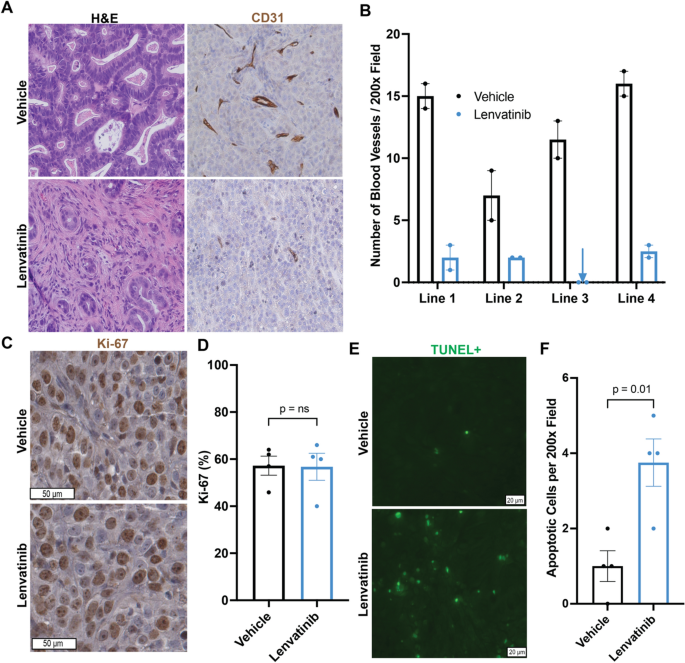
组织样品在4%多聚甲醛中固定24 h,然后包埋石蜡。切片切至4 μm。所有样品均采用苏木精和伊红染色(H&E)进行组织学检查。肿瘤和PDX组织学由具有胃肠道恶性肿瘤(S.T.G.H.)专业知识的委员会认证病理学家进行盲法评估。
用于免疫组化(IHC)的抗体为小鼠抗人泛细胞角蛋白AE1/AE3单克隆抗体(1:500稀释;圣克鲁斯生物技术;SC-81714),小鼠抗人CD20单克隆抗体(Agilent;IR60461-2),兔抗人CD31单克隆抗体(1:50稀释;Abcam;ab28364),兔抗人Ki-67抗体(1:1000稀释;Abcam ab15580)。末端脱氧核苷酸转移dUTP缺口末端标记(TUNEL)免疫荧光(IF)使用原位细胞死亡检测试剂盒,AP(罗氏)。采用Hoechst 33342, Trihydrochloride, Trihydrate (Invitrogen)进行核反染色。
肿瘤内血管密度、肿瘤细胞增殖和凋亡的定量
用热点法定量血管密度[23]。简而言之,每张载玻片在40倍放大镜下扫描,以确定血管密度最高的三个区域。然后在200倍放大镜下评估这三个区域,并计算每200倍放大镜下血管的数量。管腔周围任何染色的内皮细胞环或离散的内皮细胞簇被视为单个血管。对每个PDX系的两个肿瘤进行评估。ki -67阳性细胞在每个肿瘤的3个400×视野中人工计数。计算每个治疗组2个肿瘤的Ki-67,并报告其平均值。为了量化tunel阳性细胞,每张载玻片在40倍放大的荧光显微镜下扫描,以确定tunel阳性最高的三个区域。然后在200倍放大镜下评估这三个区域,并人工计数每200倍放大镜下凋亡细胞的数量。计算每个治疗组2个肿瘤的tunel阳性率,并报告其平均值。 All quantification was performed in a blinded fashion.
RNA测序与分析
RNA提取采用RNeasy Mini Kit (Qiagen)。总RNA采用Ribogreen方法定量,采用Victor X2荧光法(Life Technologies)。使用Agilent Technologies 2100测试台评估RNA完整性。使用TruSeq总RNA试剂盒(Illumina)构建文库,并在NovaSeq 6000上测序,末端reads为2 × 150个碱基对。
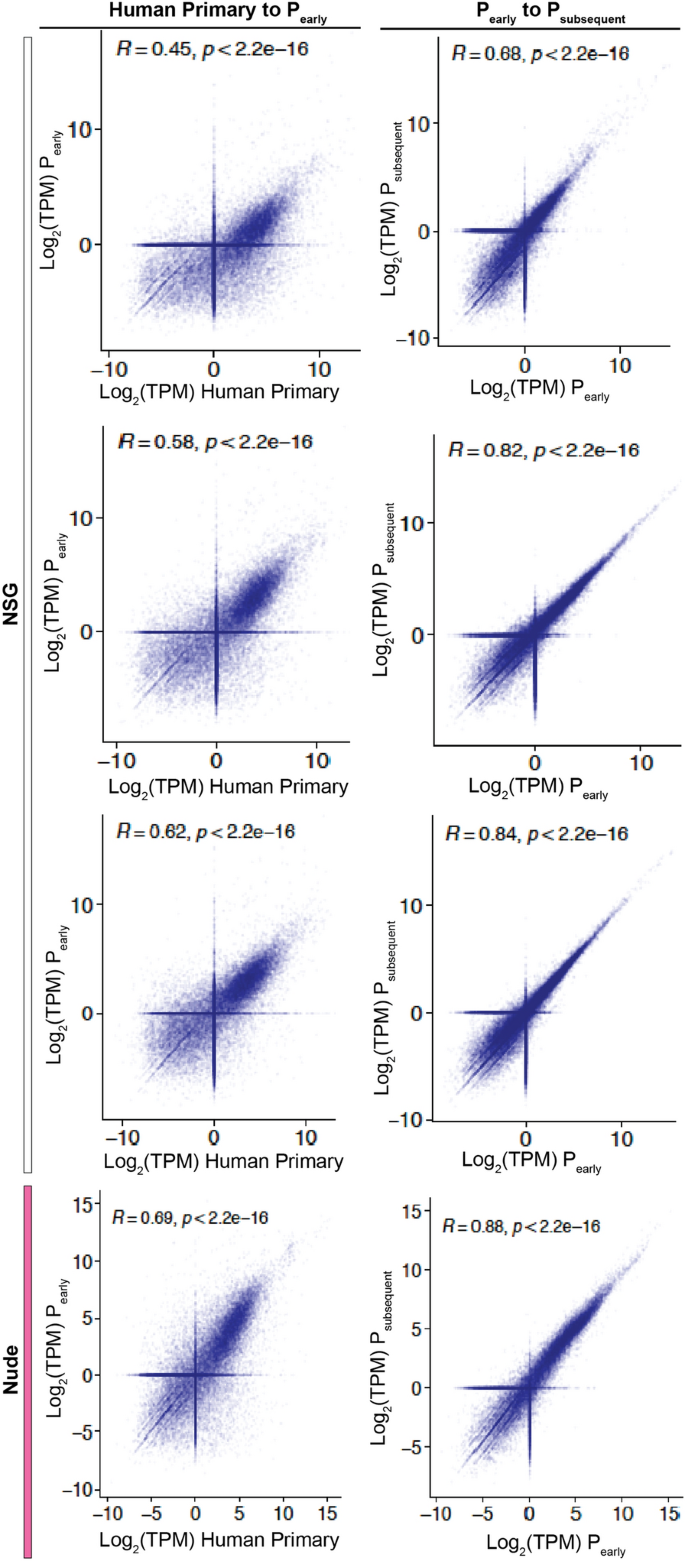
rna测序数据使用Fast p v0.20.1(默认设置)进行精化处理,裁剪Illumina通用适配器,过滤掉碱基质量较低或无信息的reads。共保留5130万对末端reads。使用STAR (v2.7.9, - twpassmode Basic)将所有移植到小鼠体内的样品对准人(hg19)和小鼠参考装配体(m38)。检查每一个对齐的读数,以确定起源的生物体。与小鼠基因组唯一匹配的读取(即比人类基因组匹配得分更高)被删除。然后,通过Salmon v1.5.2以每千碱基百万(TPM)转录本的格式将精炼的人类reads转换为转录组丰富矩阵,输入参数为' -I iu - validatemapings ')。三文鱼参考基因组序列索引以人类参考转录序列GRCm38.v29为基础,基因模型为Gencode v29 (Ensembl 94)。
统计分析
分类变量以计数表示,并与卡方检验或费雪精确检验进行比较。%Δv肿瘤用Mann-Whitney U试验比较载体和lenvatinib治疗肿瘤之间的差异,同样的试验用于比较载体和lenvatinib治疗的血管计数。一个p< 0.05为差异有统计学意义。使用GraphPad Prism (Version 9.1.0)进行统计计算。