人口特征
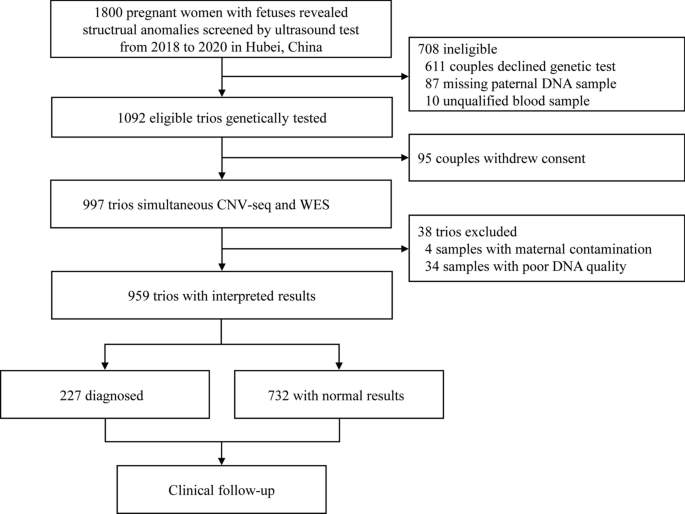
在2018年6月至2020年10月期间,共有1800名胎儿经超声筛查显示结构异常的孕妇获得资格(图2)。1 ).最初,由于任何基因检测的下降(n = 611)、缺失父亲DNA样本(n = 87)和不合格的父母血液样本(n = 10), 708个三人被排除。95对夫妇拒绝继续这项测试,然后被排除在这项研究之外。在此基础上,997组决定同时进行CNV-seq和WES分析,最终959组(男性:557;在排除38例母体污染(n = 4)和DNA质量差(n = 34)的病例(图4)后,女性:402)符合条件。1 ,附加文件1 :图S1)。
入组的959名胎儿根据超声检测发现的胎儿结构异常被分为10个表型类3. :表S1)。表型分类包括心脏、胸部和呼吸道、中枢神经系统(CNS)、面部、胃肠道和腹壁、泌尿生殖系统、积液、NT增加、骨骼和复杂的多系统异常。
收集各组的人口学特征。胸部和呼吸道亚组胎儿的比例为49%(男性)对51%(女性),这是唯一一个包含更多女性胎儿的亚组(表2)1 ).首次筛查胎儿结构异常的中位妊娠周为23.6周。中枢神经系统异常的中位妊娠周在所有类别中是最新的(26.45周,表1 ).父亲和母亲的年龄中位数分别为28岁和32岁1 ).
抽样
确认胎儿结局后取POC样本。从这些样本中提取胎儿DNA,包括出生时脐带片段(n = 667, 69.55%),终止妊娠后组织样本(n = 182, 18.98%),胎盘切片(n = 106, 11.05%),出生时脐带血(n = 4, 0.42%),表1 ).
诊断产量
在实践中,优先筛选了来自284个胎儿的345个候选CNVs和4701个遗传变异,其中17个胎儿被鉴定为包含CNVs和遗传变异的复合杂合状态。经过多学科会议的解释和确认,在227名胎儿中报告了致病性或可能致病性CNVs (n = 109)和变异(n = 128)2 ;额外的文件4 :表S2)。在这227个胎儿中,10个被确定为双重诊断,一个致病CNV和一个致病变异(表2)2 ),其中2例为涉及CNVs和遗传变异的复合杂合状态(表22 ).在其他217个单一诊断胎儿中,191个胎儿是新生胎儿,包括99个CNVs和92个基因组变异。10个男性胎儿是x连锁母体遗传变异。此外,还鉴定出2个复合杂合基因型和8个纯合基因型,均遗传自双亲。9例以常染色体显性遗传方式遗传自先前未确诊的父母。
本研究中832例胎儿超声显像显示为单一异常,其中186例(22.36%)最终诊断为CNVs或遗传变异(表2)2 ).在832名胎儿中,诊断率在9.30-41.49%的范围内,因类别而异。在单一异常表型类别中,积液胎儿的双重诊断比例(6.45%)最高2 ).127名胎儿有多系统异常,其中41名(32.28%)诊断有改变(表2)2 ).多系统异常的诊断率明显高于单一异常(Fisher精确双尾检验,P = 0.0183;表格2 ).
CNV与变异结果
在本节中,我们重点讨论了检测到的cnv和变异的后果。在109个报道的致病性CNVs中,15个是外显子CNVs,通过连续异常外显子读取来识别,范围从1.75到74.35 kb(附加文件4 :表S2)。在所有109个被诊断为CNVs的胎儿中,30个胎儿(27.5%)被诊断为微缺失或微重复综合征(MMS), 79个胎儿(72.5%)被诊断为调节共识编码区域的CNVs。
在所有报道的128个致病变异中,75个是错义型,19个是截断型,14个是内含子型或同义型变异,根据硅预测操纵剪接区并影响pre-mRNA剪接,20个引起其他后果(附加文件)4 :表S2)。所有4CHD7 胎儿突变均为截断型变异,验证了前期的典型CHARGE综合征资料CHD7 变体(附加文件)4 :表S2)。在所有128个具有基因组变异的胎儿中,58人(45.3%)被诊断为综合征,而其他70人(54.7%)被诊断为单基因疾病(附加文件)4 :表S2)。
不同类别的诊断产量分布存在差异。外显子CNVs在NT增加的胎儿中诊断最常见(5.00%)2 :图S2)。然而,在多系统异常胎儿中,其他CNVs(非外显子)的最高诊断率为19.69%2 :图S2)。由遗传变异诊断的综合征胎儿主要分布在NT增高区(10.00%)2 :图S2)。诊断为单基因疾病的胎儿比例最高的是骨骼(23.40%),而只有5.32%的骨骼缺陷胎儿被诊断为综合征(附加文件)2 :图S2)。
诊断频率
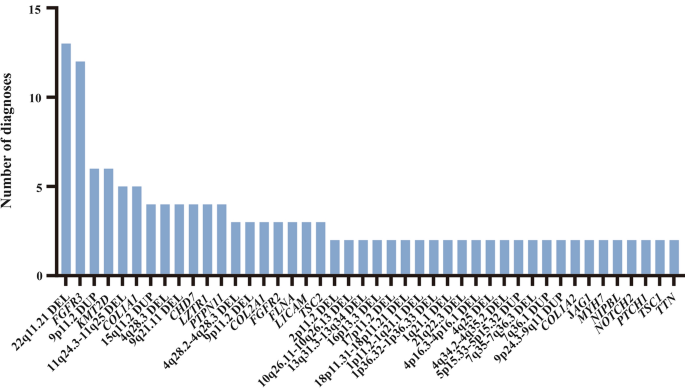
在本队列中,44种类型的CNVs和变异被诊断不止一次,涉及143名胎儿(14.91%)。最常见的诊断为22q11.21缺失13例(1.36%;无花果。2 ).22q11.21包含一组低拷贝重复,22q11.21缺失被报道为人类最常见的复发性微缺失,特别是报道为DiGeorge综合征[32 ].第二种常见的类型是FGFR3 变异,可导致12名胎儿骨骼异常(1.25%;无花果。2 ).随后,9p11.2复制和KMT2D 6例胎儿检测到变异(0.62%;无花果。2 ).特别是9p三体被认为是新生儿最常见的部分三体之一[33 ].11q24.3-11q25缺失,大多数报道为Jacobsen综合征COL1A1 5名胎儿诊断为变异(0.52%;无花果。2 ).7例3次诊断(0.31%;无花果。2 ),另有25人诊断两次(0.21%;无花果。2 ).
双诊断胎儿的附加信息
值得注意的是,10例双诊断胎儿中,先天性心脏病3例,骨骼异常3例,胎儿积液2例,面部异常1例,胃肠道腹壁异常1例(表2)3. ).胎儿C0290超声扫描显示全身皮肤水肿,并伴有腹水和胸腔积液。16p13.3的致病性CNV (33.98 kb缺失)发生改变TSC2 而且PKD1 这些基因被认为是导致腹水和胸腔积液的原因。致病性SNV上NIPBL 基因被报道与一般胎儿积液有关,这是预后的额外信息。双重诊断将彻底证明胎儿的遗传致病性,这对于在不同解剖系统中具有一般症状的胎儿至关重要。
表3在有结构异常的胎儿队列中发现的双重诊断(包括NT增加)
综合征胎儿
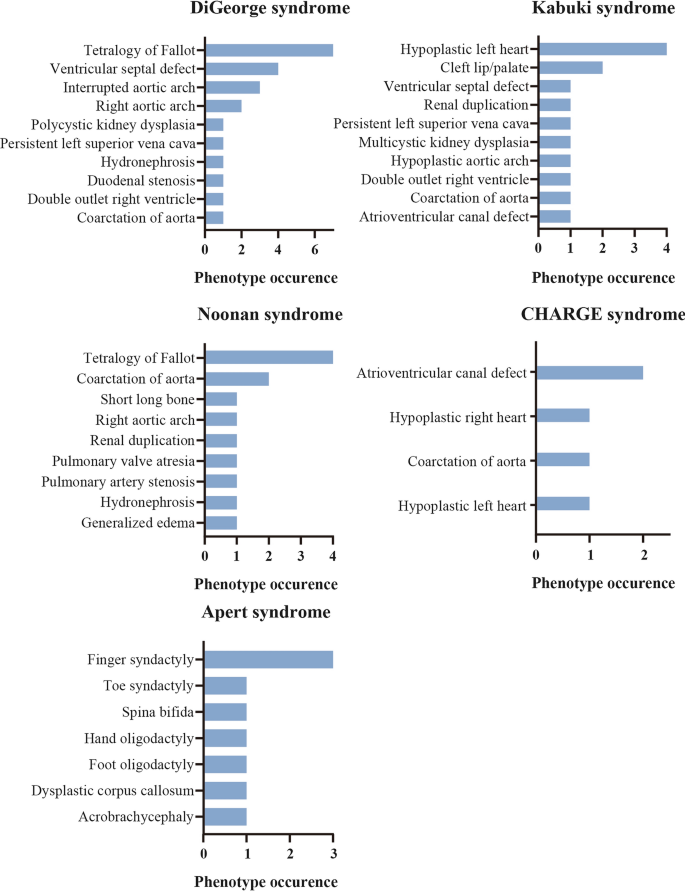
在所有综合征胎儿中,最常见的5种综合征为DiGeorge综合征(14例)、Noonan综合征(10例)、Kabuki综合征(6例)、CHARGE综合征(4例)、Apert综合征(3例;无花果。3. ).在这14个诊断为DiGeorge综合征的胎儿中,有7个(50.0%)进行了Fallot tetra (TOF)筛查。3. ),与先前的研究结果一致[34 ].在10名患有努南综合征的胎儿中,4名(40.0%)进行了TOF扫描,2名(20%)进行了主动脉缩窄(图2)。3. ),两者并非努南综合症最常见的病征[35 ].在6个患有歌舞伎综合征的胎儿中,4个(66.7%)表现为左心发育不良(图2)。3. ).4例被诊断为CHARGE综合征的胎儿均存在各种先天性心脏缺陷,包括2例(50.0%)房室管缺陷,1例(25.0%)左心发育不良,1例(25.0%)主动脉缩窄,1例(25.0%)右心发育不良(图。3. ).3个患有Apert综合征的胎儿均表现为手指并指(3个胎儿,图。3. ).然而,只有1个胎儿(33.3%)被观察到肢端短头畸形。3. ),这是另一个典型的Apert综合征症状。
胎儿的结果
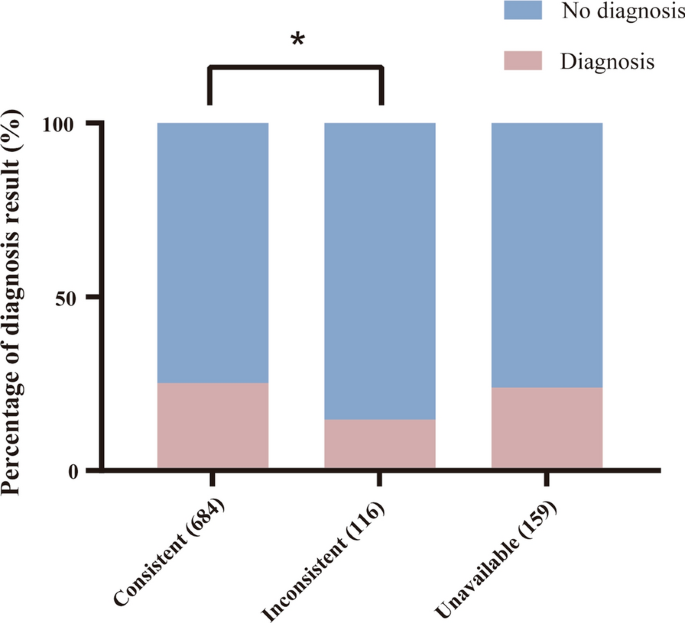
在本队列的959名胎儿中,胎儿结局均在试验前获得,800名胎儿(83.42%)也可获得死后或产后检查的表型(图2)。4 ).终止妊娠719例(74.97%),新生儿死亡7例(0.73%),活产233例(24.30%)。然后我们比较了800名胎儿尸检或产后检查确定的表型和产前超声成像结果。共有684个胎儿表现出一致的子宫内和子宫外表型(图。4 ).此外,116名超声检查异常的胎儿显示出正常的产后表型(图2)。4 ).在684名表型一致的胎儿中,172名(25.1%)被诊断为基因改变。在表型不一致的胎儿中,只有17人被诊断出基因改变,这明显低于表型一致的胎儿(P = 0.0130;无花果。4 ).
临床随访
所有959个家庭在基因检测后持续随访6个月。胎儿C1768经骨骼异常筛选,经尸检确认表型。然后,我们在2号染色体上检测到一个母体遗传的37.16 kb缺失。但由于母亲表型正常,我们最终决定最初不报告该CNV。随着随访的进展,C1768家族的后续胎儿也出现了同样的骨骼异常。因此,我们重新检查了C1768胎儿的CNV,并决定报告为母系遗传的骨骼异常。此外,12个胎儿被诊断为父母遗传,另外18个胎儿被诊断为父亲或母亲遗传。筛查异常载体父母43人(2.24%)。在另一个病例中,胎儿C1101未显示与超声成像结果相关的致病性CNVs或变异ARID1B 检测到De novo变体。出生后出现智力障碍和语言障碍,这与主要由基因突变引起的Coffin-Siris综合征的表型一致ARID1B .