摘要
背景
越来越多的临床试验表明,调节性T (T注册在不同的情况下,如移植物抗宿主病(GvHD)、实体器官移植、1型糖尿病等,细胞转移可能对维持自我耐受性和免疫稳态有良好的影响。在这种情况下,一种健壮的制造协议的可用性,能够产生足够数量的功能T注册细胞是细胞治疗临床方案成功的基本前提。然而,目前还缺乏针对非营利性制造商的扩展工作流程指南。尽管从早期临床试验中已经报道了不同的成功的制造程序和具有良好安全性的细胞产品,T注册细胞变化很大。本研究的目的是验证一种符合生产质量管理规范(GMP)的T注册采用风险管理方法,从流程设计到最终产品开发完成的整个过程的单元。高度强调了用于过程和释放试验(无菌、内毒素试验、支原体和免疫表型)的质量控制(QC)方法的描述。
结果
本文定义的gmp兼容协议允许至少为4.11 × 109T注册平均纯度为95.75±4.38%,可用于不同临床环境下T注册细胞免疫调节功能。
结论
这些结果对于实施gmp兼容的这些细胞的细胞治疗方案的设施有很大的用处,以恢复T的不同条件注册细胞数量和功能,这可能会减缓某些疾病的进展。
背景
监管T (T)注册)细胞是一种有吸引力的用于过继细胞治疗的高级治疗药物(ATMP),可用于恢复对自身或异体抗原的免疫耐受,从而预防甚至治愈疾病[1,2,3.].在小鼠模型中,扩展T注册细胞已被证明可有效诱导对骨髓移植的长期耐受,预防移植物抗宿主病(GvHD),并可延长心脏和皮肤同种异体移植物的存活[4,5,6,7].在接受人类白细胞抗原单倍同源造血干细胞移植治疗各种恶性肿瘤的患者中,T注册细胞过继转移可防止GvHD而不降低移植物抗白血病作用[8].在写这篇文章的时候,安全性和潜在的临床疗效体外扩增自体多克隆T注册细胞正在全球48个临床试验中进行评估,用于终末期肾病(KD)、肾或肝移植、1型糖尿病和GvHD等适应症[9].在这些条件下,T注册细胞可能是一种很有前途的治疗工具,通过在治疗和预处理方案中发挥其免疫调节特性来控制同种异体移植物排斥,从而促进供体特异性移植耐受,从而可能允许减少和/或停用免疫抑制药物[10].
临床应用的一个关键问题是是否扩大T注册来自自体或异基因来源的细胞。使用后者的主要问题是排斥的风险和由此导致的供体细胞存活时间短,以及可能的同种免疫致敏[11],而与自体产物相关的主要挑战可能是难以扩展T注册细胞,从而达到治疗剂量,由于患者的病理[12].此外,自体产品的制造成本高于现成的异体产品,因为每一批都是针对患者的[13].然而,自体和异基因T注册细胞已用于造血干细胞移植[12,14],自体细胞是实体器官移植的首选[15].
来自临床前模型的证据表明,T注册细胞和T效应体(Teff)促进器官移植耐受性所需的细胞水平应远高于生理水平[16,17].事实上,在正常的外周血样本中,循环T注册细胞保持稳定和低(代表CD4的2-8%)+T细胞,白细胞< 2% [15,18,19]),以及T注册细胞只有在体内或体外扩增后才能获得[17,18,20.].已经提出了几种扩展协议来获得纯T注册能保持其抑制功能的细胞群[15,20.,21,22,23].一般来说,有效的扩增方案包括在抗cd3 /CD28珠、白细胞介素(IL)-2和雷帕霉素的存在下培养3-4周[24,25]以确保T的数量增加20 - 200倍注册在不损害细胞免疫调节活性的情况下[20.].
在欧洲监管框架下,T注册经免疫选择富集的细胞不被视为医药产品,并受欧盟组织及细胞指令2004/23/EC规管[26].相反,T注册根据欧洲议会和2007年11月13日理事会(EC) N. 1394/2007条例第2条的定义,体外扩增的细胞被归类为ATMP,这是一种经过大量操纵的细胞产品[26].这意味着展开T注册细胞必须得到国家主管监管机构的授权才能用于临床试验,并且必须得到欧洲药品管理局的批准才能上市。
作为我们跨机构合作的器官移植过继细胞治疗ATMP开发项目的一部分,在本文中,我们详细描述了T细胞移植整个过程中的一些实际问题注册细胞扩增,从GMP验证开始;特别地,讨论了新项目[18,20.,27,28,29,30.,31,32,33,34,35].我们还特别注意遵守有关atmp GMP的最新欧洲监管指南[36],强烈肯定了基于风险的评估对识别与制造过程相关的潜在风险并控制/减轻风险的至关重要性。
首先,说明了我们设计验证过程所遵循的实用方法,然后对其性能进行评估,以产生符合gmp的临床规模体外扩增T注册描述了来自终末期肝病(LD或KD)患者的细胞。此外,质量控制(QC)方法验证解释。
结果
风险评估分析
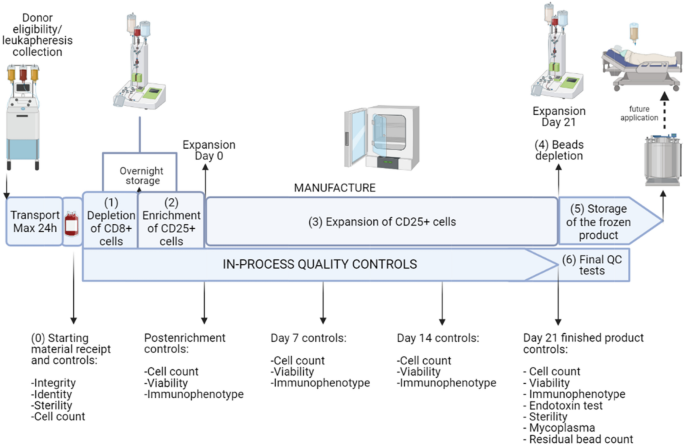
验证过程的主要步骤如图所示。1,而有关行动的详情已载于“方法”一节。简单地说,我们进行了(1)起始材料QCs,包括供体验证、白细胞采集和温控运输;(2)确定T注册起始材料中的细胞;(3)符合gmp的CD8分离−CD25+细胞,流式细胞术检验选择效率;(4) T注册单元,通过对成品执行所有的过程控制和释放测试;(5) T注册细胞(体外抑制试验);(6)低温保存与解冻,并对解冻后的T细胞的膨胀能力进行评价注册细胞。
膨化T的制造概况注册带有过程中测试的单元。每一步的工艺验证为T注册细胞制造是按照GMP指南进行的,目的是提供文件证明,按照特定的书面程序进行的过程是可行的和可重复的,并产生符合预定义质量参数的ATMP。该过程包括(0)确认患者合格后接收和控制原材料,(1)CD8耗尽+(2) CD25的富集+(3) CD25的扩增+(4)珠子耗尽,(5)成品低温保存,(6)ATMP和QC测试的最终表征。在工艺的不同阶段采集了多个过程中样品(如右侧所示),并提交进行相关测试。关于GMP符合性的更多细节可以在“方法”部分的“工艺验证设计”一节中找到。使用BioRender.com创建[56]
对于每个工艺步骤,所有可能导致故障的潜在危险和意外事件都被识别出来。通过执行初步危害分析(PHA),根据附加文件中显示的临界矩阵,为每个危险情况分配风险评分1:表S1。所有列出的要点都被考虑到有效的风险评估,以选择适当的行动计划。在没有实施风险控制策略的情况下,共确定了9个危险主题,其中7个被引用为不可接受(3个可容忍,4个不可接受)。识别出的最高风险是与环境和文档相关的风险。根据所进行的分析,表中所述的逐点缓解计划1是集。所有确定的风险都可以通过实施缓解措施来降低。因此,具有不可接受风险的场景从44%(9类中的4类)下降到0%,具有可接受风险的场景从22%(9类中的2类)增加到100%。没有一个风险仍然是不可接受的。
患者样本和起始材料质量保证
患者特征见表2.所有患者均符合意大利2010年1月25日第16号法令的要求;在采集过程24小时内,通过TRI-NAT对捐献前样本的HIV、HBV和HCV活动性感染也均为阴性。
起始材料的规格见表3..平均而言,白细胞分离产品(n = 4,平均体积:60.3±7.4 mL)在出发后03:03±00:38小时内和收集结束后04:57±01:20小时内被运送到我们的设施。平均运输温度为2.9±2.5℃。
根据表中列出的预定义标准,所有的白细胞分离产品都被批准作为制造工艺的起始材料3.,尽管由于温度登记失败,初始材料的运输温度无法用于第一次运行。事实上,根据GMP的要求,通过适当的调查,这一故障被作为计划外偏差处理。在偏差管理过程中,对几个方面进行了研究。其中,对运输条件进行了审查:经核实,原料的运送是由一名合格的快递员按照《良好分销规范》进行的专用运输[37];并对运输箱的包装符合性进行了评价。此外,还检查了起始材料是否符合表中所列的所有其他所需规格3..最后是CD45+起始材料中的细胞活力≥90%(表4).因此,供体#1起始材料被确定为符合验证条件。
如图所示。1,立即进行无菌评估,作为第一步操作,直接接种好氧和厌氧微生物。在验证运行期间收集的数据被用于设置起始材料的最终限制和规格,以确保最终产品具有预定义的质量特性。
T数的测定注册起始材料中的细胞
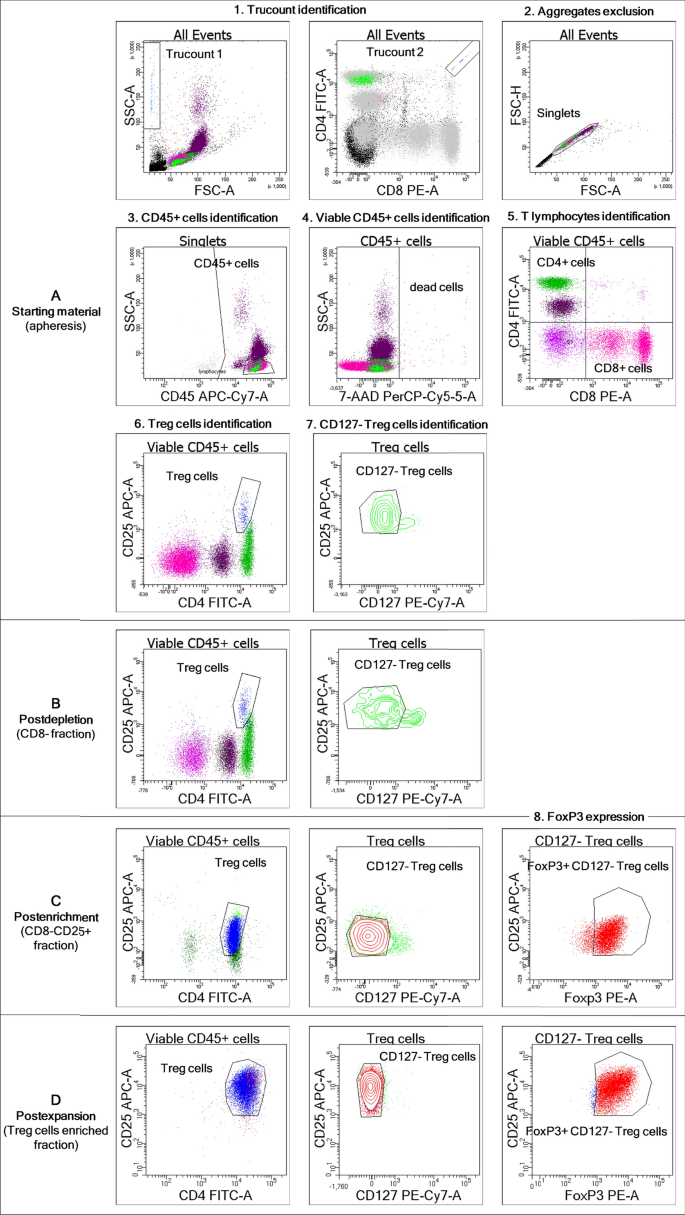
我们最初描述并计算了T注册起始材料中包含的细胞,如“方法”部分的“流式细胞术”段落所述。T注册CD4细胞表面CD25分子的高表达定义了细胞特征+细胞;T注册在转录因子FoxP3存在的情况下,细胞也低表达或CD127阴性[38].列举T注册细胞,我们标准化了T的绝对细胞计数方法注册采用如图所示的门控策略,实现基于Trucount管的单元枚举。2A.详细结果见表4.通过考虑单采产品容量为54.6 mL(范围50.8-69.2),全血细胞(WBC)含量为2.4 × 10的中位数9到10.6 × 109,可活T的绝对数量注册细胞数为155.5 × 106单元格(范围44.9 × 106-343.6 × 106).总体而言,T注册细胞占CD45的1.8±0.6%+平均来看,他们几乎都是CD127阴性。
流式细胞术分析T注册细胞沿着制造过程。全血(起始材料)或过程中样品(耗尽后、富集后和扩张后)在TruCOUNT管中使用荧光色素偶联抗体对表面标记CD45、CD4、CD25和CD127进行染色,并根据无溶洗方法进行分析。一个T的门控策略注册整个非修辞样本中的细胞枚举。一个(步骤6)到DT注册制造过程中细胞纯度定量:起始材料(一个步骤6),耗竭后(B),后富集(C)和扩展后(D)分数。详细信息:绝对细胞计数通过基于标准光散射特征的事件门控和基于荧光的事件门控的交集来识别,如PE vs. FITC图所示,这两个图都显示了所有获得的事件(步骤1)。FSC-A vs. FSC-H点图(步骤2)中排除了细胞聚集物和碎片,然后是CD45+APC-H7与SSC-A点图上的细胞鉴定(步骤3)+7-AAD染色(步骤4),以阴性为基础对活细胞进行门控。在活CD45内+在PE vs. FITC图中检测到表达CD4或CD8的细胞(步骤5),而CD4+CD25+T注册在FITC vs. APC图中鉴定细胞(步骤6)注册细胞,CD127−在PE-Cy7与APC点图上对细胞进行门控(步骤7)注册细胞(富集后和扩增后),双样品在FACS管中染色作为表面标记,然后固定并渗透进行FoxP3的胞浆内染色,在CD127中检测到FoxP3−T注册PE与APC点图上的细胞(步骤8)。显示了KD2患者样本的代表性图像。FoxP3染色阴性对照见附加文件1:图S1
符合gmp的CD8分离−CD25+细胞
T注册通过两步免疫选择程序分离细胞,如图所示。1详情见“gmp级T隔离注册细胞在“方法”部分。耗尽过程后,CD8很少被污染+细胞(中位数:0.1%,范围0-0.4%),中位数WBC回收率为起始材料的65%(范围50-70%),KD和LD患者的这一值相似(分别为58±11%和67±5%)。因此,T注册与起始材料相比,细胞含量也降低了,尤其是KD患者样本(157±65 × 10)6预选vs. 277±94 × 106postselection T注册细胞号)有一个T注册LD患者样本的细胞回收率为56±4% vs. 94±8%(67±31 × 10)6Vs. 73±39 × 106).不出所料,CD8+细胞损失对T细胞无显著影响注册耗竭后部分的细胞浓度(中位数:2.5%,范围2.1-2.9%)与起始材料的细胞浓度(中位数:1.7%,范围1.3-2.6%)相比。
T的增加注册细胞产品在整个制造过程中的细胞纯度如图所示。2和表4.CD25后+细胞富集,阳性分数(CD8−CD25+细胞)中位数为94 × 106有核细胞总数(范围59 × 106-178 × 106),中位数为T注册细胞纯度76%(范围54-85%)。根据平均荧光强度,在富集后的样品中检测到CD25的降低,这是由于免疫选择过程中抗CD25抗体的结合。关于T注册细胞富集效率,中位回收率为49%(范围34-92%)4).总体而言,两步免疫选择手术的回收率为73 × 106T注册细胞(中位数)来自约55毫升的单采量。
平均而言,分离出的T注册FoxP3或CD127细胞表达量低或不表达;此外,分离出的T注册细胞同时呈现两种特征(表4).污染CD8+, CD19+,或CD56+在富集后的分数中,细胞不超过4%。
T的临床规模扩大能力注册体外细胞
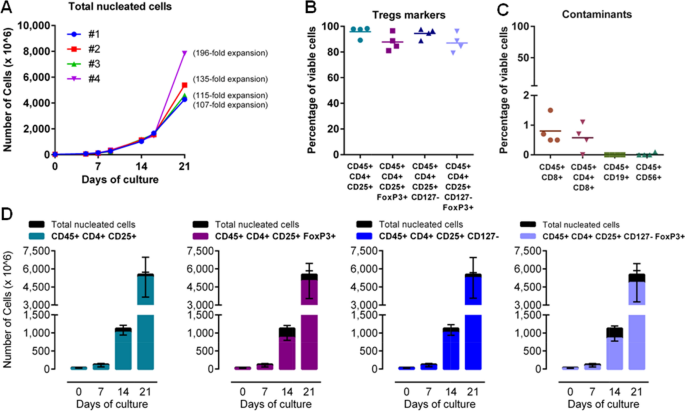
在#01,#02和#03中,40 × 106新分离的CD8−CD25+细胞(29±7 × 106T注册细胞)在异基因热灭活血浆、雷帕霉素、IL-2和膨胀珠存在的气透性培养袋中进行两次传代培养,如图所示。1.扩张21天后,按照制造商的说明进行珠子免疫衰竭,以获得目标分数;然后将目标分数的等分进行QC分析或冷冻保存以进行其他实验,详情见“qc:过程中测试和发布测试在“方法”部分。
如图所示。3.,中位数为4.6 × 109扩展单元格(范围4.3 × 109-5.4 × 109)注册细胞纯度为95±5%。平均而言,T注册在播种期间,细胞达到159±33倍的扩张(中位数:162倍;范围124-191,n = 3),中位总剂量为4.2 × 109T注册单元格(范围4.1 × 109-5.3 × 109)(图。3.).FoxP3+和CD127−FoxP3+T注册细胞分别占扩增细胞的91±6%和87±9%。污染CD8+T细胞占总数的比例不到1.5%(中位数:0.7%,范围0-1.1),导致CD8的最大数量为11个+每十亿扩增的T细胞注册细胞(验证运行#02,KD2),中位数为7 CD8+每10亿扩大的跨国公司有T细胞(范围5-15个)。富集后CD56含量可忽略不计+细胞(中位数:0%,范围0-0.1%),而污染CD19+B细胞检测不到。
在第21天,与原始部分相比,磁免疫衰竭可以去除99.99%的珠子。的确,从2.9±0.7 × 10开始6珠子,每30 × 106原始细胞中,平均每30 × 10有319±142个珠6在目标部位发现细胞(p < 0.008配对t检验)。表中提供了进一步的扩展细节5.将冷冻保存的样品作为保留样品,仅对其进行信息测试,包括解冻后细胞活力的测定(数据未显示)。
解冻T的膨胀能力注册细胞
膨胀T的冻结和储存注册细胞将保证扩展策略在不同临床环境中的临床效用(例如,多种治疗程序或异基因使用)。以测试膨胀T注册当细胞在解冻后会影响其膨胀能力时,我们进行了第四次膨胀(#04,LD2),并进行了停止-解冻过程。我们将注意力集中在第14天,因为这是过程中膨胀曲线加速的点(图2)。3.A).具体来说,我们在第14天停止细胞培养,冷冻保存正在膨胀的细胞,在同一时间点将细胞播种在培养袋中,与标准培养一样,解冻后重新开始膨胀,不增加解冻后的重新刺激时间。如前所述,我们恢复了85%的冷冻保存细胞,89.1%的细胞活力;这一发现表明,14天扩张T注册细胞成功地在低温保存中存活下来。T注册如前所述,解冻细胞上的细胞标记被保留,并与预冷冻细胞上的细胞标记相似(数据未显示)[7].解冻的T注册细胞在最后一周(从第14天到第21天)在培养袋中进行扩增,与其他试验相同。解冻后恢复的细胞的折叠膨胀与连续培养的细胞相当;我们得到T的数量累计增加了272倍注册细胞,这与新鲜T细胞没有什么不同注册(平均159±33,n = 3,图;3.和表5).此外,来自运行#04 (LD2)的21天扩增细胞保留了其免疫表型和功能特征,与其他运行的细胞相当(图2)。3.).
药典分析方法和结果的验证
无菌试验
在所有验证批次中,在产品存在和不存在的情况下都观察到了微生物的生长,这表明产品的冷冻和最终的冷冻保存产品组成本身并不影响微生物的生长。特异性(无假阳性)通过单独培养培养基来评估微生物生长情况。检测限(灵敏度)为1-10 CFU,如预期的那样,即使用两种浓度的菌株与阳性对照的增长相似。通过对两个不同操作人员在两个不同日子的结果进行分析,确定了中等精度。所有验证样品都被确定为无菌的好氧和厌氧微生物。
木糖醇
通过对4种浓度的对照标准内毒素(CSE)(相当于2λ、λ、0.5λ和0.25λ)和阴性对照(仅用于细菌内毒素测试的水)进行凝胶凝块分析4次重复,以EU/mL表示裂解液敏感性的确认。裂解液的灵敏度为0.03 EU/mL。在我们的实验条件下,对于平均体重为70 kg的患者,注射的最大容量为60 mL,因此M = 0.86 mL/kg, K = 5 EU/kg [39), EL = 5.8欧盟/毫升,MVDλ= 193.33 = 0.03欧盟/毫升。
对稀释为1:5、1:10和1:100的产品批次的初步研究表明,只有稀释为1:10和1:100的产品批次不影响凝块的形成,符合效度标准。其他两个产品批次的最终验证终点通过选择最小的无干扰产品稀释度(1:10)来满足。终点被确定为0.03 EU/mL,确认在此稀释下的产品不会干扰血栓形成。该产品的灵敏度计算公式为:灵敏度×所选稀释度(0.03 EU/mL × 10) = 0.3 EU/mL。因此,内毒素测试的规范可以固定,考虑到测试的灵敏度(0.3 EU/mL)和计算的内毒素限度(5.8 EU/mL)之间的范围。
在所使用的实验条件下,如果用稀释后的产品在CSE存在下测定的裂解液的灵敏度不小于0.5λ且不大于2λ,则该产品不含干扰因素。
支原体测试
的成长肺炎支原体而且m . hominis在接种后的第3 ~ 20天,液体培养基中UFC浓度为10 ~ 100 UFC/mL;在接种后的第2 ~ 4天至19 ~ 21天,固体培养基中UFC浓度为10 ~ 100 UFC/mL。对于每一种接种的微生物,无论是否存在该产品,差异均不大于5 CFU/mL。
根据所有微生物污染方法的预先定义的验收标准,大规模gmp合规扩展生产的4批中有4批完全符合标准,如表所示6,总结了验证数据。
发布规格的T注册细胞药物产品,批分析,稳定性
生产过程的每一步都有文件记录,并根据批记录和标准程序执行。基于我们在大规模验证运行期间获得的成品的特征,定义了ATMP的发布规范(表6).由于符合预先定义的标准和结果运行间的低变异性,因此制定了相当严格的产品定义标准(表6).
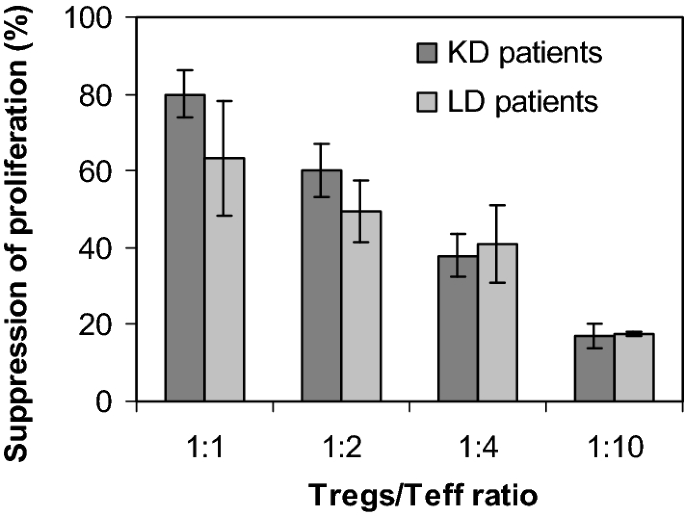
T的功能测试注册细胞(体外抑制试验)
第21天gmp扩展T注册细胞显示T升高注册表型,表明与新分离的T注册细胞(7].作为T展开量的减小注册低温保存后的细胞功能已被报道[40,41,42],即T注册在低温保存和解冻后,细胞在#01至#04运行中进行测试。与先前数据相似[7,32,融化的T注册有效抑制T细胞eff细胞在剂量依赖性的方式(图;4).在T时记录平均抑制活性注册细胞/ Teff细胞比例1:2 (n = 4, 53.0±8.2%抑制);以1:1 T注册细胞/ Teff细胞比率,T注册细胞表现出最高的抑制能力(69.0%±14.2%),它们的活性具有可比性,与患者的病理无关,也与它们的扩增是一步式还是两步式进行无关(连续培养和停止解冻培养的中位数:66.5% vs. 74%,图。4).
讨论
在此,我们描述了用于分离、膨胀和冷冻保存膨胀T的安全、可重复和灵活的GMP制造工艺的工艺验证注册来自终末期KD或LD患者的细胞。
这项工作的目的是描述用于验证适用于小型和/或学术制药厂的生产工艺所遵循的步骤,以获得可用于需要免疫调节的临床应用的最终产品。当考虑到T注册细胞可以积极影响甚至抵消严重疾病的演变和/或减少对免疫抑制治疗的需求,对治疗相关的副作用和医疗成本产生有益的结果。
在一个健康的成人实验对象中,T注册细胞占循环T细胞总数的5-10% [3.],即最多为200 × 106T注册可以从白细胞分离中分离出细胞[30.].因此,体外扩增是获得足够数量T的必要条件注册细胞,以影响免疫反应的异体移植物移植后在人类。在这方面,各个小组最近证明了一种有益的T注册肝移植术后诱导耐受的细胞剂量依赖效应[43,44].
由于细胞操纵的程度,扩大T注册根据欧洲监管框架,细胞被归类为ATMP [26].根据欧洲药品管理局关于在临床试验药品开发中纳入设计质量方法的建议,我们进行了工艺风险评估,通过适当的措施识别、解释和管理可能影响工艺的所有变异性来源。为此,我们使用PHA来识别、分类和描述可能的风险、可能导致故障的危险情况和事件、它们的起源和可能的后果(风险),以及估计给定潜在故障发生的概率。
我们制定了一个详细的战略(表1),我们可以根据类别(如设备、人员、试剂、供应商、环境、患者或工艺本身)及其可能的后果来识别不同的潜在故障,并根据各自发生的严重程度对每种故障进行严重性评分(即得分越高风险越高)。针对每一种遇到的风险提出了缓解战略,从而导致可能的最终得分大幅降低。如前所述,该方法定义了修改、控制或删除危险情况的纠正措施,并测量了制造过程的安全性和可靠性。此外,它可以作为从一开始就实施纠正措施的指南(从正确使用标准操作程序,到适当的人员培训,可追溯系统等)。
我们还提供了一个实际的例子,说明我们如何处理实际发生在起始材料运输中的意外偏差。事实上,尽管实施了控制策略,偏差仍然可能发生。根据GMP,必须立即打开调查文件,对故障的严重程度进行分类,并确定原因,目的是防止或限制对工艺可能产生的负面影响。实施的调查和纠正措施必须记录在专门的文件中,该文件必须成为批记录的附录,并且必须在验证工艺批准之前进行评估。的确,可能的偏差总是会发生,不仅在工艺的验证阶段,而且在临床试验过程中,应该根据GMP及时适当地进行管理,而不是导致可能的临床样品排斥。
为了监控如此漫长的制造过程,除了识别关键质量属性外,在工艺的不同步骤建立适当的测定方法以确保中间产品和成品的质量也是至关重要的。我们认为,并根据我们的经验,即使生产工艺的验证和质量控制方法只在有关atmp的规例的最后修订中提出建议[36],即使是最准确的风险分析也不能完全取代验证步骤,尤其是分析方法。因此,只要可能,应根据官方药典进行放行QC验证(例如,药典方法)。
不同参数的验证工作结果表明了可行性和纯度的可靠结果,对我们生产工艺的稳健性和生产高质量ATMP的能力产生了积极的影响。
临床使用前要考虑的一个关键步骤是从膨胀产物中耗尽免疫磁珠。抗cd3 /CD28膨胀珠在体内的有效性和安全性实际上并不为人所知。为保证第21天成品的安全,膨化T去珠注册根据制造商的说明,细胞是通过磁免疫衰竭进行的。对于残留珠计数的QC,我们按照GMP要求进行了特定验证,因为制造商提出的程序不用于药物开发,而仅用于研究用途[45].
因此,我们设置并验证了一种基于Bürker室的原始计数的成品珠计数方法(详情请参阅“材料和方法”部分),并与制造商提出的协议要求相比,使用了更少的QC单元数。我们决定不遵循制造商建议的程序,因为几个关键问题:(1)大多数细胞仪在不添加计数珠的情况下不能提供绝对的事件计数,这在我们的情况下很困难,因为参考珠很难与膨胀珠区分;(2)“浪费”细胞数(原始分数对应5-20 × 104MACS GMP规范注册珠子和1 × 108珠数计数所需的靶部分细胞(均为三份)影响临床剂量;(3)反复离心和丢弃上清液,必然会导致珠子损失不可预测且不标准化,且不同样品基质(如原始馏分、目标馏分和对照)的一致性可能不同,从而影响方法精度。
由于具有稳健和一致的扩展能力,无论循环T的数量注册细胞,我们验证的过程将允许患者参加临床试验。事实上,我们证明,尽管单采产物的细胞密度可能因收获过程而变化,T注册起始材料中的细胞含量不影响分离效率。
通过我们所描述的制造工艺,我们能够获得临床相关的细胞剂量为79±23 × 106T注册细胞/公斤,平均体重为70公斤;值得注意的是,临床试验的靶细胞剂量一般为1-10 × 106T注册细胞/公斤(3.].此外,体外扩张也使我们获得了比直接分离得到的更纯净的产品。根据我们的经验,大规模T注册使用CliniMACS分离系统从白细胞分离中进行细胞选择,得到CD4+CD25+t细胞纯度55%(范围42.6-62%),其中大部分表达FoxP3,与健康受试者报告的数据一致[40,46,47].针对近期研究表明低温保存对T注册细胞功能[41,42],我们之前已经证明了扩展T注册在免疫抑制小鼠(即nod - scid - γ敲除小鼠)的GvHD小鼠模型中,解冻后的细胞可以有效地预防异种GvHD的发生,并改善急性GvHD和生存[7].在此,报道的体外数据也证实了我们之前对T注册根据我们的gmp符合性过程,从终末期LD或KD患者中进行细胞扩增。
最后,我们设置的生产过程具有灵活性的重要方面,这对于符合不同的物流和临床环境可能非常有用。对于我们这样的小型学术团体来说,21天的扩张过程可能要求很高。出于这个原因,我们研究了分馏扩展的可能性,以便有一个更适应实验室需求的过程。在这一点上,我们单次运行的初步数据表明,仍有可能恢复T的膨胀能力注册解冻中间产物(例如,14天膨胀T注册细胞)。事实上,根据我们获得的扩增曲线,第14天有大量的细胞可以被冷冻作为将来扩增的主细胞库。此外,从冷冻在膨胀曲线这一点的细胞开始,将允许在7天内更快地实现临床相关数量的细胞,具有更短的时间周期和易于编程的生产设施的所有后勤优势。这意味着输注的时间可以适应不同的调节方案,甚至可以适应临床试验中由于后勤和/或临床问题而偶尔出现的偏差。此外,在适应性研究设计的背景下,它将使临床医生有机会根据患者的临床进展在最佳时间计划ATMP给药。
结论
总之,我们的数据清楚地强调了获得大量gmp级T的稳健离体方法的优势和缺陷以及灵活性注册来自肝或肾移植候选者的细胞。这些结果为临床试验的设计铺平了道路,以测试T的临床影响注册在实体器官移植患者中诱导耐受的细胞介导治疗方法。
方法
先决条件:设备要求和设施特点
制造和QC测试在细胞工厂进行,细胞工厂是位于意大利米兰的公立医院Fondazione IRCCS Ca ' Granda Ospedale Maggiore Policlinico的GMP设施。2007年,意大利药监局(Agenzia Italiana del Farmaco-AIFA)首次授权该工厂生产atmp,符合欧洲GMP法规[36],并一直保持到今天。
该设施是一个完全受控的ATMP制造工厂,其特性已在前面描述[48,49].简单地说,所有制造过程都在a类环境中进行(II类A2型生物安全柜/组织培养罩;即生物安全柜),周边环境为B类。微生物污染监测使用沉降板,体积主动空气采样,表面和操作人员采样与接触板。连续空气颗粒物监测多在a类环境下进行;然而,在关键步骤中,它是在B类环境中使用自动粒子计数器进行的。
工艺验证设计
根据欧洲药品管理局的指导方针[50对于工艺设计和验证,我们执行了以下步骤:(1)制定质量目标、产品概况和抽样计划,以识别起始原料、中间产品和成品的关键质量属性;(2)收集小规模和放大实验以及体内研究的预验证数据;(3)确定所需设备和设施的特性;(4)通过工艺设计和工艺风险分析,定义了适当的制造工艺,确定了控制策略;(5)利用已建立的工艺可重复性科学证据对设计工艺进行评价和确认,以进行工艺验证;(6)进行持续的工艺验证,确保生产过程在整个常规生产期间处于控制之下;(七)生产的批记录;(8)分析方法的验证;并(9)保证成品符合规格书中规定的所有质量属性。
过程风险识别
我们根据国际准则评估有关工序的风险[36,51]通过执行PHA,如附加文件中所述1:表S1。PHA始于系统地识别过程中任何步骤中可能干扰质量目标产品轮廓的所有潜在危险和意外事件。PHA的结果提供了每种组合的风险等级SxOxD,其中S表示故障后果的严重程度,O表示危险发生的概率,D表示检测到的概率,即在故障发生之前检测到故障的几率。PHA的输出是通过使用定制的排名量表作为指导,确定所需的危害控制和后续行动。我们进行了从工艺设计阶段到产品开发结束的过程中风险分析。
工艺验证和放行标准
对于产品验证,我们预先定义了中间产品和成品的质量目标产品概况和关键质量属性,并相应地制造了每个验证批次的成品。每次验证运行都有相应的验证报告。所有预先定义的验收标准和规格,以及原料、中间体和成品的相应QC结果,都记录在制造过程的每一步。在工艺验证结束时,对起始材料和中间产品的质量目标产品概况的预先定义的验收标准进行仔细审查,以防需要进行更改。同样的程序应用于成品的发布规格。批释试验包括细胞计数、纯度、细胞活力和无菌性(支原体试验和内毒素定量)。由于扩展过程的性质,我们将残余抗cd3 / cd28包被珠粒的定量作为释放测试的一部分。关于QC方法的详细信息如下所示。
制造过程和过程中的控制
供体选择和起始材料
起始材料来自LD或KD固体器官移植等待名单上的患者。患者的选择基于以下纳入标准:(1)年龄≥18岁;(2)诊断为终末期KD并在活体肾移植等待名单上或诊断为终末期LD并在肝移植等待名单上。排除标准如下:(1)血清学和核酸检测(NAT)人类免疫缺陷病毒(HIV)、乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV)阳性;(2)梅毒抗体阳性;(3)联合移植患者;(4)并发无控制感染。
在博洛尼亚大学Azienda Ospedaliero-Universitaria临床中心,使用连续流式细胞分离器COM对两名肾移植患者和两名肝移植患者进行了稳态白细胞分离。侦探®(Fresenius Kabi AG, Bad Homburg,德国)。以两个血量作为治疗终点。抗凝剂柠檬酸葡萄糖溶液,配方A (ACD-A),比例为1:14 ~ 1:13,用于预防凝血。为了预防柠檬酸盐相关的低钙血症,在白细胞抽取期间静脉注射葡萄糖酸钙。
每个白细胞抽取样本在受控温度(+ 4至+ 22°C)下运输到GMP设施;使用经过验证的数据记录器(Testo Spa, Settimo Milanese,意大利)进行连续温度记录。在验证过程中,记录运输温度,并用于设定临床试验期间使用的可接受范围。样品随相应的文档一起发送,其中包括与协议相同的相关信息。样品的采集和运输设置如下:采集程序的持续时间设置为小于4 h [52],样品采集完成后4小时内由GMP设备接收白细胞分离产物。取白细胞标本装入配制好的无菌密封袋中,在标本放入前立即打开包装袋,放置后尽快关闭包装袋。这个袋子密封得很好,而且有一个匿名的密码。在白细胞采集标签上报道的其他数据包括采集量/重量、采集日期和采集过程的持续时间。此外,附带的文档报告了运输和温度跟踪的持续时间。
一旦批准作为制造工艺的起始材料,对起始材料进行取样,以检查细胞计数(ABX Micros 60 CT, HORIBA,京都,日本)和使用BacT/ALERT (bioMérieux, Marcy-l'Étoile,法国)的微生物污染。流式细胞术测定淋巴细胞亚群含量如下所示;这些参数的规格是在三次验证运行结束时建立的。
gmp级T隔离注册细胞
该方案适用于膨胀T的整个制造过程注册细胞的情况如图所示。1.生产过程的每一步都有文件记录,并根据批记录和标准程序执行。在成品表征之后,质量保证组对结果进行评审,以确定ATMP的放行测试,如工艺验证部分所述。
CD8−CD25+在GMP条件下,从每个白细胞抽取样本(n = 4)中分离细胞。临床级试剂和大规模免疫磁细胞分离系统(CliniMACS™仪器,Miltenyi Biotec, Bergisch Gladbach, Germany)根据制造商的说明进行两步操作,其中包括CD8+T细胞衰竭,CD25+T细胞富集。
在详细绘制代表性样本后,对T的数量进行评估注册(见下图),将白细胞分离产物转入细胞制剂袋,用CliniMACS缓冲液(磷酸盐缓冲盐水/EDTA缓冲液)加0.5%人血清白蛋白(HSA/CliniMACS缓冲液)按1:3稀释。细胞在指定体积的HSA/CliniMACS缓冲液中洗涤和重悬,并在室温下在轨道摇床上用CD8 MicroBeads (CliniMACS Miltenyi Biotec)标记30分钟。通过洗涤去除未结合的抗体,将细胞重悬于100 mL HSA/CliniMACS缓冲液中,并使用CliniMACS分离程序“depletion 2.1”进行耗尽。中间部分(CD8−细胞)收集并保存在4°C过夜。
对于抗CD25单克隆抗体阳性选择,将细胞清洗,在HSA/CliniMACS缓冲液中重悬,并与CD25微珠(CliniMACS Miltenyi Biotec)在4-8℃的轨道摇床上孵育15分钟。洗涤后,使用CliniMACS分离程序“enrichment 3.1”分离目标细胞。
阳性部分(CD8−CD25+细胞)被收集,清洗,并用自动细胞计数器(Nucleocounter, Chemometech, Denmark, EU)计数,以确定总有核细胞(TNCs)的数量。用流式细胞仪检测分离产物的纯度。正、负分数等分(CD8−CD25−细胞)冷冻保存如下所述。
为了监测不同的分离步骤,QC实验室对每个标记、耗尽和富集步骤前后的不同样品进行分析,以评估纯度和污染物(流式细胞仪)以及细胞数量(核计数仪)。富集过程中产生的阴性部分,包括CD8−CD25−细胞被等份冷冻并冷冻保存用于体外抑制实验。
gmp级膨胀T注册细胞
临床级扩增在GMP条件下,在不断增大尺寸的气渗透性培养袋(MACS GMP细胞分化袋,Miltenyi Biotec)中进行,在37°C, 5% CO下进行3周2,在由TexMACS GMP培养基添加100 nM雷帕霉素(MACS GMP rapamycin, Miltenyi)和5%异基因热灭活血浆组成的完整培养基中。详细尺寸为40 × 106孤立的CD8−CD25+以0.5 × 10的剂量接种细胞(第0天)6细胞/mL在完全培养基中。MACS GMP规范T注册试剂盒(MACS GMP ExpAct T注册结合CD28抗生物素和cd3 -生物素单克隆抗体(Miltenyi Biotec)的珠粒在第0、7和14天以不同的珠粒与细胞比例(分别为4:1、1:1和1:1)使用。第2天,加入1000iu /mL IL-2 (Proleukin, Novartis)。每2-3天进行一次细胞喂养,通过添加添加IL-2的新鲜培养基,在1000(第5和7天)或500 IU/mL(第9、14和16天)时将培养体积增加一倍。第7和14天,接种1.0 × 10的种子进行传代培养6细胞/mL分别约320 mL和640 mL。从第5天开始,在每一种培养基饲料中,用自动细胞计数器(Nucleocounter, Chemometech, Denmark, EU)对具有代表性的样品进行测试,并根据记录的样品特异性折叠膨胀估计所获得的总细胞数。在第7、14和21天评估免疫表型。
第21天,根据制造商说明书(Miltenyi Biotech),使用大尺寸色谱柱和CliniMACS分离程序“depletion 2.1”进行磁选去除珠粒。在手术结束时(第21天),扩展T注册去除珠粒后收集细胞(目标部分),并进行最终完整的QC分析。成品由目标部分组成,在20ml由生理盐水、人白蛋白(10% vol:vol)和二甲基亚砜(DMSO;10%卷:卷)。为了评估从中间产物重新开始培养的可能性,细胞扩增从解冻14天的T开始注册执行单元(参见下一段)。
低温保存和解冻
新分离的CD8样本−CD25+细胞(阳性部分)和CD8−CD25−细胞(阴性部分)以及扩增的T注册不同时间点(第14天和第21天)的细胞使用控制速率冷冻系统(Nicool Plus,液化空气公司,法国巴黎)在含有80%氯化钠(B. Braun, Melsungen, AG,德国)、10% DMSO (CRYOSERV, Mylan Institutional, Inc., Canonsburg, PA,美国)和10% HSA (Kedrion, Lucca,意大利)的溶液中冷冻保存(CryoMACS冷冻袋50,Miltenyi Biotec)。冷冻装置被转移并立即储存在专用罐的气相液氮中。
用于功能和膨胀试验,预热的解冻溶液(80%氯化钠,10% HSA和3% ACD-A;Haemonetics)被添加到新鲜解冻的细胞中;这个条件允许较高的T注册在初步实验中测试的所有条件中的细胞活力和恢复(数据未显示)。
求T的值注册解冻后的细胞扩增能力,在第四次验证运行期间(#04),在第14天停止细胞扩增,将细胞冷冻后解冻,并按照上述方法评估细胞活力和表型。按照标准培养的描述,在同一时间点将细胞播种到培养袋中,重新开始细胞培养。
qc:过程中测试和发布测试
对新展开的T进行了过程中质量控制注册细胞(第7、14和21天)。使用前面描述的相同通用方法对成品执行所有发布测试[49].每次CQ测试都重复执行,以增加数据集。
流式细胞术
T注册细胞表型通过多色直接免疫荧光测定,单克隆抗体面板针对表面分子CD4、CD8、CD19、CD25、CD45、CD56和CD127(均来自美国加州圣何塞BD生物科学公司)和细胞内蛋白FoxP3 (FoxP3单克隆抗体,PE, eBioscience,圣迭戈,加州)。有关抗体的详细信息,请参阅附加文件1:表S2。细胞内染色0.5 × 106根据制造商的说明,使用eBioscience Foxp3/转录因子染色缓冲组固定和渗透细胞,然后用Foxp3 PE或大鼠IgG2a kappa同型对照PE (eBioscience)作为阴性对照进行染色(附加文件)1:图S1)。
T注册细胞免疫表型,定义为CD45+CD4+CD25+细胞,被认为是成品的身份[35].以CD45、CD4和CD25共表达的百分比来测定产品纯度;污染物群体也被分析为表达CD8、CD19和CD56的细胞的百分比,“仅供参考”。CD127和FoxP3在T细胞中的表达注册细胞也进行了评估。
细胞活力通过7-氨基放线菌素D染色测定(BD Biosciences, San Jose, CA, USA)。膨化T菌解冻后的生存能力注册细胞也被评估为“仅供参考”。
来测量T的数量注册我们使用基于内珠标准、6色流式细胞仪和顺序门控策略的单平台技术来测定CD45+CD4+CD25+绝对计数,类似于前面描述的[53,54].简单地说,100 μL全血细胞被转移到Becton Dickinson (BD) Trucount管中,并按照附加文件中的详细内容进行染色1:表S2。染色后,红细胞在氯化铵溶液中裂解10 min,不清洗。然后分析Trucount管,并以与前面描述的方法类似的方式计算全血中每μL的细胞数[53].T注册使用cd25 - 1对照设置细胞门,并以CD45的百分比表示+细胞。T的绝对值注册细胞/μL全血按厂家公式计算:【感兴趣事件数/事件数】×【BD Trucount珠浓度/μL试验体积】。使用FACSCanto II细胞仪(BD, Franklin Lakes, NJ, USA)分析细胞。为了减少设置门的变化,标准操作程序包括了示例门。数据采用Diva 8.0软件(BD)进行分析。
细胞计数
细胞计数根据内部协议和程序进行验证[49].关于细胞计数,每4000万个细胞,我们估计至少1 × 109细胞扩增后获得。我们的目标是得到> 1 × 109去除培养珠后的跨国公司。
微生物污染
4个不同批次的21天扩展T注册根据欧洲药典(Ph. Eur.),使用先前描述的验证策略,细胞被用于验证用于检测微生物污染的方法(例如,需氧细菌和厌氧细菌的存在,内毒素和支原体的存在)[49].无菌测试由GMP认可的外部供应商进行。
不育
无菌检验按Ph. Eur进行。第2.6.27章(9.2版)用待检验样品直接接种微生物培养基[55].进行了方法验证,以排除低温保存成品的成分与微生物生长的任何干扰。为了这个目的,Ph. Eur。-推荐的微生物菌株(ATCC Manassas, VA, USA)在成品冷冻保存前接种于成品中,解冻后检测微生物生长[49].在酪蛋白大豆消化琼脂和Sabouraud右琼脂板(Merck Millipore, MA, USA)中适当制备和分离冻干的细菌、酵母和真菌菌株。每批微生物培养基进行无菌性和育性试验(促生长试验)。通过评估三个不同批次的21天发酵T进行了三次验证注册细胞(占成品体积的1%)。每种微生物考虑两种污染水平[1-10菌落形成单位(CFU)和10-100 CFU]。作为阳性对照,对照微生物接种在没有成品的完全培养基中(T注册细胞);仅使用成品(不含微生物菌株)作为阴性对照。样品在35-37℃下孵育7天。阴性对照组在35-37℃孵育14天。结果是通过目视观察菌落确定的。评价特异性、敏感性和中间精密度。
细菌内毒素检查分析
为满足Ph. Eur的要求,进行了鲎试剂细菌内毒素(LAL)试验。第2.6.14章方法A(凝胶凝块法:极限试验)。对于内毒素水平,在分析方法验证结束时定义规范;该值最初设定为5.8个内毒素单位(EU)/mL,这对应于产品的内毒素限度(Ph. Eur. 2.6.14)。
对该方法进行了验证,确定了成品(T注册通过凝胶-凝块LAL试验,将细胞重悬在生理盐水、人静脉注射用白蛋白(10% vol:vol)和DMSO (10% vol:vol)的溶液中形成凝块。验证方案包括以下四个步骤:(1)确认标记裂解液的灵敏度:使用声明灵敏度(λ)为0.03 EU/mL的LAL (Lonza, Walkersville, MD, USA)和阳性CSE (Lonza)。CSE以冻干形式供应,用无热原水(细菌内毒素测试用水,Lonza)重新构成,并根据Ph. Eur在0.1 mL LAL存在下连续稀释。对于λ的确认。(2)产品研究:计算内毒素限度(EL)和最大有效稀释度(MVD)。根据Ph. Eur。,the EL (EU/mL) was calculated by the formula K/M, where K is the threshold pyrogenic dose of endotoxin/kg of body mass (for intravenous/parenteral administration of 5.0 EU/kg) [39], M为产品的最大推荐剂量/kg体重(M为注射的最大细胞剂量(体积)/kg)。MVD值的计算公式为MVD = EL/λ。(3)干扰因素的初步测试:在不同稀释倍数下(根据MVD)进行该步骤,以找到不激活和/或抑制酶促反应的最佳稀释倍数。在所使用的实验条件下,如果稀释后的产品在CSE存在下建立的裂解液的灵敏度不小于0.5λ且不大于2λ,则确定该产品不包含干扰因素。(4)用选定的稀释度对三批产品进行干扰因素测试。
支原体
以培养为基础的支原体试验在成品上得到验证(T注册细胞在完全培养基中重悬),按Ph. 2.6.7进行。目的是证明细胞培养上清(T注册完全培养基中的细胞(如前所述)不含干扰或抑制支原体生长的物质。参考菌株肺炎支原体(ATCC 15531)及支(ATCC 23714)移植到支原体肉汤基础(Millipore)板上,在35-38℃下孵育7天。用分光光度计(λ = 625)测定吸光度后,将悬浮液稀释至10-100 CFU/mL。支原体菌落数量通过在琼脂中包埋并在35-38℃培养板中进行两次计数来确定。为了进行分析,分别将来自三种不同产品的10 mL和0.2 mL细胞培养基上清接种于液体Hayflick培养基和固体Hayflick培养基(均来自Merck Millipore)。支原体菌株以10-100 CFU/mL的浓度加入。样品孵育21天,分别在固体培养基上接种2-4天、6-8天、13-15天和19-21天测定CFU/mL的数量。如果满足以下验收标准,则确认验证:在液体培养基中,支原体在产品存在和不存在的情况下同时生长;并且,在固体培养基中,在存在和不存在该产品的接种板之间,CFU/mL的测定没有观察到大于5倍的差异。
药液中MACS GMP颗粒残留量的测定注册细胞
对成品中残留珠粒的测定,考虑三个样品:(1)阳性对照:4 × 103.无细胞的珠子,通过连续稀释原液(0.2 × 106珠子/µL);(2)原始分数:3 × 106细胞扩张21天,去除珠粒前;(3)目标分数:30 × 106珠状免疫衰竭后21天扩增细胞。对于阳性对照和原始馏分,我们在Bürker室中测试了10 μ L,以量化未处理样品中的珠粒数量。
接下来,对所有样品(阳性对照、原始馏分和目标馏分)进行两次处理:离心(14000转,5分钟),加入1 mL 0.52%次氯酸盐裂解(涡流30秒),离心(14000转,5分钟)。最后,将颗粒重新悬浮在磷酸盐缓冲盐水中,使原始部分的最终体积达到600µL,目标部分达到40µL,阳性对照达到200µL。40 μL样品中的珠粒在Bürker腔内由两名不同的操作人员计数,每名操作人员扫描整个Bürker腔内的珠粒两次(10- μL的分位数,n = 4)。计算了回收系数,即裂解后的原始馏分中珠子数与未处理的原始馏分中珠子数之比。然后用这个恢复因子调整Bürker计数的结果。将两种操作的调整值取平均值,并假设为40 μL中准确的珠数。目标组分在40 μL中重悬。根据Miltenyi协议,规格设定为≤1000珠/ 30 × 106细胞。
体外抑制试验
T .的抑制作用注册如先前报道的,采用羧基荧光素二乙酸琥珀酰亚酯(CFSE)为基础的抑制试验来测定体外细胞的活性[7].简单地说,低温保存的自体CD8−CD25−细胞(用作Teff细胞)解冻并用5µM CFSE (Thermo Fischer Scientific, Carlsbad, CA, USA)标记。Teff与解冻的自体扩增T细胞共培养注册细胞(第21天)注册T细胞:eff细胞比例(1:1至1:10)。共培养在添加10%胎牛血清、1%青霉素/链霉素和1%的RPMI-1640培养基中进行l-谷氨酰胺存在的MACS GMP ExpAct T注册试剂盒试剂(珠:Teff细胞比例:1:10)。第5天,收集细胞,采用FlowJo软件(Treestar)流式细胞术定量CFSE残留量;T细胞的增殖eff细胞单独被认为是100%增殖。
统计分析
使用GraphPad Prism 8软件(GraphPad software, San Diego, CA, USA)使用适当的测试进行统计分析。除非另有说明,KD和LD患者的数据使用学生t检验或双向方差分析进行多重比较。数值数据显示为中位数和范围或均数±标准偏差,视情况而定。P值< 0.05为有统计学意义。
数据和材料的可用性
本研究中生成和/或分析的数据集可根据合理要求从通讯作者处获得。
参考文献
Pilat N, Sprent J. Treg治疗重访:耐受性超越缺失。前沿免疫。2021;11:622810。
阙伟,李学科。调节性T细胞诱导移植耐受。Adv Exp医学生物学。2021;289 - 302。
Romano M, Fanelli G, Albany CJ, Giganti G, Lombardi G.调节性T细胞治疗在移植和自身免疫中的过去、现在和未来。前沿免疫。2019;10:43。
乔佛里O, Santolaria T, Calise D, Al ST, Hudrisier D, Romagnoli P,等。CD4 +CD25+Foxp3+调节性T淋巴细胞预防急性和慢性同种异体移植排斥反应中华医学杂志,2008;14:88-92。
郭夏燕,姜山,曾杰,米加林,Mottet C, Lechler RI。体外扩增供体同种异体抗原特异性CD4+CD25+调节性T细胞促进实验性移植耐受。血。2007;109:827-35。
Taylor PA, panoskaltsi - mortari A, Swedin JM, Lucas PJ, Gress RE, Levine BL,等。l -选择细胞而不是l -选择细胞CD4 +25+ t调节细胞是GVHD和骨髓移植排斥反应的有效抑制剂。血。2004;104:3804-12。
Ulbar F, Montemurro T, Jofra T, Capri M, Comai G, Bertuzzo V,等。来自终末期器官疾病患者的调节性T细胞可以根据良好的生产规范进行分离、扩增和冷冻保存,以改善其功能。《翻译医学》2019;17:250。https://doi.org/10.1186/s12967-019-2004-2.
Di Ianni M, Falzetti F, Carotti A, Terenzi A, Castellino F, Bonifacio E,等。treg在hla -单倍同源移植中预防GVHD并促进免疫重建。血。2011;117:3921-8。
搜索:expanded t reg-List Results-ClinicalTrials.gov [Internet]。[引自2021年4月9日]。可以从:https://clinicaltrials.gov/ct2/results?recrs=&cond=&term=expanded+t+reg&cntry=&state=&city=&dist=.
李凯,阮维,李明明,康明生,唐强。供体反应性T细胞的衰减使得使用调节性T细胞治疗可以有效控制异体移植排斥反应。中华外科杂志。2014;14:27-38。
张华,郭华,吕林,Zahorchak AF, Wiseman RW, Raimondi G,等。非人类灵长类动物输注后体外扩增自体和非自体调节性T细胞的连续监测和稳定性。中华外科杂志,2015;https://doi.org/10.1111/ajt.13113.
曹强,王志强,王志强,等。在成人脐带血移植中输注体外扩增T调节细胞:安全性和检测动力学。血。2011;117:1061 - 70。
李志强,李志强,李志强,等。异基因细胞治疗技术的研究进展[互联网]。《前线医学》,2018。https://doi.org/10.3389/fmed.2018.00233/full.
郭伟伟,苏晓辉,王明宇,韩明哲,冯晓明,姜爱玲。调节性T细胞在GVHD治疗中的作用。前沿免疫。2021;12:697854。https://doi.org/10.3389/fimmu.2021.697854/full.
麦克麦克唐纳,皮雷JM, leings MK.用于细胞治疗的调节性T细胞的制备方法。临床免疫学杂志2019;197:52-63。
樊Z, Spencer JA, Lu Y, Pitsillides CM, Singh G, Kim P,等。在体内追踪“颜色编码”效应,自然和诱导的调节性T细胞在异体移植物反应。中华医学杂志,2010;16:718-22。
唐强,李凯。调节性t细胞治疗移植:我们需要多少细胞?科奥平器官移植杂志2012;349 - 54。
Ezzelarab MB, Thomson AW。Tregs过继细胞治疗改善移植结果:希望和障碍。移植报告。2016;3:265-74。
吴wf, Duggan PJ, Ponchel F, Matarese G, Lombardi G, David Edwards A,等。人CD4+CD25+细胞:一种自然存在的调节性T细胞群。血。2001;98:2736-44。
张志刚,张志刚,张志刚,张志刚,等。一种强大的,良好的符合生产规范的,临床规模的程序,从肌萎缩性侧索硬化症患者中产生调节性T细胞,用于过继细胞治疗。Cytotherapy。2016;18:1312-24。
维辛格M, Stoica D, Roessner S, Lorenz C, Fischer A, Atreya R,等。符合良好生产规范的体外扩增调节性T细胞的生产和大量释放,作为治疗自身免疫性和炎症性疾病患者的基础。Front Immunol[互联网]。2017年,8。
Voskens CJ, Fischer A, Roessner S, Lorenz C, Hirschmann S, Atreya R,等。在溃疡性结肠炎患者中用于treg细胞治疗的自体GMP-ready调节性T细胞的鉴定和扩增。肠炎疾病2017;23:1348-59。
Seay HR, Putnam AL, Cserny J, Posgai AL, Rosenau EH, Wingard JR,等。从冷冻保存的脐带血中扩增人treg用于gmp兼容的自体过继细胞转移治疗。Mol Ther方法临床开发[互联网]。2017; 4:178 - 91。
巴塔利亚M,斯塔利尼A,罗卡罗MG。雷帕霉素选择性地扩增CD4+CD25+FoxP3 +调节性T细胞。血。2005;105:4743-8。
张志刚,刘志刚,刘志刚,等。一种基于雷帕霉素的gmp兼容过程,用于临床试验的调节性T细胞的分离和扩增。Mol Ther Methods临床开发,2018;
欧洲议会和理事会2007年11月13日第(EC) 1394/2007号条例,关于先进治疗药品和修订指令2001/83/EC和第(EC) 726/2004号条例(与EEA相关的文本)。欧洲议会和理事会2007年11月13日第(EC) 1394/2007号条例,关于先进治疗药品和修订指令2001/83/EC和第(EC) 726/2004号条例(与EEA相关的文本)。
Garakani R, Saidi RF。实体器官移植中细胞治疗的最新进展。器官移植医学[互联网]。2017; 8:125-31。
孙晓霞,刘志强,刘志强,等。成功扩增功能性稳定调节性T细胞用于肝移植免疫治疗。Oncotarget。2016;7:7563 - 77。
Afzali B, Edozie FC, Fazekasova H, Scottà C, Mitchell PJ, Canavan JB,等。血液透析患者和健康对照中调节性T细胞的比较:移植中细胞治疗的意义临床临床杂志,2013;
McDonald-Hyman C, Turka LA, Blazar BR。实体器官和造血干细胞移植免疫治疗的进展和挑战[互联网]。科学翻译医学2015。可以从:https://pubmed.ncbi.nlm.nih.gov/25810312/.
乌科纳,Höpting M,魏伟加,P,罗丝,U,等。临床试验中调节性T细胞的分离策略:表型、功能、稳定性和扩增能力中华血液学杂志,2011;39:1152-60。
Velaga S, Alter C, Dringenberg U, Thiesler CT, Kuhs S, Olek S,等。临床级调节性T细胞:大规模扩增条件的比较分析。Exp Hematol[互联网]。2017; 45:27-35。
McKenna DH, Sumstad D, Kadidlo DM, Batdorf B, Lord CJ, Merkel SC,等。优化cGMP纯化和扩增脐带血来源的t调节细胞,以支持首次人体临床试验。Cytotherapy。2017;19:250 - 62。
Di Ianni M, Del Papa B, Zei T, Iacucci Ostini R, Cecchini D, Cantelmi MG,等。T调节细胞分离的临床应用[互联网]。输血昆虫科学2012;213 - 6。
王丽娟,王欣,王丽娟,等。培养基对CD4+ CD25highCD127lo/neg Treg扩增的影响临床应用《免疫药理学杂志》2013;16:358-63。
EudraLex。EudraLex-Volume 4 - GMP指南|公共卫生[互联网]。EudraLex-Vol。4 .良好的生产实践。指南。2003[引用2021年4月8日]。可以从:https://ec.europa.eu/health/documents/eudralex/vol-4_en.
良好的分销实践|欧洲药品管理局[互联网]。[引自2021年10月21日]。可以从:https://www.ema.europa.eu/en/human-regulatory/post-authorisation/compliance/good-distribution-practice.
Hori S, Nomura T, Sakaguchi S.转录因子Foxp3对调节性T细胞发育的控制。科学。2003;299:1057 - 61。
鲎变形细胞裂解物的比较及与美国药典热原试验的相关性。应用环境微生物学。1977;33:126 - 9。
Peters JH, Preijers FW, Woestenenk R, Hilbrands LB, Koenen HJPM, Joosten I.临床级Treg: GMP分离,通过CD127pos耗尽、Treg扩增和Treg冷冻保存提高纯度。PLoS ONE。2008; 3: e3161。
孙文杰,陈志强,陈志强,等。CD4+CD25+Foxp3+调节性T细胞的冻结和解冻导致CD62L表达的丧失和对移植物抗宿主病保护能力的降低。PLoS One[互联网]。2015; 10: e0145763。
王晓娟,王晓娟,王晓娟,等。调节性T细胞(Tregs)低温保存在临床治疗应用中的挑战《免疫药理学杂志》2013;16:371-5。
Sánchez-Fueyo A, Whitehouse G, graceda N, Cramp ME, Lim TY, Romano M,等。调节性T细胞疗法在肝移植中的适用性、安全性和生物活性Am J移植[互联网]。2020; 20:1125-36。https://doi.org/10.1111/ajt.15700.
Todo S, Yamashita K, Goto R, zitsu M, Nagatsu A, Oura T,等。基于调节性t细胞的细胞疗法在活体供肝移植中的操作耐受的初步研究。肝脏病学(互联网)。2016; 64:632-43。https://doi.org/10.1002/hep.28459.
miltenyi生物技术。(无标题)[互联网]。[引自2021年4月8日]。可以从:https://www.miltenyibiotec.com/_Resources/Persistent/c6a0b41674efcebbb1a3243d5b38a740a996d017/IM0017462.pdf.
李文杰,李志强,李志强,等。在GMP环境中大规模分离高纯度“未接触”调节性T细胞用于过继细胞治疗。免疫术[互联网]。2015; 38:250-8。
张文杰,李志强,李志强,等。分离CD4+CD25+调节性T细胞用于临床试验生物骨髓移植[互联网]。2006; 12:267 - 74。
蒙特默罗T, Viganò M,布德利S,蒙特拉蒂奇E, Lavazza C, Marino L,等。我们如何在意大利进行细胞治疗。药物Des Devel Ther[互联网]。2015; 9:4825-34。
Viganò M, Budelli S, Lavazza C, Montemurro T, Montelatici E, de Cesare S,等。良好生产规范间充质间质细胞生产中质量控制分析方法验证的提示和技巧。干细胞Int[互联网]。2018; 2018:1-16。
机构EM.成品工艺验证指南-在法规提交中提供的信息和数据[互联网]。2014[引用2021年4月8日]。1 - 15 p。。可以从:https://www.ema.europa.eu/en/process-validation-finished-products-information-data-be-provided-regulatory-submissions.
ICH Q9质量风险管理|欧洲药品管理局[互联网]。[引自2021年4月19日]。可以从:https://www.ema.europa.eu/en/ich-q9-quality-risk-management.
张志刚,张志刚,张志刚,张志刚,等。大容量标准化处理量白细胞收集外周血祖细胞疗效的影响因素。输血。2004;44:1593 - 602。
哈迪MY,瓦里F,罗塞蒂T,哈特DN,普吕RL。基于流式细胞术的全血调节性T细胞计数分析。中华免疫杂志,2013;29(3):344 - 344。
亨斯利TR,伊斯特AB, Gerdts SE,德罗莎SC,海特A,麦克拉斯MJ,等。使用全血表型分析的多中心临床试验主要外周血白细胞群的枚举。中国生物医学工程学报2012;e4302。可以从:https://pubmed.ncbi.nlm.nih.gov/23007739/.
欧洲药典。欧洲药典-第2.6.27章修订的细胞制剂的微生物检查- eca学会[互联网]。[引自2021年4月9日]。可以从:https://www.gmp-compliance.org/gmp-news/european-pharmacopoeia-chapter-2-6-27-microbiological-examination-of-cell-based-preparations-revised.
BioRender[网络]。[引自2021年4月9日]。可以从:https://biorender.com/.
确认
我们感谢Araceli Rivera Ordaz博士提供的合成图像和她对手稿的建议。
资金
这项工作得到了意大利卫生部“调节性T细胞的阳性选择、扩增和移植”项目的支持注册在实体器官移植中预防细胞排斥反应和诱导耐受”(批准号RF-2011-02346763)。
作者信息
作者及隶属关系
贡献
TM, RG:对这部作品的构思、组织、手稿的撰写以及审查和评论做出了重大贡献;CL、TM:撰写稿件,并为该作品的构思和执行做出实质性贡献;CL、MV、SS:建立并进行质量控制研究;CL、SB、MGC、EM、EG:制造工艺的建立和执行;FU、LC:定义并进行功能测试;RL和LL对稿件进行了批判性审查;MC, GLM:选择纳入研究的受试者。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
研究是根据《赫尔辛基宣言》进行,并获当地伦理委员会批准(232/2015/O/苔丝博洛尼亚大学毒品调查处).所有受试者在入组前均获得知情同意。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
补充表1.PHA的临界矩阵。补充表2.用于研究性药品表征的多色流式细胞术:每次评估的抗体类型和数量。补充图1.FoxP3染色阴性对照
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
拉瓦扎,C.,布德利,S.,蒙特拉蒂奇,E.。et al。用于未来应用的扩展调节性T细胞的工艺开发和验证:制造个性化高级治疗药物的一个例子。翻译医学杂志20., 14(2022)。https://doi.org/10.1186/s12967-021-03200-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-021-03200-x
关键字
- ATMP
- GMP工艺开发
- 工艺验证