摘要
背景
嵌合抗原受体(CAR)或t细胞受体(TCR)工程的t细胞治疗最近成为一种有前途的过继免疫治疗方法,用于治疗恶性血液病和实体瘤。基于多参数流式细胞术的检测在监测细胞制造步骤中起着关键作用。由于CAR/TCR t细胞产品的生产必须符合当前的良好生产规范(cGMP),因此应该使用流式细胞检测的标准或质量控制来确保流式细胞检测结果的准确性,但目前没有商业上可用的方法。因此,我们建立了一个程序来生成内部冷冻保存的CAR/TCR t细胞产品,用于流式细胞术质量控制,并验证了它们的使用。
方法
两种CAR - t细胞产品:CD19/CD22双特异性CAR - t细胞和FGFR4 CAR - t细胞,以及一种TCR工程t细胞产品:KK-LC-1 TCR t细胞由NIH临床中心的细胞工程中心(CCE)制造。产品分成等份,冷冻保存并保存在液氮中。低温保存流式细胞仪质量对照采用流式细胞仪检测解冻后活力、CD3、CD4和CD8频率、转导效率和载体鉴定。对质控细胞低温保存的长期稳定性和保质期进行了评价。此外,还对低温保存质控细胞的敏感性和精密度进行了评价。
结果
解冻后,发现冷冻保存的CAR/TCR t细胞对照的存活率大于50%。冷冻保存的对照细胞转导效率和载体识别标记的表达稳定至少1年;解冻后的值与低温保存时测量的值在±20%范围内。在解冻和室温保存后,这些冷冻保存的细胞的稳定性持续了至少6小时。此外,我们的冷冻保存CAR/TCR-T细胞质量控制显示,转导效率表达与稀释因子之间有很强的相关性。此外,不同实验室技术人员和不同流式细胞仪对冷冻保存细胞的流式细胞分析结果具有可比性,突出了这些质控细胞的可重复性和可靠性。
结论
我们开发并验证了一种可行可靠的方法,建立了冷冻保存的CAR/TCR t细胞库,用于流式细胞术质量控制,可作为CAR/TCR t细胞产品的在途和批量释放检测的质量控制标准。
简介
通过基因工程表达嵌合抗原受体(CAR)或t细胞受体(TCR)的t细胞已成为一种有前途的免疫治疗方法,用于治疗恶性血液病和某些类型的实体肿瘤[1,2].自2017年第一个抗CD19的CAR - t细胞产品被美国食品和药物管理局(FDA)批准用于治疗急性淋巴细胞白血病(ALL)以来,已经开发了更多针对CD19和其他抗原的CAR - t细胞产品[3.,4].目前,超过600个CAR/TCR t细胞临床试验正在进行中。
作为活性药物,临床级CAR/TCR t细胞产品的生产符合当前的良好生产规范(cGMP) [5].确保CAR/TCR t细胞产品的质量在生产过程的每一步都是至关重要的,包括用于CAR/TCR t细胞质量保证评估的流式细胞术[6,7,8].
基于流式细胞术的分析是CAR/TCR t细胞制造过程中分析、表征和评估细胞的稳健、高效和强大的工具[9].CAR/TCR t细胞的制造是一个复杂的过程,包括血液采集,然后是t细胞的选择、激活、载体转导和扩增[7,10].在此过程中,基于多参数流式细胞术的评价在监控生产步骤中发挥着重要作用,包括在程和批量放行产品测试[9].表达CD3 (t细胞)的细胞百分比,CD4/CD8 t细胞亚群组成和转导效率几乎总是使用流式细胞术测量。由于一些用于评估转导效率的流式细胞仪试剂与多种类型的CAR或TCR t细胞发生反应,因此制造多种基因工程t细胞产品的实验室可能需要在批量释放测试过程中包括一项检测,以确保在制造过程中使用了正确的载体[7,9].这种鉴定可以用分子测定法进行,但通常使用流式细胞术进行[8,11].所有这些参数都被认为是在将临床CAR/TCR t细胞注入患者之前评估其质量的关键标准。
由于所分析样品类型的巨大差异以及流式细胞术检测的主观性,因此建立标准或质量控制以评估结果并监测整个过程,包括样品制备、试剂质量、染色和仪器性能非常重要[12,13].更重要的是,标准或质量控制也确保了流式细胞术检测的准确性,这对于CAR/TCR t细胞最终产品的批量释放检测尤为关键[14].现成的流式细胞术标准可用于某些应用,如淋巴细胞免疫分型[15].这些标准可用于监测CAR/TCR-T细胞产品的部分在程和批量释放流式细胞仪检测。然而,CAR/TCR t细胞产品流式细胞术评估的标准还没有商业化,部分原因是CAR/TCR t细胞产品的种类繁多。
我们的机构符合gmp标准,生产用于I/II期临床试验的CAR/TCR t细胞产品,因此,我们有必要建立程序来生成内部冷冻保存的转导CAR/TCR t细胞最终产品,用于流式细胞仪质量控制并验证这些控制。为此,我们冷冻保存了两种代表性的CAR-T细胞产品和一种tcr工程t细胞产品。通过测量转导效率来评估低温保存的CAR/TCR t细胞对照细胞的长期稳定性及其解冻后的货架期,此外,对一个对照细胞进行了载体身份分析。使用冷冻保存质量对照的流式细胞术分析的敏感性也通过评估冷冻保存对照细胞与未转导细胞的连续稀释来确定。最后,我们比较了不同技术人员和不同仪器对这些冷冻质量控制的分析精度。因此,建立并验证了内部冷冻保存的CAR/TCR t细胞流式细胞仪质量控制。验证模式显示在附加文件中1:图S1。
材料与方法
CAR/TCR t细胞制造
两种CAR - t细胞产品(CD19/CD22双特异性CAR - t细胞和FGFR4 CAR - t细胞)和一种TCR工程t细胞产品(KK-LC-1 TCR t细胞)由NIH临床中心的细胞工程中心(CCE)使用其临床细胞治疗制造协议制造。简而言之,对于CD19/CD22双特异性CAR - t细胞和FGFR4 CAR - t细胞,通过单采法收集的自体外周血单个核细胞(pmcs)进行抗cd4 /CD8双阳性选择以进行t细胞富集,然后在自动化仪器中进行慢病毒转导和扩增(CliniMACS Prodigy, Miltenyi Biotech)。CAR - t细胞在第9天收获并冷冻保存。对于KK-LC-1 TCR工程t细胞,通过单采收集自体pmcs产物,并用编码识别KK-LC-1 TCR的逆转录病毒载体转染。细胞在第15天进行扩增和冷冻保存。
低温保存和解冻
最终CAR/TCR-T细胞产物用coolCell冷冻保存®无酒精冷冻容器与CS10 (biife溶液)和4%人血清白蛋白(HSA)血浆- lyte A按1:1的比例作为冷冻保护剂。这些细胞被冷冻保存在小瓶中,每个小瓶中含有大约5-10万个细胞。冷冻保存的小瓶储存在液氮罐中。使用ThawSTAR CFT2 (Biolife溶液)解冻细胞,并通过离心去除冷冻保护剂后重新悬浮在HBSS中。采用Cellometer AUTO 2000 (Nexcelom Bioscience),吖啶橙/碘化丙啶(AO/PI)染色法测定解冻后存活细胞的浓度。
流式细胞分析
流式细胞分析用100万个细胞进行染色。用荧光染色标记的抗人CD3、CD4、CD8和CD45抗体(Abs)以及活性染料7-AAD (BD生物科学)对样本进行染色,以评估活性和CD4/CD8 T细胞频率。此外,对于CD19/CD22双特异性CAR - t细胞,分别用纯化的protein-L (ThermoFisher Scientific)、CD22- fc(重组人siglec2,研发系统)和CD19- fc (CD19 CAR检测试剂,人,Biotin, Miltenyi Biotec)对样品进行染色,以确定转导效率和识别度,然后用相应的次级抗体:荧光标记抗蛋白L次级Ab (ThermoFisher Scientific)、抗人IgG次级Ab或链霉亲和素。对于FGFR4 CAR - t细胞和KK-LC-1 TCR t细胞,分别用荧光染色标记的抗人EGFR Ab (BioLegend)或抗小鼠TCR beta Ab (ThermoFisher Scientific)对样品进行染色,以确定FGFR4 CAR - t细胞和KK-LC-1 TCR t细胞的转译效率。在4°C孵育20分钟后,样品在BD FACS™Lyse Wash Assistant (LWA)上洗涤,然后在BD FACSCanto II和BD FACSCanto 10-Color (BD Biosciences)上采集。每个样本总共收集了3万个事件。使用BD FACSDiva™软件和FlowJo软件(BD Biosciences)分析数据。简而言之,可存活的CD3+细胞数量由7-AAD控制−单线细胞数量,然后是CD4+/ CD8+进一步分析细胞以及表达转导效率和/或识别标记的细胞。采用荧光减1 (FMO)法对各转导效率和识别标记进行对照,确定解冻质控细胞转导效率和识别标记的阳性闸门。
低温保存CAR/TCR t细胞流式细胞术质控细胞的长期稳定性
将冷冻保存的CAR/TCR t细胞流式细胞仪质控细胞在液氮中保存不同时间(2周、1个月、2个月、3个月、6个月、9个月和12个月)后解冻。每个时间点至少解冻两瓶冷冻质量控制细胞。样品立即用表面标记物和活性染料7-AAD染色。流式细胞术检测细胞活力、CD3百分比、CD4/CD8组成、转导效率和鉴别性。
解冻后CAR/TCR t细胞流式细胞仪质控细胞的稳定性
冷冻保存的CAR/TCR t细胞流式细胞仪质控细胞在离心去除冷冻保护剂后,解冻并重悬于HBSS中。室温保存,解冻后0 h、2 h、4 h、6 h染色。流式细胞术检测细胞活力、CD3百分比、CD4/CD8组成、转导效率和鉴别性。进行了两项独立实验,以确定质控细胞的解冻后货架寿命。
CAR/TCR t细胞流式细胞术质量控制细胞流式细胞术敏感性评估
将冷冻保存的CAR/TCR t细胞流式细胞仪质控细胞解冻,并与相应的未转导细胞按顺序稀释(1:1、1:2、1:4、1:8、1:16和1:32)混合。采用流式细胞仪检测转导效率和同源性,确定定量下限和表达线性度。我们进行了两个独立的实验来评估使用这些质量控制细胞的流式细胞术的敏感性。
CAR/TCR t细胞流式细胞术质量控制细胞流式细胞术测定精度的评估
冷冻保存的CAR/TCR t细胞流式细胞仪质量控制由两名实验室工作人员解冻和染色,或在两台流式细胞仪(BD FACSCanto II和BD FACSCanto 10-Color)上测量和分析一个染色样品。如上所述,在为期一年的长期稳定性研究中,技术人员和仪器之间的精度分析在所有时间点进行。采用流式细胞术检测并比较转导效率和鉴定标记的表达。
统计分析
除非另有说明,所有定量数据均以均数±标准差(SD)表示。方差系数(CV)也计算出来并列在补充表中。敏感性研究采用Pearson相关系数统计。p值小于0.05被认为是显著的。采用GraphPad Prism软件和R软件包进行统计分析。
结果
CAR/TCR t细胞流式细胞术质控细胞的生成
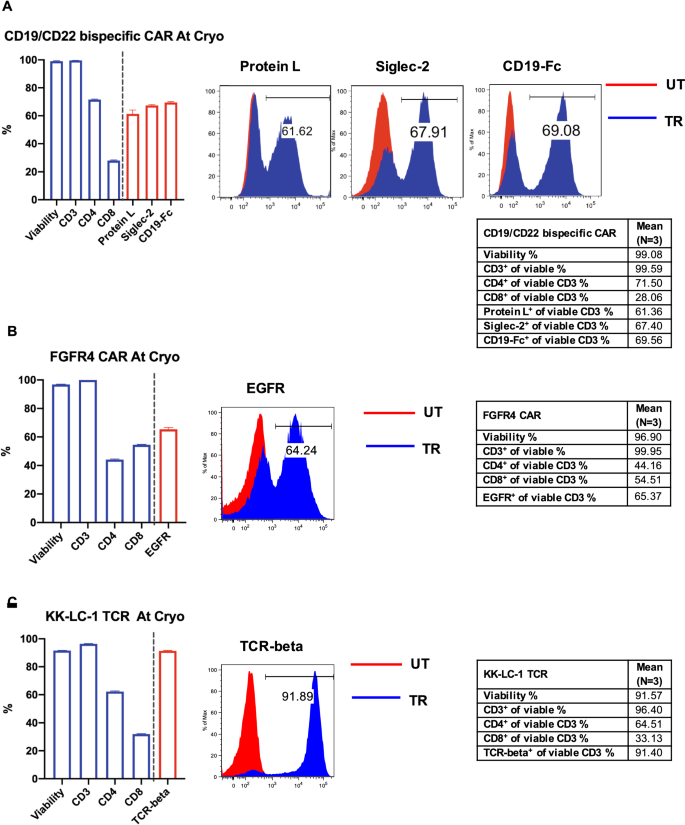
两种CAR - t细胞产品:CD19/CD22双特异性CAR - t细胞和FGFR4 CAR - t细胞和一种TCR工程t细胞产品:KK-LC-1 TCR- t细胞在CCE, NIH临床中心制造。在培养结束时收集细胞,用流式细胞仪对其进行三次特征评估,包括活力、CD3百分比+, CD4+和CD8+t细胞组成,以及转导效率和/或身份表达。附加文件显示了CD19/CD22双特异性CAR - t细胞上蛋白L表达的门控策略1以图S2为例,其中蛋白质L .+细胞群由活的CD3组成+细胞。
新鲜对照细胞通过7-AAD染色流式细胞术分析细胞活力。如图所示。1A-C,新鲜CAR/TCR t细胞质控细胞存活率超过90%,与Cellometer AUTO 2000 AO/PI存活率测定结果一致(数据未显示)。不出所料,主要是CD3+细胞和CD3+T细胞,主要是CD4+和CD8+细胞。
CAR/TCR t细胞流式细胞术质控细胞的生成。细胞来自两种CAR - t细胞:CD19/CD22双特异性CAR - t细胞(一个)和FGFR4 CAR - t细胞(B)和一种TCR工程t细胞产品:KK-LC-1 TCR t细胞(C)被收获并染色。流式细胞仪检测细胞活力;CD3、CD4和CD8频率;CAR/TCR t细胞标记物的表达:蛋白L、CD22- fc (sigle2)和CD19- fc用于CD19/CD22双特异性CAR - t细胞,EGFR用于FGFR4 CAR - t细胞,小鼠TCR-beta用于KK-LC-1 TCR- t细胞。数据以平均值±标准差表示。具有代表性的流式细胞仪直方图以活CD3为门控+L蛋白CD22-Fc (sigle -2)、CD19-Fc (一个),用于表皮生长因子受体(B)和小鼠TCR-beta (C).流式细胞仪直方图中未转导(UT)细胞的分析结果为红色,转导(TR)细胞为蓝色。每个表中总结了三个质量控制单元的每个参数的平均值
对于CD19/CD22双特异性CAR - t细胞,活CD3的转导效率+通过检测L蛋白的表达来评估t细胞,通过CD22-Fc (sigle -2)和CD19-Fc的表达来检测CAR - t细胞的身份。蛋白L是一种免疫球蛋白(Ig)结合蛋白,与Ig的可变轻链(kappa链)结合。它是检测CAR表达的常用标记物,常用于测定CAR- t细胞产物的转导效率[16].对于CAR-T细胞身份检测,针对单个CAR-T细胞的特异性标记被用于检测。在本研究中,CD19/CD22双特异性CAR - t细胞与蛋白L结合的百分比为61.36%±2.80%。双特异性CAR - t细胞与CD22-Fc (sigle -2)和CD19-Fc反应的比例分别为67.40%±0.60%和69.56%±0.46%(图2)。1A).由于FGFR4型CAR - t细胞在构建物中含有截断的EGFR (EGFRt),因此EGFR的表达被用来确定转导效率。CD3存活的百分比+表达EGFR的FGFR4 CAR - T细胞中,T细胞占65.37%±1.27%。1B).对于KK-LC-1 TCR t细胞产品,使用小鼠TCR-beta的表达来评估转导效率。可活CD3的百分比+表达小鼠tcr - β的t细胞为91.40%±0.37%。1C).附加文件中总结了各CAR/TCR t细胞流式细胞术低温保存质量控制的特点2:表S1。
CAR/TCR t细胞冷冻保存并储存在液氮中。这些冷冻保存的细胞被评估用于内部CAR/TCR t细胞流式细胞术质量控制。
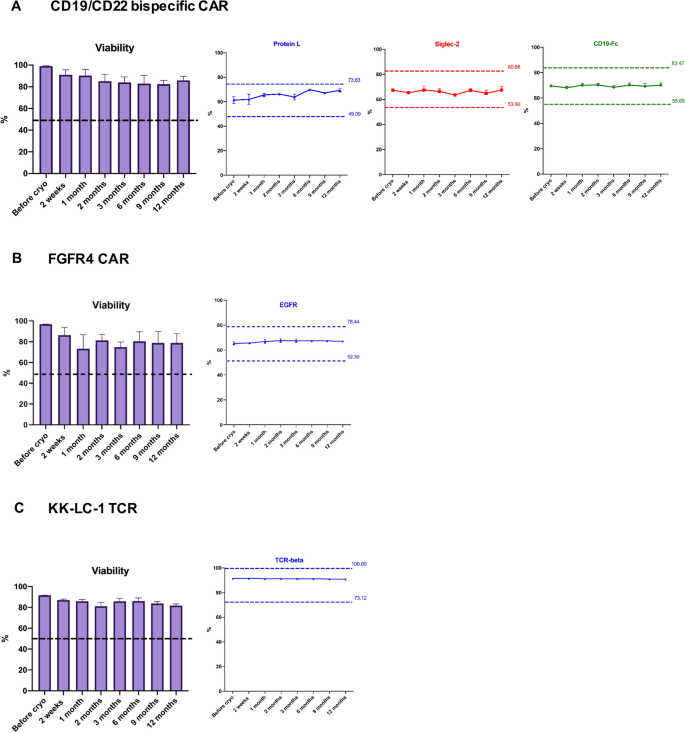
低温保存CAR/TCR t细胞流式细胞仪质控细胞的长期稳定性评价(闭瓶稳定性)
长期稳定性是质量控制单元的关键质量特性。冷冻保存的流式细胞术检测质量控制细胞的长期稳定性是通过测量细胞在长期存储中产生可重复和一致的流式细胞分析结果的能力来确定的。虽然众所周知,冷冻保存的细胞储存在液氮中可以维持多年[17],关于冷冻保存CAR - t细胞产物的寿命和其细胞表面标记物表达稳定性的报道很少。因此,我们试图通过流式细胞术测定冷冻保存的CAR/TCR t细胞对照的长期稳定性。我们在流式细胞仪测定稳定性的研究中使用的标准是比较解冻后流式细胞仪测量的参数与冷冻保存时测量的参数。根据我单位现行的解冻后质量控制(PTQC)标准操作程序(SOP),如果从解冻细胞中获得的值在低温保存时测量值的±20%范围内,则认为细胞是稳定的。如果上界(低温保存值(低温值)+低温值X 20%)超过100,则100%为临界值。此外,通过7-AAD染色的流式细胞术分析,解冻细胞的存活率要求在50%以上。
分别于低温保存后2周、1个月、2个月、3个月、6个月、9个月和12个月解冻细胞。细胞活力和CD3+, CD4+和CD8+通过流式细胞分析确定t细胞频率和转导效率,以及双特异性CD19/CD22 CAR - t细胞的身份。如图所示。27-AAD染色和AO/PI活性染色(数据未显示)显示,所有被测样品在各时间点的活性均超过50%。我们观察到冷冻保存的FGFR4 CAR - T细胞和KK-LC-1 TCR T细胞在解冻后分别表达了相似水平的EGFR或小鼠TCR- β,但与冷冻保存时相比,解冻后CD19/CD22双特异性T细胞上的转导效率和识别标记的表达略有不同。尽管如此,在12个月的时间里,所有三种产品的测试小瓶的值都保持在低温保存时测量值的±20%以内(图2)。2A-C),表明这些冷冻保存的细胞至少可以稳定一年。附加文件中总结了12个月期间每个参数的平均值、SD和CV以及每个对照细胞的通过标准2:表S2。总的来说,我们的研究结果表明,我们用于建立流式细胞术检测的长期质量控制方法,包括CAR/TCR t细胞的冷冻保存和解冻是有效、可靠和可行的。
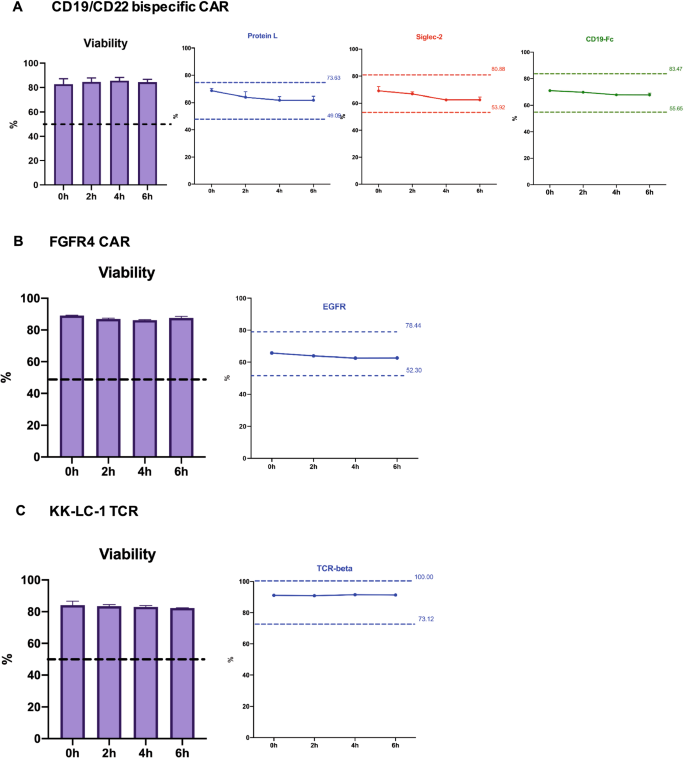
解冻CAR/TCR t细胞流式细胞术质控细胞保质期的测定(开瓶稳定性)
通过研究闭瓶稳定性来评价冷冻保存细胞的长期稳定性。确定冷冻保存的CAR/TCR t细胞的解冻后保质期也很重要,这被称为开瓶稳定性。冷冻保存的3个CAR/TCR t细胞质量对照按上述方法解冻,室温保存,流式细胞术评估。分别于解冻后0 h、2 h、4 h、6 h染色。流式细胞术检测细胞活力、转导效率和表达该标记物的细胞比例。在三个低温保存质量控制中,解冻细胞的活力没有下降超过6小时,这表明低温保存的CAR/TCR t细胞在室温解冻后至少6小时仍保持活力(图2)。3.a - c)。更重要的是,三种低温保存产物的转导效率和身份标记体的表达水平与低温保存时的测量值在±20%以内。所有三种类型的对照细胞都通过了上述标准,尽管与0小时相比,两种CAR-T对照细胞产物的值在稍后的时间点略有下降(图2)。3.a - c)。附加文件中总结了所有三个质量控制细胞在每个时间点的转导效率和身份标记的活力和表达水平2:表S3。因此,我们得出结论,冷冻保存的CAR/TCR t细胞在解冻后至少可以使用6小时。
冷冻保存的CAR/TCR t细胞流式细胞仪保质期的测定,质量控制解冻后(开瓶稳定性)。将冷冻保存的流式细胞仪质控细胞解冻,室温保存。分别于解冻后0 h、2 h、4 h、6 h染色。流式细胞术用于评估细胞活力和表面CAR/TCR标记物的表达:蛋白L, CD22- fc (Siglec-2)和CD19- fc用于CD19/CD22双特异性CAR- t细胞(一个), EGFR用于FGFR4 CAR - T细胞(B)和小鼠TCR-beta检测KK-LC-1 TCR t细胞(C).数据以平均值±标准差表示。上下边界(冷冻保存时测量值的±20%范围)也显示在每个图中。数据代表两个独立实验,结果相似。对于CD19/CD22双特异性CAR - t细胞和KK-LC-1 TCR t细胞,研究分为三次进行。对于FGFR4 CAR - t细胞,这项研究是重复进行的
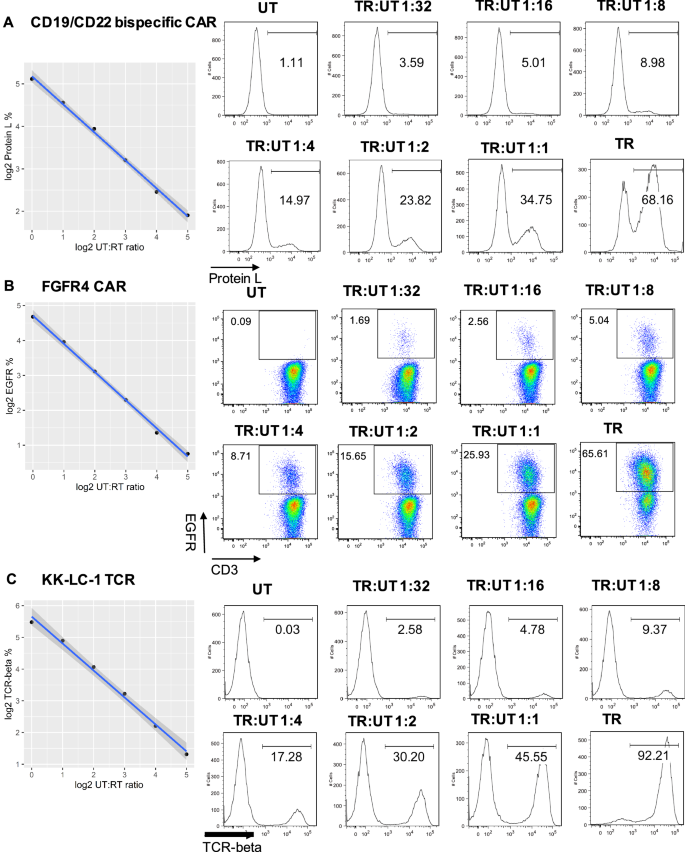
使用冷冻保存的CAR/TCR t细胞流式细胞仪质量控制细胞进行流式细胞仪检测的敏感性
为了确定冷冻保存的CAR/TCR t细胞质量控制细胞的流式细胞术检测的动态检测范围,我们将对照细胞与相应的未转导细胞进行连续稀释。本研究确定了转导效率和鉴定标记的定量下限和表达线性度。如图所示。4A-C, y轴显示为转导效率和识别标记的百分比的Log2,包括CD19/CD22双特异性CAR - t细胞的蛋白L表达,FGFR4 CAR - t细胞的EGFR表达以及KK-LC-1 TCR-T细胞的小鼠TCR-beta表达。x轴显示为稀释因子的Log2。Pearson相关系数(r)采用r包计算。转导效率的表达水平与稀释因子之间存在很强的相关性(CD19/CD22双特异性CAR - t细胞r =−0.9987,FGFR4 CAR - t细胞r =−0.9988,KK-LC-1 TCR-T细胞r =−0.9970;P值均小于0.001)。本研究的最低检测限为1:32稀释。附加文件中总结了三个质控细胞在各稀释因子下转导效率和识别标记的平均值和标准差,以及r值和p值2:表S4。这些结果表明,使用冷冻保存的CAR/TCR t细胞对照的流式细胞仪检测是敏感和可靠的。
使用冷冻保存的CAR/TCR t细胞流式细胞仪质量控制时检测敏感性的检查。将冷冻保存的流式细胞仪质控细胞与相应的未转导(UT)细胞(1:1、1:2、1:4、1:8、1:16和1:32)依次解冻稀释。CD19/CD22双特异性CAR-T细胞转导效率和识别标记的表达:蛋白L、CD22- fc (sigle -2)和CD19- fc (一个), EGFR用于FGFR4 CAR - t细胞(B)和小鼠TCR-beta检测KK-LC-1 TCR t细胞(C)用流式细胞仪检测。数据显示为转导效率和同一性百分比的Log2与稀释因子Log2的相关性。具有代表性的L蛋白的流式细胞仪直方图(一个), egfr (B)及TCR-beta (C)在可行的CD3上被门控+细胞。数据代表两个独立实验,结果相似。对于CD19/CD22双特异性CAR - t细胞,研究分为三次进行。对于FGFR4 CAR - t细胞和KK-LC-1 TCR t细胞,这项研究是重复进行的
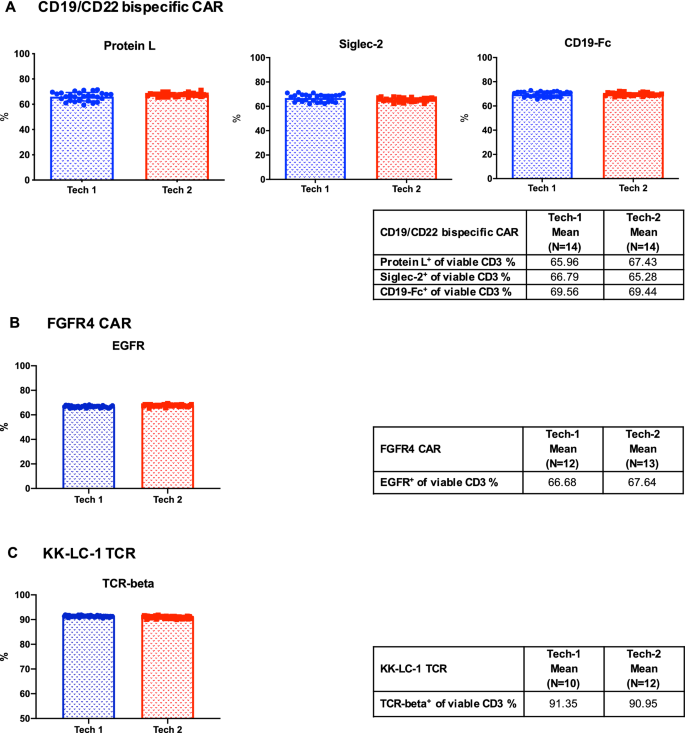
使用冷冻保存的CAR/TCR t细胞流式细胞仪质量控制细胞对检测实验室工作人员进行流式细胞仪检测精度的评估
用于流式细胞术的质控细胞评估的关键步骤是确定它们是否在工作人员之间生成一致、可靠和准确的流式细胞术数据。因此,我们首先评估了这些冷冻保存的对照细胞在不同实验室工作人员中的重复性。两名实验室技术人员在一年内的所有时间点对来自三个CAR/TCR t细胞对照组的冷冻保存细胞进行解冻和染色。流式细胞术检测表达转导效率和识别标记的细胞的活力和百分比。两名技术人员测量的解冻后活力均超过50%(数据未显示)。此外,三个CAR/TCR t细胞对照的转导效率和识别标记的百分比都通过了两位技术人员测量的±20%范围标准(图2)。5a - c)。结果总结在附加文件中2:表S5包括两名技术人员之间各参数的均值、标准差和CV。在我们的研究中,当CV小于5%时,认为值具有可比性。因此,这些结果表明,技术人员使用这些质量控制细胞的流式细胞术检测结果是可重复和可靠的。
低温保存CAR/TCR t细胞流式细胞仪质量控制对实验室工作人员检测精度的评估。在上述为期一年的长期稳定性研究中,由两名实验室技术人员在所有时间点对冷冻保存的流式细胞仪质控细胞进行解冻和染色。细胞活力以及以下CAR和TCR工程t细胞表面标志物的表达:蛋白L, CD22- fc (Siglec-2)和CD19- fc用于CD19/CD22双特异性CAR - t细胞(一个), EGFR用于FGFR4 CAR - t细胞(B)和小鼠TCR-beta检测KK-LC-1 TCR t细胞(C)用流式细胞仪检测。数据以平均值±标准差表示。各质控细胞在Tech-1和Tech-2之间的转导效率和识别标记的平均值汇总在各表中
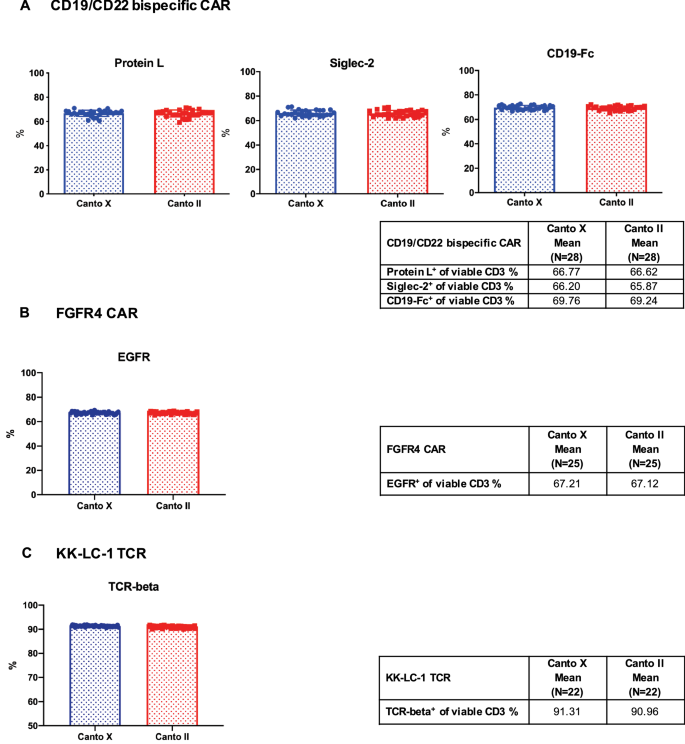
使用冷冻保存的CAR/TCR t细胞流式细胞仪质量控制细胞对流式细胞仪检测的精度进行检查
除了在实验室技术人员之间比较分析的再现性,我们还检查了低温保存质量控制细胞在不同仪器上的性能。使用BD FACSCanto II(第二章)和BD FACSCanto 10-Color(第十章)仪器测量并比较了在超过1年的所有时间点上,三种冷冻保存的CAR/TCR t细胞产品上表达转导效率和身份标记的细胞百分比。如图所示。6A-C,两种仪器之间表达转导效率和身份标记的细胞百分比相当(所有测试参数的CV均小于5%),这表明使用这些冷冻保存的对照细胞的流式细胞术测定的准确性不依赖于仪器类型。附加文件中列出了两种仪器之间各参数的平均值、SD和CV2:表S6。
低温保存CAR/TCR t细胞流式细胞术质量控制仪器检测精度的检查。在上述为期一年的长期稳定性研究中,冷冻保存的流式细胞仪质控细胞在两种流式仪器上进行解冻、染色和测量:BD FACSCanto II(第二章)和BD FACSCanto 10-Color(第十章)。这两种仪器都用于评估细胞活力以及以下CAR和TCR工程t细胞表面标志物的表达:蛋白L, CD22- fc (Siglec-2)和CD19- fc用于CD19/CD22双特异性CAR - t细胞(一个), EGFR用于FGFR4 CAR - t细胞(B)和小鼠TCR-beta检测KK-LC-1 TCR t细胞(C).数据以平均值±标准差表示。每个表中总结了第二章和第十章之间各质控细胞的转导效率和识别标记的平均值
讨论
在这项研究中,我们对从两种CAR-T细胞产品和一种TCR工程t细胞产品中获得的冷冻保存的基因工程t细胞流式细胞术质量控制进行了纵向研究。解冻后,这些质控细胞在12个月的时间内以及不同实验室人员和不同仪器之间提供了一致、稳定和准确的流式细胞仪数据。我们还发现,冷冻保存的质控细胞产生了敏感的流式细胞术检测结果,细胞在解冻后6 h稳定。因此,我们开发了一种可靠可行的方法来建立内部冷冻保存的CAR/TCR-T细胞流式细胞仪质量控制并对这些细胞进行验证。
在制造过程中,使用基因工程t细胞流式细胞仪质量控制来评估CAR - t细胞和tcr工程t细胞对于保持符合cGMP法规是至关重要的,特别是对于批量释放测试[14].质量控制细胞与患者样本一起解冻和染色。如果来自质量控制细胞的值在建立的范围内,并且其活力保持在50%以上,则认为该测定有效,并且测试临床CAR - T或TCR工程T细胞产品的流式细胞术结果是准确的,并且可以释放产品进行新鲜输注或冷冻保存。
在本研究中,我们内部CAR/TCR-T细胞流式细胞仪质量控制的通过标准包括:(1)表达转导效率和载体识别标记的细胞百分比在冷冻保存时测量值的±20%范围内;(2)经7-AAD染色流式细胞术检测,解冻后细胞活力超过50%。这些标准采用了本机构建立的解冻后细胞质量控制SOP。如果冷冻保存的对照细胞在解冻后通过了这两个标准,我们认为细胞是稳定的。我们进行了为期一年的纵向研究。我们的研究结果表明,内部冷冻保存的对照细胞保持稳定至少1年,尽管解冻细胞的一些表面标记的表达低于新鲜细胞。这可能是由于低温保存和解冻过程对CAR表达的影响。然而,一年的稳定性分析对于质量控制产品来说可能太短了,我们正在继续检查这些细胞的长期稳定性。
我们还调查了我们内部冷冻保存流量质量控制的解冻后保质期。我们发现冷冻保存的细胞在解冻后在室温下稳定至少6小时。在我们机构,标准做法是在解冻后4小时内注入细胞产品,并在室温下储存。因此,我们采用相同的解冻后存储条件进行内部低温保存流动质量控制,但将存储时间延长至解冻后6小时。如果将这些细胞放在冰上或4摄氏度的温度下,它们在解冻后的保质期可能会更长。
为了确定内部冷冻保存的CAR/TCR t细胞质量控制的敏感性,我们通过将对照细胞与相应的未转导细胞进行连续稀释,评估了转导效率和载体识别标记的量化和线性表达的最低限度。转导效率的表达与稀释因子之间有很强的相关性,这表明我们内部冷冻保存的CAR/TCR t细胞对照对流式细胞仪检测是敏感和可靠的。本研究的最低检测限为1:32稀释。我们可能会对FGFR4 CAR - t细胞和KK-LC-1 TCR t细胞对照组进行进一步稀释,因为我们仍然能够检测到EGFR和TCR-beta的表达,稀释系数为1:32,与未转译细胞的值进行比较。
为了评估我们冷冻保存的基因工程t细胞流式细胞仪质量控制的质量,我们在实验室工作人员中进行了精度评估。虽然两名工作人员测量的部分CAR - t细胞标记物的百分比略有差异,但流式细胞术结果一致(两名工作人员的CV均小于5%)且可靠。两名工作人员检查的参数均通过验收标准。然而,这项研究仅在我们的实验室进行。如果细胞被用作多个实验室的通用标准,实验室间的差异应在未来的研究中考虑和评估。
我们还通过测量和比较我们实验室BD Canto II和BD Canto X仪器上的转导效率和载体身份,评估了低温保存阳性细胞在不同仪器上的性能。BD Canto II可以检测多达八个荧光标记与三个激光配置。常用于临床流式细胞仪实验室。BD Canto X是一种新的模型,可以检查多达十种荧光色素。结果表明,两种BD流式细胞仪检测结果无明显差异。然而,这两种仪器属于同一个供应商,它们共享相同的系统和软件用于样本收集。因此,在未来的验证计划中应包括来自不同厂商的仪器或同一厂商的不同型号。
最后,我们以两种CAR - t细胞产品和一种tcr工程t细胞产品为例,建立和验证了生产和使用冷冻保存的基因工程t细胞作为流式细胞术质量控制的程序。然而,各种各样的CAR - t细胞和tcr工程t细胞产品正在临床试验中使用,一般来说,每种CAR/TCR-T细胞产品需要不同的标记物进行流式细胞术评估转导效率和身份检测,每种工程t细胞将需要一个独特的质量控制细胞。虽然我们的研究仅提供了一种验证方案,以开发三种特定的冷冻保存CAR/TCR-T细胞流式细胞术质量控制,但对于其他CAR - t细胞和tcr工程t细胞产品,可能需要建立个性化的方案。
结论
我们开发了一个可行和可靠的程序来建立和验证冷冻保存的CAR/TCR-T细胞流式细胞仪质量控制,该方法可以作为临床CAR - t细胞和tcr工程细胞产品的在程和批量释放检测的检测质量控制。
数据和材料的可用性
不适用。
参考文献
June CH,等。CAR - T细胞免疫治疗人类癌症。科学。2018;359(6382):1361 - 5。
拉森RC,老鼠MV。CAR - T细胞的机制和功能的最新进展和发现。中华癌症杂志,2021;21(3):145-61。
O 'Leary MC等人。FDA批准摘要:tisagenlecleucel用于治疗复发或难治性b细胞前体急性淋巴细胞白血病患者。临床癌症杂志2019;25(4):1142-6。
Neelapu SS,等。Axicabtagene ciloleucel CAR - t细胞治疗难治性大b细胞淋巴瘤。中华实用医学杂志,2017;26(3):344 - 344。
Gee AP. GMP CAR-T细胞生产。中国临床血液学杂志。2018;31(2):126-34。
Campbell JDM, Fraser AR.用于细胞疗法鉴别、安全性和效力的流式细胞术分析。中国生物医学工程杂志,2018;44(5):569-79。
Reddy OL, Stroncek DF, Panch SR.通过优化关键质量属性改进CAR - T细胞治疗。中国血液病杂志,2020;57(2):33-8。
Demaret J,等。使用流式细胞仪监测CAR - t细胞。中国生物医学工程学报。2010;21(2):319 - 319。
Sarikonda G,等。用于嵌合抗原受体T细胞分析的流式细胞术方法的开发、分析验证和临床实施的最佳实践。中国生物医学工程学报。2010;21(1):489 - 497。
Vormittag P,等人。CAR - T细胞疗法的制造指南。生物技术,2018;53:164-81。
卢A,等。液滴数字PCR技术在临床CAR/TCR T细胞产物中检测载体拷贝数的应用中华医学杂志2020;18(1):191。
王玲,Hoffman RA。流式细胞仪的标准化、校准和控制。Curr Protoc Cytom, 2017;79:1.3.1-1.3.27。
欧文斯MA,等。临床流式细胞术免疫分型的验证与质量控制。中华免疫杂志2000;43(1-2):33-50。
FDA,美国,工业生物分析方法验证指南,C.f.D.E.a.R.C.f.V Medicine,编辑,2018。
Nicholson JK, Hubbard M, Dawson CD.稳定全血控制材料对淋巴细胞免疫分型的评价。血细胞计数。1999;38(6):268 - 73。
郑铮,Chinnasamy N, Morgan RA。蛋白L:一种用于流式细胞术检测嵌合抗原受体(CAR)表达的新试剂。中华医学杂志,2012;10:29。
Kapoore RV,等。低温保存对一种工业藻类活力和功能稳定性的影响。科学通报2019;9(1):2093。
确认
我们感谢美国国立卫生研究院临床中心输血医学和细胞工程部门细胞工程中心的工作人员在样品制备方面的帮助。我们也感谢NCI成员,特别是Javed Khan博士、Nirali Shah博士和Scott Norberg博士,他们愿意分别分享FGFR4 CAR慢病毒载体、CD19/22 CAR慢病毒载体和KK-LC-1 TCR逆转录病毒载体。
资金
由美国国立卫生研究院(NIH)提供的开放获取资金。该项目由美国国立卫生研究院临床中心的校内研究计划资助。
作者信息
作者及隶属关系
贡献
PJ和DFS对研究进行了概念化和设计。YC和MP进行研究并分析数据。HWS, JJ, LM, NG和SLH制造CAR/TCR-T细胞产品用于研究。PJ, YC和DFS起草了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
发表同意书
不适用。
相互竞争的利益
作者没有竞争利益需要声明。
伦理批准
该研究得到了NH机构审查委员会(IRB)的批准。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
内部冷冻保存CAR/TCR t细胞流式细胞仪质量控制验证方案。CAR/TCR-T细胞产品在NIH临床中心的细胞工程中心(CCE)制造。在培养结束时收集细胞,冷冻保存并储存在液氮中。图中显示了低温保存CAR/TCR-T细胞流式细胞术质量控制的验证流程,包括:1. CAR/TCR-T细胞流式细胞术质量控制。长期稳定性(闭瓶稳定性);2.解冻后保质期(开瓶稳定性);3.灵敏度测定;4. The precision analysis among different technicians and different instruments. The passing criteria used in the study included: 1. The percentage of cells expressing transduction efficiency and vector identity markers was within ± 20% range of values measured at time of cryopreservation; 2. The post-thaw cell viability was over 50% as measured by flow cytometric analysis via 7-AAD staining.图S2:CD19/CD22双特异性CAR-T产物中蛋白L表达的门控策略活细胞(7-AAD阴性群体)首先从CD19/CD22双特异性CAR转导(TR)细胞的单链中被门控。CD3+然后对细胞进行门控并分析CD4+/ CD8+以及蛋白L的表达。同时对未转导的细胞进行染色,并用于鉴定蛋白L+TR细胞的居群。
附加文件2。
表S1:CD19/CD22双特异性CAR - t细胞/FGFR4 CAR - t细胞/KK-LC-1 TCR t细胞流式细胞术低温保存质量控制细胞特征总结表S2:CD19/CD22双特异性CAR -t细胞/FGFR4 CAR -t细胞/KK-LC-1 TCR t细胞流式细胞术质控细胞解冻后(长期稳定)特征总结。表S3:CD19/CD22双特异性CAR -t细胞/FGFR4 CAR -t细胞/KK-LC-1 TCR t细胞流式细胞仪质控细胞解冻后0小时、2小时、4小时和6小时(货架期)的特征总结。表S4:各稀释因子下CD19/CD22双特异性CAR -t细胞/FGFR4 CAR -t细胞/KK-LC-1 TCR t细胞流式细胞术质控细胞解冻后转导效率和鉴定标记的百分比总结。表S5:两技术人员对CD19/CD22双特异性CAR -t细胞/FGFR4 CAR -t细胞/KK-LC-1 TCR t细胞流式细胞术质控细胞解冻后的特点总结表S6:两种仪器解冻后CD19/CD22双特异性CAR -t细胞/FGFR4 CAR -t细胞/KK-LC-1 TCR t细胞流式细胞仪质控细胞的特征总结
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
蔡勇,普罗查兹科娃,M,蒋,C。et al。内部冷冻保存CAR/TCR-T细胞流式细胞仪质量控制的建立与验证。翻译医学杂志19, 523(2021)。https://doi.org/10.1186/s12967-021-03193-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-021-03193-7
关键字
- 基于多参数流式细胞术的检测
- 质量控制
- 嵌合抗原受体(CAR) t细胞
- t细胞受体(TCR)工程t细胞
- 细胞癌免疫治疗