摘要
背景
CAR - t细胞疗法最近被发现是血液系统恶性肿瘤中最有前途的癌症疗法之一。然而,实体肿瘤建立了一道强大的防线,以逃避CAR - t细胞的免疫监视。其中,IL-10和tgf - β等对免疫系统有抑制作用的细胞因子非常重要:tgf - β是一种多效性细胞因子,能有效抑制免疫系统,由TME常驻细胞和肿瘤细胞分泌。
方法
在这项研究中,我们假设敲除TGFβ受体II基因可以改善CAR - t细胞在体外和体内的功能。在此,我们利用CRISPR/Cas9系统敲除t细胞中的TGFβRII基因,并通过基因组分析技术监测基因敲除的效率。接下来,通过IVT-RNA电穿孔或逆转录病毒转导过表达间皮素或Claudin 6特异性CAR - t细胞,评估这些TGFβRII KO CAR - t细胞在增殖、细胞因子分泌和细胞毒性方面的多功能性,并与亲本CAR - t细胞进行比较。
结果
我们的实验表明,TGFβ rii KO CAR - t细胞完全保留了其杀死肿瘤抗原阳性靶细胞的能力,更有趣的是,在体外实验中,它可以抵抗外源性TGFβ的抗增殖作用,优于野生型CAR - t细胞。值得注意的是,没有记录到这些TGFβRII KO CAR - t细胞不依赖抗原或生长因子的增殖。TGFβRII KO CAR - t细胞在体外也更大程度地抵抗诱导的调节性t细胞的抑制作用。重复抗原刺激表明,与WT相比,这些TGFβRII KO CAR - t细胞将经历更少的激活诱导的衰竭。
结论
tgf - β rii KO方法可能成为实体瘤免疫治疗中不可或缺的工具,因为它可能超越t细胞中的一个关键负性调控信号通路。
背景
抗原受体修饰t细胞的过继细胞转移是一种有前途的治疗癌症的新工具。除了用肿瘤特异性t细胞受体(TCRs)修饰t细胞外,基于嵌合抗原受体(CAR)的疗法已成为治疗几种不同肿瘤实体的重点。CAR - t细胞疗法被认为是难治性恶性血液病最有前途的癌症疗法之一。该系统将单克隆抗体高效、敏感、不依赖hla的抗原识别特性与t细胞杀伤机制相结合的创新理念,使得该系统在追踪和根除肿瘤细胞方面表现非凡[1],该药物已被临床批准用于B细胞恶性肿瘤等“液体”肿瘤患者[2,3.].然而,另一类恶性肿瘤,实体肿瘤,有多方面的策略来逃避CAR - t细胞的杀伤,这些包括但不限于肿瘤细胞上缺乏肿瘤特异性抗原,对t细胞运输和渗透到被包裹的肿瘤造成障碍,最主要的特征是敌对的,免疫抑制肿瘤微环境(TME)以及t细胞固有的反调节机制[4].
TGFβ是TME中最关键的调节因子之一,已知由许多癌细胞如卵巢癌细胞或免疫系统和基质细胞分泌[5].该细胞因子是一种多效性细胞因子,可调节细胞入侵、抑制宿主免疫监视和调节性t细胞分化的免疫调节以及微环境修饰等过程,共同导致肿瘤进展[6,7].因此,抑制TGFβ信号有可能抵消免疫抑制环境和增强CAR - t细胞效应功能。TGFβ与TGβRII结合后,TGβRI被募集、磷酸化并被激活磷酸化下游介质Smad2和Smad3,它们进一步与Smad4偶联,后者随后转移到细胞核,并调节一些基因的转录,如参与凋亡、细胞外基质新生和免疫抑制的基因[8].由于TGFβ rii是TGFβ信号级联中的起始受体,目前还未检测到其亚型,因此靶向TGFβ rii比靶向TGFβ ri更为合理。已有研究表明,通过过表达显性阴性的TGFβ rii抑制TGFβ信号,可以积极改善t细胞和CAR - t细胞的抗肿瘤功能,并与WT相竞争[9,10].此外,一项临床试验(ClinicalTrials.gov: NCT03089203)测试了dn TGFβRII在前列腺特异性膜抗原(PSMA)特异性CAR - t细胞中的安全性和有效性,最近报道了复发和难治性转移性前列腺癌[11].所有这些数据都表明,利用CRISPR/Cas9技术敲除内源性TGFβRII表达,生成抗tgf β的工程CAR - t细胞,以应对肿瘤内的免疫抑制环境,可能是一种有方法的改进。
为了解决CRISPR/ cas9驱动的TGFβRII KO CAR - t细胞在实体肿瘤中的治疗问题,本研究使用了两种在正常组织中不表达或很少表达的癌症相关抗原。Claudin 6 (CLDN6)是一种癌胎紧密连接蛋白,常在多种人类实体癌症如卵巢癌细胞上表达[12,13].另一种肿瘤抗原取自间皮素(MSLN),这是一种糖基磷脂酰肌醇锚定的细胞表面蛋白,在正常间皮细胞上低水平表达[14].然而,它在包括卵巢癌在内的多种上皮性癌组织中大量过表达[15].
在目前的研究中,我们假设MSLN或CLDN6 CAR特异性t细胞和TGFβRII敲除的组合,即使在体外应用的免疫抑制条件下,也会释放CAR - t细胞功能。利用CRISPR/Cas9基因组编辑系统,我们成功地消除了人CD4和CD8 t细胞中TGFβ受体II的表达。通过电穿孔体外转录RNA (IVT RNA)或逆转录病毒转导将CAR编码区引入TGFβ rii KO t细胞后,这些经过工程改造的TGFβ rii KO CAR - t细胞在外源性TGFβ存在下的增殖、细胞毒性和细胞因子分泌等方面优于WT CAR - t细胞。此外,与WT CAR - t细胞相比,它们也能够更强大地抵抗自体iTregs的免疫抑制作用。在多轮抗原刺激后,它们还表现出更好的功能和更少的疲惫,并且没有激活诱导的疲惫,最终在第二次或第三次抗原暴露后,它们具有更好的细胞毒性。
材料与方法
细胞系和培养条件
本研究使用了卵巢癌NIH-OVCAR-3 (RPMI + 20% FBS)、sk - ov3 (McCoy’s 5a + 10%FBS)、宫颈癌HeLa (EMEM + 10%FBS)、肺癌COLO-699 N (RPMI + 10%FBS)、乳腺癌c.l MDA-MB-231 (RPMI + 10%FBS)、畸胎癌c.l PA1-SC12 (MEM + 10%FBS)和HEK-293胚胎肾细胞(DMEM + 10%FBS)。MDA-MB-231及其慢病毒衍生物MDA-MB-231- hcldn6 (DMEM + 10%FBS)也用于一些实验。常规检查细胞支原体污染。除COLO-699 N来自ECACC外,其余细胞系均来自ATCC。
抗体
使用一抗山羊抗人IgG F (ab’)2生物素(BioRad, Hercules, CA)和二偶联链亲和素APC (BioRad)评估CAR间皮素在人t细胞上的表面表达。本研究还使用了以下抗体作为FACS缓冲液:抗pd1 - pe (Biolegends 329906)、抗ccr7 -Alexa-fluor 647 (BD 560921)、抗cd8 - fitc (BC A07756)、抗cd8 - bv421 (BD 562428)、抗hla - a2 - fitc (BD 551285)、抗cd86 - percp - cy5.5 (BD 561129)、抗cldn6 - dylight 650 (IMAB027)、抗idiotype-IMAB027- Alexa-fluor 647、抗tim3 - apc (Biolegends 345011)和7AAD (BC A07704)。采用PE偶联抗间皮素抗体(研发体系FAB32652P)检测间皮素表达。所有样本的采集和分析均在BD FACS CantoI/II (BD Biosciences, San Jose, California)和FlowJo软件(v7.6.1)上进行。
t细胞的分离和激活以及人类iDC的生成
通过Ficoll®-Hypaque (GE Healthcare)密度梯度离心从健康捐赠者(美因茨大学医学中心(UMC)输血中心,德国)的浅色外套中分离出pbmc。使用抗cd14微珠分离单核细胞(Miltenyi Biotec),根据制造商的方案分别使用抗CD8和抗CD4微珠分离CD8和CD4细胞(Miltenyi Biotec)。未成熟dc (iDCs)由CD14分化+RPMI 1640 GlutaMAX™细胞、50iu /mL青霉素、50 μg/mL链霉素和10% (v/v)人AB血清(one lambda)(表示huRPMI),并在5天内补充1000iu /mL重组人GM-CSF和1000iu /mL rh IL-4 (Miltenyi Biotec)两次。t细胞激活,2 × 106每ml分离的t细胞在24孔组织培养板上培养,预涂2 μg/ml抗cd3抗体(克隆OKT3;在huRPMI中加入100iu /mL IL-2,持续2 - 3天。然后收集细胞,清洗并在huRPMI中以50 IU/mL IL-2重悬,然后休息或立即提交到进一步处理步骤。
体外转录
编码MSLN特异性嵌合抗原受体(CAR)的遗传结构,包含完全人类抗MSLN scFv, CD8α铰链/跨膜区域,以及41BB和CD3ε细胞质信号域,根据美国专利9272002 B2生成并化学合成。KOZAK/编码区亚克隆到pST1 [16pp1 - deltaear1 - hag - smai - 2hbgutr - a30l70,针对poly - a的长度和组成优化了RNA的体外转录。密码子优化后的人间皮素全长ORF (NP_005814.2)也被亚克隆到同一载体中。体外转录用SapI酶切10 μg质粒,线性化后用QIAquick PCR纯化试剂盒(Qiagen)进行纯化。线性化的质粒在37°C下,在所有四种核糖核苷酸和D2帽的存在下进行T7 RNA聚合酶反应3小时。随后,用Turbo DNase完全消化模板DNA。RNA用RNAeasy Mini kit (Qiagen)的组分纯化,并洗脱到无rnaase的水中。将IVT-RNA浓度调至1 μg/μl,保存于−80℃。使用1.5%的MOPS凝胶确认了rna的质量和完整性。编码第二代CAR 8BBz CLDN6和CLDN6的ivt - rna以同样的方式制备[13].
crispr的设计与构建
利用Synthego公司提供的CRISPR设计工具,设计TGFβRII外显子2特异性的单导rna (sgRNA)。https://design.synthego.com/#/)和化学合成的o -甲基保护衍生物。从人类TGFβRII的两条链(基因ID: 7048, NCBI)中选出了三个排名最高的grna,包括以下序列:gRNA-3: GAAGCCACAGGAAGUCUGUG, gRNA-5: AUGAUAGUCACUGACAACAA和gRNA-7: GCAGGAUUUCUGGUUGUCAC。将Cas9编码序列从pCAG-T3-hCAS-pA (Addgene #48625)亚克隆到pST1中,制备IVT-RNA。
TGFβRII的生成−t细胞
t细胞用OPTI-MEM (Invitrogen)洗涤2次,以最终浓度为6-12 × 10的无血清OPTI-MEM重悬7细胞/毫升。然后,将100 μL细胞悬液与rna混合:10 μg Cas9 IVT-RNA和5 μg gRNA 3/5/7用PA-4000 (Harvard Apparatus BTX)在2毫米比色皿(VWR)中电穿孔,电压为400 V,单脉冲长度为2 ms。电穿孔后,细胞立即转移到添加IL2 (50 IU/mL)的预热huRPMI培养基中,在37°C和5% CO下孵育25天。
通过IVT-RNA表达抗原和CAR表面
野生型或TGFβRII KO t细胞用血清游离X-vivo 15洗涤2次,然后在相同的培养基中重悬至终浓度为4 × 107细胞/毫升。然后,将250 μL细胞与15 μg IVT-RNA CAR MSLN或10 μg IVT-RNA CAR CLDN6在4mm比色皿(VWR)中用PA-4000 (Harvard Apparatus BTX)在495 V和9 ms下混合。电穿孔后,细胞立即转移到预热的培养基中,在37°C和5% CO下孵育2功能测定前20小时。在电穿孔前同样处理iDCs,然后调整到2 × 10的细胞密度7细胞用2 μg IVT-RNA CLDN6或10 μg MSLN在300 V下电穿孔12 ms。5 μg荧光素酶IVT-RNA电穿孔靶细胞用于荧光素酶的细胞毒性测定。
人类t细胞的转导和CRISPR/Cas9工程
对于长期的细胞毒性试验,有必要在t细胞中稳定表达CAR构建物。macs分离的人CD8+由Dynabeads™Human T-Activator CD3/CD28 (Gibco)在100 IU/ml IL-2存在下,以珠粒与CD3 + t细胞比例为1:1预激活。珠活化48 h后,将细胞播种在CAR - γ -逆转录病毒上清饱和的retroonectin (Takarabio)预包被板(200 μl / 20 μg/ml)上,离心30 min, 15°C, 1500 rpm,使t细胞:病毒颗粒的感染多重率(MOI)为1。在额外48小时后,从培养物中取出预激活的Dynabeads™人T-Activator CD3/CD28,如前所述,电穿孔细胞获得Cas9 mRNA和tgf β rii特异性gRNAs。未转导的t细胞作为对照。通过流式细胞术评估转导的人t细胞的异体CAR表达。
用铂- e细胞制备GALV假型病毒颗粒。按照制造商的说明用TransIT-LT1 (Mirus)转染细胞。转染后48和72小时收集逆转录病毒上清,用Jurkat细胞评估滴度。
基因破坏效率检测采用T7核酸内切酶I法,测序和TIDE法
在gRNA和Cas9 mRNA电穿孔5天后,根据制造商的说明使用QIAmp DNA迷你试剂盒(Qiagen)从细胞中提取基因组DNA。采用Q5高保真DNA聚合酶(NEB) PCR扩增了TGFβRII基因sgRNA靶位点两侧的基因组区域:TGFβRII正向:5 ' -AGAAAGTGGACCTTATGACAACCA和反向:5 ' -AGGAGGTGTCGGTTAAATGACTAC。PCR产物纯化后用tgf β rii测序引物:5’- tctgatgtgaaggaattatttttgcct进行Sanger测序,然后使用在线工具进行TIDE分析http://tide.nki.nl(分析使用来自Cas9模拟电穿孔样品的参考序列进行)或如前所述进行T7EI核酸酶(NEB)测定。简单地说,PCR产物首先被加热到90°C变性,然后温度逐渐降低到10°C重新退火产物。然后将混合物进行T7E1消化15分钟,以识别不匹配,最后在2%琼脂糖凝胶上进行分析。
荧光素酶,球体和阻抗为基础的细胞裂解分析
对于基于荧光素酶的细胞毒性试验,WT CAR - T细胞或TGFβRII KO CAR - T细胞与表达Ag和荧光素酶的靶细胞以指定的E:T比在白色Nunclon Delta表面96孔板电穿孔20小时后共培养三次。共培养3小时后,每孔加入50 μl底物溶液、1 mg/ml荧光素(BD, moonlight d - lucifin)和50 mM HEPES。添加Triton-X100 (0.25% f.c.)进行完全裂解控制。使用Tecan Infinite 200读取器记录指定时间点的生物发光发射,并计算细胞毒性如下:
\ ({L} _{样本}\):样品裂解发光均值
\ ({L} _{马克斯}\):最大裂解的发光均值
\ ({L} _{分钟}\):自发裂解发光
为了模拟肿瘤的3D性质,使用Incucyte活细胞成像系统进行了基于球体的细胞毒性试验。为了生成球状细胞,将肿瘤细胞系用eGFP mRNA电穿孔,并在球形板(Corning #7007)中接种24小时。24小时后,使用Incucyte确认球形细胞的生成和荧光发射,并将WT CAR - t细胞或TGFβRII KO CAR - t细胞添加到相应的孔中,并随时间监测荧光强度的降低。使用Incucyte软件分析数据,并使用Top Hat算法减去背景。
基于阻抗的肿瘤裂解细胞培养系统(xCELLigence, ACEA Biosciences)用于实时评估T细胞的长期细胞毒性。通过电极底板,该设备测量粘附靶细胞的电极阻抗,这与细胞活力相对应,并使用称为细胞指数(CI)的无单位参数报告它。细胞裂解导致靶细胞脱离,随着时间的推移降低CI。靶细胞以2 × 10的剂量接种在96孔电极底微量滴度板(E-Plate®96)上4细胞/ 100μL /。在20至24小时后,就在CI开始稳定之前,以指定的E:T比率添加效应细胞,并每15分钟记录一次CI。为了纠正96孔板上的发散生长曲线特性(“边缘效应”),在每个孔添加效应细胞之前不久,任何时间点的CI都首先标准化为CI (NCI),并在重复中求平均值。比溶度计算公式取RTCA软件:
\ ({NCI} _{样本}\):样品裂解归一化细胞指数均值
\ ({NCI} _{马克斯}\):最大裂解归一化细胞指数均值
\ ({NCI} _{分钟}\):自发裂解的归一化细胞指数平均值
重复抗原刺激试验
靶细胞在Xcelligence平板上(2 × 104细胞/100 μL/孔),20 ~ 24 h后,分别加入经逆转录病毒转导表达CLDN6特异性CAR的WT或TGFβ rii KO CD8 + T细胞,在TGFβ存在或不存在的情况下,E:T比为5:1。实时监测细胞毒性48 h。随后,从井中收集CAR - t细胞,清洗,再次计数,并将其添加到新的Xcelligence板中,其中包含先前播种的靶细胞。再次监测细胞裂解量48小时,并重复同样的过程。治疗组TGF-β1浓度维持在5 ng/mL。
扩散
WT CAR - T细胞或TGF-β rii KO CAR - T细胞用0.8 μM羧荧光素二乙酸丁二酰酯(CFSE, Invitrogen)或10 μM eBioscience™细胞增殖染料eFluor™450 (CPD450)标记,并与Ag mrna电穿孔的iDCs在圆底96孔板中以5:1的E:T比共培养,使用不同剂量的TGF-β1(无载体;研发系统)。24小时后收集培养上清液进行细胞因子分析。
共培养5天后,用抗cd8或抗cd4抗体对t细胞进行染色,并使用FACS canto II设备上的高通量采样器(HTS)测量细胞分裂时cfse染色的减少。
细胞因子酶联免疫吸附试验(ELISA)
将WT CAR - T细胞或TGFβRII KO CAR - T细胞与Ag mrna电穿孔的iDCs或不同E:T比的癌细胞系共培养于圆底96孔板中,终体积为200 μl。24 h后,收集100 μl上清,冷冻至−80℃进行分析,或立即在检测稀释液中1:2-1:10稀释,在37℃下在预包有细胞因子特异性捕获抗体的高蛋白结合96孔板上孵育3 h。重复洗涤后,加入底物NBT后,用生物素化检测抗体/链霉亲和素-酶标结合检测固定化细胞因子(IFN-γ)。在TECAN Sunrise ELISA阅读器系统上对显色进行光度定量,并通过并行开发的细胞因子标准物计算μg/ml进行定量。使用人ELISA试剂盒(Invitrogen)检测上清液产生人IL-2和IFN-γ,使用DuoSet ELISA Development kit (R&D Systems)定量颗粒酶B (GrB)、TNF-α和GM-CSF。
iTreg生成体外抑制试验
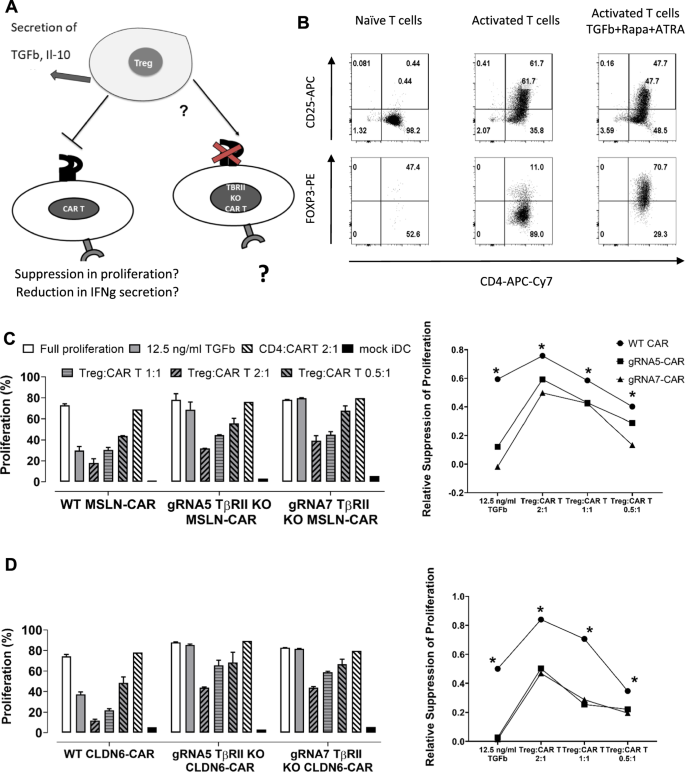
CD4+使用CD4微珠(milteni - biotec)根据制造商的方案从新鲜的pmcs中阳性选择t细胞,静置3小时。然后将细胞置于24孔板中,预涂有5 μg/ml抗cd3抗体(克隆OKT3;Bioxcell) 2 × 106在无血清X-Vivo 15培养基(Lonza)中添加1 μg/ml可溶性抗cd28抗体(Biolegend, ultra-LEAF级)和100 IU/ml IL-2。仅用这些试剂刺激的细胞作为对照。对于iTreg代,5 ng/ml TGF-β1(无载体;R&D Systems), 10 nM的全反式维甲酸(ATRA) (Sigma-Aldrich)和100 ng/ml的雷帕霉素(Calbiochem EMD Millipore)加入到培养基中。细胞在37°C/5% CO下孵育6天2在恒温箱里。随后,CD4 + t细胞被诱导分化为诱导treg (iTregs),在含50 U/ml IL-2的X-Vivo 15培养基中洗涤并静置2 - 3天。为了建立抑制试验,将iTregs再次洗涤并重悬在不含任何IL-2的新鲜介质中。应答者(Tresp)细胞为WT CAR - t细胞或TGFβRII KO CAR - t细胞。用10 μM CPD-450标记Tresp,共培养如下:在96圆底板的每孔中,等数的Tresp细胞(5 × 104)和Ag表达iDCs作为靶细胞(1 × 104)共播种,并以不同比例(2:1、1:1、0.5:1和0.25:1)与抑制iTregs或活化CD4 + t细胞共培养作为阴性对照。细胞培养3 ~ 4天,流式细胞术分析细胞增殖抑制情况。
结果与讨论
MSLN和CLDN6特异性CAR - t细胞识别并杀死同源抗原表达的肿瘤细胞系
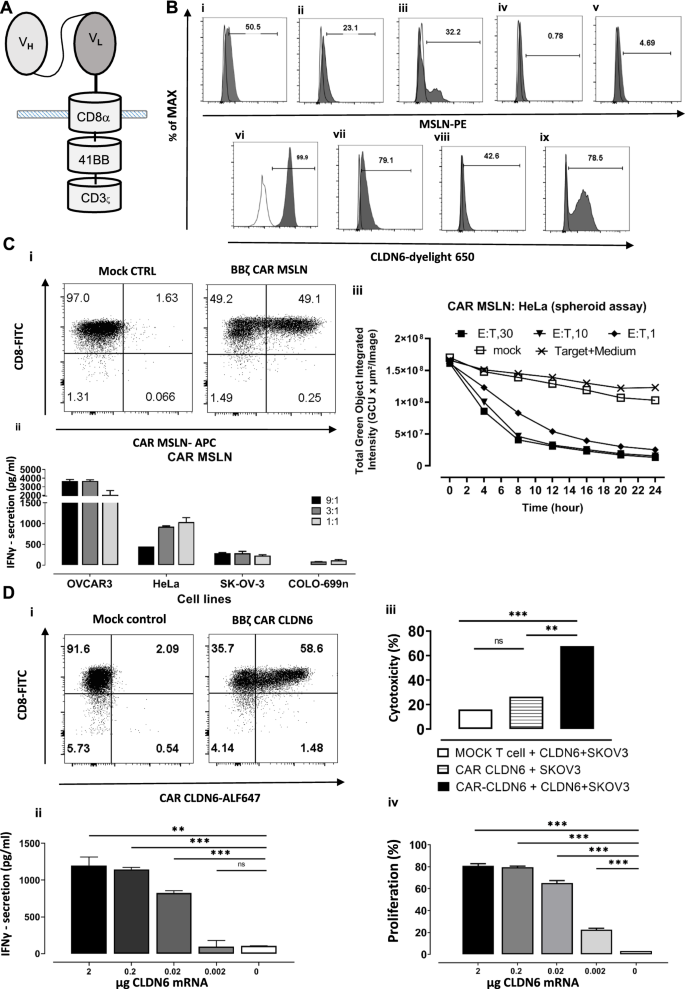
在这项研究中,我们专注于CAR - t细胞特异性的肿瘤抗原间皮素和claudin 6(图2)。1A),在肿瘤细胞上高表达,但在正常细胞上很少检测到。我们使用抗原过表达细胞系,HeLa(图2)。1B i)和OVCAR-3(图。1B ii)用于msln特异性抗原性,PA-1 SC12(图;1B vi)和OVCAR-3(图;1B vii)用于CLDN6反应性或在iDCs细胞表面外源过表达抗原(MSLN和CLDN6)(图。1B iii, ix)或(MDA-MB-231)(图。1B viii)通过IVT-RNA电穿孔或病毒转导。msln阴性癌细胞株SK-OV-3(图;1B iv)和Colo-699 N(图;1B v)也用于一些实验。
MSLN和CLDN6在肿瘤细胞系上高度表达,CAR CLDN6或MSLN能有效识别并杀死它们。一个第2代CAR CLDN6或MSLN构建基于CD8α的铰链、跨膜和胞质区嵌合,4-1BB的胞质区和CD3ς分别用于共刺激和刺激信号传导。BMSLN在i) Hela和ii) OVCAR-3细胞系上的表达,iii) 10 μg MSLN IVT-RNA电穿孔后iDCs上的外源性MSLN表达iv) SK-OV-3和v) Colo-699 N.内源性CLDN6在vi) PA-1和vii) OVCAR-3细胞表面的表达viii) CLDN6编码病毒颗粒转导后MDA-MB-231上的外源性CLDN6表达,ix)分别电穿孔2 μg CLDN6 IVT-RNA后iDCs上的表达。C:(1) 10 μg CAR- MSLN IVT-RNA电穿孔后1天CAR- MSLN在人CD8 T细胞上的表达;(2)IFN-γ分泌实验证明MSLN特异性CAR识别MSLN阳性细胞(HeLa和OVCAR-3),而它们不与抗原阴性细胞系(SK-OV-3和COLO-699 N)发生反应;(3)球形杀伤实验证明CAR- MSLN T细胞识别并杀死HeLa肿瘤的球形细胞,E:T比也很低。D:(1) 10 μg CAR CLDN6 IVT-RNA电穿孔后1天CAR CLDN6在人CD8 T细胞上的表达;(2)IFN-γ分泌实验证明CAR CLDN6能特异性识别CLDN6电穿孔后的iDCs,且与抗原阴性细胞不发生反应;(3)基于Xcelligence的杀伤实验表明CAR CLDN6 T细胞能识别并杀伤外源表达CLDN6的sk - v -3细胞系,而模拟T细胞保持不活性。vi)基于CFSE的增殖实验显示,CAR - CLDN6 T细胞强烈分裂频率高达80%,不仅在iDCs中存在高剂量的异源表达CLDN6 (2 μg),而且在低至0.02 ug的CLDN6剂量下也是如此。P值采用单因素方差分析,采用多重比较检验。* p < 0.05;** p < 0.01;*** p < 0.001;**** p < 0.0001。在所有实验中,给出了三个技术重复的平均值±标准差,并且至少对三个供体重复了涉及T细胞的实验
激活CD4 + /CD8 + t细胞,转染编码IVT rna的MSLN (15 μg)和CLDN6 (10 μg) CAR。在这种高剂量下,我们可以监测到约50%的CAR表达,以检测两种抗原特异性(图2)。1ci, di)。
为了证实CAR - MSLN t细胞在体外具有功能,我们进行了多项评估。在第一步中,研究了不同细胞系的IFN-γ分泌情况:CAR MSLN t细胞向表达MSLN的细胞系分泌高水平的IFN-γ, OVCAR-3为4000 pg/mL, HeLa为靶细胞为1500 pg/mL(图2)。1该细胞因子对阴性对照细胞株SK-OV-3和COLO-699 n无明显分泌。此外,通过3D培养球体裂解试验评估细胞的细胞毒性(图2)。1C iii).固相球状细胞反映了体内某些方面的情况,如肿瘤细胞在其边界处积极分裂,营养物质供应最佳,肿瘤细胞在其核心处凋亡或坏死[17].然而,它在TME中不包含免疫抑制和血管生成作用。我们的数据证实,即使在低E:T比为1:1的情况下,CAR MSLN T细胞也能成功杀死肿瘤球体,与模拟T细胞相比,在24小时内几乎可以实现100%的杀伤。阴性对照组的荧光减少反映了编码GFP的mRNA随时间的退化。总之,这些数据证明了CAR MSLN t细胞的细胞因子分泌和细胞毒功能。我们还对MSLN阴性细胞系SK-OV-3进行了该实验,数据显示CAR - MSLN T细胞在30:1的高E: T比下对该细胞系没有任何细胞毒性。在模拟和CAR MSLN T细胞中记录的绿色强度缓慢下降可能是由于电穿孔mRNA的半衰期(附加文件)1:图S1)。
为了评估CAR CLDN6的功能,将CAR CLDN6 T细胞与IVT-RNA电穿孔的异源表达CLDN6的iDCs以增加剂量(E:T比5:1)共培养,以在ELISA中定量分泌的IFN-γ。2 μg电穿孔CLDN6检测到的细胞因子数量为1000 pg/ml, 0.02 μg电穿孔CLDN6检测到的细胞因子数量为100 pg/ml(图2)。1D ii),因此,剂量依赖性地降低。
对于基于阻抗的细胞毒性试验,我们用2 μg CLDN6 RNA电穿孔SK-OV-3细胞系,并将其种在优良板上。24 h后,以E:T 5:1的比例加入CAR CLDN6或模拟T细胞,记录阻抗随时间的变化。成功杀死CLDN6+CAR CLDN6效应t细胞(70%)证实了SK-OV-3细胞,而对模拟t细胞没有观察到相关的细胞毒性(图。1D iii)。
我们还应用CFSE稀释法以剂量依赖的方式评估了CAR CLDN6 t细胞的增殖。这些CAR - t细胞强烈分裂频率高达80%,不仅在iDCs中存在高剂量的异源表达CLDN6(2µg),而且在低剂量的0.02µg CLDN6 (70%;无花果。1值得注意的是,在模拟电穿孔的iDCs存在时,未检测到增殖。总之,我们的数据证实了特异性于MSLN和CLDN6的CARs在对抗抗原表达的肿瘤细胞系或iDCs时都具有优异的效应功能。
外源性TGFβ损害CAR - t细胞体外增殖
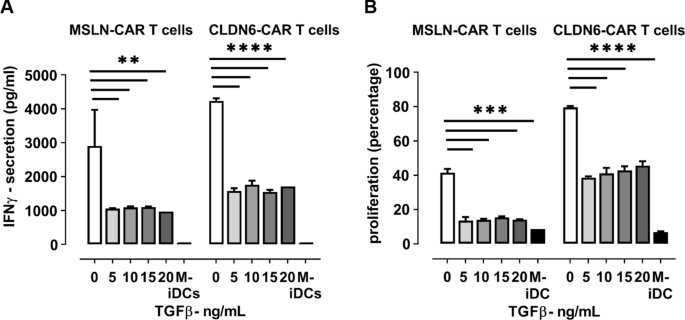
由于TGFβ是肿瘤微环境中免疫系统的关键调节因子之一,它极大地抑制了CAR - t细胞的功能[9],我们假设实体瘤CAR - t细胞治疗的障碍之一来自TME中TGFβ的高水平。为了验证这一假设,我们进行了一系列体外试验,以确定外源性TGFβ是否能对我们的CAR - t细胞特异性地抑制2种不同的肿瘤抗原。IVT电穿孔iDCs (CLDN6/ MSLN)与CAR CLDN6或CAR MSLN t细胞在增加TGFβ剂量下共培养。大范围添加外源性TGFβ (5-20 ng/ml)可显著抑制CAR - t细胞分泌细胞因子的功能(图。2A)和增殖(图;2B)与之前的报道一致。IFN-γ是最常见的免疫刺激t细胞的细胞因子,即使添加了最低剂量的TGFβ, IFN-γ的分泌也非常容易受到影响,在没有TGFβ的情况下,IFN-γ的分泌下降到不足40%。因此,即使存在非常低剂量的TGFβ (5 ng/ml), MSLN和CLDN6特异性CAR - t细胞的增殖也降低到不到其原生增殖的50%(即缺乏TGFβ)。值得注意的是,TGFβ的抑制作用不仅持续于短期孵育时间(< 24小时),而且在长期增殖试验(5-6天)中也很明显。总之,这些数据表明TGFβ是CAR - t细胞的有效抑制剂,无论其抗原特异性如何。
外源性TGFβ影响CAR - t细胞细胞因子的分泌和增殖。一个TGFβ能够在大剂量范围(5- 20ng /mL)和短时间线(20h)内抑制MSLN-或cldn6特异性CAR 4-1BBζ t细胞对抗原脉冲iDCs的IFN-γ分泌。BTGFβ还能够在大剂量范围(5- 20ng /mL)和长时间(5天)抑制MSLN-或cldn6特异性CAR 4-1BBζ t细胞对抗原脉冲iDCs的增殖。P值采用双因素方差分析,采用多重比较检验。* p < 0.05;** p < 0.01;*** p < 0.001;**** p < 0.0001。在所有实验中,给出了三个技术重复的平均值±标准差,并且至少对三个供体重复了涉及T细胞的实验
我们应该提到的是,目前还没有任何关于肿瘤部位活性TGFβ精确水平的可靠数据。数据大多集中在血液中,人体血浆中0.5 - 25ng /mL范围内[18]并且研究表明,与正常对照组相比,癌症患者体内TGFβ的浓度要高得多[19].合理地说,与血浆相比,肿瘤中活性TGFβ的浓度应该更高,因为肿瘤细胞自己分泌TGFβ,它可以被基质金属蛋白酶激活。而其他人,如侯等。20.],在他们的研究中也使用了5 ng/ml的TGFβ,我们决定使用这个浓度作为起始浓度。由于我们主要对测试我们的TGFβ RII KO CAR - t细胞的效力感兴趣,我们主要检查了更高水平的TGFβ,以确保我们的敲除组也可以抵抗我们推测在TME中普遍存在的更高水平的TGFβ。
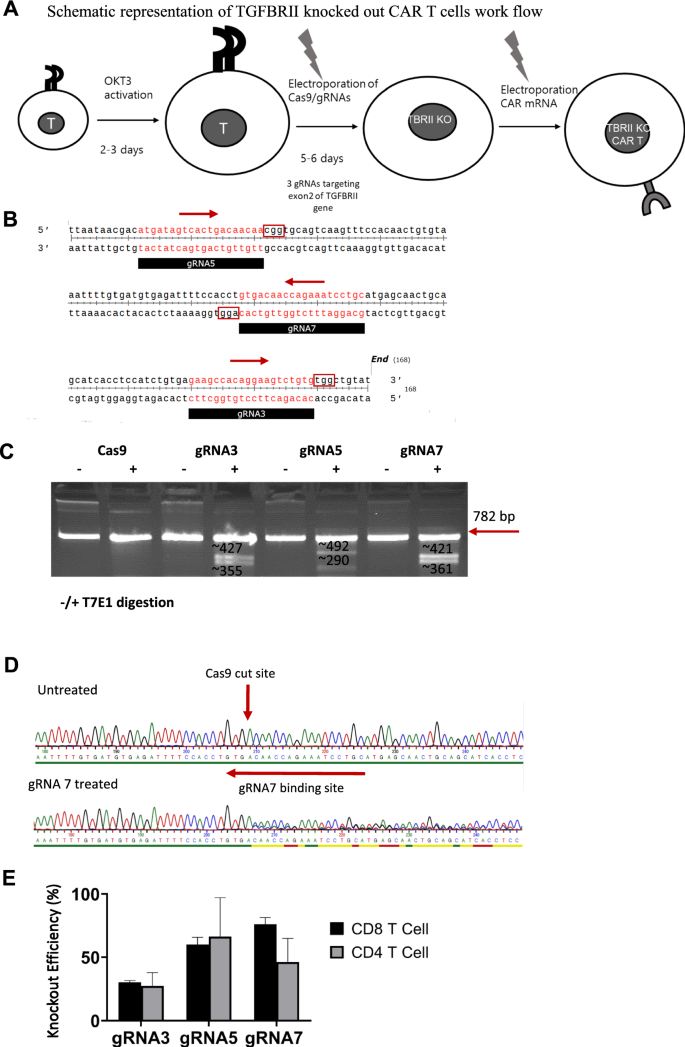
利用CRISPR/Cas9系统缺失TGFβ RII
我们促使我们评估CAR - t细胞中TGFβ rii的基因组破坏是否会抵消外源性TGFβ存在时CAR - t细胞的上述功能损害。为了达到这一目的,我们设计了一个两步方案,包括基于CRISPR/Cas9的基因敲除TGFβRII位点,随后CAR - IVT-RNA电穿孔进入那些基因组编辑的原代人类t细胞(图2)。3.A).来自微生物CRISPR适应性免疫系统的RNA引导的Cas9核酸酶是一种高效的基因组编辑工具,它由Cas9核酸酶和单导向RNA (sgRNA)组成,靶向基因组感兴趣区域的20 bp区域[21].我们使用Synthego在线工具设计sgRNAs,并从两条链上排名最高的建议sgRNAs中选择了三个至少50个核苷酸距离的gRNAs(图2)。3.B). Synthego在线工具使用Doench等人。22]评分算法来选择有效的sgrna,并根据基因组脱靶的数量对sgrna进行排名。在grna3 /5中,出现0、1和2个错配的潜在脱靶位点数量为0,而在gRNA7中,出现4个脱靶位点和2个错配位点。然而,我们不能完全排除脱靶编辑可能发生的可能性,这需要在进入临床环境之前通过下一代测序进行评估。简单地说,为了结合敲除程序和CAR表达,OKT3激活的t细胞被单独用Cas9 mRNA电穿孔(Cas9对照),或者用Cas9和化学合成的针对TGFβ RII外显子2的o -甲基保护的sgRNA电穿孔。5天后,通过T7核酸内切酶I测定和Sanger测序等基因组分析技术检查TGFβ RII消融。随后用饱和量的编码抗msln或抗cldn6 CAR的IVT mRNA电穿孔细胞(图2)。3.一个)。
通过CRISPR/Cas9系统成功靶向TGFβ RII位点。一个利用靶向TGFβRII位点和核酸酶Cas9的IVT-RNA的合成gRNAs基因组敲除TGFβRII的示意图,随后是基于IVT-RNA的CAR在人t细胞中的表达。B以TGFβ RII外显子2为靶点,长度为20个碱基的三种不同grna的序列和基因组位置的图形表示,箭头表示grna的极性。CT7内切酶1检测显示gRNA处理的t细胞组与对照组相比有额外的条带,证实gRNA处理组未形成。D野生型和gRNA7处理组的直方图测序结果显示,在互补的5’-NGG pam -序列上游的gRNA靶靶序列内,有一个4个碱基的异源序列,与indel形成一致。ETIDE分析的柱状图表明,所有三种不同的grna都可以在人CD4+和CD8+ t细胞中成功敲除TGFβ RII。在所有实验中,给出了三个技术重复的平均值±标准差,并且至少对三个供体重复了涉及T细胞的实验
为了确定敲除效率,从细胞中提取基因组DNA(仅含Cas9和含gRNAs 3,5或7的Cas9),并使用位于sgRNA靶区两侧的PCR引物进行PCR扩增。对PCR产物进行T7核酸内切酶I限制,然后在琼脂糖凝胶上运行(图2)。3.c)。
T7内切酶I识别并切割不匹配的DNA,这可能导致凝胶上出现额外的条带,以防止indel形成。对照细胞和3种grna处理细胞的PCR产物经T7E1酶切。虽然对照组中没有额外的条带,但所有gRNA处理组都表现出额外的条带,这表明了不清晰的形成(图2)。3.C).如图所示。3.B,每个gRNA都靶向TGFβRII基因附近但不同的基因组序列,因此,考虑到使用相同的PCR引物,T7E1的限制模式最终在凝胶上可见每个gRNA的限制产物大小不同。PCR产物也用于Sanger测序,并应用分解技术对数据进行不精确频率分析。碱基歧义开始于gRNA7的碱基4之后(5 ' -GTGA-A/C…),这与假设的Cas9基因组切割位点一致(图。3.D、附加文件2:图S2)。结果再次证实,所有gRNA处理组都有indeal形成。3.D / E)。尽管与其他两种grna相比,gRNA3倾向于形成更少的indels(图。3.E),我们并没有将其排除在我们进一步的实验中,以检查即使是较低水平的基因组TGFβRII敲除是否也可能对CAR - t细胞功能产生可测量的影响。总之,这些数据显示了TGFβ RII基因位点插入/缺失(INDELs)的成功生成。我们能够证明,在CD8 +和CD4 +细胞中,3种grna的基因消融程度相似(图2)。3.E)。
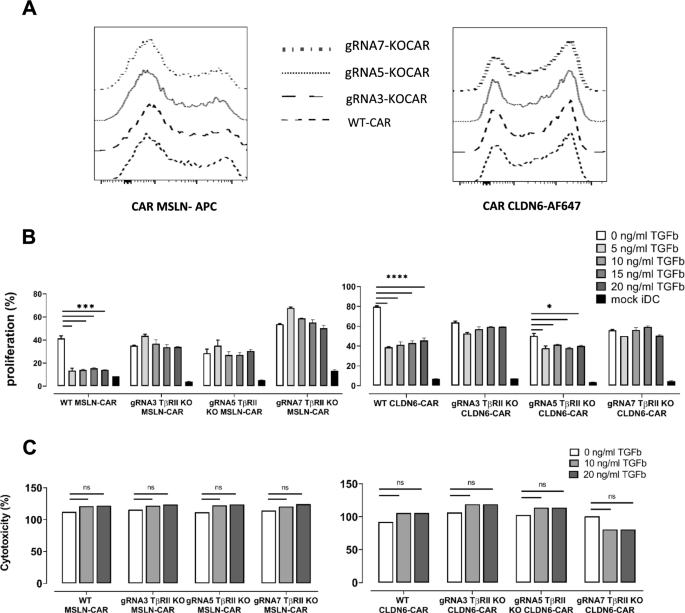
TGFβ RII在CAR - t细胞中的破坏增强了其体外效应功能
为了确定TGFβRII缺乏对CAR - t细胞功能的影响,我们在体外用不同的方法评估了TGFβRII KO CAR MSLN和CAR CLDN6 t细胞。由于KO的疗效有限,这些实验是在包含编辑过和未编辑过的细胞的大群体上进行的。作为比较KO CAR - t细胞与WT CAR - t细胞的必要前提,TGFβRII的基因消融不能干扰ivt - rna介导的CAR - t细胞表达。事实上,我们观察到CAR在t细胞上的表达频率非常相似(图2)。4A): CAR- msln电穿孔t细胞和TGFβRII KO CAR- msln t细胞均可观察到50%的CAR表达。与此类似,我们还发现CAR CLDN6电穿孔t细胞中高达70%的CAR表达,与基因组编辑步骤无关。此外,我们分析了在无外源性TGFβ的情况下电穿孔后WT或KO CAR - t细胞的增殖情况,以确定TGFβ rii基因的缺失是否对CAR - t细胞的增殖和/或存活有任何影响。在大多数测试中,我们没有监测到WT和TGFβRII KO CAR - t细胞之间增殖的任何显著变化,在多个供体中分析,当后者在3种不同的grna上平均时,WT和KO组之间的差异没有统计学上的升高(图中白色条)。4B,数据未显示)。KO CAR - t细胞不存在抗原独立扩增或细胞因子分泌,从而得出结论,TGFβRII的缺失不会导致长生不老(图中黑色条)。4B和5).
靶向MSLN或CLDN6的CAR - t细胞的基因组TGFβ RII破坏增强了它们的体外效应功能。一个与WT CAR - t细胞相比,TGFβRII KO CAR - t细胞中的TGFβRII基因组编辑不影响CAR的表达,而与抗原特异性无关。BTGFβ在任何剂量下都能抑制MSLN或CLDN6 4-1BBζ CAR - t细胞在抗原呈递的iDCs作为APCs存在时的增殖。重要的是,即使在非常高剂量的外源性TGFβ下,TGFβ rii KO CAR - t细胞的增殖仍未受损和稳定。WT组和KO组的增殖均被证明是抗原特异性的。C在针对免疫刺激iDCs的短期经典细胞毒性试验(基于荧光素酶)中,TGFβ不会损害WT CAR或TGFβ rii KO CAR -t细胞的细胞毒性。P值采用双因素方差分析,采用多重比较检验。* p < 0.05;** p < 0.01;*** p < 0.001;**** p < 0.0001。在所有实验中,给出了三个技术重复的平均值±标准差,并且至少对三个供体重复了涉及T细胞的实验
MSLN特异性CAR - t细胞的基因组TGFβ RII破坏增强了它们的细胞因子分泌。TGFβ在任何剂量下都能抑制msln特异性WT CAR 4-1BBζ t细胞的细胞因子分泌。一个2,B干扰素γ,C肿瘤坏死因子α,Dgm - csf,E颗粒酶B,在抗原存在时,将iDCs呈现为APCs。重要的是,即使在非常高剂量的外源性TGFβ下,TGFβ rii KO CAR - t细胞中的细胞因子数量仍未受损和稳定。WT组和KO组细胞因子的分泌也被证明是抗原特异性的。P值采用双因素方差分析,采用多重比较检验。* p < 0.05;** p < 0.01;*** p < 0.001;**** p < 0.0001。在所有实验中,给出了三个技术重复的平均值±标准差,并且至少对三个供体重复了涉及T细胞的实验
同样,TGFβ在WT CAR - t细胞中诱导细胞增殖减少超过2倍。有趣的是,用抗原呈递的iDCs刺激CD8+和CD4+ TGFβ rii KO CAR MSLN或CAR CLDN6 t细胞后,即使在外源TGFβ剂量增加的情况下,增殖率也能恢复(图5)。4B).值得注意的是,对于TGFβRII KO CAR MSLN t细胞,我们仍然观察到3个grna中有2个的剂量率依赖性增殖有微小但稳定的下降。除了剂量效应,这也可能是由于实验中使用的CD8+ t细胞中未编辑的CAR - t细胞比例较高,前者仍然易受TGFβ的影响。值得注意的是,对增殖的拯救并不完全:尽管TGFbRII KO CAR-T组的增殖恢复率很高,但我们观察到KO组的增殖效果仅为大约。60%,这意味着至少有40%,无论是WT部分还是KO部分在大量编辑和未编辑的KO组中,仍然没有增殖。我们还评估了针对MSLN或CLDN6特异性的KO TGFβRII CAR - t细胞对负载抗原的iDCs的细胞溶解潜力(图2)。4C)生物发光细胞溶解实验。然而,与之前讨论的增殖和细胞因子分泌结果相反,与WT对照相比,这些KO CAR - t细胞的杀伤效率不受影响。这也被其他人在传统的细胞毒性试验中观察到[23].
尽管如此,与WT car - t细胞相比,TGFβRII KO car - t细胞释放的IL-2数量相等或略多。5A、附加文件3.: S3A), IFN-γ(图;5B、附加文件3.: S3B), TNFα(图;5C、附加文件3.: S3C), GM-CSF(图;5D、附加文件3.: S3D)细胞因子和GranB(图。5E、附加文件3.: S3E)(仅对一个KO组/gRNA7进行了测试),当它们与表达同源抗原的dc在缺乏外源性TGFβ的情况下共培养时。细胞因子的释放依赖于CAR的表达,非电穿孔T细胞(模拟)在抗原阳性细胞的存在下(数据未显示)不能释放细胞因子,所有CAR - T细胞组与抗原阴性iDCs共培养时没有细胞因子分泌(图)。5,黑色条)。重要的是,在外源性TGFβ存在的情况下,WT car - t细胞在不同程度上失去了分泌细胞因子的能力。5,附加文件3.:图S3)按IFN-γ > GM-CSF > GranB > TNF-α > IL-2的顺序,与TGFβ剂量无关。与此相反,TGFβ rii KO CAR MSLN或CAR CLDN6 t细胞重置了TGFβ对细胞因子分泌的免疫抑制作用,几乎完全与WT CAR - t细胞观察到的抑制量无关。其次,TGFβ rii KO CAR MSLN或CAR CLDN6 t细胞的拮抗作用总体上与外源TGFβ添加量无关。我们假设,总体而言,在功能的净结果中,大量存在的编辑CAR - t细胞的比例主导了非编辑CAR - t细胞的比例。这意味着TGFβRII KO CAR - t细胞的细胞因子分泌会逐渐减少,这对大多数样本组都是正确的。然而,稳定的TGFβ剂量率依赖性的GM-CSF和TNF-α分泌增加仅对KO TGFβ rii CAR MSLN t细胞明显。这可能是由于编辑t细胞与非编辑t细胞的比例,这些细胞因子分泌途径对TGFβ的敏感性,以及CAR MSLN与CAR CLDN6相比效果稍低。
总的来说,这些结果表明,TGFβ RII的破坏可以拮抗所有三个KO组中由外源TGFβ处理的WT MSLN或CLDN6 4-1BBζ CAR -t细胞诱导的各种长期和短期功能缺陷。然而,我们的实验没有发现外源性TGFβ对免疫刺激靶细胞(如iDCs)的短期杀伤实验(4小时)有任何影响,对WT或KO CAR - t细胞也没有影响。
TGFβ受体II破坏增强长期细胞毒性
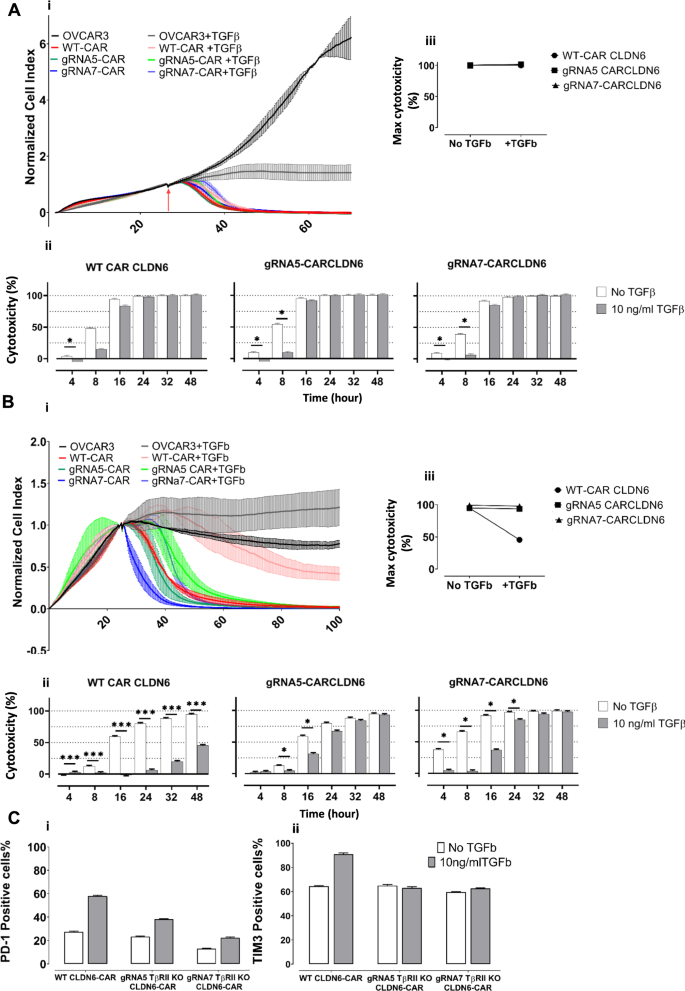
一些报道显示TGFβ对t细胞和CAR - t细胞的细胞毒性有抑制作用[24,25,26,27].然而,我们无法在短期细胞毒性实验中重现任何对iDCs的抑制。因此,我们提出了一个问题,即在长期暴露下,TGFβ是否会阻碍CAR - t细胞的杀伤功能,特别是考虑到患者在TME中长期普遍存在的抑制环境。为此,我们改用稳定的CAR修饰t细胞,以避免基于IVT-RNA的CARs的短暂表达。因此,我们决定使用病毒转导的t细胞和靶细胞(图。6A)。然后评估转导的t细胞的CAR表达(图。6B)、活力和TGFβRII KO效率。利用Xcelligence设备上的阻抗技术,以贴壁CLDN6 + PA-1 Sc12细胞系为靶标,WT和KO TGFβRII CAR CLDN6- t细胞为效应器,测量实时细胞毒性。细胞在E:T比为5:1的条件下培养。
TGFβ受体II基因缺失可恢复TGFβ rii KO CAR - t细胞的长期细胞毒性。一个长期细胞毒性试验工作流程示意图。用CAR CLDN6上清对CD8+ t细胞进行逆转录病毒转导,然后用CRISPR/Cas9处理来破坏TGFβRII的表达。B在逆转录病毒转导的WT和TGFβRII KO t细胞上,CAR CLDN6表面表达相等。C在不存在TGFβ(红色)和存在TGFβ(黑色)的情况下,基于阻抗的细胞毒性试验。将三复制的平均细胞指数归一化到播种效应细胞CAR - t细胞之前不久,然后根据中给出的公式重新计算到细胞溶解率%材料与方法.在TGFβ存在的情况下,WT CAR - t细胞对CLDN6+肿瘤的细胞毒性降低。PA-1降低了整个培养时间(> 3天),而TGFβ rii KO CAR - t细胞的细胞毒性在20h后恢复。D在指定时间点,WT和TGFβ rii KO CAR - t细胞在10 ng/ml TGFβ缺失(白色条)和存在(灰色条)时的细胞毒性柱状图B.与tgf β处理的KO CAR -t细胞相比,非tgf β处理的KO CAR -t细胞最初的细胞毒性增加随着时间的推移(24小时)趋于平稳,并导致与WT CAR -t细胞相比相当甚至更好的细胞溶解。P值采用双因素方差分析,采用多重比较检验。* p < 0.05;** p < 0.01;*** p < 0.001;**** p < 0.0001。在所有实验中,给出了三个技术重复的平均值±标准差,并且至少对三个供体重复了涉及T细胞的实验
在缺乏TGFβ的情况下,WT和KO CAR CLDN6 t细胞的细胞毒功能没有显著差异(图2)。6C,红色曲线)。然而,在TGFβ存在的情况下,WT CAR CLDN6 t细胞的杀伤效果在整个时间范围内(72 h,黑色曲线)显著受损,达到稳定水平。值得注意的是,尽管所有三种KO CAR CLDN6 t细胞在与靶细胞共培养后的前五个小时内显示出相同程度的细胞毒性下降,但它们的细胞溶解效力在TGFβ存在下恢复,并与未TGFβ处理的对照组的细胞溶解水平一致(图2)。6C/D)(细胞溶解百分比根据材料与方法特异性裂解是通过减去模拟T细胞的细胞裂解来保证的)。最初的降低可能归因于实时捕获的TGFβ对散装WT/KO t细胞对免疫缺陷肿瘤细胞的即时抑制作用,与免疫刺激iDCs的结果相反(图2)。4C).在这个迟发阶段TGFβ之后,rii KO CAR - t细胞对TGFβ效应产生了抗性,并在溶细胞功效上赶上了非TGFβ处理的CAR - t细胞。因此,我们假设CAR -t细胞确实可以被TGFβ抑制,也可以在实时设置中解决它们的细胞毒功能。重要的是,从长远来看,TGFβRII KO CAR - t细胞可以逆转这种情况。
基因组编辑的TGFβ无反应CAR - t细胞可以逃脱诱导的调节性t细胞的控制。
TGFβ不仅促使naïve CD4细胞分化为treg,而且该细胞因子还代表了treg抑制其主要靶细胞,即效应t细胞的主要机制之一[28,29,30.].过去的研究表明,不响应TGFβ的t细胞能够逃脱调节性t细胞的控制[31].众所周知,Tregs在TME中高度丰富,特别是在TGFβ分泌水平高的肿瘤中,因此我们促使我们验证TGFβ rii KO CAR - t细胞是否不仅能够抵抗TGFβ,而且能够抵抗Tregs的抑制作用(图。7A).对于这样的实验,我们面临的挑战是在体外从pmcs中产生足够数量的treg,这些treg被称为诱导调节性t细胞(iTregs)。生成iTregs的详细协议已在其他地方描述[32].简而言之,CD4+细胞被抗CD3、抗CD28和IL2激活。用这种方法处理的CD4+细胞代表活化的CD4+ t细胞,作为免疫抑制的阴性对照。为了向iTregs分化,随后将雷帕霉素、维甲酸和TGFβ添加到培养基中。t细胞被激活长达6天,然后分析FOXP3和CD25的表达,以确认它们的iTreg表型(图2)。7B).在建立共培养的前一天,用CAR MSLN电穿孔WT和TGFβRII KO t细胞(图。7C)或CLDN6(图。7D)分别用编码ivt - rna的抗原电穿孔ivt - rna和iDCs。由于我们的目的是在增殖试验中证明诱导的调节效应t细胞抑制作用的停止,在播种前用CFSE对应答CD8+ t细胞进行染色。为了建立共培养,固定数量的iDCs和WT或KO CAR - t细胞共播种,并以不同比例加入iTregs(2:1, 1:1和0.5:1;无花果。7C / D)。应答者组除WT CAR - t细胞外,还包括2个不同的TGFβRII KO CAR - t细胞组,分别用CRISPR/Cas9 gRNAs 5或7中的一种处理。作为阳性对照,我们在缺乏iTregs的情况下加入外源性TGFβ,一方面证实WT CAR - t细胞易受抑制,另一方面证实体外生成的TGFβ rii KO CAR - t细胞对外源性TGFβ的抗增殖作用具有抗性(图2)。7C/D,最左边第二)。最终,在缺乏外源性TGFβ的情况下,WT和KO CAR - t细胞的增殖率相当(图2)。7C, D最左边)。活化的CD4+ t细胞不能抑制WT和TGFβRII KO CAR - t细胞。有趣的是,即使在iTreg与CAR - t细胞的最低比例(从2:1到0.5:1)下,体外生成的iTregs也能抑制WT CAR - t细胞的增殖。最重要的是,尽管itregg也能少量抑制TGFβRII KO CAR - t细胞,但与WT CAR - t细胞相比,iTreg剂量依赖性的抑制作用不那么明显。在两个gRNA处理组中剩余的抑制作用可能至少部分是由本文使用的大量t细胞群解释的,包括未编辑的tgf β反应型WT CAR - t细胞和TGFβRII KO CAR - t细胞。我们还应该记住,Treg发挥其他几种机制来抑制T细胞,如IL-10和IL-35的分泌[33因此,TGFβRII KO CAR - T细胞并不能完全抵抗iTregs。这种现象可能是使用这类KO CAR - T细胞的安全层,因为它们不完全抵抗免疫系统的调节机制。这种抑制作用很可能是由于诱导的调节性t细胞内源性产生TGFβ导致了旁分泌效应,因为我们仅通过CRISPR/Cas9在应答t细胞中靶向TGFβ rii。由于iTreg尚未配备CLDN6或msln特异性CARs,因此iTreg/iDC*Ag细胞/细胞接触极不可能发生,并有助于抑制此处观察到的响应t细胞[34].
基因组编辑的TGFβ CAR - t细胞可以逃脱诱导的调节性t细胞的控制。一个评估iTregs抑制TGFβ rii KO CAR - t细胞能力的工作假设示意图:TGFβ rii表达的基因组破坏导致对iTregs“原位”分泌的TGFβ的功能无应答性。这使iTregs的抑制失效,从而促进响应t细胞更好的效应功能,如抗原依赖增殖对抗原电穿孔的iDCs。B流式细胞术分析体外生成的iTregs,确认其表型分化为CD4+ t细胞,具有调节功能。CD4+ t细胞仅被CD3、CD28和itregg激活,而转录因子FOXP3仅在TGFβ/全反式维甲酸/雷帕霉素处理的iTreg组中过表达。C / DWT和TGFβRII KO CAR - t细胞组正常化增殖的柱状图,后者在TGFβRII位点上用2种不同的gRNAs进行了基因组编辑。CAR - t细胞组或用外源性TGFβ处理,或与体外生成的itregg以iTreg: cart -比例从2:1到0.5:1共培养。由此,iTregs可以以剂量依赖的方式以任何效应物:反应物比抑制WT CAR - t细胞增殖。大体积KO CAR - t细胞也容易受到iTregs分泌的TGFβ的抑制,但能够基本抵抗,特别是在较低的iTreg:CART-ratio (0.5:1 CART MSLN;0.5:1和1:1 CART CLDN6)对MSLN脉冲的iDCs (C)或CLDN6 (D).在右边,增殖抑制的相对变化由C/D离开了。P值采用双因素方差分析,采用多重比较检验。* p < 0.05;** p < 0.01;*** p < 0.001;**** p < 0.0001。在所有实验中,给出了三个技术重复的平均值±标准差,并且至少对三个供体重复了涉及T细胞的实验
TGFβRIIKO拯救TGFβ诱导的CAR - t细胞衰竭
最后,我们通过重复抗原刺激实验探索了TGFβ是否也能够促进CAR - t细胞衰竭,其特征是功能反应性降低,以及TGFβ rii对CAR - t细胞的KO是否能够阻止这种反调节作用。在一系列实验中,我们利用了基于阻抗的细胞杀伤试验:为此,通过逆转录病毒转导生成稳定修饰的CAR - t细胞是长期再刺激实验的先决条件。CAR - T细胞与内源性表达CLDN6的OCVAR3细胞系以5:1的E:T比共培养。
在第一(图;8Ai)和第二轮刺激(数据未显示)TGFβ在几小时内显示初始抑制(图2)。8Aii/Aiii)对细胞毒性有影响,但不能对CAR - t细胞的细胞毒性产生持久的抑制作用,对WT和TGFβRII KO CAR - t细胞也没有作用,后者分别对gRNA 5和7显示出抑制作用。tgf β处理的样本对WT和TGFβRII KO CAR -t细胞的细胞毒性降低大致相同。在共培养8 - 16小时之间,两组都完成了裂解。在第三轮共培养过程中(图;8Bi), tgf β-未处理的WT和KO t细胞组随着时间的推移保持了细胞溶解功能。另一方面,WT CAR - t细胞首次在TGFβ存在的整个时间框架内,其细胞毒功能受到极大损害(图2)。8Bii):建立48小时后,与TGFβ未处理组相比,裂解率下降到50%以下。
TGFβRIIKO可以抵消TGFβ诱导的CAR - t细胞衰竭。一个将OVCAR-3细胞系接种在筛选板上,20小时后,在存在或不存在TGFβ的情况下,以E:T比5:1的比例加入逆转录病毒转导的WT或TGFβ rii KO CAR CLDN6 T细胞。48小时后,收集t细胞,清洗和计数,并再次在新板上播种新种子的粘附OVCAR-3细胞系,几乎生长在饱和期(20小时)。该过程重复一次,最后得到3个抗原特异性刺激周期。i)第一轮共培养表明,WT和TGFβ rii KO CAR - t细胞的归一化细胞指数几乎不受TGFβ存在的影响;ii)第一轮共培养也不妨碍任何CAR - t细胞组的细胞毒性。iii)此处给出了晚期时间点(共培养48小时)的最大细胞毒性,表明细胞毒性功效没有差异。B第三轮共培养表明TGFβ对WT CAR CLDN6 t细胞的细胞毒性有巨大影响.i) WT CAR- t细胞或TGFβRIIKO与OVCAR-3细胞共培养的第三轮归一化细胞指数表明,比较两组的细胞毒性有显著差异。ii)计算的细胞毒性柱状图显示WT CAR CLDN6 t细胞长期受到抑制,而TGFβRII KO CAR - t细胞从短暂的抑制阶段恢复,并在最后(48小时)保持完全功能。iii)这里给出了后期时间点(共培养48小时)的最大细胞毒性,表明细胞毒性功效存在实质性差异。P值采用双因素方差分析,采用多重比较检验。* p < 0.05;** p < 0.01;*** p < 0.001;**** p < 0.0001。在所有实验中,给出了三个技术重复的平均值±标准差,并且至少对三个供体重复了涉及T细胞的实验。C与OVCAR-3共培养第三轮后,收集CAR- T细胞,清洗并染色免疫检查点和衰竭标记PD-1和TIM 3。柱状图表示i: PD-1和2:TIM3阳性细胞的百分比
相比之下,tgf β处理的TGFβRII KO CAR - T细胞在16小时内从短暂的抑制阶段恢复,并保持与相关tgf β处理组相当的完全裂解能力,持续到实验结束(48小时)。我们还检查了第三次抗原刺激后不同T细胞组表面的两个重要衰竭标志物PD-1和TIM3的表达。如图所示。7C,所有组,暴露于TGFβ后,该标记物的表达上调,但野生型CAR - T细胞的上调更为明显,这与我们的细胞毒性数据一致。
我们推断TGFβ仅在第3轮刺激中对WT CAR- t细胞有抑制作用,因为CLDN6对卵巢癌c.l OVCAR-3的适度内源性表达率可防止WT CAR- t细胞过早衰竭。这与畸胎瘤c.l. PA1的高表达形成对比,后者促进早期分化为衰老效应t细胞,因此,在初始抗原特异性刺激后,WT CAR - t细胞对tgf - β的敏感性如图所示。6.
综上所述,无论是否对TGFβ rii表达进行基因组沉默,TGFβ对新激活的CAR - t细胞的抑制作用都不太明显,但对重复抗原经历的CAR - t细胞的细胞毒性有显著影响,因此衰老的CAR - t细胞。通过CRISPR/Cas9敲除TGFβ rii后,CAR - t细胞在短暂的滞后期后变成对TGFβ无反应的效应t细胞,因此,强调了我们的方法在免疫抑制TME中产生更有效的长寿CAR - t细胞的好处。
讨论
TGFβ在多种肿瘤中大量产生,包括卵巢恶性肿瘤[35,36].肿瘤可通过肿瘤微环境中的细胞如成纤维细胞促进TGFβ的产生[37,38].TGFβ是一种多效性细胞因子,对癌细胞和免疫系统有不同的影响。在肿瘤发生的早期阶段,TGFβ作为肿瘤抑制因子[39],而在进展性肿瘤免疫编辑过程中[40]癌细胞对这种细胞因子的信号传导和抗肿瘤活性产生抗性,在晚期,它们获得基因组突变,使TGFβ变成一种肿瘤促进剂[7,41].另一方面,TGFβ是免疫稳态的关键调节因子;在T细胞中,TGFβ可抑制IFN-γ和颗粒酶B等细胞溶解基因细胞因子的增殖、表达和Th1分化,同时在Treg生成中起关键作用[5,10,24].也有一些关于TGFβ在增殖、细胞毒性和细胞因子分泌等方面抑制CAR - t细胞功能的报道[9,23,25,42].
考虑到TGFβ可能是CAR - t细胞功能最重要的抑制细胞因子之一,人们可以考虑不同的方法来阻止其作用。在替代方案中,肿瘤中局部阻断TGFβ并不是最好的选择,因为肿瘤细胞并不是TME中TGFβ的唯一来源[5].尽管使用小分子或抗体对TGFβ进行全身阻断可能更有效,但不排除会使患者面临自身免疫性疾病的风险。还应注意的是,TGFβ在恶性肿瘤前期引发细胞凋亡,因此全身抑制TGFβ并不是一个合理的选择,因为它可能会导致其他组织区域的肿瘤发生[7].
在不同的可能性中,抑制t细胞中的TGFβ信号通路本身是一个有趣的想法。最近,有报道称,一种新型的TGFβ特异性CAR含有抗TGFβ的单链抗体,能够抑制内源性TGFβ信号通路,更有趣的是,它能将TGFβ转化为t细胞生长的刺激物[20.].其他几个研究小组也在CAR - t细胞治疗的背景下尝试了不同的方法来定制tgf - β通路,以改善CAR - t细胞在实体肿瘤中的功能。
由于TGFβ rii是TGFβ信号转导中的第一个细胞成分,因此首先针对该受体来阻断免疫抑制t细胞信号转导是合理的。Kloss等人报道了PSMA特异性CAR - t细胞中显性阴性TGFβRII的过表达导致CAR - t细胞体外和体内功能的改善[9].然而,这种方法仍然允许野生型TGFβRII的表达,因此不会取消t细胞中tgf β介导的信号通路。Tang等报道在CAR - t细胞中敲除内源性TGFβRII可减少向诱导treg的转化,防止CAR - t细胞衰竭,使CD28二代CAR特异性MSLN在体内具有更好的除瘤效果[25].然而,作者并没有评估由Tregs内源性产生的TGFβ是否会影响其他t细胞的功能,这一点我们可以在我们的工作中证实。在最近的一项研究中,Liu等人。[43]使用Cre-lox系统,证明了CD4+ t细胞中TGFβRII的消融促进肿瘤组织愈合并阻止癌症进展,而Li等人在一篇连续发表的文章中。[44]表明通过Cre-lox系统阻断CD4+ t细胞中的tgf - β信号通路可以重塑肿瘤微环境并抑制癌症进展。这些方法充分证明了在几种模型中靶向tgf β rii信号通路以促进t细胞效应功能的有效性。然而,他们并没有在临床前评估CRISPR/Cas9作为基因组编辑中最先进的工具之一来破坏TGFβRII,这在其他研究中已经进入临床阶段[45].在这里,我们假设通过CRISPR/Cas9在CAR - t细胞中基因组敲除TGFβ受体将改善其在实体肿瘤环境中的功能,因为它们将能够抵抗免疫抑制TME中TGFβ的抑制作用。
最重要的障碍之一是选择最佳抗原[46,47,48]:除了肿瘤细胞上缺乏肿瘤特异性抗原外,大多数靶向实体肿瘤的CAR - t细胞都是基于肿瘤相关抗原,这些抗原在肿瘤细胞上高度表达,但同时在正常组织上也有一定程度的表达,这可能导致“靶上”但“脱靶”的毒性。在这里,我们重点研究了两种卵巢癌相关抗原,它们极有可能在正常组织中不表达或很少表达。Reinhard等人最近得出结论,CLDN6是一种癌胎细胞表面抗原,对CAR - t细胞介导的免疫治疗具有理想的表达谱(图2)。1) (13].为了推广我们的策略,我们还关注了间皮素(MSLN)特异性CAR - t细胞,在一些临床研究中,它已被证明是一个安全的靶点[49].
人们应该记住,尽管CRISPR/Cas9 KO在CD4+和CD8+ t细胞中有20-60%的功效,这取决于所使用的gRNA,但我们使用包括编辑和未编辑细胞的批量CAR - t细胞进行了实验。因此,对于均质编辑或纯化的t细胞群体,TGFβ抗性的有益影响应该更加明显。尽管如此,我们可以清楚地证明CAR -t细胞在抗肿瘤功能的不同方面从敲除TGFβRII中受益:
首先,TGFβRII信号通路的基因组失活不会影响外源引入的CAR分子的表达,而与表达系统无关,这是产生抗原特异性效应t细胞的必要前提。
其次,即使在抗炎细胞因子提供的最高剂量下,TGFβ rii KO CAR - t细胞也能抵抗TGFβ的抗增殖作用。这可能不仅对CAR - T细胞的分化状态、生存能力和持久性产生积极影响,而且最重要的是,对肿瘤部位治疗性T细胞的绝对数量产生积极影响:事实证明,非衰老表型的效应细胞如中枢记忆T细胞(T厘米)产生对抗肿瘤细胞的免疫反应[50].此外,我们还证明,应答者TGFβ rii KO CAR - t细胞也能够在调节性t细胞“原位”分泌的TGFβ存在下增殖,这至少部分地模拟了TME中的免疫抑制环境。
第三,CAR - t细胞能够在外源性TGFβ存在的情况下恢复其细胞毒功能,即使是在重复抗原暴露的情况下:在这里,我们表明CD8+ TGFβ rii KO CAR - t细胞在外源性添加过量TGFβ的情况下保留其主要功能。抗原经历过的TGFβ rii KO CAR - t细胞能够承受由TGFβ触发的抑制,并被证明在连续的再刺激周期后能够恢复完全裂解,尽管它们在衰老表型方向上已经分化。这一特征是维持长寿命的细胞毒性t细胞群以防止克隆性肿瘤逃逸变异的生长的关键。
第四,TGFβ rii KO CAR - t细胞也能保留一组细胞因子的分泌,而WT CAR - t细胞在分泌促炎细胞因子如TNF-α和IFNγ、生长因子GM-CSF和IL2以及细胞毒介质颗粒酶B方面受到了严重阻碍。总之,我们的研究结果支持这样一种观点,即通过CRISPR/Cas9基因缺失来阻断TGFβRII信号通路可能是一种在抑制肿瘤微环境中抗原特异性释放抗肿瘤CAR -t细胞功能的新方法。
结论
目前已经证实,TGFβ显著抑制CD8+ T细胞的细胞毒功能,并通过诱导CD4+ T细胞转化为调节性T细胞来影响CD4+ T细胞的分化和功能。
在目前的研究中,我们促使我们利用CRISPR/Cas9基因组编辑工具,分别针对MSLN和CLDN6的两个不同的第二代BBς CARs,研究TGFβ信号通路在t细胞中完全关闭的影响。我们的研究清楚地表明,CAR -t细胞在抗肿瘤功能的不同方面受益于敲除TGFβ rii:即使在应用的细胞因子最高剂量下,TGFβ rii KO CAR -t细胞也能抵抗TGFβ的抗增殖作用,即使在重复抗原暴露实验中,它们也能在外源性TGFβ存在的情况下保持其细胞毒功能。它们还可以保留它们的细胞因子分泌谱,包括TNF-α、IFNγ、GM-CSF、IL2和颗粒酶b。我们还可以证明TGFβRIIKO CAR - t细胞可以“原位”承受tgf β介导的iTregs的抑制作用。相比之下,对于WT型CAR - t细胞,在TGFβ存在的情况下,评估的所有效应功能都显著受损。这些观察结果可能强调了在未来的临床试验中应用tgf β rii介导的信号通路的基因组破坏作为促进CAR - t细胞免疫治疗对免疫抑制性肿瘤实体的疗效的一种手段的前景。
数据和材料的可用性
本研究中使用和分析的数据集可根据合理要求从通讯作者处获得。
改变历史
2022年6月11日
经费清单已更新。
缩写
- 汽车t细胞:
-
嵌合抗原受体t细胞
- 部件。
-
细胞系
- TGFβ:
-
转化生长因子β
- TGFβRII KO CAR - t细胞:
-
TGFβ受体II敲除CAR - t细胞
- 诊断:
-
体外转录
- MSLN:
-
Mesothelin
- CLDN6:
-
Claudin 6
参考文献
波特DL,等。嵌合抗原受体修饰的T细胞在慢性淋巴白血病中的应用。中华外科杂志,2011;
Maude SL,等。b细胞淋巴母细胞白血病儿童和青年患者的Tisagenlecleucel。中华实用医学杂志,2018;26(5):439-48。
Neelapu SS,等。Axicabtagene ciloleucel CAR - t细胞治疗难治性大b细胞淋巴瘤。中华实用医学杂志,2017;26(3):344 - 344。
Newick K,等。CAR - T细胞治疗实体瘤。2017; 68:139-52。
Wrzesinski SH, Wan YY, Flavell RA。转化生长因子β和免疫反应:对抗癌治疗的意义。临床癌症杂志2007;13(18):5262-70。
Massagué J. TGFβ在癌症中的作用。细胞。2008;134(2):215 - 30。
王晓明,Massagué J.转化生长因子β信号通路与肿瘤的关系。免疫力。2019;(4):924 - 40。
Derynck R, Budi EH。TGF-β家族信号的特异性、通用性和控制科学信号。2019。https://doi.org/10.1126/scisignal.aav5183.
Kloss CC,等。显性阴性TGF-β受体增强psma靶向的人CAR - T细胞增殖并增强前列腺癌的根除。生物化学学报,2018;26(7):1855-66。
Bollard CM等。利用转化生长因子β相关的肿瘤保护策略增强抗肿瘤免疫。中华血液学杂志,2002;29(9):366 - 366。
Narayan V,等。psma导向/ tgf β不敏感CAR-T细胞在转移性去势抵抗性前列腺癌中的I期临床试验中华临床杂志2019;37(7):TPS347。
Ushiku T,等。claudin-6,一种原始表型紧密连接分子,在生殖细胞肿瘤和内脏癌中的独特表达模式。组织病理学。2012;61(6):1043 - 56。
Reinhard K,等。RNA疫苗驱动claudin-CAR-T细胞对抗实体肿瘤的扩增和有效性。科学。2020;367(6476):446 - 53年。
间皮素是正常小鼠发育或繁殖所不需要的。分子生物学杂志,2000;20(8):2902-6。
张晓明,张晓明,张晓明,等。间皮素靶向car - T细胞在实体肿瘤中的作用。癌症杂志,2016;6(2):133-46。
Holtkamp S,等。修饰抗原编码RNA可增加树突状细胞的稳定性、翻译功效和t细胞刺激能力。血。2006;108(13):4009 - 17所示。
用于体外治疗筛选的三维肿瘤球体模型:一种增强所获得数据生物学相关性的系统方法。科学通报2016;6(1):1 - 11。
Gressner AM,等。tgf - β在肝纤维化中的作用生物科学前沿,2002;7(4):793-807。
Junker U,等。转化生长因子- 1在肾细胞癌患者血浆中显著升高。细胞因子。1996;8(10):794 - 8。
侯俊杰,等。TGF-β反应性CAR-T细胞促进抗肿瘤免疫功能。生物翻译医学,2018;3(2):75-86。
Jinek M,等。可编程双rna引导的DNA内切酶在适应性细菌免疫。科学。2012;337(6096):816 - 21所示。
Doench JG,等。优化sgRNA设计,最大限度地提高CRISPR-Cas9的活性和最小化脱靶效应。中国生物工程学报,2016;34(2):184-91。
Golumba-Nagy V等。CD28 ζ CAR - T细胞通过IL-2信号通路抵抗TGF-β的抑制,这可以被工程的IL-7自分泌环路所模仿。Mol治疗。2018;26(9):2218-30。
Thomas DA, Massagué J. TGF-β在免疫监测肿瘤逃避过程中直接靶向细胞毒性T细胞功能。中华癌症杂志,2005;8(5):369-80。
唐宁,等。通过CRISPR抑制TGF-β促进CAR - T细胞对抗实体瘤的长期疗效。JCI Insight, 2020。https://doi.org/10.1172/jci.insight.133977.
Stüber T,等。抑制TGF-β受体信号通路增强ror1特异性CAR - t细胞对三阴性乳腺癌的抗肿瘤功能。免疫癌症杂志,2020。https://doi.org/10.1136/jitc-2020-000676.
福斯特AE,等。以显性负TGF-β受体转导的ebv特异性T淋巴细胞的抗肿瘤活性中华免疫杂志,2008;31(5):500。
Nakamura K, Kitani A, Strober W. CD4+ CD25+调节性T细胞接触依赖性免疫抑制是由细胞表面结合转化生长因子β介导的。中华检验医学杂志,2001;26(5):529 - 529。
中村K,等。TGF-β1在人、小鼠CD4+ CD25+调节性T细胞活性机制中发挥重要作用。中华免疫杂志,2004;29(2):344 - 344。
陈明龙,等。体内调节性T细胞通过TGF-β信号抑制肿瘤特异性CD8 T细胞的细胞毒性。中国科学(d辑:自然科学),2005;
Fahlén L,等。不能对TGF-β产生反应的T细胞逃脱CD4+ CD25+调节性T细胞的控制。中华检验医学杂志,2005;21(5):344 - 344。
Schmidt A,等。IL-2、tgf - β、维甲酸、雷帕霉素和丁酸联合诱导人CD4+ Foxp3+调节性T细胞方案的比较分析PLoS ONE。2016; 11 (2): e0148474。
李志强,李志强,李志强,等。treg介导T细胞抑制的分子机制研究。Front Immunol, 2012。https://doi.org/10.3389/fimmu.2012.00051.
Wright GP,等。采用原代调节性T细胞的过继治疗可导致关节炎的抗原特异性抑制。自然科学进展,2009;26(4):344 - 344。
Thibault B,等人。卵巢癌微环境:癌症扩散和化疗耐药获得的意义。癌症转移杂志2014;33(1):17-39。
Teicher英航。恶性细胞,恶性过程的导演:转化生长因子- β的作用。癌症转移杂志2001;20(1):133-43。
于Y,等。癌症相关成纤维细胞通过旁分泌TGF-β信号诱导乳腺癌细胞的上皮-间充质转化。中华肿瘤学杂志,2014;11(3):724-32。
Dalal B, Keown P, Greenberg A.分泌转化生长因子- β 1在人乳腺癌原发肿瘤进展边缘和淋巴结转移的免疫细胞化学定位。中华病理学杂志。1993;43(2):381。
Grady WM,等。转化生长因子β受体II型在微卫星稳定型结肠癌中的突变失活癌症杂志1999;59(2):320-4。
Dunn GP等。癌症免疫编辑:从免疫监测到肿瘤逃逸。中华免疫杂志2002;3(11):991-8。
Galliher AJ, Schiemann WP。β 3整合素和Src促进转化生长因子β介导的乳腺上皮细胞上皮-间充质转化。乳腺癌决议2006;8(4):1-16。
张志林,等。用嵌合抗原受体重新连接t细胞对可溶性因子的反应。中国生物化学杂志,2018;14(3):317。
刘敏,等。TGF-β抑制2型癌症免疫大自然。2020;587(7832):115 - 20。
李S,等。通过靶向TGF-β信号阻断TH细胞的癌症免疫治疗。大自然。2020;587(7832):121 - 5。
Stadtmauer EA,等。crispr工程T细胞在难治性癌症患者中的应用科学。2020;367(6481):7365。
Morgan RA等。一例严重不良事件的报告后,管理转导与嵌合抗原受体识别ERBB2的T细胞。Mol治疗。2010;18(4):843-51。
Richman SA,等。在临床前成神经细胞瘤模型中,高亲和力gd2特异性CAR - T细胞诱导致死性脑炎。中国癌症杂志,2018;6(1):36-46。
Lamers CH,等。CAIX car工程T细胞治疗转移性肾细胞癌:靶向毒性的临床评估和管理。Mol Therapy. 2013;21(4): 904-12。
Beatty GL,等人。间皮特异性嵌合抗原受体mrna工程T细胞诱导实体性恶性肿瘤的抗肿瘤活性。中国癌症杂志,2014;2(2):112-20。
Klebanoff CA, Gattinoni L, Restifo NP。通过亚群分类:哪些t细胞群介导高效的过继免疫治疗?中华免疫杂志,2012;35(9):651-60。
确认
我们感谢Ugur Sahin在这个项目期间的大力支持。此外,我们要感谢BioNTech细胞和基因治疗(BCGT)团队,特别是Petra Oehm,为我们提供了技术建议,并让我们有机会使用Xcelligence和Incucyte设备。
资金
由Projekt DEAL启动和组织的开放获取资金。本研究由美因茨约翰内斯古登堡大学医学中心转化肿瘤学研究所(TRON)资助,并批准no. 1。伊朗伊斯兰共和国生物技术发展委员会第960404号批准。伊朗国家科学基金会(INSF)的96011546。
作者信息
作者及隶属关系
贡献
研究概念和设计:KA、RHV、SA和JH。实验执行:KA、EM、LJ、HRM。数据分析与解释:统计分析:KA、RHV、SA、MD、MB、JH稿件起草:KA、RHV。关键修订和最终审稿:RHV, MD, MB和KA。研究指导:RHV、MD、SA、JH。所有作者都对本文有贡献。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
这项研究没有涉及任何人类参与者和动物。
发表同意书
所有作者都已批准稿件提交。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
这篇文章的原稿经过了修改。资助说明:本研究由美因茨约翰内斯古登堡大学医学中心转化肿瘤学研究所(TRON)资助,并批准no。伊朗伊斯兰共和国生物技术发展委员会第960404号批准。伊朗国家科学基金会(INSF)的96011546。本研究由美因茨约翰内斯古登堡大学医学中心的转化肿瘤研究所(TRON)资助,并批准no。伊朗伊斯兰共和国生物技术发展委员会第960404号批准。伊朗国家科学基金会(INSF)的96011546。由Projekt DEAL启动和组织的开放获取资金。
补充信息
附加文件1:图S1。
SK-OV-3球形杀伤实验表明,CAR - MSLN T细胞具有特异性反应,在E:T比为1:1时识别并杀死HeLa细胞,而在E:T比为30:1时不能杀死SK-OV-3细胞。
附加文件2:图S2。
对野生型和A: gRNA3、B: gRNA5处理组的直方图测序结果显示,在互补的5’-NGG pam -序列上游的gRNA靶靶序列内有一个4个碱基的异源序列,与indel形成一致。
附加文件3:图S3。
CLDN6特异性CAR - t细胞的基因组TGFβ RII破坏增强了细胞因子的分泌。TGFβ在任何剂量下都能抑制cldn6特异性WT CAR 4-1BBζ t细胞的细胞因子分泌。A: IL-2, B: IFNγ, C: TNFα, D: GM-CSF, E:颗粒酶B,当抗原提呈iDCs作为APCs时。重要的是,即使在非常高剂量的外源性TGFβ下,TGFβ rii KO CAR - t细胞中的细胞因子数量仍未受损和稳定。WT组和KO组细胞因子的分泌也被证明是抗原特异性的。P值采用双因素方差分析,采用多重比较检验。* p < 0.05;** p < 0.01;*** p < 0.001;**** p < 0.0001。 In all experiments, mean ± SD of three technical replicates are given and experiments, involving T cells, are repeated for at least three donors.
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Alishah, K, Birtel, M, Masoumi, E。et al。CRISPR/ cas9介导的TGFβRII破坏增强了体外人嵌合抗原受体T细胞的抗肿瘤疗效。翻译医学杂志19, 482(2021)。https://doi.org/10.1186/s12967-021-03146-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-021-03146-0
关键字
- CAR - t细胞疗法
- 共抑制t细胞信号
- TGFβ受体II
- 基因组编辑
- CRISPR / Cas9淘汰赛
- IVT-RNA