- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
CAR-T细胞治疗HER2的上下文重编程gydF4y2Ba+gydF4y2Ba癌症gydF4y2Ba
转化医学杂志gydF4y2Ba体积gydF4y2Ba19gydF4y2Ba,文章号:gydF4y2Ba459gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
嵌合抗原受体(CAR)工程T细胞过继移植联合检查点抑制可能预防T细胞衰竭并改善临床结果。然而,这种方法受到累积成本和毒性的限制。gydF4y2Ba
方法gydF4y2Ba
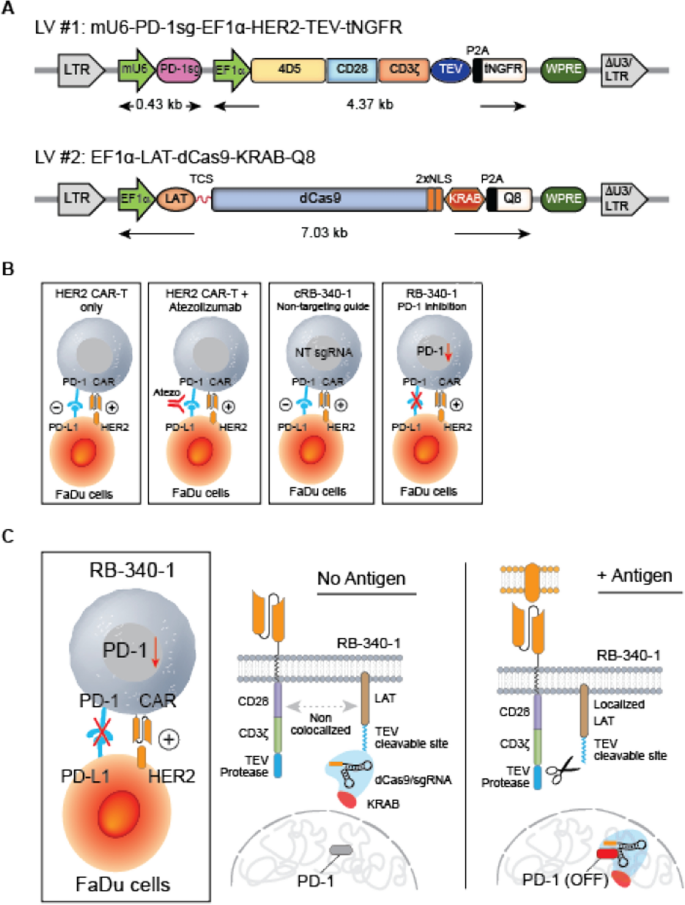
为了克服这一缺陷,我们创建了一种CAR-T (RB-340-1),它将两种模式结合在一个产品中:CRISPR干扰(CRISPRi)电路防止抗原相遇时程序性细胞死亡蛋白1 (PD-1)的表达。rb - 440 -1被设计用于表达一种抗人表皮生长因子受体2 (HER2) CAR单链可变片段(scFv),其中CD28和CD3ζ共刺激域与烟草刻蚀病毒(TEV)蛋白酶相连,以及一种靶向PD-1转录起始位点(TSS)的单一引导RNA (sgRNA)。第二种结构包括通过tev可切割序列(TCS)融合到核酸酶失活的spCas9 (dCas9)- kruppel相关盒(KRAB)的T细胞激活连接子(LAT)。抗原相遇时,LAT-dCas9-KRAB (LdCK)复合体被TEV切割,允许dCas9-KRAB靶向PD-1基因TSS。gydF4y2Ba
结果gydF4y2Ba
在本研究中,我们发现RB-340-1始终表现出较高的稳态细胞因子产量,增强CAR-T细胞的体外扩增,延长体内持久性和更有效地抑制HER2gydF4y2Ba+gydF4y2Ba发都口咽癌的生长与各自的常规CAR-T细胞产物相比。gydF4y2Ba
结论gydF4y2Ba
作为CRISPRi在临床相关产品上的首次应用,具有条件性、非基因编辑和可逆抑制的RB-340-1促进了CAR-T细胞对检查点抑制的恢复力,以及它们对her2表达癌异种移植的持久性和有效性。gydF4y2Ba
简介gydF4y2Ba
过继细胞治疗(ACT)的成功取决于T细胞的持久性和移植物[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].活化T细胞表达共抑制受体,包括程序性细胞死亡蛋白-1 (PD-1),这限制了它们在体内的持久性,并产生较低的临床效益[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].将PD-1阻断剂和ACT与嵌合抗原受体(CAR)工程T细胞联合使用可延长持久性[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].然而,这种策略受到累积成本和系统性毒性的限制。新的方法着眼于单一的ACT产品,具有多种功能,包括CAR-T细胞的细胞因子或促炎因子的组成性分泌[gydF4y2Ba7gydF4y2Ba], CAR-T细胞靶向递送抗pd -1单链可变片段(scFv) [gydF4y2Ba8gydF4y2Ba]或通过聚簇规则间隔短回文重复序列(CRISPR)技术永久敲除PD-1基因[gydF4y2Ba9gydF4y2Ba].最近,Lynn等人。[gydF4y2Ba10gydF4y2Ba]提出过表达c-Jun可抑制PD-1等检查点,从而增强T细胞持久性,提高抗肿瘤疗效。然而,这些构成性方法导致DNA结构的永久性改变,并增加了由条件系统预防的肿瘤转化的风险,在条件系统中,基因表达以上下文依赖的方式调节,而不会导致DNA结构的永久性改变。gydF4y2Ba
我们之前描述了一种基于核酸酶失活的crispr相关(dCas9)蛋白的非编辑基因表达调控策略,它为rna引导的DNA靶向提供了一个平台[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].dCas9与效应域的融合使哺乳动物细胞的转录受到有效的抑制或激活,传递位点由共表达的单一引导RNA (sgRNA)决定。将dCas9偶联到一个转录抑制因子,Kruppel-associated box domain (KRAB)可以抑制多个内源性基因的表达。RNA-seq分析表明,CRISPR干扰(CRISPRi)介导的转录抑制具有高度特异性[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].随后,我们描述了一种策略,通过g蛋白偶联受体/配体传感将CRISPR-dCas9基因组调控与自然或合成的细胞外信号耦合,以响应一系列合成化合物、趋化因子、有丝分裂原、脂肪酸和激素[gydF4y2Ba15gydF4y2Ba].gydF4y2Ba
在这里,我们提出了b -340-1,作为一种多功能T细胞产品,将抗人表皮生长因子受体2 (HER2) CAR信号与crispr介导的PD-1基因抑制结合,以延长CAR-T细胞的持久性并提高治疗效果。RB-340-1始终表现出更高的稳态细胞因子产量,增强CAR-T细胞的体外扩增,延长体内持久性和更有效地抑制HER2gydF4y2Ba+gydF4y2Ba发都口咽癌的生长与各自的常规CAR-T细胞产物相比。gydF4y2Ba
结果gydF4y2Ba
RB-340-1暴露于HER2后有条件地阻止PD-1的表达gydF4y2Ba+gydF4y2Ba并显示出比传统CAR-T细胞更好的体外扩增gydF4y2Ba
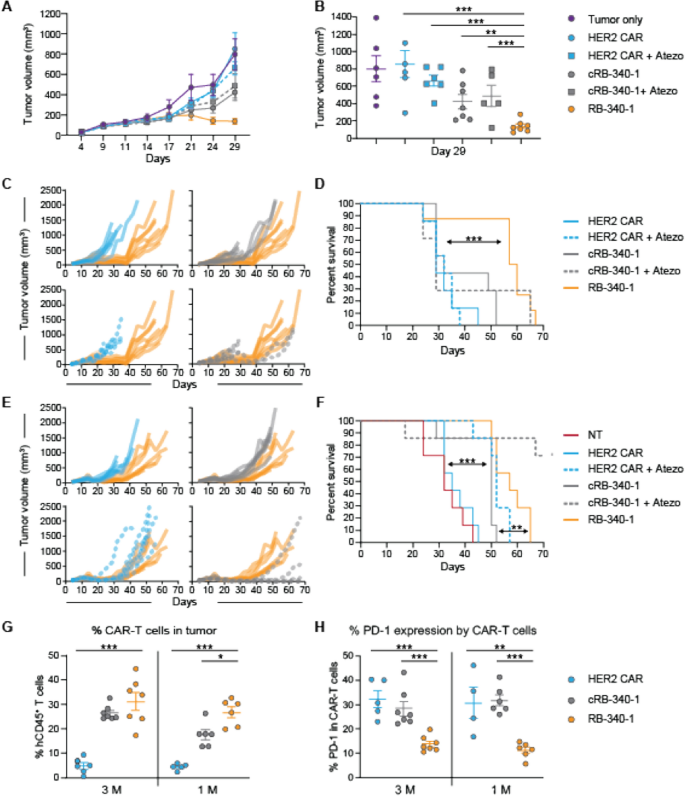
RB-340-1包括两种慢病毒结构(图。gydF4y2Ba1gydF4y2Ba) (gydF4y2Ba16gydF4y2Ba].第一种(HER2-TEV)编码抗her2 (4D5克隆)[gydF4y2Ba17gydF4y2Ba] scFv结合CD28和CD3ζ共刺激结构域,烟草刻蚀病毒(TEV)蛋白酶和一个靶向内源性PD-1基因(PD-1sg)转录起始位点(TSS)的sgRNA。第二种结构(LdCK)编码T细胞激活的连接子(LAT),通过tev可切割序列(TCS)与dCas9-KRAB融合。CAR的激活使TEV进一步接近LdCK,通过核定位序列(NLS)释放dCas9-KRAB进行核易位,并有条件地抢先表达PD-1(图2)。gydF4y2Ba1gydF4y2BaB, C). RB-340-1还包含用于评估转导效率和分类各自细胞群的细胞外标记:截断的神经生长因子受体(tNGFR)与HER2-TEV相连,Q8是CD34的一个16残基序列,与CD8柄相连,是LdCK的一部分[gydF4y2Ba18gydF4y2Ba].tNGFR的表达与抗曲妥珠单抗(抗4D5表位独特型)抗体FAB95471R-100G的HER2 CAR表达平行(研发系统,附加文件)gydF4y2Ba1gydF4y2Ba:图S1A)。Q8的表达是LdCK表达的代表,因为它遵循类似的动力学(附加文件gydF4y2Ba1gydF4y2Ba:图S1B)。这种间接评估是不可避免的,因为据我们所知,没有可靠的细胞内染色方法可用。在早期评估该方法可行性的先导实验中,也使用了绿色荧光蛋白(GFP)和mCherry (mChr) [gydF4y2Ba16gydF4y2Ba].制造工作流程显示在附加文件中gydF4y2Ba1gydF4y2Ba:图S1C。gydF4y2Ba
一个gydF4y2Barb -340-1的慢病毒成分包括两种慢病毒(LV)结构物。LV#1 (HER2-TEV)编码一种与CD28和CD3ζ共刺激结构域结合的抗her2 (4D5克隆)单链抗体,TEV蛋白酶和PD-1sg靶向内源性PD-1基因的TSS。LV#2 (LdCK)编码LAT,通过TEV-cleavable sequence (TCS)融合到dCas9-KRAB。RB-340-1还含有两个细胞外标签:LdCK的Q8部分和HER2-TEV的tNGFR部分。在早期实验中,GFP和mCherry分别用于检测LdCK或HER2-TEV。gydF4y2BaBgydF4y2BaRB-340-1在CAR-T细胞激活时有条件地抑制PD-1的表达,而相应的对照如常规HER2 CAR-T或没有靶向指导的RB-340-1技术对照(cRB-340-1)则不会。gydF4y2BaCgydF4y2BaHER2-TEV/LdCK的激活机制CRISPRi平台- HER2 CAR的激活使TEV靠近LdCK释放dCas9-KRAB进行核转位到PD-1 TSS,并有条件地、可逆地抑制PD-1表达。该图表示稳态水平的LdCK表达的CRISPRi逻辑。然而,LdCK的表达根据单个细胞的生理代谢状态而变化,导致转录活性程度不同,因此TEV切割的底物可用性也不同。这反过来又形成了如图所示的条件性。gydF4y2Ba2gydF4y2Ba一个gydF4y2Ba
RB-340-1有条件表达LdCK。选择伸长因子1α (EF1α)是因为初步实验表明,在原代人T细胞中,该启动子在CAR刺激后产生了LdCK表达的最大倍数增加。值得注意的是,尽管EF1α在细胞代谢的稳定状态下起着组成性启动子的作用,但其效率取决于转录机制的激活状态,而当T细胞从休眠状态转变为抗原诱导的激活状态时,转录机制又会发生剧烈变化。gydF4y2Ba
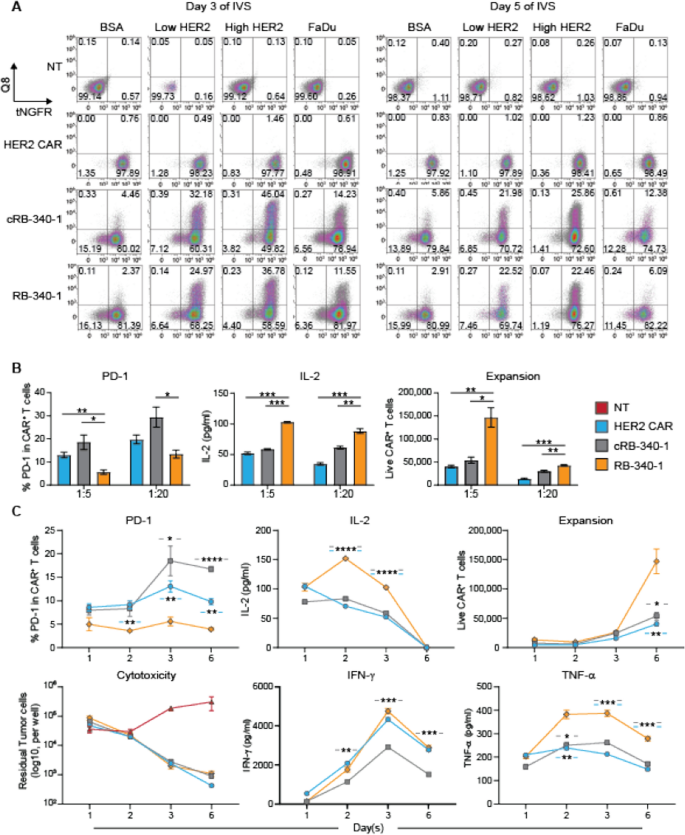
在同一启动子下,HER2-TEV (tNGFRgydF4y2Ba+gydF4y2Ba细胞)表现为构成性表达,LdCK (Q8gydF4y2Ba+gydF4y2Ba细胞)表达依赖于HER2-TEV刺激(附加文件gydF4y2Ba1gydF4y2Ba:图S1B;无花果。gydF4y2Ba2gydF4y2BaA).这种差异是由于较短的HER2-TEV结构的转录效率更高,在T细胞激活的基线条件下饱和表达。诱导率呈时间依赖性,在刺激后第3天达到峰值,之后逐渐下降。此外,当用涂有HER2蛋白外膜的珠粒刺激RB-340-1时,我们观察到LdCK的密度依赖性诱导。这是由于通过CAR/抗原接合更强的刺激,也可以通过记录CD69和PD-1在不同密度的HER2 CAR- t细胞中的诱导看到gydF4y2Ba2gydF4y2Ba:图S2A)。重要的是,珠子与HER2 CAR-T细胞的比例决定了两种激活标记的表达,强调了总体抗原暴露和密度调节激活的原则。gydF4y2Ba
一个gydF4y2Ba用牛血清白蛋白(BSA)包被珠粒、低密度或高密度的HER2外膜(低HER2和高HER2)或HER2以1:1效应靶比刺激LdCK-Non-transduced (NT)、常规HER2 CAR、cRB-340-1和RB-340-1细胞的诱导表达gydF4y2Ba+gydF4y2BaFaDu细胞,并在刺激后的第3天和第5天检测her2 - tev链接标记tNGFR或ldck链接标记Q8的表达;每个细胞群的百分比显示在各自的象限中。gydF4y2BaBgydF4y2BaCAR-T细胞以1:5和1:20 E:T比暴露于FaDu细胞系6天后,通过RB-340-1-PD-1表面表达、IL-2分泌和T细胞增殖调节细胞功能。gydF4y2BaCgydF4y2BaRB-340-1细胞功能动力学:FaDu细胞以1:5效靶比刺激后PD-1表达、IL-2、IFN-γ和TNF-α分泌、细胞毒活性和CAR-T细胞扩增的代表动力学。类似的结果得到1:20效应器靶比(未显示)。只有rb - 340 - 1 -相关的gydF4y2BapgydF4y2Ba数值在所有面板中按星号排列,在下面板中星号周围的蓝色连字符表示RB-340-1与传统HER2 CAR之间的统计差异,灰色连接符表示RB-340-1与cRB-340-1之间的统计差异。完整的统计矩阵由附加文件显示gydF4y2Ba6gydF4y2Ba:这里及以后的表S1gydF4y2Ba
将RB-340-1与传统的HER2 CAR- t细胞(HER2 CAR)进行比较,该细胞含有RB-340-1 HER2- tev衍生物和对照cRB-340-1(与RB-340-1相同,除了PD-1sg)。CAR-T细胞在体外和体内测试抗HER2gydF4y2Ba+gydF4y2BaFaDu口咽癌细胞被设计成组成性表达程序性细胞死亡配体-1 (PD-L1),以稳定PD-1/PD-L1相互作用(以下简称FaDu)。在gydF4y2Ba在活的有机体内gydF4y2Ba研究中,HER2 CAR和cRB-340-1 CAR- t细胞也与atezolizumab联合使用(5 mg/kg静脉注射,每周两次)。gydF4y2Ba
与对照组相比,当暴露于FaDu细胞时,rbc -340-1显著地抢占了PD-1的上调,并显著地增强了白细胞介素(IL)-2的分泌和CAR-T细胞的扩增(图2)。gydF4y2Ba2gydF4y2BaB)后者在刺激后6天变得明显(图;gydF4y2Ba2gydF4y2BaC).这与PD-1主要调节增殖/存活和防止衰竭的概念一致[gydF4y2Ba19gydF4y2Ba].与常规HER2 CAR相比,对照cRB-340-1在1:20效应靶比(E:T)下显示出更高的IL-2产量(p值= 0.001)和增强的T细胞扩增(p值< 0.01)gydF4y2Ba6gydF4y2Ba:表S1)。这可能是由于LdCK结构特有的LAT的过表达,已知LAT本身可以增强T细胞的活化和持久性[gydF4y2Ba20.gydF4y2Ba].然而,与RB-340-1相比,这些差异较小。细胞毒活性在RB-340-1与对照组之间没有显著差异,IFN-γ释放仅优于cRB-340-1,而RB-340-1与常规HER2 CAR和cRB-340-1相比,肿瘤坏死因子(TNF)-α释放增强(图2)。gydF4y2Ba2gydF4y2BaC;额外的文件gydF4y2Ba6gydF4y2Ba:表S1)。gydF4y2Ba
RB-340-1包括CD4的混合物gydF4y2Ba+gydF4y2Ba和CD8gydF4y2Ba+gydF4y2BaT细胞在选择和OKT3/CD28刺激后集体转导(附加文件)gydF4y2Ba2gydF4y2Ba:图S2B)。在转导后10天的体内给药时,最终产物始终包含较大比例的CD4gydF4y2Ba+gydF4y2BaT细胞(大多数情况下为60-70%)。为了研究两个种群的功能属性,我们在体外比较了在不同CD4时混合的每种成分的细胞毒活性和存活率gydF4y2Ba+gydF4y2Ba/ CD8gydF4y2Ba+gydF4y2Ba并暴露于FaDu细胞3天(附加文件gydF4y2Ba2gydF4y2Ba:图S2B)。两个亚群表现出相同的细胞毒活性。然而,CD4gydF4y2Ba+gydF4y2Ba所有CAR-T细胞产物中的T细胞均表现出较高的持久性。gydF4y2Ba
如其他系统所述[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba14gydF4y2Ba], CRISPRi基因靶向是特异性的,可以多路复用。PD-1sg或t细胞免疫球蛋白和含有粘蛋白结构域-3 sgRNA (TIM-3sg)的CAR-TEV构建物分别特异性地阻止了FaDu细胞刺激后PD-1和TIM-3的上调。只有将两者组合在一个CAR-TEV中才能抑制两个检查点(附加文件)gydF4y2Ba2gydF4y2Ba:图S2C)。动力学实验证明RB-340-1抑制PD-1是持久和特异性的(附加文件gydF4y2Ba2gydF4y2Ba:图S2D)。gydF4y2Ba
在衰竭试验中,RB-340-1部分抑制检查点的表达,增强增殖和白细胞介素-2的产生gydF4y2Ba
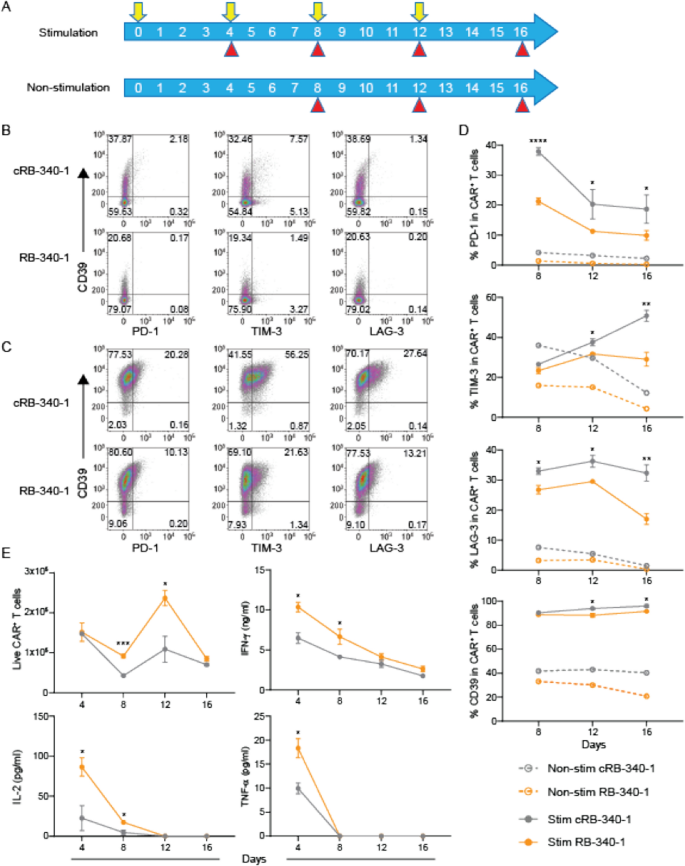
RB-340-1和cRB-340-1细胞每4天暴露于FaDu细胞4轮(图2)。gydF4y2Ba3.gydF4y2BaA),并比较PD-1、TIM-3和LAG-3在基线或刺激条件下的表达(图。gydF4y2Ba3.gydF4y2BaB, C)。在反复暴露于FaDu刺激下,RB-340-1中所有三个检查点的表达都被显著阻止(图。gydF4y2Ba3.gydF4y2BaD;额外的文件gydF4y2Ba6gydF4y2Ba:表S2)表明PD-1抑制对T细胞的功能影响超出了其特异性调控。的确,T细胞增殖和IL-2分泌在实验的早期阶段也得到了增强,但在反复刺激后,这种效果消退(图2)。gydF4y2Ba3.gydF4y2BaE)表明未来可以寻求进一步改善针对T细胞分化/成熟调控因子的T细胞适应度[gydF4y2Ba10gydF4y2Ba].gydF4y2Ba
PD-1下调部分缓解CAR - T细胞衰竭。gydF4y2Ba一个gydF4y2Ba肿瘤重复刺激试验方案。RB-340-1或cRB-340-1在第0天(E:T = 1:4)与FaDu肿瘤细胞共培养,并在第4、8和12天(黄色箭头所示)与FaDu细胞重新攻毒。未受刺激的CAR - T细胞保持在100u ml的培养基中gydF4y2Ba−1gydF4y2Ba- 2。在指定的时间点(红色箭头),收集CAR - T细胞并通过流式分析。非刺激组疲劳标志物CD39、PD-1、TIM-3和LAG-3在第16天的表面表达(gydF4y2BaBgydF4y2Ba)和受刺激的CAR - T细胞(gydF4y2BaCgydF4y2Ba).gydF4y2BaDgydF4y2BaFaDu细胞刺激(实线)和非刺激(虚线)后PD-1、TIM-3、LAG-3和CD39的代表性动力学。gydF4y2BaEgydF4y2BaFaDu细胞刺激后CAR - T增殖和IL-2、IFN-γ和TNF-α分泌的动力学gydF4y2BapgydF4y2Ba所有图中的数值用星号表示,表示RB-340-1与cRB-340-1之间的统计差异gydF4y2Ba
瘤内或全身给药后,RB-340-1在体内比传统CAR-T细胞表现更好gydF4y2Ba
在nod - sic - il2r γ皮下植入FaDu异种移植物后,对RB-340-1和相应对照进行体内检测gydF4y2Ba−gydF4y2Ba/gydF4y2Ba−gydF4y2Ba(NSG)老鼠。最初,每只小鼠瘤内注射了30万个(M) CAR-T细胞,以避免与系统捕获和低效运输相关的扰动[gydF4y2Ba21gydF4y2Ba].gydF4y2Ba
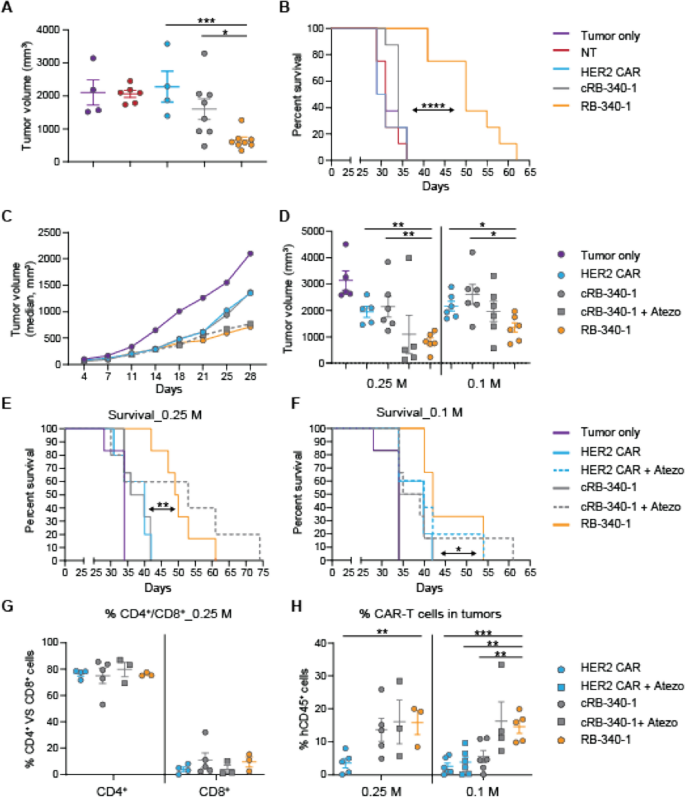
与对照组相比,RB-340-1表现出更强的肿瘤生长抑制作用,并延长了小鼠的生存期(图2)。gydF4y2Ba4gydF4y2BaA、B;额外的文件gydF4y2Ba3.gydF4y2Ba:图S3为研究设计和附加文件gydF4y2Ba6gydF4y2Ba:表S3)。在随后的实验中,两种CAR-T细胞剂量被测试为单一给药:每只小鼠0.1或0.25 M CAR-T细胞gydF4y2Ba4gydF4y2Ba:研究设计图S4)。RB-340-1比HER2 CAR或cRB-340-1更有效地抑制肿瘤生长。gydF4y2Ba4gydF4y2BaC, D)。与0.25 M的HER2 CAR和cRB-340-1相比,肿瘤生长的减少导致生存期显著延长(图。gydF4y2Ba4gydF4y2BaE)和0.1 M剂量(图;gydF4y2Ba4gydF4y2BaF). RB-340-1对肿瘤生长和动物生存的影响与系统给药atezolizumab联合cRB-340-1在0.25 M和0.1 M剂量下相似。与治疗无关,尸检时肿瘤中残留的CAR-T细胞仅为CD4gydF4y2Ba+gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2BaG)在这个免疫缺陷模型中CD4gydF4y2Ba+gydF4y2BaT细胞得益于一种内在的生存优势。重要的是,在具有0.25 M和0.1 M CAR-T细胞的动物中,RB-340-1组和cRB-340-1 + atezolizumab组中CAR-T细胞对肿瘤的定植更大。gydF4y2Ba4gydF4y2BaH)。gydF4y2Ba
肿瘤内RB-340-1对FaDu异种移植物的有效性-肿瘤内RB-340-1的体内疗效在两个不同的健康供体的独立实验中进行了研究。gydF4y2Ba一个gydF4y2Ba在供体#1中,第30天肿瘤生长的散点图(0.3 M CAR-T细胞剂量组)。gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba在供体#2中,平均肿瘤生长一直持续到第28天(gydF4y2BaCgydF4y2Ba0.25 M CAR-T细胞剂量组的数据);第28天之后,对照组的小鼠开始死亡,平均生长并不能提供信息。两剂量组随后在第32天采用散点图比较(gydF4y2BaDgydF4y2Ba).RB-340-1对供体1号存活-存活分析的影响(gydF4y2BaBgydF4y2Ba)和2号供体(gydF4y2BaEgydF4y2Ba,gydF4y2BaFgydF4y2Ba).CAR-T细胞瘤内持久性以供体#2为例,gydF4y2BaGgydF4y2BaCD4的比例gydF4y2Ba+gydF4y2Ba和CD8gydF4y2Ba+gydF4y2Ba相关治疗组的T细胞;gydF4y2BaHgydF4y2Ba在0.1 M细胞接种剂量下,RB-340-1定植在肿瘤上的CAR-T细胞数量显著增加gydF4y2Ba
初步滴定表明,静脉注射CAR-T细胞的数量要比瘤内注射高10倍才能获得与瘤内注射相当的结果。因此,每只小鼠给予1或3 M CAR-T细胞(附加文件)gydF4y2Ba5gydF4y2Ba:图S5A, B为研究设计)。在1 M剂量下,RB-340-1的表现明显优于其他所有处理(图2)。gydF4y2Ba5gydF4y2BaA, B)。在ACT治疗后29天,对照组的大量小鼠开始死亡,而与所有其他组相比,RB-340-1组的存活时间显著延长(图。gydF4y2Ba5gydF4y2BaC, D;额外的文件gydF4y2Ba6gydF4y2Ba:表S4)。在3m剂量下(图;gydF4y2Ba5gydF4y2BaE), RB-340-1的结果保持一致,而其他实验组在1 M剂量下的表现优于各自的表现。这在HER2 CAR和cRB-340-1联合atezolizumab时尤其明显,其在该剂量下的表现与RB-340-1相似,但在1m剂量下表现更差(图2)。gydF4y2Ba5gydF4y2BaF).正如瘤内给药所注意到的,系统治疗的RB-340-1小鼠更有效地定植肿瘤(图。gydF4y2Ba5gydF4y2BaG)并维持PD-1表达降低(图;gydF4y2Ba5gydF4y2BaH)。gydF4y2Ba
RB-340-1静脉注射对FaDu异种移植的有效性。gydF4y2Ba一个gydF4y2Ba观察tb -340-1对FaDu异种移植物的抗肿瘤活性-平均肿瘤生长直至第29天(数据显示1 M剂量CAR-T细胞);gydF4y2BaBgydF4y2Ba第29天之后,对照组的小鼠开始死亡,平均生长并没有提供信息。随后使用1 M剂量组的散点图作为第29天的示例。gydF4y2BaCgydF4y2BaRB-340-1对小鼠个体存活率的影响gydF4y2BaDgydF4y2Ba1 M剂量的累积生存期;gydF4y2BaEgydF4y2BaRB-340-1对小鼠个体存活率的影响gydF4y2BaFgydF4y2Ba3m剂量的累积生存期。gydF4y2BaGgydF4y2Ba肿瘤内hCD45持续存在gydF4y2Ba+gydF4y2BaCAR-T细胞和gydF4y2BaHgydF4y2BaPD-1表达hCD45的百分比gydF4y2Ba+gydF4y2Ba尸检中的CAR-T细胞gydF4y2Ba
LdCK是CRISPRi的活性成分,对其有效性至关重要gydF4y2Ba
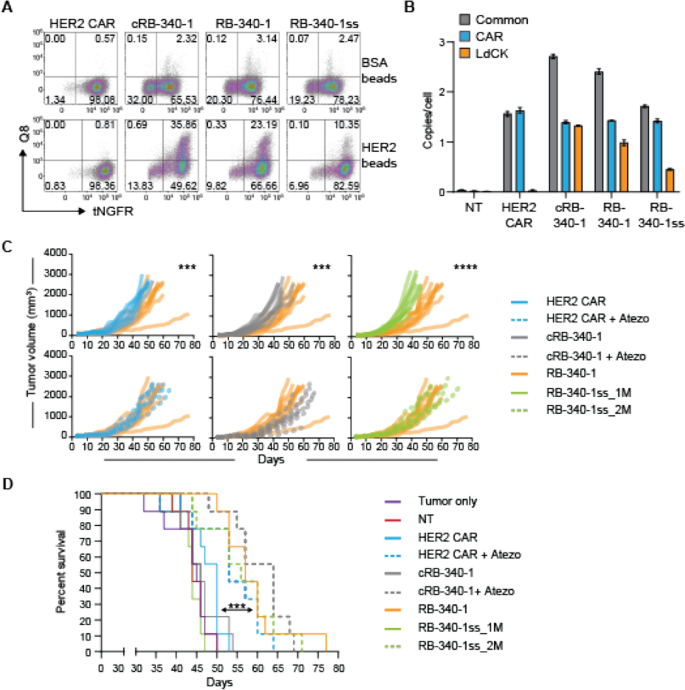
为了解决靶产品分析的监管原理,我们比较了仅通过tNGFR (HER2-TEV标记物)选择富集的RB-340-1(附加文件)gydF4y2Ba5gydF4y2Ba:图S5A, C): RB-340-1单选(RB-340-1ss)到RB-340-1,这是由于tNGFR的双重选择gydF4y2Ba+gydF4y2Ba/处置gydF4y2Ba+gydF4y2Bacell(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。这样做是为了比较CRISPRi组分在同一动物体内抗肿瘤活性的比例贡献,并评估两种分类技术是否会导致可比较的结果。以与RB-340-1相同的剂量(RB-340-1ss_1M)或双倍剂量(RB-340-1ss_2M)给予RB-340-1ss,以补偿含有两种活性元件的双阳性T细胞数量较少。的确,tNGFR的比例gydF4y2Ba+gydF4y2Ba/处置gydF4y2Ba+gydF4y2Ba给药小鼠的最终产品中的细胞从RB-340-1中的23.2%减少了大约一半,到RB-340-1ss中的10.4%(图2)。gydF4y2Ba6gydF4y2BaA)。这一比例是由HER2珠激活3天诱导LdCK表达推断出来的,如前所述(图2)。gydF4y2Ba2gydF4y2BaA).通过液滴数字PCR (ddPCR)也确认转导率为载体拷贝数(VCN)/每个细胞(如图。gydF4y2Ba6gydF4y2BaB)使用特定于两种结构共同的LV主干的引物(灰色条),或特定于HER2-TEV(蓝色条)或LdCK(橙色条)的结构标记。虽然在RB-340-1产品中HER2-TEV标记保持一致,但与cRB-340-1和RB-340-1相比,RB-340-1ss中ldck特异性VCN标记较低。在所有病例中,累积VCN均远低于fda推荐的≤5水平。gydF4y2Ba
LdCK作为RB-340-1功能的活性元件。gydF4y2Ba一个gydF4y2Ba释放产物的组成-用于小鼠的细胞被检测tNGFR和Q8的表达。为了检测LdCK的存在,在体外用HER2高珠刺激细胞3天。gydF4y2BaBgydF4y2Ba转导效率通过ddPCR分析VCN,采用代表累积转导率的所有结构共有的lv特异性引物(灰色条)、含car结构的特异性引物(蓝色条)和ldck特异性引物(橙色条)。gydF4y2BaCgydF4y2BaRB-340-1对单个小鼠肿瘤生长和存活的影响gydF4y2BaDgydF4y2Ba累计生存期(星号表示RB-340-1与其他实验组生存期的显著性水平)gydF4y2Ba
在限制肿瘤生长方面,RB-340-1明显优于传统的HER2 CAR和cRB-340-1。gydF4y2Ba6gydF4y2BaC)延长动物的生存时间(图;gydF4y2Ba6gydF4y2BaD;额外的文件gydF4y2Ba6gydF4y2Ba:表S5, RB-340-1与常规HER2 CAR、cRB-340-1或RB-340-1ss_1M之间的p值< 0.001)。RB-340-1ss_2M的结果与RB-340-1相当(RB-340-1ss_2M与常规HER2 CAR、cRB-340-1或RB-340-1ss_1M之间的p值< 0.01),而RB-340-1ss_1M与HER2 CAR和cRB-340-1相似。因此,只要给药的双阳性CAR-T细胞数量相当,两种分选策略就产生了相似的结果,这表明CRISPRi的活性成分对体内有效性至关重要。gydF4y2Ba
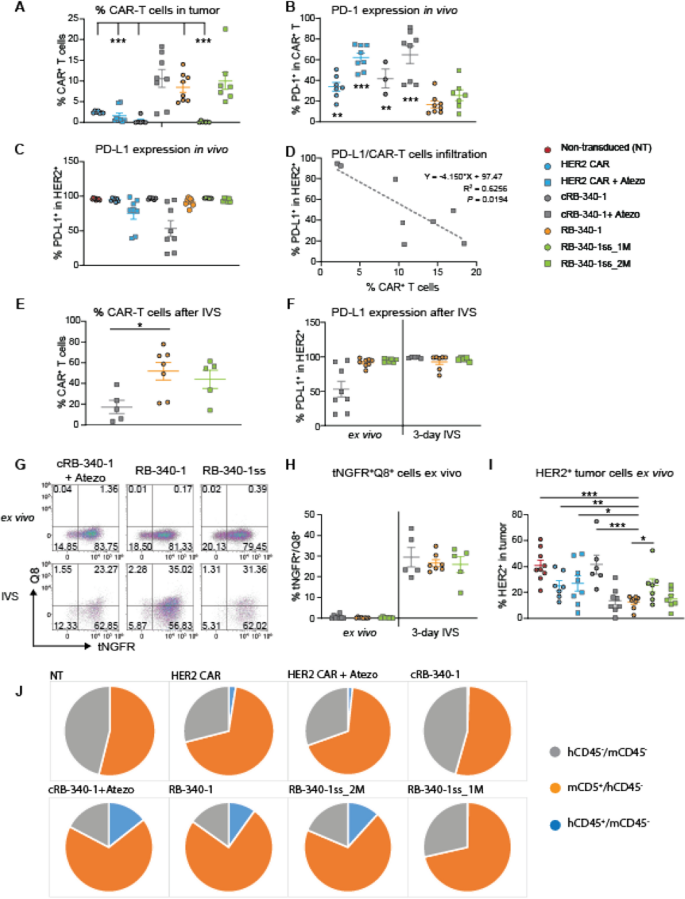
在采用RB-340-1、RB-340-1ss (2m剂量)和cRB-340-1联合atezolizumab治疗的小鼠中,CAR-T细胞对异种移植物的定植显著增加(图2)。gydF4y2Ba7gydF4y2Ba一个;额外的文件gydF4y2Ba6gydF4y2Ba:表S6)。证实了之前的观察结果,PD-1在RB-340-1中的表达显著降低(图。gydF4y2Ba7gydF4y2BaB).在atezolizumab治疗的动物中,由于PD-L1的阻断,PD-L1的占用在肿瘤中是不均匀的,尽管给药剂量据称是饱和的(图。gydF4y2Ba7gydF4y2BaC),并与尸检时残留的cRB-340-1 CAR-T细胞数量相关(图。gydF4y2Ba7gydF4y2BaD)。这强调了PD-1/PD-L1阻断在该模型中发挥的关键作用,无论是外部获得(cRB-340-1 + atezolizumab)还是内在获得(RB-340-1)。在用HER2珠体外刺激(IVS)从肿瘤中恢复的混合细胞群3天后,只有RB-340-1和RB-340-1ss_2M扩增,而来自crb -340-1处理动物的CAR-T细胞没有扩增(图2)。gydF4y2Ba7gydF4y2BaE)。这可能是由于癌细胞在体外恢复了PD-L1的表达,而在体外培养中没有添加atezolizumab(图。gydF4y2Ba6gydF4y2BaF).有趣的是,我们无法在任何rb -340-1治疗组中识别tNGFRgydF4y2Ba+gydF4y2Ba/处置gydF4y2Ba+gydF4y2Ba细胞离体。然而,这代表了上下文负性,因为在使用HER2珠的IVS三天之后,可以恢复高比例的双阳性细胞(图2)。gydF4y2Ba7gydF4y2BaG, H)提示在肿瘤快速生长的尸检时,CAR-T细胞的刺激不足以维持LdCK的表达。事实上,通过分析RB-340-1、RB-340-1ss_2M或cRB-340-1联合atezolizumab治疗的动物肿瘤中癌细胞的HER2表达,可以明显减少HER2的数量gydF4y2Ba+gydF4y2Ba癌细胞(FgydF4y2Ba我gydF4y2Bag。gydF4y2Ba7gydF4y2Ba这并不是由于单个癌细胞HER2的表达减少,而是由于CAR-T细胞的高定植和小鼠CD45的优势,这些组中HER2的表达频率与其他对照组相比被稀释gydF4y2Ba+gydF4y2Ba细胞(图。gydF4y2Ba7gydF4y2BaJ).由于CAR-T细胞与表达HER2的癌细胞相互作用的随机几率降低,这种分散间接地允许肿瘤细胞在体内逃逸。这反过来又限制了它们的活化,如珠滴实验所示,不仅是单个珠中抗原的密度,而且珠与效应细胞的比例也调节T细胞的活化(附加文件)gydF4y2Ba2gydF4y2Ba:图S2A)。gydF4y2Ba
CAR-T细胞在体内的持久性。gydF4y2Ba一个gydF4y2Ba每个实验组在尸检时肿瘤中CAR-T细胞的频率。gydF4y2BaBgydF4y2Ba肿瘤内hCD45表达PD-1的百分比gydF4y2Ba+gydF4y2BaCAR-T细胞。gydF4y2BaCgydF4y2Baatezolizumab -配体对PD-L1的占用是通过尸检时采集的肿瘤中第二种抗PD-L1抗体未检测到PD-L1来确定的。gydF4y2BaDgydF4y2BaPD-L1占用与cRB-340-1 + atezolizumab肿瘤定殖的相关性gydF4y2BaEgydF4y2Ba的hCD45gydF4y2Ba+gydF4y2Ba使用HER2珠静脉注射后3天混合肿瘤人群中的CAR-T细胞,治疗组中有足够数量的CAR-T细胞进行功能检测gydF4y2Ba一个gydF4y2Ba.gydF4y2BaFgydF4y2BaPD-L1占用体外和体外培养后3天,使用HER2珠,不添加atezolizumab。gydF4y2BaGgydF4y2BatNGFR频率gydF4y2Ba+gydF4y2Ba/处置gydF4y2Ba+gydF4y2BaHER2珠体外注射后的CAR-T细胞。gydF4y2BaHgydF4y2BatNGFR的百分比gydF4y2Ba+gydF4y2Ba/处置gydF4y2Ba+gydF4y2BaCAR-T细胞体外混合肿瘤人群和静脉注射HER2珠后3天。gydF4y2Ba我gydF4y2Ba在尸检时,her2表达癌细胞的体外百分比。gydF4y2BaJgydF4y2Ba各组肿瘤组成。星号是指RB-340-1组与其他组之间有显著差异的比较。完整的统计值集在附加文件中gydF4y2Ba6gydF4y2Ba表S6gydF4y2Ba
所有含有RB-340-1的细胞在体内都保持功能,因为当HER2珠在体外进行最佳刺激时,它们可以恢复LdCK的表达(图2)。gydF4y2Ba7gydF4y2BaG, H)。值得注意的是,cRB-340-1 CAR-T细胞联合atezolizumab与RB-340-1单药治疗效果相似,优于常规HER2 CAR-T细胞联合检查点抑制。这可能是多种因素综合作用的结果,因为cRB-340-1在atezolizumab组合保护下也具有选择性优势,这表明在LdCK结构中加入LAT有利于T细胞持久性[gydF4y2Ba20.gydF4y2Ba],但只有当其他抑制因素,如PD-1/PD-L1相互作用减轻。gydF4y2Ba
与常规HER2 CAR、cRB-340-1或RB-340-1ss_1M相比,RB-340-1ss_2M的性能更好,同时观察到前者在尸检时肿瘤中PD-1水平较低(图。gydF4y2Ba7gydF4y2BaB)表明RB-340-1的活性成分LdCK在数量上对增强的抗肿瘤有效性负责,而不仅仅是更高数量的转导细胞。gydF4y2Ba
讨论gydF4y2Ba
CRISPRi产品RB-340-1在暴露于HER2后有条件地抑制PD-1的表达gydF4y2Ba+gydF4y2Ba癌细胞在体外能更好地增殖,体内抗肿瘤活性提高。此外,在低剂量给药时,RB-340-1的表现与HER2 CAR细胞+ atezolizumab的组合相似,甚至更好。这是值得注意的,因为本研究采用的atezolizumab给药时间表(每周两次)远远超过临床批准的三周间隔[gydF4y2Ba22gydF4y2Ba].此外,与atezolizumab相反,RB-340-1中PD-1功能的抑制仅限于交付的ACT产品,预计不会引起任何全身效应。考虑到长期给药检查点抑制剂的毒性,这是对目前联合用药的重大改进[gydF4y2Ba23gydF4y2Ba].此外,通过在一个产品中包含这两种机制的方法,检查点封锁和ACT组合的累积成本得到了缓解。这种好处可以通过应用CRISPRi来同时调节多个生物相互依赖的基因,如PD-1和TIM-3的抑制来增强gydF4y2Ba2gydF4y2Ba:图S2C)或IL-12、p30/p45以及IL-15和IL-15Ra上调。此外,对T细胞激活和分化的主调控因子(如原癌基因c-Jun)的条件控制可以通过可能导致致癌转化的转基因克服与其组成性激活相关的担忧[gydF4y2Ba10gydF4y2Ba].此外,Stadtmaurer等人[gydF4y2Ba9gydF4y2Ba]通过CRISPR基因编辑T细胞中的三个基因依次删除,以观察频繁的基因组重排,包括染色体易位,这在CRISPRi中是不太可能的。gydF4y2Ba
RB-340-1是首次在人体中验证这一概念的药物,其目标是经过相对良好测试的独立临床实体,如HER2和PD-1。一项首次人体I期研究可以解决表达dcas9的CAR-T细胞的安全性、持久性和免疫原性问题。此外,基于HER2中度表达的免疫源性或免疫排除性癌症患者分层,可以探索在各自癌症免疫环境中的有效性[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].gydF4y2Ba
RB-340-1被量身定制,以最大限度地提高每个组件的熟练程度。在CAR结构物中包含CD28共刺激结构域导致CD3 ζ链的基础磷酸化和CAR信号的增强,而含有4- 1bb的结构物则会吸收SHP-1磷酸酶,从而削弱CAR- t信号的传导[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].此外,CD28 CAR结构物与GRB2相互作用导致更强的CagydF4y2Ba+ 2gydF4y2Ba助熔剂和PLC-γ1活化[gydF4y2Ba29gydF4y2Ba].然而,强烈的T细胞激活虽然改善了对抗原刺激的效应因子功能,但却以过早分化和衰竭为代价[gydF4y2Ba30.gydF4y2Ba].我们选择CD28的原因是,本构激活可以在肿瘤浸润的早期阶段放大效应器功能的部署,并触发化疗吸引来扩大治疗窗口,而过早的衰竭可以通过抑制PD-1来对抗。在适配器中选择LAT是因为其表达的稳定性延长了T细胞的激活和持久性[gydF4y2Ba20.gydF4y2Ba].RB-340-1还被构建为有条件地表达LdCK,其中包含潜在的免疫原性细菌衍生的dCas9,以限制其在体内的表达,如与肿瘤微环境中表达her2的癌细胞接触。有趣的是,用不同密度的HER2表面结构域包被的小珠刺激显示了LdCK的抗原密度依赖性诱导。gydF4y2Ba2gydF4y2BaA).这一特征有三个好处:(1)它增强了系统的条件性,(2)降低了其dCas9免疫原性的潜力,(3)将LdCK激活与靶抗原密度联系起来,这反过来可能扩大治疗指数,因为良性组织的HER2表达低于癌症[gydF4y2Ba31gydF4y2Ba].考虑到最近有报道称HER2特异性CAR-T细胞可以根除HER2,这一点尤为重要gydF4y2Ba+gydF4y2Ba肿瘤对曲妥珠单抗耐药是由于肿瘤基质内渗透增加和潜在的较低抗原密度要求,但对良性组织具有重要的靶向/脱靶潜力[gydF4y2Ba32gydF4y2Ba].gydF4y2Ba
在目前的应用中,RB-340-1包含CD4gydF4y2Ba+gydF4y2Ba和CD8gydF4y2Ba+gydF4y2BaT细胞群,其中CD4gydF4y2Ba+gydF4y2BaT细胞在最终产物中所占的比例较大(大多数情况下为60-70%),并且在免疫缺陷环境中具有较长的持久性,从而导致先前在原位胶质母细胞瘤模型中报道的优异的抗肿瘤活性[gydF4y2Ba33gydF4y2Ba].这可能与临床情况有关,其中RB-340-1将用于免疫衰竭患者。gydF4y2Ba
综上所述,RB-340-1是CRISPRi首次应用于临床相关产品。尽管该平台的潜力超出了免疫肿瘤学,延伸到其他免疫病理学和再生医学,但目前的研究为首次在人体内对直系同源蛋白的安全性、持久性和免疫原性进行概念验证评估铺平了道路。gydF4y2Ba
方法gydF4y2Ba
慢病毒载体构建gydF4y2Ba
人类codon-optimizedgydF4y2Ba链球菌gydF4y2BadCas9在c端与Kox1的KRAB (Krüppel associated box)结构域融合[gydF4y2Ba12gydF4y2Ba].将LAT (Human cDNA, NM_001014987.2)与dCas9-KRAB-GFP(或dCas9-KRAB-Q8)融合,组装成LAT- tcs - dcas9 - krab,并克隆到修饰的pHR-SFFV慢病毒载体[gydF4y2Ba34gydF4y2Ba];将SFFV启动子替换为EF1α启动子、GZMB启动子或NFATRE启动子,得到pHR-EF1αp、pHR-GZMBp和pHR-NFATREp慢病毒载体(图2)。gydF4y2Ba1gydF4y2Ba).如前所述[gydF4y2Ba15gydF4y2Ba], TCS序列(ENLYFQ)插入到LAT和dCas9之间,两侧连接GS连接器。两个核输出信号(NES, LALKLAGLDI和LQLPPLERLTL)位于LAT的两侧,以确保嵌合体蛋白的细胞质定位。gydF4y2Ba
her2特异性单链抗体4D5序列源于人源单抗4D5赫赛汀(曲妥珠单抗)[gydF4y2Ba17gydF4y2Ba].以Promab (PM-CAR-1024)采购的HER2 CAR载体为基础,通过PCR扩增4D5单链抗体,连接CD28跨膜和CD28和CD3ζ细胞内信号域,并亚克隆到pHR-EF1αp慢病毒载体中。烟草蚀刻病毒蛋白酶[gydF4y2Ba15gydF4y2Ba]被PCR扩增并克隆到HER2 CAR的c端。对于HER2 CAR检测和富集,将P2A-mCherry或P2A-tNGFR(截断的NGFR) c端融合到TEV上。小鼠U6启动子(mU6)驱动的PD-1 sgRNA (PD-1sg)被克隆到EF1α启动子上游的HER2 CAR-TEV载体中,以便于将ChaCha系统工程到人原代T细胞[gydF4y2Ba15gydF4y2Ba].gydF4y2Ba
将mU6启动子和人U6 (hU6)启动子串联驱动的PD-1sg和TIM-3 sgRNA (TIM-3sg)分别克隆到表达HER2 CAR-TEV的pHR-EF1αp慢病毒载体中进行多路复用实验。gydF4y2Ba
PD-1 sgRNA的设计与筛选gydF4y2Ba
基于预测的转录因子结合位点和靶PDCD1内源基因TSS + /−1 KB区域内核小体分布,设计了PD-1 sgRNA文库。PD-1 sgRNA的筛选是通过Neon电穿孔将96种不同的PD-1 sgRNA候选转染到表达dCas9-KRAB的Jurkat细胞中进行的。前8个被观察到敲除最多和计算预测脱靶最少的候选基因被克隆到pLenti6慢病毒载体中,以便在原代T细胞中进一步验证。选择首选的PD-1 sgRNA #45 (GCTCCGCCTGAGCAGTGGAGA)克隆到表达HER2 CAR-TEV的pHR-EF1αp慢病毒载体中。gydF4y2Ba
慢病毒载体生产gydF4y2Ba
第二代自灭活慢病毒上清是在293 T包装细胞系中产生的。简单地说,70%汇合的293 T T225瓶共转染32µg pHR-EF1αp慢病毒载体质粒,16µg psPAX2 (Gag/Pol)和8µg pMD2。G (VSVG包膜)使用108µl TransIT-LT1 (Mirus)和57µl ViralBoost Reagent (ALSTEM)包装质粒DNA。收集72 h病毒上清液,经0.45 μ m PVDF膜过滤单元过滤,分层于10%蔗糖溶液上,10000 ×高速离心gydF4y2BaggydF4y2Ba在4°C下放置4小时。浓缩的慢病毒原液在-80°C冷冻以备将来使用。gydF4y2Ba
原代T细胞的分离和CAR - T细胞的生产gydF4y2Ba
健康供体白细胞从gydF4y2Bawww.pparesearch.comgydF4y2Ba.新鲜外周血单个核细胞(pmcs)根据制造商的说明通过淋巴细胞技术(干细胞技术)低密度离心分离。Pan T细胞用Dynabeads原样人T细胞(Invitrogen)分离。为了生成CAR-T细胞,在第0天,将冷冻保存的Pan T细胞解冻并在T细胞培养液(RPMI添加10%人血清、2 mM GlutaMAX、50µM 2-巯基乙醇(Gibco)、100 U/ml青霉素和100µg/ml链霉素(Gibco))中,在人抗cd3 (OKT3, 1µg/ml, Biolegend)和人抗cd28 (αCD28, 1µg/ml, BD Pharmingen™)抗体包裹的24孔板中激活。重组人IL-7和IL-15 (Gibco)均为10 ng/ml。T细胞在激活后的第2天,用携带LAT-dCas9KRAB-GFP或LAT-dCas9KRAB-Q8的慢病毒载体转导T细胞,并在第2天转导HER2 CAR-TEV-mChr/PD-1sg或HER2 CAR-TEV-tNGFR/PD-1sg。在第5天,通过将转导的T细胞转移到经过组织培养处理的24孔板中来去除T细胞的活化。第6天,双转导T细胞通过细胞分选(Sony cell Sorter)富集GFP和mCherry或Q8和tNGFR双阳性T细胞。细胞分选后,T细胞维持在0.5 × 10gydF4y2Ba6gydF4y2Ba−1 × 10gydF4y2Ba6gydF4y2Ba在T细胞培养基中加入IL-7和IL-15 (10 ng/ml)。CAR-T细胞被用于体外试验或在生产运行的第14或21天植入小鼠体内。gydF4y2Ba
细胞系gydF4y2Ba
人头颈部鳞状细胞癌系FaDu是从ATCC (Manassas, VA)获得的。FaDu-PD-L1(以下简称FaDu)由慢病毒载体pLenti6.3/V5™-TOPO™(Invitrogen)转导,过表达PD-L1 (Human cDNA, NM_014143.4),然后选择blasticidin生成。细胞在完全培养基(DMEM + 10%胎牛血清、100 U/ml青霉素和100µg/ml链霉素(Gibco))中培养。使用MycoAlert支原体检测试剂盒(Lonza)常规检测所有细胞的潜在支原体污染。gydF4y2Ba
HER2的定量。C一个R and dCas9 vector copies in transduced T cells
将工程细胞制成颗粒,用PBS清洗,使用DNeasy血液和组织试剂盒(Qiagen)提取DNA。采用慢病毒主干(RRE序列)引物,CAR和LdCK特异性引物进行PCR扩增。RPP30扩增用于细胞数量控制。液滴是使用QX200液滴发生器(Bio-Rad)根据制造商协议生成的。使用QX200滴滴阅读器(Bio-Rad)测量液滴中的扩增量,并使用Quantasoft软件进行分析。gydF4y2Ba
流式细胞术gydF4y2Ba
使用人HER2- pe - cy7(克隆24D2, Biolegend)和PD-L1- apc(克隆MIH1, eBioscience)检测肿瘤细胞上的人HER2和PD-L1表达。使用抗曲妥珠单抗独特型Alexa Fluor 647偶联抗体(克隆2661E,研发系统)检测HER2 4D5 CAR。HER2 4D5 CAR也通过与Alex Fluor 647结合的人重组HER2蛋白检测到。使用以下抗体评估人T细胞表面表型和转导效率:NGFR-FITC(克隆ME20.4, Biolegend), Q8(克隆QBEND/10, ThermoFisher), CD45-AF700或CD45-BV605(克隆HI30, Biolegend), CD3-APC(克隆SK7, Biolegend), CD4-PerCP(克隆SK3, Biolegend), CD4-BB700(克隆SK3, BD Bioscience), CD8-BV510(克隆SK1, Biolegend), CD27-PE-CY7(克隆M-T271, Biolegend), CD28-BV605(克隆CD28.2, Biolegend。使用PD-1-BV421或PD-1-BV605(克隆EH12.2H7, Biolegend)、TIM-3-BV605或TIM-3-PE-CY-7(克隆F38-2E2, Biolegend)、CD39(克隆A1, Biolegend)、LAG-3-BV711(克隆11C3C65, Biolegend)分析T细胞抑制受体的表达。活/死区分使用活/死固定近红外死细胞染色试剂盒(ThermoFisher)。流式细胞术结果采用Kaluza软件(Beckman Coulter)进行分析。gydF4y2Ba
HER2微珠制备和HER2微珠刺激gydF4y2Ba
重组人HER2 (Thr 23-Thr 652, Acro Biosystems)的外膜化学生物素化方法是将30 μg HER2蛋白与20摩尔过量的es - link NHS-PEG4-Biotin (Thermo Scientific)混合在碳酸氢钠缓冲液(pH 8.3)中。在旋转器上4°C孵育2小时后,使用Zeba脱盐柱(7 kDa MWCO)纯化生物素化的HER2。为了将生物素化的HER2偶联到微珠上,首先将3mg直径为2.8 μm的Dynabeads(涂有链霉亲和素,M-280链霉亲和素,ThermoFisher)清洗两次并重新悬浮在1ml PBS中。在每个微管中分别加入3 μg或15 μg生物素化HER2蛋白,用于低密度或高密度。每根微管都被迅速涡旋以使溶液均质。在旋转器上4°C孵育过夜后,将微珠在PBS中洗涤一次,然后在旋转器上用添加2% (w/v)生物素化牛血清白蛋白的PBS在4°C下孵育1小时。最后,将微珠清洗两次,并在含0.02% NaN的PBS中重新悬浮gydF4y2Ba3.gydF4y2Ba用于存储。使用小鼠抗人HER2抗体(克隆191924,R&D Systems)和QiFiKit(安捷伦),通过流式细胞术评估微珠上HER2的表面密度。表面密度值(ABC/μmgydF4y2Ba2gydF4y2Ba)分别为1487和3628,HER2低珠和高珠。gydF4y2Ba
在HER2珠刺激实验中,大约80000个CAR-T细胞被培养在96孔平板中,HER2低珠或高珠以1:1的比例加入HER2 CAR-T细胞。珠粒刺激3天后,收集CAR- t细胞,流式细胞术检测HER2 CAR (tNGFR)和LdCK (Q8)的表达。gydF4y2Ba
共培养实验与细胞因子产生gydF4y2Ba
在常规共培养实验中,将大约80000个FaDu肿瘤细胞接种在48孔平板中,6小时后按指定的效应:靶细胞(E:T)比例加入CAR-T细胞,并培养6天。每一种情况分别镀三个孔。收集培养上清,ELISA法检测IFN-γ、IL-2和TNF-α (Biolegend)。流式细胞术检测肿瘤细胞残留、CAR-T细胞增殖及PD-1表面表达情况。gydF4y2Ba
在重复肿瘤刺激实验中,CAR-T细胞与FaDu肿瘤细胞在第0天共培养(2万个CAR-T细胞;8万个FaDu细胞;E:T = 1:4),并在第4、8和12天用10万个FaDu细胞重新刺激。未受刺激的CAR-T细胞保持在100u ml的培养基中gydF4y2Ba−1gydF4y2Ba- 2。在指定时间点(第4、8、12和16天),用ELISA法分析共培养上清中IFN-γ、IL-2和TNF-α的含量(Biolegend)。采用流式细胞术检测受刺激和未受刺激CAR-T细胞及PD-1、TIM-3、LAG-3和CD39的表面表达。gydF4y2Ba
动物实验gydF4y2Ba
计数后0.5 × 10gydF4y2Ba6gydF4y2Ba或1 × 10gydF4y2Ba6gydF4y2Ba将FaDu肿瘤细胞重新悬浮在100µl PBS + matrigel(康宁)中,并皮下注射到6- 8周龄雌性免疫缺陷NSG小鼠的右侧(JAX实验室)。当肿瘤平均大小接近100mm时gydF4y2Ba3.gydF4y2Ba,将小鼠随机分为不同组(见附加文件)gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba:详见图S3-5),相关小鼠静脉注射抗pd - l1 (atezolizumab, 10 mg/kg)。次日,瘤内给药CAR-T细胞模型,共0.3 × 10gydF4y2Ba6gydF4y2Ba, 0.25 × 10gydF4y2Ba6gydF4y2Ba或0.1 × 10gydF4y2Ba6gydF4y2Ba如图所示,瘤内注射20 μ l的HER2 CAR-T细胞;CAR-T细胞静脉注射模型为1 × 10gydF4y2Ba6gydF4y2Ba或3 × 10gydF4y2Ba6gydF4y2Ba以100 μ l的体积静脉注射HER2 CAR-T细胞。在两个模型中,atezolizumab组小鼠每周连续两次使用atezolizumab (5 mg/kg)治疗。每两周用数字卡尺测量肿瘤大小,用公式计算肿瘤体积gydF4y2BaVgydF4y2Ba=½(长×宽gydF4y2Ba2gydF4y2Ba).根据IACUC协议人道安乐死小鼠,安乐死后立即切除肿瘤进行进一步分析。gydF4y2Ba
肿瘤浸润CAR-T细胞的分离gydF4y2Ba
收集实体瘤组织,PBS冲洗,使用gentleMACS分离器(Miltenyi)机械分离,单细胞悬液用所述抗体染色,流式细胞仪分析。gydF4y2Ba
统计分析gydF4y2Ba
两组间显著性差异的统计分析采用非配对双尾方法进行gydF4y2BatgydF4y2Ba使用GraphPad Prism8测试。生存曲线比较采用log-rank Mantel-Cox检验。一个gydF4y2BapgydF4y2Ba< 0.05为有统计学意义。调查结果的重要性定义为:gydF4y2BansgydF4y2Ba不显著的;*gydF4y2BapgydF4y2Ba≤0.05;**gydF4y2BapgydF4y2Ba≤0.01;***gydF4y2BapgydF4y2Ba≤0.001,****gydF4y2BapgydF4y2Ba≤0.0001。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
所有与研究相关的数据都包含在文章中或作为补充信息上传。按合理要求提供数据。gydF4y2Ba
缩写gydF4y2Ba
- 行为:gydF4y2Ba
-
过继细胞疗法gydF4y2Ba
- BSA:gydF4y2Ba
-
牛血清白蛋白gydF4y2Ba
- 汽车:gydF4y2Ba
-
嵌合抗原受体gydF4y2Ba
- CRISPR:gydF4y2Ba
-
有规律地聚集在一起的短回文重复gydF4y2Ba
- CRISPRi:gydF4y2Ba
-
CRISPR干扰gydF4y2Ba
- dCas9:gydF4y2Ba
-
Nuclease-deactivated Cas9gydF4y2Ba
- ΔU3:gydF4y2Ba
-
删除U3区域gydF4y2Ba
- ddPCR:gydF4y2Ba
-
液滴数字PCRgydF4y2Ba
- EF1α:gydF4y2Ba
-
人类伸长因子-1 α启动子gydF4y2Ba
- 艾凡:师:gydF4y2Ba
-
Effector-to-target比率gydF4y2Ba
- 绿色荧光蛋白:gydF4y2Ba
-
绿色荧光蛋白gydF4y2Ba
- HER2:gydF4y2Ba
-
人表皮生长因子受体2gydF4y2Ba
- HER2汽车:gydF4y2Ba
-
传统的抗her2 CAR-T细胞gydF4y2Ba
- IL:gydF4y2Ba
-
白介素gydF4y2Ba
- 静脉注射:gydF4y2Ba
-
体外刺激gydF4y2Ba
- 带:gydF4y2Ba
-
Kruppel-associated盒子gydF4y2Ba
- 纬度:gydF4y2Ba
-
激活T细胞的连接剂gydF4y2Ba
- LdCK:gydF4y2Ba
-
LAT-dCas9-KRAB复杂gydF4y2Ba
- LTR:gydF4y2Ba
-
长终端重复gydF4y2Ba
- LV:gydF4y2Ba
-
慢病毒载体gydF4y2Ba
- mChr:gydF4y2Ba
-
mCherrygydF4y2Ba
- mU6:gydF4y2Ba
-
小鼠U6启动子gydF4y2Ba
- NLS:gydF4y2Ba
-
核定位序列gydF4y2Ba
- NSG:gydF4y2Ba
-
NOD-SCID-IL2rγgydF4y2Ba−−/gydF4y2Ba老鼠gydF4y2Ba
- NT:gydF4y2Ba
-
非转导的T细胞gydF4y2Ba
- PD-1:gydF4y2Ba
-
程序性细胞死亡蛋白1gydF4y2Ba
- PD-1sg:gydF4y2Ba
-
PD-1-targeting sgRNAgydF4y2Ba
- PD-L1:gydF4y2Ba
-
程序性死亡配体-1gydF4y2Ba
- 我想gydF4y2Ba
-
16-残馀截断CD34细胞外结构域gydF4y2Ba
- scFv:gydF4y2Ba
-
单链可变片段gydF4y2Ba
- sgRNA:gydF4y2Ba
-
单导RNAgydF4y2Ba
- 塔塔:gydF4y2Ba
-
TEV可劈裂序列gydF4y2Ba
- TEV:gydF4y2Ba
-
烟草腐蚀病毒gydF4y2Ba
- tNGFR:gydF4y2Ba
-
截断的神经生长因子受体gydF4y2Ba
- 肿瘤坏死因子:gydF4y2Ba
-
肿瘤坏死因子gydF4y2Ba
- TSS:gydF4y2Ba
-
转录起始位点gydF4y2Ba
- VCN:gydF4y2Ba
-
矢量拷贝数gydF4y2Ba
- WPRE:gydF4y2Ba
-
土拨鼠肝炎病毒转录后调节元件gydF4y2Ba
参考文献gydF4y2Ba
傅丽娟,李志强,李志强,等。慢性淋巴细胞白血病对CD19嵌合抗原受体(CAR) T细胞治疗反应和耐药性的决定因素中华医学杂志,2018;24(5):563-71。gydF4y2Ba
葛蒂诺尼L,卢格利E,吉Y,波斯Z,保洛斯CM,奎格利MF,等。具有干细胞样特性的人类记忆T细胞子集。中华外科杂志,2011;17(10):1290-7。gydF4y2Ba
Fourcade J, Sun Z, Pagliano O, Guillaume P, Luescher IF, Sander C,等。肿瘤微环境可通过上调抑制受体BTLA和PD-1使肿瘤抗原特异性CD8(+) T细胞功能紊乱。中国癌症杂志,2012;32(4):887-96。gydF4y2Ba
klebanon off CA, Scott CD, Leonardi AJ, Yamamoto TN, Cruz AC, Ouyang C,等。记忆T细胞驱动的原始细胞分化损害过继免疫治疗。中国临床医学杂志,2016;26(1):366 - 366。gydF4y2Ba
王华,郭考尔,艾桑金,陈峰,管峰,臧欣。免疫检查点阻断与CAR-T细胞治疗在恶性血液病中的应用。中华血液病杂志,2019;12(1):59。gydF4y2Ba
Blackburn SD, Shin H, WN海宁,邹涛,Workman CJ, Polley A,等。慢性病毒感染期间多种抑制受体对CD8+ T细胞衰竭的共同调节中华免疫杂志2009;10(1):29-37。gydF4y2Ba
Yeku OO, Brentjens RJ。装甲CAR -t细胞:利用细胞因子和促炎配体增强CAR -t细胞抗肿瘤功效。生物化学学报,2016;44(2):412-8。gydF4y2Ba
Rafiq S, Yeku OO, Jackson HJ, Purdon TJ, van Leeuwen DG, Drakes DJ,等。CAR-T细胞靶向递送pd -1阻断单链抗体可增强体内抗肿瘤疗效。中国生物工程学报,2018;36(9):847-56。gydF4y2Ba
Stadtmauer EA, Fraietta JA, Davis MM, Cohen AD, Weber KL, Lancaster E,等。crispr工程T细胞在难治性癌症患者中的应用科学》2020。gydF4y2Bahttps://doi.org/10.1126/science.aba7365gydF4y2Ba.gydF4y2Ba
Lynn RC, Weber EW, Sotillo E, Gennert D, Xu P, Good Z,等。CAR - T细胞过表达c-Jun诱导衰竭抵抗。自然。2019;576(7786):293 - 300。gydF4y2Ba
Gilbert LA, Horlbeck MA, Adamson B, Villalta JE, Chen Y, Whitehead EH,等。基因组尺度的crispr介导的基因抑制和激活控制。细胞。2014;159(3):647 - 61。gydF4y2Ba
Gilbert LA, Larson MH, Morsut L, Liu Z, Brar GA, Torres SE,等。crispr介导的模块化rna引导的真核生物转录调控。细胞。2013;154(2):442 - 51。gydF4y2Ba
齐LS,拉尔森MH,吉尔伯特LA,杜德纳JA,韦斯曼JS,阿金AP,等。重新利用CRISPR作为rna引导的平台,用于基因表达的序列特异性控制。细胞。2013;152(5):1173 - 83。gydF4y2Ba
Thakore PI, D 'Ippolito AM, Song L, Safi A, Shivakumar NK, Kabadi AM,等。通过CRISPR-Cas9阻遏物对远端调控元件进行高度特异性的表观基因组编辑。光子学报。2015;12(12):1143-9。gydF4y2Ba
王华,王志强,王志强,王志强,等。利用gpcr耦合的CRISPR-Cas系统工程细胞传感和响应。地理学报。2017;8(1):2212。gydF4y2Ba
李玲,高勇,Srivastava R,王伟,熊强,方震,等。TBK1/IKKvarepsilon复合物抑制剂BX795增强了CAR/CRISPRi组合电路进入人原代T细胞的慢病毒传递。中华医学杂志2020;18(1):363。gydF4y2Ba
Carter P, Presta L, Gorman CM, Ridgway JB, Henner D, Wong WL,等。用于人类癌症治疗的抗p185her2抗体的人格化。美国国家科学研究院。1992年,89(10):4285 - 9。gydF4y2Ba
Philip B, Kokalaki E, Mekkaoui L, Thomas S, Straathof K, Flutter B,等。高度紧凑的基于表位的标记/自杀基因,更容易和更安全的t细胞治疗。血。2014;124(8):1277 - 87。gydF4y2Ba
金海涛,安德森AC,谭WG,西EE,哈SJ,荒木K,等。Tim-3和PD-1在慢性病毒感染时CD8 t细胞衰竭中的合作美国国家科学研究院。2010; 107(33): 14733 - 8。gydF4y2Ba
Balagopalan L, Malik H, McIntire KM, Garvey JA, Nguyen T, Rodriguez-Pena AB,等。绕过泛素化可以使LAT循环到细胞表面,并增强T细胞中的信号。PLoS ONE。2020; 15 (2): e0229036。gydF4y2Ba
王e, Cesano A, Butterfield LH, Marincola F.提高过继细胞治疗指标:影响疗效的关键因素。免疫癌症杂志,2020。gydF4y2Bahttps://doi.org/10.1136/jitc-2020-001619gydF4y2Ba.gydF4y2Ba
水垣H,山本N,村上H,健本H,藤原Y,石田Y,等。atezolizumab是一种靶向PD-L1的工程免疫球蛋白单克隆抗体,用于日本晚期实体瘤患者的单药治疗的I期剂量寻找研究。投资新药。2016;34(5):596-603。gydF4y2Ba
西岛TF,沙查尔SS,尼罗普KA, Muss HB。PD-1/PD-L1抑制剂与化疗相比在晚期癌症患者中的安全性和耐受性:一项荟萃分析肿瘤学家。2017;22(4):470 - 9。gydF4y2Ba
图兰·T, Kannan D, Patel M, Matthew Barnes J, Tanlimco SG, Lu R,等。免疫肿瘤学,免疫反应和万物理论。中华免疫杂志,2018;6(1):50。gydF4y2Ba
Pai SI, Cesano A, Marincola FM。癌症免疫排斥的悖论:免疫肿瘤学的下一个前沿。癌症治疗决议2020;180:173-95。gydF4y2Ba
阿尤布·奈米,阿尔沙米·KM,亚格汉·RJ。her2阳性乳腺癌的免疫治疗:最新进展和联合治疗方法。乳腺癌。2019;11:53-69。gydF4y2Ba
孙超,寿鹏,杜华,平林凯,陈勇,乐海林,等。通过4-1BB招募THEMIS-SHP1调节lck介导的嵌合抗原受体重定向T细胞的启动。癌症杂志,2020;37(2):216-56。gydF4y2Ba
Salter AI, Ivey RG, Kennedy JJ, Voillet V, Rajan A, Alderman EJ,等。嵌合抗原受体信号的磷酸化蛋白质组学分析揭示了影响细胞功能的动力学和定量差异。科学信号。2018。gydF4y2Bahttps://doi.org/10.1126/scisignal.aat6753gydF4y2Ba.gydF4y2Ba
郭丹丹,马达尔,刘飞,等。cd28共刺激CAR - T细胞中的单个残留限制了长期持久性和抗肿瘤持久性。J clinin Invest, 2020年。gydF4y2Bahttps://doi.org/10.1172/JCI133215gydF4y2Ba.gydF4y2Ba
Kawalekar OU, O 'Connor RS, Fraietta JA, Guo L, McGettigan SE, Posey AD Jr,等。不同的信号共受体调节特定的代谢途径,并影响CAR - T细胞的记忆发育。免疫力。2016;44(2):380 - 90。gydF4y2Ba
人表皮生长因子受体2 (HER2)在癌症中的过表达和治疗意义。Mol生物学杂志2014;2014:852748。gydF4y2Ba
Szoor A, Toth G, Zsebik B, Szabo V, Eshhar Z, Abken H,等。曲妥珠单抗衍生的her2特异性CAR用于治疗曲妥珠单抗耐药乳腺癌:CAR - T细胞穿透并根除抗体无法接近的肿瘤。癌症杂志2020;484:1-8。gydF4y2Ba
王东,阿吉拉尔,斯塔尔,Alizadeh D, Brito A, Sarkissian A,等。胶质母细胞瘤靶向CD4+ CAR - T细胞介导优异的抗肿瘤活性。JCI Insight, 2018。gydF4y2Bahttps://doi.org/10.1172/jci.insight.99048gydF4y2Ba.gydF4y2Ba
Morsut L, Roybal KT, Xiong X, Gordley RM, Coyle SM, Thomson M,等。利用合成缺口受体设计定制的细胞传感和响应行为。细胞。2016;164(4):780 - 91。gydF4y2Ba
确认gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
一个也没有。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
LSQ提出了将细胞感知与基因调控结合起来的想法。LL、BW和LSQ设想将HER2 CAR与PD-1调控结合。ZY和FMM设计了概念验证实验。RH-S、AK、DP、MB、VB、K-HH设计了配套实验。AT、PC、HC、OS、BA、VP、AG、JY、DI、VV进行实验。ZY分析了数据。ZY和FMM撰写了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
这项研究得到了Explora BioLabs动物护理和使用委员会的批准(协议#EB17-010-122, 2020年2月3日)。gydF4y2Ba
发表同意书gydF4y2Ba
不是必需的。gydF4y2Ba
相互竞争的利益gydF4y2Ba
以下专利US#9,856,497涉及这项工作。雷s . Qi是Refuge Biotechnologies的联合创始人和科学顾问。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
一个gydF4y2Ba根据直接识别HER2的抗4d5表位独特型抗体与tNGFR标记检测HER2 CAR表达的比较评估。后者是细胞分选和表型的首选方法,因为它对T细胞的激活/功能没有直接的生物学影响。gydF4y2BaBgydF4y2BaqPCR检测dCas9和Q8表达动力学。gydF4y2BaCgydF4y2BaCAR-T制造工艺gydF4y2Ba- - - - - -gydF4y2BaCD3gydF4y2Ba+gydF4y2BaT细胞从外周血单核细胞中被负向选择,并被OKT3/CD28刺激。一天后加入LdCK进行转导,第二天加入HER2-TEV。在最初的刺激后5天,激活被移除,第二天细胞被分类以富集tNGFRgydF4y2Ba+gydF4y2Ba/处置gydF4y2Ba+gydF4y2Ba人口。然后扩展将持续到第14天的发行。细胞也在这一点上测试转导的持久性,如图所示。gydF4y2Ba1gydF4y2Ba一个。gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
一个gydF4y2BaHER2 CAR的抗原密度依赖性活化gydF4y2Ba- - - - - -gydF4y2Ba用包有BSA的珠粒刺激传统的HER2 CAR细胞,在珠粒与CAR- t细胞的比例下,低或高密度的HER2外膜(低HER2和高HER2)在刺激后第3天表达CD69和PD-1。gydF4y2BaBgydF4y2BaRB-340-1细胞成分的细胞毒性和扩增特性gydF4y2Ba- - - - - -gydF4y2Ba非转导(NT)、常规HER2 CAR、cRB-340-1和RB-340-1 T细胞以1:20效靶比暴露于FaDu细胞系3天。不同比例的CD4gydF4y2Ba+gydF4y2Ba/ CD8gydF4y2Ba+gydF4y2Ba检测T细胞的细胞毒活性(上图)和扩增(下图)。标题中的数字指的是CD4的比例gydF4y2Ba+gydF4y2BaT细胞(%)存在于每组T细胞总数。gydF4y2BaCgydF4y2BaRB-340-1基因调控特异性gydF4y2Ba- - - - - -gydF4y2Ba在FaDu细胞刺激后5天,用LdCK和HER2-TEV构建物(包括PD-1sg, TIM-3sg或两者)转导的原代T细胞检测各自靶基因的表达,以诱导两个检查点的表达。gydF4y2BaDgydF4y2BaRB-340-1调控基因表达的动力学研究gydF4y2Ba- - - - - -gydF4y2Ba用her2包被(填充形状)或bsa包被(空形状)的珠粒刺激RB-340-1(红线)和cRB-340-1(黑线),并在CD8中观察PD-1、TIM-3和CD69的表达gydF4y2Ba+gydF4y2BaT细胞在基线和刺激后48和72小时。gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
一个gydF4y2Ba瘤内给药模型及研究设计。gydF4y2BaBgydF4y2Ba实验设置gydF4y2Ba- - - - - -gydF4y2Ba所有治疗组包括8只小鼠,接受皮下植入50万个FaDu细胞,然后在第10天过继移植CAR-T细胞。gydF4y2Ba
附加文件4:图S4。gydF4y2Ba
一个gydF4y2Ba瘤内给药模型及研究设计。gydF4y2BaBgydF4y2Ba实验设置gydF4y2Ba- - - - - -gydF4y2Ba所有治疗组包括5或6只小鼠接受皮下植入100万个FaDu细胞,然后在第9天过继移植CAR-T细胞。相关组在过继转移前一天(第8天)静脉注射Atezolizumab (10mg /kg),随后以5mg /kg的剂量给药,每周两次。gydF4y2Ba
附加文件5:图S5。一个gydF4y2Ba
系统管理模式与研究设计。gydF4y2BaBgydF4y2Ba,gydF4y2BaCgydF4y2Ba实验设置gydF4y2Ba- - - - - -gydF4y2Ba所有治疗组包括7只小鼠(ingydF4y2BaBgydF4y2Ba无花果。gydF4y2Ba5gydF4y2Ba)或九只老鼠(在gydF4y2BaCgydF4y2Ba无花果。gydF4y2Ba6gydF4y2Ba)接受皮下植入50万个FaDu细胞,然后在第10天过继移植CAR-T细胞。相关组在过继转移前一天(第9天)静脉注射Atezolizumab (10mg /kg),随后以5mg /kg的剂量给药,每周两次。gydF4y2Ba
附加文件6:gydF4y2Ba
表S1。gydF4y2BaPgydF4y2Ba与图相关的值。gydF4y2Ba2gydF4y2Ba.gydF4y2Ba表S2。gydF4y2BaPgydF4y2Ba与图相关的值。gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba表S3。gydF4y2BaPgydF4y2Ba与图相关的值。gydF4y2Ba4gydF4y2Ba.gydF4y2Ba表S4。gydF4y2BaPgydF4y2Ba与图相关的值。gydF4y2Ba5gydF4y2Ba.gydF4y2Ba表S5。gydF4y2BaPgydF4y2Ba与图相关的值。gydF4y2Ba6gydF4y2Ba.gydF4y2Ba表S6。gydF4y2BaPgydF4y2Ba与图相关的值。gydF4y2Ba7gydF4y2Ba.gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
杨,Z,李,L, Turkoz, A。gydF4y2Baet al。gydF4y2BaCAR-T细胞治疗HER2的上下文重编程gydF4y2Ba+gydF4y2Ba癌症。gydF4y2Ba翻译医学杂志gydF4y2Ba19gydF4y2Ba, 459(2021)。https://doi.org/10.1186/s12967-021-03132-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12967-021-03132-6gydF4y2Ba