NSG新生小鼠植入人脐带血CD34+细胞
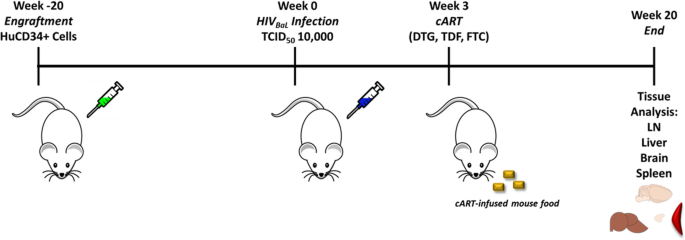
新生动物移植剂量为1 × 105从脐带血中获得的人CD34+造血干细胞,如前所述[14,18,23,32Lonza,捐赠者28753,猫号。# 2 c - 101)。用100 cGy照射3 ~ 4日龄新生儿,照射后3 h内肝内注射CD34+细胞。CD34+细胞在注射前解冻并评估其活力。动物被安置在马里兰州巴尔的摩市马里兰大学(SOM UM)医学院IHV动物设施中,在无病原体的条件下。所有实验方案均符合美国国立卫生研究院实验室动物护理和使用指南,并由SOM UM IACUC批准。CD34+ HSC移植后20周,流式细胞术判断人CD45+细胞扩增T>B细胞(CD3+细胞数高于CD19+细胞数),选择小鼠。人类CD3+ T细胞少于至少20%的动物未被选择用于本研究[23,32,33].将13只小鼠分为3个实验组:8只小鼠腹腔感染10,000 TCID50%其中5只小鼠口服cART治疗17周,5只小鼠未感染,作为对照组。HIV-1 BaL,一种R5复制能力病毒,包含大部分BaLenv基因在HIV-1 IIIB主干,滴度1 × 105/毫升(34],用来感染8只小鼠。病毒原液由IHV SOM UMµQuant Core Lab提供。美国国立卫生研究院的规定[35将两种性别的小鼠都纳入实验组的要求得到了尊重;每个实验组的性别比例为1:1。为了监测可能干扰实验结果的移植物抗宿主病(GVHD),密切观察动物的毛发和体重减轻,因为它们是GVHD的主要适应症。没有观察到头发变化或体重减轻超过10%。根据IACUC协议规定,小鼠在第20周结束时被安乐死。
抗逆转录病毒药物治疗
标准cART的剂量是根据已发表的治疗人类慢性HIV-1感染的疗效来选择的[36,37,根据老鼠的体重调整。含有cART [Tenofovir Disoproxil (TDF), Emtricitabine (FTC)和Dolutegravir (DTG)的混合物]的食物颗粒(Mod TestDiet)每天给小鼠服用17周。圆柱形药丸以每公斤食物60毫克TDF、60毫克FTC和48毫克DTG的单剂量制造。微丸还含有抗生素(阿莫西林,0.12%),使用前经过辐照处理。每天给每只小鼠口服含有cART混合物的食物颗粒。监测小鼠的药物摄入量,并在吃完药物颗粒后给予常规食物颗粒。每周对小鼠称重两次,每天两次监测其毛发脱落或行为变化。淡水每2天更换一次,随时可自由取用。
共聚焦显微镜观察人类淋巴细胞和HIV-1结构蛋白的染色程序,p24
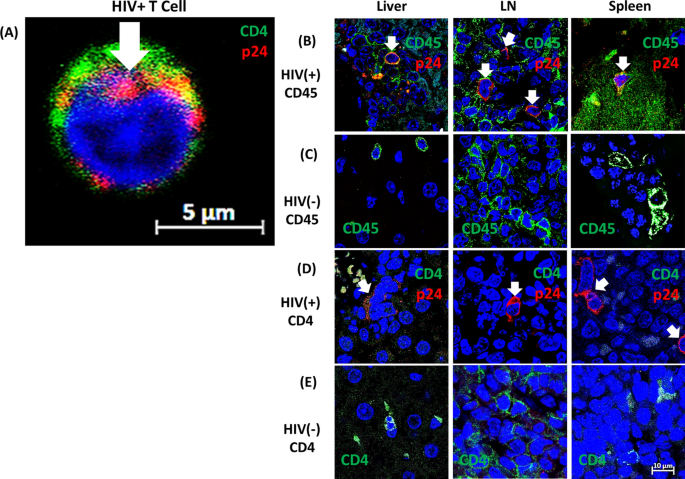
从供者全血中分离出的原代pbmc在感染前培养3天,从冷冻储存中活化,然后分为感染组和非感染组,感染组在37°C 5% CO下用HIV BaL (MOI = 0.00075)培养3小时2.随后更换培养基,两组分别培养1周。感染和未感染原代细胞用兔α-CD4 (Invitrogen, Cat。MA5-16338)一抗,1:25稀释,山羊α-兔AF647 (Abcam, Cat。ab150079)二抗,1:250稀释45分钟,4°C。细胞用Foxp3固定和渗透缓冲液(Invitrogen, Cat. 00-5523-00)在4℃下固定和渗透45分钟,然后用小鼠α-p24 FITC (Beckman Coulter, Cat. 6604665)以1:25在4℃下染色45分钟,然后用50µg/mL DAPI染色1分钟。细胞在PBS稀释的1% PFA中成像。对照组不进行兔α-CD4原代染色,用小鼠IgG1 Alexa Fluor 488 (Biolegend, Cat. 400134)代替α-p24 FITC染色。HIV-1阴性和对照细胞未显示阳性染色(未显示)。
对于组织成像,玻片被加热(45°C)至少10分钟以去除石蜡,然后浸泡在二甲苯中。装有载玻片的容器放入含有100%乙醇的脱水桶中,孵育几分钟。用较低浓度的乙醇重复该过程几次,然后将载玻片在95°C的Dako目标提取液中孵育(Dako, Cat No。S2368)冷却20分钟,并根据制造商的说明冷却。阻塞在4°C, 20% BSA在1× PBS中过夜。表面标记物染色使用1:25 α-CD4 Alexa Fluor 488 (Stemcell Technologies, Cat. 60016AD), 1:25一抗α-CD45 (Leica BioSystems, Cat. 60016AD)。NCL-L-LCA),或1:25的一抗α-CD68 (Dako, Cat。M0814)室温1小时(RT)。CD45或CD68染色的载玻片用1:250的二抗α-小鼠IgG (H + L) DyLight 488 (Vector, Cat。用0.1% Triton X-100在1× PBS中渗透10分钟,用20% BSA在4℃的1× PBS中堵塞过夜,用1:25的一抗α-p24 (Sino, Cat编号40243-RP01)在RT中标记1小时,然后用1:25的α-rabbit Alexa Fluor 647 (abcam, Cat编号40243-RP01)标记二抗。 ab150079) for 1 h at RT. Slides were DAPI stained using 50 µg/mL DAPI for 2 min and treated with 1× True Black Blocker (Biotium, Cat No. 23007) for 30 s. Slides were cover slipped with Vectashield Mounting Media (Vector, Cat No. H-1000) prior to imaging. Control samples were stained with the same conditions described above, and for additional controls, HIV-1 negative cells/tissues were stained with DAPI and secondary antibody only (not shown).
图像采集
细胞相关荧光的共聚焦图像使用蔡司LSM 800共聚焦系统(卡尔蔡司显微镜,德国)通过Airyscan超分辨率模式获得。三条激光线,405nm(蓝色,代表细胞核),488 nm(绿色,代表白细胞表面抗原[肝脏、淋巴结和脾脏中的CD45或CD4;CD68在脑]和647 nm(红色,为HIV-1蛋白,p24)。蓝色、绿色和红色信号由DAPI/FITC/TRITC/Cy5二向色分束器分离,并使用Gasp探测器进一步采集。Plan-Apochromat 63x/1.4 Oil DIC物镜用于多色标记细胞/组织样本的可视化。使用ZEN Blue 2.3软件(Carl Zeiss Microscopy, Germany)生成原始图像。所有图像都是在相同的仪器设置下获得的。信噪比通过平均使用相同增益偏置、探测器和激光激发功率获得的所有图像的数据来计算。采用软件控制的最小像素饱和度范围来避免信号饱和。
外周血病毒载量
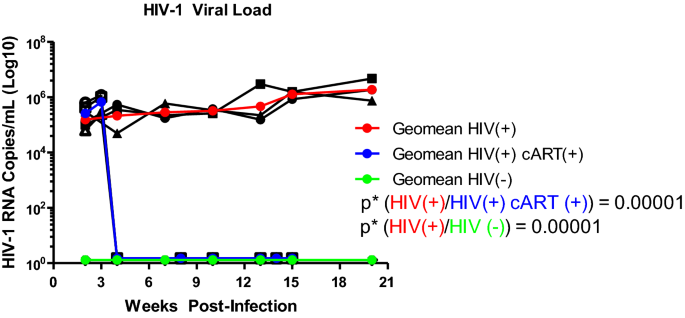
小鼠定期进行眶后出血。根据制造商说明书,使用QIAamp Viral RNA Mini Kit (QIAGEN, Cat. 52904)从血浆中提取RNA。按照制造商的说明,使用SuperScript III First-Strand Synthesis SuperMix Kit (Invitrogen 18080-400)将HIV-1 RNA转化为cDNA。采用qPCR扩增HIV-1 cDNA,定量方法如下:50°C下单周期2 min, 95°C下单周期15 min, 94°C下40周期15 s, 58°C下30 s, 72°C下30 s,然后使用BioRad LightCycler和BioRad iQ5软件进行72°C下单周期30 s。使用GraphPad Prism 9对每只小鼠绘制HIV-1 RNA数据(每治疗n = 3;随机选择),以及每个处理的平均值。
DNA标准曲线
为了建立一个通过qPCR量化HIV-1 DNA拷贝的标准,HIV-1呕吐扩增子使用TOPO™TA克隆试剂盒(Invitrogen, Cat. 450640)克隆,转染到One Shot®TOP10大肠杆菌(表达载体,猫。C404004),在含有50µg/mL卡那霉素的LB琼脂板上生长,使用QIAprep®Spin Miniprep Kit (QIAGEN, Cat. 27104)从过夜培养中提取DNA。质粒DNA测序以确定HIV-1呕吐完整性和标准的连续稀释[38].
使用HIV-1特异性引物与小鼠组织DNA样本一起进行qPCR扩增呕吐(30,000、3,000、300、30和3个标准拷贝)或人β-珠蛋白(100,000、10,000、1000、100和10个标准拷贝)。周期阈值根据对数尺度上的初始模板量绘制,以创建标准曲线[38].根据标准曲线绘制DNA样本阈值,以量化DNA拷贝数。
组织中HIV-1 gag DNA定量。
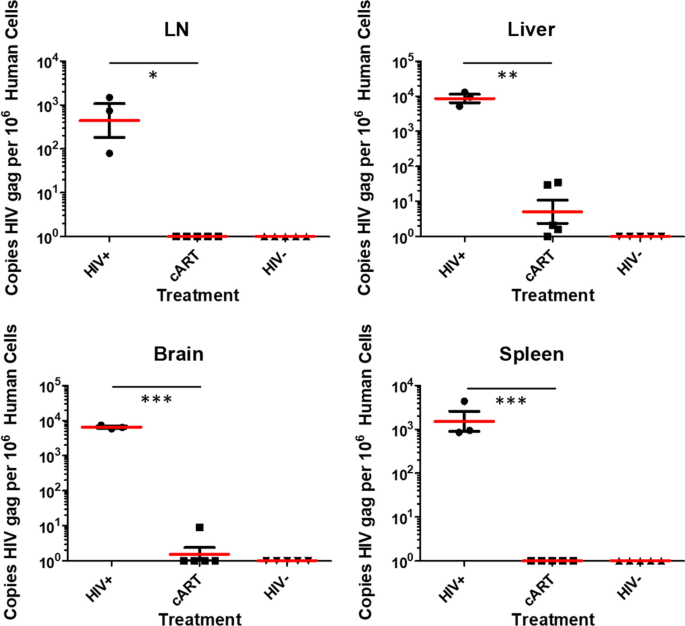
通过qPCR测定总病毒DNA(整合和非整合,线性和圆形形式),定量小鼠组织中的病毒DNA载量。使用QIAGEN DNeasy®血液和组织试剂盒(QIAGEN, Cat. 69506)从小鼠组织(大脑,肝脏,脾脏和淋巴结)中提取DNA,并使用QuantStudio 3 PCR系统(应用生物系统)对每个样本中含有10µL基因组DNA进行分析。样本与一套HIV-1标准一起进行了分析呕吐96孔板中DNA和人β-珠蛋白DNA三份。DNA拷贝数用QuantStudio 3 PCR系统采用标准TaqMan协议进行定量。这包括50°C下的单个循环5分钟,95°C下的单个循环10分钟,以及95°C下的45个循环15秒和60°C下的45个循环1分钟。所有qPCR实验均重复3次,以确保重复性。未知的hiv - 1呕吐或人类β-珠蛋白DNA拷贝数由已知的HIV-1标准DNA拷贝数外推确定呕吐DNA或人类β珠蛋白。我们表达了HIV-1呕吐每10份为一份6细胞。所有统计数据均使用GraphPad Prism 9进行计算。