摘要
背景
在卵泡中,膜细胞(Theca Cells, TCs)有两个主要功能:保持形态完整性,重要的是,分泌类固醇雄激素。tc表达必需酶17α-羟化酶/17,20-脱脂酶(CYP17),允许孕烯醇酮和孕酮转化为雄激素。由于内在卵巢缺陷导致的CYP17酶活性失调被假设为女性高雄激素血症的原因。雄激素过剩见于多囊卵巢综合征(PCOS)的女性,这是由于内源性雄激素分泌过多引起的,以及在出生时女性性别分配后接受外源性睾酮治疗的变性男性。然而,分子和形态效应Cyp17卵泡发生的过表达和雄激素过量尚不清楚。
方法
在这项工作中,为了寻求卵巢雄激素过量局部结果的全面分析,我们生成了强力霉素(Dox)诱导的转基因小鼠模型(TC17)Cyp17局部和时间的过度表达。TC17小鼠由tet依赖表达系统和Cre/LoxP基因控制系统联合获得。
结果
dox处理TC17小鼠卵巢过表达Cyp17特别是在tc中,诱导高睾酮水平。令人惊讶的是,TC17卵巢形态类似于睾丸激素治疗的变性男性的卵巢特征(部分受损的卵泡发生,肥厚或黄体化的基质细胞,闭锁的卵泡和塌陷的簇)。我们还评估了TC17的生育能力,这表明正常生殖功能受到了干扰(例如,低怀孕率和每窝幼崽的数量)。最后,RNAseq分析允许我们识别失调基因(Lhcgr,Fshr,Runx1)和途径(细胞外基质和类固醇合成)。
结论
我们的新型小鼠模型是一种多功能工具,为研究药物的影响提供了创新的见解Cyp17卵巢过表达和高雄激素血症。
简介
卵泡由三种不同的细胞群组成:卵母细胞、颗粒细胞(GCs)和膜细胞(TCs) [1,2,3.,4,5].TCs由卵泡的外层组成(3-5层),有两个主要功能:保存卵泡的形态完整性,重要的是雄激素类固醇的产生[6,7].膜层的这些功能作用主要是由两种不同的细胞类型实现的,即内膜内和外膜外[8].外膜的末端分化以收缩蛋白的表达为特征,这些蛋白在排卵过程中起关键作用,导致卵泡破裂[9].另一方面,内膜的末端分化是以产生雄激素的间质细胞的发育为特征的。理解这一发育过程很重要,因为卵泡来源的雄激素是卵泡雌激素产生的必要前体,对正常卵泡发生、排卵和生殖至关重要[10].
对tc及其在女性生殖中的雄激素作用的关注在概念上被忽视了,雄激素主要是在男性生殖功能的背景下研究的。然而,近几十年来,新的细胞和分子方法以及动物模型揭示了TC雄激素产生对卵泡进展和卵巢疾病如多囊卵巢综合征(PCOS)发病的影响的新见解[11,12,13,14,15,16,17,18].因此,随着时间的推移,对tc及其雄激素在卵泡成熟中的作用的理解已经有了显著的进展[19].最初,雄激素被认为对正常卵泡发生有害,主要是由于在小鼠模型中显示的负面影响[20.,21,22,23].后来不断发展的叙述,建立在雄激素受体(AR)调查的基础上[24,25),似乎更加复杂。的确,研究发现tc在发育过程中也能促进GCs和卵母细胞之间的交流,并在卵泡发育阶段产生成熟卵母细胞时支持其生长[26,27,28].体外研究表明,雄激素可以促进GC分化,但这似乎是阶段依赖性的,因为随着生长的增加,较大尺寸的卵泡可能对雄激素暴露的反应不佳,甚至闭锁[13,17,29].迄今为止,我们已经知道雄激素对正常卵泡成熟很重要,因为雄激素可以促进小卵泡的生长[13,17,29,30.,31].据推测,这种效应可能是雄激素能够增加GCs中的FSH受体的结果[14,15].
值得注意的是,类固醇原性tc唯一表达必需酶17α-羟化酶/17,20-脱泥酶(CYP17),这是雄激素产生所必需的[7,32,33,34].在雌性老鼠中,Cyp17表达主要局限于卵巢(~ 500转录本每百万,TPM)和胎盘,微弱表达(~ 2tpm)在子宫和肾上腺。在卵泡内,Cyp17在tc中表达,但在邻近的GCs或卵母细胞中不表达[35,36].最重要的是,在多囊症女性中,雄激素过量可能导致,至少部分原因是由于tc的内在缺陷导致Cyp17酶活性失调[37,38,39].这得到了研究的支持Cyp17卵巢TCs中mRNA和蛋白的表达[30.,40].然而,这些研究大多是在PCOS患者中进行的,因此,这些研究与内在的形态学和功能性卵巢缺陷有关,不能概括tc在正常卵巢中的真正作用。因此,雄激素对卵泡功能的生理作用尚不清楚。这一局限性并非微不足道,因为关于雄激素对正常女性卵巢功能影响的全面知识非常有限。最接近的实验证据,适当地集中在雄激素对非病理性卵巢的影响,一直是跨性别男性(TGM)研究,不幸的是,这些研究的特点是力量有限,缺乏结论性结果[41,42,43].
因此,缺乏关于雄激素对正常卵泡功能影响的可靠信息。为了解决这些知识上的差距,我们通过结合Cre/LoxP和tet依赖(开关)表达系统,创建了诱导过度表达的转基因小鼠模型Cyp17,我们称之为TC17。这一策略不同于其他雄激素过量的动物模型,这些动物模型涉及在体内和全身给药单一雄激素或芳香化酶抑制剂(例如来曲唑)[44,45,46].值得注意的是,我们的TC17概括了在接受性别确认睾酮治疗的TGM中观察到的卵巢形态,似乎是研究局部长期雄激素过量存在的卵巢卵泡发生的有价值的模型。
材料与方法
质粒和小鼠模型
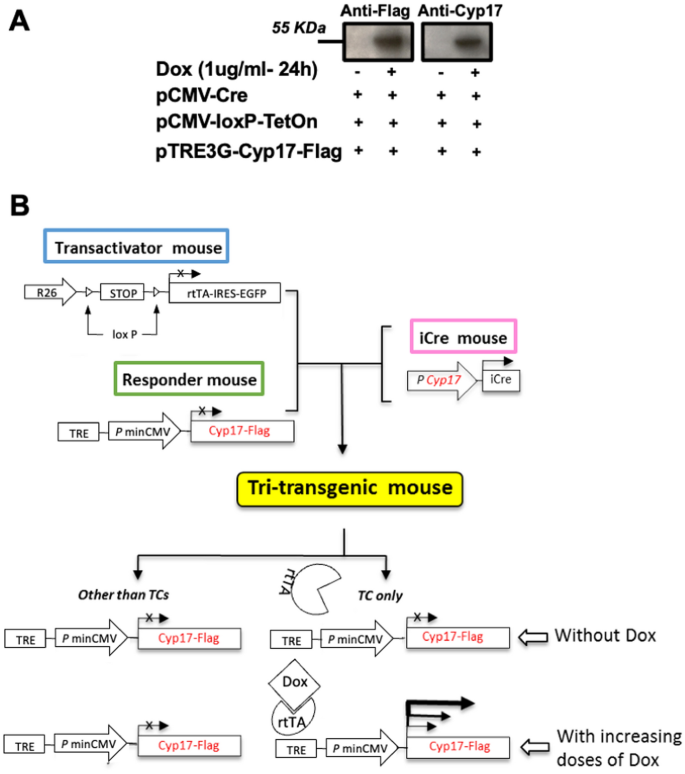
所有小鼠均为C57BL/6 J (B6)背景(Jackson or Envigo, USA)。我们生成了一个过表达tc选择性小鼠的育种系Cyp17使用tet依赖表达系统和Cre/LoxP基因控制系统的组合,如图所示。1B.基于tet的诱导和Cre/LoxP基因控制相结合是一种较新的系统,用于生产转基因动物模型,以时间方式研究成年动物中人类疾病的分子基础。这种优雅的策略在体内和体外被广泛用于有条件的、可逆的基因表达[47,48,49,50,51,52,53,54,55,56,57,58,59].具体来说,我们用过Cyp17启动子- icre小鼠[60]与反式激活小鼠(ROSA26位点的r26 - stop - rta - ires - egfp转基因,Jackson实验室)和携带由加州大学圣地亚哥分校(UCSD)转基因小鼠和胚胎干细胞核心设施创建的trei - cyp17转基因的应答小鼠进行杂交。的Cyp17编码片段被插入到TRE- pmincmv载体(pTRE-TightTM, Clontech, Mountain View, CA)的多克隆位点,其中包含一个修饰的Tet响应元件(TRE),在没有rtTA和Dox处理时沉默。通过两步育种过程获得转基因小鼠。最初,我们将transactivator小鼠和responder小鼠配对,以生产双转基因小鼠(r26 - stop - rta - ires - egfp /TRE-Cyp17)。随后,我们将双转基因小鼠与表达icre的小鼠配对,得到实验性的三转基因小鼠(r26 - stop - rta - ires - egfp /TRE-Cyp17/Cyp17iCre)。在这里,Cyp17启动子- icre小鼠[60],以确保rtTA/EGFP在次级卵泡的TCs中特异性表达。重要的是,在tc中两个LoxP位点之间的DNA片段被Cyp17iCre特异性切除后,R26-STOP-rtTA基因在所有子tc中仍然被激活。双WT转基因小鼠Cyp17基因(r26 - stop - rta - ires - egfp /Cyp17iCre)和不含rtTA/TetOn基因的双转基因小鼠(trei - cyp17 /Cyp17iCre)作为本研究的对照小鼠(CTRL)。只有用Dox治疗才能缓解抑制,并诱导trei - cyp17的活性转录。为验证该模型进行了初步研究(图2)。1A、附加文件1:图S1,附加文件1:图S2)。渐进式腹腔注射阿霉素在转基因小鼠体内产生剂量依赖性诱导基因表达增加(附加文件)1:图S1)。进行了一项体外试验研究,以验证系统的效率(图2)。1A).小鼠被分组安置在一个温度控制的房间(21-22°C),有12小时的明暗循环,可以自由地获得食物和水。所有的动物实验都是按照加州大学圣地亚哥分校的动物护理和使用委员会批准的协议(#S01022)进行的。所使用动物的样本量和年龄在图例中注明。验证有效的长期上调Cyp17,我们使用了市售的高剂量氢化多西环素饮食作为更方便的给药方法(TD.120489 2020, 994 g/Kg Teklad全球大豆蛋白无啮齿动物饮食,预挤压和6 g/Kg氢化多西环素),其中含有约87%的多西环素。该饮食由供应商设计,以小鼠每日摄取3-5克的Dox为基础,提供16-26毫克的日剂量。在幼鼠繁殖、哺乳和生长期间,给所有小鼠喂食标准对照饲料(TD.140163 2020, Teklad全球无大豆蛋白啮齿动物饲料,预挤压)。小鼠在断奶时被随机分组,以尽量减少任何潜在的偏差。实验开始时,所有动物的健康状况正常。
TC17体外和体内验证策略。一个293个T细胞转染含CRE、LoxP/TetOn和Cyp17/Flag的三种质粒。在有或没有1 ug/ml Dox暴露24 h后,细胞裂解物用抗flag和抗cyp17抗体进行免疫印迹分析。B用纯合子反应小鼠与纯合子转激活小鼠杂交。双转基因小鼠与Cyp17iCre转基因小鼠杂交[60]到producer26 - stop - rta - ires - egfp /TRECyp17/Cyp17iCre三重转基因小鼠。R26,一个普遍存在的内源性ROSA26启动子;rtTA,反向tet控制转录激活因子;IRES,内部核糖体进入位点;EGFP,增强型绿色荧光蛋白;强力霉素、强力霉素
组织收集和组织学
在阿Dox饲料暴露后,小鼠用异氟醚麻醉,称重,并在快速安乐死前通过眶后出血收集血液。取出卵巢后称重。收集每只小鼠的一个卵巢,在干冰上冷冻,并在- 80°C保存,直到使用定量PCR处理mRNA表达水平。每只小鼠的另一个卵巢在4°C的10%福尔马林中固定过夜,并在组织学处理前保存于70%乙醇中。
为了进行组织学分析,固定卵巢在10 μm处连续切片,然后通过UCSD组织技术共享资源(以前称为组织学和免疫组化核心)用苏木精和伊红(H&E)染色。从每个卵巢中随机选择两个切片,统计初级、次级、窦性和囊性卵泡。在每一种情况下,计数由一名研究人员进行,对治疗组不知情。
激素化验
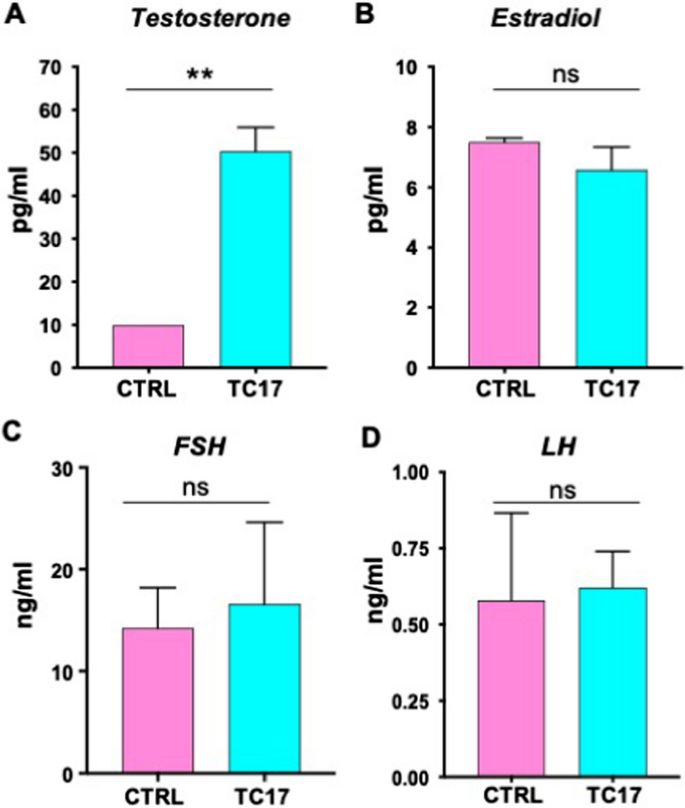
由弗吉尼亚大学配体核心设备测量LH、FSH和E2激素水平。采用小鼠多重法测定血清LH和FSH(可报告范围分别为0.24-30.0 ng/ml和2.4-300 ng/ml)。采用小鼠酶联免疫吸附法测定血清E2(范围3.0-300 pg/ml)。在UCSD高级实验室医学健康中心用LC-MS /MS测量血清T(范围4-1560 ng/dL)。
发情周期和生育评估
在Dox或对照chow治疗后4-6周,通过光镜分析阴道上皮涂片上的主要细胞类型来监测15天的发情周期。发情前期以有核和部分角化上皮细胞的存在为分类,发情前期以角化细胞的存在为分类,发情前期以部分角化上皮细胞和主要为白细胞的存在为分类。另一组7周大的雌性TC17和CTRL小鼠被用来评估生育能力。在治疗8周龄和治疗后1周龄(n = 10只/组),TC17与3月龄的C57BL/ 6n成年雄性配种。繁殖雄性在10天后被移除,雌性被评估怀孕、第一窝的时间和每窝幼崽的数量。
血液学的概要文件
采集血液后,使用Hemavet 950FS获得TC17和CTRL小鼠的血液学资料。RBC (M/μl)和HCT(%)的控制范围分别为6.36 ~ 9.42和35.1 ~ 45.4。
瞬时转染
293个T细胞培养于6孔组织培养板(1 × 106细胞/)。第2天用无血清DMEM-F12(补充抗生素)替换培养基,按照制造商的程序,使用上述质粒,Lipofectamine LTX +或Lipofectamine 3000试剂(目录#15338100或#L3000008,分别来自赛默飞仕科技公司)转染4小时。4 h后,用新的无血清DMEM-F12替换培养基,转染细胞在37°C下加或不加Dox培养24 h。此时,细胞被裂解用于进一步分析。
RNA提取和q-RT-PCR
转染4小时后,在无血清DMEM-F12中额外培养24小时,使用TRIzol试剂(目录#15596026,赛默飞雪科学公司)溶解293 T和整个卵巢,并使用Direct-zol RNA MiniPrep试剂盒(#R2052, Zymo Research, Irvine, CA)按照制造商的方案提取RNA。使用高容量cDNA逆转录试剂盒(#4368814,Thermo Fisher Scientific)逆转录1 μg RNA。使用SYBR Green PCR Master Mix (#4309155, Thermo Fisher Scientific)和Bio-Rad CFX384实时PCR检测系统对cDNA进行q-RT-PCR扩增,定量mRNA表达。Q-RT-PCR采用Qiagen RT引物分析2qPCR引物分析(200)(目录号330001)Cyp17、Cyp19,Pgr,阿,Lhcgr, Fshr而且,Foxl2基因。引物检测效率由制造商保证。目标基因表达归一化Gapdh而且肌动蛋白表达式。
RNAseq分析
使用TRIzol试剂(目录#15596026,赛默飞世尔科学公司)粉碎并溶解TC17卵巢,并使用Direct-zol RNA MiniPrep试剂盒(#R2052, Zymo Research, Irvine, CA)按照制造商的方案提取RNA。RNAseq由Novogene公司执行。简单地说,用聚t低聚附着磁珠从总RNA中纯化mRNA。在NEBNext第一链合成反应缓冲液(5×)中使用二价阳离子在高温下进行裂解。使用随机六聚体引物和M-MuLV逆转录酶(RNase H)合成第一股cDNA,随后使用DNA聚合酶I和RNase H合成第二股cDNA,剩余的悬链通过外切酶/聚合酶活性转化为钝端。将DNA片段3 '端进行腺苷酸化后,结扎具有发夹环结构的NEBNext Adaptor,准备杂交。为了优选150-200 bp长度的cDNA片段,文库片段用AMPure XP系统(Beckman Coulter, Beverly, USA)进行纯化。然后使用3 μ l USER酶(NEB, USA),选择大小,接头连接cDNA在37℃下15 min,然后在95℃下5 min,然后进行PCR。然后用Phusion高保真DNA聚合酶、万能PCR引物和Index (X)引物进行PCR。最后对PCR产物进行纯化(AMPure XP系统),并在Agilent Bioanalyzer 2100系统上对文库质量进行评估。 Sequencing libraries were generated using NEBNext UltraTM RNA Library Prep Kit for Illumina (NEB, USA) following the manufacturer’s recommendations and index codes were added to attribute sequences to each sample. RNA-seq libraries were sequenced on the Novaseq4000, with 150 bp paired end read chemistry. Reads were aligned to the Mus musculus genome using STAR (mismatch = 2). Read quantification was called using FeatureCounts, and differential expression analysis was called using DESeq2, with an adjusted p-value threshold of 0.05. Additionally, GO and KEGG enrichment analyses were performed using ClusterProfiler using an adjusted p-value threshold of 0.05 [61,62,63].
共焦和RNAscope
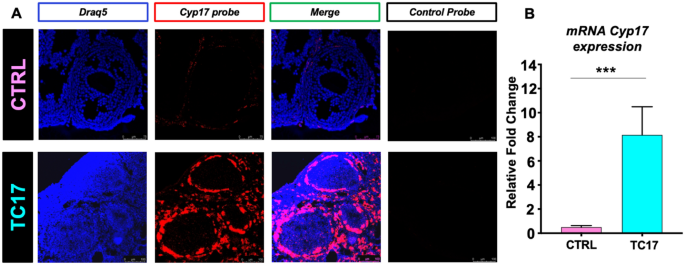
小鼠用美托咪定/氯胺酮深度麻醉。当尾/趾捏无反应时,先经心脏灌注1%的磷酸盐缓冲生理盐水,然后再注入4%的多聚甲醛溶液固定卵巢组织。然后将卵巢从小鼠体内取出,保存在30%的蔗糖溶液中直到使用。冷冻卵巢用标准徕卡Cryostat (CM1860)切片(30 μm)。用徕卡共聚焦显微镜获得每只小鼠四个卵巢切片的荧光图像。用于小鼠的RNAscope原位杂交(ACD,高级细胞诊断)Cyp17按照制造商的说明进行mRNA。基于ACD双ZZ探针对的设计,两者都需要与目标结合才能开始放大,任何不匹配的目标在放大之前都被忽略,因此获得的信号非常特定。的探测Cyp17(ACD Ref. 522611, GenBank Accession Number NM_007809.3)被设计用于靶向cDNA序列的核苷酸159-1100。RNAscope®3-plex阴性对照探针(ACD Ref. 320871, Bacillus subtilis菌株的细菌基因dapB)用于评估任何非特异性背景。
Western blot分析
转染4小时并在无血清DMEM-F12中额外培养24小时后,HGrC1细胞在裂解缓冲液(RIPA缓冲液,目录#89901,赛默飞世尔科学公司)、磷酸酶抑制剂鸡尾酒(#78420,赛默飞世尔科学公司)和蛋白酶抑制剂鸡尾酒(#P8340, Sigma-Aldrich)中裂解。使用Pierce BCA蛋白测定试剂盒进行总蛋白定量(#23227,赛默飞世尔科学公司)。将NuPAGE LDS样品缓冲液4× (#NP0007,赛默飞世尔科学公司)和β-巯基乙醇(#6010,Calbiochem, Billerica, MA)添加到细胞裂解液中,样品在95°C变性5分钟。蛋白质分离发生在12% SDS-PAGE凝胶上,随后转移到氮纤维膜上。然后用阻塞液(BSA, #A30075-100, Research Products International, Mount Prospect, IL)将膜孵育1小时,并在4℃下与一抗孵育过夜。膜清洗三次,然后用辣根过氧化物酶偶联二抗体孵育1小时,再进一步清洗三次,并用Super Signal West Femto Maximum sensitivity底物孵育,以检测化学发光(#34095,赛默飞雪科学公司)。或者,primary (antibody Proteintech cat。#14447-1-AP Cyp17A1抗体Sigma cat。分别使用Signal Enhancer HIKARI (#NU00101和#NU00102, Nacalai USA, San Diego, CA)的溶液1和2进行二抗培养,以增强蛋白质检测。β-肌动蛋白作为负荷对照。
统计分析
样本量的选择是基于我们所进行的分析的经验,以获得足够的能力来检测正在进行的实验中生物学相关的差异。未配对t以及,未配对t-测试韦尔奇修正,曼-惠特尼测试,并在适当的地方执行,如图图例所述。所有统计分析均使用GraphPad Prism软件进行。如果P < 0.05,则比较被认为是显著的。
结果
阿Dox处理诱导TC17转基因小鼠表达Cyp17在局部和暂时的方式和增加睾丸激素的血液水平
在体外验证了目前工作中使用的反基因结构(图。1A),并执行育种策略以获得TC17小鼠(见材料与方法,图。1B),对TC17模型进行dox处理i.p。剂量反应注射(附加文件1:图S1)。
的表达式Cyp17似乎与剂量有关。以验证长期有效的上调Cyp17,我们采用阿Dox饮食作为更方便的给药方法。在长期治疗(4周)后,对小鼠实施安乐死Cyp17通过RNAscope和qPCR验证其上调(图;2).值得注意的是,对TC17卵巢的RNAscope分析清楚地显示了特异性的上调Cyp17在tc中与CTRL相比(图;2增加)。Cyp17通过qPCR分析和确认mRNA水平(图;2B)。此外,该系统在显微镜下显示的TC17 tc中特异性表达transactivator rtTA蛋白(附加文件)1:无花果。2).
为了进一步验证我们的模型,我们量化了血清中的激素水平。正如预期的那样,与CTRL相比,TC17中T强烈上调(图。3.A). E2、FSH、LH无显著性差异(图。3.罪犯)。
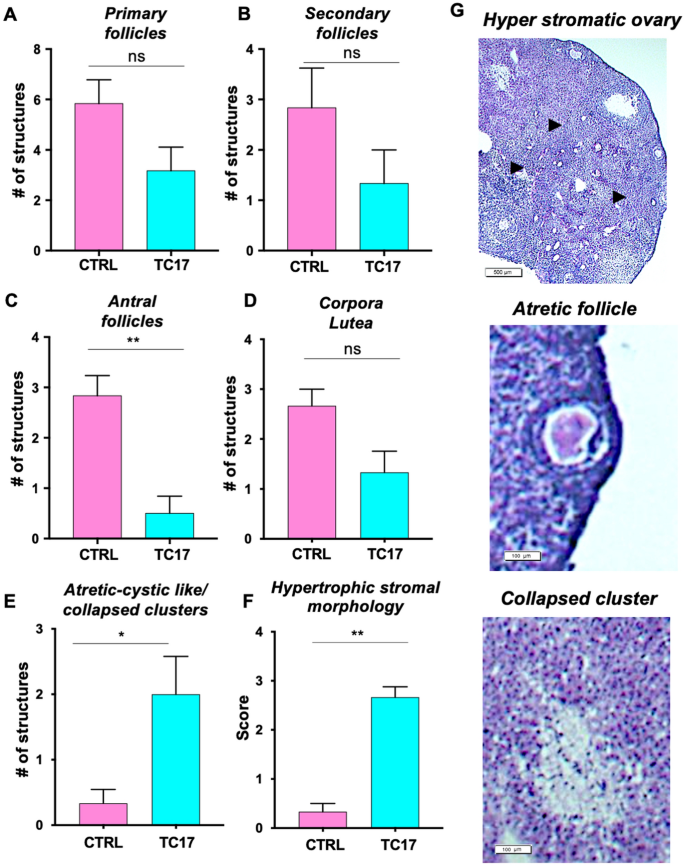
TC17卵巢表型以卵泡发育受损、气孔细胞肥大、卵泡闭锁和细胞簇塌陷为标志
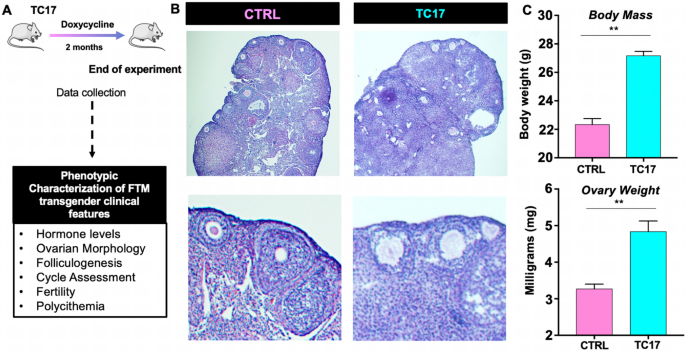
进一步了解诱导的长期效果Cyp17雌性TC17小鼠用Dox治疗8周(图2)。4).实验的原理图如图所示。4A.治疗后,TC17小鼠的体重和卵巢重量明显高于CTRL小鼠(图。4C)。卵巢的组织学评估显示,与基质细胞大量存在的对照组相比,TC17呈现不同的形态(图。4B)。
TC17卵巢还以卵泡发生受损为特征,窦卵泡数量显著减少(图17)。5A-D和G)和肥厚间质或黄体化间质细胞(图。5此外,还观察到闭锁性卵泡和闭锁性囊性形成(图。5E).我们还发现了与基质黄体化有关的形态结构,而不是与语料体有关。这些结构(图;5G)——我们称之为塌陷团簇——由周围基质中无法分辨的明亮细胞池组成。
TC17雌性小鼠发情周期延迟,生育力受损
TC17卵巢与变性男性卵巢相似的证据为研究长期高雄激素血症对这些个体生殖生理的影响创造了一个潜在的模型。作为第一种方法,我们评估了TC17的发情周期。治疗后5周,TC17雌性小鼠的阴道涂片中白细胞占优势,结果显示TC17雌性小鼠的发情周期处于双肠状态。6A),表现为部分少排卵,发情明显延迟(图。6B).评估的功能后果Cyp17和卵巢高雄激素血症对生殖的影响,我们评估了TC17和CTRL女性在阿Dox治疗1周后的生育能力(实验方案如图所示)。6C).所有对照雌鸟(10/ 10,100 %)与育种雄鸟交配10天后产下一窝(图1)。6D).相比之下,TC17只雌性中只有2只(2/ 10,20 %)成功分娩。生育力受损的迹象也明显表现在第一胎出生时间的显著差异上(图。6E)和窝仔数(图。6F)与CTRL组相比。
TC17小鼠发情周期及生育力评价。在Dox治疗期间(8周),在治疗开始后4周评估CTRL和TC17小鼠(N = 10)的发情周期。发情前期以有核和部分角化上皮细胞的存在为分类,发情前期以角化细胞的存在为分类,发情前期以部分角化上皮细胞和主要为白细胞的存在为分类。一个每个周期阶段所花费的相对时间的百分比,B6只小鼠/组连续15天具有代表性的发情周期。M/D,流/背相;P,发情前期;E,发情期。C用TC17和CTRL小鼠7周龄的雌性小鼠单独队列来评估生育力。在8周龄时,治疗后1周(N = 10)与成年C57BL/6 N繁殖雄性(3个月大)配对。繁殖雄性在10天后被移除。评估女性的怀孕率(D)、第一次分娩的时间(天)(E),幼崽数/窝数为±s.e.m。数据分析采用双尾Mann-Whitney检验(*p < 0.05)
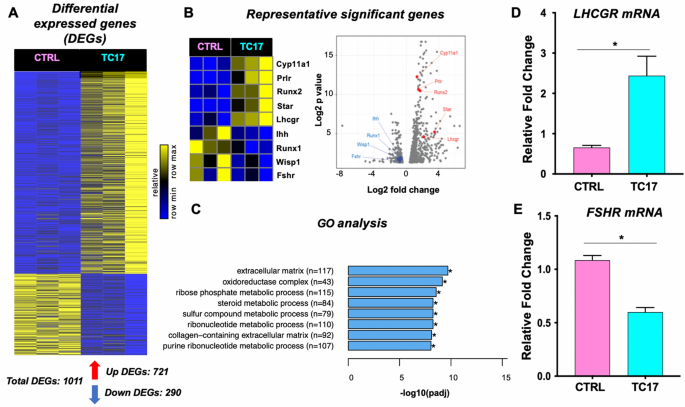
TC17卵巢的转录谱分析揭示了Cyp17上调的全基因组影响
研究与dox诱导相关的转录变化Cyp17因此,通过RNA测序分析了过量雄激素、TC17和CTRL卵巢的影响。7A).然后我们在CTRL和TC17样本之间进行差异表达分析,以识别被诱导或抑制的基因Cyp17过度表达式(附加文件2:表S1)。
Cyp17过表达的转录组效应是TC17子房。RNA测序揭示Cyp17对卵巢基因调控的影响。一个在Cyp17诱导中上调基因721个,下调基因290个(p值< 0.05)。B在这些基因中,众所周知的卵巢形态发生转录调控因子如Cyp11, Prlr被上调了,而本次事件而且Runx1表达下调。火山图显示基因的相对折叠变化和p值B.C对1011个差异表达基因的GO分析包括细胞外基质和含胶原蛋白的细胞外基质(见附加文件)1:全学期表见图S4)。D- - - - - -E的诱导和抑制Lhcgr而且Fshr分别为RNA-seq检测结果,经qPCR验证
我们发现共有1011个差异表达基因(DEGs),其中721个表达上调,290个表达下调(图2)。7底部)。热图分析和图中火山图。7B表示上调(例如,Prlr,Cyp11a,明星,Runx2)或降低管制(例如,Fshr,Runx1)的基因,这些基因对卵巢形态发生是不可或缺的。额外的文件1:图S3显示了50个上下调节的差异值(按调整后的p值排序)。我们独立核实Lhcgr而且FshrqPCR检测mRNA水平(图;7D和E)。其他重要的卵巢标志物(Cyp19,Pgr,抗苗勒氏管激素,Foxl2)以同样的方式进行验证(附加文件1:图S6)。
接下来,为了评估TC17模型中发现的失调基因的功能意义,我们对DEGs进行了基因本体(Gene Ontology, GO)分析。我们找到了DEGs(附加文件1:图S4)在细胞外基质(ECM)、含胶原的ECM和类固醇代谢过程通路中显著富集(图4)。7C、附加文件1:图S5)。这些发现有助于解释我们的组织病理学发现,其中的主要特征是层间质成分/黄体化组织的增加(见LH受体的增加和与胶原和ECM相关的GO通路的富集),具有特定的跨性别特征,以及卵泡发生的部分损伤(减少)Fshr水平)。
TC17小鼠红细胞增多
最后,我们试图调查TC17是否表现出与雄激素过载相关的特定全身体征。我们发现TC17血液以红细胞增多症为特征,红细胞(RBC)水平和红细胞压积(HCT)百分比升高,如附加文件所述1:图S7.;
讨论
在这项工作中,我们提出了一个新的转基因小鼠模型,称为TC17,其特征是dox诱导的空间和时间Cyp17tc上调。我们生成了pTRE3G-Cyp17应答小鼠。通过将这些小鼠与transactivator小鼠(在ROSA26位点上的r26 - stop - rta - ires - egfp转基因)和iCre小鼠(Cyp17启动子- icre),成功获得过表达dox依赖的三转基因小鼠Cyp17卵巢的tc。经过长期阿Dox治疗,Cyp17这些TC17小鼠卵巢的mRNA水平显示,与野生型小鼠卵巢相比,增加了6到10倍。与过度表达一致Cyp17,血清T水平显著升高,E2、FSH、LH无明显变化。在治疗结束时,与对照组相比,我们模型的内分泌特征也伴随着明显更大的身体和卵巢重量。此外,TC17小鼠表现出不规则的发情周期和生育力下降的特征,与野生型小鼠相比,TC17小鼠的第一窝时间更长,每窝的幼崽数量更少。TC17卵巢形态学评估显示卵泡发生部分受损,窦卵泡和间质细胞肥大减少,黄体化间质细胞增多。我们还发现大量的闭锁/囊性卵泡和坍塌的透明细胞簇。总的来说,这些数据表明雄激素诱导的正常卵泡发生和生育缺陷。
卵巢形态特征与我们TC17模型中显示的相似,已在先前对接受睾酮替代疗法(TRT)治疗的跨性别男性的研究中描述过[43,64,65,66,67,68].事实上,TC17小鼠模型似乎特别类似于这些特征中的几个:卵巢形态学评估表明,卵泡发生部分受损,窦卵泡显著减少。此外,肥厚间质细胞或黄体化间质细胞[69]类似于在变性男性卵巢中观察到的[41,42,70,71].虽然我们没有发现Ikeda等人所描述的多囊卵巢形态,但我们确实观察到大量的闭锁/囊性卵泡和小组所描述的塌陷的透明细胞簇[67].
迄今为止,只有一种动物模型被提出来研究睾酮疗法对变性男性生殖的影响。这个模型,由Kinnear等人提出.利用睾酮酮的皮下给药,并反映了在变性男性T治疗中观察到的一些生殖障碍[43,72].有趣的是,他们表明T疗法诱导的发情周期中断是可逆的[72].然而,该模型的妊娠结局没有报道,也没有显示出在人类中观察到的卵巢肥厚间质形态。
引起的形态变化Cyp17TC17模型的过表达有几个分子改变。我们在TC17小鼠卵巢中发现了1011个差异表达基因(290个下调,721个上调)。其中,我们发现基因可以阐明我们所描述的卵巢组织病理学。在TC17转录组谱中,控制类固醇合成的基因(明星,Cyp11a1)在TC17小鼠中上调。LH受体基因(Lhcgr)也显著上调,解释了高水平的黄体化间质细胞。对这些deg的GO和KEGG分析证实了我们的假设,TC17可以类似于睾丸激素治疗的变性男性的卵巢表型,具有丰富的胶原化途径和ECM组织。
来自我们转录组数据的TGM卵巢表型的其他重要证据包括催乳素受体(Prlr)基因和Runx1而且Foxl2基因。目前的文献表明Prlr在卵巢中有促性激素作用[73].有趣的是,尼科尔等人.在2019年发现Runx1必不可少的卵巢的维持和综合损失Runx1而且Foxl2使胎儿卵巢部分男性化[74].TC17还表现为红细胞增多。高水平的HCT和rbc通常在TGM中增加,随后的红细胞增多被认为是一种药物不良反应,终身激素治疗[75,76].
最后,除了在TC17小鼠中观察到上述分子和形态变化外,还观察到生育力受损。我们的研究发现TC17发情周期被打乱,怀孕率显著降低。鉴于缺乏描述TGM中性别确认TRT对生殖影响的人类临床数据,这一点尤其重要。虽然TRT是TGM性别确认医疗护理的支柱[77,78继发性闭经在睾酮治疗的个体中很常见[79,80,81],确切的经期抑制机制尚不清楚。尽管最近的一项研究观察到接受TRT的TGM无排卵率很高[82],很少有研究评估睾酮对卵泡结构和功能的影响。鉴于这种有限的知识,目前的护理标准是在出生时女性性别分配后,就生育能力下降的可能性向对性别肯定睾酮治疗感兴趣的患者提供咨询[77,78,83,84,85,86].随着性别确认护理的改善,越来越多的患者开始考虑保留生育能力及其对他们身份认同和未来家庭目标的影响[87].因此,有必要进行临床调查,仔细检查雄激素治疗对正常排卵功能的影响。
考虑到研究人类高剂量睾酮治疗的生殖后果的伦理困难,以及研究非人类灵长类动物时所引入的成本、繁殖力、世代时间和寿命所施加的限制,啮齿动物模型提供了一个有吸引力的选择。
考虑到这一点,我们的研究表明,新的TC17模型是未来研究雄激素对卵巢结构和功能、生殖周期和生育能力的剂量依赖效应的创新和强大的工具。综上所述,TC17:(i)具有强西环素依赖性调节,Cyp17特异性地存在于tc中,(ii)类似于TGM卵巢组织病理学,(iii)模拟高雄激素血症中典型的红细胞增多症(图2)。8).
数据和材料的可用性
原始测序数据可在国家生物技术中心信息序列阅读档案(登录号PRJNA769200)中找到。
参考文献
McNatty KP, Heath DA, Lundy T, Fidler AE, Quirke L, O 'Connell A, Smith P, Groome N, Tisdall DJ。控制卵巢早期卵泡发育。中华农学杂志,1999;44:3 - 16。
McNatty KP, Moore LG, Hudson NL, Quirke LD, Lawrence SB, Reader K, Hanrahan JP, Smith P, Groome NP, Laitinen M, Ritvos O, Juengel JL。卵母细胞及其在调节排卵率中的作用:生殖生物学的新范式。繁殖。2004;128(4):379 - 86。
田岛K, Orisaka M, Yata H, Goto K,细川K, Kotsuji F.颗粒细胞和膜细胞相互作用在卵巢卵泡成熟中的作用。光学精密工程学报。2006;26(6):457 - 457。
李志刚,曾柏凯,李志刚。卵母细胞-颗粒-膜细胞在卵泡发育过程中的相互作用。中国卵巢杂志,2009;2(1):9。
McNatty KP, Makris A, DeGrazia C, Osathanondh R, Ryan KJ。体外人类卵巢的颗粒细胞、硬膜组织和间质组织产生孕酮、雄激素和雌激素中华临床内分泌杂志,2009;19(5):687 - 698。
年轻的JM, McNeilly AS。卵泡膜:卵泡中被遗忘的细胞。繁殖。2010;140(4):489 - 504。
Richards JS, Ren YA, Candelaria N, Adams JE, Rajkovic A.卵巢卵泡膜细胞招募、分化及对生育能力的影响:2017年更新。Endocr Rev. 2018;39(1):1 - 20。
Erickson GF, Magoffin DA, Dyer CA, Hofeditz C.卵巢雄激素产生细胞:结构/功能关系的综述。Endocr Rev. 1985;6(3): 371-99。
Ko C, Gieske MC, Al-Alem L, Hahn Y, Su W, Gong MC, Iglarz M, Koo Y.内皮素-2在卵泡破裂中的作用。内分泌学。2006;147(4):1770 - 9。
卵巢中间充质-上皮细胞的相互作用:雌激素诱导的膜细胞类固醇生成。中国生物医学工程学报。1990;22(1):1-5。
Rosenfield RL, Ehrmann DA。多囊卵巢综合征发病机制:多囊卵巢综合征为功能性卵巢高雄激素血症假说的再认识。Endocr Rev. 2016;37(5): 467-520。
Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, escoba - morreale HF, Futterweit W, Janssen OE, Legro RS, Norman RJ, Taylor AE, Witchel SF,多囊卵巢综合征的雄激素表型工作组E, Society p。多囊卵巢综合征的雄激素过剩和PCOS社会标准:完整的工作组报告。中国生物医学工程学报。2009;32(2):456-88。
杨MY,财富JE。睾丸激素在体外刺激牛卵泡中初级到次级卵泡的转变。中国生物医学工程学报。2006;75(6):924-32。
动物模型和多囊卵巢综合征的发育起源:越来越多的证据表明雄激素在编程生殖和代谢功能障碍中的作用。内分泌学。2012;153(6):2536 - 8。
Caldwell AS, Middleton LJ, Jimenez M, Desai R, McMahon AC, Allan CM, Handelsman DJ, Walters KA。雌性高雄激素小鼠多囊卵巢综合征生殖、代谢和内分泌特征的研究内分泌学。2014;155(8):3146 - 59。
王晓明,周娟,王晓明,王晓明。雄性激素对灵长类动物卵巢卵泡生长的影响。《中国经济》,1998;29(3):344 - 344。
Harlow CR, Shaw HJ, Hillier SG, Hodges JK。绒绒粒细胞中促卵泡激素反应性类固醇生成的影响因素:雄激素的作用和卵泡成熟阶段。内分泌学。1988;122(6):2780 - 7。
Abbott DH, Barnett DK, Levine JE, Padmanabhan V, Dumesic DA, Jacoris S, Tarantal AF.胎儿和婴儿产前雄激素化雌性恒河猴多囊卵巢综合征的内分泌前因。中国生物医学工程学报。2008;79(1):154-63。
格莱歇N,韦戈夫A,巴拉德DH。雄激素在卵泡成熟和促排卵中的作用:不孕症治疗的朋友还是敌人?《生物内分泌杂志》2011;9:116。
杨建平,杨建平。激素对小鼠卵母细胞体外成熟的影响。中国农业大学学报(自然科学版),2000,20(2):331 - 331。
埃皮格JJ,弗雷特RR,沃德贝利大前锋,舒尔茨RM。小鼠卵母细胞成熟的抑制:cAMP的参与,类固醇激素,和一个假定的成熟抑制因子。中国生物医学工程学报。1983;100(1):39-49。
舒尔茨防守,蒙哥马利防守,沃德贝利防守,埃皮格防守。小鼠卵母细胞成熟的调节:细胞间通讯、cAMP和睾酮的可能作用。中国生物医学工程学报,2003;29(2):344 - 344。
安德列斯C,特伦森AO。睾酮对小鼠卵母细胞体外成熟和发育能力的影响。中国科学(d辑),1995;10(9):2377-81。
木村S, Matsumoto T, Matsuyama R, Shiina H, Sato T, Takeyama K, Kato S.雄激素受体在卵泡发生中的功能及其在卵巢早衰中的临床意义。内分泌杂志2007;18(5):183-9。
李敏,夏腾H,孙启勇。雄激素受体在哺乳动物卵母细胞中的命运:一个新假设。动物科学进展。2009;15(3):149-54。
基德GM,范德海登BC。卵母细胞与卵泡细胞的双向通讯:保证卵母细胞的发育能力。中华药物学杂志,2010;29(4):369 - 369。
刘霞,乔萍,蒋安,姜娟,韩辉,王玲,任晨。小鼠窦前卵泡颗粒细胞对膜细胞类固醇生成的旁分泌调节。生物医学学报,2015;
田岛K, Orisaka M, Mori T, Kotsuji F.卵泡功能的卵巢膜细胞。中国生物医学杂志。2007;15(5):591-609。
哲冢M,希利尔SG。雄激素受体基因在大鼠颗粒细胞中的表达:促卵泡激素和类固醇激素的作用。内分泌学。1996;137(10):4392 - 7。
Jakimiuk AJ, Weitsman SR, Navab A, Magoffin DA。黄体生成素受体、类固醇生成急性调节蛋白和类固醇生成酶信使核糖核酸在多囊卵巢的鞘状细胞和颗粒细胞中过表达。中国临床内分泌杂志,2001;26(3):344 - 344。
Manneras L, Cajander S, Holmang A, Seleskovic Z, Lystig T, Lonn M, Stener-Victorin E.多囊卵巢综合征大鼠卵巢和代谢特征的新模型。内分泌学。2007;148(8):3781 - 91。
Akhtar MK, Kelly SL, Kaderbhai MA。细胞色素b(5)调节17{α}羟化酶和17 - 20裂解酶(CYP17)在类固醇生成中的活性。中华内分泌杂志,2005;37(2):366 - 366。
Patel SS, Beshay VE, Escobar JC, Carr BR。17 α -羟化酶(CYP17)的表达和随后雄烯二酮的产生在人类卵巢。生殖科学,2010;17(11):978-86。
McAllister JM, Kerin JF, Trant JM, estabbrook RW, Mason JI, Waterman MR, Simpson ER。胆固醇侧链裂解和17 α -羟化酶/裂解酶活性的调节在长期单层培养中增殖的人膜内细胞。内分泌学。1989;125(4):1959 - 66。
苏艾,Cooke MP, Ching KA, Hakak Y, Walker JR, Wiltshire T, Orth AP, Vega RG, Sapinoso LM, Moqrich A, Patapoutian A, Hampton GM, Schultz PG, Hogenesch JB。人类和小鼠转录组的大规模分析。美国国家科学研究院。2002, 99(7): 4465 - 70。
张平,Compagnone NA, Fiore C, Vigne JL, Culp P, Musci TJ, Mellon SH.转录因子SET及其靶基因P450c17 (17 α -羟化酶/c17,20裂解酶)的发育性腺表达。细胞生物学杂志,2001;20(10):613-24。
罗森菲尔德RL,巴恩斯RB,卡拉JF,幸运AW。细胞色素p450c17 alpha失调是多囊卵巢综合征的原因。中国农学杂志。1990;32(5):344 - 344。
Gilling-Smith C, Story H, Rogers V, Franks S.多囊卵巢综合征中鞘细胞类固醇生成原发性异常的证据。临床内分泌杂志,1997;47(1):93-9。
纳尔逊VL,列格罗RS,施特劳斯JF 3,麦卡利斯特JM。增强雄激素的产生是多囊卵巢繁殖的膜细胞的一种稳定的类固醇激素表型。分子内分泌。1999;13(6):946-57。
Comim FV, Teerds K, Hardy K, Franks S.人多囊卵巢LHCG受体和17 α -羟化酶/17-20-裂解酶蛋白表达增加。植物学报。2013;28(11):3086-92。
Pache TD, Chadha S, Gooren LJ, Hop WC, Jaarsma KW, Dommerholt HB, Fauser BC。长期雄激素治疗的女性到男性变性人的卵巢形态。多囊卵巢综合征研究的人体模型?组织病理学。1991;19(5):445 - 52。
Spinder T, Spijkstra JJ, Gooren LJ, Hompes PG, van Kessel H.与性腺功能低下和正常女性相比,长期服用睾酮对agonadal女性到男性变性者促性腺激素分泌的影响。中华内分泌杂志,2001;29(1):1 - 7。
Moravek MB, Kinnear HM, George J, Batchelor J, Shikanov A, Padmanabhan V, Randolph JF。外源性睾酮对变性男性生殖的影响。内分泌学》2020。https://doi.org/10.1210/endocr/bqaa014.
Kauffman AS, Thackray VG, Ryan GE, Tolson KP, Glidewell-Kenney CA, Semaan SJ, Poling MC, Iwata N, Breen KM, Duleba AJ, Stener-Victorin E, Shimasaki S, Webster NJ, Mellon PL.一种新的来曲唑模型概括了雌性小鼠多囊卵巢综合征的生殖和代谢表型。中国生物医学工程学报。2015;39(3):369。
Stener-Victorin E, Padmanabhan V, Walters KA, Campbell RE, Benrick A, Giacobini P, Dumesic DA, Abbott DH。了解多囊卵巢综合征病因和病理生理的动物模型。Endocr Rev. 2020。https://doi.org/10.1210/endrev/bnaa010.
Maliqueo M, Sun M, Johansson J, Benrick A, Labrie F, Svensson H, Lonn M, Duleba AJ, Stener-Victorin E.持续给予P450芳香化酶抑制剂可诱导成年雌性大鼠代谢和内分泌表型的多囊卵巢综合征。内分泌学。2013;154(1):434 - 45。
Belteki G, Haigh J, Kabacs N, Haigh K, Sison K, Costantini F, Whitsett J, Quaggin SE, Nagy A.通过cree介导的重组和四环素诱导在小鼠中的条件和诱导转基因表达。核酸研究,2005;33(5):e51。
于敏,刘波,赵雪云,徐伟,Costantini F,一种独特的小鼠时空和谱系特异性基因表达系统的开发。美国国家科学研究院。102(24): 8615 - 2005; 20。
El Andaloussi A, Graves S,孟F, Mandal M, Mashayekhi M, Aifantis I. Hedgehog信号通路控制胸腺细胞祖细胞稳态和分化中华免疫杂志2006;7(4):418-26。
Maes C, Goossens, Bartunkova S, Drogat B, Coenegrachts L, Stockmans I, Moermans K, Nyabi O, Haigh K, Naessens M, Haenebalcke L, Tuckermann JP, Tjwa M, Carmeliet P, Mandic V, David JP, Behrens A, Nagy A, Carmeliet G, Haigh JJ。骨骼VEGF的增加增强了-连环蛋白的活性,导致骨骼过度骨化。中国生物医学工程学报。2010;29(2):424-41。
潘伟,金勇,史丹格B,陈志勇。Notch信号是哺乳动物内耳毛细胞和支持细胞生成所必需的。美国国家科学研究院。2010; 107(36): 15798 - 803。
Parsa S, Ramasamy SK, De Langhe S, Gupte VV, Haigh JJ, Medina D, Bellusci S乳腺末端芽的维持依赖于FGFR2b信号。中国生物医学工程学报。2008;36(1):339 - 344。
Eshkar-Oren I, Viukov SV, Salameh S, Krief S, Oh CD, Akiyama H, Gerber HP, Ferrara N, Zelzer E.形成的肢体骨骼通过Vegf调节作为肢体血管系统模式的信号中心。发展。2009;136(8):1263 - 72。
诺阿TK,卡赞坚A,惠塞特J,施罗耶NF。SAM尖结构域ETS因子(SPDEF)调控肠杯状细胞的终末分化和成熟。科学通报,2010;36(3):452-65。
黄敏,皮敏,黄敏,罗强。钙感受器与甲状旁腺蛋白相互作用的研究进展。中华肾脏病学杂志,2008;
唐珊,史奈德P, Firulli AB,康威SJ。Smad7过表达导致先天性颅面和心血管缺陷。中国生物医学工程学报。2010;36(1):339 - 344。
Wehn AK, Chapman DL。在体细胞和侧板中胚层表达Tbx6的小鼠胚胎中的Tbx18和Tbx15零样表型。中国生物医学工程学报。2010;36(2):339 - 344。
徐k, Nieuwenhuis E, Cohen BL, Wang W, Canty AJ, Danska JS, Coultas L, Rossant J, Wu MY, Piscione TD, Nagy A, Gossler A, Hicks GG, Hui CC, Henkelman RM, Yu LX, Sled JG, Gridley T, Egan SE。Lunatic - fringe介导的Notch信号通路是肺泡形成所必需的。中国生物医学工程杂志,2010;29(1):344 - 344。
Parsa S, Kuremoto K, Seidel K, Tabatabai R, Mackenzie B, Yamaza T, Akiyama K, Branch J, Koh CJ, Al Alam D, Klein OD, Bellusci S. FGFR2b信号通路控制成年小鼠门牙再生能力发展。2010;137(22):3743 - 52。
梁志军,古毅,康德伟,Hudgins-Spivey S,兰志军,徐欣,DeMayo F, Cooney A, Ko C. Cyp17iCre转基因小鼠的生成及其在卵巢和睾丸中有条件删除雌激素受体α (Esr1)的应用。《创世纪》。2008;46(9):499 - 505。
王磊,冯志,王旭,王霞,张旭。一种从RNA-seq数据中识别差异表达基因的R包。生物信息学,2010,26(1):136 - 8。
Young MD, Wakefield MJ, Smyth GK, Oshlack A. RNA-seq的基因本体分析:考虑选择偏差。中国生物医学工程学报。2010;11(2):R14。
后藤凯格:京都基因基因组百科全书。核酸研究,2000;28(1):27-30。
Amirikia H, Savoy-Moore RT, Sundareson AS, Moghissi KS。长期雄激素治疗对卵巢的影响。中国农学杂志。1986;45(2):202-8。
Spinder T, Spijkstra JJ, van den Tweel JG, Burger CW, van Kessel H, Hompes PG, Gooren LJ。在性腺正常的女性到男性变性受试者中,长期服用睾酮对脉动促黄体激素分泌和卵巢组织学的影响。中华内分泌杂志,2001;29(1):1 - 7。
Grynberg M, Fanchin R, Dubost G, Colau JC, Bremont-Weil C, Frydman R, Ayoubi JM。在一个女变男变性人群中长期服用睾酮后生殖道和乳房组织的组织学。中国生物医学杂志。2010;20(4):553-8。
池田K, Baba T, Noguchi H, Nagasawa K, Endo T, Kiya T, Saito T.育龄女变男变性人过度暴露雄激素会引起卵巢皮层和间质增生,但不会引起多囊卵巢形态。生态学报。2013;28(2):453-61。
Loverro G, Resta L, Dellino M, Edoardo DN, Cascarano MA, Loverro M, Mastrolia SA。年轻女变男变性人在服用睾酮期间子宫和卵巢的变化。台湾妇产科杂志。2016;55(5):686-91。
卵巢皮层和髓质中的特异性间质。与卵泡器官和排卵有关的细胞类型和血管供应。妇产科杂志,1971;37(6):832-44。
Moravek MB.变性人的性别肯定激素疗法。中华妇产科杂志,2018;61(4):687-704。
金近敏,张福林,许敏,许敏,张文敏,张文敏。卵巢间质的研究进展。繁殖。2020;160 (3):R25-39。
Kinnear HM, Constance ES, David A, Marsh EE, Padmanabhan V, Shikanov A, Moravek MB.一个研究睾丸激素治疗对变性男性生殖影响的小鼠模型。生态学报。2019;34(10):2009-17。
Bole-Feysot C, Goffin V, Edery M, Binart N, Kelly PA。催乳素(PRL)及其受体:PRL受体敲除小鼠中观察到的作用、信号转导途径和表型。科学通报,1998;19(3):225-68。
尼科尔B,格林SA,查尔梅尔F,勒克卢兹E,潘尼蒂埃M,派侯克斯E,杜邦-德-贝萨特E,桂根Y,卡佩尔B,姚HH。RUNX1通过与FOXL2相互作用来维持胎儿卵巢的身份。地理学报。2019;10(1):5116。
Ederveen EGT, van Hunsel F, Wondergem MJ, van Puijenbroek EP。重度继发性红细胞增多症在女性到男性变性患者,同时使用终身激素治疗:患者的观点。毒品安全案代表2018;5(1):6。
Madsen MC, van Dijk D, Wiepjes CM, Conemans EB, Thijs A, den Heijer M.使用睾酮的跨性别男性大队列中的红细胞增多:一项关于患病率、决定因素和暴露年限的长期随访研究。中国临床内分泌杂志,2016;26(6):457 - 457。
Hembree WC, Cohen-Kettenis PT, Gooren L, Hannema SE, Meyer WJ, Murad MH, Rosenthal SM, Safer JD, Tangpricha V, T ' joen GG.性别焦虑/性别不一致患者的内分泌治疗:内分泌学会临床实践指南。中国临床内分泌杂志,2017;39(11):369 - 369。
科尔曼E, Bockting W, Botzer M, Cohen-Kettenis P, DeCuypere G,费尔德曼J,弗雷泽L,绿色J,努森G, Meyer WJ, Monstrey年代,阿德勒RK,布朗GR Devor啊,Ehrbar R, Ettner R,埃勒镇E, Garofalo R, Karasic DH,列弗AI,梅耶尔G, Meyer-Bahlburg H,大厅BP Pfaefflin F, Rachlin K,罗宾逊B, Schechter LS, Tangpricha V, van Trotsenburg M,维塔莱,冬天的年代,惠特尔年代,威利KR, Zucker K .照顾的健康标准的变性,变性人,和性别错位,version 7。国际性别研究杂志。2012;13(4):165-232。
麦克法兰J,克雷格W,克拉克NJ,斯普拉特DI。接受皮下注射睾酮的患者,血清睾酮浓度保持稳定。中国生物医学工程学报,2017;1(8):1095-103。
Nakamura A, Watanabe M, Sugimoto M, Sako T, Mahmood S, Kaku H, Nasu Y, Ishii K, Nagai A, Kumon H.睾酮替代治疗对女性到男性性别认同障碍患者的剂量反应分析。中国生物医学工程学报,2013;29(3):344 - 344。
Deutsch MB, Bhakri V, Kubicek K.跨性别激素治疗对跨性别女性和男性的影响。妇产科杂志2015;125(3):605-10。
Taub RL, Ellis SA, neil - perry G, Magaret AS, Prager SW, Micks EA.睾酮对跨男性个体排卵功能的影响。中华妇产科杂志。2020;223(2):229.e221-8。
拉基克斯A,戴维斯AM。性别不安/性别不一致者的内分泌治疗。《美国医学协会杂志》上。318(15): 1491 - 2017; 2。
Lapinski J, Covas T, Perkins JM, Russell K, Adkins D, Coffigny MC, Hull S.变性人健康的最佳实践:临床医生指南。Prim Care. 2018;45(4): 687-703。
韦克菲尔德BW, Boguszewski KE,切尼D,泰勒JF。跨学科性别诊所的生育讨论和青年转诊模式。LGBT健康。2019;6(8):417-21。
Johnson EK, Finlayson C.保存性别和性别多样化个体的生育潜力。跨性别健康,2016;1(1):41-4。
儿童和家庭健康社会心理方面委员会,青少年委员会,女同性恋、男同性恋、双性恋和变性人健康与福利部门。确保为跨性别者和性别多样化的儿童和青少年提供全面的照顾和支持。儿科学》2018。https://doi.org/10.1542/peds.2018-2162.
确认
作者要感谢Alessandra Porcu博士在RNAscope实验中的帮助,以及Marco Orecchioni博士在红细胞增多症评估中的帮助。
资金
这项工作得到了NIH拨款P50HD012303的支持,部分授予TH, AD, RJC和SS,由NIH拨款R01CA244182授予SS和DS,由妇产科和生殖科学系支持,加州大学圣地亚哥医学院基金60121B授予SS。JS是生命科学研究基金会的公开慈善奖获得者。
作者信息
作者及隶属关系
贡献
CS、MB对数据采集有贡献。CS、MB、JS、TNHH对数据分析有贡献。CS, MB, JRC和SS对研究的概念和设计做出了贡献。CS、JS、DS、JRC、AJD、CK、TNHH、SS参与了资料的解释和稿件的准备。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。TC17模型中Cyp17表达的强力霉素剂量效应。
qPCR定量Cyp17分别用200 mg/Kg强力霉素处理CTRL小鼠和TC17小鼠卵巢(N=3),用20mg/Kg、100 mg/Kg、200 mg/Kg强力霉素处理TC17小鼠卵巢(7 d,每隔一天i.p.注射一次)mRNA表达。小鼠Cyp17相对于GAPDH管家基因表达的均值+/- s.e.m.。(* * P = 0.01),方差分析。图S2。TC17卵巢表达rtTA/EGFP transactivator。阿Dox治疗后(2周),处死WT和TC17小鼠,灌注PFA,收集卵巢(N=3)。用Cyp17抗体和Draq5免疫染色DNA。WT(上面板)和TC17卵巢(下面板)的代表性共聚焦显微图。图中显示了在TC17小鼠Theca细胞中,Dox处理对Cyp17表达(左,红色)和rtTA/EGFP(中,绿色)的影响。卵泡中的免疫荧光共定位(右侧,黄色)显示暴露Dox后共表达增加。图S3。前50个差异表达基因。通过RNA-seq发现Cyp17上调导致前50个差异诱导或抑制基因的热图。(A)热图显示前50个基因上调Cyp17诱导(按p值排序,p值< 0.05)。(B)热图显示Cyp17诱导后前50个基因下调。图S4。基因本体丰富。受调控的1011个差异表达基因(DEGs)中重要的GO术语(生物学功能)列表Cyp17归纳。图S5。RNAseq数据注释京都基因和基因组百科全书(KEGG)。TC17卵巢和CTRL卵巢中DEGs上调(A)和下调(B)亚群的KEGG富集分析(N=3)。图S6。卵巢标志物的分子分析。图中显示折叠变化意味着+/- s.e.m相对表达量对CTRL后归一化到管家基因为Cyp19(一),Pgr(B),阿(C),Foxl2(D).数据采用双尾未配对t检验分析(*p<0.05)。图S7。TC17小鼠红细胞增多症。用Hemavet 950FS对CTRL和TC17的红细胞(RBC, M/μl)和红细胞压积(HMT, %)进行定量(N=6/7)。RBC和HCT的控制范围(%)分别为6.36 M/μl ~ 9.42 M/μl和35.1% ~ 45.4%,均数+/- s.e.m。数据采用双尾Mann-Whitney检验(**p<0.01, ***p<0.001)进行分析。
12967 _2021_3103_moesm2_esm.xlsx
附加文件2:表S1。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
塞奇,C.,贝利,M.,哈里森,T.N.H.et al。时空特异性膜细胞Cyp17过表达对新型TC17小鼠生殖表型的影响。翻译医学杂志19, 428(2021)。https://doi.org/10.1186/s12967-021-03103-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-021-03103-x
关键字
- CYP17
- 卵泡膜细胞
- 雄性激素过多
- 小鼠模型
- 卵巢
- 变性人
- 生育能力