基因表达分析
我们从癌症基因组图谱(TCGA)数据库下载了BC患者的RNA-seq数据(https://cancergenome.nih.gov/).然后对数据进行过滤和标准化,分析FBXO43在BC肿瘤组织和邻近正常组织中的表达水平。
细胞培养
人BC细胞系MDA-MB-231、MCF7和T-47D来自GeneChem公司(上海,中国)。细胞在DMEM (Corning, 10-013-CVR)和10% FBS (Ausbian, A11-104)中培养,37℃,5% CO2.
抗体
本研究使用的抗体如下:抗fbxo43 (Sigma, HPA024292, 1:20 00),抗gapdh (Santa-Cruz, sc-32233, 1:20 00),抗-β-actin (Santa Cruz, sc-69879, 1:20 00),抗vcp (Abcam, ab109240, 1:10 000),抗cd44 (Abcam, ab51037, 1:10 000),抗pcna (CST, #2586, 1:10 000),抗acly (Abcam, ab40793, 1:10 00),抗hspa5 (Abcam, ab108615, 1:10 00),抗actn4 (Abcam, ab108198, 1:10 00),抗兔IgG (Santa-Cruz, sc-2004, 1:20 00),抗小鼠IgG (Santa-Cruz, sc-2005, 1:20 00),抗兔IgG (CST, #7074)和抗小鼠IgG (CST, #7076, 1:10 000)。
质粒构建和慢病毒转染
shRNA-1 (5 ' -CAAGTTATCAACTTAGAAA-3 ')和shRNA-2 (5 ' -TTAACACATCCTTTAGAAT-3 ')序列被设计为沉默FBXO43,而打乱序列(5 ' -TTCTCCGAACGTGTCACGT-3 ')被用作阴性对照。然后合成具有干扰序列的单链DNA寡核苷酸,引物退火后合成双链DNA。双链DNA的限制性内切酶切割位点直接连接到用限制性内切酶处理的慢病毒载体上。结扎产物转化为合格产物大肠杆菌细胞(TIANGEN, #CB104-03),经定量PCR (qPCR)鉴定并验证阳性重组载体。按照厂家说明书使用EndoFree Midi质粒试剂盒(TIANGEN, #DP118-2)提取并纯化正确序列的慢病毒载体。同样,构建的慢病毒可以上调FBXO43、PCNA、VCP和ACLY的表达水平。
将具有干扰序列的慢病毒质粒转染293T细胞。培养48 h后,收集病毒上清,离心纯化,检测慢病毒质量。然后,荧光标记慢病毒转染MDA-MB-231细胞系。当荧光率超过80%,细胞汇合度达到80%时,收集细胞进行进一步实验。
细胞增殖试验
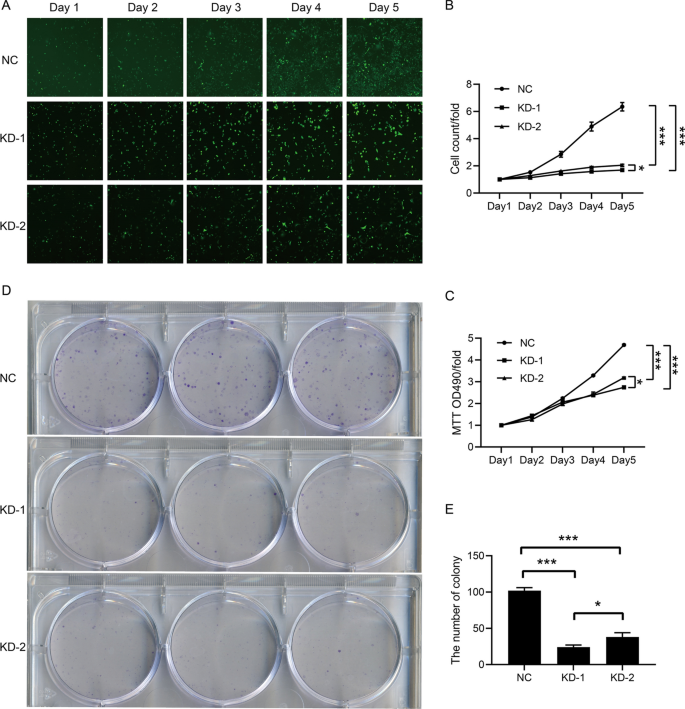
转染的人BC细胞系被播种到96孔板(1500个细胞/孔)并孵育。采用Celigo图像细胞仪(Nexcelom)检测绿色荧光细胞数,连续检测5天。细胞图像用Celigo软件(Nexcelom)进行分析。
MTT试验
用MTT溶液(Genview, JT343)评价细胞活力。简单地说,转染细胞被播种到96孔板(2000个细胞/孔)。将20 ml MTT溶液(5 mg/ml)加入孔中,孵育4小时。然后,取上清液,用100 μl DMSO(石毅股份有限公司,130701)溶解甲醛。采用酶标系统(Tecan Infinite, M2009PR)测定490 nm处的吸光度。
菌落形成试验
转染后的细胞接种于6孔板(500个/孔),培养8天,大多数单克隆的细胞数大于50个。媒体每三天更换一次。细胞用4%多聚甲醛固定(国药控股化学试剂有限公司),甲基紫染色(生工生物,CB0331)。ddH2O被用来清洗细胞。用显微镜(蔡康光学仪器有限公司XDS-100)对细胞菌落进行扫描和定量。
细胞凋亡
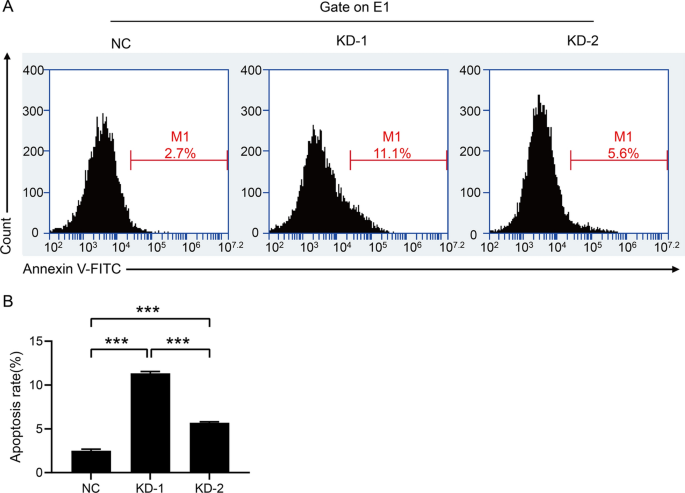
使用FITC-Annexin V细胞凋亡检测试剂盒检测凋亡细胞数量(eBioscience, 88-8007)。简单地说,转染细胞用冷的D-Hanks (pH 7.2-7.4)洗涤,并在1 ×结合缓冲液中重悬。然后加入10 μl Annexin V-APC,孵育10 - 15 min。最后用流式细胞仪(BD, C6 PLUS)检测凋亡细胞数量。
划伤愈合试验
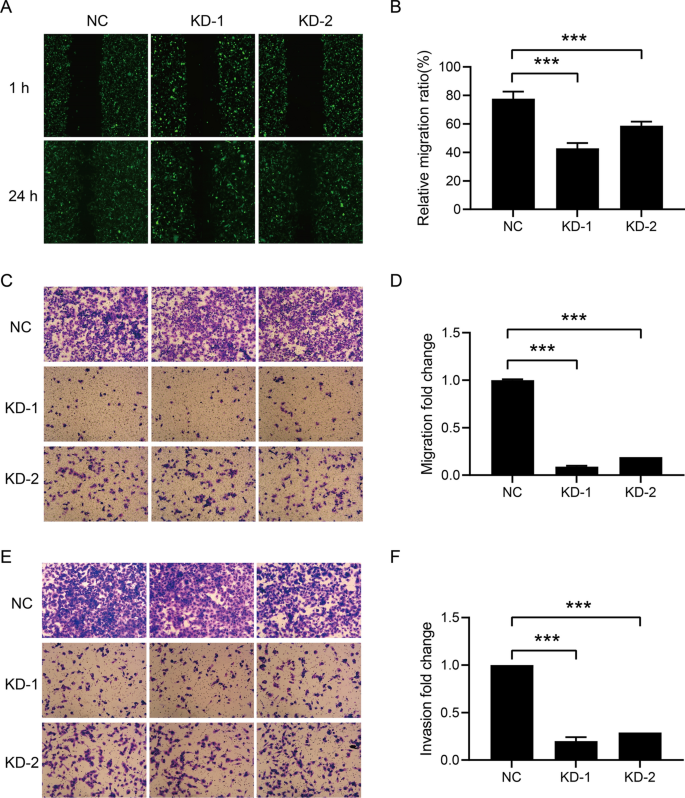
细胞被播种到6孔板中。当细胞密度超过90%时,在盘子上产生划痕,然后用介质清洗盘子。然后,细胞孵育24 h。分别在0 h和24 h用荧光显微镜(Olympus, IX71)拍摄细胞图像,并通过Celigo图像细胞术(Nexcelom)分析细胞迁移面积。
Transwell迁移和侵袭试验
根据制造商说明书,分别使用Transwell迁移试剂盒(康宁,3433)和Transwell侵袭试剂盒(康宁,354480)评估细胞迁移和侵袭能力。感染细胞(1 × 105细胞/腔)被镀入上腔,而下腔则补充30%胎牛血清培养基。孵育24小时后,丢弃培养基,拭子擦拭未迁移的细胞。用4%多聚甲醛固定细胞,结晶紫染色。在显微镜下计数迁移或侵袭细胞的数量(Olympus, IX71)。
实时定量PCR (RT-qPCR)
MDA-MB-231细胞总RNA使用TRIzol试剂(上海普飞生物技术有限公司,#3101-100)获得,并根据制造商的协议使用M-MLV逆转录酶(Promega, M1705)逆转录为cDNA。采用SYBR Master mix (TAKARA, DRR041B)在实时PCR仪(Roche, LightCycler 480 II)上进行qPCR。本研究采用引物序列:FBXO43: 5 ' -CTCCGATAAGTAATCTTGTGGC-3 '(上游)和5 ' - cttgtctttcttatggtgtcc -3 '(下游);PCNA: 5 ' -TGAAGCACCAAACCAGGAG-3 '(上游)和5 ' -GAAGGCATCTTTACTACACAGC-3 '(下游);VCP: 5 ' -TCTGATGATACTTGTTCTGATGAG-3 '(上游)和5 ' -ATGGCTGGATGCTGATGAC-3 '(下游);ACLY: 5 ' -GCGATACCATCTGTGATCTAG-3 '(上游)和5 ' -TTGTGACTTCGTGCTCCTT-3 '(下游);GAPDH: 5 ' - tgacttcaacagcgacacca -3 '(上游)和5 ' -CACCCTGTTGCTGTAGCCAAA-3 '(下游)。相对基因表达量按2−ΔΔCt方法。
Western blot分析
PBS清洗细胞,用2 ×裂解液冷裂解10分钟。使用BCA蛋白测定试剂盒(Beyotime Biotechnology, P0010S)检测细胞裂解液上清液中蛋白质的丰度。然后,蛋白质在10% sds -聚丙烯酰胺凝胶(Tanon Science & Technology Co., Ltd., VE-186)上分离,并转移到聚偏二氟乙烯膜(Millipore, IPVH00010)上。用含5%脱脂牛奶的PBST阻断细胞膜,并用抗体孵育。采用ECL-PLUS/Kit (Thermo, M3121/1859022)检测蛋白条带。定量分析采用ImageJ (https://imagej.nih.gov/ij/).
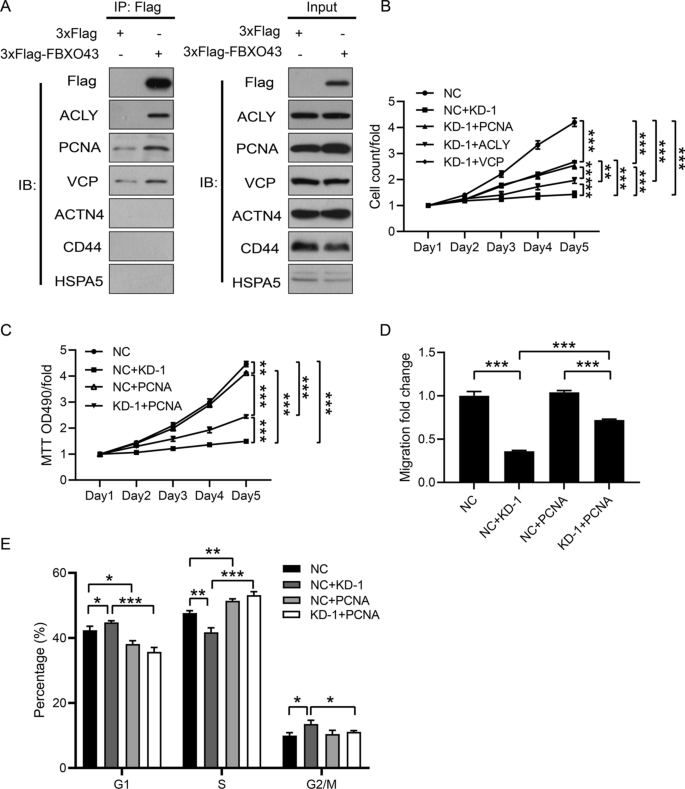
免疫共沉淀(Co-IP)法和质谱法检测相互作用蛋白
构建含3 × Flag-FBXO43的慢病毒,稳定过表达3 × Flag-FBXO43,转染MDA-MB-231细胞。RT-qPCR和western blot检测3 × Flag-FBXO43的表达水平。
用IP缓冲液从转染的MDA-MB-231细胞中提取蛋白(Beyotime Biotechnology, P0013)。细胞裂解液、PBS和Flag珠孵育24小时。将混合物离心后用TBS冲洗,弃去上清。加入3 × Flag肽(Sigma, F4799)和TBS, 4℃孵育40 min。混合物离心浓缩后,加入加载缓冲液。反应产物在10% sds -聚丙烯酰胺凝胶(Tanon Science & Technology Co., Ltd., VE-186)上分离,并用考马斯亮蓝染色。最后进行western blotting。
用3 × Flag拉下的凝胶条被切断,每个凝胶条中的蛋白质被胰蛋白酶(Promega, V5117)消化并切割成多肽。每种肽样品均采用散弹式液相色谱-质谱联用仪进行检测。使用Proteome Discoverer 2.1 (Thermo)和MASCOT 2.5 (Matrix Science)软件对数据库进行查询,得到蛋白鉴定结果。最后,对所鉴定的蛋白质进行生物信息学分析。
动物研究
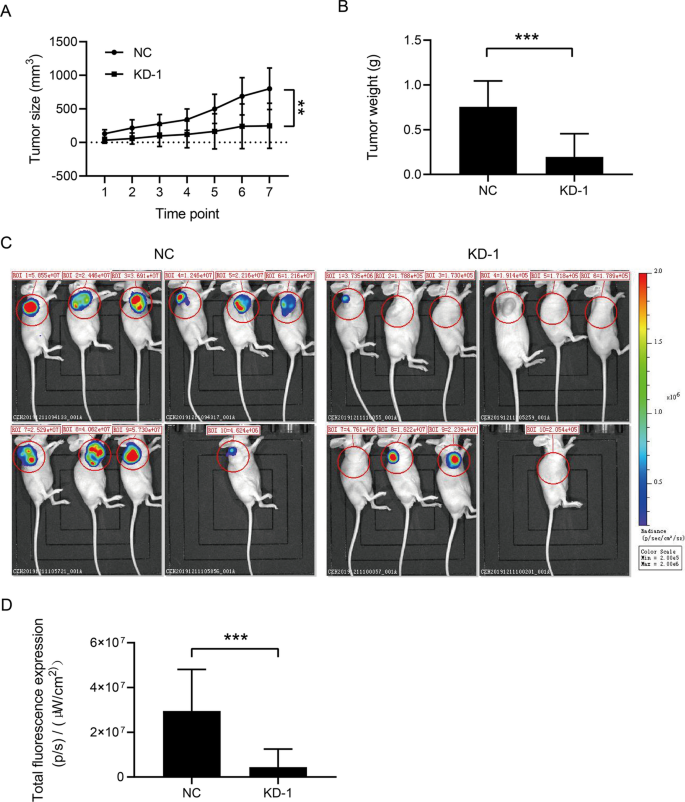
动物实验按照西安交通大学实验动物关爱委员会的指导方针进行。4周龄BALB/c裸鼠从Charles River实验室取,皮下注射1 × 107用含有shRNA-1的慢病毒载体转染MDA-MB-231细胞。当肿瘤长度超过5mm时,肿瘤体积(π/6 ×长×宽2)和小鼠体重,每周检测两次。三周后小鼠被处死。在活体成像中检测牺牲前的总荧光强度。
细胞周期分析
转染MDA-MB-231细胞离心5分钟(1300 rmp/min),丢弃上清液。用预冷的DPBS (pH = 7.2-7.4)清洗细胞,离心5分钟(1300 rmp/min)。用40 × PI溶液(2 mg/ml) (Sigma, P4170)、100 × RNase A (10 mg/ml) (Thermo Fisher Scientific, EN0531)、1 × DPBS和Triton X-100 (Sigma, SLBT4524)(染色液比为25:10:1000:40)对细胞进行染色。采用流式细胞仪检测染色细胞,细胞合格率为300 ~ 800 cell/s。采用ModFit软件(Millipore, Guava easyCyte HT)分析细胞周期。
统计分析
数据分析通过GraphPad Prism 8.3.0 (GraphPad Software, Inc.)、IBM SPSS 22.0 (IBM, Corp.)和R version 3.0.3进行。数据以均数(M)±均数(SEM)的标准误差表示。统计学差异采用t检验或单因素方差分析。与a的区别P-value < 0.05为有统计学意义。