摘要
背景
间质细胞上皮-间充质转化(Epithelial-mesenchymal transition, EMT)是腹膜纤维化(PF)的关键步骤。近年来有证据表明,信号换能器和转录激活因子3 (STAT3)可能介导肾纤维化过程,从而诱导低氧诱导因子1α (HIF-1α)的表达。在此,我们研究了STAT3激活对HIF-1α表达和间皮细胞EMT的影响,并进一步研究了STAT3的药物阻断在腹膜透析(PD)治疗中PF过程中的作用。
方法
首先,我们研究了人腹膜间皮细胞(HPMCs)中的STAT3信号通路。其次,我们探讨了STAT3信号通路激活对高糖诱导的人间皮细胞(Met-5A) EMT和HIF-1α表达的影响。最后通过每日腹腔注射腹膜透析液(PDF)诱导腹膜纤维化,探讨STAT3药物阻断在此过程中的作用。
结果
与新的PD患者相比,长期PD患者的腹膜间皮细胞中磷酸化的STAT3水平上调。高糖(60 mmol/L)诱导Met-5A细胞I型胶原、纤连蛋白、α-SMA的过表达,降低E-cadherin的表达,可通过STAT3抑制剂S3I-201预处理和STAT3的siRNA消除。此外,在间皮细胞中,高糖介导的STAT3激活诱导了HIF-1α的表达,siRNA对HIF-1α缓解了STAT3信号通路的促纤维化作用。每日腹腔注射高糖透析液(HG-PDF)诱导小鼠腹膜纤维化,伴有STAT3磷酸化。免疫染色显示,磷酸化STAT3主要表达于HG-PDF诱导的腹膜α-SMA阳性细胞中。S3I-201可阻止高糖诱导的腹膜纤维化、血管生成、巨噬细胞浸润以及HIF-1α在腹膜中的表达。
结论
综上所述,这些发现确定了长期PD治疗期间STAT3/HIF-1α信号通路与腹膜纤维化之间的新机制。它提供了第一个证据,药物抑制STAT3信号减弱高糖介导的间皮细胞EMT和腹膜纤维化。
简介
腹膜透析(PD)已成为终末期肾病(ESRD)患者的一种完善的治疗方式。其疗效取决于腹膜结构和功能的完整性。获得性腹膜纤维化(PF)是导致PD患者超滤失败并最终中断治疗的主要因素。这种情况被认为是对多种损害的反应,包括持续暴露于生物不相容的透析液(酸性溶液、高葡萄糖、葡萄糖降解产物、低pH值、高渗透压)、尿毒症毒素和腹膜炎[1,2,3.].在这些成分中,高糖被广泛认为是导致腹膜结构和功能改变的关键因素[4].
腹膜纤维化的过程包括间皮细胞的丢失,α-平滑肌肌动蛋白(α-SMA)阳性成纤维细胞异常增殖,间皮下区增厚,胶原蛋白堆积[5,6,7].人腹膜间质细胞(HPMCs)上皮-间质转化(Epithelial-mesenchymal transition, EMT)是腹膜纤维化的关键步骤,严重的腹膜损伤导致腹膜硬化,导致腹膜硬化技术失败,死亡率高。与这些改变并行的是,腹膜经历了典型的功能变化——腹膜小溶质转运率(PSTR)增加,导致超滤受损并最终停止治疗[8].因此,为了维持PD患者的长期治疗和提高生活质量,制定预防和治疗PF的干预措施是很重要的。
信号换能器和转录激活因子3 (STAT3)介导多种细胞功能,包括细胞存活和增殖[9,10].在众多生长因子和细胞因子的响应下,STAT3被酪氨酸705位点的酪氨酸磷酸化通过Janus激酶激活。磷酸化的STAT3形成二聚体,然后转移到细胞核,二聚体直接与DNA序列结合,调节靶基因的表达[11,12,13].近年来,我们报道了白细胞介素-6 (IL-6)在小鼠腹膜纤维化模型中驱动一种依赖于stat3的途径,导致腹膜结构和功能的改变[14].据报道,高糖直接诱导肾小管上皮细胞STAT3磷酸化,而药物抑制STAT3可减弱糖尿病肾病的进展[15].与此同时,也有报道STAT3抑制剂可降低转化生长因子-β1(TGF-β1)的表达,缓解高糖诱导间皮细胞的EMT过程[16].然而,体内STAT3抑制剂对腹膜纤维化进展的影响尚不清楚。
据报道STAT3可诱导多种基因的表达[11,12,13].有报道称,抑制STAT3可抑制高糖诱导肾小管上皮细胞TGF-β1、血管紧张素II生成酶(ACE)或血管紧张素II受体1型(AT1)、血管内皮细胞生长因子(VEGF)的表达[15].此外,有报道称,白细胞介素37 (IL-37)在胰腺癌进展和化疗耐药过程中通过抑制STAT3抑制低氧诱导因子-1α (HIF-1α)的表达[17].众所周知,HIF-1α是细胞对缺氧反应的关键调节因子[18].肾间质慢性缺氧是慢性肾脏病(CKD)进展的特征之一,可导致肾小管细胞EMT或凋亡,激活常驻成纤维细胞[19].森下等人[20.]报道了缺氧通过上调HIF-1α诱导间皮细胞(Met-5A) EMT,而抑制HIF-1α可减弱这一过程。在此背景下,我们推测STAT3激活与HIF-1α表达之间可能存在关联,涉及高糖诱导间皮细胞EMT过程。
因此,在本研究中,我们研究了STAT3激活对高糖诱导间皮细胞HIF-1α表达和EMT的影响,以及在PD治疗中STAT3的药理阻断在PF过程中的作用。
材料与方法
道德声明
该研究方案符合1975年《赫尔辛基宣言》的伦理准则,并得到中山医院伦理委员会的批准。获得每位参与者的书面知情同意。实验方案严格遵守机构指南和《实验动物护理和使用指南》(NIH Publication No. 80-23)中概述的标准,并经复旦大学中山医院批准。
材料
我们获得了针对p-STAT3 (CST, #9145)、STAT3 (CST, #4904)、E-cadherin (Proteintech, #20874)、纤连蛋白(Proteintech, #15613)、HIF-1α (Proteintech, #2096)、GAPDH (Proteintech, #10494)、I型胶原蛋白(Santa Cruz, sc-293182)、α-SMA (Santa Cruz, sc-53142)、CD31 (Santa Cruz, sc-376764)、F4/80 (Santa Cruz, sc-377009)的抗体。S3I-201购自Merck生命科学公司(S1155,上海,中国)。M199培养基和其他细胞培养试剂均取自Gibco BRL。葡萄糖和甘露醇是从Sigma中获得的。
HPMCs分离和细胞培养
在停留时间为7至10小时后,从PD患者中获得PD流出液。样本收集后立即进行处理。所有患者均使用Dianeal Baxter公司的PD溶液。从我们中心PD患者的流出物中获得的hpmc,如其他地方详细描述的那样进行培养和表征[14,21].排除标准为:3个月内有全身炎症性疾病、腹膜炎或积液过多、恶性肿瘤病史、1年内服用大剂量糖皮质激素或免疫抑制剂。在研究开始时收集了以下人口统计学特征:年龄、性别、ESRD的潜在原因、PD持续时间。
人间皮细胞系(Met-5A: CRL-9444)从ATCC (Manassas, VA, USA)获得,并在含有5.5 mM的M199培养基中培养d-葡萄糖添加10% FCS (Gibco)和1%青霉素/链霉素溶液(Gibco),无菌条件下的5% CO237°C。治疗前,间皮细胞在60mm板中培养过夜。在高糖处理组,细胞用含有60 mM葡萄糖的M199培养基培养。间皮细胞与我们先前研究中描述的相同浓度的甘露醇培养基孵育[22].间皮细胞的确切治疗方法在相应的图例中有描述。
腹膜纤维化小鼠模型的建立及S3I-201给药
雄性C57BL/6J小鼠(8 ~ 10周龄)在复旦大学中山医院实验动物中心无特定病原体条件下饲养。将动物分为3组(n = 5):假手术组、高糖腹膜透析液(HG-PDF)加或不加S3I-201诱导腹膜纤维化组。与之前的研究相同[23,24],每日腹腔注射含4.25%葡萄糖的PDF 100 mL/kg诱导腹膜纤维化。假手术组小鼠注射等量0.9%生理盐水。为了探索STAT3抑制对腹膜纤维化的影响,根据以往的研究,S3I-201以10mg /kg /只小鼠每天腹腔注射[25,26].28天后,对小鼠实施安乐死,取离注射点较远的腹膜壁层作进一步分析。腹膜用4%多聚甲醛固定进行病理分析,或用液氮速冻进行基因和蛋白表达分析。
逆转录和实时定量PCR
根据制造商的说明,使用TRIZOL (Invitrogen, Carlsbad, CA)从细胞和组织中分离总RNA。使用PrimeScript RT Master Mix kit (Takara)将总RNA反转录为cDNA。实时PCR反应采用SYBR Premix Ex Taq II (Tli RNaseH Plus, Takara)进行,并使用7500实时PCR系统(Thermo Fisher Scientific)进行分析。所有引物均购自生工生物科技(中国上海)。使用ΔΔCt方法计算mRNA的相对变化,并标准化为管家基因GAPDH。
小鼠基因及引物:
MCP-1,向前,5'-TTTTTGTCACCAAGCTCAAGAG-3',
相反,5‘-TTCTGATCTCATTTGGTTCCGA-3’。
摘要意思β,向前,5'-TCGCAGCAGCACATCAACAAGAG-3',
相反,5‘-AGGTCCACGGGAAAGACACAGG-3’。
Col1a1,向前,5-TAAGGGTCCCCAATGGTGAGA-3'。
相反,5‘-GGGTCCCTCGACTCCTACAT-3’。
Acta2,向前,5'-CCCAGACATCAGGGAGTAATGG-3'。
相反,5‘-TCTATCGGATACTTCAGCGTCA-3’。
Hif1a,向前,5'- GATGAGTTCTGAACGTCGAAAAG-3'。
反向,5'- CACTGTCTAGACCACCGGC-3'。
Tgfb1,向前,5'- CTCCCGTGGCTTCTAGTGC-3'。
反向,5- GCCTTAGTTTGGACAGGATCTG-3'。
免疫印迹分析
利用RIPA缓冲液从组织或培养细胞中提取总蛋白(Beyotime, Shanghai, China)。使用Pierce BCA蛋白检测试剂盒(赛默飞世尔)测定蛋白质浓度。将蛋白质(20-50 μg)煮沸,sds -聚丙烯酰胺凝胶电泳分离,转移到PVDF膜上(Bio-Rad)。用5%牛血清白蛋白(TBS)与0.1% Tween 20 (Sigma Aldrich)在室温下阻断膜1小时,并与一抗在4℃下孵育过夜。使用增强化学发光检测系统(Tanon Science & Technology Co., Ltd)和Image J 1.43软件(National Institute of Health, Bethesda, MD)对所获得的条带进行可视化和分析。数据根据GAPDH进行归一化。
腹膜组织学分析
腹膜用4%多聚甲醛固定,石蜡包埋,5µm厚切片制备。为了评估腹膜纤维化,根据制造商(Sigma-Aldrich)提供的方案进行三色马松染色。
石蜡包埋切片(5µm厚)脱蜡并复水化。98°C在pH为6的10 mM柠檬酸缓冲液中回收抗原10 min,用磷酸盐缓冲盐水(PBS)洗涤15 min,然后用含5%牛血清白蛋白的阻塞缓冲液处理切片,室温30 min, 4°C与一抗孵育过夜。使用以下抗体:胶原蛋白I (Santa Cruz, sc-293182, 1:100), CD31 (Santa Cruz, sc-376764, 1:100), F4/80 (Santa Cruz, sc-377009, 1:200)。PBS冲洗3次后,加入二抗,苏木精反染,200倍放大6个视野,分析DAB阳性。用Image J(美国国立卫生研究院)测量阳性面积。
免疫荧光
制备脱蜡和再水化的石蜡包埋切片(5µm厚),在98℃(pH为6)的10 mM柠檬酸缓冲液中提取抗原10分钟,用PBS洗涤15分钟,用含有5%马血清的封闭缓冲液在室温下处理30分钟,然后在4℃与一抗孵育过夜。二级标记抗体:Alexa Fluor®488 (Abcam, ab150077)或Alexa Fluor®594 (Abcam, ab150116)与腹膜切片在室温下孵育1小时。用5%马血清代替一抗进行免疫荧光染色阴性对照。图像分析采用计算机数字图像分析(analysis, Soft Imaging System)。
HPMCs和Met-5A细胞以10的密度接种4细胞/孔,用不同的刺激方法孵育,如图所示。然后用4%多聚甲醛固定细胞,与一抗孵育。使用以下抗体:p-STAT3 (CST, #9145, 1:1000), E-cadherin (Proteintech, #20874, 1:1000),纤连蛋白(Proteintech, #15613, 1:1000), I型胶原蛋白(Santa Cruz, sc-293182, 1:100), α-SMA (Santa Cruz, sc-53142, 1:200)。将载玻片分别用Alexa Fluor®488或Alexa Fluor®594培养1小时。用DAPI (Life Technology)标记细胞核,然后用荧光显微镜检查载玻片。
间皮细胞的转染研究
利用siRNA特异性靶序列实现基因表达的沉默。所有siRNA特异性靶序列均来自中国上海汉生物科技有限公司。
人siRNA序列如下:
STAT3: sense, 5'- cucauuagcagaaucucatt 3',
反义,5'- UGAGAUUCUGCUAAUGACGtt-3'。
HIF-1α: 5' -GCCGAGGAAGAACUAUGAATT-3',
反义5“-UUCAUAGUUCUUCCUCGGCTT-3”。
控制:sense, 5'-UUCUCCGAACGUGUCACGUTT-3',
反义5“-ACGUGACACGUUCGGAGAATT-3”。
根据制造商说明书,使用Lipofectamine 2000 (Invitrogen, CA, USA)对Met-5A细胞瞬时转染100 nM靶序列或阴性对照(NC) siRNA。转染后用高糖处理细胞进行后续实验。
统计分析
数值数据以均数±标准误差(SE)表示,并使用SPSS 12.0软件生成(芝加哥,伊利诺伊州)。在本文中,每个实验一般用不同的细胞重复5-6次,随机选取其中3个进行统计分析。我们一般采用方差分析比较多组间的差异。为比较两组间的差异,异常分布数据采用Kruskal-Wallis检验,正态分布数据采用t检验。差异被认为是显著的P< 0.05。
结果
在排出的PD废水中离体间皮细胞STAT3的激活
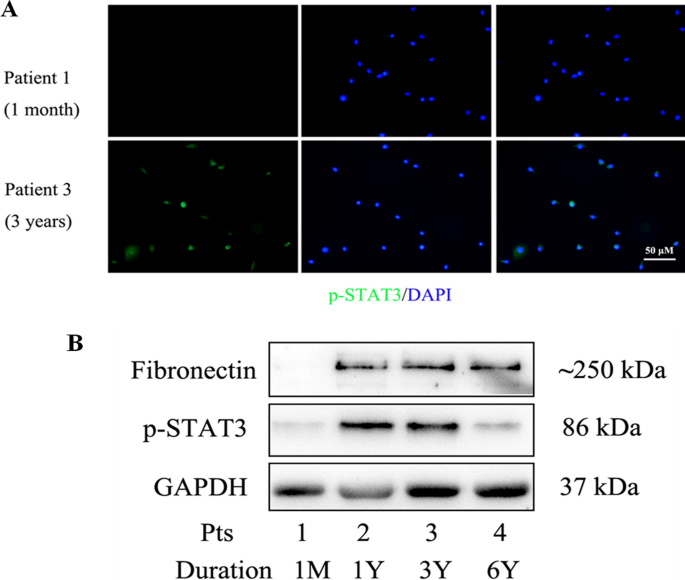
我们收集了不同治疗时间的患者的PD排出物。患者临床总结见附档1:表S1。我们首先用免疫荧光法研究了p-STAT3在排泄后的人间皮细胞中的表达。与1号患者(PD持续1个月)相比,3号患者(PD持续3年)p-STAT3表达显著增加。数字1A).我们进一步使用western blot分析PD出水细胞裂解物。如图所示。1B,长期患者的Fibronectin和p-STAT3水平显著上调(No. 2,3,4),但在新患者中没有明显上调(No. 1)。综上所述,这些结果表明长期治疗PD患者的间皮细胞中STAT3通路被激活。
高糖对间皮细胞STAT3激活的影响
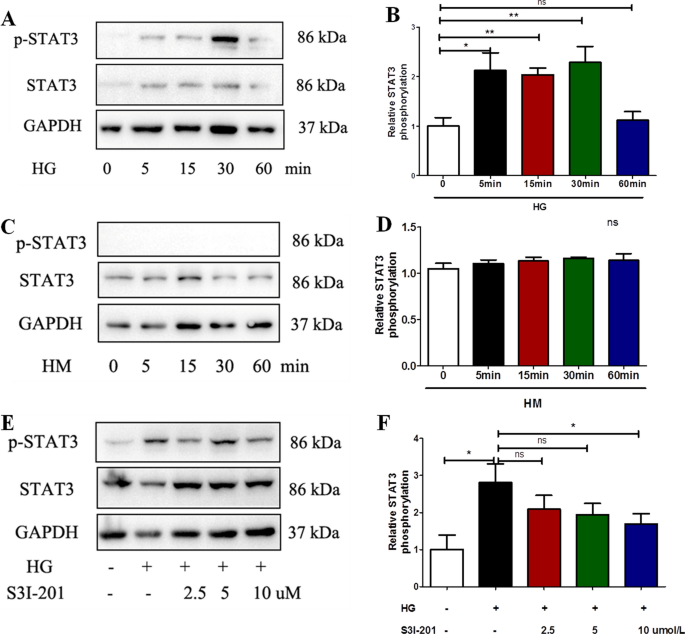
然后,我们利用western blot分析探讨了高糖对间皮细胞中STAT3激活(Met-5A)的影响。结果表明,高糖(60 mmol/L)诱导Met-5A细胞在孵育5 min后STAT3磷酸化,30min时达到峰值,60min后消失(P与基线相比,5、15、30 min < 0.05。2A、B);而甘露醇(60 mmol/L)在同等时间孵育后对STAT3磷酸化无显著影响(图。2c - d)。在10 μM浓度下,STAT3抑制剂S3I-201(预处理1 h)消除了高糖(60 mmol/L,孵卵30 min)诱导的STAT3磷酸化,而不影响Met-5A细胞中STAT3的总表达(P< 0.05,图;2E、F)。
高糖激活Met-5A细胞中的STAT3通路。细胞用高糖(60 mmol/L,一个)或高甘露醇(60 mmol/L,C)进行不同时间(0、5、15、30、60分钟)的试验。Western blot检测p-STAT3和STAT3蛋白表达。p-STAT3与总STAT3的相对比值用三个实验的平均值±SE表示(B).D,EMet-5A细胞与高糖(60 mmol/L)或与不同浓度的STAT3特异性抑制剂S3I-201(2.5、5、10 μM,预处理1 h)联合孵育30 min, p-STAT3与总STAT3的相对比值为三个实验的平均值±SE (E).P数值由t检验确定。* p < 0.05;**P< 0.01;ns。不重要
STAT3抑制剂S3I-201对高糖诱导间皮细胞EMT及HIF-1α水平的影响
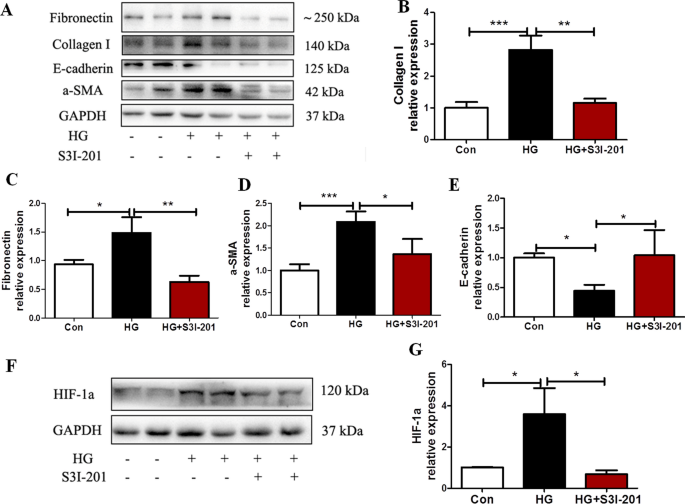
细胞在60 mmol/L高糖环境下培养48 h,加入或不加入S3I-201 (10 μM,预处理1 h)。我们通过免疫荧光检测上皮-上皮粘附蛋白标记物E-cadherin、间充质标记物α-SMA以及纤维化标记物纤连蛋白和I型胶原蛋白的亚细胞位置和表达(附加文件)2:图S1)或western blot分析(图S1)。3.).高糖处理Met-5A细胞可增加α-SMA、纤连蛋白和I型胶原的表达,但显著降低E-cadherin的表达。S3I-201预处理后效果减弱P与HG相比< 0.05。3.a e)。此外,高糖显著增加Met-5A细胞中HIF-1α的表达(P与对照组相比< 0.05),S3I-201预处理也可以逆转(P与HG相比< 0.05。3.F, G)。
STAT3 siRNA对高糖诱导间皮细胞EMT及HIF-1α水平的影响
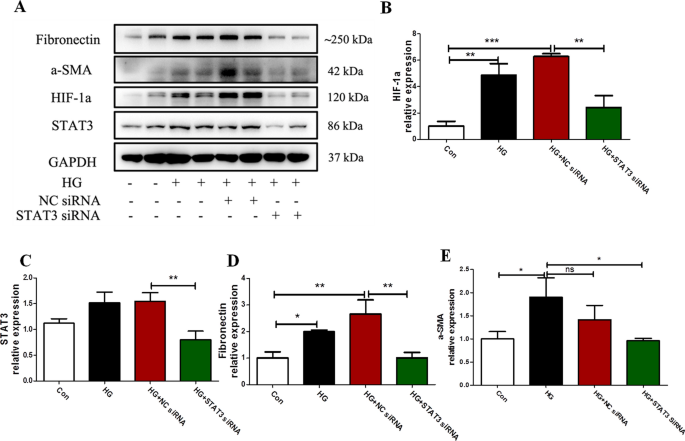
我们分析了高糖对HIF-1α表达的影响,以及转染siRNA对抗STAT3后间皮细胞的EMT过程(图2)。4).免疫印迹分析显示,高糖诱导的间皮细胞HIF-1α、纤维连接蛋白、α-SMA蛋白水平均显著升高P与对照组比较< 0.05;4),转染STAT3的siRNA后明显减弱P与HG或HG + NC siRNA相比< 0.05,图4).
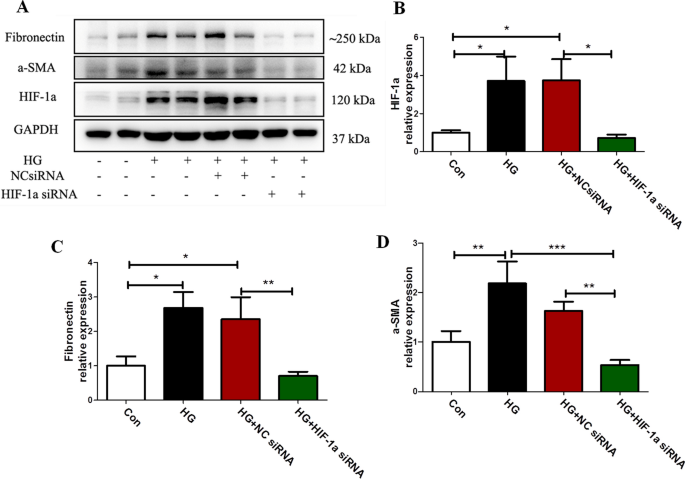
HIF-1α siRNA对高糖诱导间皮细胞EMT过程的影响
我们进一步分析了HIF-1α siRNA对高糖诱导间皮细胞EMT过程的影响(图。5).免疫印迹分析显示,高糖诱导的间皮细胞中纤连蛋白、α-SMA蛋白水平显著升高(均p < 0.05,与对照组比较)。5),转染siRNA后HIF-1α显著减弱(所有P与HG + NC siRNA相比< 0.05;5).
小鼠PF模型中STAT3通路的激活
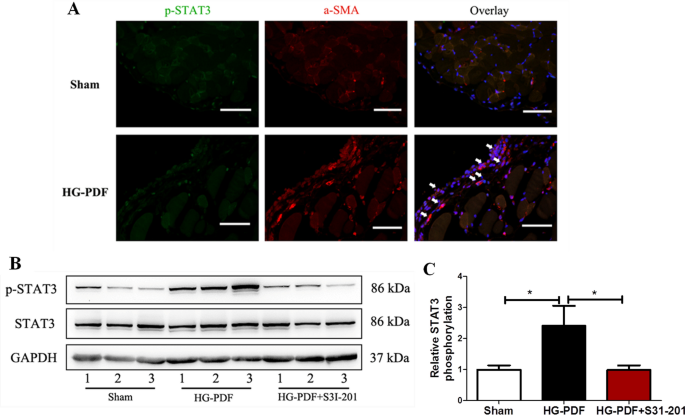
为了检测STAT3在小鼠PF模型中的激活,我们在每日注射HG-PDF(4.25%葡萄糖透析液,Dianeal Baxter) 28天后,通过免疫染色和免疫印迹分析检测p-STAT3在腹膜中的表达和位置。免疫染色显示p-STAT3主要表达于我们前期研究的α-SMA阳性腹膜细胞中[14(图。6A).免疫印迹分析显示,小鼠PF模型腹膜中STAT3磷酸化,而同时给药S3I-201(10 mg/kg/天)抑制了这一变化(P与HG-PDF组比较< 0.05。6B, C)。
小鼠PF模型中STAT3通路的激活。在4.25% HG-PDF注射后28天收集小鼠腹膜,同时或不给药S31-201 (10 mg/kg/day)。一个显微照片显示腹膜中含有p-STAT3(绿色)和α-SMA(红色)。白色箭头显示p-STAT3(绿色)和α-SMA(红色)在腹膜中的共存位置。DAPI 4”6-diamidino-2-phenylindole。原始放大,×200。B,C对腹膜裂解液进行免疫印迹分析,使用针对p-STAT3、STAT3或GAPDH的特异性抗体;给出了三个样品的代表性结果。p-STAT3与总STAT3的相对比值以3次实验的平均值±SE表示。P数值由t检验确定。*P< 0.05。比例尺,50 μm
STAT3抑制剂S3I-201在小鼠PF模型中的体内效应
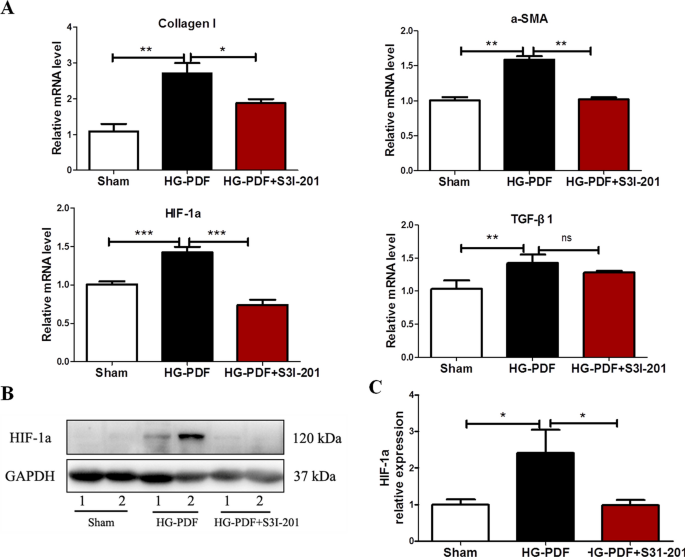
接下来,我们利用实时荧光定量PCR检测小鼠PF模型腹膜中I型胶原蛋白、α-SMA、TGF-β1和HIF-1α的mRNA水平。在HG-PDF诱导的腹膜中,I型胶原蛋白、α-SMA和HIF-1α mRNA均显著上调,而S3I-201(10 mg/kg/day)诱导后明显降低(P与HG-PDF组比较< 0.05。7A). TGF-β1 mRNA在小鼠PF模型中也有升高,但S3I-201处理后没有变化(图2)。7A).免疫印迹分析显示,HIF-1α在HG-PDF诱导的腹膜中表达明显增加,而同时给药S3I-201明显抑制了这一变化(与HG-PDF组比较p < 0.05,图。7B, C)。
体内STAT3抑制剂S3I-201对腹膜纤维化发展的影响
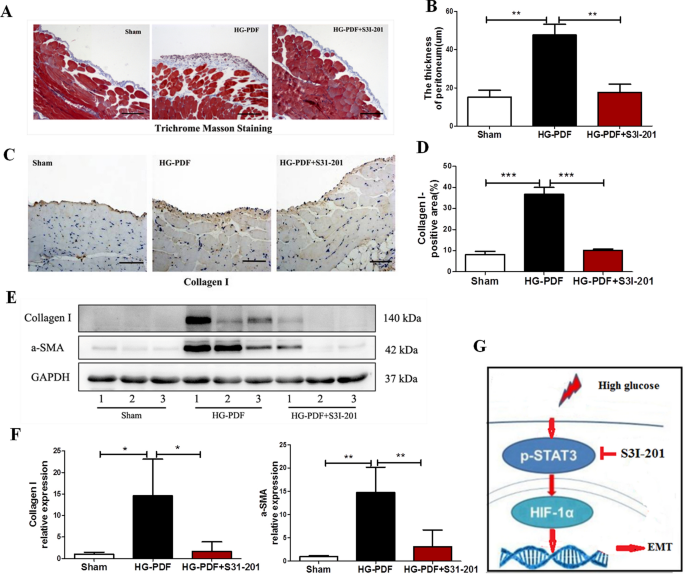
我们进一步研究了STAT3抑制剂S3I-201对HG-PDF诱导的小鼠腹膜纤维化的影响。每日注射HG-PDF 28天诱导腹膜增厚和胶原原纤维沉积,三色马尾松染色证实(图2)。8A, B)或免疫染色(图。8C, D)。然而,S3I-201的应用减弱了这些变化。S3I-201还能有效抑制HG-PDF诱导的腹膜I型胶原和α-SMA的表达(P与HG-PDF组比较< 0.05。8E、F)。
STAT3磷酸化阻断对腹膜纤维化发展的影响。在注射4.25% HG-PDF后28天收集小鼠腹膜,同时或不给药S3I-201 (10 mg/kg/day)。一个显微照片显示腹膜马氏三色染色。原始放大,×200。B该图显示了从三个小鼠腹膜样本的十个随机场测量的致密区厚度(原始放大倍率,×200)。C显微照片显示了间皮下致密区I型胶原的免疫组化染色DI型胶原蛋白相对阳性面积的定量数据(每组n = 3)。原始放大,×200。E,F用I型胶原蛋白、α-SMA或GAPDH特异性抗体对腹膜裂解物进行免疫印迹分析;给出了三个样品的代表性结果。数据以三次实验的平均值±SE表示。P数值由t检验确定。*P< 0.05;**P< 0.01;***P< 0.001。GSTAT3/HIF-1α在腹膜纤维化中的作用以及STAT3抑制剂S3I-201的作用示意图比例尺,50 μm
炎性细胞因子/趋化因子表达增加,间皮下增厚区巨噬细胞浸润被认为是纤维化腹膜的典型病理改变。为了确定STAT3抑制剂对HG-PDF损伤后这些反应的影响,我们通过免疫组化检测了巨噬细胞浸润标志物F4/80的表达。HG-PDF损伤后小鼠腹膜间皮下层巨噬细胞浸润显著增加,但S3I-201治疗显著阻断(附加文件)3.:图S2A, B)。接下来,我们进一步利用实时荧光定量PCR技术检测腹腔内单核细胞趋化蛋白-1 (MCP-1)和白细胞介素-1β (IL-1β)等炎症因子的水平。在hg - pdf诱导的腹膜中,MCP-1和IL-1β mRNA均显著上调,而S3I-201后则显著下调(P与HG-PDF组比较< 0.053.:图S2C)。此外,与假手术组相比,注射HG-PDF后腹膜内CD31 +血管数量明显增加。S3I-201显著抑制HG-PDF诱导的腹膜血管增加(附加文件)3.:图S2D, E)。
综上所述,我们的数据支持HG-PDF促进STAT3通路激活和HIF-1α表达。此外,STAT3/HIF-1α信号的表达可能是间皮细胞EMT过程的基础,从而引起腹膜纤维化,而STAT3阻断可能是长期PD患者PF的有效治疗方法(图。8G)。
讨论
本研究表明,在HG-PDF诱导的小鼠PF模型和hg刺激的间皮细胞以及排泄PDF中丢弃的HPMCs中,STAT3信号通路被激活。STAT3激活后HIF-1α水平上调。我们证实HG/STAT3/HIF-1α信号通路可能在高糖透析液诱导腹膜纤维化的发病机制中发挥重要作用。STAT3抑制剂S3I-201可降低HIF-1α的表达,防止间皮细胞EMT,最终缓解PF的发展,本研究首次证明药物抑制STAT3可通过HG/STAT3/HIF-1α信号通路防止腹膜纤维化,提示STAT3抑制剂可能是长期治疗PD患者PF的有效治疗策略。
成功的PD治疗很大程度上取决于腹膜的保存。然而,长期的PD治疗伴有腹膜结构和功能的晚期改变[27].目前,导致PF的机制尚不清楚,对这种并发症也没有有效的治疗干预。我们的数据表明,STAT3在长期PD患者排出的PDF排出的HPMCs中被激活。此外,我们发现HG诱导STAT3的磷酸化以及α-SMA、I型胶原蛋白和纤连蛋白的表达,但降低了人间皮细胞中E-cadherin的表达,即EMT过程。而STAT3抑制剂抑制了高糖诱导的间皮细胞前纤维化活性和腹膜胶原组织积累。迄今为止,STAT3信号在腹膜纤维化中的激活仅在一些研究中报道过[14,28,29],高糖诱导间皮细胞STAT3信号通路的激活仅在一项研究中报道过[16],但STAT3抑制剂在腹膜纤维化发病机制中的作用及其可能参与的分子仍不完全清楚。我们的研究支持STAT3信号通路似乎是间皮细胞调节纤维化前活性的一种机制,有助于PF的整体进展,HIF-1α可能是STAT3信号通路激活的纤维化前作用的关键分子(图2)。8G)。
缺氧促进了不同类型细胞的EMT,如恶性细胞和肾小管细胞[30.,31].森下等人[20.]的研究报道,缺氧通过激活HIF-1α诱导间皮细胞EMT,这可能有助于PD患者腹膜纤维化。作为重要补充,我们的研究表明HIF-1α在HG诱导的间皮细胞中的表达主要依赖于STAT3信号的激活,而下调HIF-1α可以缓解高糖诱导的间皮细胞EMT。我们还观察到,小鼠PF模型腹膜中STAT3激活和HIF-1α表达升高。鉴于TGF-β1已被报道为PF过程的重要贡献者,在我们的研究中,纤维化腹膜中TGF-β1的表达也增加,但STAT3抑制剂无法降低其表达水平。我们的研究结果提示,HG/STAT3/HIF-1α信号通路可能是帕金森病长期治疗中PF机制的重要补充,STAT3抑制剂可能是一种新的PF治疗策略。
在长期PD治疗过程中,越来越多的证据支持腹膜是慢性炎症器官。腹腔内炎症在PF发病机制中起着至关重要的作用[14].在我们的研究中,巨噬细胞在损伤后聚集在间皮下区,STAT3的阻断抑制了巨噬细胞的浸润,减弱了小鼠腹膜纤维化。MCP-1、IL-1β等炎症因子也在hg - pdf诱导的腹膜中上调,我们的研究中S3I-201也减弱了这种上调。在长期腹膜透析患者中观察到腹膜血管密度与腹膜纤维化的相关性[3.].为了支持这一观点,我们证明了hg - pdf处理的小鼠增厚间皮下区的血管增加,而S3I-201的管理显著降低了血管密度。因此,STAT3通路激活还可能参与血管生成和炎症细胞浸润,并发挥促纤维化功能,从而在腹膜结构和功能改变中发挥广泛作用。
到目前为止,还没有确定的治疗腹膜结构改变的方法。为了预防腹膜纤维化所涉及的一些主要病理过程,如成纤维细胞活化、炎症和血管生成,已研究了许多治疗干预措施[32,33].我们的研究表明,HG/STAT3/HIF-1α信号通路可能参与了所有这些过程,使用STAT3抑制剂治疗可以部分减弱腹膜纤维化、血管生成和炎症的进展。
我们的研究有一些局限性。我们使用腹腔注射而不是腹腔导管灌注高糖透析液来诱导小鼠腹膜纤维化,尽管多项研究表明直接腹腔注射可以诱导小鼠腹膜纤维化,并类似于长期接受PD治疗的患者的腹膜结构改变[29,34,35].其次,我们使用了永生的人胸膜间皮细胞(Met-5A)而不是原代人腹膜间皮细胞,尽管一些研究表明Met-5A细胞在表型和功能上类似于正常的人腹膜间皮细胞[22,36,37].最近的一项综述表明,从Met-5A细胞中获得的数据与从原代腹膜间皮细胞中获得的数据有很大的一致性[37].最后,由于我们的研究纳入的患者数量较多,需要进一步研究足够数量的PD患者,以确认STAT3磷酸化与PD病程之间的关系。
综上所述,我们的研究结果对STAT3信号通路通过上调HIF-1α的表达介导间皮细胞EMT的作用提供了初步和重要的认识。s3i -201可有效减弱高糖诱导的间皮细胞EMT,最终缓解腹膜纤维化的进展。因此,靶向STAT3/ HIF-1α信号通路可能是在PD长期治疗期间保持腹膜完整性的有效方法。
数据和材料的可用性
在这项研究中产生或分析的所有数据都包含在这篇发表的文章(及其附加文件)中。
缩写
- EMT:
-
Epithelial-mesenchymal过渡
- PF:
-
腹膜纤维化
- STAT3:
-
信号换能器和转录激活子3
- HIF-1α:
-
缺氧诱导因子-1α
- 帕金森病:
-
腹膜透析
- PDF格式:
-
腹膜透析液
- HG-PDF:
-
高糖透析液
- 迹象:
-
终末期肾病
- αsma:
-
α平滑肌肌动蛋白
- hpmc:
-
人腹膜间皮细胞
- PSTR:
-
腹膜小溶质转运率
- il - 6:
-
白细胞介素- 6
- 转化生长因子-β1:
-
转化生长因子-β1
- 王牌:
-
血管紧张素II生成酶
- AT1:
-
血管紧张素II受体1型
- VEGF:
-
血管内皮细胞生长因子
- IL-37:
-
Interleukin-37
- CKD:
-
慢性肾病
- PBS:
-
磷酸盐
- NC:
-
消极的控制
- SE:
-
标准错误
- MCP-1:
-
单核细胞趋化蛋白-1
- il - 1β:
-
Interleukin-1β
参考文献
戴维斯SJ,布莱恩J,菲利普斯L,罗素GI。腹膜动力学的纵向变化:腹膜透析和腹膜炎的影响。《肾移植杂志》1996;11(3):498-506。
戴维斯SJ,菲利普斯L,奈什PF,罗素GI。腹膜透析时腹膜葡萄糖暴露及膜溶质转运随时间的变化。中国生物医学杂志,2001;12(5):1046-51。
Williams JD, Craig KJ, Topley N, Von Ruhland C, Fallon M, Newman GR,等。肾脏疾病患者腹膜的形态学改变。中国生物医学杂志,2002;13(2):470-9。
车明,史涛,冯松,李华,张旭,冯宁,等。microRNA-199a/214簇靶向E-cadherin和Claudin-2并促进高糖诱导的腹膜纤维化。中国生物医学杂志,2017;28(8):2459-71。
金子,滨田C,富野杨。腹膜纤维化的干预。Perit Dial Int. 2007;27(增刊2):S82-86。
Selgas R, Bajo A, Jimenez-Heffernan JA, Sanchez-Tomero JA, Del Peso G, Aguilera A,等。间皮细胞的上皮细胞到间质细胞的转变——它在腹膜透析反应中的作用。《肾移植杂志》2006;21(增刊2):ii2-7。
腹膜纤维化的机制及干预措施。临床临床经验。2012;16(1):109-14。
戴维斯SJ。腹膜透析患者溶质转运与超滤能力的纵向关系。肾内科杂志2004;66(6):2437-45。
斯特普科夫斯基SM,陈伟,罗斯JA,纳吉ZS,科肯RA。STAT3:多种细胞因子功能的重要调节因子。移植。2008;85(10):1372 - 7。
张志强,张志强,张志强,等。STAT蛋白在肿瘤药物研究中的应用。致癌基因。2000;19(56):6613 - 26所示。
Horvath)厘米。STAT蛋白和细胞外信号的转录反应。生物化学,2000;25(10):496-502。
张震。纤维蛋白原基因表达的转录控制机制。中国科学(d辑),2001;
绪方,陈能,吉田,金次郎,高泽秀,白石,等。肝脏中SOCS3的缺失通过增强stat3介导的TGF-beta1的产生来促进纤维化。致癌基因。2006;25(17):2520 - 30。
杨旭,闫慧,姜宁,于智,袁杰,倪震,等。IL-6转信号驱动stat3依赖通路,导致腹膜的结构改变。中国生物医学工程杂志。2020;18(2):F338-53。
郑超,黄磊,罗伟,于伟,胡霞,管霞,等。抑制小管上皮细胞中的STAT3可防止stz诱导的糖尿病小鼠肾纤维化和肾病。细胞死亡,2019;10(11):1-4。
张萍,戴红,彭玲。STAT3信号通路参与高糖诱导的人腹膜间质细胞HMrSV5上皮间质转化。肾血压计res 2019;44(2): 179-87。
赵涛,金峰,肖东,王华,黄超,王旭,等。IL-37/ STAT3/ HIF-1α负反馈信号驱动胰腺癌吉西他滨耐药开展。2020;10(9):4088 - 100。
Gunaratnam L, Bonventre JV。HIF在肾脏疾病中的作用及其发展。生态学报。2009;20(9):1877-87。
Mimura I, Nangaku M.窒息性肾:终末期肾病的小管间质性缺氧。自然科学进展。2010;6(11):667-78。
Morishita Y, Ookawara S, Hirahara I, Muto S, Nagata D. HIF-1α介导缺氧诱导的腹膜间质细胞上皮-间质转化。Ren Fail. 2015;38(2): 282-9。
Diaz C, Selgas R, Castro MA, Bajo MA, Fernandez de Castro M, Molina S,等。直接从腹膜流出物获得间皮细胞的体外增殖:其与腹膜前因和功能参数的关系。Adv Perit Dial. 1998; 14:19-24。
杨霞,林安,姜宁,闫慧,倪震,钱杰,等。白细胞介素6反式信号部分通过Janus激酶- stat3途径在人间皮细胞中诱导血管内皮生长因子的合成。肾脏学。2017;22(2):150 - 8。
王杰,蒋志平,苏楠,范建军,阮艳萍,彭文祥,等。腹腔交替激活巨噬细胞在腹膜透析相关腹膜纤维化过程中的作用。中华分子生物学杂志,2013;14(5):10369-82。
Kihm LP, Müller-Krebs S, Holoch S, Schmuck S, Becker LE, Brownlee M,等。乙醛酶1敲除小鼠腹膜损伤增加腹膜透析治疗。中国生物医学工程杂志,2015;30(3):401-9。
陈勇,苏林kaew S, Naud P,齐晓勇,Gillis M-A,史永飞,等。JAK-STAT信号通路与促进心房颤动的纤维底物。中国生物医学工程学报,2017;29(3):344 - 344。
庞敏,马琳,龚瑞,Tolbert E,毛海,Ponnusamy M,等。一种新型STAT3抑制剂S3I-201在阻塞性肾病中减弱肾间质成纤维细胞激活和间质纤维化。肾内科杂志2010;78(3):257-68。
Krediet RT, Struijk DG。长期腹膜透析患者的腹膜变化。自然科学进展。2013;9(7):419-29。
戴涛,王勇,王永杰,李志强,等。Janus激酶信号激活介导体外和体内对透析液的腹膜炎症和损伤。肾内科杂志2014;86(6):1187-96。
王玲,刘楠,熊超,徐玲,石勇,邱安,等。抑制EGF受体可阻断腹膜纤维化的发生和发展。中国生物医学杂志,2016;27(9):2631-44。
杨敏敏,吴明哲,邱世胜,陈培敏,张淑云,刘佳杰,等。HIF-1alpha直接调控TWIST促进转移。中国生物医学工程学报。2008;10(3):295-305。
罗磊,罗刚,方强,孙卓。人肾近端小管上皮细胞缺氧诱导因子-1的稳定表达促进上皮细胞向间充质细胞转变。交通学报,2014;46(1):130-4。
Bargman JM。腹膜透析研究进展综述。科学通报。2012;25(5):545-9。
Farhat K, Stavenuiter AW, Beelen RH, Ter Wee PM。药理学靶点与腹膜重塑。中国科学(d辑)。2014;34(1):114-23。
陈奕婷,张奕婷,潘思生,周永华,张洪峰,叶碧,等。谱系追踪揭示了腹膜损伤时间皮细胞和间皮下成纤维细胞的不同命运。中国生物医学杂志,2014;25(12):2847-58。
张晓文,王磊,丁海龙非编码RNA AK089579通过DOK2竞争性结合microRNA-296-3p抑制腹膜间皮细胞上皮向间质转化法医学杂志,2019;33(4):5112-25。
Kinashi H, Ito Y, Mizuno M, Suzuki Y, Terabayashi T, Nagura F,等。TGF-beta1在腹膜纤维化期间促进淋巴管生成。中国生物医学杂志,2013;24(10):1627-42。
容硕,李富芳,陈天明。腹膜间皮细胞培养与生物学。中国机械工程学报。2006;26(2):162-73。
确认
我们感谢中国上海中山医院肾内科的所有医生的工作。
资金
本研究得到国家自然科学基金项目(No. 82000726)的资助。国家重点研发计划(No. 2016YFC1305500),上海市重点临床医学中心和重点学科建设计划(No. 2017ZZ01015)。复旦大学中山医院青年基金(No. 2020ZSQN48)。
作者信息
作者及隶属关系
贡献
杨晓晓设计实验并撰写手稿。杨晓晓负责大部分实验和数据分析。方毅参与了数据分析。包曼晨帮助进行动物实验。于晓芳和纪军协助分析组织学和组织病理学,并解释数据。丁晓强设计并指导了所有实验,并编辑了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
动物操作和所有实验程序均按照适用的法规和指南进行,并得到《实验动物护理和使用指南》(NIH出版物第80-23号)的批准,并得到复旦大学中山医院的批准。该研究方案符合1975年《赫尔辛基宣言》的伦理准则,并得到中山医院伦理委员会的批准。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
帕金森病患者的临床特点。
附加文件2:图S1。
高糖诱导间皮细胞EMT。(A)通过免疫荧光分析检测间皮细胞中E-cadherin、α-SMA、纤连蛋白和I型胶原的亚细胞定位;(B)相对荧光强度的定量数据(每组n = 3)。用Alex Fluor检测e -钙粘蛋白和纤连蛋白@488偶联二抗(绿色),α-SMA和I型胶原蛋白使用Alex Fluor@594偶联二抗(红色)。原始放大,×200。*P< 0.05;***P< 0.001。
附加文件3:图S2。
STAT3磷酸化阻断对腹膜炎症和血管生成的影响。在注射4.25% HG-PDF后28天收集小鼠腹膜,同时或不给药S3I-201 (10 mg/kg/day)。(A)显微照片显示间皮下致密区F4/80免疫组化染色,(B)相对F4/80阳性区域的定量数据(每组n = 3)。原始放大,×200。(C)利用实时荧光定量PCR检测腹膜裂解液中MCP-1和IL-1β mRNA的水平。结果显示为平均值±SE (n = 4)。(D)显微照片显示间皮下致密区CD31免疫组化染色,(E)相对CD31阳性区域的定量数据(每组n = 3)。结果显示为均数±标准差。原始放大,×200。P数值由t检验确定。**P< 0.01;***P< 0.001。比例尺,50 μm。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
杨,X,鲍,M,方,Y。et al。STAT3/HIF-1α信号通路激活介导高糖诱导的腹膜纤维化。翻译医学杂志19, 283(2021)。https://doi.org/10.1186/s12967-021-02946-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-021-02946-8
关键字
- 腹膜透析
- 腹膜纤维化
- STAT3
- HIF-1α
- Epithelial-mesenchymal过渡