摘要
无脂肪细胞衍生物作为治疗多种人类疾病的潜在药物,近年来受到广泛关注。在此背景下,间充质基质/干细胞(MSCs)、脂肪细胞间充质干细胞(Ad-MSCs)和脂肪源性干细胞(ADSC)具有强大的免疫调节活性,被提出作为治疗2019冠状病毒病(COVID-19)的一种治疗方案。COVID-19是由严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)引起的全球公共卫生关注,实际上没有任何特定的治疗方法。MSCs通过分泌内源性因子,如血管内皮生长因子(VEGF)、胰岛素生长因子(IGF)、神经生长因子(NGF)、转化生长因子(TGF)-β和生长分化因子(GDF)-11等,发挥免疫调节作用。最近的报道为ADSCs和Ad-MSCs在COVID-19患者中的进一步研究和临床应用提供了希望。实验和临床研究正在探索间充质干细胞和衍生外泌体在减缓COVID-19发病率和死亡率方面的治疗潜力。在这一领域,需要进行更多的临床前和临床研究,以寻找COVID-19感染患者的有效治疗方法。
背景
自2020年2月世界卫生组织(世卫组织)宣布SARS-CoV-2感染为2019年大流行冠状病毒疾病(COVID-19)以来,该疾病已在200多个国家广泛传播,并以简单的呼吸道飞沫人际传播的形式成为全球公共卫生关注的焦点。2020年11月24日,从中国武汉到世界各地,报告了超过59,730,774例冠状病毒病例,1,405,753例死亡,41,322,917例康复https://www.worldometersinfo.coronavirus.
部分重症COVID-19患者出现严重炎症和多器官功能障碍,与“细胞因子风暴综合征”(CSS)一致。新型冠状病毒感染症(COVID-19)诱导宿主过度免疫反应,并伴随细胞因子风暴,最终导致急性呼吸窘迫综合征(ARDS)和急性肺损伤,进而导致多器官衰竭和死亡。重症或危重型新冠肺炎患者出现广泛的肺部炎症、肺水肿和轻度肺纤维化、肺实变,远高于SARS感染[1].目前还没有抗病毒的有效疗法。
病毒潜伏期为2至14天[2,3.].甚至有些患者可能无症状,脆弱的人受严重影响并发展为严重的ARDS,死亡率很高[4,5].与血液学和生化血液参数相关的肺部x线图像或计算机断层扫描显示患者对感染的反应,以及针对器官稳态的病毒复制的进展,并导致细胞因子风暴。有证据表明,涉及单核/巨噬细胞和T淋巴细胞的宿主对冠状病毒- sars -2的免疫反应出现了严重失调[6,7,8].
2019-nCoV (SARS-CoV -2)的序列几乎相同,与SARS-CoV的序列相同度为79.6%。这两种病毒共享相似的细胞进入受体血管紧张素转换酶II [4].ACE2是肾素-血管紧张素系统(RAS)的关键调节剂,RAS是参与血管功能调节的信号通路。ACE2的主要底物是Ang II,在c端裂解时产生血管紧张素1-7 (Ang1-7) [9].ACE2存在于包括肾脏、心脏、肺和胃肠道系统在内的许多组织的细胞表面,因此可以解释与COVID-19相关的特定症状。S蛋白表面亚基S1上的受体结合域负责病毒与ACE2的附着。结合后,S蛋白被跨膜丝氨酸蛋白酶TMPRSS2: S蛋白引物在S1/2和S2’区域裂解,从而促进病毒膜与宿主细胞膜的融合,病毒直接进入细胞质。SARS-CoV-2使用SARS-CoV受体ACE2进入,丝氨酸蛋白酶TMPRSS2启动S蛋白。目前的工作重点是阻断病毒的进化。ACE2/COVID-19通路早前被认为是一种有前景的治疗靶点。此外,蛋白酶TMPRSS2参与细胞进入,有选择地建议在临床使用TMPRSS2抑制剂,从而阻止病毒进入[10].在这个问题上使用了一种抗病毒药物甲磺酸卡莫司他,其中根据favipiravir和remdesivir分别对流感病毒和埃博拉病毒的治疗作用,建议使用favipiravir [11].目前,更多的免疫治疗策略正在研究中,包括靶向IL-6受体的单克隆抗体托珠单抗[12]、IL-1β阻断(anakinra)及Janus激酶抑制[6].然而,人们越来越关注间充质干细胞(MSCs)和脂肪源性干细胞(ADSCs)在新冠肺炎病例中的有益治疗作用,因此出现了不同的临床试验研究。基于adscs的细胞治疗产品在不同炎症相关疾病和ARDS的自体和异体目的中均表现出最佳疗效和效率[13,14,15,16].此外,来自间充质干细胞,特别是ADSCs的外泌体作为多种人类疾病的潜在治疗药物,特别是免疫调节策略,最近受到了人们的关注。
COVID-19感染与免疫表现
Sars-Cov2和ACE2的相互作用是COVID-19症状发生的主要关键。然而,病毒感染更可能是由IFN损伤引起的异常免疫反应引起的,从而导致了疾病的发病机制[17].Chen等报道SARS-CoV的核衣壳(N)蛋白抑制维甲酸诱导基因I (RIG-I)通路诱导的IFN-β的产生,作为参与RNA病毒鉴定的关键面板识别受体(PRR) [18].这导致病毒逃避宿主的先天免疫反应,吞噬,促炎细胞因子释放,高效复制,从而传播病毒感染。中性粒细胞计数、d -二聚体、丙氨酸转氨酶、总胆红素、乳酸脱氢酶、铁蛋白和降钙素原升高、凝血酶原时间延长、淋巴细胞数和白蛋白减少与重症相关[6,8].此外,严重的淋巴细胞减少症伴T细胞过度活化,调节性T细胞计数减少伴间质浸润单核细胞和巨噬细胞多有报道[19,20.,21].此外,促炎细胞因子如IL-6、IL-1β、IL-8和TNF-α的释放导致内皮细胞和上皮性肺损伤[8,22,23].CD8+ T细胞和CD4+表达IFN-γ的淋巴细胞减少[24].
严重者发生细胞因子风暴,IFN-γ、诱导蛋白10 (IP10)、单核细胞趋化蛋白-1 (MCP-1)、粒细胞集落刺激因子(G-CSF)、肿瘤坏死因子-α (TNF-α)和IL-1β水平显著升高[8,23,25].细胞因子和趋化因子分泌的增加也导致疾病的加重。在ards相关的肺损伤中,出现全身性炎症,肺部浸润,中性粒细胞和巨噬细胞聚集到肺泡间隙。IFN-β的缺失和IFN-α的低生成和活性与高病毒感染和炎症反应有关[26].据报道,在COVID-19发病的患者中,有中和相应I型ifn阻断SARS-CoV-2感染能力的自身抗体[27].IFN表型的这种损伤似乎是由于TLR3-和干扰素调节因子7 (IRF7)依赖的I型IFN免疫的先天性错误导致的,这与危及生命的COVID-19肺炎有关[26,28].此外,IL-6/IFN-γ的比率与疾病的严重程度有关[29]期望ADSCs通过调节含有炎症因子IL-6、IL-1β和TNF-α的外泌体分泌,在免疫应答中发挥关键作用。
根据在细胞因子释放综合征(CRS)发展过程中宿主免疫反应的失调作为Covid - 19疾病进化的病理基石,抑制IL - 6可能是Covid - 19患者治疗的新靶点。最近的研究结果支持控制新的临床研究的要求,以澄清免疫调节的作用,精确地通过IL - 6抑制,在治愈Covid - 19中[22].Sarilumab, Siltuximab, Tocilizumab是人单克隆抗体,通过结合和阻断IL-6受体抑制IL-6通路。它们可能是治疗COVID-19患者的一种新的治疗策略,但目前还需要进一步的大型试验数据来确定IL-6拮抗剂是否能在COVID-19患者中提供临床益处[30.].一些药理学方法,包括糖皮质激素,吸入一氧化氮,抗氧化剂和蛋白酶抑制剂,已被发现是无效的。目前,还没有一种针对SARS-CoV-2感染的特异性治疗方法在随机对照试验中证明有效,因此,测试新的治疗方法似乎迫在眉睫。
脂肪来源干细胞(ADSCs)及其外泌体的治疗用途
ADSC是一种丰富的间充质干细胞,具有强大的再生和免疫调节活性,被认为是治疗COVID-19的一种治疗选择。已知ADSCs增殖和分化为各种细胞以修复受损或死亡的细胞,但也通过自分泌和旁分泌途径激活细胞再生和愈合过程[14,31].由于其主要组织相容性复合体I (MHC I)分子的低表达和缺少MHC II和共刺激分子的表达,它们具有数量丰富、容易获得的优势,特别是免疫原性较低。
ADSCs具有由转化生长因子-β (TGF- β)、生长发育因子-11 (GDF-11)、肝细胞生长因子(HGF)、神经生长因子(NGF)、胰岛素生长因子(IGF)、白细胞介素-1 (IL-1)、IL-6、toll样受体(TLR)-2、TLR-4、干扰素-γ (INF-γ)和外泌体内共同分泌的一组mirna介导的免疫调节特性[13,14].ADSCs在来源、类型和使用方式方面面临着许多治疗挑战,最近的不同研究为其在组织修复中的成功应用铺平了道路。ADSCs在自体和异体环境下的许多临床研究中被使用,特别是用于治疗炎症性疾病或疾病相关炎症,这得益于其再生和保护能力,因此在COVID-19病例中成为一个真正的问题[13,32].研究表明,ADSCs可能比骨髓间充质干细胞(BM)或脐带间充质干细胞(UC)更具有免疫抑制作用。它们能够通过它们的细胞网络和外泌体分泌调节免疫反应,从而驱动它们周围的微环境来防止炎症、细胞凋亡和衰老[14,33].
脂肪组织和外周血单个核细胞(pmcs)内抗炎控制机制的失败与疾病进展有关。更重要的是,ADSCs可以区分M1和M2巨噬细胞,并诱导其极化为抗炎表型M2 [34].ADSCs通过分泌IL-10、TGF-β使T细胞失活,损害B淋巴细胞功能[35].T-reg细胞数量在COVID-19患者中受到影响,这在一定程度上解释了在重症COVID-19患者中观察到的严重炎症和肺损伤。然而,T-reg的增加使其成为设计COVID-19治疗方案的合适候选人,特别是重症病例。增强体内T-reg细胞数量或使用T-reg细胞衍生分子的疗法将有益于COVID-19重症患者。细胞毒性t淋巴细胞相关蛋白4 (CTLA-4)通过与抗原提呈细胞上的CD80/86相互作用,在t -reg细胞介导的抑制中发挥关键作用[36].
间充质干细胞因其抗炎作用等多种功能而引起人们的关注,并引发了许多研究。在小鼠模型中,经尾静脉输注后,这些细胞已被证明直接迁移到肺部,并部分迁移到肝脏,这一特性将有助于设计这些细胞产物的给药途径[37].既往研究已证实其对急性呼吸窘迫综合征(ARDS)及大肠杆菌内毒素诱导的急性肺损伤有良好的治疗作用[15,38,39].表1总结了使用不同来源的间充质干细胞和/或其外泌体治疗COVID-19患者的总体临床试验。
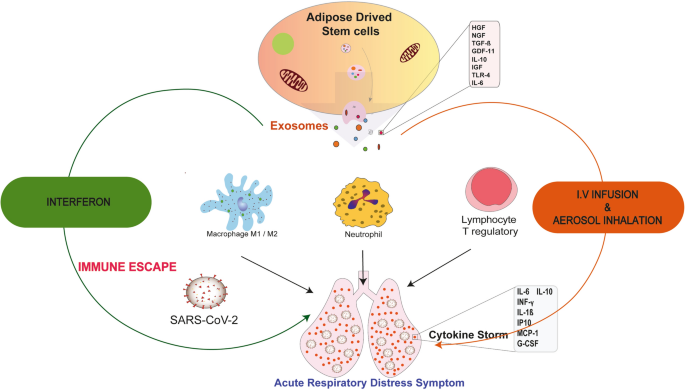
有趣的是,间充质干细胞不会被冠状病毒感染[40].全身给药2 × 106MSCs/kg导致多种肺部和全身炎症标志物、上皮细胞凋亡、肺泡毛细血管液体渗漏和促炎细胞因子的减少,而T细胞反应的抑制和T细胞、单核细胞和中性粒细胞调节表型的诱导已经证明,当标准临床措施失败时,这些细胞对ARDS的抗炎诱导(图)。1) [39].此外,静脉输注在不同的临床试验中被证明更有效。为了寻找可能影响新试验设计的潜在因素,对给药途径的数据进行了评估[41].
此外,ADSCs衍生的外泌体参与了许多生物学功能,如正常和病理生理过程中的细胞增殖、免疫调节和细胞间通信[42,43].它们已被证明具有促进细胞增殖、迁移、血管生成、限制细胞凋亡、减轻炎症和氧化应激以及参与免疫调节的功效[44,45,46,47].与间充质干细胞相反,外泌体具有迁移到目标器官的优势,而不是被肺捕获,因此可以通过气溶胶吸入应用批准作为一种治疗工具[48,49].来自ADSCs的外泌体已被证明在免疫应答中有效,通过增加T细胞调节剂导致抗炎IL-4和IL-10水平的增加,与促炎细胞因子IL-17和IFN水平的降低相关。这种免疫调节作用有利于调节自身免疫性糖尿病1型和特应性皮炎患者的t细胞炎症反应[50,51].这些外泌体具有激活M2巨噬细胞极化从而减少炎症的能力[52].此外,据报道外泌体可增加中性粒细胞数量和活力,同时减少嗜酸性粒细胞和浸润肥大细胞,这表明外泌体在感染和免疫缺陷疾病中具有潜在的益处[53].另一方面,外泌体含有一组微rna (miR),包括miR-21、miR-23a和miR-124,它们被认为具有免疫抑制和抗炎作用[54].这些发现为确保来自ADSCs和BM-MSCs的安全高效外泌体作为免疫调节研究药物输送系统的生物利用度的几种方法铺平了道路[55,56].
目前,许多临床试验都是使用ADSCs进行的。7项研究注册了来自骨髓间充质干细胞,17项使用UC-MSCs,包括5项尚未招募试验,7项招募试验和2项活跃的未招募试验(表2)1).10个使用自体和异体ADSCs的临床试验注册,其中4个尚未招募,3个正在招募,3个正在招募。这些试验主要在美国、中国和西班牙进行,旨在治疗患者的安全性和有效性,并提供对COVID-19的保护https://clinicaltrials.gov/ct2/results?cond=COVID,19&term=Mesenchymal%20Stem%20Cells&cntry=&state=&city=&dist=。由BM、UC和脂肪组织制造的生物间充质干细胞有不同的制备方法,如NestaCell、Astrostem、Prime Pro、Descartes 30等。已注册的试验大多为I期、II期或I/II期,很少有II/III期进行MSCS静脉注射,剂量为1 × 106细胞/kg至3 × 106cell /Kg或5 × 107到8 × 108总细胞是治疗包括COVID-19在内的不同病因相关ARDS的潜在疗法。然而,2个临床试验主张使用3-4 × 107间充质干细胞治疗新冠肺炎相关ARDS [57].在静脉注射临床级ace2间充质干细胞后,COVID-19患者的肺功能活性在2天后出现了有趣的改善,同时血清促炎细胞因子TNF-α的比例显著降低。
继使用骨髓间充质干细胞注射的研究之后,由于其免疫和再生作用,ADSCs和脂肪源性间充质干细胞(AD-MSCs)在COVID-19中的潜在应用受到了更多的关注。自体和异体ADSCs已在免疫介导的炎症性疾病的多项人体临床试验中证明了其安全性和有效性,并在心血管、肺部、代谢、神经和免疫疾病中得到证实[14,58,59].实际上,即使正在计划使用ADSCs或衍生产品进行临床试验,临床结果仍未报告。在一项随机、安慰剂对照的初步研究中,对ARDS患者进行了异基因ADSCs全身给药,以检查可能的不良事件,从而证实其安全性[60].
最近的报道对ADSCs和mscs来源的外泌体用于治疗COVID-19患者的进一步研究和临床应用充满希望和鼓舞。一些临床试验已经注册,并在其制剂的安全性和有效性的支持下为它们的亲本细胞铺平了道路[58,61,62].此外,使用这些细胞外囊泡治疗多种疾病的结果越来越有前景,这在很大程度上得到了描述[42,63,64].事实上,在治疗严重COVID-19肺炎的不同试验(NCT04602442, NCT04491240, ChiCTR2000030261)中,基于一项试点研究(NCT04276987)的有希望结果开展了方案调查(https://covid - 19. cochrane.org/?q=k(液)pn = 1),旨在提高他们吸入外泌体后的安全性和治疗效果。一项前瞻性非随机开放标签队列研究中使用的BM-MSCs衍生外泌体ExoFlo®在改善肺炎参数、下调细胞因子风暴和重建COVID-19患者的免疫方面也表现出安全[65].
在临床研究ChiCTR2000030484中,以5 × 10的剂量静脉注射UC-MSCs及其外泌体治疗COVID-19肺炎期间的肺部疾病7细胞(4次)和180 mg/次(14次)。经静脉注射纯化的XoGlo®外泌体用于因肺炎导致呼吸衰竭需要有创机械通气或需要血管升压药物治疗的COVID-19重症患者(ISRCTN33578935)。Zofin(有机细胞流)是从人羊水中提取的,平均浓度为5.24 × 1011在COVID-19感染SARS患者中检测颗粒/mL。本I/II期随机、双盲、安慰剂试验旨在评估静脉输注佐芬(NCT04384445)的安全性和潜在疗效。土屋等人计划在中国进行一项研究,以调查2.0 × 10的气溶胶吸入的影响8纳米囊泡(5次)治疗新型冠状病毒肺炎重症患者[66].T细胞在治疗COVID-19患者早期肺炎方面也引起了人们的关注,一项临床研究(NCT04389385)使用来自异基因COVID-19 T细胞的外泌体,并通过气溶胶吸入给药。另一方面,一项临床试点研究使用异体adscs来源的外泌体治疗新型冠状病毒重症患者吸入性肺炎(NCT04276987)。
结论
为了探索MSCs、ADSCs和外泌体在减缓COVID-19发病率和死亡率以及治疗相关ARDS方面的治疗潜力,我们使用各种细胞因子和d -二聚体代表的炎症生物标志物来确定结果和COVID-19患者的恢复情况。如果说ADSCs临床应用的局限性已经被广泛讨论,那么使用外泌体会引发一些不可忽视的问题。国际细胞外囊泡学会(ISEV)最近在2018年提出了标准化外泌体培养、纯化和储存方案的必要性[67].此外,外泌体货物仍然与其亲本细胞的功能状态密切相关,我们可以预期激活的、未成熟的和提交的细胞在其分泌轮廓中显示出可变性,这可以通过其分泌外泌体的组成来确认[23,64,68].此外,年轻mscs衍生的外泌体在减轻脂多糖诱导的急性肺损伤方面优于年老的外泌体[69],可能是由于生长分化因子11 (GDF11)在不同器官中的再生潜力和组织修复而被广泛认可[33,70,71,72,73].这些因素可能导致外泌体治疗效果的变异性,建议使用额外的定量和定性标记物来预测所使用的外泌体在COVID-19中的治疗效果。ISEV和国际细胞和基因治疗学会已经声明需要具体的指导方针和操作程序的标准化,以解决高效外泌体的生产,满足良好生产规范标准[67,74,75].因此,我们最近还报告说,在COVID-19的背景下,改进基于细胞的疗法正变得具有挑战性,无法完全达到效率和患者安全[76].最后,在创纪录的时间内管理好所有这些限制因素,仍然是阻止这一大流行病的世界性挑战。
数据和材料的可用性
不适用。
参考文献
刘珊,智勇,应生。COVID-19与哮喘:大流行期间的反思。临床进展过敏免疫。2020。https://doi.org/10.1007/s12016-020-08797-3.
Lauer SA, Grantz KH, Bi Q, Jones FK, Zheng Q, Meredith HR,等。2019冠状病毒病(COVID-19)公开报告确诊病例的潜伏期:估计和应用中华医学杂志(英文版);
关文杰,梁文华,赵颖,梁红蓉,陈志生,李永明,等。中国1590例COVID-19患者的共病及其影响:全国分析中国生物医学工程学报,2010;29(5):379 - 379。
周鹏,杨晓林,王晓刚,胡波,张磊,张伟,等。与一种可能来自蝙蝠的新型冠状病毒有关的肺炎爆发。大自然。2020;579(7798):270 - 3。
王东,胡斌,胡超,朱峰,刘霞,张杰,等。武汉市138例2019年新型冠状病毒感染的肺炎住院患者临床特征分析《美国医学协会杂志》上。2020年,323(11):1061 - 9。
梅塔P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ,等。COVID-19:考虑细胞因子风暴综合征和免疫抑制。柳叶刀》。2020;395(10229):1033 - 4。
查纳帕纳瓦R,帕尔曼。致病性人类冠状病毒感染:细胞因子风暴和免疫病理学的原因和后果。中国免疫杂志,2017;39(5):529-39。
周峰,于涛,杜锐,范刚,刘勇,刘震,等。中国武汉成人COVID-19住院患者的临床病程和死亡危险因素:一项回顾性队列研究柳叶刀》。2020;395(10229):1054 - 62。
Oudot A, Vergely C, ecarno - laubriet A, Rochette L.血管紧张素-(1-7)的药理学浓度通过AT1受体刺激大鼠心脏缺血再灌注后激活NADPH氧化酶。中华人民共和国学报。2005;29(3):344 - 344。
Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S,等。SARS-CoV-2细胞进入依赖于ACE2和TMPRSS2,并被临床证明的蛋白酶抑制剂阻断。细胞。2020;181 (2):271 - 80. - e8。
Kupferschmidt K, Cohen J.新型病毒会大流行还是被控制?科学。2020;367(6478):610 - 1。
徐旭,韩敏,李涛,孙伟,王东,付波,等。托珠单抗有效治疗重症COVID-19患者美国国家科学研究院。117(20): 10970 - 2020; 5。
马兹尼,罗切特,曼敏,马尔卡。脂肪来源干细胞(ADSCs)的再生能力,与间充质干细胞(MSCs)的比较。国际分子生物学杂志,2019;20(10):2523。https://doi.org/10.3390/ijms20102523.
马兹尼,罗彻特,阿梅,马凯。脂肪源性干细胞(adscs)和间充质干细胞(mscs)在伤口愈合中的作用。中华分子化学杂志,2020;21(4):1306。https://doi.org/10.3390/ijms21041306.
Laffey JG, Matthay MA。五十年的ARDS研究。急性呼吸窘迫综合征的细胞疗法。生物学和潜在的治疗价值。中国呼吸危重症杂志,2017;29(3):366 - 366。
马马泰,Calfee CS,卓华,Thompson BT, Wilson JG, Levitt JE,等。异基因间充质基质细胞治疗中重度急性呼吸窘迫综合征(START研究):一项随机2a期安全性试验中华呼吸医学杂志2019;7(2):154-62。
Broggi A, Ghosh S, Sposito B, Spreafico R, Balzarini F, Lo Cascio A,等。III型干扰素在病毒识别时破坏肺上皮屏障。科学。2020;369(6504):706 - 12所示。
陈凯,肖峰,胡东,葛伟,田敏,王伟,等。SARS-CoV-2核衣壳蛋白与RIG-I相互作用并抑制rig介导的IFN-β的产生。病毒。2020;13(1):47。https://doi.org/10.3390/v13010047.
秦超,周琳,胡震,张松,杨松,陶勇,等。中国武汉2019冠状病毒(COVID-19)患者免疫反应失调。中国生物医学工程学报(自然科学版);
徐震,石磊,王勇,张杰,黄磊,张超,等。COVID-19与急性呼吸窘迫综合征相关的病理结果《呼吸医学杂志》2020;8(4):420-2。
姚晓华,李泰天,何志春,平永飞,刘宏伟,余顺生,等。3例新冠肺炎病例微创解剖病理报告中华医学杂志。2020;49(5):411-7。
Coomes EA, Haghbayan H.白介素-6在Covid-19中的应用:系统综述和荟萃分析。中国生物医学杂志。2020;30(6):1-9。
王震,杨波,李强,文玲,张荣。武汉市69例新型冠状病毒感染的临床特征分析。中国临床感染杂志2020;71(15):769-77。
裴德生,何永昌。SARS-CoV-2:风暴正在肆虐。中华临床医学杂志,2020;30(5):528 - 528。
黄超,王勇,李霞,任玲,赵娟,胡勇,等。武汉地区新型冠状病毒感染患者临床特征分析柳叶刀》。2020;395(10223):497 - 506。
李志强,李志强,李志强,等。重症COVID-19患者I型干扰素活性受损和炎症反应。科学。2020;369(6504):718 - 24。
Bastard P, Rosen LB, Zhang Q, Michailidis E, Hoffmann H-H, Zhang Y,等。威胁生命的COVID-19患者的I型干扰素自身抗体。科学》2020。https://doi.org/10.1126/science.abd4585.
张强,王德P,刘震,勒庞J, Moncada-Velez M,陈杰,等。危及生命的COVID-19患者的I型IFN免疫先天错误。科学》2020。https://doi.org/10.1126/science.abd4570.
Lagunas-Rangel FA, Chávez-Valencia V.高IL-6/IFN-γ比值可能与COVID-19患者的严重疾病有关。中国医学病毒学杂志,2020;42(10):1799 - 1799。
宋勇,张敏,尹林,王凯,周勇,周敏,等。COVID-19治疗方法:接近治愈?新型冠状病毒(SARS-CoV-2)药物治疗的快速回顾。国际抗菌药物杂志。2020;56(2):106080。
Gentile P, Calabrese C, De Angelis B, Pizzicannella J, Kothari A, Garcovich S.获得人脂肪源性间充质干细胞(AD-MSCs)的不同制备方法对酶消化与机械离心的影响国际分子生物学杂志,2019;20(21):5471。https://doi.org/10.3390/ijms20215471.
Kern S, Eichler H, Stoeve J, Kluter H, Bieback K.骨髓,脐带血或脂肪组织间充质干细胞的比较分析。干细胞。2006.https://doi.org/10.1634/stemcells.2005-0342.
脂肪来源干细胞(ADSCs)的免疫调节对皮肤组织修复的影响。是的。2020[引2020年9月11日];4(1):1 - 9。https://medwinpublishers.com/JES/JES16000136.pdf
Kruger MJ, Conradie MM, Conradie M, Van de Vyver M. adsc条件下的培养基诱导体外抗炎巨噬细胞反应。《Mol Endocrinol》,2020。https://doi.org/10.1530/JME-18-0078.
Corcione A, Benvenuto F, Ferretti E, Giunti D, Cappiello V, Cazzanti F,等。人间充质干细胞调节b细胞功能。2006年血。。https://doi.org/10.1182/blood-2005-07-2657.
Bonam SR, Kaveri SV, Sakuntabhai A, Gilardin L, Bayry J.辅助免疫疗法用于COVID-19重症患者的管理。医疗小组2020年代表。https://doi.org/10.1016/j.xcrm.2020.100016.
渡边Y,土屋A, Seino S,川田Y,小岛Y,伊岚S,等。间充质干细胞和诱导骨髓来源的巨噬细胞协同改善小鼠肝纤维化。中国医学杂志,2019;8(3):271。
李继伟,李志强,李志强,李志强。间充质干细胞在急性肺损伤中的潜在应用。《专家观点生物学杂志》2009。https://doi.org/10.1517/14712590903213651.
西蒙森·OE,穆吉阿卡克斯·D,赫德林·N,巴西·G,约翰松·HJ, Dalén M,等。两例严重急性呼吸窘迫综合征患者间充质基质细胞的体内效应。中国生物医学工程杂志,2015;4(10):1199-213。
Shetty正义与发展党。间充质干细胞输注有望对抗冠状病毒(COVID-19)诱导的肺炎。老年病学2020;11(2):462 - 64。
卡巴特,博科夫,库马尔,格鲁梅特。间充质干细胞临床试验趋势2004-2018:在狭窄剂量范围内疗效最佳?《干细胞转化医学》2020;9(1):17-27。
张晓东,杨晓东,杨晓东,等。杨晓东,杨晓东,等。外泌体:转化纳米医学的新参与者。中华临床医学杂志2020;9(8):2380。https://doi.org/10.3390/jcm9082380.
李娜,赵玲,魏勇,艾维林,年红,魏锐。外泌体在免疫介导眼病中的研究进展。中国生物医学工程学报,2019;10(1):278。
蔡颖,李娟,贾超,何颖,邓超。脂肪细胞游离衍生物的治疗应用综述。中国生物医学工程学报。2020;11(1):312。
崔晓宇,徐mk,吴永毅,金夏,Park EJ, Kim S.人脂肪来源干细胞的外泌体促进皮肤成纤维细胞增殖和迁移。中国皮肤科杂志,2018;27(10):1170-2。
费雷拉AD,库尼亚PD,卡雷加尔VM,席尔瓦PD,米兰达MC,昆拉特-利马M,等。来自脂肪来源的间充质干/基质细胞的细胞外囊泡在人角质形成细胞和成纤维细胞中加速迁移并激活AKT通路,独立于miR-205活性。干细胞杂志2017;2017:9841035。
费雷拉广告,戈梅斯检察官。干细胞细胞外囊泡在皮肤修复中的作用。生物工程学报。2018;6(1):4。https://doi.org/10.3390/bioengineering6010004.
Elahi FM, Farwell DG, Nolta JA, Anderson JD。来自间充质干细胞/基质细胞的外泌体临床前转译。干细胞。2020;38(1):15-21。
张晓峰,张晓峰,张晓峰。间充质基质细胞来源的细胞外囊泡用于再生治疗和免疫调节:临床应用的进展和挑战。中国生物医学工程学报。2020;9(1):39-46。
Nojehdehi S, Soudi S, Hesampour A, Rasouli S, Soleimani M, Hashemi SM。间充质干细胞来源外泌体对实验性1型自身免疫性糖尿病的免疫调节作用中国生物医学工程学报,2018;29(4):344 - 344。
赵斌,金卓,哈德华,李耀文。来自人类脂肪组织来源间充质干细胞的外泌体缓解特应性皮炎。中国生物医学工程杂志,2018;9(1):187。
赵慧,尚强,潘智,白勇,李智,张辉,等。来自脂肪来源干细胞的外泌体通过极化M2巨噬细胞和白色脂肪组织的米色来减弱脂肪炎症和肥胖。糖尿病。2018;67(2):235 - 47岁。
Mahmoudi M, Taghavi-Farahabadi M, Rezaei N, Hashemi SM。脂肪组织间充质基质细胞来源外泌体与条件培养基对中性粒细胞功能和凋亡影响的比较。《免疫药物学杂志》2019;74:105689。
Salvioli S, Olivieri F, Marchegiani F, Cardelli M, Santoro A, Bellavista E,等。人类的基因、衰老和长寿:问题、优势和前景。自由基决议2006;40(12):1303-23。
de Jong B, Barros ER, Hoenderop JGJ, Rigalli JP。细胞外囊泡作为药物传递系统的最新进展及其在精准医疗中的潜力。制药学。2020;12(11):1006。https://doi.org/10.3390/pharmaceutics12111006.
Bari E, Perteghella S, Catenacci L, Sorlini M, Croce S, Mantelli M,等。用于脱细胞间充质间质细胞免疫调节治疗的含外泌体的冻干和gmp兼容药物。纳米医学。2019;14(6):753 - 65。
刘松,彭东,邱华,杨凯,付忠,邹玲。间充质干细胞在新冠肺炎治疗中的应用。中国生物医学工程学报。2020;11(1):169。
Rogers CJ, Harman RJ, Bunnell BA, Schreiber MA, Xiang C,王芳生,等。COVID-19患者临床使用脂肪来源间充质干细胞的基本原理中华医学杂志2020;18(1):203。
刘志刚,杨媛媛,王丽娟,王丽娟。脂肪干细胞和外泌体在人类疾病和组织再生中的临床应用。Front Pharmacol, 2020;11:158。
郑刚,黄磊,佟华,舒强,胡勇,葛敏,等。异基因脂肪源性间充质干细胞治疗急性呼吸窘迫综合征:一项随机、安慰剂对照的初步研究呼吸科学,2014;4(15):39。
Mahida RY, Matsumoto S, Matthay MA。细胞外囊泡:急性呼吸窘迫综合征研究的新前沿。中国生物医学工程学报。2010;30(1):344 - 344。
沃辛顿恩,哈古德JS。细胞外囊泡治疗急性和慢性肺部疾病。国际分子生物学杂志,2020;21(7):2318。https://doi.org/10.3390/ijms21072318.
Nassar W, El-Ansary M, Sabry D, Mostafa MA, Fayad T, Kotb E,等。脐带间充质干细胞来源的细胞外囊泡可以安全地改善慢性肾脏疾病的进展。Biomater Res. 2016;20:21。
柯德拉,吕伯曼,李志强,等。msc来源的外泌体:治疗难治性移植物抗宿主病的新工具。白血病。2014;28(4):970 - 3。
Sengupta V, Sengupta S, Lazo A, Woods P, Nolan A, Bremer N.来自骨髓间充质干细胞的外泌体用于治疗严重COVID-19。中国生物医学工程学报,2020;29(12):747-54。
土屋A,竹内S,岩泽T,熊谷M,佐藤T,茂木S,等。间充质干细胞及其外泌体在新型冠状病毒病(COVID-19)重症病例中的治疗潜力炎症再生。2020;40:14。
Théry C, Witwer KW, Aikawa E, Alcaraz MJ, Anderson JD, Andriantsitohaina R,等。细胞外囊泡研究的最低信息2018 (MISEV2018):国际细胞外囊泡学会的立场声明和MISEV2014指南的更新。中国生物医学工程学报。2018;7(1):1535750。
Phinney DG。间充质干细胞的功能异质性:对细胞治疗的意义。中国生物医学工程学报,2012;29(3):326 - 326。
黄蓉,秦超,王娟,胡勇,郑刚,邱刚,等。衰老和年轻间充质干细胞细胞外囊泡在急性肺损伤中的差异作用。衰老。2019;11(18):7996 - 8014。
Idkowiak-Baldys J, Santhanam U, Buchanan SM, Pfaff KL, Rubin LL, Lyga J.生长分化因子11 (GDF11)对皮肤生物学有显著影响。PLoS ONE。2019; 14 (6): e0218035。
金永杰,徐德华,李硕,李世华,安国华,安海杰,等。人脐带血来源间充质干细胞的条件介质刺激人皮肤的再生功能。生物化学生物物理代表2018;16:96-102。
Rochette L, Mazini L, Meloux A, Zeller M, Cottin Y, Vergely C,等。GDF11对皮肤的抗衰老作用。国际Mol科学2020。https://doi.org/10.3390/ijms21072598.
L Mazini。生长分化因子11 (GDF11)/转化生长因子- β (TGF - β)/间充质干细胞(MSCs)平衡:皮肤年轻化的复杂伙伴关系。是的。2019[引2020年12月3日];3(2):1-10。https://medwinpublishers.com/JES/JES16000122.pdf
Börger V, Weiss DJ, Anderson JD, Borràs FE, Bussolati B, Carter DRF,等。国际细胞外囊泡学会和国际细胞和基因治疗学会关于间充质基质细胞和其他细胞的细胞外囊泡的声明:抑制冠状病毒疾病的潜在治疗剂的考虑19。Cytotherapy。2020;22(9):482 - 5。
李丽娟,李丽娟,李丽娟,Börger V,李丽娟,等。在临床试验中应用基于细胞外囊泡的治疗方法——ISEV的立场论文。中国生物医学工程学报。2015;
Mazini L, Ezzoubi M, Malka G.当前涉及治疗进展的脂肪来源干细胞(ADSCs)加工概述:COVID-19前后的流程图和调控更新。《干细胞研究》2021;12:1。
确认
作者要感谢穆罕默德六世理工大学对出版的支持,并感谢Yousra Hamdan为我们提供了图形摘要。
资金
不适用。
作者信息
作者及隶属关系
贡献
LM:概念和设计,数据的收集和/或组装,数据分析和解释,手稿写作,最终批准手稿。LR:数据分析和解释。总经理:行政支持,资金支持,稿件最终审定。所有作者均已阅读并批准最终稿。
相应的作者
道德声明
伦理批准并同意参与
所有作者都同意参与这项工作。
参与同意书
所有的作者都同意参加这项工作。
发表同意书
不适用。
相互竞争的利益
作者宣称没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Mazini, L., Rochette, L. & Malka, G.外泌体在COVID-19患者治疗中的贡献。翻译医学杂志19, 234(2021)。https://doi.org/10.1186/s12967-021-02884-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-021-02884-5
关键字
- 新型冠状病毒肺炎
- 脂肪来源的干细胞
- 间充质干细胞
- 液
- 炎症
- 患者安全