摘要
急性呼吸窘迫综合征(ARDS)重症患者死亡率为30.9% ~ 46.1%。2019冠状病毒病(Covid-19)的出现已成为一个全球性问题,令人担忧。重症Covid-19患者可能会发展为ARDS。间充质干细胞(Mesenchymal stem cells, MSCs)可以来源于骨髓、脐带、脂肪组织等。间充质干细胞具有易获得性和低免疫原性等特点,可用于异体移植,在动物和临床研究中得到广泛应用。越来越多的证据表明间充质干细胞输注可以改善ARDS。然而,骨髓间充质干细胞的潜在机制还有待探讨。近年来研究表明MSCs可以调节免疫/炎症细胞,减弱内质网应激,抑制肺纤维化。旁分泌细胞因子和外泌体可能是这些有益作用的原因。本文综述了骨髓间充质干细胞治疗急性呼吸窘迫综合征的机制,分析了最新的动物实验和新冠肺炎临床试验结果,讨论了近年来研究的不良反应和前景,并强调了骨髓间充质干细胞治疗新冠肺炎急性呼吸窘迫综合征的潜在作用。
背景
急性呼吸窘迫综合征(ARDS)仍然是重症患者死亡的主要原因。急性呼吸窘迫综合征的住院死亡率为34.9%至46.1% [1].根据柏林定义,ARDS根据低氧血症的程度可分为轻度、中度和重度三个程度[2].急性呼吸窘迫综合征的病因包括重症肺炎、败血症、外伤、失血性休克、再灌注损伤、流感病毒、冠状病毒等[3.,4,5].
ARDS主要表现为肺毛细血管内皮细胞和肺泡上皮细胞通透性增加、炎症细胞浸润、肺水肿、氧合损伤和肺纤维化。ARDS患者的主要治疗方法包括机械通气、使用利尿剂减轻肺水肿、俯卧位改善肺部气体交换[6,7].尽管治疗取得了进展,但迫切需要更有效的方法来治疗ARDS。
骨髓间充质干细胞是一种多能成体干细胞,来源于骨髓(BM)、脂肪(AD)和脐带(UC)等多种组织和器官。基于msc的疗法在临床前模型中广泛用于多种疾病的治疗,并在许多临床试验中进行研究[8,9,10].经静脉输注后,MSCs因血流动力学物质在5分钟内向肺组织趋向性。不同研究中,细胞在肺中的滞留时间从数小时到数天不等[11,12,13,14,15].一些研究表明,尽管这些细胞仍在发挥其治疗作用,但它们在肺部的停留时间甚至不到24小时[12].因此,间充质干细胞在治疗肺部疾病方面具有显著优势。大量临床前研究表明,在动物模型中灌注MSCs对ARDS具有保护作用,但机制的多样性需要进一步讨论[16,17,18].
此外,全球传播的2019冠状病毒病(Covid-19)是由严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)引起的,它是冠状病毒科的一种RNA病毒[19].急性呼吸窘迫综合征是Covid-19重症患者死亡的主要原因[20.].MSC输血有望成为治疗重症或危重症患者的可行方法。
在此,我们总结了目前对基于msc治疗ARDS的治疗机制的认识。本文就MSC治疗在临床前研究和临床应用中的进展和局限性进行了综述。这些结果为Covid-19的治疗提供了线索。
MSCs在ARDS中的免疫调节特性
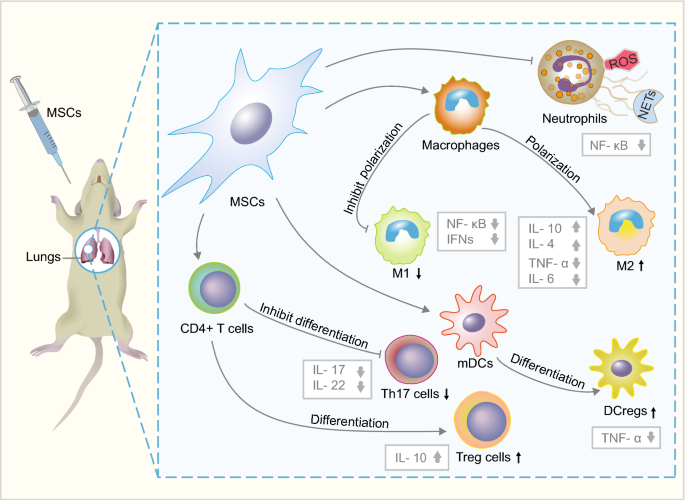
中性粒细胞被认为是急性呼吸窘迫综合征病理生理学的驱动因素,它释放几种与肺组织直接损伤相关的促炎介质[21].当中性粒细胞在上皮细胞中迁移时,中性粒细胞会释放一些毒性介质,如蛋白酶、中性粒细胞细胞外陷阱(NETs)和活性氧(ROS) [6].中性粒细胞产生ROS过多也称为氧化爆发或呼吸爆发[22],不仅能杀死病原体,还会损害肺血管内皮和肺泡上皮[6].小鼠AD-和人BM-MSCs输注可抑制中性粒细胞激活并导致ROS减少[23,24].此外,小鼠AD-MSCs抑制作为中性粒细胞反应一部分的NETs的释放,从而抑制核因子κ b (NF-κB),提高ARDS的生存率[24,25,26].有趣的是,人和小鼠bm - msc条件下的培养基也可以通过抑制NF-κB信号通路诱导中性粒细胞凋亡,减轻肺损伤[27],提示MSCs的旁分泌功能可能在肺修复中发挥重要作用。
在ARDS期间,巨噬细胞在m1型(经典激活的巨噬细胞)和m2型(交替激活的巨噬细胞)极化之间表现出动态平衡。M1亚型分泌促炎细胞因子,包括TNF-α、IFN-γ、IL-1β、IL-6、IL-12和IL-23,表达诱导型一氧化氮合酶(iNOS), M2亚型分泌抗炎细胞因子,包括IL-4、IL-10和TGF-β [28,29,30.,31].与人骨髓间充质干细胞非接触共培养后,巨噬细胞M2极化增强,吞噬能力增强。这可能解释了人骨髓间充质干细胞在脂多糖(LPS)诱导的小鼠肺损伤中的抗炎作用[32].此外,人ad - msc教育的巨噬细胞可以增加血清和支气管肺泡灌洗液中IL-4和IL-10的水平,降低TNF-α和IL-6的水平,从而改善lps诱导的小鼠模型全身炎症反应[33].因此,这些结果揭示了人AD-MSCs通过调节M2极化发挥抗炎作用。此外,与人骨髓间充质干细胞孵育的巨噬细胞表现出较高的吞噬活性大肠杆菌-大鼠肺损伤[34].有趣的是,人骨髓间充质干细胞可能通过隧道纳米管和细胞外囊泡将线粒体转移到巨噬细胞,增强巨噬细胞氧化磷酸化,有助于ARDS巨噬细胞的抗菌作用和吞噬活性[32,35].
在失血性休克或LPS诱导的ARDS中,肺组织中树突状细胞(dendritic cells, DCs)数量增加,且肺dc成熟参与加重肺部炎症反应和病理损伤[36,37,38].猎犬AD-和小鼠BM-MSCs可诱导成熟树突状细胞(mDCs)进入调节性树突状细胞(DCregs)群体,从而抑制mDCs的激活,抑制炎性细胞因子的分泌[39,40].机械地,小鼠BM-和人UC-MSCs分泌的旁分泌肝细胞生长因子(paracrine hepatocyte growth factor, HGF)可激活AKT信号通路,诱导mDCs分化为DCregs并抑制T细胞增殖,以改善小鼠模型的肺损伤[41,42].
辅助T细胞17 (Th17)和调节性T细胞(Treg细胞)也在ARDS中发挥作用[43,44,45].Th17/Treg细胞比值升高与ARDS患者预后不良相关,也是判断28天死亡率的一种新的危险指标[46].小鼠BM-MSCs可调节T细胞向Th17和Treg极化,降低Th17/Treg比值,平衡体内外炎症细胞因子[47,48].在小鼠模型中,大鼠肺内MSCs还可以通过减少Th17细胞和增加Treg细胞来减轻肺损伤。相应的,MSCs在肺和血浆中降低th17相关细胞因子IL-17和IL-22的表达,增加treg相关IL-10的表达[44体外共培养研究表明,小鼠骨髓间充质干细胞可抑制Th17细胞从CD4细胞向CD4细胞分化+T细胞通过程序性死亡-1 (PD-1)途径通过细胞间接触[49].然而,这还需要在体内使用ARDS模型进一步验证。
综上所述,MSCs可以通过调节免疫细胞和炎症细胞来减少ARDS中的炎症组织损伤(图2)。1).然而,MSCs在炎症反应中的分子机制尚不清楚。
间充质干细胞维持肺泡上皮和内皮屏障的旁分泌功能
肺血管内皮是分布在血管腔表面的单层内皮细胞,具有内皮屏障功能。肺血管内皮屏障功能障碍与内皮通透性增加和肺水肿有关。调节血管内皮屏障通透性的主要途径有两种:旁细胞通路和跨细胞通路[50].细胞旁通透性由连接蛋白决定,如β-catenin、VE-cadherin、occludin等,而跨细胞通透性则由内皮屏障大分子,如转铁蛋白、白蛋白等间接反映[51,52].
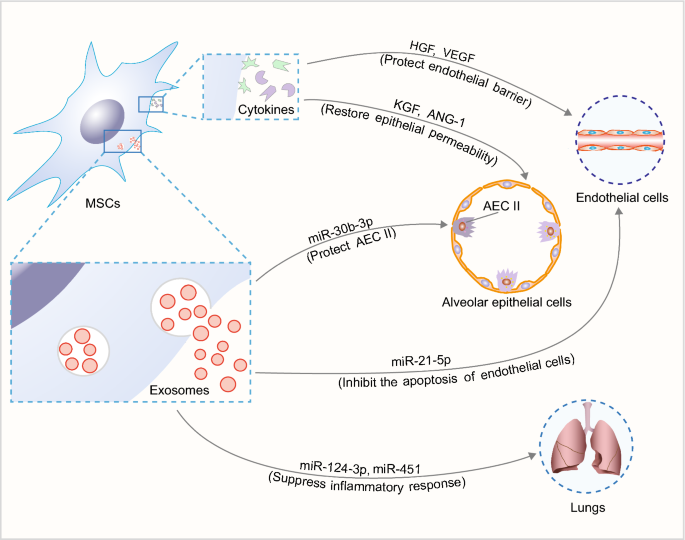
体外实验表明,人bm - msc条件培养基可以通过维持粘附连接蛋白(VE-cadherin和β-catenin)来恢复肺内皮的通透性[52],说明条件培养基中的旁分泌因子可以调节肺内皮的通透性。最近,一项体外研究发现,LPS刺激后肺内皮细胞旁通透性增加,与小鼠骨髓间充质干细胞非接触共培养后肺内皮细胞旁通透性恢复。机械上,本研究证实了小鼠骨髓间充质干细胞通过mTOR/STAT3信号通路分泌HGF作为旁分泌因子保护紧密连接蛋白闭塞蛋白和内皮屏障[51].另一项类似研究显示,人msc分泌的旁分泌因子HGF和血管内皮生长因子(VEGF)通过激活Rac1信号通路保护细胞旁和跨细胞内皮屏障[53].
此外,间充质干细胞分泌的旁分泌因子可保护肺泡上皮的完整性。在损伤的肺泡中,上皮屏障功能障碍导致富含蛋白质的水肿形成和炎症细胞的聚集,从而导致Na进一步减少+对整个肺泡上皮细胞的吸收和更严重的II型肺泡上皮细胞(AEC II)损伤[54].
体外研究表明,人bm - msc条件下的培养基逆转了上皮的高通透性,恢复了经上皮的Na+交通工具。此外,从人脑转移-间充质干细胞分泌到条件培养基中的旁分泌角质细胞生长因子(KGF)对肺泡上皮Na的保护作用是必需的+运输(55].此外,当AEC II暴露于炎症损伤(IL-1β, TNF-α和IFN-γ的组合)时,上皮的通透性增加,而共培养的人BM-MSCs分泌的旁分泌因子血管生成素-1 (ANG-1)可以恢复上皮的完整性[56].
这些研究表明,msc衍生的旁分泌因子是肺血管内皮和肺泡上皮的有效稳定剂。2).然而,这些机制需要在体内进一步验证。
msc来源的外泌体在ARDS中的治疗潜力
外泌体是纳米大小的细胞外囊泡(直径30 - 100nm),由包括间充质干细胞在内的各种细胞积极分泌。它们携带蛋白质、mirna和mrna等治疗性货物,并可将这些生物分子转移到靶细胞,以影响其生物学特性[57].msc -外泌体的治疗益处已经在ARDS的几个方面得到了证明(图2)。2).
msc来源的外泌体被证明在ARDS中介导炎症反应和调节免疫功能。P2X配体门控离子通道7 (P2X7)密切参与ARDS的炎症过程。大鼠bm - mscs来源的外泌体携带miR-124-3p抑制P2X7表达,抑制炎症反应,改善创伤性ARDS [58].大鼠bm - msc来源的外泌体也可抑制TLR4/NF-κB信号通路,抑制肠缺血再灌注诱导的ARDS [59].同样,来自人UC-MSCs的外泌体可以通过转移miR-451下调TLR4和p65的表达,从而限制烧伤诱导ARDS的TLR4/NF-κB信号通路[60].此外,小鼠bm - msc来源的外泌体可以通过miR-21-5p抑制肺内皮细胞凋亡,miR-21-5p靶向PDCD4和PTEN [61].此外,工程外泌体代表了一个新的方向。小鼠bm - msc来源的外泌体过表达miR-30b-3p可以通过抑制血清淀粉样蛋白A3 (SAA3)缓解炎症反应并修复AEC II, SAA3被认为是一种炎症急性期反应物[62].综上所述,MSC外泌体相关mirna在ARDS中发挥着重要作用,代表了一种有前途的非细胞治疗策略。
此外,MSC-exosomes可以调节肺泡巨噬细胞的代谢状态。小鼠bm - msc来源的外泌体可抑制HIF-1α下调糖酵解,从而抑制肺组织M1巨噬细胞极化,促进M2巨噬细胞极化,从而改善lps诱导的ARDS [63].这一机制可能与BM-MSCs通过线粒体转移在巨噬细胞氧化磷酸化中的作用协同作用[32].
MSCs在内质网应激中的作用
大量研究发现,抑制内质网应激(内质网应激)可以预防或减少ARDS [64,65,66].4-苯基丁酸阻断ERS可显著改善肺组织凋亡和组织病理学改变[65].此外,抑制ERS还能抑制NF-κB信号通路的激活,减少促炎介质,包括TNF-α、IL-1β和IL-6 [66].
体外研究显示博莱霉素诱导的ERS可促进AEC凋亡,而小鼠bm - msc条件培养基可通过减少ERS来减轻AEC损伤[67].在体内研究中,博莱霉素致肺损伤后第7天,AEC和成纤维细胞中ERS标记物(Bip或XBP-1)水平升高。人BM-MSC静脉输注主要通过Bip-PERK-Nrf2途径抑制ERS,而另外两个位于内质网膜的传感器不受影响,包括肌醇要求酶1 (IRE-1)和活化转录因子6 (ATF-6)。令人惊讶的是,人骨髓间充质干细胞并未影响ers诱导的细胞凋亡[68].这些研究在体内和体外实验中显示出不一致的结果。我们推测,静脉输注方式可能会影响MSC治疗AEC的疗效,因为MSCs首先与肺内皮细胞接触,必须穿透内皮细胞屏障才能到达AEC。
MSCs在ARDS中的抗纤维化能力
肺纤维化是一种进行性间质性肺部疾病,原因很多,包括病毒和细菌感染、化疗药物不良反应、空气污染、吸烟、职业暴露等环境因素。肺泡内和间质纤维化是ARDS晚期的标志,表现为细胞外基质蛋白特别是胶原蛋白的异常沉积。肺纤维化主要涉及两种细胞机制。ARDS的炎性肺环境可能触发AEC II的上皮-间充质转变,AEC II分化为活跃的肌成纤维细胞[69].此外,TGF-β诱导成纤维细胞向肌成纤维细胞转化有助于肺纤维化[70].肺纤维化可严重影响加速肺功能障碍的ARDS患者,导致呼吸机依赖[71].因此,减少肺纤维化是预防ARDS的必要措施。
气管内输注人AD-MSCs可显著改善lps诱导的ARDS小鼠模型间质纤维化的肺损伤,并减少中性粒细胞浸润[72].同样,静脉输注人UC-MSCs可抑制免疫功能正常小鼠博莱霉素诱导的纤维化[70].在机制上,人UC-MSCs通过增强巨噬细胞基质金属肽酶-9的表达促进胶原降解,以及增强toll样受体-4信号通路促进肺泡再生来逆转纤维化[69].此外,静脉输注AD-MSCs可降低血清和肺组织中成纤维细胞生长因子-7的表达,逆转胺碘酮诱导的肺损伤纤维化过程[73].此外,敲低Last-1或Last-2的小鼠BM-MSCs在lps诱导的ARDS早期表现出更强的抗纤维化能力[74,75].这些研究表明来自不同组织的间充质干细胞可以通过减轻肺纤维化来治疗ARDS。
临床试验
在临床前模型中,注射MSCs是治疗ARDS的一种有前途的治疗方法(表2)1),但基于msc的疗法仍在临床试验中进行研究。由于临床前研究的进展,一些临床试验被注册,以调查异基因MSC治疗ARDS患者的安全性和有效性,特别是在Covid-19大流行期间(表2)2).
2013年,一项多中心、开放标签的I期临床试验(NCT01775774)启动,以测试人类BM-MSCs在ARDS患者中的安全性。9例患者接受单剂量静脉输注1,500或1000万细胞/kg预测体重(PBW)。该试验证实了BM-MSCs在ARDS患者中的安全性,输注后未发生BM-MSCs相关不良事件[76].随后,该团队进行了一项多中心双盲II期临床试验(NCT02097641),以评估基于人类bm - msc治疗的安全性。60名参与者被随机分配以2:1的比例接受异体骨髓间充质干细胞或安慰剂。以1000万细胞/kg PBW的剂量静脉注射BM-MSCs。没有发生与脑转移- msc相关的不良事件,但疗效应在更大规模的试验中进一步验证。同时,必须提高BM-MSCs的生存能力[77].
2015年,BM-MSCs用于一项I期开放标签临床试验,用于治疗败血性休克患者,败血性休克通常与ARDS相关(NCT02421484)。9名参与者随机分为三组,分别接受0.3、100或300万细胞/kg PBW的单次静脉输注BM-MSC。骨髓间充质干细胞输注于感染性休克患者似乎是安全的,并显示出潜在的疗效迹象[78].
最近,Chen报告了一项单中心和开放标签的临床研究(NCT02095444),评估了异基因经血来源的MSC在h7n9诱导的ARDS患者中的应用。在这项试验中,9名患者接受了3次人经血来源的MSCs输注,8名患者接受了4次这种细胞输注。经血来源间充质干细胞静脉注射,每次剂量为100万细胞/kg PBW。结果显示,MSC组的死亡率显著降低(MSC组为17.6%)vs对照组54.5%)。此外,4例患者的5年随访调查显示,注射经血来源的MSC是安全的[79].因此,注射间充质干细胞治疗h7n9引起的急性呼吸窘迫综合征的疗效表明了间充质干细胞在Covid-19患者中的治疗潜力。
Zheng及其同事报告了一项I期单中心双盲研究(NCT01902082)。在这项试验中,12名成年ARDS患者按1:1的比例被随机分为两组,分别接受异体人AD-MSCs或安慰剂。AD-MSCs静脉注射剂量为100万细胞/kg PBW。然而,AD-MSCs并没有显著改善肺功能。同时,血清炎症因子(IL-6和IL-8)水平不受影响[80].事实上,现有的大多数相关临床试验仅处于I期或II期,并将安全性作为主要结果进行评估。因此,这可能不足以评估疗效。同时,MSCs为基础的治疗效果可能受到多种因素的影响,包括MSCs来源、细胞活力、细胞剂量、给药次数和给药途径[81,82].因此,骨髓间充质干细胞的生产和输血过程应该标准化。需要进行更大规模、控制良好的临床试验。
MSCs在Covid-19患者中的治疗潜力
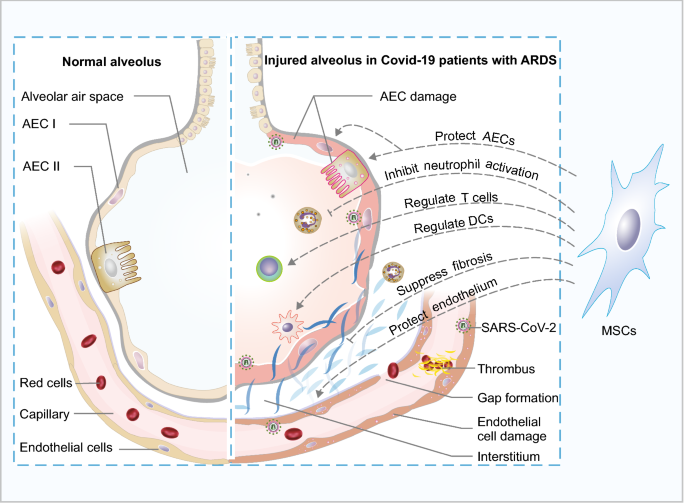
在许多Covid-19患者中观察到严重肺炎和急性呼吸窘迫综合征。在需要住院治疗的受影响病人中,死亡率可达5%至15% [83].然而,随着疫情在世界各地蔓延,这些数字也在不断变化。提出了与Covid-19病理生理学相关的五个关键机制,包括:(1)SARS-CoV-2对上皮细胞的直接细胞毒性;(2) SARS-CoV-2与ACE2相互作用导致血管紧张素转换酶2 (angiotensin-converting enzyme 2, ACE2)下调导致肾素-血管紧张素-醛固酮系统调节异常;(3)免疫反应失调,细胞因子和趋化因子引起的过度炎症;(4)内皮细胞损伤和血栓炎症;(5)间质增厚和纤维化[84,85].然而,Covid-19病理生理学中的详细机制目前尚不清楚。
恢复期血浆在治疗Covid-19方面具有巨大潜力。早期高滴度血浆输注可以预防老年人严重的Covid-19 [86].最近的一份报告显示,30天内的死亡风险还与血浆输血中抗sars - cov -2抗体水平有关。当患者未接受机械通气时,输入高滴度抗体血浆的Covid-19患者的死亡风险低于低滴度抗体组。然而,在接受机械通气的患者中,死亡风险与抗体滴度无关[87].令人失望的是,包括羟氯喹、干扰素β -1a、洛匹那韦和瑞德西韦在内的四种抗病毒药物对住院的Covid-19患者几乎没有作用[88].因此,迫切需要对Covid-19急性呼吸窘迫综合征患者进行有效的治疗。
间充质干细胞具有组织再生能力,并有可能抑制急性呼吸窘迫综合征中的细胞因子风暴、肺纤维化[69,70,89,90],用于抗击新冠肺炎。因此,MSCs在新冠肺炎患者的治疗中受到了广泛的关注。基于msc的Covid-19治疗方法的临床试验数量迅速增长(表2)2).Leng及其同事进行了一项I-II期和多中心研究(ChiCTR2000029990),评估向7例Covid-19肺炎患者注射人脑转移质间充质干细胞。以100万细胞/kg PBW的剂量静脉注射BM-MSCs。在给药后,随访患者14天,以评估BM-MSC治疗的安全性和有效性。在这些患者中观察到临床获益,肺功能得到改善。过度激活的免疫细胞在3-6天内消失,包括CXCR3+CD4+T细胞,CXCR3+CD8+T细胞和CXCR3+NK细胞。同时,BM-MSCs治疗组血清TNF-α水平明显降低,抗炎IL-10水平升高。因此,人类脑转移质间充质干细胞治疗可能是Covid-19肺炎患者安全有效的方法[91].
截至2020年3月10日,中国发布了Covid-19干细胞治疗标准化指南。MSC临床应用的一般方案是患者接受不超过3次干细胞输注,每次输注剂量为1-5 × 106细胞/kg体重,每次输液间隔不少于3天。最近,报道了一项Covid-19一期临床试验(平行分配对照,非随机,每组n = 9),以评估人类UC-MSCs在中重度Covid-19症状患者中的安全性。分别于第0、3、6天注入3次,剂量为3 × 107细胞/灌注。本一期试验中所有患者均康复出院,显示MSC静脉输注的安全性[92].在一项Covid-19 2期临床试验(随机、双盲、安慰剂对照,UC-MSCs组n = 65,安慰剂组n = 35)中,3个周期的UC-MSCs (4 × 107在第0天、第3天和第6天,每次输注细胞)或安慰剂用于治疗有肺损伤的严重Covid-19患者。从基线到第28天监测全肺病变体积的比例。与安慰剂相比,UC-MSCs输注可显著改善肺功能,固体组分病变比例降低[93].这些结果初步证明了UC-MSCs治疗Covid-19患者的疗效和安全性。
重要的是,人骨髓间充质干细胞ACE2和TMPRSS2基因均为阴性,提示人骨髓间充质干细胞可能未感染SARS-CoV-2 [91].此外,最近的一项研究报告称,一名Covid-19患者通过静脉输注人UC-MSCs和恢复期血浆成功治愈。这种联合治疗可能在抑制细胞因子风暴和改善肺功能方面有协同作用[94].
Covid-19患者的ARDS通常与引起宿主免疫系统紊乱的细胞因子风暴有关。中性粒细胞是严重SARS-CoV-2感染的关键介质,并导致Covid-19患者的器官损伤和死亡[95,96].在Covid-19患者中观察到树突状细胞、Th17细胞和Treg细胞的失调[97,98,99].炎症细胞和免疫细胞的激活和浸润可引发细胞因子的过度生产,释放多种炎症介质,如IL-6、IFN-γ和TNF-α [One hundred.,101].因此,MSCs的免疫调节特性可能是有利于ARDS患者的最重要方面。在UC-MSC或BM-MSC治疗的患者中,许多细胞因子呈下降趋势,过度激活的免疫细胞减少[91,92].特别是在UC-MSC输注3天后,IL-6基线水平高的患者IL-6水平显著降低,而IL-6基线水平低的患者IL-6水平没有明显降低[92].因此,血浆细胞因子浓度高的患者可能更受益于UC-MSCs治疗。
综上所述,由于MSCs对ARDS的治疗机制与Covid-19的病理特征相匹配,因此MSCs输注可作为Covid-19患者的细胞治疗方法(图2)。3.).同时,MSCs对肺功能的长期影响应在后续临床试验中进行监测。
问题与展望
尽管基于msc的治疗为ARDS的治疗带来了新的希望,但在这种治疗常规应用于临床应用之前,仍有许多挑战有待解决。经静脉输注间充质干细胞可明显改善肺功能,但可能引起剂量依赖性肺栓塞或肺梗死。因此,应严格控制细胞的剂量。腹腔和气管内途径在临床试验中很少使用,尽管其在临床前研究中已被证明有效[102,103].气管内MSC输注时过量介质吸入可能加重ARDS,应引起注意。理论上,气管内灌注MSCs可能对aec最有利,而静脉注射可能首先有利于内皮细胞。然而,对于ARDS, MSC给药的最佳途径可能是静脉输注。通过这一途径,MSCs也可以直接与血液免疫细胞相互作用,抑制细胞因子风暴。在临床前实验和临床试验中,应比较不同给药途径的效果,以确定更优的给药途径[81,82,104,105].
在一些临床试验中,MSCs输注的疗效并没有预期的那么好。未来的研究应着眼于提高间充质干细胞的疗效。据报道,调节自噬揭示了通过增强间充质干细胞的免疫调节能力来提高其治疗效果的潜力[106].输注缺氧培养的大鼠骨髓间充质干细胞可促进细胞存活和治疗效果[107].此外,转基因大鼠和小鼠骨髓间充质干细胞在改善肺组织损伤方面具有增强的有益作用[62,108,109].因此,以骨髓间充质干细胞为前提是提高骨髓间充质干细胞对ARDS治疗能力的一种有前途的策略[110].
静脉注射后,间充质干细胞可在体内停留数小时至数天,并逐渐消失。因此,可能没有中期和长期的肿瘤风险。然而,人和大鼠BM-MSC输注也可能通过进入肿瘤微环境促进肿瘤生长和血管生成[111,112,113].因此,在未来的研究中,特别是在癌症患者中,必须明确MSC输注的适应症和禁忌症。2019年,一项最新的系统综述报告了2696例患者血管内给药后MSCs的不良反应。与对照组相比,MSC输注与短暂性发热风险增加有关[114].在最近的Covid-19一期试验中,2例患者(n = 9)在接受UC-MSCs后出现短暂性面部潮红和发热[92].然而,MSC输注不会增加急性输注毒性、感染、肺栓塞、死亡或恶性肿瘤的风险[114].值得注意的是,在临床试验中确实观察到了AD-MSC给药后致死性肺血栓栓塞,在小鼠静脉输注AD-MSC后也证实了剂量依赖性肺栓塞[115].因此,在临床试验中应严格控制MSCs的剂量,并在静脉输注前将细胞分散成单细胞。
此外,间充质干细胞的优势是可以作为现成的治疗产品,因为它们可以用于异体移植。然而,应建立标准程序以确保MSCs的安全性和有效性。在骨髓间充质干细胞的分离和培养过程中,动物血清是一个主要的问题,可能会导致不良的并发症。相反,人AB血清(HABS)和人血小板裂解物(HPL)被用于大多数无异种培养。然而,由于供体的异质性,HABS和HPL的质量可能在批次之间有所不同。另一种替代方法是化学定义的培养基,这可能使稳定的MSC培养用于临床使用[110,116].重要的是,MSCs的前提条件是一种很有前途的策略,以改善细胞对特定疾病的疗效,包括缺氧、细胞外基质、激素、生长因子等[110].这些条件增加了标准MSC生产的复杂性。针对特定疾病的MSC产品未来应该标准化。最近,中国发布了人间充质干细胞标准(T/CSCB 0003-2021),这可能有助于标准化间充质干细胞的生产和应用。
结论
以msc为基础的治疗ARDS有几种可能的机制,包括调节免疫细胞和炎症细胞、细胞因子的旁分泌、有益外泌体的释放、调节内质网应激和减弱肺纤维化。这些特性使间充质干细胞能够改善ARDS。在临床前研究中,输注MSCs明确了ARDS模型的治疗效果,新冠肺炎临床试验的结果证明了MSCs的安全性和潜在疗效。然而,MSC治疗的疗效应在更大规模的试验中进一步证实,特别是在Covid-19急性呼吸窘迫综合征患者中。此外,还需要研究确定MSCs治疗的最佳细胞来源、剂量和途径,为ARDS患者特别是Covid-19患者提供有效、安全的治疗方案。
数据和材料的可用性
不适用。
缩写
- 原子能委员会我:
-
I型肺泡上皮细胞
- 原子能委员会2:
-
II型肺泡上皮细胞
- ARDS:
-
急性呼吸窘迫综合征
- Covid-19:
-
2019冠状病毒病
- DCregs:
-
调节性树突细胞
- 人:
-
内质网应激
- 伊诺:
-
诱导型一氧化氮合酶
- KGF:
-
角质细胞生长因子
- 有限合伙人:
-
脂多糖
- mDCs:
-
成熟树突细胞
- 硕士:
-
间充质干细胞
- 网:
-
中性粒细胞细胞外陷阱
- NF -κB:
-
核因子b
- PBW:
-
预测体重
- ROS:
-
活性氧
- SARS-CoV-2:
-
严重急性呼吸综合征冠状病毒2
- Th17:
-
辅助T细胞17
- Treg细胞:
-
调节性T细胞
参考文献
Bellani G, Laffey JG, Pham T, Fan E, Brochard L, Esteban A, Gattinoni L, van Haren F, Larsson A, McAuley DF,等。50个国家重症监护室急性呼吸窘迫综合征患者的流行病学、护理模式和死亡率《美国医学协会杂志》上。2016; 315:788 - 800。
拉涅利VM,鲁本菲尔德GD,汤普森BT,弗格森ND,考德威尔E,范E,坎波洛塔L,斯卢茨基AS。急性呼吸窘迫综合征:柏林定义。《美国医学协会杂志》上。2012; 307:2526-33。
黄志强,李志强,李志强。急性呼吸窘迫综合征少见病因的肺力学和气体交换特征。中华外科杂志2018;10:5030-8。
Quispe-Laime AM, Bracco JD, Barberio PA, Campagne CG, Rolfo VE, Umberger R, Meduri GU。甲型H1N1流感病毒相关急性肺损伤:对奥司他韦联合长期皮质类固醇治疗的反应重症监护医学。2010;36:33-41。
吴C,陈X, Y Cai,夏J,周X,徐年代,黄H,张L,周X, Du C, et al。中国武汉2019冠状病毒病肺炎患者急性呼吸窘迫综合征和死亡相关危险因素JAMA实习生医学2020;180:1-11。
Matthay MA, Zemans RL, Zimmerman GA, Arabi YM, Beitler JR, Mercat A, Herridge M, Randolph AG, Calfee CS。急性呼吸窘迫综合征。Nat Rev Dis Primers. 2019;5:18。
Spinelli E, Mauri T, Beitler JR, Pesenti A, Brodie D.急性呼吸窘迫综合征中的呼吸驱动:病理生理学,监测和治疗干预。重症监护医学2020;46:606-18。
Soontararak S, Chow L, Johnson V, Coy J, Wheat W, Regan D, Dow S.诱导多能干细胞(iPSC)衍生的间充质干细胞(MSC)在促进小鼠炎症性肠病模型肠道愈合和微生物群正常化中的作用《干细胞转化医学》2018;7:456-67。
田芳,王志刚,王志刚,王志刚。大鼠间充质基质细胞薄片对肾纤维化的抑制作用。《干细胞转化医学》2019;8:1330-41。
Nagaishi K, Ataka K, Echizen E, Arimura Y, Fujimiya M.间充质干细胞治疗通过抑制骨髓来源细胞的浸润来改善糖尿病小鼠肝细胞损伤。肝脏病学。2014;59:1816-29。
陈东,李强,郭玲,唐勇,刘震,尹胜,秦伟,袁震,张旭,吴晨。追踪干细胞移植和迁移到损伤小鼠肝脏的荧光聚合物点。开展。2017;7:1820-34。
de Oliveira HD, de Melo EBB, Silva JD, Kitoko JZ, Gutfilen B, Barboza T, de Souza SAL, Takiya CM, Rocco PRM, lope - pacheco M, Morales MM.来自健康或矽肺供体的骨髓来源的单个核细胞对受体矽肺小鼠的治疗作用。干细胞研究。2017;8:259。
Schmuck EG, Koch JM, Centanni JM, Hacker TA, Braun RK, Eldridge M, Hei DJ, Hematti P, Raval AN。大鼠肺损伤模型静脉输注后定量三维冷冻成像研究人间充质干细胞的生物分布和清除。干细胞转化医学。2016;5:1668-75。
Schrepfer S, Deuse T, Reichenspurner H, Fischbein MP, Robbins RC, Pelletier MP。干细胞移植:肺屏障。移植科学,2007;39:573-6。
谢萍,胡霞,李东,谢松,周忠,孟X,单红。过表达肝细胞核因子4α对移植间充质干细胞的生物发光成像:生物分布和存活的追踪。Mol成像生物学2019;21:44-53。
马晓辉,李建伟,李建伟。简要回顾:间充质干(基质)细胞:创伤或败血症后器官功能障碍治疗潜力的生物学和临床前证据。干细胞。2017;35:316-24。
Lopes-Pacheco M, roba C, Rocco PRM, Pelosi P.急性呼吸窘迫综合征间充质干细胞治疗益处的当前认识。细胞生物学毒物。2020;36:83-102。
Barros I, Silva A, de Almeida LP, Miranda CO.间充质基质细胞对抗SARS-CoV-2:利用多效治疗。细胞因子生长因子Rev. 2020;58:114。
朱楠,张东,王伟,李霞,杨波,宋杰,赵鑫,黄波,史伟,卢瑞,等。2019年中国肺炎患者的新型冠状病毒。英国医学杂志,2020;382:727-33。
吴C,陈X, Y Cai,夏J,周X,徐年代,黄H,张L,周X, Du C, et al。中国武汉2019冠状病毒病肺炎患者急性呼吸窘迫综合征和死亡相关危险因素JAMA实习生医学2020;180:934。
Hook JS, Cao M, Potera RM, Alsmadi NZ, Schmidtke DW, Moreland JG。Nox2调节肺部血小板活化和NET形成。前沿免疫。2019;10:1472。
El-Benna J, Hurtado-Nedelec M, Marzaioli V, Marie JC, Gougerot-Pocidalo MA, Dang PM。中性粒细胞呼吸爆发启动:在宿主防御和炎症中的作用。Immunol Rev. 2016; 273:180-93。
Bernard O, Jeny F, Uzunhan Y, Dondi E, Terfous R, Label R, Sutton A, Larghero J, Vanneaux V, Nunes H,等。间充质干细胞通过调节HIF和ROS缺氧信号来减少肺泡上皮细胞缺氧诱导的凋亡。中国生物医学工程杂志。2018;314:L360-l371。
Pedrazza L, Cunha AA, Luft C, Nunes NK, Schimitz F, Gassen RB, Breda RV, Donadio MV, de Souza Wyse AT, Pitrez PMC,等。间充质干细胞通过抑制NETs的形成来改善lps诱导的急性肺损伤的生存。中国生物医学工程学报,2017;
Amulic B, Cazalet C, Hayes GL, Metzler KD, Zychlinsky A.中性粒细胞功能:从机制到疾病。中华免疫杂志2012;30:459-89。
刘松,苏旭,潘鹏,张磊,胡勇,谭红,吴东,刘波,李红,李红,等。中性粒细胞细胞外陷阱是由脂多糖间接触发的,并有助于急性肺损伤。科学代表2016;6:37252。
苏伟,林春春,洪超,杨健。在内毒素诱导的急性肺损伤中,间充质干细胞条件培养基诱导中性粒细胞凋亡与NF-kappaB通路抑制相关。国际分子生物学杂志2019;20:2208。
Woods PS, Tazi MF, Chesarino NM, Amer AO, Davis IC. TGF-β诱导的IL-6预防甲型流感病毒感染的F508del cftr杂合小鼠急性肺损伤的发展。中国生物医学工程杂志,2015;30(2):344 - 344。
黄志敏,梁志勇,李志华,李志华,杨志刚。急性呼吸窘迫综合征的免疫发病机制研究。安翻译医学2019;7:504。
沈艳,宋娟,王勇,陈震,张玲,于娟,朱东,钟敏。M2巨噬细胞促进脓毒症急性肺损伤肺内皮细胞再生。安翻译医学2019;7:142。
Shapouri-Moghaddam A, Mohammadian S, Vazini H, Taghadosi M, Esmaeili SA, Mardani F, Seifi B, Mohammadi A, Afshari JT, Sahebkar A.巨噬细胞的可塑性,极化和健康与疾病的功能。中国生物医学工程学报,2018;
莫里森TJ,杰克逊MV,坎宁安EK, Kissenpfennig A,麦考利DF,奥凯恩CM, Krasnodembskaya AD。在临床相关肺损伤模型中,间充质基质细胞通过细胞外囊泡线粒体转移调节巨噬细胞。美国呼吸急救医学杂志。2017;196:1275-86。
胡勇,秦超,郑刚,赖东,陶宏,张勇,邱刚,葛明,黄磊,陈磊,等。间充质干细胞培养的巨噬细胞改善lps诱导的全身反应。介质炎症。2016;2016:3735452。
Masterson C, Devaney J, Horie S, O 'Flynn L, Deedigan L, Elliman S, Barry F, O 'Brien T, O 'Toole D, Laffey JG。syndecan -2阳性,骨髓来源的人间充质基质细胞可减弱细菌诱导的急性肺损伤,并增强呼吸机诱导的大鼠肺损伤的缓解。麻醉学。2018;129:502-16。
Jackson MV, Morrison TJ, Doherty DF, McAuley DF, Matthay MA, Kissenpfennig A, O 'Kane CM, Krasnodembskaya AD通过隧道纳米管的线粒体转移是间充质干细胞在体外和体内ARDS模型中增强巨噬细胞吞噬的重要机制。干细胞。2016;34:2210-23。
黄晓霞,陈艳,黄晓霞,陈艳,等。间接急性肺损伤中浆细胞样树突状细胞对肺炎症和单核细胞募集的影响。Am J Pathol. 2010; 176:764-73。
李玲,董玲,赵东,高峰,闫娟。经典树突状细胞在脂多糖诱导的急性呼吸窘迫综合征小鼠急性肺炎症和损伤中的调控作用。国际分子医学杂志,2019;44:617-29。
李锐,邹霞,黄红,余艳,张辉,刘鹏,潘松,欧阳阳,尚勇。HMGB1/PI3K/Akt/mTOR信号通路通过调控树突状细胞的成熟和功能参与急性肺损伤的病理过程。前沿免疫。2020;11:1104。
Wheat WH, Chow L, Kurihara JN, Regan DP, Coy JW, Webb TL, Dow SW。间充质干细胞抑制犬树突状细胞活化/成熟和炎症细胞因子释放通过多种不同的生化途径发生。中国生物医学工程学报,2017;26:249-62。
张斌,刘荣,史东,刘霞,陈勇,窦霞,朱霞,陆超,梁伟,廖磊,等。间充质干细胞诱导成熟的树突状细胞形成新的jagged -2依赖性调节树突状细胞群。血。2009;113:46-57。
陈伟,王珊珊,向华,刘娟,张艳,周松,杜涛,单琳。人Wharton’S Jelly间充质干细胞微囊对肝细胞生长因子介导的急性肺损伤的改善作用。中国生物化学杂志,2019;
陆铮,常伟,孟S,徐欣,谢娟,郭峰,杨颖,邱宏,刘磊。间充质干细胞通过旁分泌肝细胞生长因子诱导树突状细胞免疫耐受缓解急性肺损伤。《干细胞研究》2019;10:372。
石昌昌,朱海燕,李辉,曾德龙,石晓林,张元宇,陆勇,凌丽娟,王春英,陈东峰。鱼腥草多糖通过调节肠-肺轴Th17/Treg细胞的平衡,对h1n1致急性肺损伤有治疗作用。中国生物医学杂志,2010;
王玲,石敏,仝玲,王娟,季松,毕娟,陈超,蒋娟,白超,周娟,宋艳。肺内间充质干细胞通过调节调节性T细胞和Th17细胞的平衡促进脂多糖诱导的急性肺损伤的修复。炎症。2019;42:199 - 210。
王玲,王鑫,童玲,王娟,窦敏,季松,毕杰,陈超,杨东,何辉,等。急性肺损伤的恢复可以通过调节调节性T细胞和Th17细胞来调节。中华免疫杂志。2018;39:e12715。
于志霞,季明思,闫娟,蔡勇,刘杰,杨海峰,李勇,金志春,郑建新。Th17/Treg细胞比值作为早期急性呼吸窘迫综合征的危险指标重症监护2015;19:82。
陈娟,张鑫,谢娟,薛敏,刘玲,杨艳,邱慧。TGFβ1在小鼠间充质干细胞中过表达通过影响lps诱导的ARDS小鼠Th17/Treg平衡改善肺部炎症。《干细胞研究》2020;11:311。
陈庆华,吴峰,刘林,陈海波,郑仁强,王海林,于丽兰。间充质干细胞在体外部分通过肝细胞生长因子调节Th17/Treg细胞平衡。《干细胞研究》2020;11:91。
Luz-Crawford P, Noël D, Fernandez X, Khoury M, Figueroa F, Carrión F, Jorgensen C, Djouad F.间充质干细胞通过PD-1途径抑制Th17分子程序。PLoS ONE。2012; 7: e45272。
黄艳,何强。抑制c-Src通过调节小穴蛋白1磷酸化和小穴介导的跨细胞通透性保护百草枯诱导的微血管内皮损伤。环境毒理学杂志,2017;52:62-8。
孟SS,郭伟峰,张晓文,常伟,彭峰,邱海波,杨艳。mTOR/STAT-3通路介导间充质干细胞分泌的肝细胞生长因子对脂多糖诱导的血管内皮屏障功能障碍和细胞凋亡的保护作用。中国生物医学工程学报,2019;
Pati S, Gerber MH, Menge TD, Wataha KA, Zhao Y, Baumgartner JA, Zhao J, Letourneau PA, Huby MP, Baer LA,等。骨髓源性间充质干细胞抑制失血性休克后肺部炎症和保护血管内皮完整性。PLoS ONE。2011; 6: e25171。
杨勇,陈庆华,刘爱尔,徐小鹏,韩俊杰,邱海波。在通过Rac1通路的脂多糖刺激下,msc分泌的HGF和VEGF在稳定内皮屏障功能中的协同作用。干细胞研究。2015;6:250。
韦尔LB,马修MA。急性呼吸窘迫综合征。中华医学杂志2000;342:1334-49。
Goolaerts A, Pellan-Randrianarison N, Larghero J, Vanneaux V, Uzunhan Y, Gille T, Dard N, Planès C, Matthay MA, Clerici C.间充质基质在急性肺泡损伤体外模型中恢复钠转运和保持上皮通透性。中国生物医学工程杂志。2014;30(2):975-985。
方X, AP Neyrinck, MA Matthay, Lee JW。异基因人间充质干细胞通过分泌血管生成素-1恢复培养的人肺泡II型细胞中上皮蛋白的通透性。中国生物医学工程学报。2010;
余华,王哲。心肌细胞来源的外泌体:生物学功能和潜在的治疗意义。前沿物理。2019;10:1049。
李春春,梁勇,苏志斌。msc来源的外泌体预防性治疗可减轻大鼠创伤性急性肺损伤。中国生物医学工程杂志。2019;37(2):374 - 374。
刘娟,陈涛,雷鹏,唐霞,黄萍。骨髓间充质干细胞释放的外泌体通过TLR4/NF-kappaB途径减轻肠缺血再灌注所致肺损伤。国际医学杂志2019;16:1238-44。
刘建军,杜军,程旭,张学忠,李勇,陈小林。来自人脐带间充质干细胞的外泌体miR-451可减轻烧伤诱导的急性肺损伤。中华医学杂志2019;82:895-901。
张欣,陈娟,薛敏,唐艳,徐娟,刘玲,黄艳,杨艳,邱宏,郭峰。间充质干细胞过表达p130/E2F4促进lps诱导ARDS小鼠肺泡上皮细胞损伤的修复。《干细胞研究》2019;10:74。
易鑫,魏鑫,吕红,安艳,李玲,陆鹏,杨艳,张强,易红,陈刚,过表达microrna -30b-3p的间充质干细胞外泌体通过抑制SAA3对脂多糖诱导的急性肺损伤有保护作用。Exp Cell res 2019;383:111454。
邓宏,吴林,刘明,朱林,陈勇,周辉,石霞,魏健,郑林,胡霞,等。骨髓间充质干细胞来源的外泌体通过抑制巨噬细胞的糖酵解调节巨噬细胞极化来减弱lps诱导的ARDS。冲击。2020;54:828。
Khan MM, Yang WL, Brenner M, Bolognese AC, Wang P.冷诱导rna结合蛋白(CIRP)通过诱导内质网应激引起脓毒症相关急性肺损伤。科学通报2017;7:41363。
李鹏鹏,王宝荣,李昌昌,陆翔,钱文伟,李玉军,金峰,穆德东。海水吸入可通过ROS生成和内质网应激途径诱导急性肺损伤。中华医学杂志,2018;41:2505-16。
曾敏,桑伟,陈松,陈锐,张辉,薛峰,李震,刘颖,龚颖,张宏,孔霞。4-PBA通过调节内质网应激和自噬抑制lps诱导的急性肺损伤模型炎症。毒理学杂志2017;271:26-37。
彭旭,李霞,李超,岳松,黄勇,黄鹏,程华,周勇,唐勇,刘伟,等。NMDA受体激活通过抑制ERK信号通路和旁分泌因子HGF抑制BMMSCs对博莱霉素诱导的肺上皮细胞损伤的保护作用。国际分子与分子医学杂志2019;44:227-39。
李永杰,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚。间充质干细胞通过PERK-Nrf2通路降低衰老小鼠内质网应激。Respirology。2020;25:417-26。
朱嘉佳、王淑云、叶春春、傅太华、傅友友、柯涛、赵敏敏、陈涛、蔡普军、傅玉生。通过沃顿果冻的人脐间充质干细胞异种移植逆转博莱霉素诱导的大鼠肺纤维化。开展。2019;9:6646 - 64。
Moroncini G, Paolini C, Orlando F, Capelli C, Grieco A, Tonnini C, Agarbati S, Mondini E, Saccomanno S, Goteri G,等。人脐带间充质间质细胞可预防免疫能力小鼠肺纤维化的发生。PLoS ONE。2018; 13: e0196048。
急性呼吸窘迫综合征:快速通道中的纤维化。胸腔。1998;53:815-7。
郑玉杰,朴云云,许景伟,洪树生。人脂肪干细胞对脂多糖诱导小鼠急性呼吸窘迫综合征的影响。安翻译医学2019;7:674。
Radwan SM, Ghoneim D, Salem M, Saeed M, Saleh Y, Elhamy M, Wael K, Shokair O, Wahdan SA。脂肪组织来源间充质干细胞对胺碘酮诱导的大鼠肺损伤的保护作用。应用生物化学,2020;191:1027。
董玲,李玲。lats2低表达骨髓源性间充质干细胞改善lps诱导的小鼠急性肺损伤。介质炎症。2019;2019:4851431。
李玲,董玲,张娟,高峰,惠娟,闫娟。Hippo信号下调的间充质干细胞减轻脂多糖诱导的急性呼吸窘迫综合征小鼠肺损伤。中国生物医学杂志。2019;43:441 - 52。
Wilson JG, Liu KD, zhuh, Caballero L, McMillan M, Fang X, Cosgrove K, Vojnik R, Calfee CS, Lee JW,等。间充质干细胞治疗ARDS: 1期临床试验《柳叶刀呼吸医学》2015;3:24-32。
Matthay MA, Calfee CS,卓h, Thompson BT, Wilson JG, Levitt JE, Rogers AJ, Gotts JE, Wiener-Kronish JP, Bajwa EK,等。异基因间充质基质细胞治疗中重度急性呼吸窘迫综合征(START研究):一项随机2a期安全性试验《柳叶刀呼吸医学》2019;7:154-62。
McIntyre LA, Stewart DJ, Mei SHJ, Courtman D, Watpool I, Granton J, Marshall J, Dos Santos C, Walley KR, Winston BW,等。细胞免疫疗法治疗感染性休克A期临床试验。Am J呼吸危重护理医学。2018;197:337-47。
陈杰,胡超,陈琳,唐琳,朱勇,徐鑫,陈琳,高红,陆霞,余玲,等。间充质干细胞治疗H7N9流感急性呼吸窘迫综合征的临床研究,为新冠肺炎治疗提供参考。工程(北京)。2020; 6:1153。
郑刚,黄玲,童红,舒青,胡艳,葛敏,邓凯,张玲,邹斌,程斌,徐娟。异基因脂肪源间充质干细胞治疗急性呼吸窘迫综合征的随机对照中试研究。呼吸决议2014;15:39。
de Castro LL, Lopes-Pacheco M, Weiss DJ, Cruz FF, Rocco PRM。间充质间质细胞免疫抑制特性的最新认识。J Mol医学(Berl)。2019; 97:605-18。
Masterson CH, Curley GF, Laffey JG。调节外源性骨髓间充质干细胞的分布和命运以增强治疗潜力:已知和未知。重症监护医学实验2019;7:41。
曲伟,王震,Hare JM, Bu G, Mallea JM, Pascual JM, Caplan AI, Kurtzberg J, Zubair AC, Kubrova E,等。细胞疗法降低COVID-19死亡率:急性呼吸窘迫综合征人类研究的系统综述和荟萃分析《干细胞转化医学》2020;9:1007。
Gupta A, Madhavan MV, Sehgal K, Nair N, Mahajan S, Sehrawat TS, Bikdeli B, Ahluwalia N, Ausiello JC, Wan EY,等。COVID-19的肺外表现。国际医学杂志2020;26:1017-32。
LopesPacheco M, Silva PL, Cruz FF, Battaglini D, Robba C, Pelosi P, Morales MM, Caruso Neves C, Rocco PRM。COVID-19多器官损伤的发病机制及潜在治疗策略前沿物理。2021;12:593223。
lister R, Pérez Marc G, Wappner D, Coviello S, Bianchi A, Braem V, Esteban I, Caballero MT, Wood C, Berrueta M,等。早期高滴度血浆治疗可预防老年人严重Covid-19。英国医学杂志。2021;384:610-8。
Joyner MJ, Carter RE, Senefeld JW, Klassen SA, Mills JR, Johnson PW, Theel ES, Wiggins CC, Bruno KA, Klompas AM,等。恢复期血浆抗体水平与Covid-19死亡风险英国医学杂志。2021;384:1015-27。
潘H, Peto R, Henao-Restrepo AM, Preziosi MP, Sathiyamoorthy V, Abdool Karim Q, Alejandria MM, Hernández García C, Kieny MP, Malekzadeh R,等。针对covid -19重新使用抗病毒药物的世卫组织团结试验中期结果英国医学杂志。2021;384:497-511。
Silva JD, Lopes-Pacheco M, Paz AHR, Cruz FF, Melo EB, de Oliveira MV, Xisto DG, Capelozzi VL, Morales MM, Pelosi P,等。来自骨髓、脂肪组织和肺组织的间充质干细胞在实验性急性呼吸窘迫综合征中不同程度地减轻肺和远端器官损伤。重症监护医学。2018;46:e132-40。
Xu AL, Rodriguez LA 2nd, Walker KP 3rd, Mohammadipoor A, Kamucheka RM, Cancio LC, Batchinsky AI, Antebi B.在自身血清中修复的间充质干细胞在急性呼吸窘迫综合征中表现出增强的治疗特性。干细胞转化医学2019;8:1092-106。
冷震,朱睿,侯伟,冯勇,杨勇,韩青,单刚,孟F,杜东,王松,等。ACE2(-)间充质干细胞移植改善COVID-19肺炎患者的预后。老龄病2020;11:216-28。
孟F,徐锐,王松,徐震,张超,李勇,杨涛,石林,付杰,姜涛,等。人脐带来源的间充质干细胞治疗COVID-19患者:一期临床试验信号传输目标Ther 2020;5:172。
石磊,黄辉,陆旭,闫旭,姜旭,徐瑞,王松,张超,袁旭,徐震,等。人脐带来源的间充质干细胞对COVID-19重症患者肺损伤的影响:一项随机、双盲、安慰剂对照的2期试验信号传输目标Ther. 2021;6:58。
彭红,龚涛,黄霞,孙霞,罗红,王伟,罗杰,罗波,陈勇,王鑫,等。恢复期血浆和间充质干细胞在COVID-19重症患者治疗中的协同作用:临床病例报告干细胞研究。2020;11:291。
Barnes BJ, Adrover JM, Baxter-Stoltzfus A, Borczuk A, Cools-Lartigue J, Crawford JM, Daßler-Plenker J, Guerci P, Huynh C, Knight JS,等。针对COVID-19的潜在驱动因素:中性粒细胞细胞外陷阱。中华实验医学杂志2020;217:e20200652。
Tomar B, Anders HJ, Desai J, Mulay SR.中性粒细胞和中性粒细胞细胞外陷阱驱动COVID-19的坏死性炎症。细胞。2020;9:1383。
De Biasi S, Meschiari M, Gibellini L, Bellinazzi C, Borella R, Fidanza L, Gozzi L, Iannone A, Lo Tartaro D, Mattioli M,等。COVID-19肺炎患者的T细胞活化、衰老、衰竭和向TH17倾斜。Nat Commun. 2020;11:3434。
Ranger A, Haji R, Kaczmarski R, Danga .白介素6阻断治疗一例控制不良的慢性髓系白血病患者的COVID-19相关细胞因子释放综合征Br J Haematol 2020;190:e128。
Sanchez-Cerrillo I, Landete P, Aldave B, Sanchez-Alonso S, SanchezAzofra A, maros - jimenez A, Avalos E, Alcaraz-Serna A, de Los Santos I, matu - albero T等:肺部活化单核细胞和树突状细胞亚群的差异再分配与COVID-19的严重程度相关。medRxiv.2020.
陈晓,赵斌,曲勇,陈勇,熊杰,冯勇,门冬,黄强,刘勇,杨波,等。COVID-19危重症患者血清SARS-CoV-2病毒载量(rnaemia)与白细胞介素6 (IL-6)水平显著升高密切相关。临床感染杂志2020;71:1937。
刘娟,李松,刘娟,梁波,王旭,王辉,李伟,童青,易娟,赵玲,等。SARS-CoV-2感染者外周血淋巴细胞反应和细胞因子谱的纵向特征EBioMedicine。2020; 55:102763。
刘林,毛青,褚s, Mounayar M, Abdi R, Fodor W, Padbury JF, De Paepe ME。人脐带组织来源的培养间充质基质细胞在新生儿肺损伤小鼠模型中的鼻内和腹腔输送。Am J Pathol. 2014; 184:3344-58。
朱辉,熊勇,夏勇,张荣,田东,王涛,戴杰,王林,姚辉,姜辉,等。人脐带间充质干细胞对急性肺损伤小鼠的治疗作用。科学通报2017;7:39889。
克鲁兹FF,洛可PRM。间充质干细胞治疗慢性肺部疾病的潜力。2020; 14:31-9。
古德曼RR,钟MK,戴维斯JE。简要回顾:利用间充质基质细胞治疗急性胰腺炎的挑战和机遇。生物技术,2020;42:107338。
贾克夫列维J,哈勒尔CR, Fellabaum C, Arsenijevic A, Jovicic N, Volarevic V.调节自噬在间充质干细胞治疗中的新方法。Biomed Pharmacother, 2018; 104:404-10。
Chailakhyan RK, Aver 'yanov AV, Zabozlaev FG, Sobolev PA, Sorokina AV, Akul 'shin DA, Gerasimov YV。多氧、低氧培养骨髓多功能间充质细胞及其条件培养基移植急性肺损伤模型的效果比较。公牛Exp生物医学。2014;157:138-42。
陈松,陈霞,吴霞,魏松,韩伟,林杰,康敏,陈琳。肝细胞生长因子修饰的间充质干细胞对大鼠缺血/再灌注急性肺损伤的改善作用。Gene Ther. 2017; 24:3-11。
王C, D Lv,张X,倪咱,太阳X,朱C Interleukin-10-overexpressing间充质基质细胞诱导炎症系统的一系列监管效果和促进的生存endotoxin-induced急性肺损伤小鼠模型。DNA细胞生物学,2018;37:53-61。
尹建强,朱军,安克鲁姆。用于治疗的间充质间质细胞的制造。生物工程学报。2019;3:90-104。
Tsukamoto S, Honoki K, Fujii H, Tohma Y, Kido A, Mori T, Tsujiuchi T, Tanaka Y.间充质干细胞促进大鼠骨肉瘤模型肿瘤移植和转移定植国际医学杂志,2012;40:163-9。
timer M, Letko-Khait N, Kotsofruk R, Benguigui M, Beyar-Katz O, Rachman-Tzemah C, Raviv Z, Bronshtein T, Machluf M, Shaked y。癌症决议2018;78:1253-65。
罗东,胡松,唐晨,刘刚。间充质干细胞促进A549肺腺癌细胞的细胞侵袭迁移和自噬诱导的上皮-间充质转化。细胞生物化学学报,2018;36:88-94。
Thompson M, Mei SHJ, Wolfe D, Champagne J, Fergusson D, Stewart DJ, Sullivan KJ, Doxtator E, Lalu M, English SW,等。血管内给药间充质间质细胞的细胞治疗仍然是安全的:一项最新的系统综述和荟萃分析。EClinicalMedicine。2020; 19:100249。
Tatsumi K, Ohashi K, Matsubara Y, Kohori A, Ohno T, Kakidachi H, Horii A, Kanegae K, Utoh R, Iwata T, Okano T.组织因子触发移植间充质干细胞促凝导致血栓栓塞。生物化学与生物物理学报,2013;
间充质间质细胞治疗的研究进展。Cytotherapy。2019;21:289 - 306。
确认
不适用。
资金
本工作得到河北省自然科学基金(C2020405008, H2020405023)、河北省高等学校科研项目(ZD2021005)、国家自然科学基金(81770492)和河北北方大学基础研究基金(JYT2019002, JYT2019006)的资助。
作者信息
作者及隶属关系
贡献
WW, WL和Z-AZ撰写并修改了手稿。Z-AZ, WW, C-YN, Z-GZ构思了手稿并对表格和图表进行了修改。LJ、SG和SH为论文的撰写提供了宝贵的建议。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
所有作者均已阅读并批准最终稿提交。我们确认稿件中的表格和数字是本文的原创。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
中国发布了Covid-19干细胞治疗标准化指南。链接是http://www.most.gov.cn/gnwkjdt/202003/t20200327_152617.htm.
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
王伟,雷伟,蒋,李。et al。间充质干细胞治疗急性呼吸窘迫综合征的机制揭示了Covid-19治疗的潜力。翻译医学杂志19, 198(2021)。https://doi.org/10.1186/s12967-021-02862-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-021-02862-x
关键字
- 间充质干细胞
- 新型冠状病毒肺炎
- 急性呼吸窘迫综合征