摘要
背景
内源性肽抑制CXCR4 (EPI-X4)是CXC趋化因子受体4 (CXCR4)的天然拮抗剂。EPI-X4是一种由酸性天冬氨酸蛋白酶(如组织蛋白酶D和e)从人血清白蛋白(HSA)中释放的16分子肽,由于人血清白蛋白(HSA)是一种重要的药用物质,我们询问了不同的制药HSA产品是否含有在制造过程中产生的EPI-X4,以及HSA是否可以作为组织蛋白酶的底物,尽管存在稳定剂(如辛酸)。
方法
分析了代表所有目前使用的分馏技术的八种药用HSA制剂。采用之前描述的特异性EPI-X4 ELISA进行定量;在组织蛋白酶存在或不存在的情况下,通过酸化体外产生EPI-X4,然后用ELISA定量。
结果
所有检测的HSA制剂均不含EPI-X4。HSA酸化不产生EPI-X4。将组织蛋白酶D和E添加到酸化的HSA中,在所有HSA制剂中产生高浓度的EPI-X4,在各个产品之间没有区别。
结论
医用HSA制剂本身不含EPI-X4,但在环境条件允许的情况下,会在体内补充其前体,可裂解为EPI-X4。
背景
白蛋白是血浆中含量最多的蛋白质(3.5-4.5 g/dL),占血浆总蛋白质含量的一半以上[1,2,3.,4].它由肝脏以相当恒定的9-12克/分升的量产生[1,3.,4],其血浆半衰期约为19天[4],分别由于胶体渗透压或某些激素和炎症细胞因子的丧失而适度上调和下调[1,2,5,6,7,8].白蛋白被认为是流体分布的主要调节剂和瘤压的主要产生者[1,2,4因为获得性低蛋白血症与动脉低血压、循环性休克、血管内容量衰竭和凹陷性水肿有关。因此,令人惊讶的是,原发性血浆钠素血症通常与血管内容积收缩或水肿无关[9],或任何异常的表型,就此而言[10].白蛋白非特异性地将酶、代谢物、毒素、激素和药物分子结合在其疏水口袋中,从而将它们穿梭到目标器官或肝脏中排泄[1,4].白蛋白在清除自由基、抑制血小板功能、限制毛细血管膜通透性和伴随蛋白质折叠等方面的作用尚不为人所知[1].
最近报道了白蛋白一种令人惊讶的全新功能:天冬氨酸酸性蛋白酶组织蛋白酶D和E特异性地切割白蛋白,释放一种高度保守的短肽,代表氨基酸408-423,被称为EPI-X4 (CXCR4内源性肽抑制剂)[11,12,13].EPI-X4是趋化因子受体CXCR4的特异性拮抗剂,CXCR4参与了大量的生理和病理生理状况[14].因此,CXCR4是一个很有前途的药物靶点,而CXCR4拮抗剂AMD3100 (Mozobil)已被批准作为非霍奇金淋巴瘤或多发性骨髓瘤患者自体移植的干细胞动员剂[15].与AMD3100一样,EPI-X4与CXCR4结合,并阻止其最重要的配体趋化因子CXCL12的相互作用,从而阻断CXCL12引发的反应,如细胞迁移[13,16].此外,synt, hetic EPI-X4在哮喘,特应性皮炎和Waldenström的大球蛋白血症小鼠模型中显示治疗作用,并动员小鼠的造血干细胞[13,17,18].EPI-X4可在体内产生,例如在慢性肾病患者的尿液中以µg/mL的浓度存在[13],但在人血浆中检测不到相关浓度的肽[19],其在体内的生理作用尚不清楚。结构上,HSA是一个含有585个氨基酸的单链蛋白,分子量为66.5 kDa [5].它由三个结构相似的域组成,每个域由两个相同的亚基组成。在x射线晶体学上,白蛋白呈心形,结构域I、II和III对应于“心脏”的左耳、尖端和右耳。EPI-X4是从结构域III的亚单元1 [3.,4,13].
HSA是由大量健康供体血浆制成的药用物质[1,3.],或采用冷酒精分馏工艺,或采用源自科恩法的改进方案,或采用各种柱式纯化方法[4].后者的优点是,其他感兴趣的血浆蛋白可以从贯穿中恢复。在几乎均质纯化后,医用HSA随后通过热处理(60°C 10-11小时)灭菌,这需要添加某些稳定剂,主要包括辛酸酯和n -乙酰-色氨酸,两者的浓度均为4 mM [20.],以减少氧化应激及限制变性或聚集[3.].药用HSA已获批准用于白蛋白损失的替代治疗,如全身毛细血管渗漏或肾病综合征,或一般蛋白质损失,如烧伤,以及无法产生足够白蛋白,如肝衰竭[1,3.,4].在经典替代疗法中,HSA以200 g/L的浓度快速静脉输注,目标至少是低正常血浆白蛋白浓度。
EPI-X4拮抗CXCR4的半最大浓度为~ 16µg/mL [13].因此,如果一种药品(200 g/L)中只有1%的HSA被加工成EPI-X4,这将对应于每mL HSA输液溶液中56µg的EPI-X4,这可能足以建立一个局部浓度的拮抗剂,阻断CXCR4的功能,并在体内引起药理学事件。此外,白蛋白也过量添加到重组蛋白中,以饱和主要包装材料或输液管中的非特异性蛋白结合位点,以及用于细胞治疗产品分散的盐酸缓冲液[21].鉴于HSA作为一种药用物质的重要性,我们在这里试图解决HSA的制造条件是否有利于EPI-X4的产生,而EPI-X4可能会对HSA的输注产生意想不到的影响。
材料与方法
试剂
购买了德国所有可用的许可治疗性HSA制剂(表1).分馏技术没有被个别制造商公开。除白蛋白和其他血浆蛋白的少量残留外,所有产品在近似等渗盐水溶液中均含有4mm辛酸和4mm色氨酸。所有的药物都被批准用于治疗低蛋白血症,无论其病因如何。
特异性夹心ELISA法检测EPI-X4
夹心ELISA法定量EPI-X4的方法已有报道[19,然后进行了一些小的修改。简而言之,ELISA板在包膜缓冲液(0.05 M碳酸氢钠、0.01%叠氮化钠和0.03% ddH BND-D)中包膜抗体(n端抗ALB(408-423)) 0.1µg/mL20 pH 9.6)在4°C过夜。第二天,用洗涤缓冲液(0.81 mM二水磷酸氢钠,0.15 mM磷酸二氢钾,13.6 mM氯化钠,0.27 mM氯化钾,0.05% (v/v) Tween20和0.0012% (w/v) BND-D在ddH中堵塞ELISA板20 pH 7.1)室温1小时。用洗涤缓冲液洗涤5次,然后直接将50 μ L/孔基质(10% (v/v)人血清,1mg /mL (w/v)白蛋白分数v无生物素(Carl Roth), 100 ng/mL (w/v) HSA(409-422)和100 ng/mL (w/v) HSA(407-424)在测定缓冲液中加入)加入板中。接下来,将50 μ L 1:10稀释系列的分析物和预稀释在测定缓冲液中的合成HSA(408-423)(作为标准品)添加到板中,然后使用50 μ L/孔生物素标记的针对ALB408-423 c端结构域的抗体作为检测抗体。反应在室温下在摇板器(450转/分钟)上进行2小时,然后用洗涤缓冲液再次洗涤3次。随后,将100 μ L/孔链霉亲和素标记的HRP(检测缓冲液中为200 ng/mL)添加到培养皿中,在相同条件下进一步孵育30分钟。去除链霉亲和素标记的HRP,在每孔(100 μ L/孔)添加TMB(3,3 ',5,5 ' -四甲基苄)底物之前,使用洗涤缓冲液再次洗涤5次,并再次在室温下450 rpm孵育20分钟。加入停止液(H2所以4)和光密度(OD)在450/650 nm处用ELISA阅读器测定。
HSA制剂中EPI-X4的蛋白水解生成
四种不同的HSA产品在0.2 M柠檬酸缓冲液pH 4中稀释至最终浓度为4mg /mL HSA,同时存在或不存在Cathepsin D (C8696, Sigma-Aldrich)和Cathepsin E (1294-AS-010;R&D Systems)(10µg/mL),在37°C下孵育4小时。接下来,将样品放在冰上以停止反应,然后在−20°C保存,直到使用EPI-X4特异性三明治ELISA分析。
统计分析
采用双因素方差分析(Two way ANOVA)和Tukey 's multiple comparison test比较不同组HSA产品中EPI-X4的浓度。使用GraphPad Prism V.9 (San Diego, CA)绘制图表并进行统计计算。假设p值< 0.05有统计学意义。
结果
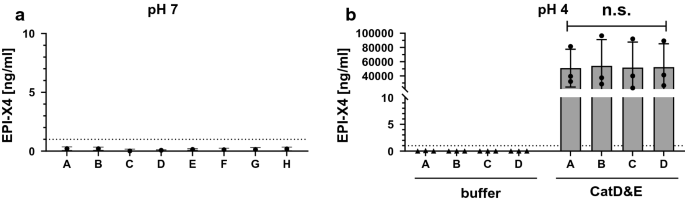
我们首先通过ELISA分析了每种HSA制剂中EPI-X4的存在[13,19,22].将一系列稀释的白蛋白样品添加到抗n -末端- epi - x4抗体包被的板上,然后用抗c -末端- epi - x4抗体标记,该抗体用酶标二抗检测。浓度插值到合成EPI-X4的标准曲线,检测下限为1 ng/mL。如图所示。1a,所有HSA药用浓度均不含EPI-X4。
由于人体血浆酸化会触发EPI-X4的产生[13],我们接下来研究了调整HSA制剂A-D (4 mg/mL)到pH 4并在37°C孵卵4小时是否会导致CXCR4拮抗剂的产生。如图所示。1b(左侧),EPI-X4未检测到。然而,酸化和添加Cathepsin D和E产生的EPI-X4药理学相关浓度为50-55µg/mL,在制剂A-D之间没有明显差异。考虑到EPI-X4的分子量(1.83 kDa)和HSA (66.5 kDa),以及试验中白蛋白的浓度(4 mg/mL),可以预期完全消化约110µg/mL时的理论EPI-X4浓度。因此,尽管存在稳定剂,组织蛋白酶对HSA制剂的消化仍导致近一半的白蛋白裂解。
讨论
EPI-X4是一种天然内源性白蛋白裂解产物,可拮抗CXCR4,可能在CXCR4信号通路中发挥重要的调控作用。作为一种药理化合物,EPI-X4表现为典型的CXCR4拮抗剂,在体外阻断CXCL12介导的信号通路和癌细胞迁移,并在体内动员干细胞[13,17,18].此外,EPI-X4还作为CXCR4的逆激动剂,下调了受体的固有信号活性[13].EPI-X4前体,人血清白蛋白,被用作许多适应症的药品,包括低蛋白血症和低血容量血症。药用HSA是从浓缩的人血浆中分离纯化的,用辛酸钠和乙酰色氨酸钠稳定,通常以20-100 g的剂量静脉注射。EPI-X4是否会在HSA的生产或储存过程中产生,这可能会导致CXCR4拮抗肽不良地应用到患者的血液中,这一研究从未进行过。因此,我们在这里分析了来自不同提供者的8种临床批准的HSA制剂中EPI-X4的存在。我们的分析显示,没有一个HSA样本含有EPI-X4,即使浓度很低,也不包括EPI-X4在输注过程中与HSA共同使用。
EPI-X4可通过酸化人体血浆产生与生理相关的浓度[13].我们在这里表明,白蛋白制剂的酸化不会导致EPI-X4的产生,这支持了先前的发现,即肽只能通过活性酶蛋白水解从白蛋白中释放[13].负责的是天冬氨酸蛋白酶,例如组织蛋白酶D和E,它们在酸性pH值下具有最佳活性[13].事实上,我们的研究表明,将这两种蛋白酶添加到酸化的HSA制剂中会产生高浓度的、药学相关的μ g/mL浓度的EPI-X4。重要的是,在分馏和热灭菌过程中为保护HSA而添加的稳定剂并不限制EPI-X4的生成。因此,在适当的环境条件下,注入的HSA会裂解成EPI-X4,从而使肽发挥正常的生理功能。
数据和材料的可用性
在这项研究中产生或分析的所有数据都包含在这篇发表的文章中。原始数据将根据要求提供。
参考文献
Mendez CM, McClain CJ, Marsano LS。白蛋白治疗的临床应用。中华儿科杂志,2005;20(3):314-20。
Doweiko JP, Nompleggi DJ。白蛋白在人体生理和病理生理中的作用。中华儿科杂志。1991;15(2):207-11。
危害S, Schildböck C, Hartmann J.从人血清白蛋白中去除稳定剂吸附剂和用于血液净化的透析。PLoS ONE。2018年,十三1。
Raoufinia R, Mota A, Keyhanvar N, Safari F,沙米希S, Abdolalizadeh J.白蛋白及其纯化方法综述。中国医药学报。2016;6(4):495-507。
马杰舒克P,达什CH,加斯科因EW。人白蛋白溶液的生产:一种持续发展的胶体。中华麻醉学杂志,2000;
Fanali G, di Masi A, Trezza V, Marino M, Fasano M, Ascenzi P.人血清白蛋白:从实验到临床。生物医学杂志,2012;33(3):209-90。
tsutsusumi T, Nakao K, Mitsuoka S, Hamasaki K, tsura S, Shima M,等。胶体渗透压对人肝癌细胞白蛋白和α胎蛋白基因表达的调控。胃肠病学。1993;104(1):256 - 62。
Pietrangelo A, Shafritz DA。培养肝癌细胞中肝细胞核转录因子1表达的稳态调控美国国家科学研究院。1994年,91(1):182 - 6。
本霍德,刘国强,刘国强。Über德国经济衰退与经济衰退的关系。入:考夫曼F,编辑。Sechzigster在。慕尼黑:J.F. Bergmann-Verlag;1954.630 - 4页。
白蛋白修饰小鼠对造血干细胞动员剂的反应。细胞。2019;9(1):1 - 11。
Buske C, Kirchhoff F, Münch J. CXCR4内源性拮抗剂EPI-X4。Oncotarget。2015;6(34):35137 - 8。
Zirafi O, Hermann PC, Münch J.人血清白蛋白的蛋白水解过程产生CXCR4内源性拮抗剂EPI-X4。中华生物医学杂志,2016;99(6):863-8。
吴晓峰,王晓峰,杨晓峰,杨晓峰,等。内源性CXCR4拮抗剂的发现和鉴定。细胞学报,2015;11(5):737-47。
Kawaguchi N,张婷婷,Nakanishi T. CXCR4参与正常和异常发育。细胞。2019;8(2):185。
De Clercq E. Mozobil®(Plerixafor, AMD3100)在获得美国食品和药物管理局批准10年后上市。红伞化学化学。2019;27:78。
Harms M, Gilg A, Ständker L, Beer AJ, Mayer B, Rasche V,等。基于微量滴度板的抗体竞争检测,以确定CXCR4配体的结合亲和力和血浆/血液稳定性。科学通报2020;10(1):1 - 13。
Kaiser LM, Harms M, Sauter D, Rawat VPS, Glitscher M, Hildt E,等。CXCR4拮抗剂EPI-X4靶向Waldenström的大球蛋白血症。癌症(巴塞尔)。2021; 13:826。
Harms M, Habib MMW, Nemska S, Nicolò A, Gilg A, Preising N,等。内源性CXCR4拮抗剂的优化衍生物可预防特应性皮炎和气道炎症。药物学报B. 2020
杨晓明,杨晓明,杨晓明,杨晓明,等。人血清白蛋白408-423酶联免疫吸附测定方法的研究。Münch中国生物化学。2015;1(476):29-35。
于MW, Finlayson JS。辛酸酯和乙酰色氨酸稳定人白蛋白的研究。中国社会科学。1984;47(1):28-40。
Christie M, Peritt D, Torres RM, Randolph TW, Carpenter JF。蛋白赋形剂在推动抗体对促红细胞生成素反应中的作用。中国药学杂志,2015;104(12):4041-55。
Müller杨丽娟,李世杰,李志强,李志强,Münch J. EPI-X4对晚期急性移植物抗宿主病(GvHD)诊断和预后的影响。《骨髓移植》2016;51(8):1137-9。
确认
我们感谢Daniela Krnavek出色的实验支持。
资金
J.M.感谢DFG (CRC1279)和Baden-Württemberg基金会的资助。由Projekt DEAL启动和组织的开放获取资金。
作者信息
作者及隶属关系
贡献
HB和JM构想了这项研究。AG, LRO和MH进行了测量和分析。AG, MH, HB和JM共同撰写了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
J.M.和M.H.拥有EPI-X4的相关知识产权。其他作者都没有任何声明。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
吉尔,A.,哈姆斯,M.,奥拉里,LR.。et al。人血清白蛋白制剂中CXCR4拮抗剂EPI-X4的缺失。翻译医学杂志19, 190(2021)。https://doi.org/10.1186/s12967-021-02859-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-021-02859-6
关键字
- 趋化因子受体CXCR4
- EPI-X4
- 人血清白蛋白