摘要
背景
西妥昔单抗已被批准用于野生型患者的一线治疗喀斯特转移性结直肠癌(CRC)。然而,西妥昔单抗作为结直肠癌单药治疗的疗效有限。此外,已知癌症患者的自然杀伤(NK)细胞功能严重减弱。本研究的目的是开发一种新的策略,以增强NK细胞介导的抗体依赖性细胞介导的细胞毒性(ADCC),联合西妥昔单抗对抗CRC细胞。
方法
用呼肠孤病毒刺激体外扩增NK细胞,联合西妥昔单抗对结直肠癌细胞进行呼肠孤病毒活化NK细胞介导的ADCC实验。研究呼肠孤病毒活化NK细胞与西妥昔单抗对DLD-1荷瘤小鼠的协同抗肿瘤作用。最后,研究人员通过在NK细胞中敲低toll样受体3 (TLR3)、化学阻断TLR3/dsRNA复合物以及抑制TLR3下游信号通路来探索呼肠孤病毒增强NK细胞毒性的机制。
结果
我们首先证实NK细胞暴露于呼肠孤病毒以剂量依赖的方式增强了它们的细胞毒性。然后,我们研究了呼肠孤病毒激活的NK细胞暴露于西妥昔单抗结合的CRC细胞是否比单药治疗表现出更大的抗肿瘤功效。与呼肠孤病毒激活的NK细胞共培养的CRC细胞系表明,与西妥昔单抗联合使用时,NK细胞毒性显著提高喀斯特突变状态或EGFR表达水平我们还发现呼肠孤病毒激活NK细胞,与西妥昔单抗联合使用,可显著增强抗肿瘤效果。最后,通过TLR3的敲低、TLR3/dsRNA复合物或TBK1/IKKε的抑制表明呼肠孤病毒对NK细胞的激活依赖于TLR3及其下游信号通路。
结论
该研究表明呼肠孤病毒激活的NK细胞与西妥昔单抗联合治疗可协同增强其抗肿瘤细胞毒性,为临床治疗CRC提供了强有力的候选策略。
背景
结直肠癌(CRC)是全球第三大常见癌症和第四大癌症相关死亡原因[1,2]。在过去的二十年中,CRC的治疗取得了重大进展,包括引入了奥西铂、伊立替康和靶向治疗性单克隆抗体(mAb),如西妥昔单抗[3.,4]。西妥昔单抗(Cetuximab)是一种靶向表皮生长因子受体(EGFR)的嵌合免疫球蛋白G1(IgG1)单抗,已被批准与FOLFIRI联合用于野生型患者的一线治疗喀斯特转移性结直肠癌[5]。西妥昔单抗特异性地与EGFR结合,阻断内源性EGFR配体,从而破坏EGFR驱动的信号传导,导致细胞周期阻滞和凋亡。除了西妥昔单抗的直接抗肿瘤作用外,来自小鼠模型和临床系列的体内证据表明,西妥昔单抗发挥抗肿瘤作用的部分原因是抗体依赖性细胞介导的细胞毒性(ADCC) [6,7]。ADCC是先天效应细胞免疫的一种机制,由IgG (Fcγ rs) Fc结构域的受体结合引发。FcγRs及其亚类在树突状细胞(dc)、单核细胞、巨噬细胞和自然杀伤细胞(NK)上表达。对于NK细胞,fc - γ riiia (CD16)对IgG1单抗的识别导致NK细胞脱颗粒、细胞因子分泌和细胞毒性增强[8,9]。然而,尽管西妥昔单抗具有多种作用机制,但对西妥昔单抗的反应是有限的:只有1 / 5的转移性结直肠癌患者对西妥昔单抗有反应[10]。因此,需要新的办法来加强其效力。为此,增加NK细胞对西妥昔单抗治疗的反应可能会潜在地增强ADCC在CRC治疗中的作用。
NK细胞是癌症免疫治疗的重要靶点,因为它们可以直接杀死肿瘤细胞,而无需事先致敏或主要组织相容性复合体(MHC)限制。NK细胞通过激活受体和抑制受体识别肿瘤细胞。活化的NK细胞通过释放细胞毒颗粒和促炎细胞因子直接杀死肿瘤或病毒感染的细胞。最近的研究表明,NK细胞表现出活性下降,分泌IFN-γ的NK细胞比例减少,CD16占主导地位暗/否定癌症病人的亚群[11,12]。此外,多篇报道发现癌症患者的NK细胞功能严重减弱[13]。程序性细胞死亡蛋白1(PD-1)或T细胞免疫球蛋白和粘蛋白结构域分子-3(Tim-3)在NK细胞上的表达增加可抑制NK细胞的细胞毒性并与不良预后相关[j]。14,15,16]。因此,广泛的研究探讨了不同的策略来增强NK细胞的细胞毒性,从而改善NK细胞免疫疗法的临床结果[17,18,19]。
在这里,在这项工作中,我们试图开发一种新的策略来增强NK细胞的细胞毒性,同时也改善西妥昔单抗介导的ADCC的效果。我们之前的研究发现呼肠孤病毒可以在体外直接激活新鲜NK细胞,并且装载呼肠孤病毒的NK细胞可以在中和抗体(nab)存在的情况下将呼肠孤病毒传递到肿瘤细胞[20.,21]。因此,我们假设西妥昔单抗联合呼肠孤病毒活化NK细胞可以提高其抗肿瘤效果。在这种策略中,首先用呼肠孤病毒激活NK细胞,然后将呼肠孤病毒激活的NK细胞暴露于西妥昔单抗结合的CRC细胞。使用不同的CRC细胞系喀斯特我们发现呼肠孤病毒直接增强NK细胞的细胞毒性,并且与西妥昔单抗联合使用,呼肠孤病毒激活的NK细胞在体外表现出更高的CRC细胞杀伤能力,不管喀斯特突变或EGFR表达的n using human colorectal tumor xenograft models, we also observed that reovirus activation of NK cells, in conjunction with cetuximab, provided significantly greater anti-tumor effects than either monotherapy. Finally, using Toll-like receptor 3 (TLR3) knockdown NK cells,chemical blockade of TLR3/double-stranded RNA (dsRNA) complex,and chemical inhibition of the TLR3 downstream pathway, we further determined that reovirus activation of NK cells is mediated in a TLR3 signaling pathway-dependent manner.These findings of synergistically enhanced NK cell anti-tumor activity provide a viable framework for improvement of clinical strategies against CRC.
材料与方法
细胞,病毒和试剂
小鼠成纤维细胞系L929、表达egfr的结直肠癌细胞系DLD-1 (喀斯特-突变体,EGFR培养基),Caco-2 (喀斯特-WT, EGFR高),HT-29 (喀斯特-WT, EGFR低)从中国体字培养收藏中心(CCTCC)获得[6]。所有细胞系在MEM和rpm -1640 (Hyclone)培养基中培养,培养基中添加10%胎牛血清(FBS, Gibco)、1%谷氨酰胺(Gibco)和1%青霉素/链霉素(Hyclone)。所有细胞在37°C, 5% CO2的潮湿环境中保持。从ATCC (VR-824)中获得呼肠孤病毒3型分离株。呼肠孤病毒在L929细胞中繁殖,并使用标准空斑测定方案进行滴定,以评估L929细胞。产生紫外线灭活的呼肠孤病毒。将PBS中的呼肠孤病毒暴露在紫外线(短波254 nm)下30分钟。通过L929细胞活力测定证实了紫外线诱导的呼肠孤病毒复制能力丧失。活呼肠孤病毒和紫外线灭活呼肠孤病毒在-80℃保存至使用。西妥昔单抗(鼠人嵌合抗egfr, IgG1)从百时美施贵宝公司获得。控制IgG1从Sigma-Aldrich购买。Bx795 (Sigma-Aldrich)用于抑制TBK/IKKε,TLR3/dsRNA复合物抑制剂购自Calbiochem。polyinosic:polycytidylic acid [Poly (I:C)] HMW来自InvivoGen。
体外NK细胞扩增
采用Ficoll-Paque Plus (GE healthcare)标准密度梯度离心分离健康人外周血单个核细胞(PBMCs)。如上所述,从pbmc中富集NK细胞。简而言之,5 × 106pbmc在添加1%自体血清和200 IU/mL rhIL-2 (PeproTech)的GT-T551 H3培养基(Takara Bio Inc.)中培养,与5 × 10共培养6辐照灭活K562-mbIL-21给料细胞(Lifeark)。每3-4天更换一次培养基,每周添加K562-mbIL-21。培养14-16天后收获NK细胞并评估纯度(NK细胞定义为CD3)−CD14−CD56+)(纯度达到95%以上)。NK细胞在液氮中冷冻保存至使用。为了尽量减少表型变化,所有NK细胞在初始冷冻日期后两个月内使用。
细胞毒性试验
使用细胞计数试剂盒-8 (CCK-8, Dojindo)评估NK细胞的细胞毒活性。简单地说,NK细胞在37°C水浴中解冻,使用前在GT-T551 H3培养基中洗涤两次。NK细胞在GT-T551 H3培养基中维持至少2小时,然后以2 × 10重悬6细胞/mL,用10个多重感染(MOI)呼肠呼肠病毒或1 μg/mL Poly(I:C)与Lipofectamine 3000 (Invitrogen)复配,在37℃、5% CO2条件下孵育12 h。预处理12 h后,NK细胞与靶肿瘤细胞(DLD-1、Caco-2和HT-29)以5:1的E:T比例在u底96孔板中37℃、5% CO2条件下孵育4 h。ADCC实验采用1 μg/mL西妥昔单抗或对照抗体IgG1孵育靶肿瘤细胞1 h,孵育后进行细胞毒性实验。在一些阻断实验中,呼肠呼病病毒或Poly(I:C)激活的NK细胞在加入NK细胞之前,用10 μM Bx795或10 μM TLR3/dsRNA复合物抑制剂在37℃和5% CO2下处理12小时。孵育4 h后,每孔取上清液10 μL,按厂家说明测定每孔450 nm处吸光度。所有的实验都做了三个重复。
sirna介导的基因敲低
为了降低TLR3的表达,我们在NK细胞中转染了针对TLR3的siRNA (siTLR3 no. 1)。337 ' - gcuugaugaggauuuaat -3'和5 ' - uuaaauccuacacaagctt -3',基因制药)或随机对照siRNA (5 ' - uucuccgaacguguucacgutt -3')。& 5 ' - acgugacacguucggagaat -3 ', Gene Pharma),使用Lipofectamine 3000转染试剂(Invitrogen,美国)进行指定的持续时间。通过qPCR和Western Blotting分析证实了TLR3的敲低效果。NK细胞与10个MOI呼肠呼肠病毒或1 μg/mL Poly(I:C)共孵育48 h后,与DLD-1细胞共培养12 h。
西方墨点法
在细胞裂解缓冲液中制备细胞裂解液。提取液采用SDS-PAGE (Invitrogen)和western blot进行分析。以下抗体在指定浓度下用于免疫印迹:TLR3(克隆D10F10;1:1,000;细胞信号技术;#6961)和β-肌动蛋白(克隆5B7;1:5,000; ImmunoWay;YM3028)。二抗为酶标驴抗兔IgG (H + L) (1:10 000;Biodragon; BF03008X). Antigen–antibody complexes were visualized by enhanced chemiluminescence (Bio-Rad). Western blots were quantified using ImageJ software (National Institutes of Health).
实时定量PCR
用Trizol试剂(TaKaRa)从细胞中提取总RNA,用iScript cDNA Synthesis Kit (BioRad)反转录成cDNA。采用SYBR Green实时荧光定量PCR法定量GZMH、GZMM、PRF1、TNF、TLR3、T3D、β-actin mRNA表达。在Bio-Rad CFX96系统上使用Premix Ex TaqTM (TaKaRa)进行实时PCR扩增。本研究使用的PCR引物(附加文件)1:表S1)购自三工生物科技(上海)有限公司。扩增通过在95°C下激活热启动DNA聚合酶30 s,然后在95°C下5 s和60°C下45 s进行40个循环。数据采用Bio-Rad CFX管理软件v.2.1, ΔΔCT方法计算,β-actin归一化后以相对量表示。
ELISA
对于某些实验,收集上清液并在- 80°C保存至使用时间。采用Human IFN-γ定量因子ELISA Kit (R&D Systems)、Human TNF-α定量因子ELISA Kit (R&D Systems)和perforin Human ELISA Kit (Abcam)检测上清液中IFN-γ、TNF-α和穿孔素的水平。
肿瘤移植与治疗
本研究中进行的所有动物实验均经中国贵州省贵阳市贵州医科大学伦理委员会批准。5 ~ 6周龄雌性胸腺性BALB/cν/ν小鼠由北京HFK生物科技有限公司提供,饲养于贵州医科大学动物实验中心。DLD-1细胞(2 × 106)在左侧植入s.c。肿瘤达到~ 50mm后3.第10天,将小鼠分为4组。小鼠静脉注射磷酸缓冲盐水(PBS, 100 μL)或用10 MOI呼肠孤病毒单药(Reo-NK, 1 × 10)预处理的NK细胞7细胞),或腹腔注射西妥昔单抗200 μg单药,或连续静脉注射1 × 107Reo-NK在腹腔注射西妥昔单抗前12小时,剂量与单药治疗组相同。给药3周。每周一次用卡尺测量肿瘤大小,计算为长×宽×高。第26天处死小鼠。该体内模型每组3只小鼠,每组5只小鼠重复。取每只小鼠的肿瘤、肝脏和肾脏,然后对肿瘤进行qPCR分析。肝、肾切片按说明书进行苏木精、伊红染色(H&E)。
流式细胞术免疫分型
NK细胞染色使用以下抗体:抗cd3(克隆:UCHT1),抗cd56(克隆:memm -188),抗cd69(克隆:FN50)均来自BioLegend;抗tlr3(克隆:TLR3.7, Invitrogen)。FITC-IgG2b, κ同型(BD Biosciences)作为同型对照。所有细胞样品用抗cd16 /32抗体预孵育以阻断非特异性结合。在fc受体阻断之后。用冷FACS缓冲液(PBS中添加2% FBS和0.1%叠氮化钠)洗涤细胞一次。室温下用表面染色抗体对细胞进行30min染色。使用Cytofix/Cytoperm Kit (BD Biosciences)进行TLR-3细胞内染色。在FC500流式细胞仪(Beckman Coulter Inc.)上收集染色细胞,使用Flowjo软件分析数据。
统计分析
采用GraphPad Prism version 8软件进行统计分析。对于正态分布变量,两组间比较采用参数Student’st检验;采用单因素方差分析(ANOVA)进行多组比较。显著性差异定义为:*p< 0.05, **p< 0.01, ***p< 0.001。
结果
呼肠孤病毒刺激增强NK细胞介导的细胞毒性
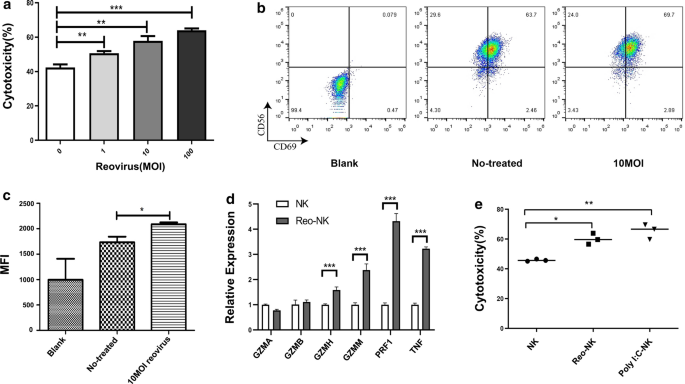
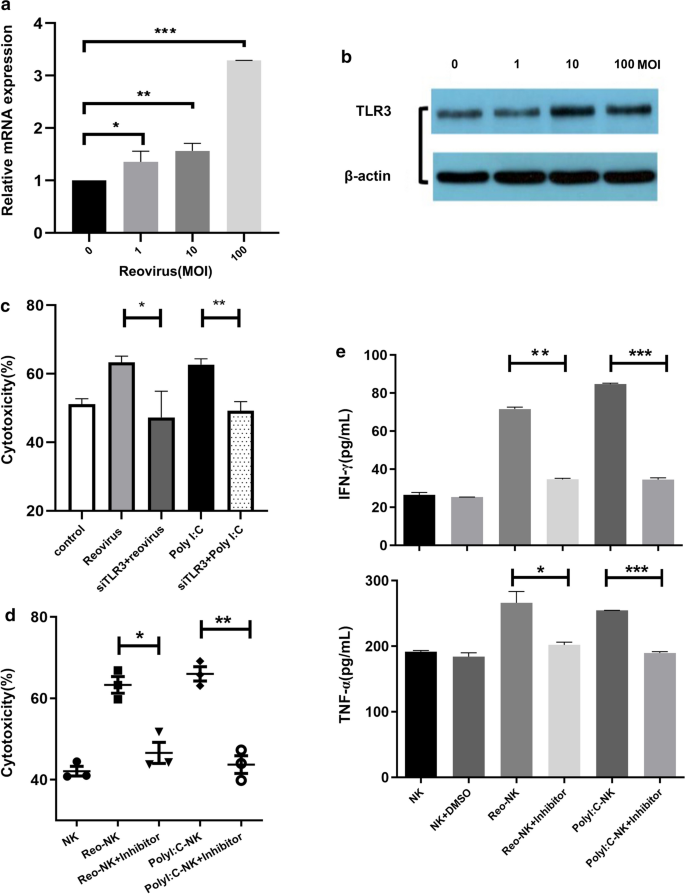
鉴于先前的研究发现NK细胞可以在没有事先暴露的情况下溶解肿瘤细胞,并且通过Poly(I:C), IL-2或IL-15预处理可以增强NK细胞的细胞毒性[22,23],因此,我们使用体外扩增NK细胞来评估呼肠孤病毒介导激活后的细胞毒性。的results of NK cell cytotoxicity analysis showed that stimulation with different titers of reovirus and subsequent co-culture with DLD-1 target cells at a 5:1 effector-to-target-cell (E:T) ratio enhanced NK cell cytotoxicity in a dose-dependent manner (Fig.1a).由于CD69是NK细胞活化的标记物,我们也通过流式细胞术评估了它们的活化,证实了CD69在呼肠孤病毒刺激下被上调(图2)。1b, c).穿孔素(PRF1)和颗粒酶(如GZMA, GZMB, GZMM和GZMH)代表NK细胞释放的两种不同类型的细胞毒性蛋白。此外,TNF-α已被证明与IFN-γ协同作用,促进NK细胞的细胞毒性。我们应用qPCR分析发现,呼肠病毒10 MOI作用NK细胞12 h后,GZMH、GZMM、PRF1和TNF的表达均上调(图2)。1d)。
Poly(I:C)是一种模拟病毒dsRNA的合成配体,在先前的研究中显示可以增加NK细胞的细胞毒性[24,25]。根据这些发现,我们接下来测试了脂质体包装Poly(I:C)对NK细胞的影响。NK细胞分别用10个MOI呼肠病毒或1 μg/mL Poly(I:C)处理12 h后,与DLD-1细胞共培养。我们发现,10个MOI呼肠孤病毒处理后NK细胞的细胞毒性显著增加(60.10±3.67,n = 3);p< 0.05)或者lipofectamine-Poly(我:C)(65.38±5.05,n = 3,p(45.84±0.72,n = 3)。1e).由于呼肠孤病毒具有双链RNA基因组,这表明呼肠孤病毒以与Poly(I:C)相似的方式激活NK细胞。综上所述,这些结果表明NK细胞的细胞毒性可以通过暴露于呼肠孤病毒而增强。
呼肠孤病毒对NK细胞的影响。一个NK细胞在不含或存在1、10或100 MOI呼肠孤病毒的条件下于37℃孵育12 h,以ddd -1细胞为靶细胞。以5:1的E:T比对靶细胞进行CCK-8测定4 h时细胞毒活性。所有样品均为三份,这些数据代表了三个独立的实验。(* *p< 0.01, ***p< 0.001)。b有代表性的流式细胞术图显示CD69在受10个MOI呼肠孤病毒刺激或未刺激的NK细胞上表达12小时。c三个独立实验的汇编数据(平均值±SEM)显示CD69的平均荧光强度(MFI),dqPCR检测暴露于10个MOI呼肠孤病毒或单独培养基12 h后NK细胞中GZMA、GZMB、GZMH、GZMM、PRF1和TNF的相对表达量(对照;NK)。qPCR实验2次,每个样品3个技术重复。数据为平均值±SD (***)p< 0.001)。eNK细胞1 × 10孵育6细胞/mL在单独培养基或10个MOI呼肠孤病毒中孵育12小时;用Lipofectamine用1 μg/mL Poly(I:C)转染NK细胞,同样培养12 h,将不同条件下刺激的NK细胞与DLD-1细胞按5:1的E:T比例共培养4 h。CCK-8法检测NK细胞毒性。上面显示的数据是从三个独立实验中选出的具有代表性的分析。(*p< 0.05, **p< 0.01)
刺激呼肠孤病毒激活的NK细胞增强西妥昔单抗介导的针对结直肠癌细胞的ADCC
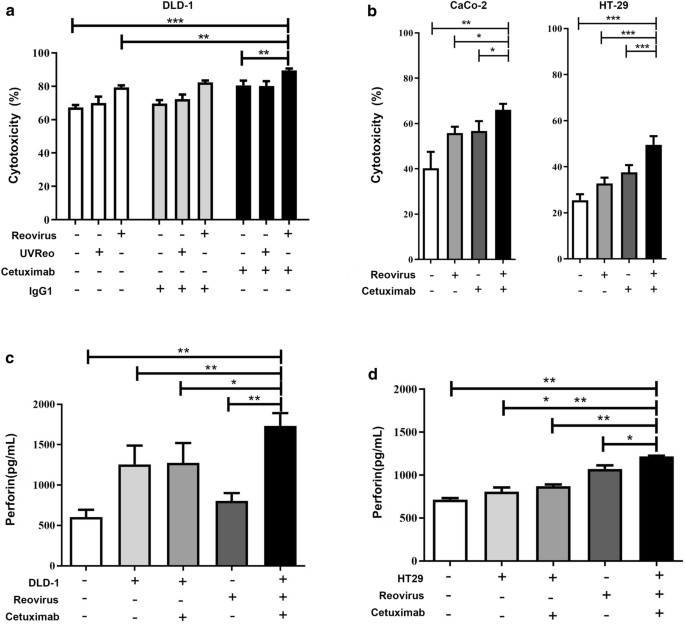
既往研究报道西妥昔单抗可作为连接NK细胞和CRC细胞的桥梁,触发ADCC,从而杀死结直肠癌细胞[8,26]。因此,促进NK细胞毒性可增强西妥昔单抗介导的ADCC作用。此外,呼肠孤病毒增强NK细胞毒性的能力使其成为联合治疗策略(如与西妥昔单抗)的理想候选者。为了检验呼肠孤病毒激活NK细胞是否也能增强对表达egfr的结直肠癌细胞的ADCC,我们使用体外扩增NK细胞,用10 MOI呼肠孤病毒激活12小时,对同样用西妥昔单抗治疗的结直肠癌细胞进行ADCC检测。DLD-1 (喀斯特-突变体,EGFR培养基),Caco-2 (喀斯特-WT, EGFR高),HT-29 (喀斯特-WT, EGFR低)与NK细胞以5:1的E:T比例孵育[6],我们发现NK细胞可以有效地杀死DLD-1(图2)。2a),以及Caco-2和HT-29(图2)。2B)靶细胞。此外,10 MOI呼肠孤病毒激活后NK细胞的细胞毒性增加,呼肠孤病毒激活的NK细胞在西妥昔单抗联合治疗后表现出增强的ADCC,表明肿瘤细胞活力降低。结直肠癌细胞对呼肠孤病毒激活的NK细胞杀伤均高度敏感喀斯特基因型或EGFR表达水平,呼肠孤病毒进一步增强nk细胞对西妥昔单抗包被结直肠癌细胞的细胞毒性(图2)。2a、b)。
由于NK细胞的细胞毒性是由主要效应分子穿孔素介导的,穿孔素在靶细胞上形成气孔,促进诱导凋亡的颗粒酶进入,因此我们假设呼肠孤病毒增强和启动NK细胞功能的一种机制是通过增加NK细胞的穿孔素释放。ELISA检测支持了这一假设,事实上,呼肠孤病毒激活的NK细胞使用西妥昔单抗对DLD-1和HT-29细胞释放的穿孔素水平显著提高(图2)。2综上所述,这些数据表明呼肠孤病毒刺激可增强NK细胞介导的ADCC对结直肠癌细胞的杀伤作用,并且在与西妥昔单抗联合治疗时具有协同作用。
呼肠孤病毒激活的NK细胞在体内增强了西妥昔单抗对kras突变肿瘤的抗肿瘤活性
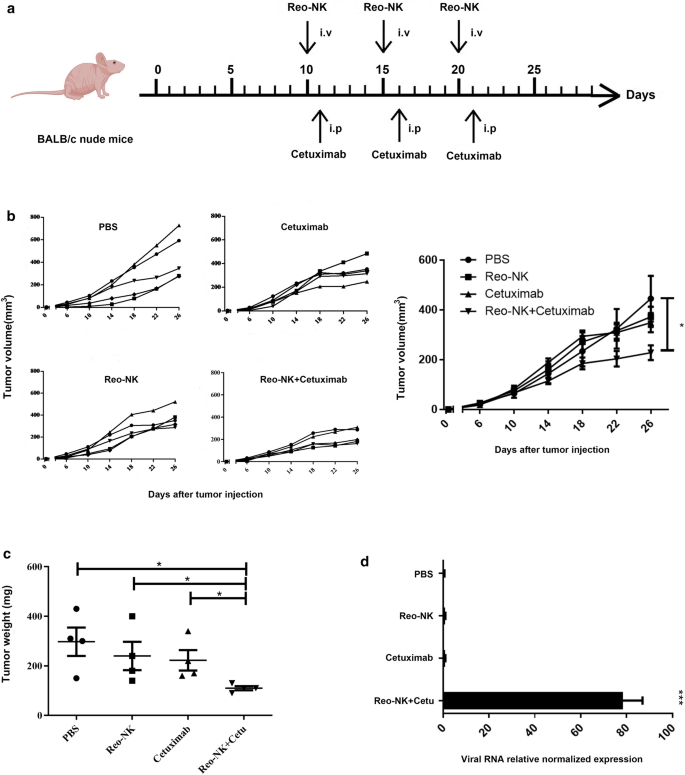
由于西妥昔单抗与呼肠孤病毒激活的NK细胞联合使用导致体外结直肠癌细胞溶解增加,我们接下来使用人类结直肠癌异种移植模型评估了这种联合治疗的疗效。将扩增的NK细胞用10个MOI呼肠孤病毒(Reo-NK)激活,然后转移到荷瘤小鼠体内,或在转移后1天每只小鼠腹腔注射200 μg西妥昔单抗,或呼肠孤病毒激活的NK细胞与西妥昔单抗联合使用。给药3周(图3)。3.a).异种移植瘤生长曲线在第三次治疗后肿瘤生长明显受限。第26天,我们观察到联合治疗显著抑制肿瘤生长(227.8±65.76 mm)3.,p呼肠孤病毒激活NK细胞(371.9±91.12mm)3.)和西妥昔单抗(348.1±86.30 mm)3.)也均显示出抑制肿瘤生长的作用(图2)。3.b)与PBS对照(444.8±204.1 mm)比较3.).我们还对每组的肿瘤重量进行了评估,结果证实,与单独治疗相比,联合治疗显著抑制了裸鼠的肿瘤生长(图5)。3.c).考虑到Reo-NK和西妥昔单抗联合治疗对局部DLD-1肿瘤具有较强的抗肿瘤作用,我们下一步试图确定这种疗效是否与呼肠孤病毒裂解肿瘤细胞有关。qPCR结果显示,呼肠孤病毒在西妥昔单抗和呼肠孤病毒激活的NK细胞治疗的肿瘤组织中均可显著检测到呼肠孤病毒复制,而在单独治疗呼肠孤病毒激活的NK细胞的肿瘤组织中未检测到该病毒。3.D, p < 0.001)。这些结果表明,西妥昔单抗的活性可能通过介导病毒从NK细胞转移到肿瘤细胞,从而使病毒在肿瘤细胞中复制和裂解。
呼肠孤病毒活化NK细胞和西妥昔单抗在DLD-1荷瘤小鼠体内的协同抗肿瘤作用。BALB/c裸鼠皮下注射2 × 106DLD-1细胞。一个肿瘤接种后第10天,小鼠接种DLD-1后静脉注射PBS或1 × 107呼肠孤病毒活化NK细胞(Reo-NK)或200 μg西妥昔单抗腹腔单药治疗第11天,或序贯静脉注射1 × 107Reo-NK在西妥昔单抗腹腔注射前12小时与单药治疗组相同。每次注射每周重复3次(每组n = 5)。b随时间监测肿瘤体积,计算各组平均肿瘤体积±SD(右)。*p与对照组比较< 0.05。c各组肿瘤重量。*p< 0.05。d肿瘤组织中呼肠孤病毒相关基因表达水平的qPCR分析。的β肌动蛋白吉恩被用作内参。采用ΔΔCt方法计算相对表达式。数据代表平均值±SEM (n = 3)。* * *p< 0.001
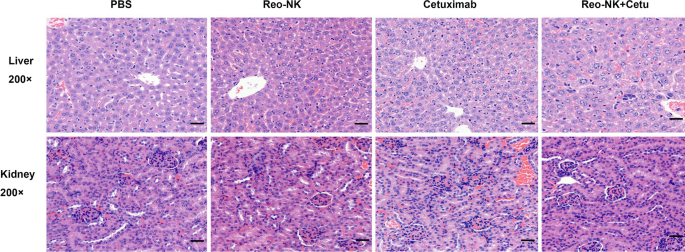
联合用药的副作用或毒副作用一直是临床应用中关注的问题。用H&E染色法研究呼肠孤病毒活化NK细胞联合西妥昔单抗的毒副作用。第26天取肝、肾,进行H&E染色。结果显示,小鼠肝、肾无毒性病理改变(图2)。4).
TLR3在NK细胞中感知呼肠孤病毒
研究呼肠孤病毒增强NK细胞毒性的机制。我们首先确定了哪个受体参与呼肠孤病毒诱导的NK细胞活化。基于我们之前的证据,呼肠孤病毒激活NK细胞的机制明显类似于Poly(I:C),因此我们将重点放在呼肠孤病毒的dsRNA基因组上。TLR3被锚定在内体膜上以识别胞外质dsRNA,如Poly(I:C)。我们推断呼肠孤病毒可以感染NK细胞,从而将dsRNA传递到细胞内部,随后激活TLR3,类似于脂质体包装Poly(I:C)。为了验证这一假设,我们首先测定了NK细胞中TLR3的mRNA和蛋白表达水平,发现呼肠孤病毒给药后NK细胞中TLR3 mRNA和蛋白水平均升高(图2)。5细胞内染色和流式细胞术也证实了TLR3的表达,显示呼肠孤病毒处理的NK细胞中TLR3略有增加(附加文件)2:图S1),这一发现也与Western blotting的结果一致。
NK细胞对呼肠孤病毒的应答需要TLR3。用1、10或100个MOI呼肠孤病毒刺激NK细胞12小时。未处理的NK细胞作为对照。一个qPCR检测NK细胞相对于对照细胞TLR3基因表达的折叠变化。bNK细胞TLR3表达的Western blot分析。c用siTLR3转染NK细胞,然后用10个MOI呼肠病毒或1 μg/mL Poly(I:C)刺激敲低NK细胞12 h, CCK-8法检测对照组和敲低NK细胞对DLD-1细胞的细胞毒性。d在10 μM TLR3/dsRNA复合物抑制剂存在或不存在的情况下,用10个MOI呼肠病毒或1 μg/mL Poly(I:C)激活NK细胞12 h, CCK-8法检测化学抑制NK细胞和对照NK细胞对DLD-1细胞的细胞毒性。eELISA法测定培养上清中TNF-α和IFN-γ水平。误差条表示平均值±SD。*p< 0.05, **p< 0.01, ***p< 0.001
为了进一步证实TLR3可能参与呼肠孤病毒诱导的NK细胞活化,我们使用siRNA靶向敲低呼肠孤病毒激活的NK细胞中TLR3的表达(附加文件)3.:图S2)。然后我们发现TLR3敲低显著逆转呼肠孤病毒或聚(I:C)诱导的细胞毒性(图2)。5c),而阴性对照NK细胞对呼肠孤病毒激活仍有反应。然后,我们使用TLR3/dsRNA复合物抑制剂(一种dsRNA与TLR3结合的竞争性抑制剂)来确认TLR3/dsRNA结合在呼肠孤病毒介导的NK细胞活化中的作用。实验结果表明,该抑制剂显著降低呼肠孤病毒和聚(I:C)增强的细胞毒性(图2)。5d)。此外,用10 MOI呼肠孤病毒或Poly(I:C)刺激24小时后,TNF-α和IFN-γ的释放也显著诱导,但用TLR3/dsRNA复合物抑制剂治疗后,TNF-α和IFN-γ的释放减少(图3)。5e).综上所述,这些结果表明TLR3是呼肠孤病毒调节NK细胞活化和功能的主要受体。
TBK/IKKε介导NK细胞对呼肠孤病毒的应答
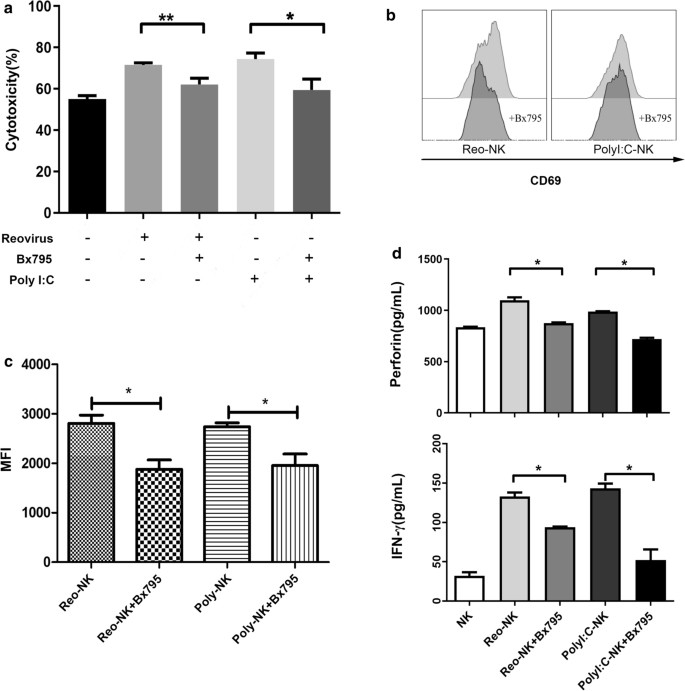
为了进一步阐明依赖TLR3的呼肠孤病毒激活NK细胞的途径,我们检测了阻断TLR3信号通路中的下游效应分子TBK1/IKKε的效果。为此,NK细胞与10个MOI呼肠孤病毒在TBK1/IKKε小分子抑制剂Bx795存在下孵育12小时。我们发现Bx795抑制呼肠孤病毒和Poly(I:C)增强NK细胞的细胞毒性(图2)。6a)。此外,Bx795处理后,NK细胞上CD69的表达也同样下降(图2)。6b, c)。此外,我们观察到穿孔素分泌在暴露于10 MOI呼肠酶病毒或1 μg/mL Poly(I: c)时增加,但在Bx795处理时减少,并且TBK1/IKKε阻断后NK细胞的IFN-γ分泌也减少(图1)。6d).这些结果累积表明,对呼肠孤病毒的tlr3依赖性应答是由TBK1/IKKε信号通路介导的。
讨论
溶瘤病毒(OV)是一类很有前途的抗癌治疗药物,它可以选择性地感染、复制和杀死肿瘤细胞。癌细胞对OV感染的独特易感性是伴随肿瘤发生的免疫反应缺陷和异常细胞信号传导的结果[27,28,29]。在内化之后,溶瘤病毒劫持细胞的转录和翻译机制,并通过各种坏死、凋亡和免疫介导的途径触发细胞死亡。呼肠孤病毒是一种非包膜dsRNA病毒,优先在喀斯特突变细胞。鉴于呼肠孤病毒具有特异性靶向和杀死肿瘤细胞的这种有趣且可能极其有用的特性,因此,在世界范围内的许多临床试验中,呼肠孤病毒已被评估为一种治疗药物[30.,31]。例如,目前正在进行一项I期CRC临床试验,以测试溶瘤呼肠孤病毒联合化疗的疗效(NCT01274624) [32]。除了直接溶瘤外,最近的发现还表明呼肠孤病毒感染的肿瘤细胞释放的抗原能够诱导有效的抗肿瘤免疫,这可能是病毒治疗效果的关键[33,34,35]。
在这项研究中,我们证明体外扩增的NK细胞可以被呼肠孤病毒直接激活。呼肠孤病毒激活的NK细胞对不同的人结直肠癌细胞系显示出强烈增强的细胞毒性,无论EGFR的表达水平和表达水平如何喀斯特突变状态。此外,呼肠孤病毒暴露导致NK激活标志物CD69的显著上调以及穿孔素、颗粒酶和TNF的转录诱导。先前的研究表明呼肠孤病毒优先在细胞内复制并诱导细胞凋亡喀斯特西妥昔单抗介导的ADCC活性与EGFR的表达水平相关。野生型喀斯特或低EGFR表达的肿瘤细胞因此可能对呼肠孤病毒或西妥昔单抗介导的ADCC表现出更高的抗性[6,36,37]。在这项研究中,我们观察到喀斯特突变体,喀斯特-WT CRC细胞系对呼肠孤病毒激活的NK细胞杀伤表现出相似的敏感性,此外,EGFR高表达和低表达的肿瘤细胞对西妥昔单抗诱导的ADCC同样敏感,从而克服了单药治疗的这些障碍。呼肠孤病毒激活NK细胞与西妥昔单抗联合使用,因此提供了一种通用的策略来规避肿瘤耐药,可以修改以克服肿瘤对其他肿瘤靶向治疗的耐药。
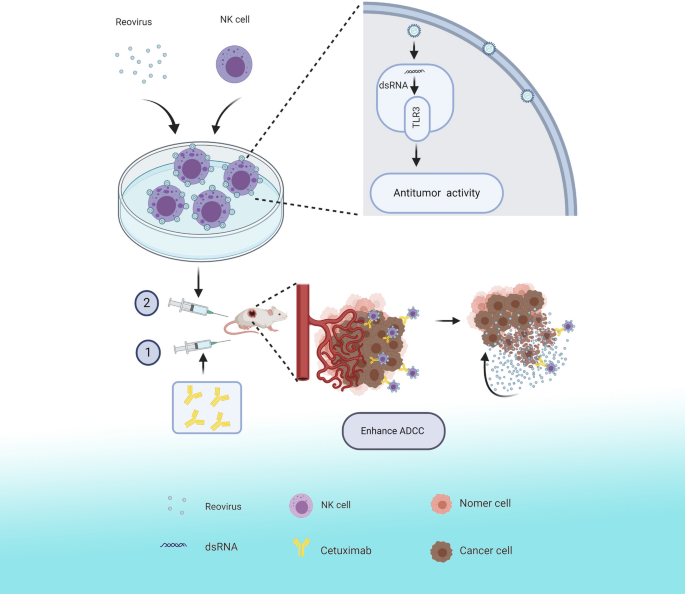
如上所述,呼肠孤病毒目前正在许多临床试验中作为溶瘤剂进行评估。不幸的是,呼肠孤病毒在环境中无处不在,大多数成年人由于先前接触或静脉注射治疗而具有nab [38]。因此,呼肠孤病毒治疗是严重削弱nab如果给药系统。然而,先前的研究表明呼肠孤病毒可以通过携带在pbmc或dc上而免受nab的攻击,而pbmc或dc也可以将呼肠孤病毒运送到肿瘤部位[39]。因此,呼肠孤病毒联合细胞毒性适应性细胞疗法作为一种抗癌治疗策略显示出相当大的前景[40,41]。在之前的工作中,我们已经证明细胞因子诱导的杀伤细胞(CIK)或体外扩增NK细胞可以作为保护性递送载体携带呼肠孤病毒到肿瘤,避免抗体中和[21,42]。此外,转染呼肠孤病毒后,CIK细胞的细胞毒性增强[43]。在本研究中,组合策略可以总结如下(图2)。7):对体外扩增的NK细胞进行预处理并装载呼肠孤病毒,随后激活NK细胞并增强其细胞毒性。我们的数据进一步表明,当与西妥昔单抗联合使用时,装载呼肠孤病毒的NK细胞能够将活性呼肠孤病毒沉积到肿瘤部位。一旦与装载呼肠孤病毒的NK细胞接触,西妥昔单抗可能作为促进呼肠孤病毒向肿瘤细胞递送的桥梁。
尽管先前的体外研究表明,呼肠孤病毒可以激活pbmc内的NK细胞,导致NK抗白血病活性增加,这表明呼肠孤病毒实际上激活了dc或单核细胞,而单核细胞又激活了NK细胞[44,45]。此外,一项结直肠癌临床试验的结果也表明,呼肠孤病毒介导的人体内NK细胞活性的增加可能是由于NK细胞与呼肠孤病毒激活的dc之间的相互作用[46]。这与我们的数据的差异可能是由于实验条件的差异。首先,我们使用高度纯化、新鲜、体外扩增的NK细胞(> 95%)代替pbmc。其次,我们用不同滴度的呼肠孤病毒刺激NK细胞,发现呼肠孤病毒刺激以剂量依赖的方式增强NK细胞的细胞毒性。最后,呼肠孤病毒激活的NK细胞的细胞毒性在TLR3敲除或阻断TLR3信号通路后降低,我们推测这是呼肠孤病毒激活依赖TLR3的NK细胞的机制。
TLR3是一种识别dsRNA并对其作出反应的模式识别受体。我们发现,在未受刺激的NK细胞中,TLR3的表达只有中等水平,这与Schmidt等人报道的结果一致。[24]。使用TLR3激动剂增强NK细胞的细胞毒性已经得到了很好的描述[47,48]。Poly(I:C)是一种合成的dsRNA类似物,在体外和体内一直用于诱导TLR3信号传导。既往研究表明,NK细胞可直接识别Poly(I:C)并对其作出反应,从而刺激NK细胞介导的细胞毒性,导致TLR3和活化标记CD69的上调[24]。NK细胞通过产生IFN-γ来响应Poly(I:C)。在这项研究中,我们证实呼肠孤病毒增强了NK细胞的细胞毒性,我们发现呼肠孤病毒刺激增加了NK细胞中TLR3转录物和蛋白水平。此外,我们的研究结果表明,TLR3的敲低显著降低了呼肠孤病毒激活的NK细胞的细胞毒性,而TLR3/dsRNA复合物的抑制剂(阻止dsRNA与TLR3结合)也显著降低了呼肠孤病毒激活的NK细胞的细胞毒性和细胞因子(TNF-α和IFN-γ)的释放。与这些结果一致,我们发现在呼肠病毒激活的NK细胞中,用Bx795治疗后,细胞毒性、CD69表达、穿孔素和IFN-γ分泌都降低了。Bx795是TBK1/IKKε的抑制剂,在TLR3的信号通路中起着共同的中介作用。实验采用Poly(I:C)作为阳性对照。因此,这些结果表明TLR3对于NK细胞对Poly(I:C)和呼肠孤病毒的反应至关重要,并且呼肠孤病毒通过可能与Poly(I:C)相似的机制促进NK细胞的激活。
结论
总之,本研究提供了呼肠孤病毒体外扩增NK细胞活化用于结直肠癌治疗的见解。我们证明呼肠孤病毒以tlr -3依赖的方式直接增强NK细胞对结直肠癌细胞的细胞毒性。NK细胞作为载体将呼肠孤病毒转移到肿瘤部位,西妥昔单抗与呼肠孤病毒激活的NK细胞联合使用可增强ADCC效果。因此,呼肠孤病毒可以直接在肿瘤部位裂解肿瘤细胞,而呼肠孤病毒激活的nk细胞可以增强ADCC的作用来杀死肿瘤,从而为进一步开发有效的临床治疗CRC的策略提供了框架。
数据和材料的可用性
本研究中分析的数据集可应通讯作者的合理要求提供。
缩写
- 儿童权利公约:
-
结肠直肠癌
- 小伙子:
-
神经化抗体
- 表皮生长因子受体:
-
表皮生长因子受体
- ADCC:
-
抗体依赖细胞介导的细胞毒性
- DCs:
-
树突细胞
- NK:
-
自然杀伤细胞
- TLR3:
-
toll样受体3
- 保利(我:C):
-
Polyinosinic: polycytidylic酸
- PBMCs:
-
外周血单核细胞
- CCK-8:
-
细胞计数试剂盒-8
- 极:
-
双链RNA
- 我:
-
感染的多重性
- 空斑形成单位:
-
点状单位
- 行为:
-
过继细胞疗法
- CIK:
-
细胞因子诱导的杀伤
参考文献
王晓明,王晓明,王晓明,等。结直肠癌统计,2020。CA。2020;70(3):145 - 64。
李建平,李建平。全球结直肠癌负担的影响因素及预防策略。中华胃肠病杂志,2019;16(12):713 - 732。
谢艳华,陈云云,方建勇。结直肠癌靶向治疗的综合综述。信号传导学报,2020;5(1):22。
Guren TK, Thomsen M, Kure EH,等。西妥昔单抗治疗转移性结直肠癌:来自NORDIC-VII研究的最终生存分析和扩展RAS数据中国生物医学工程学报,2017;31(6):1145 - 1145。
Heinemann V, von weikerstal LF, Decker T,等。FOLFIRI联合西妥昔单抗或贝伐单抗治疗晚期结直肠癌:一项随机临床试验FIRE-3的最终生存期和方案分析中国生物医学工程学报,2010;31(3):587 - 594。
徐勇,石井,王家辉,等。西妥昔单抗介导的ADCC活性与结直肠癌中EGFR的细胞表面表达水平相关,但与KRAS/BRAF突变状态无关。中国生物医学工程学报,2014;31(5):2115-22。
张建军,张建军,张建军,等。体外抗体依赖性细胞毒性诱导预测西妥昔单抗的疗效。中华癌症杂志,2015;3(5):567-74。
Lo Nigro C, Macagno M, Sangiolo D,等。实体肿瘤中nk介导的抗体依赖细胞介导的细胞毒性:生物学证据和临床观点。中华医学杂志,2019;7(5):105-105。
Zahavi D, AlDeghaither D, O 'Connell A,等。增强抗体依赖细胞介导的细胞毒性:改善基于抗体的免疫治疗的策略。抗体学报,2018;1(1):7-12。
Kohrt HE, Colevas AD, Houot R,等。靶向CD137可增强西妥昔单抗的疗效。中华临床医学杂志,2014,31(6):668 - 682。
朱伟杰,柯士杰,王志强,等。自然杀伤细胞:在肿瘤免疫中的多种功能和肿瘤发生前和肿瘤发生阶段的缺陷。医学通报。2020;16:41-52。
关勇,钱伯斯,Tabatabai T,等。肾细胞肿瘤将自然杀伤细胞转化为促血管生成表型。Oncotarget。2020;11(26):2571 - 85。
Melaiu O, Lucarini V, Cifaldi L,等。肿瘤微环境对实体瘤中NK细胞功能的影响。中华免疫学杂志,2020;10:3038-3038。
张超,刘勇。靶向NK细胞检查点受体或分子的肿瘤免疫治疗。中华免疫学杂志,2020;11:1295-1295。
da Silva IP, Gallois A, Jimenez-Baranda S等。Tim-3阻断逆转晚期黑色素瘤中nk细胞衰竭。中华癌症杂志,2014;2(5):410-22。
刘毅,程毅,徐毅,等。NK细胞上程序性细胞死亡蛋白1的表达增加抑制NK细胞介导的抗肿瘤功能,提示消化系统癌症预后不良。36(44):致癌基因。2017;6143 - 53。
刘建军,刘建军,刘建军,等。NK细胞功能的研究进展[J]。免疫学杂志,2018,38(2):105-30。
李建军,李建军,李建军,等。通过自然杀伤细胞刺激增强肺腺癌的适应性免疫反应。中国生物医学工程学报,2019;36(5):369 - 369。
张春华,张春华,张春华,等。增强抗体依赖细胞介导的细胞毒性:癌症治疗的新时代。免疫目标[j] . 2015; 4:91-100。
赵鑫,Rajasekaran N, Chester C,等。在体外和体内结直肠癌模型中,溶瘤呼肠孤病毒激活的自然杀伤细胞增强西妥昔单抗介导的抗体依赖性细胞毒性。血。2015;126(23):3439 - 3439。
陈晓青,王念学,李世奇,等。体外扩增NK细胞携带溶瘤呼肠孤病毒对结直肠癌细胞的细胞毒作用。中国癌症杂志,2019;26(5):492-9。
张敏,温波,安东东,等。IL-15增强NK细胞和巨噬细胞介导的抗体依赖性细胞毒性。自然科学进展,2018;35(6):915 - 924。
Sivori S, Falco M, Chiesa MD等。CpG和双链RNA通过toll样受体触发人NK细胞:诱导细胞因子释放和对肿瘤和树突状细胞的细胞毒性。美国国家科学促进会。101(27): 10116 - 2004; 21。
李建平,梁波,邝明,等。toll样受体3激动剂双链RNA对NK细胞的apc非依赖性激活。中国生物医学工程学报,2004;32(1):344。
Matsumoto M, Tatematsu M, Nishikawa F,等。定义了tlr3特异性佐剂,在体内诱导NK和CTL活化而不产生显著的细胞因子。生态学报,2015;6(1):6280。
Veluchamy JP, Spanholtz J, Tordoir M,等。NK细胞联合西妥昔单抗增强RAS突变型转移性结直肠癌的抗肿瘤反应。PLoS ONE。2016; 11 (6): e0157830-e0157830。
王志强,王志强,王志强,等。NF-κB信号通路在肿瘤细胞中的应用。癌症。2018;10(11):426。
李文杰。肿瘤基因:通过PKR抑制病毒溶瘤的护照。中国生物医学工程学报,2016;8(8):1010 - 1010。
赵鑫,Chester C, Rajasekaran N,等。策略组合:呼肠孤病毒溶瘤病毒治疗的未来。中华肿瘤杂志,2016;15(5):767-73。
王建军,张建军,张建军,等。溶瘤呼肠孤病毒作为抗病毒和抗肿瘤药物治疗肝癌。肠道。2018;67(3):562 - 73。
李建军,李建军,李建军,等。溶瘤性呼肠孤病毒的过去、现在和未来。癌症(巴塞尔)。2020; 12:11弟兄。
Parakrama R, Chaudhary I, Coffey MC,等。KRAS突变型转移性结直肠癌(mCRC)患者化疗后对呼肠孤病毒(REO)的免疫应答的I期研究中华临床杂志,2018;36(增刊1):217-217。
张建军,张建军,张建军,等。溶瘤性呼肠孤病毒感染肿瘤引发适应性抗肿瘤免疫。临床肿瘤杂志,2008;14(22):758 - 766。
Russell L, Peng KW, Russell SJ,等。溶瘤病毒:癌症免疫治疗的启动时间。BioDrugs。2019; 33(5): 485 - 501。
溶瘤病毒:要达到治疗效果,它们的“溶瘤性”必须达到什么程度?OncoImmunology。2019; 8 (6): e1581528。
Maitra R, Seetharam R, Tesfa L,等。溶瘤呼肠孤病毒优先诱导KRAS突变型结直肠癌细胞凋亡,并与伊立替康协同作用。Oncotarget。2014;5(9):2807 - 19所示。
李建军,李建军,李建军,等。溶瘤呼肠孤病毒(pelareorep)诱导kras突变的结直肠癌自噬。中华肿瘤杂志,2020;27(3):865-76。
Berkeley RA, Steele LP, Mulder AA,等。抗体中和呼肠孤病毒在溶瘤病毒治疗中是有效的。中华癌症杂志,2018;6(10):1161 - 173。
李建军,李建军,李建军,等。肿瘤患者中溶瘤病毒的细胞携带、传递和选择性复制。科学通报,2012;33(3):388 - 388。
王晓东,王晓东,王晓东,等。溶瘤性呼肠孤病毒被人树突状细胞携带者内化保护病毒免于中和。临床肿瘤杂志,2011;17(9):2767-76。
詹宁斯VA, Ilett EJ, Scott KJ,等。淋巴因子激活的杀手和树突状细胞载体通过克服腹水中的抗体中和来增强溶瘤呼肠孤病毒治疗卵巢癌。国际肿瘤学杂志,2014;34(5):1091 - 1091。
赵鑫,欧阳伟,Chester C,等。细胞因子诱导的杀伤细胞递送增强溶瘤呼肠孤病毒的抗肿瘤活性。PLoS ONE。2017; 12 (9): e0184816。
赵鑫,Rajasekaran N, Chester C,等。呼肠孤病毒激活的NK细胞显示增强的西妥昔单抗介导的抗体依赖性细胞对结直肠癌细胞的细胞毒性。中华肿瘤杂志,2015;3(增刊2):P340-P340。
张建军,张建军,张建军,等。溶瘤呼肠孤病毒增强利妥昔单抗介导的抗体依赖细胞对慢性淋巴细胞白血病的细胞毒性。白血病。2015;29(9):1799 - 810。
霍凯,史考特,罗思,等。呼肠孤病毒介导的细胞毒性和增强对急性髓性白血病的先天免疫反应。生物资源学报,2012;1(1):3-15。
El-Sherbiny YM, Holmes TD, Wetherill LF等。治疗性病毒的控制感染定义了人体内自然杀伤细胞的激活动力学。中华临床医学杂志,2015;18(1):98-107。
李建军,李建军,李建军,等。TLR受体激动剂:肿瘤免疫治疗的友敌。中国生物医学工程学报,2013;31(6):847 - 863。
苏尔坦,吴杰,费森科娃,等。Poly-IC通过促进T细胞肿瘤浸润来增强肿瘤免疫治疗的有效性。[J]中华肿瘤杂志,2020;8(2):1224 - 1224。
致谢
不适用。
资金
基金资助:国家自然科学基金(No. 81860542);贵州省科技拔尖人才计划项目(2019)5663号);KY(2018)049],贵州省科技重点计划项目[批准号:81111111118];ZK(2021) 012)。
作者信息
作者及单位
贡献
XZ构思并设计了这项研究。ZXH修改了原稿。SQL设计实验并分析数据。YZG。监督小鼠实验并撰写手稿。YYA, XJL, XQC, XYW, CXL完成了大部分实验并解释了数据。WWOY和NXW协助文献检索和评价相关研究。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
在涉及动物的研究中进行的所有程序都得到了贵州医科大学伦理委员会的批准(参考文献:2000803)。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1:表S1。
本研究使用的PCR引物。
附加文件2:图S1。
呼肠孤病毒处理NK细胞中细胞内TLR3的表达。
附加文件3:图S2。
Western blot显示转染了siTLR3的NK细胞中TLR3的表达。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
龙,S,顾,Y,安,Y。et al。呼肠孤病毒通过TLR3途径增强自然杀伤细胞对结直肠癌的细胞毒性。J翻译医学19, 185(2021)。https://doi.org/10.1186/s12967-021-02853-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-021-02853-y
关键字
- 自然杀伤细胞
- 呼肠孤病毒
- 结肠直肠癌
- 抗体依赖细胞介导的细胞毒性
- toll样受体3