摘要
背景
胶质瘤是一种高发病率、高死亡率的复杂癌症。骨髓间充质干细胞(BMSCs)已显示出作为基因靶向治疗的优良细胞/药物传递载体的前景;然而,保持遗传稳定性和生物活性仍然很困难。此外,骨髓间充质干细胞是支持还是抑制肿瘤生长仍存在争议。本研究探讨中药复方扶正益流汤(FYD)与IL-12基因修饰的骨髓间充质干细胞在胶质瘤裸鼠体内是否具有协同抗肿瘤作用
方法
慢病毒介导的IL-12基因转染原代培养的骨髓间充质干细胞。采用72只BALB/c裸鼠建立胶质瘤U251细胞移植模型,分为空白对照组、裸鼠模型组(模型组)、无基因加载的BMSC慢病毒转染组(BMSC组)、IL-12慢病毒转染BMSC组(IL-12 + BMSC组)、FYD处理组(FYD组)、IL-12慢病毒转染BMSC组(FYD + IL-12 + BMSC组)。治疗14 d后处死小鼠,采集肿瘤组织和血清进行更多检测,如BMSCs分布、异种移植瘤细胞凋亡、血清IL-12和INF-γ水平、小鼠体重和肿瘤体积
结果
IL-12基因转染组、FYD治疗组及FYD联合IL-12基因转染组肿瘤组织中凋亡细胞明显多于模型组(P< 0.05)。FYD + IL-12 + BMSC组Bax表达明显升高,Bcl-2表达明显降低(P< 0.05),血清IL-12和INF-γ水平(P< 0.05)均高于其他各组。干预后,该组对肿瘤生长也表现出较强的抑制作用(P< 0.05)
结论
本研究提示,IL-12基因修饰的骨髓间充质干细胞联合治疗FYD对胶质瘤裸鼠具有协同抗肿瘤作用。
简介
胶质瘤占成人中枢神经系统肿瘤的80%。这些致命的脑瘤具有侵略性,恶性,基本上无法治愈。1],造成了重大的经济负担。因此,需要新的有效治疗胶质瘤的方法。骨髓间充质干细胞(BMSCs)可能是一种潜在的解决方案,因为它们具有多向分化的特征[2],很容易被复制[3.],表达肿瘤向性[4],免疫原性较低[5],可进行EasyGene修饰[6],并表现出免疫调节[7].因此,在以细胞为基础的靶向治疗中,骨髓间充质干细胞可作为一种优秀的细胞/药物传递载体[3.],为胶质瘤的治疗提供了免疫疗法、自杀蛋白疗法和抗血管生成疗法的替代治疗方法[3.,8].然而,作为载体,骨髓间充质干细胞对肿瘤生长的影响还有待进一步研究[6,9].有研究者发现骨髓间充质干细胞可增加肿瘤的侵袭性[10],而另一些则报道了抗肿瘤作用[11].
骨髓间充质干细胞在体外分泌多种调节因子,对免疫抑制具有复杂的作用[12].Shirjang等。[13最近的研究表明toll样受体(TLRs)在调节骨髓间充质干细胞的作用中至关重要。TLRs主要存在于抗原呈递细胞(如树突状细胞)表面,在感染时向机体发出警告信号。TLR2和TLR4都能激活树突细胞,并刺激各种细胞因子和化学激活剂的产生;例如,TLR4主要刺激p70,干扰素(IFN -)γ而TLR2刺激白介素(IL -8)和IL-23的表达。这些可溶性细胞因子可以诱导T辅助性(Th)细胞活化,并作为免疫监测器。特别是IL-12可以刺激T细胞产生IFN,有效促进Th细胞向Th1细胞分化,进而发挥免疫功能。IL-12还能刺激T细胞产生IFN-γ,而BMSCs经IFN-γ启动后可增加TLR3和TLR4的表达,有效促进抗原细胞活化,产生抗肿瘤免疫[6,7,14].研究证实,IL-12或INF基因修饰的骨髓间充质干细胞是抗肿瘤基因治疗的理想基因递送系统,稳定表达转染蛋白,发挥强大的抗肿瘤作用[6,15].因此,在潜在的抗肿瘤治疗中,基因修饰可能提高骨髓间充质干细胞的致瘤性,许多研究已经证明了维持骨髓间充质干细胞遗传稳定性和生物活性的方法[16,17,18].
中医提供有效的治疗方法,以改善免疫功能,抑制肿瘤生长,减轻放化疗的不良影响[19].中药汤剂既能抑制骨髓间充质干细胞,又能有效逆转其致瘤性,有助于疾病的治疗[20.,21,22,23].扶正益流汤是一种由红色组成的方剂对称二苯代乙烯,当归,莪术,mutouhui以3:1:3:1的草药剂量比例。FYD被用作抗肿瘤药物,并已被证明在体外肿瘤微环境中逆转骨髓间充质干细胞的致瘤性[24,25,26,27].在本研究中,我们利用含胶质瘤的BALB/c裸鼠模型,评估了FYD和IL-12基因修饰的BMSCs的协同抗肿瘤作用。
方法
人胶质瘤U251细胞系培养
U251细胞购自中国科学院细胞库(中国上海)。细胞在37°C, 5% CO孵育2, Dulbecco的改良Eagle介质(DMEM;Gibco, USA),培养基每1-3天更换一次。
骨髓间充质干细胞的原代培养、分离和鉴定
8周龄无特异性病原体BALB/c小鼠颈椎脱位前麻醉。然后在无菌条件下分离股骨和胫骨,并去除骨赘。用DMEM清洗骨髓,直至骨髓腔变白。将细胞吸入离心管,以1000rpm离心5 min,上清液弃去。接下来,用磷酸盐缓冲盐水(PBS)冲洗细胞,并补充15%的胎牛血清。24小时后丢弃培养基并清洗以去除任何未附着的细胞。加入新培养基,继续培养3天,之后再次进行完全的培养基更换。第10天,细胞生长和汇合度普遍超过70%。采用双色流式细胞仪检测细胞表面分子标志物CD45、CD90。
BALB/c裸鼠异种移植模型及分组
成年雌性BALB/c无胸腺小鼠(体重15-20 g;6 ~ 7周龄),取自北京华康生物科技有限公司。这些动物被安置在一个每天接受12小时光照的设施中,并被自由喂食。这些动物按照《实验动物护理和使用指南》进行饲养。在实验过程中,对肿瘤的喂养、牺牲或解剖程序严格按照国际伦理准则和美国国立卫生研究院《实验动物护理和使用指南》进行。本研究方案已通过甘肃中医药大学动物实验伦理审查。他们尽一切努力避免动物遭受不必要的痛苦。
随机选取12只小鼠作为空白组,其余小鼠建立模型。采用对数生长期胶质瘤细胞建立异种移植瘤模型。制备150 μ l的细胞悬液。最终细胞浓度为107细胞/毫升。将150 μ L的悬浮液皮下注射到小鼠的辅助区。每天监测这些动物的体重变化、副作用或接种后的疾病。成功建立的小鼠模型包括10 d后皮下有圆形结节的小鼠。最后,将剩下的小鼠随机分为五组。末次给药次日,60只小鼠腹腔注射水合氯醛350 mg/kg麻醉,取眼球采血,测定血清IFN-γ和IL-12浓度。此后,随机选取麻醉小鼠15只(每组3只),采用颈椎脱位法处死,收集各组肿瘤组织进行体积重量测定、病理实验及免疫组化检测。当小鼠被处死后,肿瘤被解剖并拍照。所有接受麻醉的小鼠在计划的一段时间内接受血液和肿瘤组织样本的轮流分离,无疼痛感。小鼠的人道终点为大量失血和严重贫血,或皮下异种移植瘤达到或接近20mm。 Next, all animals which still remained in a state without consciousness would be sacrificed by cervical dislocation treatment till death of all animals was confirmed by the signs including no spontaneous breathing for 2–3 min, no blink reflex existed, and body rigor mortis appeared finally. All operation including anesthesia, injection, sacrifice in animal experiments were performed in strict accordance with the international ethical guidelines and the National Institutes of Health Guide [28]和《动物安乐死指南》,2013年版[29为实验动物的护理和使用,以确保老鼠的终点是人道的。本实验方案经甘肃中医药大学机构动物护理使用委员会批准。
实验组和治疗组各给药
将小鼠随机分为6组(每组n = 12):空白对照组裸鼠模型组(模型组)、无基因加载的BMSC慢病毒转染组(BMSC组)、IL-12慢病毒转染BMSC组(IL-12 + BMSC组)、FYD治疗组(FYD组)、IL-12慢病毒转染BMSC组(FYD + IL-12 + BMSC组)。在治疗前,用慢病毒载体转导骨髓间充质干细胞,用嘌呤霉素筛选稳定转染的细胞。样品溶液在PBS (106, 200 μL)注入BMSC组、IL-12 + BMSC组和FYD + IL-12 + BMSC组小鼠尾静脉;模型组和FYD组注射生理盐水。FYD组和FYD + IL-12 + BMSC组给予FYD提取物,灌胃14 d (0.6 FYD g/20 g体重,每天1次,连续给药);模型组、BMSC组和IL-12 + BMSC组给予等量蒸馏水灌胃。
FYD的制备和质量控制
在中医中,FYD由红芪:当归:莪术:mutouhui比例为3:1:3:1(表1).洪琪(编号:160627,Hedysarum polybotrys手- mazz .),党贵(编号160713,当归(摘要)。(编号160503);Patrinia作用研究邦吉)和朱娥(编号160525,姜黄绿脓杆菌Roxb.)购自甘肃复兴侯中药饮片药业有限公司(甘肃省兰州市,中国),并由甘肃中医药大学药学院教授(邵静教授)仔细鉴定。参考标准草药(红二苯乙烯,当归、木头惠和莪术)购自中国北京国家食品和药物控制研究所。
煎煮前将药材晾干,混合成指定比例,用蒸馏水室温浸泡40 min,煎煮3次30 min,用纱布过滤除渣。滤液在0.09 MPa、60℃下混合冷凝至最终浓度为1 g/mL(原药材重量/溶液体积),4℃保存。
IL-12慢病毒载体的构建和转染
载体设计和质粒构建
利用含有目的基因的质粒克隆模板进行PCR纯化。引物由上海吉马药业科技有限公司合成,通过PCR扩增IL-12过表达序列。我们将目的基因的上游和下游引物分别添加到LV5载体上的NotI和NsiI的同源序列中进行亚克隆。IL-12引物序列为:5 ' - agggttccaagcttaagcggccgcgccaccatgtggccccctgggtcagcctcccac -3 '和3 ' -GATCCATCCCTAGGTAGATGCATTTAGGAAGCATTCAGATAGCTC -3 '。PCR反应完成后,通过琼脂糖凝胶电泳和凝胶切割回收IL-12基因片段。
病毒生产,基因转导和纯化
利用克隆技术(TaKaRa, Japan)将IL-12基因片段扩增并克隆到线性化的LV5载体中,并将重组克隆产物转化为先前制备的感受态细胞。用质粒Miniprep Kit (Promega, USA)提取培养菌液,对提取的质粒进行双酶切鉴定。质粒提取以获得足够量的重组质粒。病毒包装使用由LV5、PG-p1-VSVG、PG-P2-REV和PG-P3-RRE组成的四质粒系统进行。其中,LV5质粒可表达绿色荧光蛋白。所有四种质粒载体均使用高纯度内毒素检测试剂盒(Biosciences, american)提取,并共转染到293T细胞中。收集并浓缩富含慢病毒颗粒的细胞上清液。
负载il -12的慢病毒转染骨髓间充质干细胞
对靶细胞进行了慢病毒感染的初步实验。将感染倍数(MOI)为10的给定体积的病毒溶液转移到靶细胞和对照组,在5% CO下孵育过夜237°C。我们用嘌呤霉素来选择稳定转染的细胞。在倒置荧光显微镜下观察荧光(Olympus, Japan),以估计细胞慢病毒感染的效率。
IL-12在BMSCs中过表达的定量PCR验证
利用随机引物对IL-12进行逆转录,将RNA逆转录为cDNA,然后设计特异性引物(中国重庆威斯顿生物医药科技有限公司)和SYBR绿I荧光染料(威斯顿生物医药科技有限公司)进行实时PCR(威斯顿生物医药科技有限公司)。IL-12的随机引物序列为:5 ' -CAGCACTTCAGAATCACAACCA-3 '和5 ' -TCATTTTCACTCTGTA AGGGTCTG-3 '。引物序列β-actin分别为:5 ' -GAGACCTTCAACA CCCCAGC-3 '和5 ' -ATGTCACGCACGATTTCCC-3 '。
il -12转染骨髓间充质干细胞在小鼠肿瘤中的分布
所有组的肿瘤组织都用最佳切割温度的化合物(Sakura Finetek USA, Torrance CA, USA)包埋,并在- 80℃保存,直到分析。切片后,利用激光共聚焦系统(Leica, Germay)在室温下进行免疫荧光染色,观察il -12转染小鼠骨髓间充质干细胞的荧光分布。
TUNEL染色检测小鼠肿瘤细胞凋亡
用PBS清洗小鼠肿瘤组织,用4%多聚甲醛固定,然后依次在75%、85%、95%和100%乙醇中脱水。组织用清洗剂处理,并用蜡包埋。将组织切片切成5 μm厚,平放在载玻片上。烘烤、脱蜡、复水后,用TUNEL细胞凋亡检测试剂盒染色。每组随机选取一个区域评估细胞凋亡/坏死阳性细胞数及总细胞数。计算阳性细胞的相对比例(阳性细胞数/总细胞数)。
ELISA检测
样品中IL-12和INF-γ含量采用人IL-12/ ifn -γ酶联免疫吸附测定法(上海联科生物有限公司,中国),根据制造商指南在微皿中进行评估。在孵育过程中,样品中的IL-12和INF-γ与固相抗体结合。在清洗和去除未结合的材料后,加入生物素化检测抗体并孵育。洗去未结合的生物素化抗体,加入辣根过氧化物酶标记的链霉亲和素。洗净后加入显色底物TMB显色。显色反应的深度与样品中IL-12/INF-γ的浓度成正比。加入停止液终止反应,在450nm波长(参考波长570 nm)下测定吸光度。
肿瘤体积测量
每2天用游标卡尺测量裸鼠肿瘤的长度和短直径。肿瘤体积及平均体积按公式[肿瘤体积= (π/ 6)×一个×b2)]使用Microsoft Excel(微软公司,Redmond, CA, USA)。根据体积绘制每个肿瘤的生长曲线,其中一个是更长的b是较短的轴。每只老鼠的体重变化也被记录下来。
免疫组织化学分析
免疫组化法检测Bax、Bcl-2在小鼠肿瘤组织中的表达。将肿瘤组织切成4 μm切片。脱蜡、复水和清洗后,按照标准免疫组化程序制备组织。最后,切片用苏木精反染色,在光学显微镜下观察(Olympus, Japan)。
从每组肿瘤组织中随机选取3个组织切片,使用随机选择的5个视野进行索引。使用化学发光成像分析系统(Chemidoc MP成像系统;Bio-Rad, Hercules, CA, USA),并对光密度进行测定和平均。
统计分析
定量资料以均数±标准差表示。两个以上组间检验采用单因素方差分析(ANOVA)计算3个或以上组间的统计推断。的问用检验比较两组间的结果。以0.05为阈值表示显著性。
此外,还采用重复测量方差分析来检验不同组间肿瘤体积和重量的显著性,首先采用球形检验来比较不同时间点间的参数时间或不同组间的治疗因素,或时间与治疗的相互作用。一旦球度检验显示P值< 0.01,则通过Greenhouse-Geisser模型确定主效应在不同时间点的差异具有统计学意义。接下来,采用Tukey的检验方法检验任意两组之间的显著性差异。以0.05为阈值表示显著性。
结果
骨髓间充质干细胞的原代培养、分离和鉴定
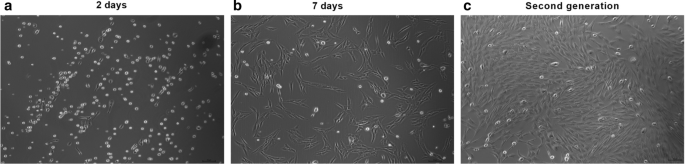
体外培养骨髓间充质干细胞,在大约24小时内发生贴壁生长(原代培养)。细胞慢慢变成圆形、梭形和三角形外观。随后,细胞大量增殖,出现了一些纺锤形形态(图。1a - c)。流式细胞仪分析结果显示CD90表达过表达,CD45表达下调(表2)2).
RT-qPCR检测骨髓间充质干细胞IL-12 mRNA表达水平
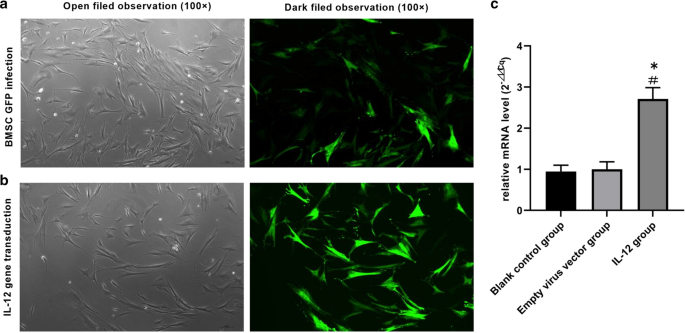
转染IL-12基因后,检测BMSCs中IL-12 mRNA的相对表达量。数据显示,空慢病毒载体转染BMSC组(BMSC组)与IL-12慢病毒转染BMSC组(IL-12 + BMSC组)相比,IL-12表达明显降低(P < 0.05)(图。2a - c)。
共聚焦显微镜观察il -12转染小鼠骨髓间充质干细胞的荧光分布
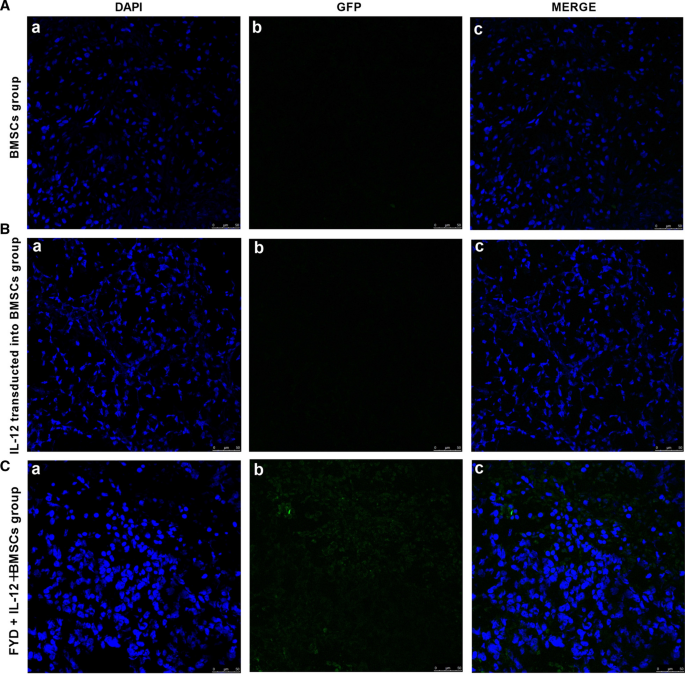
免疫荧光染色后,用共聚焦显微镜检测荧光强度。模型组小鼠肿瘤组织中未观察到荧光信号,而BMSC组小鼠肿瘤组织中荧光信号明显。后者GFP发射的荧光信号较弱,而IL-12 + BMSC组表现出较强的GFP发射的荧光信号,这表明IL-12基因成功转染到BMSCs中。结果表明,IL-12基因分布在肿瘤组织中,揭示了BMSCs对IL-12的归巢效应(图12)。3.a - c)。
通过DAPI染色检测il -12转染的骨髓间充质干细胞的荧光分布特征和细胞凋亡诱导(×400)。(Aa)、(Ba)、(Ca)分别为BMSC、IL-12 + BMSC、FYD + IL-12 + BMSC组DAPI染色结果。(Ab)、(Bb)、(Cb)分别为BMSC组、IL-12 + BMSC组和FYD + IL-12 + BMSC组的荧光数据。(Ac), (Bc)和(Cc)表示在共聚焦显微镜下,BMSC、IL-12 + BMSC和FYD + IL-12 + BMSC组的DAPI染色和荧光合并信号。BMSC组小鼠肿瘤组织中未观察到荧光,而IL-12 + BMSC组和FYD + IL-12 + BMSC组小鼠肿瘤组织中荧光明显,表明IL-12基因成功转染BMSCs (一个- - - - - -c).DAPI染色检测细胞凋亡诱导情况。与BMSC组相比,IL-12 + BMSC组和FYD + IL-12 + BMSC组细胞凋亡更为普遍。与IL-12 + BMSC组相比,FYD + IL-12 + BMSC组表现出更多的凋亡细胞,细胞呈蓝色荧光染色。蓝色荧光染色显示,IL-12 + BMSC组与BMSC组相比,凋亡细胞比例更高(一个- - - - - -c).结果表明,IL-12基因分布在肿瘤组织中,提示BMSCs对IL-12具有归巢效应。骨髓间充质干细胞;DAPI 4′, 6-diamidino-2-phenylindole;FYD、扶正益流汤IL-12 + BMSC、il12 -慢病毒转染BMSC;BMSC组,空慢病毒载体转染BMSC组;FYD + IL-12 + BMSC组,FYD治疗IL-12慢病毒转染BMSC组
通过DAPI和TUNEL染色测定凋亡细胞的数量
DAPI染色显示,与BMSC组相比,IL-12 + BMSC组和FYD + IL-12 + BMSC组细胞凋亡更为普遍。蓝色荧光染色显示,与IL-12 + BMSC组相比,FYD + IL-12 + BMSC组表现出更多的凋亡细胞。蓝色荧光染色显示,IL-12 + BMSC组与BMSC组相比,凋亡细胞数量增加(图2)。3.A和b)。
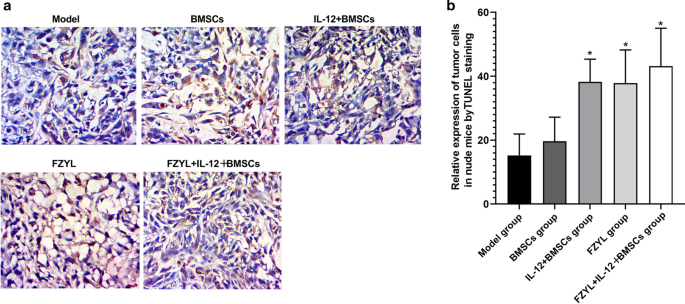
TUNEL染色结果显示,与模型组相比,IL-12 + BMSC组、FYD组和FYD + IL-12 + BMSC组细胞凋亡更为普遍。FYD + IL-12 + BMSC组凋亡细胞数量增加,核染色呈深棕色。作为比较,未凋亡细胞的细胞核用苏木精反染成蓝色(图2)。4与模型组相比,IL-12 + BMSC组、FYD组和FYD + IL-12 + BMSC组凋亡细胞的相对表达量较高(P < 0.05)。
TUNEL染色评价裸鼠肿瘤细胞凋亡(×400)。采用tdt介导的dUPT缺口端标记染色法检测细胞凋亡诱导。与模型组相比,IL-12 + BMSC组、FYD组和FYD + IL-12 + BMSC组细胞凋亡更普遍。FYD + IL-12 + BMSC组凋亡细胞比例较高,细胞核染色深棕色,外观枯萎;作为比较,未凋亡细胞的细胞核用苏木精反染蓝色,如图所示一个而且b.n = 5, IL-12 + BMSC组、FYD组、FYD + IL-12 + BMSC组凋亡阳性细胞相对数量均高于模型组(P < 0.05)。TUNEL, tdt介导的dUPT缺口端标记;骨髓间充质干细胞;IL-12 + BMSC, il12慢病毒转染的BMSC;BMSC组,空慢病毒载体转染BMSC组;FYD,扶正益流汤;FYD + IL-12 + BMSC组,FYD治疗IL-12慢病毒转染BMSC组
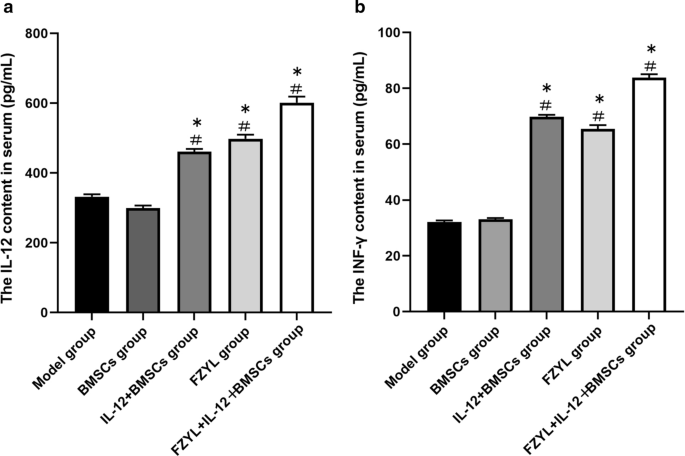
血清IL-12和IFN-γ水平
各组间IL-12表达水平差异有统计学意义(P < 0.05),其中FYD + IL-12 + BMSC组IL-12表达水平最高(P < 0.05)。特别是IL-12 + BMSC组与FYD组之间、IL-12 + BMSC组与FYD + IL-12 + BMSC组之间差异有统计学意义(P < 0.05)。此外,各组间IFN-γ水平差异有统计学意义(P < 0.05), FYD + IL-12 + BMSC组IFN-γ水平最高(P < 0.05)(图5)。5A和b)。
血清IL-12和IFN -γ水平检测。各组间IL-12水平差异有统计学意义(P < 0.05)。FYD + IL-12 + BMSC组IL-12水平最高(P < 0.05)。特别是IL-12 + BMSC组与FYD组之间、IL-12 + BMSC组与FYD + IL-12 + BMSC组之间差异有统计学意义(P < 0.05)。此外,各组间IFN-γ水平存在显著差异(P < 0.05), FYD + IL-12 + BMSC组IFN-γ水平最高(P < 0.05),如图一个,b.n = 5,#P < 0.05:与模型组比较,*p < 0.05;与模型组比较。进行单因素方差分析(IL-12: F = 1107.69, P = 0.00;Ifn -γ: f = 5456.68, p = 0.00)。两组比较采用q检验,两组比较差异有统计学意义(P < 0.05)。骨髓间充质干细胞;IL-12 + BMSC, il12慢病毒转染的BMSC;FYD,扶正益流汤;FYD + IL-12 + BMSC组,FYD治疗IL-12慢病毒转染BMSC组
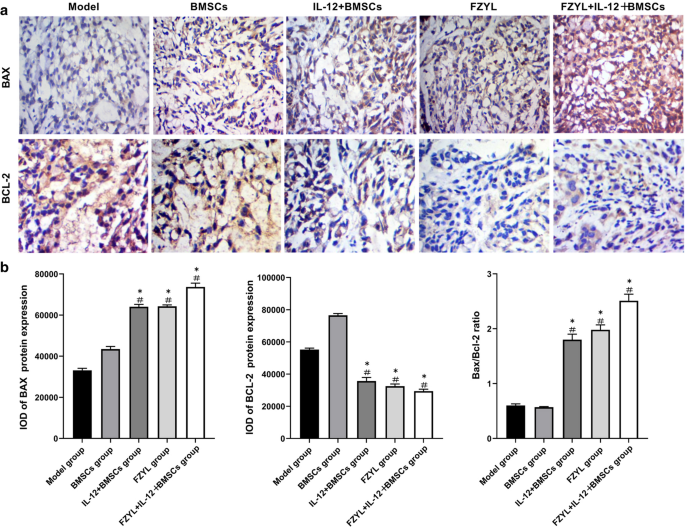
Bax和Bcl-2在肿瘤组织中的表达水平
免疫组化染色显示Bax和Bcl-2主要分布在细胞质中,呈明显的棕黄色弥散分布。部分阳性细胞在细胞质或核膜中含有棕色颗粒(图。6a).干预后IL-12 + BMSC组、FYD组和FYD + IL-12 + BMSC组Bax表达水平明显高于模型组和BMSC组(P < 0.05)。与模型组和BMSC组相比,IL-12 + BMSC组、FYD组和FYD + IL-12 + BMSC组Bcl-2表达下调(P < 0.05)。6A和b)。
Bax和Bcl-2在肿瘤组织中的表达.免疫组化染色显示Bax和Bcl-2主要分布在细胞质中,呈明显的棕黄色弥散分布。一个部分阳性细胞在细胞质或核膜上可见棕色颗粒(一个而且b).干预后IL-12 + BMSC、FYD、FYD + IL-12 + BMSC组Bax表达水平明显高于模型组和BMSC组(P < 0.05), IL-12 + BMSC、FYD、FYD + IL-12 + BMSC组Bcl-2表达水平明显低于模型组和BMSC组(P < 0.05)。n = 3,#P < 0.05:与模型组比较,*P < 0.05:与模型组比较。骨髓间充质干细胞;IL-12 + BMSC, il12慢病毒转染的BMSC;BMSC组,空慢病毒载体转染BMSC组;FYD,扶正益流汤;FYD + IL-12 + BMSC组,FYD治疗IL-12慢病毒转染BMSC组
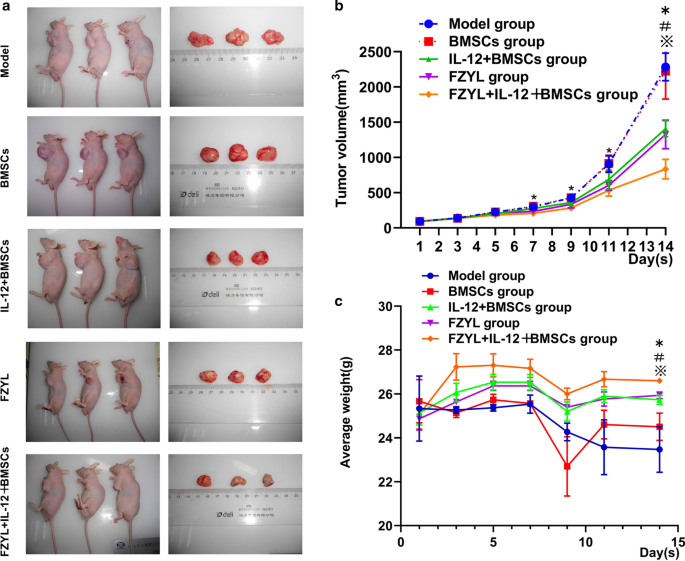
荷瘤小鼠的肿瘤体积和体重变化
在FYD灌胃14天期间,每隔一天测量荷瘤小鼠的肿瘤体积和体重。每日计算各组肿瘤体积变化均值。单个肿瘤直径为8.12 ~ 12.38 mm。根据各组肿瘤体积变化绘制生长曲线,可以看出各组肿瘤体积生长的趋势。除IL-12 + BMSCs组外,IL-12 + BMSCs组、FYD组、FYD + IL-12 + BMSCs组在第7、9、11、14天肿瘤体积生长均显著低于模型组和BMSC组vs模型组第9、11天,FYD + IL-12 + BMSCs组14天肿瘤体积生长明显低于其他各组th第14天,FYD + IL-12 + BMSCs组与FYD组比较差异无统计学意义(图;7b, P < 0.05)。根据各组荷瘤小鼠体重变化情况绘制生长曲线,揭示各组荷瘤小鼠体重变化趋势。FYD + IL-12 + BMSC组大鼠第14天体重明显低于模型组(图2)。7C, p < 0.05)。
荷瘤小鼠的肿瘤体积和体重变化。在FYD灌胃14天期间,每隔一天测量荷瘤小鼠的肿瘤体积和体重。每天记录各组平均肿瘤体积变化并计算。一个这些图显示了荷瘤小鼠和肿瘤。b根据各组肿瘤体积变化绘制生长曲线,可以看出各组肿瘤体积生长的趋势。FYD + IL-12 + BMSC组肿瘤体积生长明显低于模型组和BMSC组。对于肿瘤体积的比较,采用球形试验P= 0.00 < 0.01,不符合球形度,由Greenhouse-Geisser模型得到F= 482.8,P= 0.00,说明各时间点主效应差异有统计学意义。两组之间的Tukey检验比较发现,任何两组之间的差异均有统计学意义(P= 0.00);以及交互测试时间╳小组发现F= 16.79,P= 0.00,表示与组有交互作用。此外,受试者间效应检验发现各组间主要效应差异有统计学意义(F= 28.22,P= 0.00)。n = 3,*P < 0.05:第7、9、11、14 d, IL-12 + BMSCs组,FYD组,FYD + IL-12 + BMSCs组vs模型组,除第9、11天外,为IL-12 + BMSCs组vs模型组。#P < 0.05,第14天除FYD组外,其余各组均无显著差异vsIL-12 + BMSCs组。※P < 0.05:第14天,其他各组差异无统计学意义vsFYD + IL-12 + BMSCs组。cFYD + IL-12 + BMSC组体重明显低于其他各组。对于荷瘤小鼠体重变化的比较,球体度试验不符合球体度(P= 0.00 < 0.01)。Greenhouse-Geisser模型对时间点的主要影响有统计学差异F= 13.73,P= 0.00。交互测试时间╳小组发现时间和小组之间存在交互作用(F= 3.053,P= 0.02)。此外,采用Tukey 's检验方法检验between - subjects Effects,第14天各组间主效应差异有统计学意义(F= 75.779,P= 0.00)。n = 3,*P < 0.05:第14天,IL-12 + BMSCs组、FYD组、FYD + IL-12 + BMSCs组vs模型组、#P < 0.05: 14thDay:所有其他组vs所有其他组vsIL-12 + BMSCs组※其他各组P < 0.05vsFYD + IL-12 + BMSCs组。注:BMSCs,骨髓间充质干细胞;IL-12 + BMSC, il12慢病毒转染的BMSC;BMSC组,空慢病毒载体转染BMSC组;FYD,扶正益流汤;FYD + IL-12 + BMSC组,FYD治疗IL-12慢病毒转染BMSC组
讨论
胶质瘤是一种侵袭性和浸润性肿瘤,是最常见的原发性脑癌类型。胶质瘤的治疗因胶质瘤干细胞在微环境中诱导免疫耐受而复杂化[30.].因此,恶性胶质瘤的复杂特征导致预后不良[31],发病率和死亡率均很高[32].
骨髓间充质干细胞已被用作治疗胶质瘤的药物/基因靶向载体,但其结果在很大程度上取决于其特定的归巢能力[33,34].本研究中细胞形态及细胞表面免疫标志物表达与文献报道一致[3.,8,11,33,34].IL-12基因成功转染BMSCs, IL-12基因在肿瘤组织中具有很强的归巢效应,验证了BMSCs作为肿瘤生物治疗载体的可靠性。基于细胞的抗肿瘤靶向治疗必须依赖于骨髓间充质干细胞激活局部肿瘤组织的能力及其对靶细胞的内在影响能力;然而,骨髓间充质干细胞作为生物治疗首选载体的安全性尚不清楚[3.].
骨髓间充质干细胞治疗胶质瘤的研究已取得长足进展。然而,由于难以确定骨髓间充质干细胞植入后的最佳治疗时间和评估治疗后的长期结果,目前还没有研究研究利用骨髓间充质干细胞治疗恶性胶质瘤。无论如何,这种靶向治疗作为大多数实体肿瘤(包括胶质瘤)的治疗仍然很有前景。35,36].特别是,基于骨髓间充质干细胞的治疗是一种有效的抗肿瘤治疗,因为它具有向肿瘤的归巢和迁移特性29.在本研究中,当IL-12基因转染到骨髓间充质干细胞,IL-12在血清中稳定表达时(P< 0.05),对肿瘤生长有显著抑制作用。具体而言,在荷瘤小鼠的第9、11和14天,模型组与IL-12 + BMSC、FYD和FYD + IL-12 + BMSC组之间存在显著差异(P< 0.05)。模型组也表现出显著的肿瘤诱导体重减轻(P< 0.05)。
研究表明,骨髓间充质干细胞具有与癌细胞相似的自我更新能力,并具有在体外自发转化的能力。也有研究表明,肿瘤可能由高侵袭性间充质干细胞转化而来[37],特别是在肿瘤微环境中[38].此外,日本科学家证实,骨髓间充质干细胞与癌细胞在增殖基因表达上仍有显著差异[39].因此,骨髓间充质干细胞的使用在临床应用中仍然受到限制,因为其结果和可能的致瘤性存在内在的不确定性。
临床应用中医药治疗肿瘤有诸多优势[40,41].例如,中医治疗肿瘤的主要方法是扶正和驱魔[42,43],扶正治疗可改善免疫功能[26,44,45].我们前期研究表明,含FYD的血清可通过抑制BMSCs端粒酶活性、增加p53表达、诱导细胞凋亡在体内逆转脑胶质瘤微环境中BMSCs的致瘤性[27,46].此外,本研究通过TUNEL染色、肿瘤体积和体重变化、血清IL-12水平、Bax/Bcl-2表达等研究结果,证实了中药FYD能有效抑制小鼠骨髓间充质干细胞的潜在致瘤性,且表达IL-12基因的骨髓间充质干细胞具有靶向抗肿瘤作用。在本研究的所有治疗组(包括FYD和IL-12 + BMSC组)中,FYD + IL-12 + BMSC联合组的疗效明显更好。
既往报道表明,骨髓间充质干细胞对肿瘤的抑制作用可能取决于免疫机制的参与[11,47].IL-12已成为调节先天和适应性免疫反应以及介导抗肿瘤活性的关键分子[48].例如,IL-12可以导致CD4+CD8+细胞浸润和分泌各种细胞因子(如IFN-γ)到肿瘤微环境中,通过其他细胞因子引发级联反应,从而引发抗肿瘤作用[48,49].因此,IL-12作为免疫介导基因治疗的候选基因越来越受欢迎,这激发了IL-12在本研究中作为靶基因的使用。
在常规治疗实体瘤去除大量肿瘤组织后,可采用免疫治疗去除残留细胞,增强治疗效果。然而,手术、化疗、放疗等治疗会削弱癌症患者的免疫系统,这是肿瘤最终治疗的重要考虑因素[50].由于本研究的模型裸鼠表现出T细胞免疫缺陷,因此小鼠与肿瘤移植后的临床环境非常相似。IL-12刺激NK细胞和巨噬细胞增殖,增强其自然杀伤功能,NK细胞对NK杀伤也变得敏感,从而减缓肿瘤进展。IL-12通过产生IFN-γ来抑制肿瘤血管生成、降低微血管密度和诱导细胞凋亡,发挥抗肿瘤作用[49].我们的结果显示,通过酶联免疫吸附试验(ELISA)检测,IL-12 + BMSC和FYD + IL-12 + BMSC组的血清IL-12和IFN-γ水平明显高于其他组(P< 0.05)。
高Bax/Bcl-2比值可导致线粒体膜电位降低,线粒体膜电位是导致细胞凋亡的早期细胞内信号[51].在本研究中,干预组Bax和Bcl-2凋亡标志物的细胞表达明显高于模型组。此外,在所有治疗组中,FYD + IL-12 + BMSC组血清中IL-12和IFN-γ水平最高,肿瘤细胞中Bax和Bcl-2表达最高(P< 0.05)。
综上所述,本研究证明了il -12转染BMSCs联合治疗FYD的成功应用。但IL-12是否激活抗原提呈细胞(即NK细胞和巨噬细胞),FYD是否促进荷瘤裸鼠的非特异性免疫,尚需进一步研究,需要在U251-MG细胞中检测与肿瘤表型相关的功能和分子机制的体外实验,如增殖、凋亡、转移等,以探索相关机制。
数据和材料的可用性
在本研究过程中产生和分析的所有数据和材料均可根据合理要求从通讯作者处获得。
缩写
- FYD:
-
扶正益流汤
- 伴着:
-
骨髓间充质干细胞
- 通常:
-
toll样受体
- 中医:
-
中医
- PBS:
-
磷酸盐
参考文献
陈杰,麦凯RM, Parada LF。恶性胶质瘤:来自基因组学、小鼠模型和干细胞的教训。细胞。2012;149:36-47。
Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR.成人间充质干细胞的多谱系潜能。科学。1999;284:143-7。
马志刚,李志刚,李志刚。人类间充质干细胞及其在细胞治疗中的应用。癌症。2010;116:2519-30。
金文文,李玉凯,洪志辉,朴志勇,崔亚,李杜,崔杰,沈世杰,金晓辉,康东。纳米药物结合隐形间充质干细胞对肺深部肿瘤组织的相互破坏作用。AdvSci。2018; 5:1700860。
张松,刘勇,Derakhshanfar S,何伟,黄强,董松,饶杰,罗广喜,钟伟,廖伟,等。具有嗜癌性和程序性归巢的聚合物自组装BMSCs。AdvHealthc Mater. 2018;7:e1800118。
杜娟,周琳,陈霞,闫松,柯敏,陆霞,王铮,余伟,项爱萍。ifn - γ介导的人骨髓间充质干细胞通过肿瘤坏死因子相关凋亡诱导配体体外诱导肿瘤细胞凋亡。中国生物化学杂志,2012;44:1305-14。
Romieu-Mourez R, Francois M, Boivin MN, Bouchentouf M, Spaner DE, Galipeau J.间充质间质细胞中TLR表达和激活的细胞因子调节导致促炎表型。中华免疫杂志2009;182:7963-73。
张泰宇,黄斌,袁志智,胡丽丽,塔巴塔勇,高建强。基因重组骨髓间充质干细胞在非病毒转染肺转移治疗中作为肿瘤靶向自杀基因传递载体。纳米医学。2014;10:257 - 67。
魏铮,陈楠,郭宏,王霞,徐峰,任强,卢松,刘波,张玲,赵慧。白血病患者骨髓间充质干细胞抑制血清缺失K562细胞的生长和凋亡。中华癌症杂志2009;28:141。
米芳,龚玲。骨髓间充质干细胞分泌白细胞介素-6促进肝细胞癌转移。2017.Biosci代表。https://doi.org/10.1042/BSR20170181.
张玲,苏秀生,叶建军,王友友,管志,尹玉峰。骨髓间充质干细胞通过调节免疫系统抑制小鼠转移瘤的发展。干细胞研究。2015;6:45。
Mognetti B, La Montagna G, Perrelli MG, Pagliaro P, Penna C.骨髓间充质干细胞通过产生基质细胞衍生因子-1 α增加前列腺癌细胞的运动性。中国生物医学杂志,2013;17(2):377 - 382。
Shirjang S, Mansoori B, Solali S, Hagh MF, Shamsasenjan K. toll样受体作为间充质干细胞功能的关键调节器:最新综述。细胞免疫杂志,2017;315:1-10。
Romieu-Mourez R, Francois M, Boivin MN, Stagg J, Galipeau J. ifn - γ, tgf - β和细胞密度对小鼠和人间充质间质细胞MHC II类表达和抗原加工的调控。中华免疫杂志2007;179:1549-58。
段旭,管宏,曹勇,Kleinerman ES。小鼠骨髓来源间充质干细胞作为白介素-12基因传递到尤因肉瘤肿瘤的载体。癌症。2009;115:13-22。
Dahl JA, Duggal S, Coulston N, Millar D, Melki J, Shahdadfar A, Brinchmann JE, Collas P.人骨髓间充质干细胞在自体血清或胎牛血清中扩增的遗传和表观遗传不稳定性。中国生物医学工程杂志,2008;
El-Badawy A, Ghoneim MA, Gabr MM, Salah RA, Mohamed IK, Amer M, El-Badri N.癌症细胞可溶性因子重编程间充质基质细胞,使其具有更像干细胞的状态的慢循环,耐化疗细胞。干细胞研究。2017;8:254。
Gjerstorff M, Burns JS, Nielsen O, Kassem M, Ditzel H.在致瘤性人间充质干细胞中癌症生殖系抗原基因表达的表观遗传调节:对癌症治疗的意义。中国医学杂志。2009;175:314-23
戚飞,李安,稻垣勇,高洁,李娟,国都奈,李小康,唐伟。中草药在癌症化疗或放疗中的辅助治疗。生物科学进展。2010;4:297-307。
刘XP,明HX,李培强。半夏泻胃汤对胃癌微环境中骨髓间充质干细胞恶性转化的干预作用。Am J Transl Res. 2016; 8:2937-46。
马友友,刘丽琴,秦丽玲,左桂梅,王艳。含血复珠玉汤体外诱导血清desmin和α -肌动蛋白表达的实验研究。中华综合医学杂志2013;33:1252。
柯波,石磊,徐震,吴刚,龚颖,朱林,王勇,欧阳红,王旭。加味桂桂二仙汤对顺铂诱导的人骨髓间充质干细胞损伤的抑制作用。细胞MolBiol。2018; 64:58 - 64。
杨萍,陈安,秦勇,尹杰,蔡旭,范玉军,李玲,黄海燕。补阳还五汤联合骨髓间充质干细胞移植对脊髓损伤后红核神经元的修复作用。《中华民族药典》2019;228:123-31。
王XX,赵建新,陈睿。扶正益流颗粒含荷瘤小鼠血清对肝癌H22细胞凋亡率、自由基含量及线粒体膜电位的影响。中华综合医学杂志2007;27:3 3。
赵JX。扶正益流颗粒对小鼠肝癌H22细胞凋亡率及线粒体膜电位的影响中华综合医学杂志2006;4:271-4。
赵建新,李小峰,王XX。体抗抑瘤颗粒对食管癌患者肿瘤细胞红细胞免疫粘附功能及转移蛋白CD44表达的影响世界胃肠杂志。2007;13:4360-4。
曾玲,马志,吴娟,王铮,周松,王旭。含血清复正益流汤对胶质瘤环境下骨髓间充质干细胞增殖、周期及凋亡的影响。兰州大学学报(自然科学版)2016;42:7-13。
IoLA R.实验动物的护理和使用指南。出版。2011;327:963-5。
Cima G. AVMA动物安乐死指南2013版。美国兽医学会,2013;242:715-6。
张晓东,张志刚,张志刚,张志刚。骨形态发生蛋白4在人脑恶性胶质瘤中的应用。瘤。2017;19:261 - 70。
郑青,薛伟,尹东野,薛炳洲,W婉婉,Ahmed A, X南翔,J小兵,Z洪阳,彭峰。间充质干细胞治疗恶性胶质瘤的研究现状及潜在挑战。干细胞研究与治疗。2017;9:228。
Dunn-Pirio AM, Vlahovic G.免疫疗法在恶性脑肿瘤治疗中的应用。癌症。2017;123:734-50。
肖玲W,建清G,徐梅O,军波W,肖艺S,圆圆L.紫杉醇-聚乳酸共乙醇酸纳米颗粒载间充质干细胞用于胶质瘤靶向治疗。国际纳米医学杂志,2018;13:5231-48。
石松,闵志,郭睿,马颖,李彪:骨髓间充质干细胞介导的双基因治疗恶性胶质瘤。人类基因治疗: hum.2018.2092 -。
穆尼R,哈马德M,巴塔拉-科维罗J,阿卜杜勒·马吉德A,阿布迪KS。简要综述:神经干细胞介导的靶向癌症治疗。《干细胞转化医学》2018;7:740-7。
Stepanenko AA, Chekhonin VP:胶质母细胞瘤溶瘤病毒治疗和免疫治疗的最新进展:寻找有效治疗方法的一线希望?癌症(巴塞尔)2018年,10。
Matushansky I, Hernando E, Socci ND, Mills JE, Cordon-Cardo C.间充质干细胞通过失活Wnt途径衍生肉瘤。J ClinInvestig。2007; 117:3248-57。
赵艳,陈娟,戴霞,蔡红,季霞,盛艳,刘红,杨玲,陈艳,奚东。人胶质瘤干细胞样细胞通过激活TERT表达诱导骨髓间充质干细胞恶性转化。Oncotarget。2017;8:104418。
Sawada R, Matsuoka A, Matsuda Y, Tsuchiya T.体外培养人间充质干细胞特性的变化。YakugakuZasshi。2008; 128:1851-6。
郑霞,吴峰,林霞,沈玲,冯勇。中药衍生生物碱给药研究进展。药物交付。2018;25:398-416。
濮伟力,孙丽玲,高晓明,Ruegg C, Cuendet M, Hottiger MO,周凯,苗林,张玉生,Gebauer M.抗肿瘤中药靶向肿瘤相关巨噬细胞。中华综合医学杂志2017;23:723-32。
吕福儿,h光英。中医三原则治疗恶性肿瘤的作用机制探讨。中华综合医学杂志2003;9:237-40。
凯璟,杨东:中药联合介入化疗治疗恶性肿瘤的临床研究。《现代西医综合传统》2009。
陈秀珍,曹志勇,廖丽琳,刘志忠,简东。血清药理学在中药扶正益流汤抗肿瘤作用评价中的应用。中华综合医学杂志2013;20:50 50。
魏峰,辛丽琴,舒长波,贝泽波,闫玉刚,龙昌昌,明龙伟,林勇,邱泽波,君YX:抚正益流汤对荷瘤裸鼠前列腺癌抑瘤作用及血清IL-2表达的研究。中药学指导杂志2018.
建军W,龙Z,李永琪,贾勇,湛军M,准灵W,舒宁Z,薛曦W:扶正益流方对C6微环境下骨髓间充质干细胞端粒酶活性及P53表达的影响。中国传统医学科技杂志2017.
Chao S, Jia T, Mendez-Ferrer S, Hohl TM, Serbina NV, Lipuma L, Leiner I, Li MO, Frenette PS, Pamer EG。骨髓间充质干细胞和祖细胞诱导单核细胞迁移响应循环toll样受体配体。免疫力。2011;34:590 - 601。
金华,高伟,何敏。新型免疫细胞因子IL12-SS1 (Fv)抑制裸鼠间皮瘤肿瘤生长。Plos One, 2013;8:e81919。
杨世祥,魏文生,欧燕庆文,蒋庆华,邹艳芳,曲伟,涂建辉,周志波,丁海林,谢春文。白细胞介素12激活的CD8+ T细胞诱导乳腺癌细胞凋亡并抑制肿瘤生长。Biomed Pharmacother, 2016; 84:1466-71。
左松,张霞,王磊。基于RNA测序的胶质母细胞瘤患者生存预测研究。科学通报2019;9:2615。
Skala E, Sitarek P, Toma M, Szemraj J, Radek M, Nieborowska-Skorska M, Skorski T, Wysokinska H, Sliwinski T. Bax/Bcl-2-p53表达改变对人脑胶质瘤细胞增殖的抑制作用Rhaponticum carthamoides从转化根和正常根中提取。J Pharm Pharmacol, 2016; 68:1454-64。
确认
甘肃省财政厅研究服务性经费项目(BH-2013-23)资助;甘肃省教育厅项目(A-079);甘肃省中医药防治慢性疾病重点实验室开放基金项目(GSMBKY2015-10、GSMBKY2015-11),甘肃省高校科研计划项目(2018A-049)。
资金
甘肃省财政厅研究服务性经费项目(BH-2013-23)资助;甘肃省教育厅项目(A-079);甘肃省中医药防治慢性疾病重点实验室开放基金项目(GSMBKY2015-10、GSMBKY2015-11),甘肃省高校科研计划项目(2018A-049)。
作者信息
作者及隶属关系
贡献
YL, GZ, YL和JW设计并指导了这项研究。JW, SX, HL, YZ, JY, RX和CY执行实验室方案。JW和KLiu对结果进行了统计分析。所有作者都对手稿的撰写和审稿做出了贡献。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
本实验动物实验由甘肃中医药大学机构动物护理使用委员会(批准号:2016-269)授权并批准。
同意出版
作者都同意发表这篇论文。
相互竞争的利益
作者声明他们在这篇论文中没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
吴俊,谢松,李宏,李伟。et al。IL-12基因修饰骨髓间充质干细胞联合扶正益流汤对体内胶质瘤裸鼠模型的抗肿瘤作用翻译医学杂志19, 143(2021)。https://doi.org/10.1186/s12967-021-02809-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-021-02809-2
关键字
- 骨髓间充质干细胞
- 神经胶质瘤
- il - 12
- 扶正益流汤