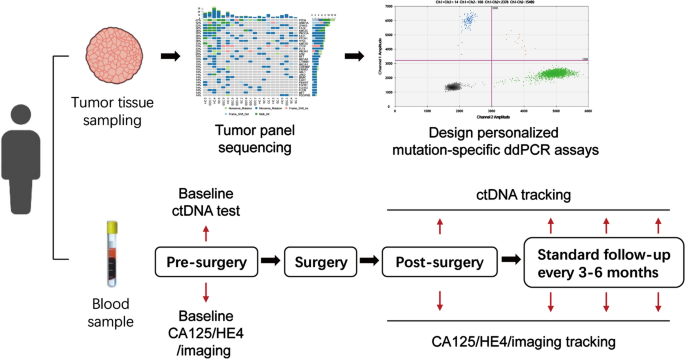
肿瘤面板测序和ddPCR检测方法的建立
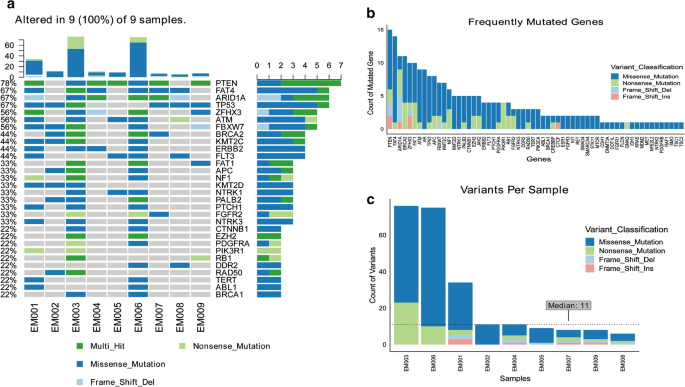
为了确定疾病相关的突变,我们首先对肿瘤样本进行了NGS分析。为此,我们收集了所有9名招募患者的肿瘤样本和相应的血液样本,并使用肿瘤小组(tumor Panel)分析了肿瘤dna。所有病例均发现体细胞突变。9例患者中有7例发现了体细胞PTEN突变,如先前报道的那样,这种突变的频率很高[252个为错义突变,5个为多命中突变(多于一种类型)。TP53所有6例浆液性癌患者(EM001, 002, 003, 007, 008, 009)均存在突变,其中大部分为错义突变,而非浆液性癌患者(EM004, 005, 006)则不存在错义突变。在我们的分析中,最常突变的基因是PTEN,FAT4,ARID1A,TP53,ZFHX3,自动取款机,FBXW7(无花果。2a).结果部分符合EC浆液样/拷贝数高亚群的突变模式,以突变为特征Tp53, pik3ca, fbxw7, ppp2r1a, pik3r1, chd4, pten而且CSMD3(PPP2R1A, CHD4,CSMD3不包括在肿瘤小组内)[25].我们关注的是Tp53 pten pik3ca pik3r1,FBXW7CLISING和cBioportal数据库中记录的这些基因的致病性或可能致病性突变(附加文件)3.:表S3),以确定是否与复发或FIGO分期有关。但复发/非复发病例与晚期/早期病例之间无特异性突变模式。关于突变基因的数量,PTEN我们可以在大多数基因中看到多位点突变(图2)。2b).在EM001、003、006中,变异数远高于其他情况;然而,它与预后或任何其他临床特征无关(图。2c)。
为了追踪血浆DNA中的体细胞突变并识别ctDNA的存在,我们选择了1 - 3个高频突变来为每个病例设计个性化的ddPCR检测(附加文件)4:表S4),种系突变被排除。这些突变通常被报道为外显子上的移码、停止增益或nSNV变异,TPS和ddPCR的检出率与某些ddPCR方法的检出率高度一致。
个体化肿瘤特异性ddPCR分析有效可靠
在每个病例都鉴定出体细胞突变,并建立了个性化的ddPCR检测后,我们在9名患有高风险EC的前瞻性队列中研究了ctDNA分析在高风险EC中的潜在用途(图2)。2).
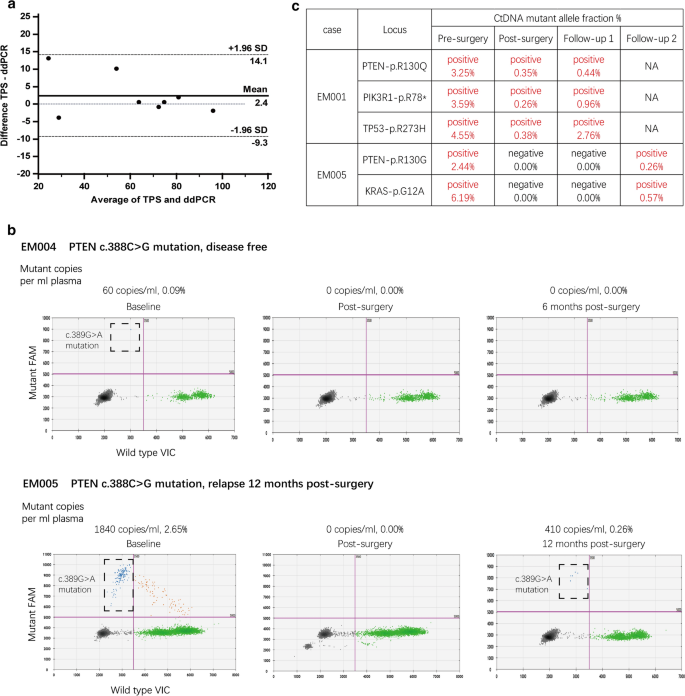
数据显示TPS和ddPCR分析在评估基线肿瘤组织DNA中的突变等位基因部分方面具有高度的一致性(图2)。3.a),证明了开发针对不同突变的ddPCR分析的强大能力。DdPCR在单分子灵敏度下准确定量突变DNA,即使存在大量野生型DNA (64,060 cfDNA拷贝中有60个突变拷贝,0.09%)(图。3.b). EM004和EM005患者的肿瘤存在相同的体细胞突变(PTEN-c.389G > A),无病患者未检测到ctDNA,复发患者检测到ctDNA(图。3.B),证明了该方法的有效性和可靠性。在原发肿瘤中发现不止一种突变的患者中,我们追踪了血浆中的所有突变,在同一血浆中存在/不存在突变的一致性稳定(图2)。3.C),强调所开发的测定方法的可重复性和鲁棒性。
术后ctDNA状态与无病生存期相关
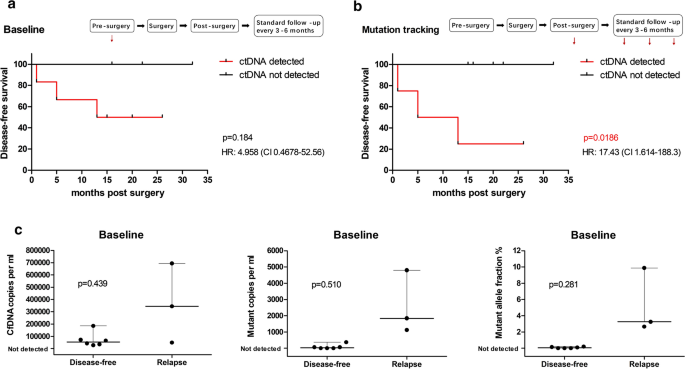
我们确定ddPCR分析的ctDNA状态是否与肿瘤复发相关。如前所述,个性化的ddPCR检测用于跟踪收集的连续血浆样本中的突变。我们评估了不同时间点复发与ctDNA状态之间的相关性。与先前的观察相一致[16],在67%(6 / 9)的基线血浆样本中检测到ctDNA。基线水平包括中位cfDNA水平、突变拷贝数、突变等位基因分数和ctDNA检出率与疾病的晚期状态如FIGO分期和淋巴结状态相关,但与其他临床病理特征如年龄、病理亚型、肿瘤大小、肌层侵犯、LVSI和子宫下段受累无关(表2)1).
基线时CtDNA检测,即在任何治疗前,并不能预测DFS(图。4a).复发患者的CfDNA和ctDNA基线水平高于未复发患者(CfDNA拷贝数:中位数为344,200对52,760/mL;突变拷贝:中位数1840 vs 30/mL;突变等位基因分数:复发和DFS的中位数分别为3.25%和0.045%),尽管没有达到统计学显著性水平(图2)。4c)。
CtDNA在一系列术后血浆样本中的追踪预测肿瘤复发。然后我们评估了ctDNA追踪报告肿瘤复发的潜力。在44%(4 / 9)的患者术后血液检测中检测到CtDNA(图4 / 9)。4b),具有高度可变的突变负载(中位数为900拷贝/mL;范围为290 ~ 81,300拷贝/mL,突变等位基因比例为0.15% ~ 79.47%)。在这些样本中,ctDNA检测可预测肿瘤复发(DFS:中位数为9个月[检测到ctDNA],中位数为未知[未检测到ctDNA];风险比[HR], 17.43 [95% CI, 1.614至188.3])。4b).在ctDNA追踪中,根据基线值,ctDNA检测与FIGO分期和淋巴结转移相关(附加文件5:表S5),与肿瘤大小和肌层侵犯一起,是肿瘤复发的预测因子(附加文件)6:表S6)。这些结果提示,术后ctDNA检测与肿瘤复发密切相关,但由于样本量小,我们在多因素cox回归分析中无法统计证明ctDNA是独立的预后因素(P = 0.336, HR, 0.007, 95% CI 0.000-164.011)。
CtDNA在肿瘤复发检测方面优于CA125或HE4
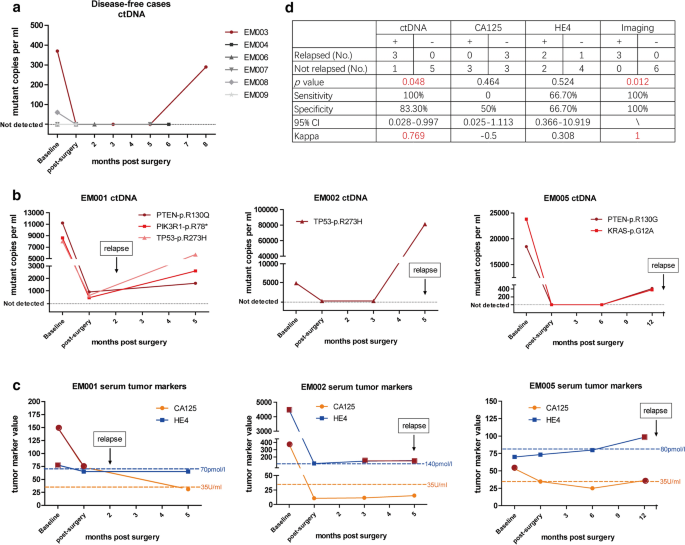
在分析ctDNA时,同时监测常用的上皮肿瘤标志物CA125和HE4。在未复发的患者中,5/6的患者术后血浆中均未检测到ctDNA (P = 0.048)。1例患者(EM003)在术后8个月检测到ctDNA,但在术后26个月的随访期间无疾病(图。5a).在随访期复发的患者中,所有病例(3/3)在术后血浆样本中均检测出ctDNA(图3)。5b)。
普通肿瘤标志物的表现不如ctDNA检测可靠。所有复发病例CA125阴性,假阴性率极高,无病病例CA125阳性占一半(3/6)。HE4在估计肿瘤复发的敏感性和特异性均为66.7%,kappa指数为0.308,仅表明该标志物与肿瘤复发估计具有较好的一致性(图3)。5c).影像学与复发完全一致,敏感性和特异性100%。总体而言,术后ctDNA检测对判断肿瘤复发的敏感性为100%,特异性为83.3%,kappa指数为0.769,表明术后ctDNA检测与肿瘤复发具有较好的一致性(图2)。5d)。