摘要
背景
冠状病毒病(COVID-19)的爆发是由严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)通过其表面突刺糖蛋白(s蛋白)识别人类受体血管紧张素转换酶2 (ACE2)引起的。然而,目前尚不清楚ACE2基因变异如何影响其功能和结构,从而改变SARS-CoV-2的识别。
方法
我们利用基因组聚合数据库(gnomAD;n = 141456)。为了研究误义变量的假定有害作用,应用了六种现有的功能预测工具来评估其影响。我们利用开发的军团界面分析(LiAn)程序进一步分析了ACE2的结构灵活性及其与SARS-CoV-2 s蛋白的蛋白-蛋白界面。
结果
在这里,我们共鉴定了12个假定有害的ACE2错义变异。在这12个变体中,我们进一步证明了p.His378Arg可以直接削弱催化金属原子的结合以降低ACE2活性,p.Ser19Pro可以扭曲s蛋白最重要的螺旋。另外7个错义变体可能会影响二级结构(即p.Gly211Arg;p.Asp206Gly;p.Arg219Cys;p.Arg219His, p.Lys341Arg, p.Ile468Val和p.Ser547Cys),而AF = 0.01的p.Ile468Val仅存在于亚洲。
结论
我们提供了强有力的证据,证明在特定人群中存在假定的有害的ACE2错义变异,这可能会破坏ACE2的功能和结构。这些发现为ACE2基因变异可能影响SARS-CoV-2的识别和感染,以及COVID-19的易感性和治疗提供了新的见解。
背景
由新型冠状病毒(SARS-CoV-2)引起的2019年冠状病毒病(COVID-19)暴发已被定性为全球大流行[1,2,3.,4,5].COVID-19正在全球迅速蔓延,影响到所有人群。已有文献证明,SARS-CoV-2的s蛋白在识别血管紧张素转换酶的肽酶结构域(PD)中起关键作用(ACE2)在人类中的作用[6,7].新型冠状病毒(SARS-CoV-2)的三维蛋白质结构已被确定,这为新冠病毒的疫苗研制、抗体设计和药物研发等治疗提供了重要依据[7].3CLpro的第一个x射线结晶结构由Liu等人以2.16 Å分辨率(Protein data bank (PDB) id 6lu7)解析。Wrapp等人在3.46 Å分辨率下通过电子显微镜(PDB id 6vsb)首次观察到病毒s蛋白结构[8].西湖大学研究所首次观察到具有人ACE2 Cryo-EM结构的全长s蛋白复合物[7],几乎与此同时,清华大学在2.45 Å re solution解出了与ACE2配合物中s蛋白RBD结构域的x射线结构[9].Zhu等人测定了S2亚基的两个x射线结构(PDB id 6lxt和6lvn)。除SARS- cov -2外,ACE2的几种三维结构,特别是与SARS s蛋白复合物的三维结构已被解决。这表明当ACE2结合抑制剂或病毒s蛋白时,它的结构可以灵活地在开放和关闭状态之间切换。遗传变异,特别是这些灵活区域的有害错义变异,可能会影响其功能和结构,从而改变SARS-CoV-2的识别。因此,系统地描述和评估ACE2中的潜在有害变异非常重要,这些变异可能会影响SARS-CoV-2的识别和感染,以及COVID-19的易感性和治疗。
方法
从基因组聚合数据库中鉴定ACE2基因变异
基因组聚合数据库(gnomAD v2.1.1)通过网站浏览器提供了来自125,748个WES和15708个来自不相关个体的全基因组序列的种系变异的汇总数据(即等位基因数),这些序列是各种特定疾病和群体遗传研究的一部分http://gnomad.broadinstitute.org/.在去除低质量控制或等位基因频率(AF) = 0的ACE2基因后,我们共鉴定了251个位于ACE2基因中的非沉默遗传变异,包括错义、剪接、停止增益/损失和移码/帧内缺失(附加文件)1).接下来,我们只关注了前21个ACE2误感变型与AF > 8 × 10−5在合并人群中,占携带非沉默变异的主体的主要比例(附加文件1).
变体注释,生物信息学和统计分析
ANNOVAR工具[10]用于标注错义和破坏变量。破坏性变异由无意义、剪接位点和移码来定义。为了进一步评估错义变异对功能的影响,我们通过5种蛋白质预测算法(包括polyphen2 HumDiv, Poplyphen HumVar, Sorting in耐受性从耐受性(SIFT),逻辑回归测试分数和MutationTaster)注释了氨基酸替代对结构/功能的可能影响。在前21个ACE2错义变体中,有一个AF > 8 × 10−5在组合群体中,只进一步分析了至少两种工具预测的假定有害误义变异。
ACE2蛋白结构分析及新冠病毒刺突糖蛋白与ACE2相互作用
蛋白质结构可从RCSB蛋白质数据库或作者网站下载。蛋白质结构图和动画是由PyMol和它的Morph函数[11].二维交互图由Schrödinger Maestro软件制作[12].三维相互作用图由我们自主开发的Legion Interfaces Analysis (LiAn)程序生成,该程序可以计算和显示蛋白质与配体或蛋白质与蛋白质的相互作用(如氢键、盐桥、水桥、π-相互作用、疏水相互作用、卤素键等),用于单个蛋白质结构或分子动力学模拟的大规模结构。LiAn程序还集成了蛋白质-蛋白质界面分析、蛋白质结构聚类、蛋白质相互作用能计算和固定水预测,可自动分析大量蛋白质结构。
结果
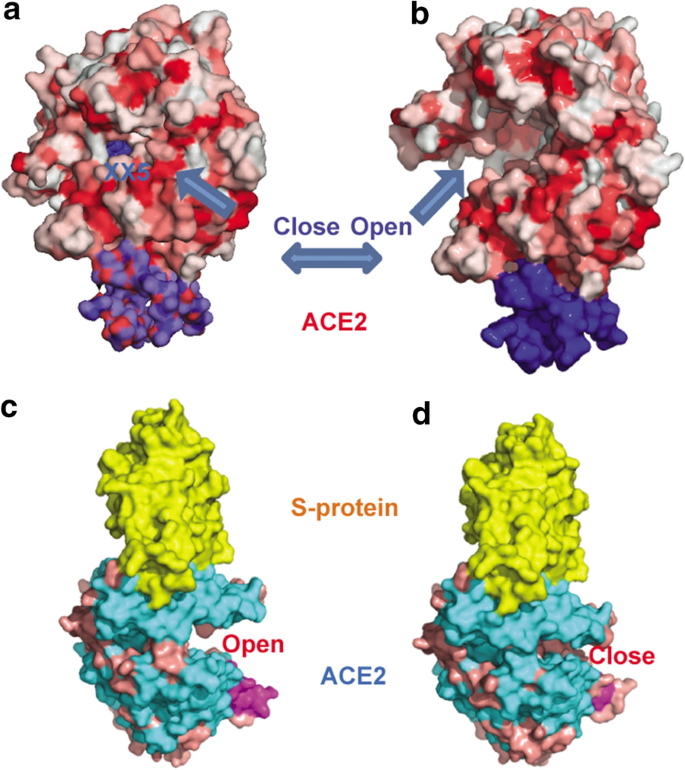
为了说明遗传变异如何影响结构,我们分析了ACE2和SARS-Cov-2之间的结构相互作用。如图所示。1a, b和附加文件2:图S1中,我们证明了ACE2的原生态和配体结合态通过较大的铰链弯曲运动具有开放和闭合两种状态[13].在开放状态下,ACE2从其活性位点大开,等待配体进入。当配体进入ACE2活性位点时,触发ACE2关闭活性槽。大多数SARS结合结构(如PDB ids 2ajf, 30g, 3kbh, 3scl)表明s蛋白结合ACE2的开放/原生状态。然而,如图所示。1c, d和附加文件2:图S2, PDB 3scl中的两个单体显示SARS刺突蛋白既可以以开放状态结合ACE2,也可以以封闭状态结合ACE2,这意味着ACE2的构象变化可以由来自内部活性位点的抑制剂或来自外部PPI (protein-protein interface)位点的s蛋白触发。Lys341和Thr129之间的巨大构象变化可达14 Å。与SARS-Cov-2 s蛋白接触的两个n端螺旋(Ser19-Asn53, Ile54-Met82)是最灵活的区域之一。螺旋的铰链运动以Trp83-Asn90的环区为中心。我们还观察到SARS-CoV-2刺突糖蛋白与ACE2的蛋白-蛋白界面具有更多的亲水残基而非疏水残基。ACE2在3 Å距离s蛋白范围内的残基分别为Gln24、His34、Asp38、Tyr41、Gln42、Tyr83和Lys353到Gly446、Tyr449、Tyr453、Asn487、Thr500和Gly502。PPI界面结合6个氢键(Gln24-Asn487, Gln42-Gly446, Gln42-Gln498, Lys353-Gly502), 1个π-阳离子相互作用网络(Tyr41-Gln498, Tyr41-Asn501, Gln42-Tyr449, Tyr83-Asn487, Gln493-His34), 1个π-堆叠相互作用(Tyr83-Phe486), 1个疏水相互作用对(Met82-Phe486)。总之,ACE2的结构灵活性意味着它的结构可能被ACE2中改变的氨基酸的潜在有害的错义变体扭曲,这可能因此影响它与病毒中s蛋白的结合效率。
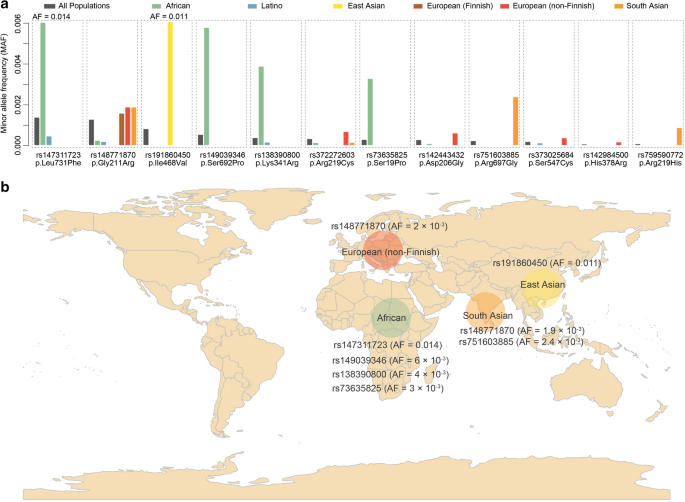
接下来,我们分析了来自gnomAD的ACE2的种系编码变体,并使用六种现有的生物信息学工具进行了功能预测(参见“方法”)。我们共鉴定了12个ACE2假定的有害错义变异,而所有工具预测的功能中断的顶级变异包括p.Leu731Phe (rs147311723, AF = 0.01在非洲),p.Arg219Cys (rs372272603, AF = 7 × 10−4, p.Ser547Cys (rs373025684, AF = 4 × 10−4p.His378Arg (rs142984500, AF = 2 × 10−4在欧洲)(表1).其中,我们观察到这些变异在所有人群中表现出低频率或罕见(图2)。2一个;表格1).特征变异体的AF在群体中各不相同,而大多数都表现出群体特异性(图2)。2a).特别地,我们观察到在非洲(rs147311723)和东亚(s191860450)分别出现了两个频率较低的变异(图。2b).其他错义变异的最高AF位点包括非洲(rs73635825、rs138390800和rs149039346)、东亚(rs191860450)、南亚(rs148771870和rs751603885)和欧洲(rs148771870)(图。2b)。
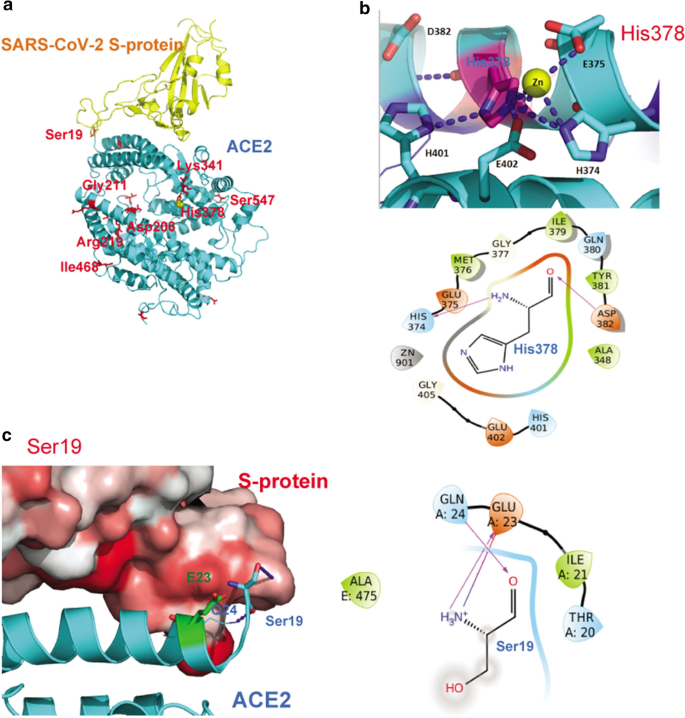
我们进一步分析了ACE2的结构灵活性及其与SARS-CoV-2 s蛋白RBD的相互作用,使用二维或三维相互作用图(见“方法8个残基上的9个错义变体,如图所示。3.a.我们发现p.His378Arg可以直接削弱催化金属原子的结合从而降低ACE2的催化活性,p.Ser19Pro (rs73635825, AF = 3 × 10−3在非洲)可能会扭曲最重要的螺旋与s蛋白相互作用。
His378Arg
如图所示。3.b, His378是催化金属原子与Glu375、Glu402固定在一起的关键残基。它突变为更长的精氨酸将破坏锌原子的螯合网络,这可能导致其肽酶活性减弱。同时,His378还通过与Glu402和His401的氢键和π相互作用稳定了催化中心的结构。因此,His378Arg突变体可以降低ACE2肽酶的功能,破坏ACE2结构的稳定。
Ser19Pro
Ser19是第一个能在x射线结构中显示的n端残基,如图所示。3.c (9].它位于螺旋结构Ser19-Ile54的开始,是接触病毒s蛋白最重要的区域之一。其主链与Glu23和Gln24形成氢键,稳定螺旋结构。它也可能通过弱亲水相互作用与SARS-CoV-2 s蛋白中的Ser477相互作用。脯氨酸具有较差的螺旋形成倾向,因为它会破坏或扭曲螺旋[14].因此,Ser19Pro突变可能导致螺旋结构不稳定。
我们还发现了另外7个可能影响二级结构的错义变体(即p.Gly211Arg/rs148771870;p.Asp206Gly / rs142443432;p.Arg219Cys / rs759590772;p.Arg219His/rs759590772、p.Lys341Arg/rs138390800、p.Ile468Val/rs191860450和p.Ser547Cys/rs373025684),而AF = 0.01的p.Ile468Val/rs191860450仅在亚洲地区存在。
Gly211Arg
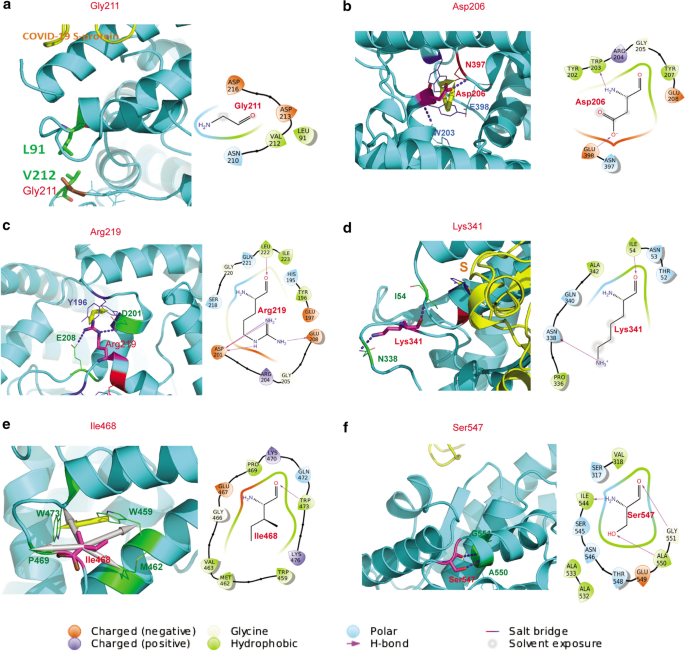
Gly211位于循环的转折点,如图所示。4a.其相邻的Val212与Leu91有强烈的疏水相互作用,使ACE2结构跨二级结构稳定。其突变为长型阳性精氨酸不利于环车削。此外,其精氨酸突变也在该区域引入亲水基团,这可能削弱了Val212-Leu91的重要疏水相互作用对。因此,Gly211Arg突变可能导致ACE2结构不稳定。
Asp206Gly
如图所示,Asp206位于Tyr199-Tyr207的螺旋上,通过与Asn397/Glu398的氢键稳定多个二级结构。4b.其突变为甘氨酸可能会对ACE2抑制剂的结合位点发生变构影响,因为它可能会扰乱Glu398-Ala413的螺旋位置,而这对催化锌原子的结合至关重要。
Arg219Cys /他
Arg219是稳定三个螺旋的关键中心残基,分别是Asp157-Tyr196、Asp198-Glu208和Arg219 - tyr252。如图所示。4c, Arg219与Asp201、Glu208存在强的盐桥、氢键和电荷相互作用,并存在阳离子-π相互作用,与Tyr196跨二级结构稳定蛋白质。它突变为半胱氨酸或组氨酸会中断强相互作用,使蛋白质结构不稳定。
Lys341Arg
如图所示,Lys341在一个环上,以稳定从骨干氢键到Ile54的另一个环。4d.通过与Asn338形成强氢键使环结构稳定。它突变为更长的精氨酸可能会削弱这个氢键,并使环结构略微不稳定。
Ile468Val
如图所示。4e, Ile468位于一个环的转折点,通过与Trp459、Met462、Pro469和Trp473的疏水相互作用,稳定两个螺旋结构(螺旋Asp431-Lys465和Trp473 - val485),并与Trp473形成主链氢键。Trp459和Trp473对的π-堆叠相互作用是两个螺旋束的重要相互作用。Ile468通过固定两个色氨酸的位置来陪伴这对相互作用。因此,其突变为缬氨酸,其侧链较短,疏水作用较弱,可能会轻微削弱两个螺旋的接触,使蛋白质结构不稳定。
Ser547Cys
如图所示。4f, Ser547通过与Ala550和Gly551的氢键稳定局部螺旋Ser547 - gly561。其突变为半胱氨酸可能削弱Ala550从羟基侧链到巯基的氢键,从而使螺旋结构略微不稳定。
讨论
如图所示。3.当ACE2与抑制剂或病毒s蛋白结合时,其结构具有灵活性。因此,氨基酸的改变也可能引起构象的改变。虽然我们分析的一些错义变异并不直接位于PPI表面,但改变的氨基酸可以影响病毒s蛋白的变构结合。由于抑制剂在活性位点内的结合,通过巨大的构象变化,使ACE2由开放状态进入封闭状态,活性位点残基氨基酸的改变更容易引起ACE2的结构变化。因此,His378Arg氨基酸的改变可能不仅降低了ACE2肽酶的活性,而且改变了一个PPI区域的结构,从而影响s蛋白的结合。当S19突变为螺旋“杀手”脯氨酸时,它可能会破坏与s蛋白接触的最重要的螺旋。对于SARS, ACE2的24QAK到24KAE突变体轻微抑制与穗状糖蛋白的相互作用[15].Gly211Arg, Asp206Gly, Arg219Cys/His, Lys341Arg和Ile468Val可能影响二级结构之间的相互作用。因此,它们的突变可能会显著地破坏局部结构的稳定。Ser547Cys可能只影响一个二级结构的稳定性,这可能对s蛋白结合有轻微影响。如表所示1, Procko [16]通过深度诱变实验研究了2340个人类ACE2突变体的病毒结合能力。这表明Ser19Pro突变体是病毒结合的强助推器,His378Arg是弱助推器。因此,根据他的实验结果,来自Ser19Pro或His378Arg突变的局部结构变化可能会从变构上增强s蛋白相互作用。值得注意的是,我们预测的蛋白质结构中的有害变异缺乏实验验证。为了进一步证实它们对ACE2功能的潜在影响,还需要进一步的研究。需要指出的是,在理论预测中,不同的研究者基于不同的标准和方法,对突变效应给出了不同的结论。例如,对于Ser19Pro突变,一些研究小组预测它是相互作用的助推器[17,18,19],以及其他研究小组发现的相互作用抑制剂[20.,21].
最近的一项全基因组关联研究(GWAS)由严重COVID-19 GWAS小组进行,包括835名COVID-19和严重疾病(定义为呼吸衰竭)患者和来自意大利的1255名对照参与者,以及来自西班牙的775名患者和950名对照参与者[22].他们发现了与COVID-19呼吸衰竭相关的多种遗传变异和基因。虽然我们的研究在不同人群中描述了ACE2的功能和结构相关的假定变异,但缺乏COVID-19的表型使我们无法确定与COVID-19表型相关的易感变异。然而,我们的发现,以及其他ACE2基因研究[17,19],可以优先考虑ACE2中有前景的变异,以便对COVID-19患者的血液样本进行进一步的快速基因分型,这可能为识别与COVID-19患者症状相关的ACE2易感变异提供了一个很好的机会。另一方面,我们的发现也可能为目前的疫苗开发提供可能的考虑,即携带ACE2中已识别变异的个体,特别是那些ACE2与SARS-CoV-2 s蛋白相互作用的个体。
结论
在这项研究中,我们鉴定了ACE2基因中总共12个假定的有害错义变异。其中,我们进一步提供了强有力的证据,证明9个错义变体可能破坏SARS-CoV-2 ACE2蛋白结构的柔性区域或其与s蛋白RBD的蛋白-蛋白相互作用。这项研究的结果强调了在特定人群中存在的ACE2基因有害错义变异的重要作用,这可能会影响SARS-CoV-2的识别和感染。这些变异对于制定适当的COVID-19预防、控制和治疗战略以区分携带和非携带这些有害变异的个体可能非常重要。我们的发现也可能为部分解释为什么不同地区和不同人群的发病率和死亡率存在显著差异提供线索。
数据和材料的可用性
位于ACE2的所有具有特征的非沉默变体都列在附加文件中1在我们的研究中。利用ANNOVAR (https://doc-openbio.readthedocs.io/projects/annovar/).我们内部开发的LiAn工具未来将在网上提供。
缩写
- COVID-19:
-
冠状病毒病
- SARS-CoV-2:
-
严重急性呼吸综合征冠状病毒2
- S-protein:
-
斯派克糖蛋白
- ACE2:
-
血管紧张素转换酶2
- gnomAD:
-
基因组聚合数据库
- 丽安:
-
军团界面分析
- 帕金森病:
-
肽酶域
- PDB:
-
蛋白质数据库
- PPI:
-
蛋白质界面
- 房颤:
-
等位基因频率
参考文献
黄超,王勇,李霞,等。武汉地区新型冠状病毒感染患者临床特征分析柳叶刀》。2020;395(10223):497 - 506。
梁伟,关伟,陈锐,等。SARS-CoV-2感染的癌症患者:中国全国范围内的分析《医学杂志》2020;21(3):335-7。
王东,胡波,胡超,等。武汉市138例新型冠状病毒感染的肺炎住院患者临床特征分析《美国医学协会杂志》上。2020年,323(11):1061 - 9。
杨旭,于勇,徐健,等。中国武汉SARS-CoV-2肺炎重症患者的临床病程和转归:一项单中心、回顾性、观察性研究中国呼吸医学杂志,2020;8(5):474-81。
朱楠,张东,王伟,等。2019年中国肺炎患者的新型冠状病毒。中华实用医学杂志,2015;29(4):344 - 344。
李峰,李伟,李文杰,李文杰。SARS冠状病毒刺突受体结合域与受体复合物的结构。科学。2005;309(5742):1864 - 8。
闫锐,张颖,李艳,夏玲,郭艳,周强。人ACE2全长识别SARS-CoV-2的结构基础。科学。2020;367(6485):1444 - 8。
王永强,王永强,等。预融合构象中2019-nCoV峰值的冷冻电镜结构。科学。2020;367(6483):1260 - 3。
兰娟,葛娟,于娟,等。2019-nCoV刺突受体结合域与ACE2受体结合的晶体结构。在bioRxiv预印本。2020.https://www.biorxiv.org/content/10.1101/2020.02.19.956235v1.
王凯,李敏,Hakonarson H. ANNOVAR:基于高通量测序数据的基因变异功能注释。中国生物医学工程学报,2010;38(16):e164。
PyMol薛定谔。发布2020-2:大师,薛定谔,LLC,纽约,纽约州,2020年。
大师。薛定谔发布2020-2:大师,薛定谔,LLC,纽约,纽约州,2020年。
王志强,王志强,王志强,等。ACE2 x射线结构揭示了一个大的铰链弯曲运动,这对抑制剂的结合和催化很重要。中国生物医学工程学报,2004;29(4):379 - 379。
佩斯CN,肖尔茨JM。基于多肽和蛋白质实验研究的螺旋倾向量表。中国生物工程学报,1998;30(1):422 - 422。
李伟,张超,隋娟,等。sars冠状病毒适应人类ACE2的受体和病毒决定因素。中国地质大学学报,2005;24(8):1634-43。
人ACE2序列与SARS冠状病毒2的S刺突蛋白结合不理想。在medRxiv预印本。2020.https://www.biorxiv.org/content/10.1101/2020.03.16.994236v1.
MacGowan SA, Barton GJ。ACE2的错义变异预计会鼓励和抑制与SARS-CoV-2 Spike的相互作用,并导致COVID-19的遗传风险。在bioRxiv预印本。2020.https://www.biorxiv.org/content/10.1101/2020.05.03.074781v1.
王志强,王志强,王志强,等。人类ACE2受体多态性预测SARS-CoV-2易感性。在bioRxiv预印本。2020.https://www.biorxiv.org/content/10.1101/2020.04.07.024752v1.
Darbani B.人类COVID-19进入机制的表达和多态性:并置人群、性别和不同组织。国际环境与公共卫生杂志,2020;17(10):3433。
张志刚,张志刚,张志刚,等。ACE2多态性与个体对SARS-CoV-2感染的易感性:来自硅内研究的见解。在bioRxiv预印本。2020.https://www.biorxiv.org/content/10.1101/2020.04.23.057042v1.
胡珊,贾宾,拉扎,等。人类ACE2的结构变化可能会影响其与SARS-CoV-2刺突蛋白的结合。中国医学病毒学杂志,2020;92:1580-6。https://doi.org/10.1002/jmv.25832.
李志强,李志强,等。重症Covid-19与呼吸衰竭的全基因组关联研究英国医学,2020年。https://doi.org/10.1056/NEJMoa2020283.
确认
我们感谢gnomAD和RCSB蛋白质数据库为本研究提供了宝贵的数据资源。我们也感谢杨格元帅在编辑和手稿准备方面的协助。
资金
H. Li的工作得到了美国国立卫生研究院国家癌症研究所的部分支持,资助号为P30CA033572。
作者信息
作者及隶属关系
贡献
XG构思并设计了该研究。XG、WL和HL进行了数据、生物信息学和蛋白质结构分析。XG, WL和HL撰写了手稿,ZC和YX贡献了手稿。所有作者都审阅了文章的内容。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
我们声明没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
在去除低质量控制或AF = 0的基因后,共鉴定出251个ACE2基因的非沉默遗传变异。
附加文件2:图S1。
ACE2打开状态和关闭状态的视频。图S2。SARS s蛋白结合ACE2开启和关闭状态的视频。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
郭,X,陈,Z,夏,Y。et al。新型冠状病毒(SARS-CoV-2)结构识别ACE2基因变异研究翻译医学杂志18, 321(2020)。https://doi.org/10.1186/s12967-020-02486-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-020-02486-7
关键字
- 新型冠状病毒肺炎
- ACE2
- SARS-CoV-2
- S-protein
- 错义