摘要
背景
检测心外膜脂肪组织(EAT)的发育、功能及治疗潜力;分析相关基因表达数据集,包括新生儿、婴儿和先天性心脏病(CHD)患儿的数据;比较数据以鉴定共差异表达(DE) mrna和lncrna以及相应的mirna;产生潜在的竞争性内源性RNA (ceRNA)网络;并评估免疫细胞浸润在胃食管炎发展中的作用。
方法
使用了微阵列数据算法(LIMMA)、CIBERSORT、基因集富集分析(GSEA)和基因集变异分析(GSVA)的多种线性模型算法。使用miRcode、miRDB、miRTarBase和TargetScan数据库构建ceRNA网络。对DE mrna进行基因本体(GO)和京都基因与基因组百科全书(KEGG)途径富集分析。
结果
随后鉴定了13个co-DE mrna和47个co-DE lncrna。相关类别包括成肌细胞分化的负调控、离子跨膜运输的调控和心脏发育,这些主要是为了进一步的途径富集分析而确定的。此外,中心ceRNA网络在EAT的发展涉及MIR210HGhsa-miR-449c-5p,和CACNA2D4产生并显示针对单核细胞浸润。
结论
这些发现提示成肌细胞分化和离子跨膜转运通路可能是参与冠心病患者EAT发展的潜在中枢通路。此外,该网络还包括单核细胞,MIR210HG,CACNA2D4,这些因子可靶向rig - i样受体信号通路和PPAR信号通路,表明这些因子可能是EAT发展过程中新的调节因子和治疗靶点。
背景
心外膜脂肪组织(EAT)位于心脏和冠状血管周围,是一个复杂的代谢和内分泌器官,在各种生理或病理生理过程中具有双重作用。已知EAT具有保护作用,作为机械缓冲液和心肌和血管动脉中游离脂肪酸(FFAs)的快速来源[1].在EAT和其他脂肪组织储存库之间有关键的代谢差异。重要的是,Iacobellis小组的一项系统综述显示,与其他内脏脂肪相比,EAT中脂肪酸的合成、释放和分解速度明显更高,并且EAT也表现出更低的葡萄糖利用率[2].此外,EAT似乎富含饱和脂肪酸和代谢相关蛋白质,并可能通过为缺血心肌提供能量底物来保护心肌和血管动脉,防止心肌中游离脂肪酸水平升高和动脉血管损伤[3.].EAT较高的溶脂潜能也可能有助于满足心肌能量需求的增加,特别是在运动相关代谢或缺血的情况下[1,4,5].虽然脂肪酸可能是维持心脏代谢和收缩功能的主要能量底物,但脂肪酸的摄取也会导致线粒体结构和功能的损害以及有毒代谢物的积累,包括膜电位紊乱,Ca2+超载,细胞色素c (Cyt-C)释放;这些变化诱发氧化应激并破坏代谢途径[6].解剖上,EAT与没有筋膜样结构的下层心肌有共同的血液供应[5].研究人员越来越多地认为,EAT参与与冠状动脉粥样硬化、舒张功能障碍、心房颤动和进行性心室重构相关的病理生理过程,对心脏血管系统产生外分泌和旁分泌作用[4,7,8].最近,越来越多的数据表明,EAT含有高密度的淋巴细胞簇,它被普遍认为是免疫调节和炎症介质的来源[9].值得注意的是,在EAT的形成和心脏重塑的病理过程中存在着相互加强的关系。
对于成人患者,Patel等人发现EAT可分泌多种脂肪因子,包括apelin、脂联素、肾上腺髓质素、血管紧张素原、瘦素和visfatin,并具有调节炎症、免疫反应、冠状动脉斑块、心室重构和血管平滑肌细胞生长和迁移的潜在旁分泌功能[5].Sakamoto等人发现免疫炎症介质与冠状动脉钙化之间存在显著关联,这可能反映了与心血管重构发展相关的免疫炎症机制[7].有趣的是,炎性细胞因子、炎性脂肪因子和M1/M2巨噬细胞在EAT中显著积聚,加重了缺血状况和心肌梗死损伤[7].Park等人分析了临床研究的证据,清楚地证明EAT厚度可以预测亚洲人群代谢综合征和冠状动脉粥样硬化的发生,并指出在BMI < 27 kg/m的患者中更强2[10].此外,对于儿科患者来说,婴儿阶段的营养需求和器官发育形态对生命至关重要。Ojha等在比较不同发育阶段的产热基因转录本时发现EAT组织中存在独特的基因表达模式(~ 10%)[11].Chechi等人发现产热基因的表达与氧化应激和免疫相关途径显著相关,在EAT组织内的微环境调节和心肌细胞与间质细胞之间的局部串音中也发挥着重要作用[12,13].
在这种情况下,免疫和内分泌器官EAT可能作为心血管系统发展的关键炎症介质发挥作用。这里,胰岛素样生长因子1受体(IGF1R)在心肌损伤后受到刺激,进而促进心外膜细胞向脂肪细胞分化,保护心肌细胞,保证心脏祖细胞的存活[14].相比之下,EAT作为次级淋巴器官,调节先天和适应性免疫反应,从而局部和系统地促进免疫细胞增殖,激活炎症受体,并通过血管壁招募脂质沉积[9].在这项研究中,我们进行了系统的微阵列分析,以揭示基因表达变化,炎症细胞浸润和非编码rna -免疫细胞协同调节网络,这可能有助于我们识别新的生物标志物和治疗靶点。
方法
数据源和流程
我们基于R软件的“affy”软件包进行了差分表达式(DE)分析,该软件包根据表达式数据背景校正、log2变换、数据归一化以及线性模型和DE分析等数据处理原则进行了策划。在这里,数据归一化、缺失值处理和强大的DE分析分别通过微阵列数据算法(LIMMA)的鲁棒多阵列平均(RMA)、k近邻(KNN)和线性模型的函数进行[15].我们定义了调整后的DE阈值p-value,经Benjamini-Hochberg方法校正,小于0.05和|log2fold-change (FC)| > 1.5。在这里,这些基因被鉴定为具有显著增加的(log)2FC > 1.5)或降低(log2FC <−1.5)表达式。数字1用R(版本3.6.1)和Perl(版本5.30.1)工具箱进行统计分析。
免疫浸润亚型检测
在这个例程中,我们应用了CIBERSORT算法(https://cibersort.stanford.edu/),利用R工具包中的系统级基因表达数据,基于基因表达数据的线性支持向量回归(SVR)算法,估算EAT发展过程中免疫浸润亚型的负担[16].选取中心细胞亚型,参数设置如下:(1)所有基因表达数据通过RMA算法归一化;(2) perm参数为1000;(3)组间有统计学差异p-value < 0.05;(4)新生儿组、婴幼儿组和儿童组间的多重比较采用单因素方差分析检验p-值由Bonferroni方法。
基因集生物信息学富集分析
基因本体(GO)术语富集分析使用MetaScape数据库(http://metascape.org/),这是一个基于网络的分析工具,用于基因功能富集分析[17].值得注意的是,DE基因在生物过程、分子功能和细胞成分中的主要氧化石墨烯术语被阐明。参数设置如下:(1)最小重叠量为3;(2)截止p-value = 0.05;(3)最小富集分数= 1.5。
基于时间序列相关的京都基因与基因组百科全书(KEGG)途径和生物过程项富集,进行了基因集富集分析(GSEA;http://software.broadinstitute.org/gsea/index.jsp)被执行[18].参数如下:(1)显著富集阈值为p-value < 0.05;(2)排列试验数= 1000;(3)通过时间序列实验将基因谱定义为用于EAT发育的连续表型,并将其定义为响应中枢mrna表达水平/免疫细胞浸润的类标记;(4)加权采用富集统计量;(5)所选基因排序指标皮尔森进行时间序列分析,并定义了“Signal2Noise”进行分类分析。
竞争内源性RNA (ceRNA)调控网络的构建
lncrna、mirna和mrna的ceRNA网络基于miRcode (http://www.mircode.org/) [19]、miRDB (http://mirdb.org/) [20.]、miRTarBase (http://mirtarbase.mbc.nctu.edu.tw/php/index.php) [21]和TargetScan (http://www.targetscan.org/mamm_31/)资料库[22].在这里,分析分为几个步骤,包括:(1)基于HUGO Gene Nomenclature Committee (HGNC)数据库和Affymetrix HG-U133 Plus 2.0阵列的NetAffx注释和DE分析计算差异表达lncrna [23];(2)基于miRcode数据库中高度保守的microRNA家族文件,预测microRNA与DE lncrna的结合;(3)通过比较miRDB、miRTarBase和TargetScan数据库的注释文件,以匹配数据库数≥2为标准,预测上一步中识别的miRNAs结合的mrna;(4)在确定重叠的靶mrna和DE mrna后选择枢纽mrna。
鉴定靶基因的下游调控途径
根据靶基因、lncRNA和浸润免疫细胞的中位表达值分组后,我们采用基因集富集分析(GSEA)检测下游通路。通过聚类分析得到归一化富集分数(NES)皮尔森统计方法[18].此外,在确定了潜在的调控途径后,我们采用基于非参数无监督方法的基因集变异分析(GSVA)包来探索每个样本中枢纽基因的表达与枢纽ceRNA网络和候选免疫细胞的关系[24].
候选免疫细胞、调控网络和枢纽基因的验证
最后,我们还验证了基于GSE115799数据集的免疫细胞浸润、调控网络和枢纽基因表达与EAT发展相关的景观羊属白羊座。采用CIBERSORT算法比较1周龄和4周龄的EAT样本免疫浸润情况。此外,候选途径变异通过GSVA包进行评估。采用LIMMA算法进行强大DE分析,比较两组患者mRNA和lncRNA的表达值。
结果
枢纽通路和差异表达基因的检测
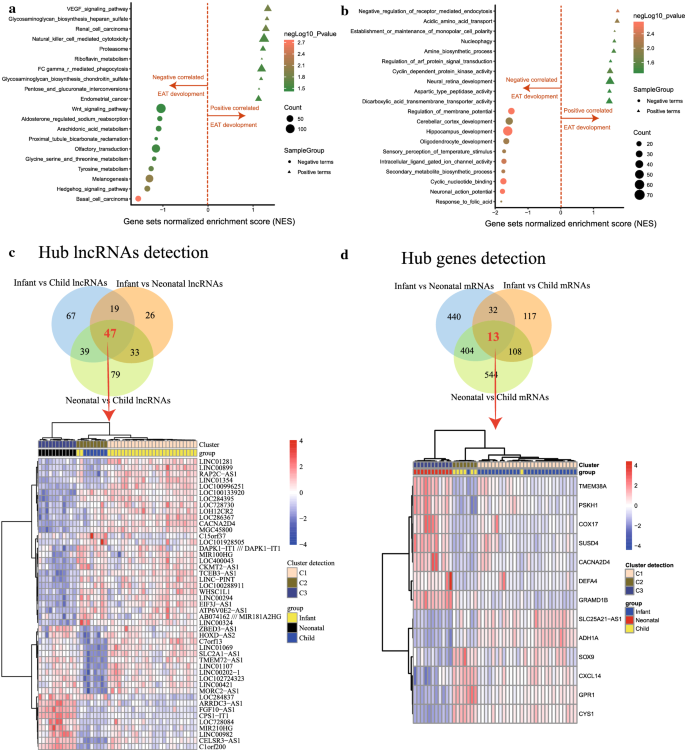
基于时间序列分析的GSEA结果显示,基底细胞癌的KEGG分类(size = 52, NES = - 1.56,p值= 0.001),杀菌作用(大小= 96,NES =−1.32,p-value = 0.009), hedgehog信号通路(size = 53, NES =−1.36,p-value = 0.011)与EAT的发展呈负相关,而其他类别包括VEGF信号通路(size = 70, NES = 1.33,p-value = 0.015),糖胺聚糖生物合成硫酸肝素(size = 26, NES = 1.31,p-value = 0.015),肾细胞癌(size = 69, NES = 1.28,p-value = 0.016)与EAT的发展呈正相关(图2)。2一个;额外的文件1:表1)。GO分析的生物学过程包括海马发育(size = 72, NES = - 1.65,p-value = 0.002),环核苷酸结合(size = 34, NES = - 1.77,p-value = 0.002),神经元动作电位(size = 26, NES =−1.80,p-value = 0.002),与进食发育和受体介导的内吞作用负调控呈负相关(size = 17, NES = 1.74,p-value = 0.004),酸性氨基酸运输(size = 21, NES = 1.72,p-value = 0.010),单极电池极性的建立或维持(size = 15, NES = 1.64,p-value = 0.019),与EAT的发展呈正相关(图2)。2b;额外的文件1:表1)。
值得注意的是,46例EAT样本来自先天性心脏病(CHD)患儿的体外循环心脏手术。在这里,为了比较新生儿、婴儿和儿童的EAT样本,以说明EAT发展的转录和表达谱,我们在对照组之间进行了强有力的差异分析。结果显示,在婴儿比较中分别检测到270、889和1069个DE mrnavs儿童、婴儿vs新生儿,新生儿vs,分别为(图2)。2c;额外的文件2表2)。同样,在婴儿的比较中发现了172,125和198个DE lncrnavs儿童、婴儿vs新生儿,新生儿vs,分别为(图2)。2d;额外的文件2表2)。随后鉴定了13个co-DE mrna和47个co-DE lncrna。此外,鉴定co-DE mrna和lncrna构建热图。的聚类分析皮尔森方法呈现出显著的组间差异(图2)。2c, d)。
途径富集分析
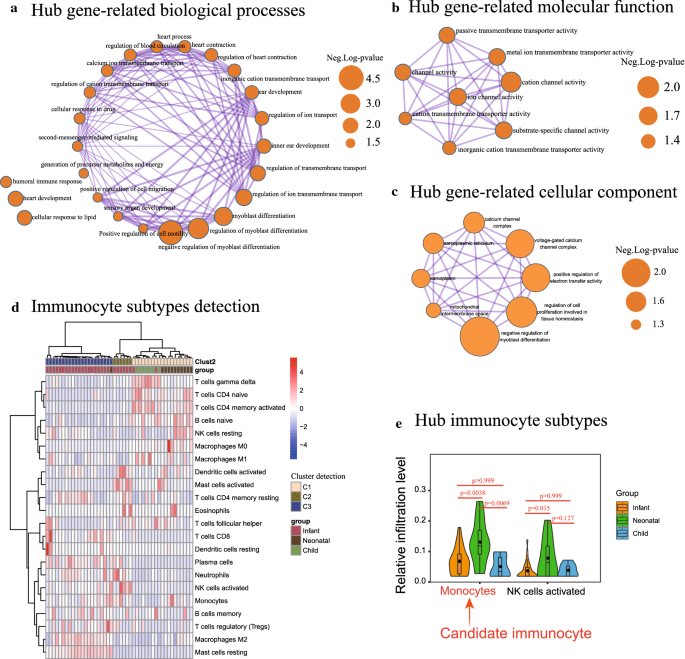
在共表达的13个DE基因中,生物学功能主要与负调控成肌细胞分化有关(p-value = 7.96E−05),离子跨膜运输的调控(p-value = 0.002),心脏发育(p-value = 0.003)。3.一个;额外的文件3.表S3)。分子功能与阳离子通道活性显著相关(p-value = 0.012),离子通道活度(p-value = 0.020),以及基质特异性通道活动(p-value = 0.021)。3.b;额外的文件3.(表S3),以及对成肌细胞分化的负调控(p-value = 7.96E−05),参与组织稳态的细胞增殖调控(p-value = 5.38E−04),正调控电子转移活性(p-value = 0.001)。3.c;额外的文件3.表S3)。
免疫细胞亚型检测
如图所示。3.d,通过CIBERSORT算法计算后检测免疫细胞浸润响应EAT发展的格局。通过对不同阶段EAT样本的统计分析,单核细胞(婴儿vs新生儿):p-value = 0.0038, t = 3.45;婴儿vs儿童:p-value > 0.999, t = 0.799;儿童vs新生儿:p-value = 0.0069, t = 3.242)和NK细胞活化(婴儿vs新生儿:p-value = 0.015, t = 2.956;婴儿vs儿童:p-value > 0.999, t = 0.0937;儿童vs新生儿:p-value = 0.127, t = 2.093)。3.d;额外的文件4:表S4)。因此,单核细胞的免疫细胞作为一个中心免疫细胞部分,从来自EAT样品的基因表达矩阵中被量化(图2)。3.e)。
CeRNA网络建设
我们的研究结果包括(1)根据47个co-DE lncrna和靶向mirna计算出1742个链接,(2)去除重复节点后选择27个lncrna和7个mirna,(3)在多组比较中确定靶向mrna和co-DE mrna的mirna后选择4个靶向mrna。因此,构建了包括27个lncrna、7个mirna和4个mrna的ceRNA网络,用于冠心病患者的EAT发展(图2)。4一个;额外的文件5表5)。
单核细胞浸润值与表达值之间存在显著的相关系数CACNA2D4被确认(皮尔森s相关系数= 0.62;p-value = 4.32E−06)(图4b).随后,一个子网包括CACNA2D4,保险公司-米尔-449 c-5便士,C7orf13,PTEN,LINC00478,WDFY3。AS2,WHSC1L1,MIR210HG被确定为核心调控网络(图2)。4d)。这些生物标记物的聚类分析结果显示,在不同的EAT发育阶段,这些生物标记物存在显著的差异(图2)。4c).然后,为了进一步阐明lncRNA-miRNA-mRNA响应单核细胞浸润的调控机制,我们进行了计算皮尔森这些生物标志物的相关系数值。高密度相关模块包括单核细胞,MIR210HG,CACNA2D4生成(图2)。4e;额外的文件6表6)。
GSEA和GSVA分析
采用GSEA分析,通过中位数分组来阐明潜在的调控途径。聚类分析该通路的NES值显示,PPAR信号通路与单核细胞高浸润显著相关CACNA2D4表达式,及更高MIR210HG表达式(无花果。5a和附加文件7表S7)。相反,rig - i样受体信号通路主要与单核细胞浸润降低相关CACNA2D4表达式,和下MIR210HG表达式(无花果。5b)。
此外,在EAT发育的不同阶段表现出显著差异的基因包括ACSBG1(59%),CYP4A11(54%),SLC27A2(30%)和CYP27A1(28%),在PPAR信号通路中被鉴定(变异评分)p-value = 0.0166;无花果。5c).同样地,基因如IFNA8(64%),TRAF2(64%),IL12A(59%),IFNK(64%),MAPK12(59%)和TBKBP1(62%)在维甲酸诱导基因i (RIG-I)样受体信号通路(变异评分)中检测到p-value = 0.00073;无花果。5d)。
免疫细胞、调控图谱和枢纽基因的验证羊属白羊座模型
经分析,免疫浸润景观如图所示。6a(附加文件)4:表S4)。此外,与7日龄组相比,28日龄组单核细胞的浸润水平下降(图2)。6b).的EAT转录组水平CACNA2D4,C7orf13,PTEN,LINC00478,WDFY3-AS2,TMEM72-AS1,WHSC1L1,MIR210HG比较了7天和28日龄组之间的差异,结果表明CACNA2D4和MIR210HG与7日龄组相比,28日龄组基因表达上调(图2)。5c, d)。基于GSVA分析,PPAR信号通路(变异得分p值= 0.035)和RIG-I样受体信号通路(变异得分p值= 0.046)得到验证,因此被认为是EAT发展的重要调控通路/网络(图1)。6e)。
讨论
目前认为,EAT是一种大型分泌体,在调节心血管疾病的生理和病理生理过程中发挥重要作用。此外,基于功能和解剖上的接近性,EAT对血管动脉粥样硬化易感性、心肌纤维化和心律失常的旁分泌调节有强有力的影响。综上所述,EAT与产热、免疫-炎症调节、心脏代谢活性、肾上腺素能受体分布等相关,是近年来的研究热点。第一次,我们把人类和o .白羊座基于微阵列的表达数据谱,以确定免疫细胞浸润和候选免疫细胞相关的调节ceRNA网络在EAT发展过程中的早期生命。本文提出的生物信息学工具的进一步扩展用于确定与EAT发育和免疫细胞浸润相关的分子机制和遗传因素。
cerna为共享mirna池而竞争,提供了一个复杂的相互作用网络,目标是蛋白质编码mrna、microRNA、长链非编码rna、假基因rna和环状rna中的microRNA应答元件(MREs) [25,26].近年来,大量研究报道了RNA剪切、RNA编辑、RNA修饰和RNA结合等在人类发育和疾病中的广泛功能[25,26].因此,了解与EAT发育和免疫细胞浸润相关的ceRNA网络将有助于了解冠心病患者早期EAT年龄变化中涉及的心脏发育和免疫调节。
基于复杂的生物信息学分析,我们的研究展示了一个框架来系统地表征一个涉及DE mrna、DE lncRNAs、免疫细胞浸润和潜在调控途径的调控图谱。在新生儿、婴儿和儿童冠心病患者的EAT样本的比较中,共有13个co-DE mrna和47个co-DE lncrna被鉴定为核心调节因子,主要参与成肌细胞分化、离子跨膜运输和心脏发育的途径。如上所述,我们随后构建了一个针对这些co-DE mrna和co-DE lncrna的ceRNA调控网络。因此,MIR210HG被确定为hsa-miR-449c-5p的重要竞争内源性RNA,以调节CACNA2D4表达水平,从而调节单核细胞浸润在早期生活中的冠心病患者的EAT发展。PPAR信号通路与MIR210HG,CACNA2D4而RIG-I样受体信号通路呈负相关。
在功能上,CACNA2D4编码一种电压依赖性钙通道复合物的蛋白质,该复合物作为导致钙离子通过细胞膜流入的介质。基于PathCards数据库(https://pathcards.genecards.org/) [27,我们发现了CACNA2D4可能与T细胞受体信号通路和扩张性心肌病(DCM)有关。Weeke等人发现钙通道亚基基因CACNB2和CACNA2D4与家族性心房颤动显著相关[28].虽然研究了心律的调节,但其确切机制尚未完全阐明[28].长链非编码RNA-MIR210HG据最近的研究报道,在乳腺癌、胶质瘤、肝细胞癌和非小细胞肺癌中,它可能是一种促进肿瘤转移、增殖和侵袭的致癌调节剂[29,30.,31,32,33,34].此外,Voellenkle的研究小组和Lin的研究小组证明MIR210HG可能参与内皮细胞缺氧和炎症应激通路[35,36].Hsa-miR-449c-5p在脑发育、胃癌生长和肝癌细胞迁移过程中发挥着重要的调节作用,通过细胞外信号和细胞内通路靶向基因转录后调控[qh]37,38,39].Xu等人发现hsa-miR-449c-5p过表达可能通过靶向Smad4在钙化主动脉瓣疾病中的表达抑制瓣膜间质细胞的成骨分化[40].
据报道,包括PPARα、PPARβ/δ和PPARγ在内的ppar可调节脂肪生成、脂质代谢和免疫炎症反应,特别是在维持代谢稳态方面[qh]41].有趣的是,最近的研究结果表明,ppar,特别是PPARγ,在白色脂肪组织(WAT)和BAT中高度表达,并在生理和病理条件下通过调节脂质氧化、甘油三酯积累和葡萄糖利用介导脂肪形成[41].ppar作为脂肪细胞分化的主要调控因子,还参与脂肪组织血管生成、免疫微环境构建和能量代谢[41,42,43].然而,这些能量代谢和免疫微环境的构建过程可能由氧化应激、离子转运、线粒体氧化磷酸化和心肌能量代谢紊乱引起的EAT发育和代谢失调诱导[j]。44,45].Wang等研究表明,rig - 1可能是胰岛素抵抗(insulin resistance, IR)过程中的直接靶点,参与调节抗炎、促炎反应和葡萄糖稳态之间的平衡,这与免疫耐受调节是一致的[46].此外,RIG-I样受体信号通路的激活可能潜在地将炎症和心肌细胞凋亡联系起来[47].Renovato-Martins等人证明单核细胞浸润到脂肪组织是器官早期发育的标志,而巨噬细胞浸润是肥胖患者脂肪组织炎症反应的标志[48].同样,Wolf的研究小组发现单核细胞和巨噬细胞之间的反馈回路不仅提供免疫防御,还有助于维持EAT的功能,这涉及到产热、代谢平衡和局部交感神经分布[49].Pirzgalska等人证明单核-巨噬细胞与白色脂肪组织(WAT)的褐变和去甲肾上腺素(NE)介导的产热密切相关[50].
结论
相关研究证明,EAT的发育受免疫-炎症微环境调控,且遗传调控较为复杂。在我们的研究中,这些结果进一步揭示了成肌细胞分化和离子跨膜转运在儿童早期EAT发育中的潜在作用和研究价值,因此,我们将在后续研究中进一步评估这些相关DE基因。此外,一个包括单核细胞,MIR210HGhsa-miR-449c-5p,和CACNA2D4在EAT发育过程中被检测到,可能是控制产热和免疫炎症反应的主要调节剂。这些结果可能用于开发针对冠心病患者心肌能量供应和发展的有效疗法的新策略。我们的发现可以进一步阐明EAT参与的分子机制,从而从新的角度探索EAT的发展和冠心病的病理生理,可能有助于改善目前的治疗方法。
数据和材料的可用性
基因表达汇编[51)(地理;https://www.ncbi.nlm.nih.gov/geo/)基因表达谱GSE82155,研究了11例新生儿(6 ~ 24天)、28例婴儿(40天~ 1岁)和7例儿童(2 ~ 7岁)早期冠心病患者EAT随年龄变化的变化,应用系统生物学分子分析方法进行DE分析和基因间相互作用。该研究是通过评估转录组的变化羊属白羊座早期发展,包括GSE115799数据集中5个7日龄和5个28日龄的仓库。分析脚本可以从Github网站访问https://github.com/RogerZou0108/EAT-Bio-analysis。
缩写
- 吃:
-
心外膜脂肪组织
- 冠心病:
-
先天性心脏病
- 德:
-
差异表达
- 走:
-
基因本体论
- KEGG:
-
京都基因与基因组百科全书
- Cyt-C:
-
细胞色素c
- 地理:
-
基因表达总览
- RMA:
-
鲁棒多阵平均
- 资讯:
-
再
- LIMMA:
-
微阵列数据算法的线性模型
- 舰队指挥官:
-
褶皱的变化
- 罗斯福:
-
错误发现率
- SVR:
-
支持向量回归
- 龙头:
-
竞争的内源性rna
- HGNC:
-
雨果基因命名委员会
- GSEA:
-
基因集富集分析
- 新经济学院:
-
归一化浓缩分数
- GSVA:
-
基因组变异分析
- 研究硕士:
-
microRNA反应元件
- DCM:
-
扩张型心肌病
- 红外光谱:
-
胰岛素抵抗
- 窟:
-
白色脂肪组织
- 不:
-
去甲肾上腺素
参考文献
Gibb AA, Epstein PN, Uchida S, Zheng Y, McNally LA, Obal D, Katragadda K, Trainor P, Conklin DJ, Brittian KR,等。运动引起的葡萄糖代谢变化促进心脏生理性生长。循环。2017;136(22):2144 - 57。
Iacobellis G, Sharma AM。心外膜脂肪组织作为代谢综合征新的心脏代谢危险标志和潜在的治疗靶点。中国医药杂志,2007;13(21):2180-4。
刘建军,刘建军,刘建军,等。心外膜脂肪:从生物分子角度看临床。中国生物医学工程学报,2011;43(12):1651 - 1661。
多面心外膜脂肪组织库的局部和全身效应。中华内分泌杂志,2015;11(6):363-71。
帕特尔VB,沙阿S, Verma S, Oudit GY。心外膜脂肪组织作为代谢换能器:在心力衰竭和冠状动脉疾病中的作用。心衰杂志,2017;22(6):889-902。
李建平,李建平,李建平,等。心外膜脂肪组织与冠心病的相关性研究。中华心血管病杂志。2012;31(4):534 - 538。
李建平,李建平,李建平,等。血清IgG4和可溶性白细胞介素-2受体水平与心外膜脂肪组织和冠状动脉钙化的关系。临床化学杂志,2014;28(2):63 - 9。
Beiert T, Knappe V, Tiyerili V, stockight F, Effelsberg V, Linhart M, Steinmetz M, Klein S, Schierwagen R, Trebicka J,等。由于抗炎和抗纤维化的特性,慢性低剂量松弛素对实验性心肌梗死的心律失常有保护作用。中华心血管病杂志,2018;25(2):21 - 21。
Horckmans M, Bianchini M, Santovito D, Megens RTA, Springael JY, Negri I, Vacca M, Di Eusanio M, Moschetta A, Weber C,等。心包脂肪组织调节心肌梗死后的颗粒形成、纤维化和心功能。循环。2018;137(9):948 - 60。
Park JS, Ahn SG, Hwang JW, Lim HS, Choi BJ, Choi SY, Yoon MH, Hwang GS, Tahk SJ, Shin JH。亚洲人群体重指数对心外膜脂肪组织与代谢综合征和冠状动脉疾病关系的影响中华心血管病杂志,2010;9:29。
Ojha S, Fainberg HP, Wilson V, Pelella G, Castellanos M, May ST, Lotto AA, Sacks H, Symonds ME, Budge H.早期人类心外膜脂肪组织基因通路的发育。生态学报,2016;1(13):87460。
chehi K, Voisine P, Mathieu P, Laplante M, Bonnet S, Picard F, Joubert P, Richard D.人心外膜脂肪组织ucp1相关氧化表型的功能表征。科学通报,2017;7(1):1 - 5。
chchechi K, Vijay J, Voisine P, Mathieu P, Bosse Y, Tchernof A, Grundberg E, Richard D.人心外膜脂肪组织UCP1表达相关基因特征。JCI洞察,2019。https://doi.org/10.1172/jci.insight.123618。
Zangi L, Oliveira MS, Ye LY, Ma Q, Sultana N, Hadas Y, Chepurko E, Spater D, Zhou B, Chew WL,等。胰岛素样生长因子1受体依赖通路驱动心肌损伤后心外膜脂肪组织形成。循环。2017;135(1):59 - 72。
Ritchie ME, Phipson B, Wu D, Hu Y, Law CW, Shi W, Smyth GK。极限幂差分表达分析用于rna测序和微阵列研究。核酸学报,2015;43(7):e47。
Newman AM, Liu CL ., Green MR ., Gentles AJ,冯伟,徐勇,Hoang CD, Diehn M, Alizadeh AA。从组织表达谱健壮枚举细胞亚群。地理学报,2015;12(5):453-7。
周颖,周波,Pache L, Chang M, Khodabakhshi AH, Tanaseichuk O, Benner C, Chanda SK. metscape基于生物学的系统级数据集分析。生态学报,2019;10(1):1523。
Subramanian A, Tamayo P, Mootha VK, Mukherjee S, Ebert BL, Gillette MA, Paulovich A, Pomeroy SL, Golub TR, Lander ES等。基因集富集分析:解释全基因组表达谱的一种基于知识的方法。美国国家科学促进会。2005、102(43):15545 - 50。
Jeggari A, Marks DS, Larsson E. miRcode:长非编码转录组中推测的microRNA靶点图谱。生物信息学(牛津,英国)。2012; 28(15): 2062 - 3。
王宁,王欣。miRDB: microRNA靶点预测和功能注释的在线资源。核酸研究。2015;43(数据库版):D146-52。
周超,Shrestha S, Yang CD,常乃文,林玉玲,廖光华,黄文武,孙涛,涂世杰,李文辉,等。miRTarBase更新2018:实验验证microrna -靶标相互作用的资源。中国生物医学工程学报,2018;46(1):662 - 662。
Agarwal V, Bell GW, Nam JW, Bartel DP。预测哺乳动物mrna中有效的microRNA靶位。eLife。2015; 4: e05005。
brbraschi B, Denny P, Gray K, Jones T, Seal R, Tweedie S, Yates B, Bruford E. Genenames.org: 2019年HGNC和VGNC资源。核酸学报,2019;47(D1): D786-92。
李建军,李建军,李建军,等。基因序列分析方法的研究进展。生物医学通报,2013;14:7。
李建军,李建军,李建军,等。ceRNA串扰的多层复杂性及其竞争。大自然。2014;505(7483):344 - 52。
安阳,傅克林,纪生。假基因通过ceRNA网络调控亲本基因的表达。中华细胞医学杂志,2017;21(1):185-92。
刘建军,刘建军,刘建军,刘建军。基于路径卡的生物信息学研究进展。数据库》2015。https://doi.org/10.1093/database/bav006。
周克P, Muhammad R, Delaney JT, Shaffer C, Mosley JD, Blair M, Short L, Stubblefield T, Roden DM, Darbar D.家族性心房颤动的全外显子组测序。中华心脏杂志,2014;35(6):377 - 383。
何忠,党军,宋安,崔霞,马忠,张铮。结肠癌患者预后新标志物LINC01234和MIR210HG的鉴定。中国生物医学工程学报,2019;34(5):779 - 779。
阮志,徐志,李志,吕勇。结肠癌存活相关长链非编码RNA MIR210HG的整体分析及其预后作用。中国生物医学工程学报,2019;18(2):1107 - 1106。
康鑫,孔锋,黄凯,李磊,李忠,王鑫,张伟,吴鑫。LncRNA MIR210HG通过与DNMT1结合,上调CACNA2D2启动子甲基化,促进非小细胞肺癌的增殖和侵袭。肿瘤学杂志。2019;12:3779-90。
闵伟,戴东,王军,张东,张勇,韩刚,张磊,陈超,李翔,李勇,等。长链非编码RNA miR210HG作为神经胶质瘤诊断的潜在生物标志物。PLoS ONE。2016; 11 (9): e0160451。
李晓燕,周丽丽,罗慧,朱强,左丽,刘广远,冯超,赵建勇,张云云,李鑫。长链非编码RNA MIR210HG作为miR-1226-3p的ceRNA调控浸润性乳腺癌中mucin-1c的表达,促进肿瘤转移。衰老。2019;11(15):5646 - 65。
王勇,李伟,陈旭,李勇,温鹏,徐峰。MIR210HG在肝细胞癌中预测预后不良及作为致癌lncRNA的功能。生物医学学报。2019;11:1297 - 301。
林杰,张翔,薛超,张宏,Shashaty MG, Gosai SJ, Meyer N, Grazioli A, Hinkle C, Caughey J,等。低氧和炎症性肾上皮损伤中的长链非编码RNA景观。[J] .中国医学杂志,2015;31(11):391 - 391。
Voellenkle C, Garcia-Manteiga JM, Pedrotti S, Perfetti A, De Toma I, Da Silva D, Maimone B, Greco S, Fasanaro P, Creo P等。rna测序揭示了长链非编码rna在内皮细胞缺氧反应中的意义。科学通报,2016;6:24 - 41。
Sandbothe M, Buurman R, Reich N, Greiwe L, Vajen B, Gurlevik E, Schaffer V, Eilers M, Kuhnel F, Vaquero A,等。microRNA-449家族通过靶向SOX4抑制tgf - β介导的肝癌细胞迁移。国际肝病杂志,2017;66(5):1012-21。
吴忠,王华,方森,徐晨。MiR-449c抑制胃癌生长。生命科学,2015;137:14-9。
吴军,鲍军,金敏,袁生,唐超,郑华,Mastick GS,徐超,闫伟。miR-34b/ C和miR-449两个miRNA簇在正常大脑发育、纤毛运动和精子发生中至关重要。美国国家科学促进会。2014; 111 (28): E2851-7。
黄许R,赵M,杨Y, Z,施C,侯X, Y, B,陈小Z,刘J,等。MicroRNA-449c-5p通过smad4介导的途径抑制人vic成骨分化。科学通报,2017;7(1):874。
Ahmadian M, Suh JM, Hah N, Liddle C, Atkins AR, Downes M, Evans RM。PPARgamma信号和新陈代谢:好的,坏的和未来。中华医学杂志,2013;19(5):557-66。
Fang H, Judd RL。脂联素的调节和功能。物理学报,2018;8(3):1031-63。
王晓明,王晓明,王晓明,等。过氧化物酶体增殖物激活受体在炎症控制中的作用。中华内分泌科杂志,2001;32(3):391 - 391。
Palomer X, Salvado L, Barroso E, Vazquez-Carrera M.糖尿病性心肌病炎症过程与代谢失调的相互作用综述。中华心血管病杂志,2013;32(4):361 - 361。
贾刚,马山,王晓明。糖尿病性心肌病的发病机制研究进展。中国生物医学工程学报,2018;122(4):624-38。
王玉华,张玉刚。Poly (I:C)减轻肥胖相关的促炎状态,促进葡萄糖稳态。细胞因子。2017;99:225-32。
Chattopadhyay S, Sen GC。RIG-I-like受体诱导的IRF3介导的细胞凋亡途径(RIPA):一种新的抗病毒途径。蛋白学报,2017;8(3):165-8。
Renovato-Martins M, Matheus ME, de Andrade IR, Moraes JA, da Silva SV, Citelli Dos Reis M, de Souza AA, da Silva CC, Bouskela E, Barja-Fidalgo C.肥胖脂肪组织微颗粒诱导CD16(+), CCR5(+)和TLR8(+)单核细胞的促炎表型。生物化学学报,2017;1863(1):139-51。
Wolf Y, Boura-Halfon S, Cortese N, Haimon Z, Sar Shalom H, Kuperman Y, Kalchenko V, Brandis A, David E, Segal-Hayoun Y,等。棕色脂肪组织巨噬细胞控制组织神经支配和稳态能量消耗。中华免疫学杂志,2017;18(6):665-74。
Pirzgalska RM, Seixas E, Seidman JS, Link VM, Sanchez NM, Mahu I, Mendes R, Gres V, Kubasova N, Morris I,等。交感神经元相关巨噬细胞通过输入和代谢去甲肾上腺素促进肥胖。中华医学杂志,2017;23(11):1309-18。
Barrett T, Wilhite SE, Ledoux P, Evangelista C, Kim IF, Tomashevsky M, Marshall KA, Phillippy KH, Sherman PM, Holko M等。NCBI GEO:功能基因组数据集的存档-更新。核酸学报,2013;41(数据库版):D991-5。
致谢
不适用。
资金
广州市临床重点专科学科建设项目(批准号011102-02)。
作者信息
作者及单位
贡献
LM和WS对所呈现的数据及其讨论的解释的可靠性和无偏见的所有方面负责;他们还起草了这篇文章。XM, MZ, WC和WL负责数据的统计分析和解释。RZ和XC负责全文评估和指导,并对提交的版本进行最终审定。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
相互竞争的利益
作者没有需要披露的利益冲突。
发表同意书
不适用。
额外的信息
出版商的注意
伟德体育在线b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
补充信息
附加文件1:表S1。
心外膜脂肪组织(EAT)的发育与基于时间序列相关GSEA的通路相关。
附加文件2:表S2。
在不同发育阶段的EAT样本中,通过多次比较鉴定了差异表达的mrna和lncrna。
附加文件3:表S3。
新生儿、婴儿和儿童EAT样本中共差异表达mrna的基因本体富集项。
附加文件4:表S4。
GSE82155和GSE115799数据集的免疫细胞浸润检测。
附加文件5:表S5。
竞争内源性RNA (ceRNA)调控网络的构建。
附加文件6:表S6。
皮尔森中心mirna与单核细胞浸润水平的相关系数值。
附加文件7:表S7。
单核细胞浸润水平分组后基因集富集分析;CACNA2D4和MIR210HG表达式的值。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
马,L.,史,W.,马,X。et al。先天性心脏病患者心外膜脂肪组织发育过程中差异免疫细胞浸润及潜在ceRNA网络的综合分析J翻译医学18, 111(2020)。https://doi.org/10.1186/s12967-020-02279-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-020-02279-y
关键字
- 先天性心脏病
- 竞争性内源性RNA网络
- 免疫细胞浸润
- 生物信息学分析