摘要
背景
18基因肿瘤炎症特征(TIS)是一种临床研究方法,丰富了免疫检查点阻断的临床益处。我们评估了其在常规临床护理中使用PD-1检查点抑制剂治疗的癌症患者中预测免疫治疗临床获益的能力。
方法
CERTIM队列是一个前瞻性队列,包括在科钦大学医院接受免疫检查点抑制剂的患者。从58个存档的固定石蜡包埋肿瘤块(包括38个肺癌,5个黑素瘤,10个肾癌,4个尿路上皮癌和1个结肠癌)中提取的RNA与NanoString的beta版本杂交®PanCancer IO360™CodeSet使用nCounter®技术。基因表达特征与肿瘤反应(按RECIST标准)和总生存期相关。在37个非小细胞肺癌(NSCLC)样本中评估了PD-L1对肿瘤细胞的免疫染色,并在其中19个样本中通过全外显子组测序测量了肿瘤突变负担(TMB)。
结果
在整个队列中,TIS评分与抗pd -1治疗的完全或部分缓解显著相关(优势比= 2.64,95% CI [1.4;6.0),p= 0.008),在NSCLC人群中也是如此(优势比= 3.27,95% CI [1.2;11.6),p= 0.03)。在整个队列中,与TIS评分较低的肿瘤患者相比,TIS评分较高的肿瘤患者总体生存期延长(风险比= 0.37,95% CI [0.18, 0.76],p在NSCLC人群中(危险比= 0.36,95% CI [0.14, 0.90],p= 0.02)。在后者中,TIS评分与肿瘤细胞的PD-L1染色(spearman系数为0.2)和TMB (spearman系数为−0.2)无关。
结论
这些结果表明,经验证的检测肿瘤微环境炎症(如TIS)水平的基因表达试验是准确和独立的预测生物标志物,可以很容易地在临床实践中实施。
背景
免疫检查点抑制剂(ICI),特异性地通过单克隆抗体阻断PD-1/PD-L1通路,已经进入肿瘤治疗武器库,并在越来越多的适应症中进行评估,尽管作为单一药物和未选择的患者群体的反应率通常很低。目前正在探索多种生物标志物作为丰富临床反应者的策略,对于一些适应症,抗pd -1/PD-L1治疗的批准将免疫组化(IHC) PD-L1测量形式的生物标志物检测纳入处方标签。尽管被FDA批准作为不同抗pd -1/PD-L1药物的伴发和/或补充诊断,PD-L1免疫组化检测有许多局限性,包括不理想的阳性和阴性预测值和可重复性。由于ICI破坏了来自多种不同肿瘤类型和免疫环境的肿瘤细胞之间的保守通路,因此对各种适应症具有预测作用的生物标志物特别感兴趣。
已经开发了几种生物标志物,它们可以表征肿瘤细胞启动适应性免疫反应的潜力,例如肿瘤突变负担(TMB)和微卫星不稳定性(MSI),或者通过免疫细胞的存在来测量免疫激活的下游后果,例如免疫评分,或与免疫环境相关的基因表达特征[1].已经开发了许多候选基因表达签名,其中大多数集中在活化T细胞和IFNγ信号转导的生物学上[2,3.有趣的是,IFNγ信号通路的缺陷已被确定为一种耐药机制,强烈支持IFNγ在抗癌免疫反应中的关键作用[4,5].据报道,黑色素瘤中IFNγ表达或IFNγ诱导的基因标记与抗pd -1/PD-L1单抗的临床反应之间存在关联[6]及膀胱癌[7].最近,一种18个基因的“肿瘤炎症特征”(TIS)在临床试验中被证明可以回顾性预测抗pd -1在各种癌症类型(黑色素瘤、头颈部鳞状细胞癌、消化系统癌、卵巢癌和三阴性乳腺癌)中的临床益处,该基因量化了肿瘤微环境中激活但被抑制的适应性免疫反应。[2].签名已分析验证[8,9],目前正在多项研究用途(RUO)和研究用途(IUO)研究中研究其作为预测生物标志物的性能。
为了评估基因表达谱在常规临床实践中的可行性和实用性,我们评估了单一中心抗pd -1标记治疗的混合肿瘤队列患者的TIS评分,这是使用panccancer IO360基因表达板进行的更大规模转录谱研究的一部分。
方法
病人
来自CERTIM(免疫调节疗法多学科研究组)的58例患者被纳入该研究。CERTIM队列于2015年7月在我院启动,前瞻性地包括所有接受PD-1检查点抑制剂(nivolumab或pembrolizumab)治疗的晚期实体瘤患者。继续治疗,直到疾病进展或无法忍受的毒性,医生或患者的决定。在基线时进行CT扫描,接受nivolumab的患者每8周进行一次CT扫描,接受pembrolizumab的患者前6个月每6周进行一次CT扫描,之后每12周进行一次CT扫描。根据实体瘤反应评价标准(RECIST) 1.1版评估反应。被认为获得临床获益的临床稳定患者可以继续治疗,直到在第一次疾病稳定评估后至少4周进行影像学检查确认疾病进展为止。CERTIM专门的多学科委员会每月审查在患者队列中观察到的毒性。在治疗期间每月评估一次临床状态,并在治疗停止时继续进行。数据库锁定时间为2018年2月9日。患者中位随访时间为19.2个月。
本研究由伦理委员会(CPP Ile de France II, no. 1)批准。2008-133, 2012 06-12, 2018 MS1),符合法国法律第L.1121-1条。
PD-L1疣状
对于每个肿瘤,我们在Bond自机器(Leica)上使用抗PD-L1抗体(E1L3N,细胞信号)对代表性FFPE块的新切切片进行PD-L1免疫染色,如前所述,并由PATTERN法国胸科病理学家小组验证[10].对肿瘤细胞进行盲法染色(DD、ALM、BB)分析。
基因组DNA提取和illumina全外显子组测序
根据制造商的说明,使用Maxwell 16 FFPE组织LEV DNA纯化试剂盒(Promega)从福尔马林固定石蜡包埋(FFPE)块中分离出22个肿瘤的基因组DNA。全外显子组测序如先前报道[11].DNA在Novaseq 6000平台上测序,使用至少100 ng的双链肿瘤DNA (Qubit dsDNA HS试剂盒)。在剪切后,随机选择11个样本在安捷伦生物分析仪上运行,以确认在文库构建之前剪切成功。SureSelect Human All Exon V6捕获试剂盒用于捕获主要基因组数据库中包含的基因编码区域。生成101mer序列读取的成对结束FASTQ文件。使用FastQC (v0.10.1)对所有序列数据进行质量控制,包括读取计数、质量值、kmer使用情况、gc含量和所有其他相关参数。DNA读取序列与基因组(UCSC hg19;使用BWA (v0.7.15)和Picard (v2.8.3)进行reads排序和PCR重复去除。使用VarScan2 (v2.4.2)和Samtools mpileup (v1.3)对人类参考基因组调用snv /Indels。通过在1000个基因组和NHLBI-ESP项目的6500外显子组数据库中仅保留所有种族中MAF < 1%或未知MAF的变体来去除种系多态性。通过去除dbSNP129中的SNPs进一步过滤保留的snv /indels。 Depth of sequencing coverage was 60× on average across all samples in the cohort.
RNA提取和杂交到nCounter编码集
入选CERTIM队列的患者的档案活检,在抗pd -1治疗前取样,并在FFPE块中留有足够的肿瘤组织,被选择用于RNA提取。根据制造商的建议,使用高纯FFPE RNA分离试剂盒(Roche)从FFPE肿瘤样本中提取RNA,并使用Qubit™RNA XR检测试剂盒(Invitrogen)进行荧光定量。100 ng RNA(46个样品)或30 - 85 ng RNA(12个样品)成功杂交到beta版本的NanoString®PanCancer IO 360面板代码集,根据制造商的建议。
转录数据的统计分析
每个样本和基因的原始数据归一化到内部ERCC对照,以消除分析的技术可变性,然后计数归一化到内源性管家基因的几何平均值,然后进行log2转换。包括TIS在内的基因表达特征被计算为组成基因的加权线性平均[2,12].用于计算TIS和其他签名的加权分数属于NanoString知识产权。在与临床治疗反应的相关性分析中,将临床获益定义为完全或部分RECIST缓解,将病情稳定和进展定义为缺乏临床获益。使用线性模型将归一化基因计数和特征分数与响应类别进行比较。log2倍变化,wald型置信区间和p-value为每个基因和签名计算(附加文件1:表S1和附加文件2:表S2)。为了评估超出TIS预测性能的附加特征的预测性能,使用逻辑回归模型评估以TIS评分为条件的性能。
生存时间分析中,除TIS以百分位数为单位外,其余基因及评分均按中位数分为高、低两组。生存时间用Cox比例危险度模型拟合为二元组。高、低组间的危险比、wald型置信区间和log-rank检验p-value为每个基因和签名报告(附加文件1:表S1和附加文件2:表S2)。
结果
在多肿瘤队列中,肿瘤炎症特征增强了抗pd -1的临床反应
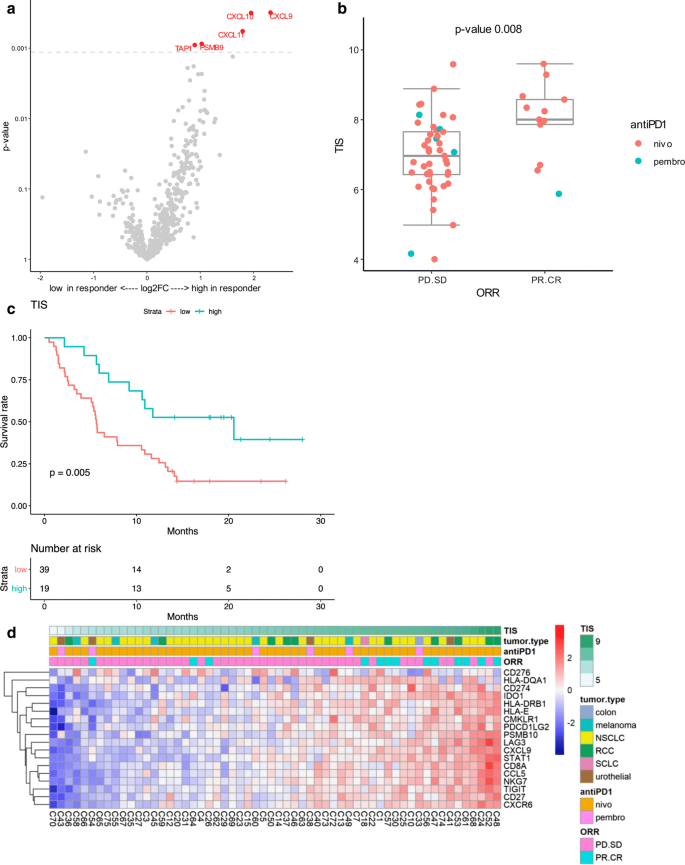
在门诊单中心CERTIM队列中,连续接受抗pd -1单克隆抗体治疗的转移性癌症患者被选为可用的FFPE肿瘤标本,使用NanoString panccancer IO 360面板(beta版本)分析基因表达和免疫特征,该面板包含TIS的RUO版本。本研究纳入的58例不同癌症类型患者的临床特征见表1.在抗pd -1应答者[根据RECIST标准有完全应答(CR)或部分应答(PR)的患者]中,与无应答者(病情稳定或进展)相比,几个基因表现出不同的表达(附加文件)1:表S1)。经过多项测试校正后,应答者中与ifn - γ信号转导和抗原处理相关的5个基因仍然显著升高:CXCL9,CXL10,CXCL11,TAP1而且PSMB9(无花果。1a).由于许多与临床获益关系最大的基因包含在TIS中或与TIS中的基因密切相关,我们将TIS作为本队列中的预测生物标志物进行评估。在本研究中,高TIS评分与抗pd -1治疗的疗效显著相关(优势比= 2.64,95% CI [1.4;6.0),p= 0.008, Logistic回归)(图;1b).此外,与较低评分的患者相比,TIS评分高的患者(上不育点)的总生存期更长(危险比= 0.37,95% CI [0.18, 0.76],p-value = 0.005, Cox回归)(图1c). TIS评分中16个基因的表达密切相关,而小鼠而且HLA-DQA1在不同的TIS评分中,表达变化更大(图。1d).本研究中每个样本的归一化基因表达数据、TIS评分以及对ICI的反应和生存期在附加文件中提供3.:表S3。总之,这些数据表明,在“现实生活”队列患者中,TIS与抗pd -1 (pembrolizumab或nivolumab)的临床获益显著相关。
在CERTIM多肿瘤队列中,TIS评分与抗pd -1反应相关。一个火山分布图p在整个队列中,应答者(PR/CR)和无应答者(PD/SD)之间差异表达的变化为-value与log2倍。用线性模型拟合log2归一化计数对响应进行差分表达式检验。的p-值由Benjamini-Hochberg程序调整。与FDR < 0.1显著基因对应的点用红色标记。b有反应者和无反应者的TIS评分箱线图(有反应者的下须不可见,长度为0)。反应与TIS评分用逻辑回归拟合p-value = 0.008,表明高TIS评分可预测抗pd -1治疗的疗效。优势比为2.64,95%置信区间(1.37,5.95)。c整个患者队列的TIS评分组的Kaplan-Meier曲线。TIS评分按分位数分为三组。Kaplan-Meier曲线显示,TIS评分高的组的生存率高于其他两组(在图中合并为“低”组)。用Cox比例危险度模型拟合TIS评分组(高、低、中)生存时间。风险比0.374,95%可信区间(0.18,0.76),p-value = 0.005,意味着高TIS评分组的危险性降低了63%。d热图显示单个TIS基因的正常化表达,以及TIS总体评分、组织学亚型和抗pd1的总体反应。非小细胞肺癌非小细胞肺癌,碾压混凝土肾细胞癌,SCLC小细胞肺癌,nivonivolumab,pembropembrolizumab,奥尔根据RECIST v1.1的总体响应,CR完整的反应,公关局部反应,SD稳定的疾病,PD进步的疾病
TIS预测抗pd -1在非小细胞肺癌(NSCLC)队列中的获益
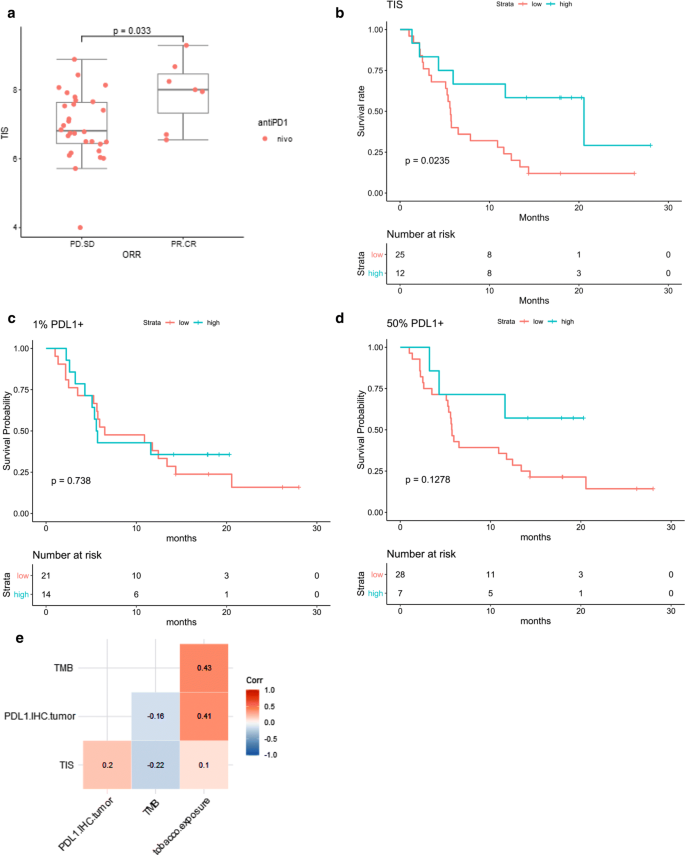
然后我们将分析重点放在NSCLC上,它代表了本队列中研究的大多数病例。37例患者均接受了尼volumab治疗,患者的临床特征,包括肿瘤亚型和吸烟情况见表2.总体而言,7/37(19%)患者对治疗有效。在整个队列中,我们观察到TIS增强了NSCLC的肿瘤反应(优势比= 3.27,95% CI [1.2;11.6),p= 0.03, Logistic回归)(图;2a).此外,与TIS评分较低的患者相比,TIS评分高的患者(上不育点)生存期延长(危险比= 0.36,95% CI [0.14, 0.90],p-value = 0.02, Cox回归)(图2b).为了在临床感兴趣的其他生物标志物之一的背景下评估TIS评分的预测价值,我们还在肿瘤细胞阳性的1%和50%的临界值处对NSCLC样本的PD-L1表达进行了IHC评分,这两个临界值在标签中报道,用于选择二线NSCLC患者接受派姆单抗治疗。PD-L1染色≥1%的肿瘤细胞与生存率无显著相关性(危险比= 0.87,CI [0.4, 2],p= 0.74), 50%肿瘤细胞的PD-L1染色有总生存趋势,但未达到统计学意义(危险比= 0.40,CI [0.1, 1.3],p= 0.13)。2c, d)。此外,19例患者通过全外显子组测序获得了肿瘤突变负担(见附加文件)4:基线特征见表S4)。肿瘤突变负担在13.7 ~ 26.8个突变/MB之间,与吸烟包年数呈正相关(spearman系数0.43)。在这个有限的患者队列中,腺癌的TMB (n = 11,中位数= 20.3突变/Mb)低于鳞状细胞癌(n = 6,中位数= 23.3突变/Mb) (p值= 0.01,Fisher检验),与生存无显著相关性(危险比= 1.91,CI [0.6, 6.2],p= 0.25)。在这个小队列中,TIS仍与总生存期显著相关(p = 0.02,数据未显示)。最后,我们评估了这些生物标志物之间是否存在相关性,并观察到肿瘤细胞上的PD-L1染色和TMB与烟草暴露呈正相关,但其他生物标志物之间的相关性不强(图2)。2e).具体而言,PD-L1免疫组化染色与TMB无显著相关性(spearman系数−0.16,p值0.53),而TIS与PD-L1免疫组化染色(spearman系数0.20,p值0.25)和TMB (spearman系数−0.22,p值0.38)均无显著相关性。
TIS检测在NSCLC队列中与其他生物标志物的比较。一个NSCLC队列中应答者和无应答者的TIS评分箱线图。所有患者均接受nivolumab治疗。反应符合TIS评分与逻辑回归p-value = 0.033,表明TIS评分高预示肿瘤对抗PD-1治疗的反应。优势比为3.27,95%置信区间(1.23,11.63)。bNSCLC队列TIS评分组的Kaplan-Meier曲线。患者按TIS评分进行分层,观察到TIS评分最高的组比其他两组(在图中合并为“低”组)的生存时间更长。生存时间适用于TIS评分组(高、低、中),Cox比例风险模型。风险比为0.36,95%可信区间(0.14,0.90),p-value = 0.0235,即TIS评分高组的危险性降低64%。c肿瘤细胞PD-L1阳性1%的NSCLC患者的Kaplan-Meier曲线被用作截断线。NSCLC队列的生存时间符合PD-L1+组(高vs低)Cox比例风险模型。d肿瘤细胞PD-L1阳性50%的NSCLC患者的Kaplan-Meier曲线被用作截断线。NSCLC队列的生存时间符合PD-L1+组(高vs低)Cox比例风险模型。分析表明,50% PD-L1+肿瘤细胞的患者可能有更长的生存期,但样本量太有限,无法达到统计学意义。eNSCLC队列中TIS评分、PD-L1+肿瘤细胞百分比、肿瘤突变负担与烟草暴露之间的Spearman相关矩阵PD-L1+肿瘤细胞和TMB与烟草暴露呈正相关
TIS之外的其他特征预测抗pd -1的益处
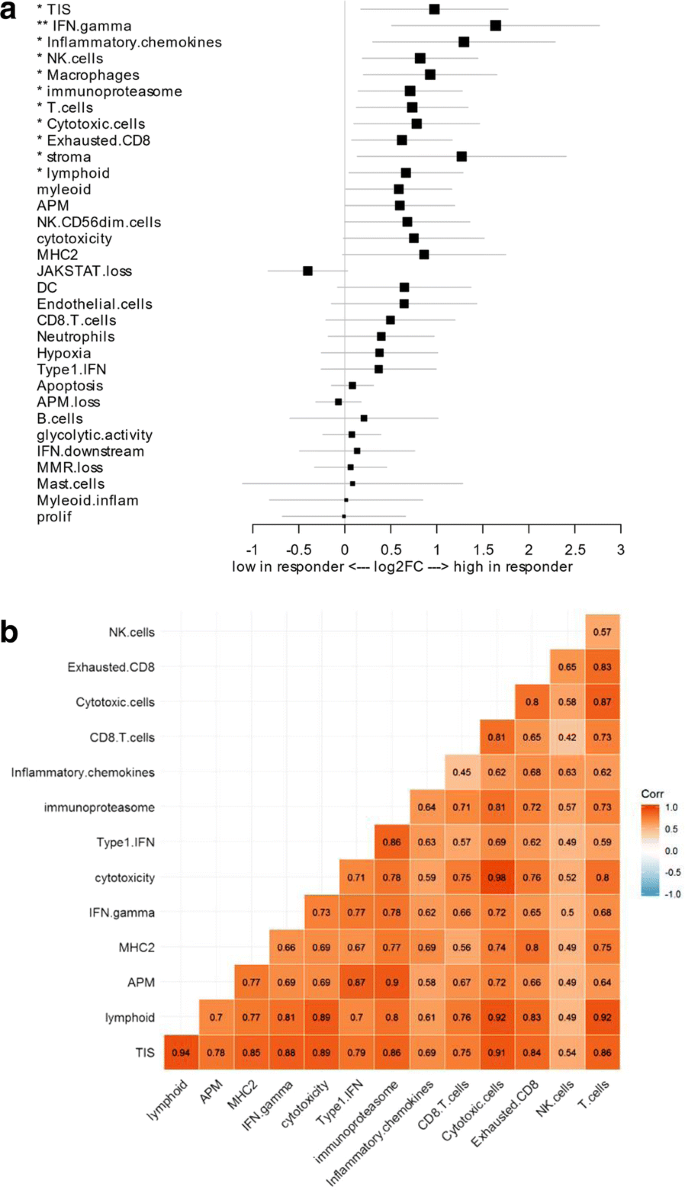
接下来,我们评估了IO360组中包含的其他一些与NSCLC队列应答相关的预先定义的免疫基因标记,并确定了几个具有统计学意义的标记,包括IFNγ信号、淋巴样细胞、T细胞、NK细胞、细胞毒性细胞、耗尽的CD8 T细胞、巨噬细胞、基质、炎症趋化因子和免疫蛋白酶体(图3)。3.a).大多数与TIS及两者之间存在较强的正相关(图。3.b).多变量分析显示,这些基因特征均未显著预测校正TIS后的反应(数据未显示)。然后对这些标记进行评估,以确定哪些标记也可预测NSCLC队列中的总生存率,只有TIS、间质和淋巴样标记具有显著相关性(附加文件)5:图S1)。在多肿瘤队列中,有几个特征与缓解相关,但只有IFNγ特征在调整了TIS后仍然显著(p-value = 0.03)(附加文件6:图S2A);而TIS、免疫蛋白酶体、淋巴样和缺氧特征可预测生存(附加文件)6:图S2B)。这些发现表明,TIS在非小细胞肺癌和现实世界患者的多肿瘤队列中都是PD-1检查点阻断后反应和生存的可靠生物标志物。
讨论
抗pd -1/PD-L1分子在癌症患者中的有限疗效、潜在毒性和成本要求使用预测性生物标志物。我们的研究重点是基于基因表达的生物标志物,因为它们与当前的临床实践兼容,即它们可以用小组织样本和当地实验室进行,并具有跨疾病适应症和治疗药物的临床应用潜力。TIS最初被描述为预测不同癌症类型患者反应的生物标志物,在临床试验中使用派姆单抗治疗[2].在这里,我们扩展了TIS的特征,包括新适应症(NSCLC)和新药物(nivolumab)。这项研究的一个优点是,它是在社区环境中接受治疗的患者;因此,与临床试验相比,在较少选择的患者群体中,可能更能反映更大的现实世界表现。这项研究证明了高TIS与ICI获益的相关性,无论是临床反应还是总生存期,都独立于癌症亚型和抗pd -1治疗分子的使用。
这项研究有许多局限性,在解释结果时必须加以考虑。首先,该研究是由一个小的患者队列,特别是肺癌队列组成。尽管队列规模较小,但TIS可预测缓解和生存,因此可能是确定可能受益于ICI的患者的现实选择。我们等待在现实生活管理中接受ICI治疗的更大队列患者的可用性,以证实这些结果。最终,使用TIS作为分层生物标志物的前瞻性临床试验需要明确确认其在不同癌症类型中的预测价值。
在这项研究中,值得考虑非基因标记生物标志物的表现。虽然PD-L1免疫组化是被批准的诊断,但没有观察到它具有预测性,这可能是由于组织异质性和队列规模。小型活组织检查有时包含少量肿瘤细胞,这些细胞的阳性不一定能反映整个肿瘤状况[13].使用多基因标记,如TIS,可能是一种比单独测量PD-L1蛋白更可靠的方法来测量细胞毒性抗肿瘤免疫反应的存在。同样,在许多研究中,高TMB已被证明与ICI获益相关,特别是在肺癌中[14,15,16,17],但在这个NSCLC队列中,它不是可预测的,也与TIS无关。这可能是由于研究的病例数量有限,混合组织学(腺癌和鳞状细胞癌)和/或所有样本中的TMB都很高(13.7到26.8个突变/MB)。有趣的是,最近的一项研究表明,在KEYNOTE临床试验中,TMB和TIS可以独立预测各种肿瘤对派姆单抗的临床反应,但没有检查NSCLC [18].进一步限制了它的实用性,目前TMB测量是一项昂贵的技术,正在等待国际标准化和建议[19].
最后,未来可能需要TIS之外的基因标记来进一步剖析肿瘤对单一药物PD-1/PD-L1阻断无反应的患者的免疫抵抗机制,以提供基于生物学的组合。具体来说,虽然肿瘤炎症基因特征,包括TIS,正在测量IFN生物学和/或特定T细胞群的存在[2,6,20.,21,22],需要更多的特征(可能与TIS结合)来进一步了解与免疫逃逸相关的其他过程,这些过程可能是治疗靶向的[23].
结论
在这项研究中,分析了在常规临床护理中接受抗pd -1治疗的癌症患者的FFPE肿瘤样本队列中的基因表达特征。肿瘤炎症特征与临床反应和总生存期显著相关,支持在常规实践和未来临床试验中与其他生物标志物并行评估。
数据和材料的可用性
不适用。
缩写
- CERTIM:
-
免疫调节疗法多学科研究组
- 克雷格:
-
完整的反应
- FFPE:
-
formalin-fixed石蜡包埋
- 这里:
-
免疫检查点抑制剂
- 包含IHC:
-
免疫组织化学
- IUO:
-
仅限研究用途
- MSI:
-
微卫星不稳定
- 非小细胞肺癌:
-
非小细胞肺癌
- 公关:
-
部分响应
- RECIST:
-
实体瘤疗效评价标准
- RUO:
-
只供研究用途
- TIS:
-
肿瘤炎症特征
- 三甲:
-
肿瘤突变负担
参考文献
陈世德,梅尔曼I.癌症免疫的要素和癌症免疫的设定点。大自然。2017;541(7637):321 - 30。
Ayers M, Lunceford J, Nebozhyn M, Murphy E, Loboda A, Kaufman DR,等。ifn - γ相关mRNA谱预测PD-1阻断的临床反应。中国临床医学杂志。2017;29(8):344 - 344。
Auslander N, Zhang G, Lee JS, Frederick DT, Miao B, Moll T,等。免疫检查点阻断治疗转移性黑色素瘤反应的可靠预测中国医学杂志,2018;24(10):1545-9。
张志刚,张志刚,张志刚,张志刚,等。JAK1/2突变介导PD-1阻断的原发性耐药。中国癌症杂志,2017;7(2):188-201。
Zaretsky JM, Garcia-Diaz A, Shin DS, Escuin-Ordinas H, Hugo W, Hu-Lieskovan S,等。黑色素瘤中与获得性PD-1阻断抗性相关的突变。中华实用医学杂志,2016;29(3):344 - 344。
张志刚,张志刚,张志刚,张志刚,等。癌症患者抗pd - l1抗体MPDL3280A反应的预测相关性大自然。2014;515(7528):563 - 7。
张志刚,张志刚,张志刚,张志刚,等。Atezolizumab用于局部晚期和转移性尿路上皮癌患者,这些患者在铂基化疗治疗后进展:一项单臂多中心2期试验柳叶刀》。2016;387(10031):1909 - 20。
Popa S, Church SE, Pekker I, Dowidar N, Sullivan A, Ngouenet C,等。验证用于预测抗pd1治疗反应的测量肿瘤炎症的多重基因表达试验的关键分析变量。2018年ASCO-SITC海报,摘要#203。2018.
Wallden B, Church S, Pekker I, Zimmerman S, Popa S, Sullivan A,等。组织处理和干扰对测量肿瘤炎症的多重基因表达测定的重现性和稳稳性的影响。ESMO 2018的海报,摘要#4244。2018.
Adam J, Le Stang N, Rouquette I, Cazes A, Badoual C, Pinot-Roussel H,等。非小细胞肺癌PD-L1免疫组化检测的多中心协调研究中国科学院学报,2018;29(4):953-8。
李文杰,李志强,李志强,等。慢性阻塞性肺疾病患者肿瘤浸润T细胞受损影响肺癌对PD-1阻断的反应。中国呼吸急救杂志。2018;32(7):928-40。
邓丽娟,张志强,张志强。肿瘤-免疫相互作用基因表达特征的研究进展。临床肿瘤学杂志。2018。https://doi.org/10.1200/JCO.2018.36.5_suppl.205.
于海涛,周春华,周春华,李丽娟,王丽娟。PD-L1在肺癌中的表达。中华胸内科杂志,2016;11(7):964-75。
李丽娟,李丽娟,李丽娟,等。非小细胞肺癌患者抗程序性细胞死亡(PD)-1和抗程序性死亡配体1 (PD- l1)阻断反应的分子决定因素中华临床肿瘤学杂志,2018;36(7):633-41。
Carbone DP, Reck M, Paz-Ares L, Creelan B, Horn L, Steins M,等。nivolumab用于IV期或复发性非小细胞肺癌的一线治疗。中华实用医学杂志,2017;26(3):344 - 344。
helmann MD, Ciuleanu TE, Pluzanski A, Lee JS, Otterson GA, Audigier-Valette C,等。Nivolumab联合ipilimumab治疗肿瘤突变负担高的肺癌。中华实用医学杂志,2018;29(3):344 - 344。
helmann MD, Nathanson T, Rizvi H, Creelan BC, Sanchez-Vega F, Ahuja A,等。晚期非小细胞肺癌患者联合免疫治疗反应的基因组特征中国癌症杂志,2018;33(5):843.e4-852.e4。
李志强,李志强,李志强,等。基于PD-1检查点封锁的免疫治疗的泛肿瘤基因组生物标志物科学。2018;362 (6411):eaar3593。
Stenzinger A, Allen JD, Maas J, Stewart MD, Merino DM, Wempe MM,等。肿瘤突变负担(TMB)标准化倡议:建议临床样本中一致的TMB评估,以指导免疫治疗决策。基因与染色体。2019;58(8):578-88。
Fehrenbacher L, Spira A, Ballinger M, Kowanetz M, Vansteenkiste J, Mazieres J,等。Atezolizumab与多西他赛用于既往治疗的非小细胞肺癌(POPLAR)患者:一项多中心、开放标签、2期随机对照试验柳叶刀》。2016;387(10030):1837 - 46所示。
Prat A, Navarro A, Paré L, Reguart N, Galván P, Pascual T,等。PD-1阻断非小细胞肺癌、头颈部鳞状细胞癌和黑色素瘤中免疫相关基因表达谱癌症决议2017;77(13):3540-50。
Karachaliou N, Gonzalez-Cao M, Crespo G, Drozdowskyj A, Aldeguer E, Gimenez-Capitan A,等。γ干扰素,非小细胞肺癌和黑色素瘤患者免疫检查点封锁反应的重要标志。中国医学杂志,2018;10:1758834017749748。
Cesano A, Warren S.将下一代免疫肿瘤生物标志物引入临床。共同参与。2018;6(1):14。
确认
我们感谢Aurélie Boni和Hiromi Sato的技术援助。
资金
这项工作得到了国家研究机构Santé和研究机构Médicale (INSERM)的支持;巴黎第五大学;巴黎第六居里大学;个体化医疗癌症研究(CARPEM);LabEx免疫肿瘤学;癌症组织,国家生命科学与健康联盟,在癌症计划框架内;和落实。
作者信息
作者及隶属关系
贡献
DD, FG和KL设计了研究,分析和解释了数据,并准备了手稿。SW、XR、PM和AC设计、分析和解释基因表达数据;并准备手稿。RH、HS、RH、TC提供肿瘤突变负荷评估。JA、PBR、CG、AB、NK、CT、MA提供临床资料。AML和BB进行PDL1评估。JB和HO进行RNA提取。FL和AD进行nCounter试验。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
本研究由伦理委员会(CPP Ile de France II, no. 1)批准。2008-133, 2012 06-12, 2018 MS1),符合法国法律第L.1121-1条。
发表同意书
不适用。
相互竞争的利益
这项工作是由CERTIM的研究人员和NanoString的研究人员合作完成的。CERTIM团队(由DD、FG和KL领导)从他们的患者数据库中提供了样本和临床信息,并进行了包括PD-L1 IHC在内的分子表征,并运行了nCounter检测。NanoString团队(SW, XR, PM和AC)为基因表达谱提供了试剂,并对基因表达测定进行了分析。两个小组都对分析的设计、结果的解释和手稿的准备做出了贡献。RH, HS, RH和TC是MedImmune的全职员工,他们提供了肿瘤突变负担评估。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
在整个队列和NSCLC队列中,个体基因表达与应答和生存的统计相关性。
附加文件2:表S2。
在整个队列和NSCLC队列中,基因标记与应答和生存的统计相关性。
附加文件3:表S3。
研究中纳入的58个样本的组织学亚型、临床结果(抗pd1反应和生存)、TIS评分和归一化基因表达数据。
附加文件4:表S4。
有TMB数据的NSCLC患者的临床特征。
附加文件5:图S1。
在NSCLC队列中,免疫特征与总生存率相关。NSCLC队列中高、低特征评分生存分析中的危险比森林图。特征评分根据中位数分为高分组和低分组(TIS评分除外,如图所示使用上百分位数。2b).生存时间拟合Cox比例风险模型评分组(高vs低)。估计了风险比和wald型置信区间。的p-value由log-rank检验确定。*号表示的重要性p-value(< 0.001***, < 0.01**, < 0.05*)。
附加文件6:图S2.;
在CERTIM多肿瘤队列中,TIS评分和其他基因标记与应答和总生存期相关。一个CERTIM多肿瘤队列中应答者和无应答者之间多基因签名评分差异的森林图。平方点的位置表示得分差异,大小表示有统计学意义。水平线是wald型置信区间。*号表示的重要性p-value(< 0.001***, < 0.01**, < 0.05*)。b在CERTIM队列中,生存分析中高和低签名评分之间的危险比森林图。特征评分根据中位数分为高分组和低分组(TIS评分除外,如图所示使用上百分位数。1c).生存时间拟合Cox比例风险模型评分组(高vs低)。估计了风险比和wald型置信区间。的p-value由log-rank检验确定。*号表示的重要性p-value(< 0.001***, < 0.01**, < 0.05*)。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。除非另有说明,创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据。
关于本文
引用本文
达摩特,D.,沃伦,S.,阿隆多,J.。et al。在CERTIM泛癌症队列中,肿瘤炎症特征(TIS)与抗pd -1治疗获益相关。翻译医学杂志17, 357(2019)。https://doi.org/10.1186/s12967-019-2100-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-019-2100-3
关键字
- 免疫疗法
- PD-1
- 干扰素
- 肿瘤
- 炎症
- 签名