摘要
背景
基于血浆中循环的无细胞DNA的液体活检作为一种非侵入性生物标志物显示了可靠的结果。在本研究中,我们评估了循环游离DNA (cfDNA)和亚型肿瘤DNA (ctDNA)在肝细胞癌(HCC)患者中的应用,以评估治疗反应和临床结果。
方法
在SORAMIC试验背景下招募的13例不可切除的晚期HCC患者和不同的病因学和临床病理特征被纳入这项探索性研究。在肝脏微干预和开始索拉非尼为基础的全身治疗之间收集血浆样本,然后在对应的另外三次随访中收集血浆样本。从血浆中分离DNA,并对597个癌症相关基因进行下一代测序(NGS)。
结果
cfDNA水平与转移的存在和生存有显著相关性。此外,cfDNA动力学随时间的变化揭示了患者临床病史的趋势,支持将其用作监测治疗的生物标志物。基于ngs的ctDNA分析鉴定出28个变异,在不同时间点以不同组合检测到。在这些变异中,HNF1A、BAX和CYP2B6基因的突变频率最高,且与患者的临床病理特征显著相关,提示在这种特定的临床环境中可能发挥驱动基因的作用。
结论
综上所述,这些结果支持cfDNA/ctDNA在晚期HCC患者中的预后价值,并具有预测治疗反应的潜力。这些发现支持了液体活检在晚期HCC中的临床应用,改善了个体化治疗,并可能更早地识别治疗应答者。
背景
肝细胞癌(HCC)是全球第六大常见癌症,也是癌症相关死亡的第二大原因,如果不治疗,中位生存期仅为7个月[1,2,3.].虽然肝硬化一般由慢性炎症和氧化应激引起[4],被认为是最常见的危险因素,患者通常在治疗有限,切除或移植不再是一种选择的晚期被诊断为HCC。这部分是由于成像和生物标志物(如血清甲胎蛋白)等标准诊断模式的敏感性和特异性有限[5],在监测高风险人群时检测小肿瘤。晚期HCC通常预后较差,细胞毒性药物的疗效非常有限。多酪氨酸激酶抑制剂索拉非尼的靶向治疗一直是全身治疗的主流,然而与安慰剂相比,总生存期有适度改善,而且通常仅在亚组患者中[6].为了让患者迅速接受更有效的治疗,识别治疗反应的早期预测因素是非常可取的。
循环游离DNA (cfDNA)在健康人的血浆和血清中检测到,是细胞坏死或凋亡的结果。癌症患者的cfDNA含量较高,因为肿瘤细胞比正常细胞分裂更快,cfDNA的释放比例更高[7,8,9].来自肿瘤的cfDNA的部分被表示为循环肿瘤DNA (ctDNA) [10,11].在过去的几年里,cfDNA和ctDNA的分析作为一种新型的血液生物标志物已经引起了相当大的关注,因为cfDNA的定量和动力学分析[12,13]及ctDNA的分子分析[14]显示了预测和预后的价值。静脉穿刺具有随时间连续取样的能力,可能比标准活检更有优势,避免了切口并发症,并反映了整个肿瘤的遗传异质性。此外,由于循环DNA的半衰期较短[15],基因分析可以为治疗过程中产生的动态突变提供“实时”的见解。cfDNA/ctDNA在早期HCC中的预后价值已被证实[16,17].本研究的目的是评估在SORAMIC试验的背景下,cfDNA随时间的定量是否可能是预测晚期HCC患者临床结果的有效监测策略[18,19],以及ctDNA的分子谱分析是否可以追踪系统和肝脏定向微介入联合治疗过程中肿瘤的遗传进化。
方法
患者与治疗
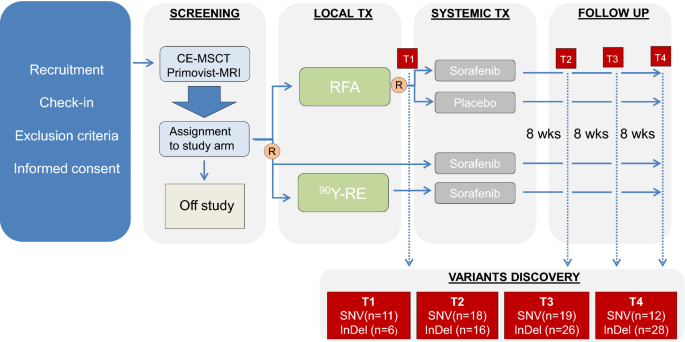
来自前瞻性随机多中心II期SORAMIC试验(EudraCT 2009-012576-27, NCT01126645)的13例男性患者(中位年龄(年龄±标准差):68±8.91,范围46-82)纳入本探索性研究[18,19].参与者于2011年至2016年在不同的欧洲研究中心招募。晚期、不可切除的HCC患者接受了钇-90 (90Y-RE)放射栓塞联合索拉非尼全身治疗(n = 10)或射频消融联合索拉非尼(n = 2)或安慰剂(n = 1)。根据影像学和甲胎蛋白(AFP)评价治疗效果[20.,21].中位总生存期为23.8个月(范围11.9 - 41.4),仅有2例患者复发,无进展生存期分别为22.3和26.8个月。在四个不同的时间点采集血液样本:微介入治疗后和开始索拉非尼全身治疗前(T1),全身治疗开始后约8周(T2,在T1和T2之间的中位数天数:112),第一次随访(FU) (T3,在T1和T3之间的中位数天数:224)和第二次FU (T4,在T1和T4之间的中位数天数:297)。SORAMIC试验设计如图所示。1,表示相对于采血的时间点。这项研究得到所有相关伦理委员会的批准,并根据《赫尔辛基宣言》进行[22].在进入研究之前,所有患者都提交了书面知情同意书。
DNA分离、文库制备和下一代测序(NGS)
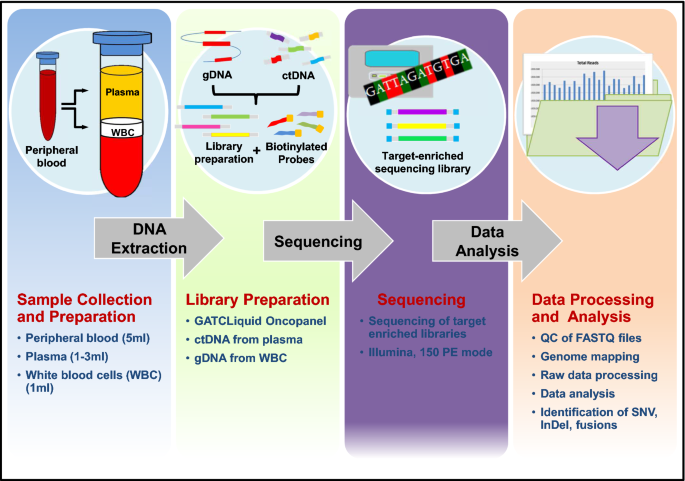
用EDTA管(Becton-Dickinson, Heidelberg, Germany)抽取外周血(5ml),并立即处理(离心3000转,5分钟,4℃),以收集血浆和黄色涂层,并将其取出并保存在−80℃下,待进一步使用。血浆用于提取游离细胞DNA (cfDNA),浅色涂层用于提取基因组DNA (gDNA)。DNA提取、质量控制和NGS在Eurofins Genomics GmbH (Konstanz, Germany)进行。通过电泳和荧光计浓度测定评估提取DNA的质量和数量(详情见附加文件)1:图S1)。提取的DNA用于文库制备和后续测序。覆盖深度的摘要显示在附加文件中2:表S1。
这些基因是根据它们的重要性和临床指南进行选择的,如欧洲医学肿瘤学会(ESMO)、国家综合癌症网络(NCCN)和美国病理学家学院(CAP)。
在Illumina平台上使用150对端模式进行NGS。测序读数进行质量检查,并使用默认参数的BWA映射到人类基因组[23].经过靶标处理和比对细化,得到变异体(单核苷酸变异体,SNV;插入和删除,InDel;根据Chimer DB 2.0进行基因融合[24])被发现并作了注释。为了区分体细胞和种系突变,从浅黄色外套中提取的基因组DNA被并行分析(附加文件)3.:表S2)。整个实验流程如图所示。2.
统计分析
所有统计分析均使用IBM SPSS Statistics 21.0.0 (IBM公司,纽约,纽约州)进行。数值数据的结果以中值以及样本的最小值和最大值(即范围)给出。采用Pearson相关系数及显著性检验分析肿瘤大小与不同时间点cfDNA浓度的相关性。采用非参数Mann-Whitney U检验比较不同临床病理特征患者组不同时间点的cfDNA。不同时间点的变异与患者临床特征之间的关系采用Fisher精确检验进行评估。使用Kaplan-Meier方法分析总生存期(OS),使用log-rank检验比较不同组的生存估计。患者按cfDNA浓度高低分为两组(高cfDNA =高于中位数,低cfDNA =低于中位数)。OS从原发肿瘤诊断之日起计算至死亡日期或最后一次临床随访日期。所有试验都是双面进行的。由于样本量低(n = 13例),未做alpha调整。 All statistical tests are interpreted at a significance level of alpha = 5% and according results are considered exploratory.
结果
患者的临床病理特征
在本研究选择的队列中,患者被分为两个亚组:年龄在65岁以下的患者,在招募时没有肝硬化,没有报告任何过去的酒精滥用,根据SORAMIC试验[19]结果,对治疗的反应更好;65岁以上的患者,在招募时表现为肝硬化,报告有酗酒史,对治疗的反应更差。所有患者均无乙肝阳性,仅1例丙肝阳性,4例为非酒精性脂肪性肝炎(NASH)。3例(33.3%,n = 4,病灶数目不详)为弥漫性病变(> 20个病灶),其余患者中位病灶数目为2个(0-28个范围),病灶中位大小为49毫米(8-160毫米范围)。3例(23.0%)门静脉浸润,均表现为Child-Pugh a型肝功能,46.1% (n = 6)为巴塞罗那临床肝癌分期(BCLC) C型,其余为a型(n = 3, 23.0%)或B型(n = 4, 30.7%)。4例(30.7%)有淋巴结转移,1例(7.7%)有骨转移。2例(66.6%)FU 2年复发。表中总结了患者的临床病理特征1.
cfDNA水平、患者临床病理特征与临床结局的相关性
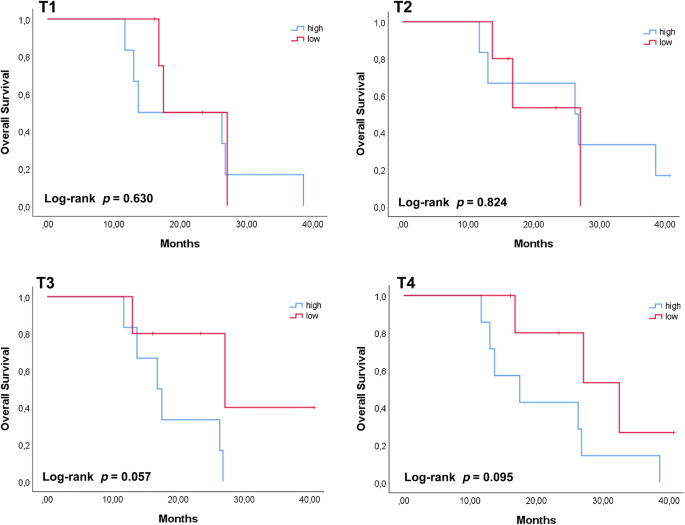
从SORAMIC试验中4个时间点(T1、T2、T3和T4)采集的血浆中分离cfDNA。52个cfDNA样本中的9个(17.3%)由于基因组DNA污染高或浓度低于阈值而被排除在后续分析之外(附加文件)1:图S1)。在其余样本中,不同时间点cfDNA的含量在2.04 ng/ml至160.75 ng/ml之间,T1时中位数为10.2 ng/ml, T2时为15.3 ng/ml, T3时为9.3 ng/ml, T4时为13.3 ng/ml2).我们没有观察到T1时cfDNA浓度与肿瘤体积之间的显著相关性,也没有观察到任何时间点cfDNA浓度与患者临床特征之间的显著相关性p>0.1)(数据未列示)。相反,我们确实观察到cfDNA在转移灶存在或不存在时的浓度差异,这是显著的(p= 0.012)或临界显著性(p= 0.073)。3.).不同时间点cfDNA的相对数量也与总生存期(OS)相关。患者根据cfDNA水平相对于不同时间点的中位数进行分组。我们发现最晚时间点(T3,p= 0.057;T4,p= 0.095),提示在接受全身治疗的同时保持高水平的血浆cfDNA的患者可能有更坏的结果(图。4).相反,我们没有发现早期时间点的cfDNA水平与OS之间有任何关联p> 0.1)。我们发现具有边缘性显著性的事实可能是由于纳入分析的患者数量较少,因此有必要在更大的患者队列中验证这些初步结果。
cfDNA与传统生物标志物AFP的比较
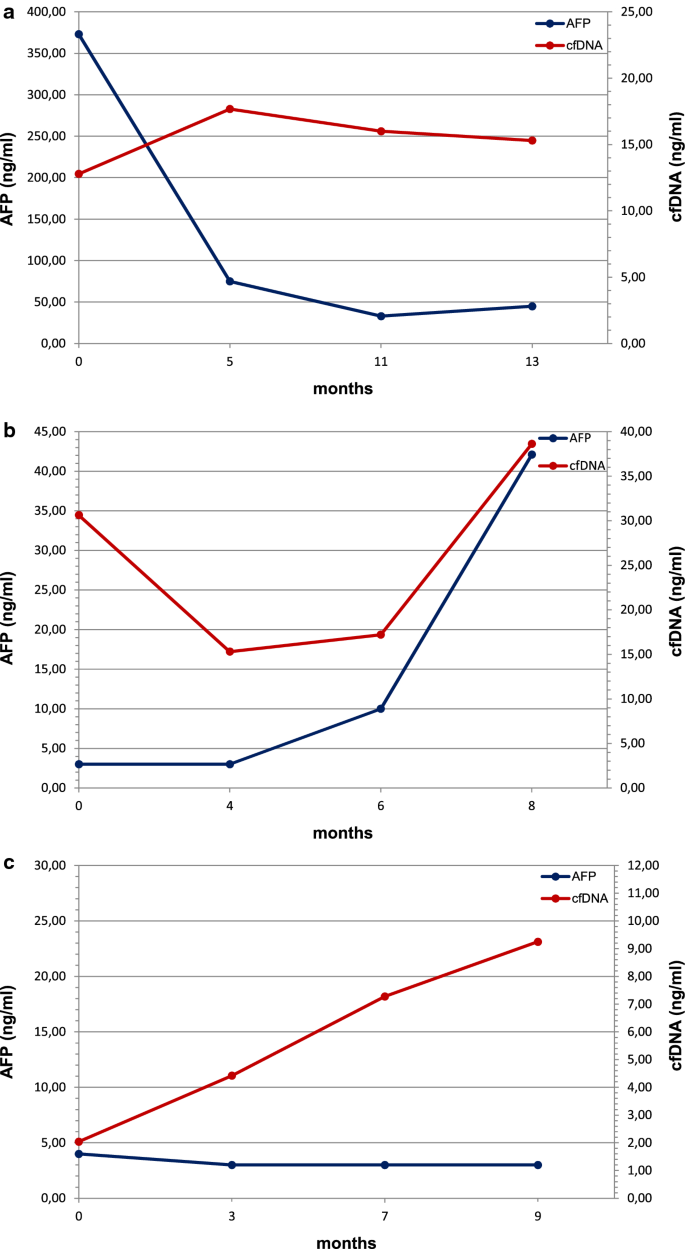
高达30%的HCC患者在诊断时可检测到AFP,并且通常在病程中保持低水平,即使是晚期HCC [20.].AFP > 400-500 ng/ml支持HCC诊断[21].在所考虑的时间点,只有2例(15.4%)患者的AFP值较高(> 400 ng/ml), 4例(30.8%)患者的AFP值在20 ~ 400 ng/ml之间,7例(53.8%)患者的AFP值在2 ~ 20 ng/ml之间(表2)2).已经证明cfDNA具有临床诊断相关性,反映治疗反应[25].我们在这里更详细地报告了三个有疾病进展证据的患者的小插图,对于这些患者,cfDNA比AFP等传统生物标志物提供了更早的监测价值(图2)。5).以400 ng/ml为临界值。第一个患者(患者B)进入试验,肝脏和淋巴结弥漫性疾病和骨转移;他在参加SORAMIC试验38.6个月后死亡。在开始索拉非尼治疗前AFP浓度高(373 ng/ml);然而,它迅速下降到50 ng/ml以下,并在服用索拉非尼时保持在较低水平,提示治疗有效。相反,我们没有发现cfDNA浓度的相应降低,而是随着时间的推移而增加,这表明存在进行性疾病,如随访时CT成像所证实的(图。5a).第二例患者(患者E)在治疗中出现淋巴结转移、门静脉浸润和疾病进展,自治疗开始OS为11.7个月。在所考虑的时间点,AFP值的测量始终低于50 ng/ml;相比之下,cfDNA水平虽然在治疗开始后立即出现急剧下降,但在治疗开始后6 - 8个月间迅速上升,反映了疾病的快速进展,表明对索拉非尼的反应发生了变化(图2)。5b).进入本研究的第三例患者(患者K)仅出现一处肝脏病变,且无转移证据。AFP在所有时间点均低于5 ng/ml,但cfDNA显示稳步增加,预测疾病的进展。患者最终复发并在不久后死亡(图。5c).总之,我们的数据与其他报道一致,表明cfDNA比AFP的诊断敏感性更高[24,26],这也表明cfDNA在晚期HCC中可以作为监测治疗效果的生物标志物。
体细胞突变分析
在不同时间点对ctDNA进行基因组分析,筛选出597个癌症相关基因。只有那些根据ClinVar数据库(国家生物技术信息中心ncbi)证明具有临床影响的突变被进一步分析。在我们的数据集中共发现了28个变异,包括单核苷酸变异(SNV)或插入和缺失(InDel),而没有发现基因融合(图2)。6).所有患者均表现出至少一种变异(中位数=每个患者6个变异,范围3-16),但患者之间的模式有所不同。在涉及DNA修复、多药耐药、细胞周期控制、信号转导、转录控制、染色质结构、凋亡和DNA甲基化的基因中发现了变异(表2)3.).我们在公认的HCC驱动基因如CTNNB1和TP53中检测到体细胞突变,但频率非常低。在28个变异中,有3个基因的MAF频率最高,分别为HNF1A (n = 12,92.3%)、BAX (n = 9,69.2%)和CYB2B6 (n = 6,46.1%)。我们观察到高比例的基因变异(n = 19,68%)主要是在索拉非尼治疗开始后发现的,这表明可能是由治疗本身诱导的克隆选择。然而,也观察到了不同的动力学。例如,在HNF1A病例中,50%的患者在开始服用索拉非尼之前就已经出现了变异。在T2时,只有1例患者仍呈阳性,提示良好的治疗反应。然而,在T3时,该变异的MAF为82% (n = 9),这一发现可能表明克隆性扩增的细胞对索拉非尼不再有反应。
变异、患者临床病理特征与总生存期之间的关系
遗传变异和患者临床病理特征之间的可能联系也进行了评估。由于队列规模较小,患者被分为仅在早期时间点(T1和T2)发现变异的患者和仅在晚期时间点(T3和T4)发现变异的患者。我们测定了BAX变异与门静脉侵入之间的显著相关性(p= 0.014)以及HNF1A变异与肝硬化(p= 0.032)。对于这两个基因来说,显著性只在较早的时间点被发现。相反,CYP2B仅在较晚的时间点与BCLC分级显著相关(p = 0.005)。没有发现进一步的相关性(所有p> 1.04).
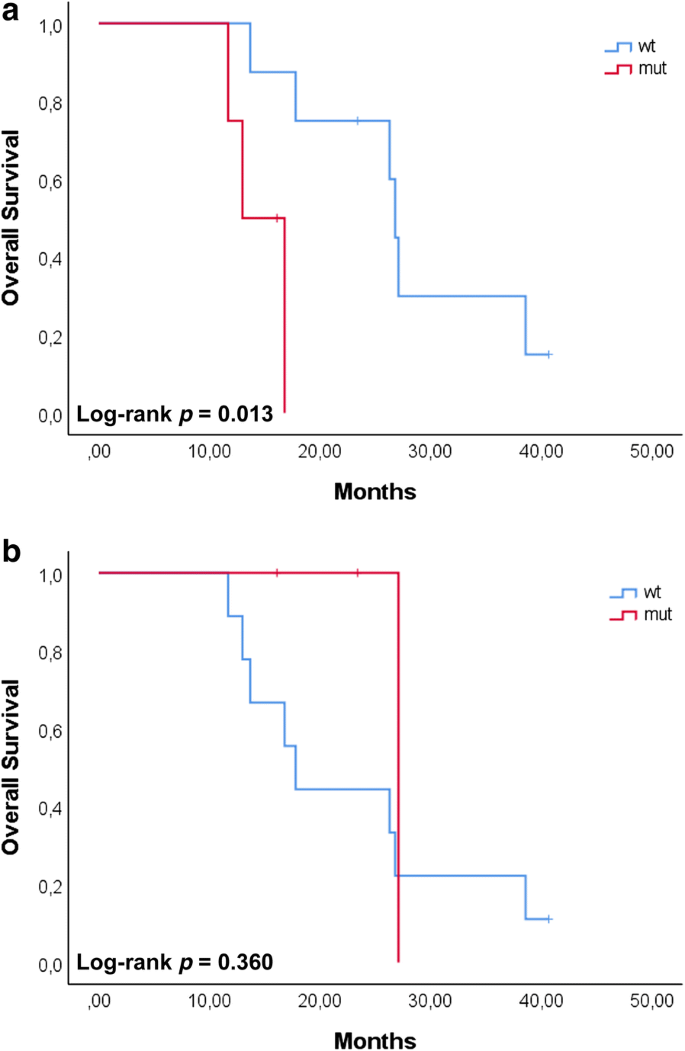
我们进一步评估了与OS相关的遗传变异的预后价值。在T1-T2时段携带CYP2B6变异的患者表现出较差的OS (p= 0.013)。相反,当在之后的时间点检测到相同的变异时,没有发现显著的相关性(p= 0.360)。7).在任何考虑的时间点,没有其他遗传变异显示与临床结果有任何相关性p> 0.1)。
讨论
HCC是一种异质性病理,涉及多个体细胞基因组改变,导致不同程度的肿瘤分化和相关的临床结果。
TP53和CTNNB1是两种最常见的突变,尽管已经发现了其他驱动突变[27].基于肝活检的基因组分析允许对HCC进行分子分型,并为选择和调整治疗方案以满足个别患者的需要打开了大门。除了与患者较高的风险相关外,组织活检也存在一些局限性:首先,肿瘤分化的遗传异质性不能通过单一部位取样来评估;其次,血管侵犯的组织病理学评估需要大的活检;第三,活检具有高侵入性,在整个治疗过程中通常只进行一次。液体活检不受这些限制,在包括HCC在内的几种癌症中显示出预测和预后价值[12,13,28].cfDNA的数量变化主要与肿瘤的负担和治疗效果有关[26],而ctDNA质变可以检测肿瘤整体的遗传变异[16,29].
在这项探索性研究中,我们研究了SORAMIC试验中多个时间点从晚期HCC患者中分离出的cfDNA/ctDNA的预后价值。我们观察到,在微干预后立即测量的cfDNA量与远处转移的存在显著相关,在这种临床背景下,也支持cfDNA对揭示继发性病变的诊断价值,正如在其他肿瘤类型中所显示的那样[25,30.,31].此外,术后cfDNA水平高的患者有较短的OS。有趣的是,这只在索拉非尼治疗几周后的时间点成立,这表明在晚期HCC中cfDNA也可以支持监测治疗反应。在考虑使用其他生物标志物如AFP时,这一发现是相关的。32,33]其预后价值仍有争议[34,35].在本研究纳入的患者中,在考虑的时间点上,只有两名患者的AFP浓度高于指定的临界值400 ng/ml。相反,术后cfDNA的定量分析总是可行的,并随患者的临床病史呈现趋势,支持使用cfDNA监测晚期HCC的治疗反应。
NGS分析显示,所有13例患者共有28个基因存在SNV和/或InDel变异,每个患者的中位变异数为6个。我们从未发现两名患者具有相同的特征,这支持了HCC是一种高度异质性疾病的概念。有趣的是,我们仅在少数病例中检测到通常与HCC相关的热点变异,如TP53或CTNNB1。我们不能排除这一结果是由于研究中纳入的患者数量较少,因此有必要进行更大队列的验证研究。然而,这些驱动突变通常与特定的病因学特征相关,在我们的患者组中不存在,如HBV感染,饮食暴露于黄曲霉毒素B1,或本身是非常罕见的事件[36].因此,这些变异的缺失可能与患者的临床特征有关。此外,在对1494个HCC样本进行的多模态荟萃分析中,已表明可以识别出其他不太频繁但仍具有临床意义的驱动突变[37].从28个变异中,我们特别鉴定出3个显示高MAFs的基因。CYP2B6(46.1%的患者至少在一个时间点发生突变)属于细胞色素P450类酶,是所有代谢酶中的重要催化剂。CYP2B6亚型主要在肝脏中表达,具有高度多态性[38](单倍型CYP2B6*6在高加索人群中发现的病例高达25%),并显示临床相关性[38,39].然而,单倍型*6 (h*6)的效果存在矛盾的结果。一方面,据报道携带h*6的患者mRNA和蛋白质的数量减少[40],对特定治疗的反应较差。另一方面,研究表明h*6可以提高CYP2B6的酶活性[41].在我们的研究中,我们发现46%的患者存在与h*6相对应的CYP2B6变异,在较早的时间点检测到该变异与较差的预后和较短的OS显著相关。由于参与代谢的酶的变异会影响对特定药物的反应[42]和CYP450及其单倍型参与多种药物的代谢[39,43],我们可以假设那些出现变异h*6的患者对sorafenib治疗的反应更差,因此有短的OS。
BAX(至少在一个时间点在69.2%的患者中发生突变)属于促凋亡蛋白Bcl-2基因家族[44].BAX的失活可能是一种逃避细胞死亡的机制,为肿瘤提供了生存优势。在结直肠癌中,这种特殊的移码突变确实对肿瘤进展有利,它具有p53不依赖的凋亡诱导[45].Sorafenib是一种多激酶抑制剂,对不同类型的细胞具有很强的抗增殖和抗血管生成作用[46],也显示出促凋亡作用[47].BAX可能在sorafenib诱导的细胞死亡中起作用,这种移码变体的存在可能预测由于诱导凋亡途径的失活而导致的低治疗效果。虽然我们没有发现BAX变异与OS之间存在任何显著相关性,但我们揭示了与门静脉侵犯的显著相关性。能够克服凋亡的肿瘤细胞表现出更高的侵袭性特征。3例携带该突变的患者门静脉浸润阳性,这一事实可能支持BAX在肿瘤侵袭中的作用,以及sorafenib在这些患者中可能无效。然而,目前这只是一个假设,需要进一步的分析来证实它。
最后,HNF1A表现出最高的MAF,在整个队列中达到92.3%。HNF1A编码一种调节肝脏分化和发育的转录因子(HNF1α) [48].这种转录因子作为肿瘤抑制因子[49],其失活可能在肿瘤发展中发挥重要作用[50].Takashima等人最近的一项研究表明,HNF1α的异位表达与其他两种转录因子(HNF4a和FOXA3)结合成功地抑制了细胞模型系统中的增殖[51].如果在其他模型系统中得到证实,HNF1A可能成为联合治疗的新靶点,特别是在出现耐药性时。
此外,虽然已知HNF1A失活在肝细胞腺瘤中很常见,但该基因的体细胞突变在HCC中相对罕见,通常与特定的病因学特征有关,如无肝硬化和病毒感染[52].在我们的队列中,除1例患者外,没有患者出现病毒感染,该变异的存在与肝硬化呈显著负相关。虽然TP53和CTBNN1是HCC中最常突变的两个基因,但还有其他低频驱动基因,如HNF1A,它们与患者的生存显著相关。我们可以假设,在本研究选择的患者队列中,HNF1A是一个驱动突变。如果在更多的患者中得到证实,HNF1A可能是个性化治疗的新靶点。
我们观察到的一个显著结果是突变状态随时间的动态变化。对于每个基因,在T1和T4之间的时间框架内,我们确定了6类患者,显示:始终是野生型基因(WT);总是突变基因(M);单移WT→M;单移M→WT;双shift WT→M→WT;双移M→WT→M。由于本研究纳入的患者数量较少,目前我们只能推测这些变化反映了原发肿瘤中发现的克隆异质性[53,54],因为分析是通过液体活检完成的。我们有理由推测WT→M的转变可能是因为突变的克隆对治疗更有抵抗力;因此处理后的样品富含携带突变的ctDNA。这些克隆可能是自发发育的,它们携带的突变赋予细胞选择优势。相反,M→WT的转变可能是因为突变的克隆对治疗更敏感,这可能会减缓它们的增殖,而WT克隆分裂和扩张更快。在后一种情况下,我们不能排除携带突变的ctDNA仍然存在,但在这种情况下,相应的MAF低于NGS检测阈值。治疗期间克隆扩增的动态变化是一个已知事件[55],我们的数据也强有力地证明了这一点。由于样本数量有限,我们只能提供一个假设。然而,在这个方向上进行研究,扩大病例数量并验证这些初步结果,肯定会很有趣。
结论
为了确认这些初步结果并支持其临床价值,有必要进行更大队列的验证研究并纳入适当的对照组。此外,还应考虑对接受消融或放射栓塞的患者进行更详细的比较,以了解可能的微介入治疗的不同程序是否会诱导替代基因突变的积累。然而,从这项探索性研究的结果中,我们可以得出结论,在微干预后的晚期HCC中,cfDNA定量也是可行的,可以支持标准成像分析,以早期发现转移性病灶,并显示出与OS相关的预后价值。此外,检查ctDNA的遗传变异可以减少因全身治疗而导致的克隆选择分期不足,有可能提高治疗疗效的纵向监测。HCC是一种高度异质性的肿瘤类型;因此,根据固有的遗传特征量身定制治疗将是一个优势。本研究中纳入的所有患者均未显示相同的基因组谱,这支持了在高级HCC个体化治疗中也有必要改善临床结果的概念。对于已经处于疾病晚期,因此总体生存预期相对较短的患者来说,快速适应不同的外观并因此获得更有效的治疗可能特别重要。
数据和材料的可用性
支持本文结论的数据包含在文章中。
缩写
- 肝细胞癌:
-
肝细胞癌
- cfDNA:
-
循环游离DNA
- ctDNA:
-
循环肿瘤DNA
- 门店:
-
下一代测序
- 法新社:
-
甲胎蛋白
- SNV:
-
单核苷酸变体
- InDel:
-
插入和删除
参考文献
Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M,等。全球癌症发病率和死亡率:来源、方法和主要模式。中华肿瘤学杂志,2015;36(5):369 - 369。
李志强,王志强,王志强,王志强。全球癌症统计杂志,2012。中华癌症杂志2015;65(2):87-108。
Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D.全球癌症统计。中华肿瘤学杂志,2011;29(2):369 - 369。
El-Serag HB, Rudolph KL.肝细胞癌:流行病学和分子癌变。胃肠病学。2007;132(7):2557 - 76。
Bruix J, Sherman M,美国肝脏研究协会D.肝细胞癌的治疗:最新进展。肝脏病学。2011;53(3):1020 - 2。
程爱林,康玉凯,陈震,曹佳杰,秦山,金建军,等。索拉非尼在亚太地区晚期肝细胞癌患者中的有效性和安全性:一项III期随机、双盲、安慰剂对照试验中华肿瘤学杂志,2009;10(1):25-34。
Raja R, Kuziora M, Brohawn PZ, Higgs BW, Gupta A, Dennis PA,等。ctDNA的早期减少预示着durvalumab治疗的肺癌和膀胱癌患者的生存。临床癌症杂志2018;24(24):6212-22。
Sorenson GD, Pribish DM, Valone FH, Memoli VA, Bzik DJ, Yao SL.人类血液中单拷贝基因的可溶性正常和突变DNA序列。癌症流行病学生物标志物,1994;3(1):67-71。
Vasioukhin V, Anker P, Maurice P, Lyautey J, Lederrey C, Stroun M.骨髓增生异常综合征或急性骨髓性白血病患者血浆DNA中N-ras基因的点突变。中华血液学杂志,1994;26(4):344 - 344。
Leon SA, Shapiro B, Sklaroff DM, Yaros MJ。癌症患者血清中游离DNA与治疗效果。癌症杂志1977;37(3):646-50。
舒燕,吴霞,童霞,王霞,常志,毛勇,等。通过靶向下一代测序的循环肿瘤DNA突变分析为多种癌症类型的个性化治疗提供了指导。科学通报2017;7(1):583。
Iizuka N, Sakaida I, Moribe T,藤田N,三浦T, Stark M,等。丙型肝炎病毒相关肝细胞癌患者血液中循环游离DNA水平升高抗癌决议2006;26(6C): 4713-9。
德久Y,饭冢N,佐井田I,森部T,藤田N,三浦T,等。循环无细胞DNA作为丙型肝炎病毒相关肝细胞癌远处转移的预测标志物。中华肿瘤学杂志,2007;29(4):389 - 397。
杜尔F,施密特K,马乔提,罗曼K,古德曼S,李明,等。循环突变DNA以评估肿瘤动态。中华外科杂志,2008;14(9):985-90。
罗玉敏,张杰,梁丹丹,刘志强,张安敏,海敏。从母体血浆中快速清除胎儿DNA。王志刚。1999;32(1):1 - 4。
冈岛W,小松S,市川D,宫美M, Ohashi T,今村T,等。肝细胞癌患者液体活检:循环肿瘤细胞和无细胞核酸。世界胃肠杂志,2017;23(31):5650-68。
尹长青,袁春春,曲忠,管强,陈华,王方芳。肝细胞癌的液体活检:循环肿瘤来源的生物标志物。Dis marker . 2016;2016:1427849。
李志强,李志强,李志强,等。放射栓塞联合索拉非尼治疗晚期肝细胞癌的安全性和毒性:欧洲多中心试验SORAMIC的分析中国肝病杂志,2015;35(2):620-6。
李志强,李志强,李志强,等。选择性内部放射治疗(SIRT)联合索拉非尼对晚期肝细胞癌患者总生存期的影响:SORAMIC试验姑息性队列中国肝病杂志。2018;68:S102。
科伦坡M.病毒性肝炎癌症筛查。临床肝病杂志2001;5(1):109-22。
Bialecki ES, Di biseglie AM。肝细胞癌诊断。HPB(牛津大学)。2005年,7(1):保险。
世界医学A.世界医学协会《赫尔辛基宣言》:涉及人体的医学研究的伦理原则。《美国医学协会杂志》上。310(20): 2191 - 2013; 4。
李华,杜斌。基于Burrows-Wheeler变换的快速精确短读对齐。生物信息学,2009,25(14):1754 - 60。
金鹏,尹森,金宁,李松,高敏,李海,等。ChimerDB 2.0 -一个更新的融合基因知识库。Nucleic Acids Res. 2010;38(数据库issue): D81-5。
Allin DM, Shaikh R, Carter P, Thway K, Sharabiani MTA, gonzalez -de- castro D,等。循环肿瘤DNA是晚期甲状腺癌疾病进展和靶向治疗反应的潜在生物标志物。欧洲癌症杂志。2018;103:165-75。
陈浩,孙丽丽,郑海峰,张庆峰,金晓明。血清总DNA和DNA完整性:对乙型肝炎病毒相关肝细胞癌的诊断价值病理学。2012;44(4):318 - 24。
柴田,李志强,李志强。肝癌基因组的研究进展。中华胃肠病杂志,2014;11(6):340-9。
徐德伟,徐秀杰,陈世峰,陈志伟,等。循环肿瘤DNA分析监测转移性乳腺癌。中华实用医学杂志,2013;29(4):369 - 369。
唐继杰,冯丽丽,郭涛,谢艾,蔡新军。肝细胞癌循环肿瘤DNA:趋势和挑战。细胞生物学,2016;6:32。
黄志刚,王志刚,王志刚,等。循环肿瘤DNA突变追踪预测早期乳腺癌复发。中国生物医学工程学报,2015;29(3):342 - 342。
Chaudhuri AA, Chabon JJ, Lovejoy AF, Newman AM, Stehr H, Azad TD,等。循环肿瘤DNA分析在局限性肺癌分子残留病变的早期检测。中国癌症杂志,2017;7(12):1394-403。
Chaiteerakij R, Addissie BD, Roberts LR。肝细胞癌生物标志物的最新进展。中华胃肠病杂志。2015;13(2):237-45。
Lok AS, Sterling RK, Everhart JE, Wright EC, Hoefs JC, Di biseglie AM,等。des - γ -羧基凝血酶原和甲胎蛋白作为肝细胞癌早期检测的生物标志物。胃肠病学。2010;138(2):493 - 502。
Giannini EG, Marenco S, Borgonovo G, Savarino V, Farinati F, Del Poggio P,等。甲胎蛋白在代偿性肝硬化监测中发现的小肝细胞癌中没有预后作用。肝脏病学。2012;56(4):1371 - 9。
沈志华,尹德龙,韩山,李玉杰,李松生,金敏敏,等。血清甲胎蛋白是否有助于预测肝细胞癌切除术后的复发和死亡率?基于倾向评分和竞争风险分析的测试。中华外科杂志,2012;19(12):3687-96。
Tornesello ML, Buonaguro L, Tatangelo F, Botti G, Izzo F, Buonaguro FM。与乙型和丙型肝炎病毒感染相关的肝细胞癌中TP53、CTNNB1和PIK3CA基因突变基因组学,2013;102(2):74 - 83。
Chaudhary K, Poirion OB, Lu L, Huang S, Ching T, Garmire LX。对1494个肝细胞癌样本的多模态元分析揭示了共识驱动基因对表型的显著影响。临床癌症杂志2019;25(2):463-72。
李志强,李志强,李志强,等。CYP2B6*6是慢性淋巴细胞白血病氟达拉滨+环磷酰胺不良反应的独立决定因素。血。2013;122(26):4253 - 8。
宋强,周旭,于娟,董宁,王霞,杨华,等。CYP2B6基因多态性和转移位点对多西他赛和硫替帕治疗晚期乳腺癌患者的预后价值。科学通报2015;5:16775。
Hofmann MH, Blievernicht JK, Klein K, Saussele T, Schaeffeler E, Schwab M,等。CYP2B6*6标记物c.516G>T [Q172H]引起的异常剪接可导致CYP2B6在肝脏中的表达和活性降低。中国药物学杂志,2008;29(1):344 - 344。
中岛M, Komagata S, Fujiki Y, Kanada Y, Ebi H, Itoh K,等。CYP2B6基因多态性影响日本癌症患者环磷酰胺的药代动力学/药动力学药物基因学杂志,2007;17(6):431-45。
艾彻鲍姆,英格曼-桑德伯格,埃文斯,我们。药物基因组学与个体化药物治疗。2006; 57:19 19 - 37。
细胞色素P450的药物遗传学及其在药物治疗中的应用:过去,现在和未来。药理学进展,2004;25(4):193-200。
Campbell KJ, Tait SWG。靶向BCL-2调控肿瘤细胞凋亡。开放生物学。2018;8:180002。https://doi.org/10.1098/rsob.180002.
李志刚,李志刚,李志刚,王志刚,等。BAX基因在微卫星突变表型结肠癌中的体细胞移码突变。科学。1997;275(5302):967 - 9。
Wilhelm SM, Adnane L, Newell P, Villanueva A, Llovet JM, Lynch M. sorafenib的临床前概述,一种多激酶抑制剂,靶向Raf和VEGF和PDGF受体酪氨酸激酶信号。中华癌症杂志,2008;7(10):3129-40。
郝华,张东,史俊,王勇,陈琳,郭勇,等。Sorafenib通过JNK和Akt信号通路诱导肝星状细胞自噬死亡和凋亡。抗癌药物。2016;27(3):192-203。
Cereghini S, Yaniv M, Cortese r。肝细胞去分化和消失伴随着转录因子HNF1/LFB1编码mRNA合成的阻断。中国科学(d辑),2001;
曾旭,林勇,尹超,张旭,宁宝波,张强,等。携带肝细胞核因子-1基因的重组腺病毒抑制小鼠肝细胞癌异种移植物的生长。肝脏病学。2011年,54(6):2036 - 47。
罗震,李勇,王辉,Fleming J,李敏,康勇,等。肝细胞核因子1A (HNF1A)可能是胰腺癌的抑癌因子。PLoS ONE。2015; 10 (3): e0121082。
高岛勇,高泽浩,田田勇,铃木毅,等。转录因子组合表达对肝癌细胞增殖的抑制作用。中国生物医学工程学报,2018;29(4):344 - 344。
赫特曼JF,阿布-阿尔法GK,施塔德勒ZK,曼德尔克DL, Roehrl MHA, Zehir A,等。肝细胞腺瘤恶性转化中的体细胞HNF1A突变:MSK-IMPACT和TCGA数据的回顾性分析《哼哼哀乐》2019;83:1-6。
王勇,Waters J,梁明明,安鲁A,卢伟,石旭,等。单核基因组测序揭示乳腺癌的克隆进化。大自然。2014;512(7513):155 - 60。
李文杰,李志强,李志强,等。通过单细胞测序推断肿瘤进化。大自然。2011;472(7341):90 - 4。
谭帅,Sapari NS,苗红,Hartman M, Loh M, chong WJ,等。新诊断乳腺癌患者化疗前和化疗后3周的高通量突变谱变化。PLoS ONE。2015; 10 (12): e0142466。
确认
这项工作得到了德国马格德堡Otto-von-Guericke大学的支持。作者要感谢Regina Schinner (LMU, Munich)审查统计分析,Cheryl Gray (LMU, Munich)协助准备数字和校对手稿,Andreas Mittermaier (LMU, Munich)准备热图。作者要感谢所有参加SORAMIC试验的患者。
资金
这项研究得到了德国马格德堡奥托-冯-格里克大学的支持。
作者信息
作者及隶属关系
贡献
MA-F、PM、JR:研究设计;MA-F和KR:数据分析和稿件撰写;TH:成像分析;JM, MP, BB, CV, JB, MS, CCC:患者招募,临床数据收集,数据分析。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
这项研究得到了所有相关伦理委员会的批准,并按照《赫尔辛基宣言》进行。在进入试验前,所有患者都给予书面知情同意。
发表同意书
不适用。
相互竞争的利益
JR是SORAMIC试验的首席研究员,由拜耳GA和Sirtex Europe支持。PM是SORAMIC试验的联合首席研究员,由拜耳GA公司和Sirtex欧洲公司支持。所有其他作者都宣称他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
毛细管电泳(CE)检测提取cfDNA的尺寸分布。从所有血浆样本中提取DNA进行CE分离分析。cfDNA的大小约为150个碱基对(bp),对应于一个核小体,而gDNA的分子量较高,为几千个碱基对(kb)。在150 bp左右有一个独特峰值的样品被进一步分析,而有几个kb峰值的样品则不需要进一步处理。A组和B组分别报告了CE测定cfDNA和gDNA的实例(RFU,相对荧光单位;LM,下标记;嗯,上面的记号笔)。
附加文件2:表S1。
报道深度。除F4样本深度较低(840.41)外,所有样本平均覆盖至少1000次以上(平均值1743.63,范围1182.17-2870.64)。
附加文件3:表S2。
从每个病人的棕色外套中提取的基因组DNA中检测到的变异列表。指出了染色体位置、基因名称和突变频率。除E患者未获得相应细胞样本外,其余患者均进行了分析。对于这个病人,我们任意设置一个突变频率阈值,对应于其他样本的平均值。突变频率为50(±5)%和100(±5)%的基因被认为携带种系突变,因此被排除在接下来的分析中。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。除非另有说明,创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据。
关于本文
引用本文
阿鲁尼-法布罗尼,M., Rönsch, K.,胡贝尔,T.。et al。循环DNA作为晚期肝细胞癌患者预后的生物标志物:来自SORAMIC试验的一项翻译探索性研究。翻译医学杂志17, 328(2019)。https://doi.org/10.1186/s12967-019-2079-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-019-2079-9
关键字
- 液体活检
- 循环肿瘤DNA
- 肝细胞癌
- 生物标记物