摘要
背景
糖尿病是一种与许多问题和高成本相关的慢性疾病。近几十年来,为了改进糖尿病患者的治疗方法,进行了大量的研究。目前用于糖尿病的补充疗法之一是臭氧疗法或自体血液疗法。臭氧对糖尿病等许多疾病的有益作用已得到证实,但关键问题是确定臭氧与血液特别是血红蛋白反应的安全有效浓度。
方法
采用本征荧光、圆二色、紫外-可见光谱、SDS-PAGE、Native-PAGE、动态光散射等多种光谱技术,分析了臭氧化对1例非糖尿病患者和4例糖尿病患者血红蛋白的影响,以寻找适合个性化自体血液治疗的臭氧浓度。
结果
在这项研究中,我们根据血液血红蛋白分析,确定了安全有效的臭氧化治疗1例非糖尿病患者和4例II型糖尿病患者的个性化浓度。
结论
为了安全有效地进行基于血红蛋白分析的自体血液治疗,我们采用了多种技术来确定个性化臭氧浓度。SDS-PAGE和动态光散射被确定为个性化每个人的臭氧浓度所需的两种主要技术,否则,如果使用不适当的臭氧浓度,血液中的血红蛋白会发生寡聚并造成严重损害。
背景
糖尿病是一种代谢性疾病,其特征是碳水化合物代谢受损,胰岛素产生或消耗不当,导致糖尿和高血糖[1].全球糖尿病患病率正在大幅上升。自2011年以来,总共有3.66亿人被诊断患有糖尿病,其中II型糖尿病几乎占所有病例的90% [2].就其社会和经济压力以及造成的痛苦而言,II型糖尿病与I型糖尿病或胰岛素依赖型糖尿病是最严重的疾病之一。在发达国家,糖尿病患者的人数正在稳步上升,残疾率和死亡率也越来越高[3.,4].在II型糖尿病患者中,其特征是组织无法检测胰岛素敏感性,肝脏中的糖异生过程增加,葡萄糖摄取及其在胰岛素敏感组织中的转化严重受损。为了消除这些疾病,β细胞释放胰岛素增加,导致II型糖尿病,其特征是高血糖水平和高胰岛素血症的存在[5].
有大量临床证据表明,两种类型的糖尿病中活性氧(ROS)的产生都有所增加[6].氧化应激与葡萄糖摄取缺陷之间也存在直接关系。据报道,抗氧化剂消耗与2型糖尿病患者葡萄糖摄取减少有关。活性氧和抗氧化剂水平的失衡在胰岛素抵抗中起着重要的作用,其他研究表明氧化应激与胰岛素敏感性之间存在密切的关系。因此,增加抗氧化能力似乎可以克服胰岛素抵抗[5].
臭氧是活性最强的气体之一,也是仅次于氟和过硫酸盐的第三强氧化剂[7]和臭氧疗法已被记录为生物氧化疗法之一,已将其用作消毒剂和用于治疗包括糖尿病在内的各种疾病[8].在适应慢性氧化应激的现象中[8],也被评价为氧化预处理[9]或hormosis [10,11],经确定,重复和计算的治疗方法,例如以适当浓度和方式进行的臭氧治疗[12在低于抑制量和毒性量的浓度下可以产生刺激作用[11]触发氧化应激蛋白如HO-1的合成[13].事实上,臭氧疗法的治疗效果也可能部分是由于臭氧与几种生物成分的反应所产生的可控和适度的氧化应激[11].
据报道,臭氧疗法通过上述机制使血糖水平恢复正常,随后使有机过氧化物浓度恢复到原来的状态,降低II型糖尿病患者的高血糖,并发挥抗糖尿病作用[5].臭氧可以维持糖原含量,减少乳酸和尿酸的形成,并通过氧化预处理过程刺激或维持内源性抗氧化系统,阻断产生ROS的黄嘌呤-氧化酶途径,控制CCl氧化应激造成的损伤4[14,15,16].内源性氧化应激具有较长的半衰期,不同于患者离体血液暴露于氧气和臭氧气体混合物中引起的暂时性、精准性和调节性氧化应激。臭氧疗法可以产生这种温和、精确和暂时的氧化应激,可能会减少慢性氧化应激和可能的糖尿病并发症。1].事实上,根据最近对臭氧生物活性的研究,已经证明,低和精心调整的臭氧浓度意外地诱导了一种适应性反应,可以减少内源性氧化应激[8,17,18].
自体血液疗法是臭氧治疗中最常见和最有效的方法之一3.-AHT),其中包括将一定量的患者血液,连同作为抗凝血剂的柠檬酸钠,暴露于等体积的氧气(95%)和臭氧(5%)气体混合物中,以每毫升血液的特定浓度[12,19].
水环境中的臭氧能够迅速溶解,并将其能量提供给血液成分[20.],如血红蛋白(Hb),它是血液循环中含血红素最多的蛋白质。因此,臭氧对Hb的影响被广泛研究[21].
身体可以通过产生内源性或外源性抗氧化剂来应对氧化应激。抗氧化剂的作用是中和多余的自由基,保护细胞免受毒性作用,并帮助预防疾病的流行[22].总抗氧化能力(TAC)值在非糖尿病人和糖尿病患者中有所不同[23].血浆TAC测量被认为是解释抗氧化状态与其他疾病之间关系的重要步骤[24].
在这项研究中,我们首次研究了不同浓度的臭氧对1名非糖尿病个体和4名糖尿病患者(合并II型糖尿病)全血中人血红蛋白的影响,旨在重点研究一种个性化的方法,以确定一个安全、适当和有效的臭氧浓度,用于治疗糖尿病患者3.出去。本研究使用光谱研究,如本征荧光,圆二色性(CD)和紫外-可见光谱,以检查Hb的二级和三级结构的变化及其血红素基团和芳香残基,以及Native-PAGE,特别是SDS-PAGE,在存在和不存在二硫苏糖醇(DTT)(作为还原剂)的情况下。和动态光散射(DLS)来分析Hb暴露于不同浓度臭氧时的寡聚化和多分散性。
方法
臭氧生成
臭氧是由医用级氧气通过电晕电弧放电产生的3.发生器(Gardina,伊朗),使用光度法控制气体流量和臭氧浓度,并根据国际臭氧协会制定的规则定期进行碘滴定检查[25].血液臭氧化只能用医用氧气进行,而不能用含有78%氮的过滤空气,因为过滤空气会导致不必要的氮氧化物形成。在整个反应过程中使用一次性硅处理聚丙烯注射器(耐臭氧),以确保臭氧浓度的稳定性并防止其泄漏或污染。
Hb的收集、臭氧化和净化
非糖尿病个体和4例糖尿病患者的全血Hb分别用15、35、55µg/ml不同浓度的臭氧对其进行臭氧处理,纯化后用我们前期研究的方法进行透析[26].
气体输送和全血样本处理
实验采用单一浓度的臭氧气体混合物(浓度单位体积,µg/ml),由氧气(96-99%)和臭氧(1-4%)组成,流速为0.8 lit/min。气体的最终压力保持在正常的大气压力[27].在我们之前的研究中,我们以“百万分率”和“剂量”报告了使用的臭氧量[26].然而,在本研究中,我们使用“µg/ml”和“浓度”来代替这些术语,作为更准确的臭氧气体测量。大O区的不同臭氧浓度3.-用于治疗糖尿病患者的aht分别为15、35和50µg/ml,对外周动脉疾病也有效[28],与血液有效混合的最佳时间为5min [19].血液(具有粘性)与臭氧气体达到完全均匀平衡所需的时间长度[29].
在本研究中,全血样本以1:1的体积比暴露于臭氧浓度为15、35和55µg/ml的臭氧气体中5分钟,然后进行Hb纯化[27].选择55 μ g/ml而不是报道的50 μ g/ml是为了保持本研究中使用的增加的臭氧浓度水平的一致性。对照血样没有暴露在臭氧中。
荧光光谱
荧光光谱的检测仪器和方法与我们之前的研究相同[26].发射光谱在300 ~ 400 nm之间测量。激发波长为280 nm。
CD测量
CD光谱的测量使用AVIV 215分光偏振计(AVIV Associates, Lakewood, NJ, USA)进行。所有的CD测量与我们之前的研究一样[26].结果以椭圆度(度、厘米)表示2dmol−1)和以纳米为单位的波长。
紫外-可见吸收光谱
我们使用与我们之前研究相同的参数来测量UV-VIS光谱[26].吸光度扫描光谱使用紫外可见分光光度计(Varian, Carry 100 Bio, Australia)测量,吸光度为280 nm,范围为200-700 nm。
SDS-PAGE和Native-PAGE
在SDS-PAGE和Native-PAGE分析中,所有条件与我们之前的研究相同,使用18%的凝胶[26].Hb样品中的条带分子量通过与蛋白质标记物(SMOBiO,台湾)的比较来估计。
动态光散射
非糖尿病个体和4名糖尿病患者的Hb DLS测量方法与我们之前的研究报道的方法相同[26].材料(蛋白质)的折射率和吸收率分别设为1.59和0.01。采用如下参数:分散剂粘度为0.8872 cP,折射率为1.330。
血浆TAC的测量
使用ZellBio GmbH试剂盒(德国产品)测量非糖尿病个体和4名糖尿病患者在臭氧治疗前的血浆TAC值,并以mM表示[30.].
统计分析
TAC结果是每个人血浆中三次测量的平均值,并通过Friedman检验(非参数检验)以mean±SD报告,并使用SPSS软件,版本18。
结果
非糖尿病和II型糖尿病患者
表格1提供有关非糖尿病个体和四名糖尿病患者的信息(包括疾病持续时间),每个个体血浆的TAC测量(测量三次并取平均值)以及基于280 nm吸光度读数的臭氧化后每个样品的纯化Hb浓度(这取决于含芳香环残留物的存在或暴露,特别是色氨酸和酪氨酸)。本研究分析了一名非糖尿病个体和四名诊断为II型糖尿病的患者的全血Hb,以确定用于O中每个个体的臭氧安全有效浓度3.出去。
观察基于臭氧化后280 nm吸光度读数的Hb浓度结果,似乎有迹象表明Hb浓度在样品之间有所不同。这可能与臭氧氧化引起的结构变化有关,即在280 nm处吸光度的芳香残基暴露于不同的环境中进行检测。
在非糖尿病个体A中,与来自同一个体的非臭氧化Hb样品相比,三种臭氧处理浓度中的Hb浓度均有所增加。以15µg/ml臭氧处理的Hb测定最大Hb浓度。在患者B中,用35µg/ml臭氧氧化的Hb浓度最高。在患者C中,臭氧存在时Hb浓度最高,为15µg/ml。在患者D中,臭氧存在时Hb浓度最高,浓度为55 μg/ml;在患者E中,未臭氧化的Hb浓度最高。本研究中使用的其他技术将更好地解释这些观察结果。
Hb的臭氧化
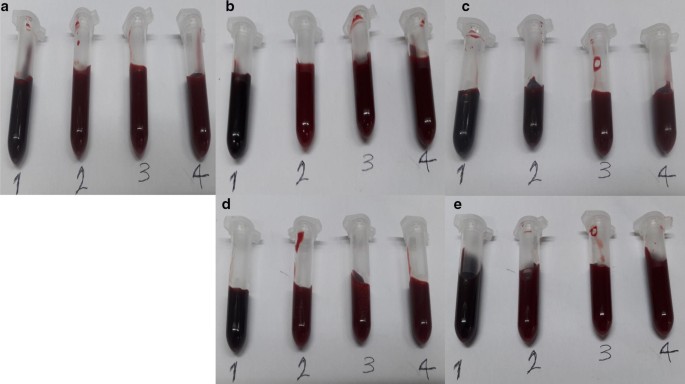
在这项研究中,在暴露于不同浓度的臭氧(15、35和55µg/ml) 5分钟后,纯化了一名非糖尿病个体和四名糖尿病患者的全血Hb。在所有情况下,观察到血液颜色从对照样品的暗红色到不同浓度臭氧化样品的略亮红色的轻微变化(图1)。1)。这表明臭氧化对全血Hb的颜色有轻微的影响,但与我们在之前的研究中观察到的结果相差很大,在我们之前的研究中,在纯化的Hb样品中缺乏抗氧化剂和臭氧的直接连续冒泡导致了引人注目的颜色变化[26],而不是本研究中的全血Hb样本,后者含有抗氧化剂(TAC值见表)1),并在注射器中以1:1的体积比暴露于臭氧气体中。
荧光分析
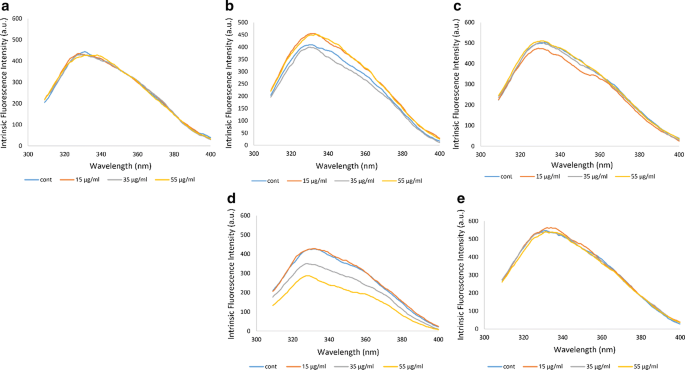
荧光用于评估蛋白质三级结构的变化,如Hb [31],其特点是其自身固有的荧光团,包括酪氨酸、苯丙氨酸和主要是色氨酸。α1 - β2界面上有一个β-Trp37,似乎在Hb的本征荧光中起主要作用[32].在非糖尿病个体A中,暴露于不同浓度臭氧的Hb与未臭氧化的对照Hb样品相比,荧光峰强度没有变化,这与我们之前的研究一致[26].
在糖尿病患者B中,35 μg/ml的臭氧浓度降低了Hb峰强度,而15 μg/ml和55 μg/ml的臭氧浓度增加了Hb峰强度。在糖尿病患者C中,15 μg/ml的臭氧浓度使Hb峰值强度略有降低。在糖尿病患者D中,臭氧浓度为55 μg/ml,然后是35 μg/ml,使峰值强度降低,而臭氧浓度为15 μg/ml能够使峰值强度升高,接近非臭氧化Hb样品的峰值强度。在糖尿病患者E中,不同臭氧浓度的峰值强度没有明显变化。表中所列Hb浓度之间的直接关系是什么1和本征荧光峰见图。2.例如,患者B的Hb浓度从最高到最低(基于280 nm处的吸光度读数)的趋势与35 μg/ml臭氧化的Hb有关,其次是非臭氧化的Hb,然后是15 μg/ml,最后是55 μg/ml臭氧。这一趋势在图1中也是一致的。2b,其中本质暴露Hb结构最高的最低峰与35 μg/ml臭氧处理的Hb有关。患者D在55 μg/ml时表现更为明显。其原因可能是患者B和D的Hb样品分别使用35和55 μg/ml的臭氧浓度,引起Hb中荧光团和β-Trp37周围环境的变化和极化,特别是与未臭氧化和其他臭氧处理的Hb样品相比,荧光峰强度更低,结构更开放。
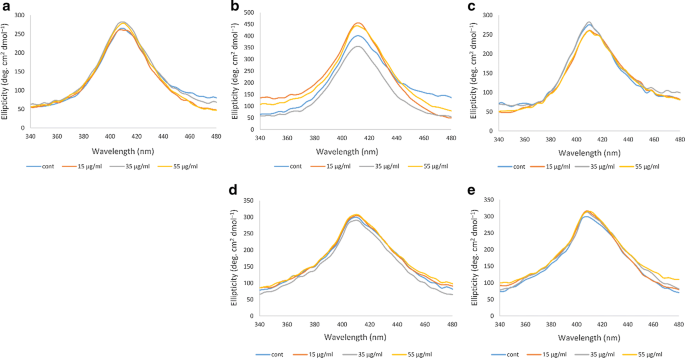
CD测量
远紫外CD
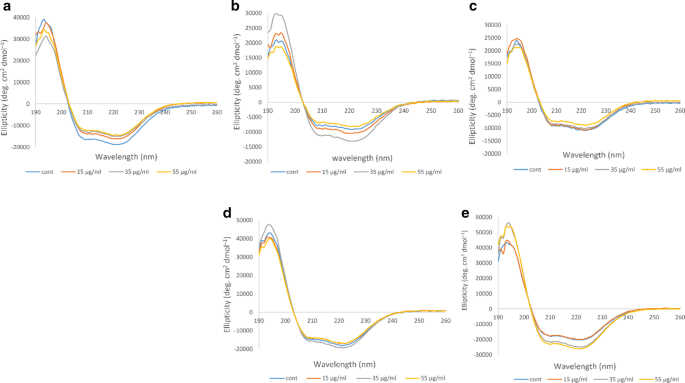
CD测量用于研究蛋白质结构的变化[31].在远紫外CD中,蛋白的α-螺旋结构在209 nm和222 nm处有两个高负峰,这两个峰分别与α-螺旋结构中的π -π*跃迁和α-螺旋构象中的n-π*跃迁有关。33,34].如图所示。3.在非糖尿病个体A中,非臭氧化Hb样品的α -螺旋含量最高,负峰最多,当臭氧浓度为15 μg/ml时,α -螺旋含量降低。在糖尿病患者B中,15 μg/ml和55 μg/ml臭氧处理的Hb样品与未臭氧处理的Hb样品相比变化较小,而35 μg/ml臭氧浓度导致峰值强度明显增加,α螺旋含量增加。在糖尿病患者C中,两个峰的强度在未臭氧化和臭氧处理的Hb样品之间没有显著差异。在糖尿病患者D中,未臭氧处理和臭氧处理的Hb样品之间的变化也可以忽略不计。对于糖尿病患者E,臭氧浓度为55 μg/ml后,再为35 μg/ml,峰值强度明显增加,表明α螺旋含量增加。
近紫外线CD
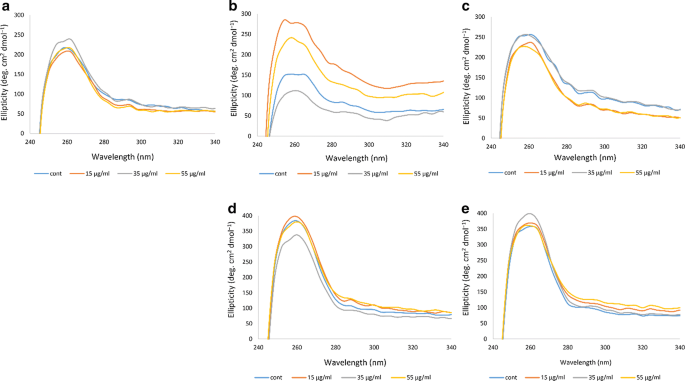
近紫外对芳香残基的变化也很敏感,这反映了蛋白质(如Hb)的三级结构,在260 nm波长处有一个高正极带[33,34].数字4显示了非糖尿病个体和4名糖尿病患者的Hb相关结果。在非糖尿病个体A的Hb样品中,不同浓度的臭氧对近紫外波段没有明显影响,只有35 μg/ml的臭氧化才引起近紫外波段强度的轻微增加。在糖尿病患者B的Hb样品中,近紫外波段的变化更为明显,35 μg/ml的臭氧化使波段强度大大降低,而55 μg/ml,特别是15 μg/ml的臭氧化使波段强度比未臭氧化的Hb样品大大增加。在糖尿病患者C中,臭氧浓度为35 μg/ml时,近紫外波段与对照未臭氧化的Hb样品接近,而臭氧浓度为15和55 μg/ml时,近紫外波段强度降低。糖尿病患者D,波段强度总体较高,仅35 μg/ml臭氧化导致波段强度降低。
在糖尿病患者E中,臭氧浓度为15 μg/ml和55 μg/ml时没有明显差异,与该患者非臭氧化Hb样品相似,而臭氧浓度为35 μg/ml时,在260 nm处波段强度相对明显增加。
Soret-UV CD
Soret-UV或b波段显示血红素组的变化,包括血红素组与球蛋白以及氧的结合。事实上,当血红素基团附着在珠蛋白上时,Soret区域的信号是可识别的,其特征是在410 nm处有一个高正极带[31].与近紫外研究的结果相似,图2。5在糖尿病患者B的Hb样本中,暴露于不同浓度臭氧的Hb的Soret带变化更为明显。当臭氧浓度分别为15 μg/ml和55 μg/ml时,与未臭氧处理的Hb样品相比,Soret波段的强度有所增加。然而,在35 μg/ml的臭氧处理下,Soret波段减少,低于未臭氧处理样品的Soret波段。对于非糖尿病个体和其他糖尿病患者,这种变化不太明显。
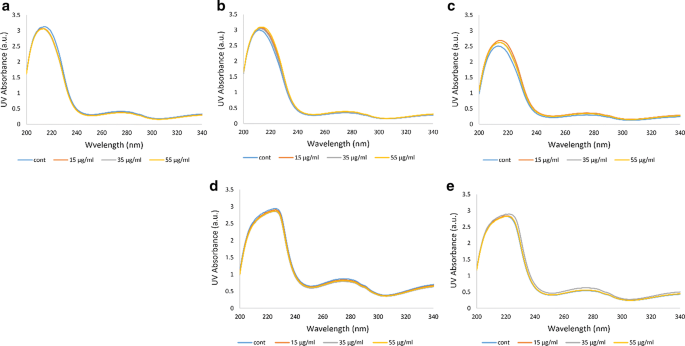
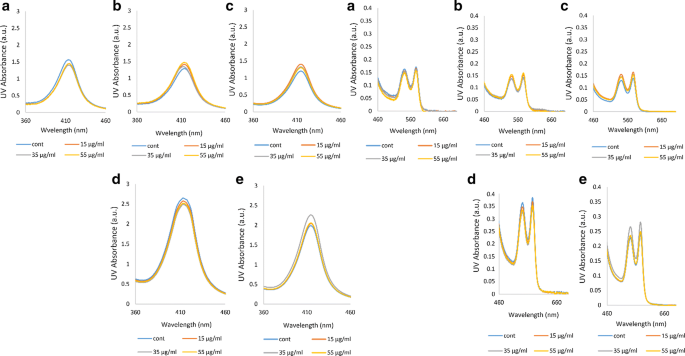
紫外-可见吸收光谱
紫外线-可见吸收是由于蛋白质的二级和三级结构以及血红素组构型的变化引起的[31].Hb的UV-VIS吸收峰表示其杂环卟啉结构所识别的血红素假体的存在[35].在紫外可见吸收光谱中,222 nm和278 nm处的峰分别与酰胺键和芳香残基(色氨酸、酪氨酸和苯丙氨酸)的n→π*跃迁有关[36].卟啉环的紫外可见光谱是由它们的π电子通过3个原始波段探测到的:414 nm的b波段(与Soret- uv CD中的Soret波段相同)和542和577 nm可见光区较长波长的一对q波段[35].在本研究分析的所有Hb样品中,222 nm和278 nm波段的强度保持不变,这表明臭氧化对蛋白质的肽键和芳香残基都没有明显的影响(图2)。6)。尽管如此,在糖尿病患者D和E中,肽带的形状发生了变化,并向更大的波长移动(图2)。6d, e)。
总的来说,观察UV-VIS光谱,无论是非糖尿病个体A还是4名糖尿病患者的Hb,在存在或不存在臭氧治疗的情况下,都没有很多显著的变化。然而,通过仔细分析紫外-可见光谱和图中的Soret和q波段。7,我们发现糖尿病患者D和E,与其肽带的形状变化和移位相似,也出现了一些变化,波段强度几乎增加了一倍,特别是在患者D的Hb样本中,波段强度大大增加(根据波长范围360-460的数据)。此外,无论是非糖尿病个体a还是4名糖尿病患者(根据波长范围460-660的数据),Hb中都没有臭氧化导致高铁血红蛋白形成的迹象。通过542和577 nm (q波段)的两个可区分的峰,所有Hb样品都处于氧化状态。
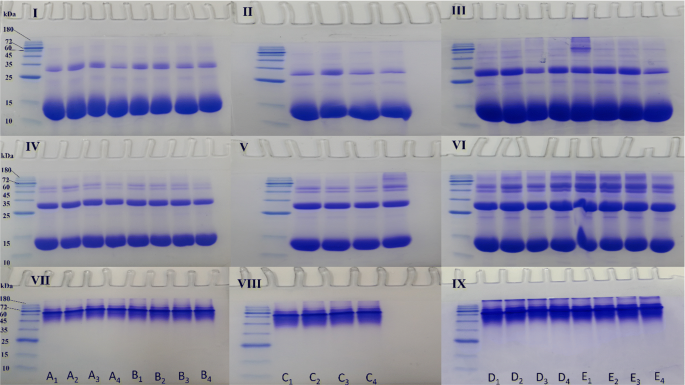
SDS-和Native-PAGE
Hb是一种四聚体大分子,由四条多肽链通过非共价键连接而成,每条多肽链携带一个血红素假基[37].使用SDS-PAGE的蛋白质迁移在很大程度上取决于蛋白质的水动力学性质、形状和表面电荷的水平[38].总的来说,我们发现,在非糖尿病个体A或四名糖尿病患者中,以及在两种情况下暴露于不同浓度臭氧的Hb样品中,在DTT作为还原剂存在或不存在的情况下,Hb单体和二聚体带宽没有显著变化(图2)。8)。然而,主要的区别是在涂抹的外观和高分子量带的形成,如三聚体、四聚体和低聚体。在糖尿病患者B和C以及非糖尿病患者A中,Hb样品(通过SDS-PAGE在还原和非还原条件下进行评估)被发现降解程度较低。此外,这些个体的Hb与三聚体、四聚体和低聚体相关的多条带或涂片较少(图2)。8然而,在糖尿病患者D和E中,有证据表明Hb降解更大,存在多个高分子量带和涂片,以及低聚物的形成,表明这些患者Hb的不稳定性(图2)。8,凝胶III和VI)。在我们之前的工作中[26],在还原条件下(使用DTT)查看SDS-PAGE结果,我们可以看到一个主要的厚Hb带在10和15 kDa分子量标记带之间迁移,表明Hb的α和β珠蛋白被还原和变性,分子量几乎相似。下一个强度较低的明显蛋白带属于25 - 35 kDa分子量标记带之间的一条带,表明Hb二聚体。在DTT存在的情况下,在25 kDa标记带以下和35 kDa标记带以上存在额外的条带,这可能是由于ROS对Hb的降解随机攻击四吡咯环中的碳-甲烷键并产生各种可以通过共价键结合在一起的吡咯产物,如前所述[39或由于Hb的三聚体和四聚体的形成。这些额外的条带在患者B和C的Hb样本中几乎看不到,但在患者D和E的Hb样本中更为明显,特别是在患者E的非臭氧化Hb样本中(图2)。8然而,在没有DTT的情况下,单体Hb波段的带宽被减少并加入到二聚体带宽中,这是由于二硫键的存在,在非还原条件下变得更加明显。此外,臭氧化似乎增加了三聚体和四聚体的条带形成,在某些情况下,通过共价二酪氨酸交联增加了低聚物的条带形成[40]或通过二硫键可能通过形成巨大的细胞外Hb,如先前报道的那样存在[38],这在患者D和E的Hb样本中更为明显,但在患者C的Hb样本中,臭氧浓度为55 μg/ml(图2)。8有趣的是,在患者E的情况下,高浓度55 μg/ml的臭氧降低了低聚物形成的可能性,而这种高浓度的臭氧导致患者C和D的低聚物形成(图5)。8在非糖尿病个体A的Hb样品中,将Hb暴露于不同的臭氧浓度没有引起显著影响,因此即使在55 μg/ml的臭氧下,Hb的状态与未臭氧化的Hb样品相似。在糖尿病患者B的Hb样品中,不同浓度的臭氧对低聚物形成的可能性影响不大,55 μg/ml的臭氧在防止低聚物形成方面的效果与对照非臭氧化Hb样品相似或更好。
在糖尿病患者C的Hb样本中,在DTT存在的情况下,当臭氧浓度为15 μg/ml时,可以看到单体带强度明显降低,二聚体带宽明显增加。此外,在没有DTT的情况下,臭氧化在55 μg/ml时显著增加了低聚物形成的可能性。在糖尿病患者D的Hb样本中,35 μg/ml的臭氧浓度与15 μg/ml和55 μg/ml的臭氧浓度相比,可以减少涂片和低聚物的形成。在糖尿病患者E的Hb样本中,非臭氧化的Hb对照样本显示有表明四聚体和低聚物形成的强烈波段。有趣的是,臭氧化在55 μg/ml时,减少了这些条带的存在,从而有助于减少这些低聚物种的形成。非糖尿病个体和4例糖尿病患者Hb的Native-PAGE显示Hb的四聚体是60 kDa分子量标记带附近的主要带(图2)。8(凝胶VII, VIII和IX)。natural - page结果与SDS-PAGE结果一致,显示糖尿病患者D和E的Hb样品有更明显的涂片形成,并且存在低聚物或更高分子量的物种,如前文所述,这可能是由于ROS随机攻击四吡啶环中的碳甲烷键而引起的降解[39]和/或形成共价二酪氨酸交联[40].
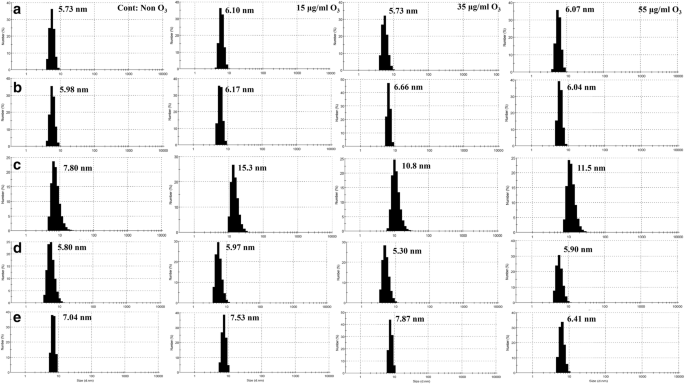
动态光散射
非糖尿病个体和4例糖尿病患者全血氧血红蛋白DLS结果见表2和无花果。9.在非糖尿病个体A中,臭氧浓度为15 μg/ml和55 μg/ml时,Hb的直径大小仅略有增加,而臭氧浓度为35 μg/ml时,对Hb的直径大小没有影响。在糖尿病患者B中,在35 μg/ml臭氧下,Hb的直径大小比同一患者的对照非臭氧化Hb样品增加。另外两种臭氧浓度为15 μg/ml和55 μg/ml时,该患者的Hb直径与未臭氧化的样品接近。在糖尿病患者C中,三种臭氧浓度均使Hb直径增大,在臭氧浓度为15 μg/ml时,以数字模式下Hb直径增大最大。这与SDS-PAGE结果(在还原条件下)是一致的。8我们观察到,与该患者的其他Hb样品相比,在15 μg/ml臭氧下,Hb降解和形成高分子量物种的可能性增加,单体主能带强度减少,而二聚体带宽增加。在非还原条件下对相同样品的评估(图2)。8,凝胶V),表明在55 μg/ml臭氧下形成低聚物的可能性更明显,这得到了该样品的DLS强度模式值的支持(见表1)2)。糖尿病D患者在35 μg/ml臭氧处理时,血红蛋白直径减小,而在15和55 μg/ml臭氧处理时,血红蛋白直径增大。这些结果与SDS-PAGE结果一致,表明低聚物形成的最低概率与患者D的35 μg/ml臭氧化样品有关(图2)。8此外,在糖尿病患者E中,臭氧浓度为55 μg/ml时,血红蛋白直径大小明显减小,而臭氧浓度为15 μg/ml和35 μg/ml时,血红蛋白直径大小比未臭氧化的对照血红蛋白样品有所增加。在该糖尿病患者的Hb样品中,55 μg/ml的臭氧化处理减少了低聚物的形成,与SDS-PAGE结果一致(图2)。8凝胶III和VI),并表现为最显著。
臭氧化全血氧血红蛋白DLS显示的5个人体样本的大小分布。一个非糖尿病个体氧- hb的DLS谱b- - - - - -e分别为B ~ E糖尿病患者oxy-Hb的DLS谱。第1列-每个个体的非臭氧化Hb;2-Hb柱样品以15 μg/ml臭氧处理;35 μg/ml臭氧处理柱3-Hb样品;4-Hb柱样品以55 μg/ml臭氧处理。峰值直径以纳米为单位给出。强度模式值和强度百分比见表2
讨论
我们的研究结果主要强调个性化的臭氧浓度,任何个人想要进行基于一些分析技术的自体血液治疗。虽然糖尿病患者的血红蛋白没有表现出血红蛋白降解的主要迹象,如血红蛋白颜色或高铁血红蛋白形成的异常减少,这可以通过抗氧化剂的存在和注射器中臭氧与全血混合的方法来解释,但使用多种技术(特别是SDS-PAGE和DLS)的详细分析显示,形成了更高分子量的Hb物种或低聚物。我们的研究结果表明,基于280 nm的吸光度读数,臭氧能够通过改变其结构和暴露芳香残留物来影响Hb浓度。荧光分析表明,不同浓度的臭氧引起Hb样品中荧光团(主要是色氨酸)周围环境的变化和极化。CD分析包括远紫外(用于分析Hb样品的α螺旋峰强度),近紫外(用于检测Hb样品中芳香残基的变化)和紫外(用于显示Hb样品中血红素组的变化)都用于检测臭氧化后Hb的二级和三级结构变化。此外,UV-VIS分析显示,臭氧处理没有形成高铁血红蛋白,所有Hb样品都保持氧态。这些技术都提供了相当多的信息,然而,SDS-PAGE和DLS强调了臭氧对Hb的主要影响,并且似乎有效地提供了确定O中建议的安全和有效臭氧浓度的必要信息3.-AHT,因为这些技术清楚地表明是否形成了高分子量的物种或低聚物。这两种技术都显示了Hb的大小和寡聚化状态。
对于SDS-PAGE,在DTT存在的情况下,Hb降解和通过共价键形成各种吡咯产物和三聚体的概率[39],共价二酪氨酸交联形成低聚物[40]在没有DTT的情况下,可以观察到二硫键的形成,也许还可以观察到巨大的细胞外Hb的形成[38].
在非糖尿病个体A中,通过三种不同的凝胶(包括还原性和非还原性SDS-PAGE和Native-PAGE)分析,没有迹象表明低聚物的形成,样品与对照非臭氧化Hb样品几乎相同。非糖尿病个体A的DLS结果也显示,臭氧化Hb样品的直径大小与对照组相比没有明显变化。糖尿病患者B在臭氧浓度为15 μg/ml时,在臭氧浓度为55 μg/ml时,DTT存在时形成低聚物的概率最低。DLS结果也证实了这一点,臭氧浓度为55和15 μg/ml的Hb的直径分别为6.04和6.17 nm,仅略大于非臭氧浓度为5.98 nm的Hb的直径,但明显小于35 μg/ml臭氧浓度为6.66 nm的Hb的直径。
至于病人C,臭氧浓度似乎都不合适。这是因为即使该患者在35 μg/ml臭氧下臭氧化Hb的直径尺寸为10.8 nm,明显小于其他两种臭氧浓度(分别为11.5 nm和15.3 nm,分别为55 μg/ml和15 μg/ml),非臭氧化Hb对照样品的直径尺寸要小得多,为7.80 nm。此外,SDS-PAGE显示患者c在55 μg/ml臭氧浓度下发生了主要的低聚现象。在患者D中,无论是否存在DTT, 35 μg/ml臭氧浓度都降低了形成不良低聚Hb的可能性,并且与55 μg/ml臭氧浓度相比,该浓度下280 nm的吸光度较低。DLS也证实了这一点,35 μg/ml臭氧氧化的Hb直径尺寸为5.30 nm,小于未臭氧氧化的Hb直径尺寸为5.80 nm。在患者E中,在有DTT和没有DTT的凝胶中,在280 nm波长下测量,55 μg/ml的臭氧浓度显然是最合适的浓度,因为它在280 nm处的吸光度读数下降最大,并且减少了该患者非臭氧化Hb样品中已经存在的低聚物。DLS结果也支持这一观点,在55 μg/ml臭氧下氧化的Hb直径为6.41 nm,明显小于未臭氧处理的Hb直径为7.04 nm。
结论
根据本研究使用的技术,特别是SDS-PAGE和DLS的结果,可以得出结论,在非糖尿病个体A中,使用不同浓度的臭氧对Hb样品没有显著差异,并且使用所有浓度的臭氧都是安全的,即使是55 μg/ml。对于糖尿病患者B,最好使用15 μg/ml或55 μg/ml的臭氧。对于糖尿病患者C,不建议使用任何臭氧浓度。这是因为总体结果,特别是DLS结果表明,与未臭氧化的Hb相比,臭氧化Hb的直径尺寸增加了。臭氧化对这个病人来说是绝对危险的,因为它会导致低聚物的形成。另一方面,对于糖尿病患者D,建议使用35 μg/ml的臭氧。对于糖尿病患者E,强烈推荐55 μg/ml的臭氧化处理,因为它可以大大减少低聚物的存在,这些低聚物在臭氧化之前就存在,即在该患者的非臭氧化Hb样本中。
综上所述,可以建议使用SDS-PAGE和DLS来确定个性化臭氧浓度,从而在血液Hb分析的基础上进行安全有效的自体血液治疗。臭氧浓度应高度个性化的每个个体进行自体血液治疗,不应以任何方式普遍化。
数据和材料的可用性
数据和材料(如适用)可应要求提供。
缩写
- O3.出去:
-
autohemotherapy
- CD:
-
圆二色性
- 德勤:
-
二硫苏糖醇
- DLS:
-
动态光散射
- Hb:
-
血红蛋白
- ROS:
-
活性氧
- TAC:
-
总抗氧化能力
参考文献
张建军,张建军,张建军,等。糖尿病与慢性氧化应激的关系。基于臭氧疗法可能有用性的观点。糖尿病杂志,2011;5(1):45-9。
Baynes HW。糖尿病的分类、病理生理、诊断及治疗。中华糖尿病杂志,2015;6(5):1-9。
Knowler WC, Barrett-Connor E, Fowler SE, Hamman RF, Lachin JM, Walker EA,等。生活方式干预或二甲双胍降低2型糖尿病的发病率。中华医学杂志,2002;31(6):393 - 393。
Marathe PH,高红霞,Close KL.美国糖尿病协会糖尿病医疗护理标准2017。糖尿病杂志,2017;9(4):320-4。
张建军,张建军,张建军,等。臭氧治疗糖尿病足的疗效观察。中国药理学杂志,2005;23(1):51 - 61。
Rosen P, Nawroth PP, King G, Moller W, Tritschler HJ, Packer L.氧化应激在糖尿病及其并发症的发生和发展中的作用:联合国教科文组织- mcbn,美国糖尿病协会和德国糖尿病学会主办的系列会议综述。中华糖尿病杂志,2001;17(3):189-212。
猫王AM, Ekta JS。臭氧治疗:临床回顾。中华生物医学杂志,2011;2(1):66。
Bocci V, Borrelli E, Travagli V, Zanardi I.臭氧悖论:臭氧是一种强氧化剂,也是一种医疗药物。医学杂志,2009;29(4):646-82。
Leon OS, Menendez S, Merino N, Castillo R, Sam S, Perez L,等。臭氧氧化预处理:保护细胞免受自由基损伤。炎症介质。1998;7(4):289-94。
花茎甘蓝EJ。激效是毒理学、药理学和风险评估的核心。中华毒物学杂志,2010;29(4):249-61。
臭氧治疗的作用机制:是否通过轻度氧化应激诱导愈合?医学气体学报,2011;1(1):29。
张丽娟,张丽娟,张丽娟,等。臭氧治疗:对免疫调节、抗感染特性、抗癌潜力和抗氧化酶影响的重要生理和临床评价。分子物理学报,2015;5(03):37。
Bocci V, Aldinucci C, Mosci F, Carraro F, Valacchi G.人体血液臭氧化诱导血红素氧合酶-1和热应激蛋白-70的显著上调。《炎症介质》2007。https://doi.org/10.1155/2007/26785.
Candelario-Jalil E, MohammedAl-Dalain S, Fernandez OS, Menendez S, Perez-Davison G, Merino N等。氧化预处理对大鼠四氯化碳诱导的糖原消耗和氧化应激具有保护作用。中华病毒学杂志,2001;21(4):297 - 291。
Peralta C, Leon OS, Xaus C, Prats N, Jalil EC, Planell ES,等。臭氧处理对肝缺血再灌注损伤的保护作用:抗氧化-促氧化平衡。自由基学报。1999;31(3):191-6。
张建军,张建军,李建军,等。臭氧处理对肝缺血再灌注过程中活性氧和腺苷生成的影响。生物医学进展,2000;33(5):595-605。
臭氧真的总是有毒的吗?教条的终结。中国生物医学工程学报,2006;31(3):493 - 494。
Bocci V.氧臭氧疗法的案例。生物医学进展[J]; 2007; 31(1): 1 - 9。
刘建军,李建军,张建军,等。臭氧在医学中的应用:低剂量臭氧的概念、指南和治疗策略。臭氧科学与工程,2012,34(6):408-24。
张建军,张建军,张建军,等。臭氧在血管疾病治疗中的应用。心血管内科杂志,2011;11(2):73-82。
李建军,李建军,李建军,李建军。重组a1-微球蛋白与血红素结合的研究进展。物理学报,2014;5:465。
范辉,何华,范辉。自由基、抗氧化剂在疾病和健康中的作用。中华生物医学杂志,2008;4(2):89。
Rahbani-Nobar ME, Rahimi-Pour A, Rahbani-Nobar M, adi - beijing F, Mirhashemi SM。糖尿病患者的总抗氧化能力、超氧化物歧化酶和谷胱甘肽过氧化物酶。伊斯兰医学学报,1999;12(4):109-14。
陈建军,陈建军,陈建军,等。氧化还原分子在肿瘤预防中的作用。中华癌症杂志,2006;56(2):232-40。
Travagli V, Zanardi I, Bernini P, Nepi S, Tenori L, Bocci V.臭氧血液处理对人体血液代谢物谱的影响。中华毒物学杂志,2010;29(2):165-74。
Mehraban F, Seyedarabi A, Seraj Z, Ahmadian S, Poursasan N, Rayati S,等。在自体血液治疗中臭氧对人血红蛋白影响的分子见解:强调臭氧化过程中血液抗氧化剂存在的重要性。中华生物医学杂志,2018;19(2):444 - 444。
Travagli V, Zanardi I, Silvietti A, Bocci V.臭氧对血液影响的理化研究。中国生物医学工程学报,2009;31(5):544 - 544。
Bocci VA, Zanardi I, Travagli V.臭氧作用于人体血液产生辐照剂量-反应关系。中华检验医学杂志,2011;9(1):66。
一种新的医疗药物。荷兰:100英镑;2005.
黄鹏,刘伟,黄鹏,黄平。氧化还原对细胞存活的调控作用。抗氧化还原信号。2008;10(8):1343 - 1349。
穆尼奥斯G, De Juan a . ph和时间依赖的血红蛋白转变:过程建模的案例研究。生物化学学报;2007;35(1):398 - 398。
巴苏A,库马尔GS。有毒偶氮染料与血红蛋白的相互作用:食品添加剂苋菜与人血红蛋白结合方面的生物物理学见解。环境科学与技术,2015;29(1):1 - 4。
李东,张涛,季波。pH、尿素和金属离子对青藤碱与溶菌酶相互作用的影响。稳态荧光光谱研究。生物化学学报,2014;33(2):444 - 444。
李荣,李永强,李永强。氧结合对人血红蛋白中酪氨酸和色氨酸残基的影响:近紫外和远紫外圆二色性。中国生物医学工程学报,2009;32(1):1 - 4。
[3]李建平,李建平。臭氧对全牛血液的影响。生物医学工程学报,2005;39(3):527 - 533。
Sharma VK, Graham NJD。臭氧氧化氨基酸、多肽和蛋白质的研究进展。臭氧科学与工程,2010;32(2):81-90。
李志强,李志强。生物化学,1995。纽约:H Freeman & Co;1995.
Carvalho FAO, Carvalho JWP, Santiago PS, Tabak M. Glossoscolex paulistus (HbGp)巨胞外血红蛋白亚基的SDS-PAGE电泳和MALDI-TOF-MS进一步表征。生物化学学报,2011;46(11):2144-51。
Nagababu E, Rifkind JM。活性氧对血红素的降解。抗氧化还原信号。2004;6(6):967-78。
Kampf CJ, Liu F, Reinmuth-Selzle K, Berkemeier T, Meusel H, Shiraiwa M,等。暴露于臭氧后通过二酪氨酸形成的蛋白质交联和寡聚化。环境科学与技术,2015;49(18):10859-66。
致谢
我们非常感谢Moshtagh医生伤口中心的Maryam Fahimifar医生和伊朗德黑兰Neiayesh卫生综合中心伤口诊所的Mansoureh Farhadian医生帮助安排和收集了本研究中使用的五个人的血液样本。
资金
作者承担了研究的主要费用。我们也感谢伊朗国家科学基金会(INSF)的支持。
作者信息
作者及单位
贡献
FM:调查,形式分析,方法论,撰写原稿,安排样本收集。AS:概念化、调查、形式分析、方法、资金、项目管理、资源、监督、写作审查。SA:资金,写作审查。VM:臭氧机的主要资助者,生产商和供应商,安排样品收集。AAMM: Writing-review。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
本研究中5名受试者的血样采集已获得同意(伦理准则:IR.UT.SPORT.REC.1397.038)。
发表同意书
已同意发表。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
Mehraban, F., Seyedarabi, A., Ahmadian, S.。et al。通过血液血红蛋白分析确定1例非糖尿病患者和4例2型糖尿病患者自体血液治疗中臭氧的安全、适宜和有效浓度。J翻译医学17, 227(2019)。https://doi.org/10.1186/s12967-019-1973-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-019-1973-5
关键字
- Autohemotherapy
- 抗氧化剂
- 糖尿病
- 个性化臭氧治疗
- 全血血红蛋白