动脉瘤性蛛网膜下腔出血患者的长期预后。《柳叶刀神经病学》2011;10:349-56。
文章PubMed谷歌学者
Nieuwkamp DJ, Setz LE, Algra A,等。动脉瘤性蛛网膜下腔出血病死率随时间的变化,根据年龄、性别和地区:一项荟萃分析。《柳叶刀神经病学》2009;8:635-42。
文章PubMed谷歌学者
张志刚,张志刚,张志刚。中枢神经系统损伤所致免疫缺陷综合征的研究进展。神经科学。2005;6:775-86。
文章中科院PubMed谷歌学者
马志强,李志强,等。中风与免疫系统:从病理生理学到新的治疗策略。《医学杂志》2011;10:471-80。
文章中科院PubMed谷歌学者
Sarrafzadeh A, Schlenk F, Meisel A, Dreier J, Vajkoczy P, Meisel C.动脉瘤性蛛网膜下腔出血后免疫抑制。中风。2011;42:53-8。
文章PubMed谷歌学者
Hong CM, Tosun C, Kurland DB, Gerzanich V, Schreibman D, Simard JM。生物标记物作为蛛网膜下腔出血的预后预测指标——一项系统综述。生物标志物。2014;19:95 - 108。
文章中科院PubMed公共医学中心谷歌学者
Savarraj JPJ, Parsha K, Hergenroeder GW, Zhu L, Bajgur SS, Ahn S, Lee K, Chang T, Kim DH, Liu Y, Choi HA。蛛网膜下腔出血后外周炎症的系统模型。神经学。2017;88:1535-45。
文章中科院PubMed公共医学中心谷歌学者
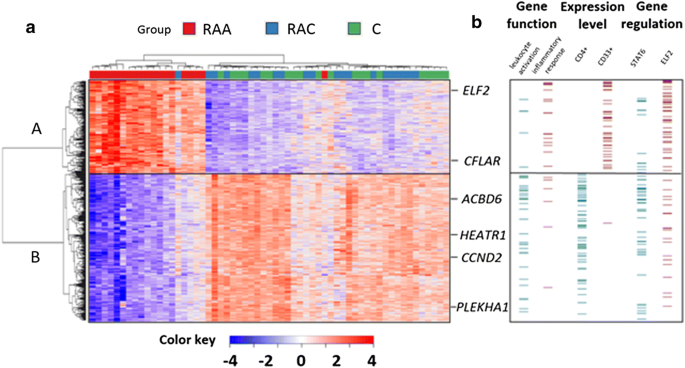
Pera J, Korostynski M, Golda S, Piechota M, Dzbek J, Krzyszkowski T, Dziedzic T, Moskala M, Przewlocki R, Szczudlik A, Slowik A.颅内破裂动脉瘤血液基因表达谱的生物标志物研究。中国脑血流杂志。2013;33:1025-31。
文章中科院PubMed公共医学中心谷歌学者
张娟,任强,宋勇,何梅,曾颖,刘志,徐娟。中性粒细胞-淋巴细胞比值在急性缺血性脑卒中患者预后中的作用。医学(巴尔的摩)。2017; 96: e8624。
文章谷歌学者
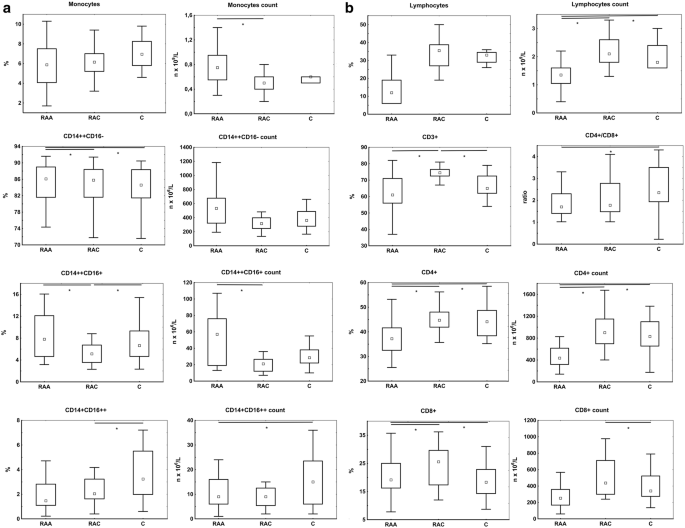
梁张高频,赵毫克,GB, CY, W,李ZQ、高x失调的CD4 (+) T细胞亚群在颅内动脉瘤。DNA细胞生物学,2016;35:96-103。
文章中科院PubMed谷歌学者
钟W,张Z,赵P,沈J,李X,王D,李G,苏W .最初的影响动脉瘤性蛛网膜下腔出血后全身炎症反应。土耳其神经外科,2017;27:346-52。
PubMed谷歌学者
Urra X, Cervera A, Obach V, Climent N, Planas AM, Chamorro A.单核细胞在急性卒中后的预后和感染风险中起主要作用。中风。2009;40:1262-8。
文章中科院PubMed谷歌学者
江东,李志刚,李志刚,李志刚,李志刚。缺血性脑卒中患者外周血单核细胞亚群的变化及其与临床进展的关系。PLoS ONE。2013; 8: e69409。
文章中科院PubMed公共医学中心谷歌学者
佩乔塔M,郭尔达S,菲切克J, Jantas D, Przewlocki R, Korostynski M.纹状体中抗抑郁药物反应的替代基因转录调控。神经药理学。2015;99:328-36。
文章中科院PubMed谷歌学者
Kuleshov MV, Jones MR, Rouillard AD, Fernandez NF, Duan Q, Wang Z, Koplev S, Jenkins SL, Jagodnik KM, Lachmann A, McDermott MG, Monteiro CD, Gundersen GW, Ma 'ayan A. enrichment:一个全面的基因集富集分析web服务器2016年更新。核酸研究。2016;2016(44):W90-7。
文章谷歌学者
范·霍夫FN,瑞格洛克YM,梅迪克J,桑贾比B,范德·弗利斯P,林克尔GJ,维尔丁克JH。动脉瘤性蛛网膜下腔出血患者的全血基因表达谱。PLoS ONE。2015; 10: e0139352。
文章谷歌学者
王志刚,王志刚,王志刚,王志刚。心肌梗死中单核细胞亚群的研究进展。国际心血管杂志。2017;231:47-53。
文章PubMed谷歌学者
杨天明,林玉杰,蔡新文,林伟文,何俊涛,张文文,郑崇林,孔廷涛,李浩天,黄昌昌,王兴辉,陆兴辉。连续白细胞黏附分子在动脉瘤后蛛网膜下腔出血中的预后价值。临床化学学报。2012;413:411-6。
文章中科院PubMed谷歌学者
Hoogeveen RM, Nahrendorf M, Riksen NP, Netea MG, de Winther MPJ, Lutgens E, Nordestgaard BG, Neidhart M, Stroes ESG, Catapano AL, Bekkering S.单核细胞和造血祖细胞重编程是慢性炎症和心血管疾病的常见机制。欧洲心脏J. 2018; 39:3521-7。
文章PubMed谷歌学者
Courties G, Herisson F, Sager HB, Heidt T, Ye Y, Wei Y, Sun Y, Severe N, Dutta P, Scharff J, Scadden DT, Weisskeder R, Swirski FK, Moskowitz MA, Nahrendorf M.缺血性中风激活造血骨髓干细胞。Circ res 2015; 116:407-17。
文章中科院PubMed谷歌学者
Patel AA, Zhang Y, Fullerton JN, Boelen L, Rongvaux A, Maini AA, Bigley V, Flavell RA, Gilroy DW, Asquith B, Macallan D, Yona S.稳态和全身炎症中人单核细胞亚群的命运和寿命。中华临床医学杂志2017;214:1913-23。
文章中科院PubMed公共医学中心谷歌学者
Urra X, Cervera A, Villamor N, Planas AM, Chamorro A.急性脑卒中患者淋巴细胞亚群的危害和益处。神经科学。2009;158:1174 - 83。
文章中科院PubMed谷歌学者
徐超,葛红,王涛,秦杰,刘,刘勇。CD14(+)单核细胞T细胞免疫球蛋白和粘蛋白结构域3表达升高与自发性脑出血患者全身炎症反应和脑损伤相关。中国脑卒中脑血管杂志2018;27:1226-36。
文章PubMed谷歌学者
Liesz A, Rüger H, Purrucker J, Zorn M, Dalpke A, Möhlenbruch M, Englert S, Nawroth PP, Veltkamp R.急性脑血管疾病患者应激介质与免疫功能障碍。PLoS ONE。2013; 8: e74839。
文章中科院PubMed公共医学中心谷歌学者
gied - jeppe A, Bobinger T, Gerner ST, madhar D, Sembill J, Lücking H, Kloska SP, Keil T, Kuramatsu JB, Huttner HB。淋巴细胞减少是自发性脑出血不良功能预后的独立预测因素。中风。2016;47:1239-46。
文章中科院PubMed谷歌学者
兰霞,韩霞,李强,杨秋文,王娟。脑出血后小胶质细胞激活和极化的调节因子。神经科学,2017;13:420-33。
文章中科院PubMed公共医学中心谷歌学者
Vacchio MS, Bosselut R.胸腺中发生的事情并不停留在胸腺中:T细胞如何循环CD4+ -CD8+谱系承诺转录电路来控制它们的功能。中华免疫杂志,2016;196:4848-56。
文章中科院PubMed公共医学中心谷歌学者
王春华,陈志明,谭志强,Léger C, Venegas A, Ryckborst K, Hill MD, Kubes P.脑卒中患者th2偏斜免疫的延长激活。Front Neurol. 2017;8:6。
文章PubMed公共医学中心谷歌学者
Dykstra-Aiello C, Jickling GC, Ander BP, Zhan X, Liu D, Hull H, Orantia M, Ho C, Stamova B.不同原因的脑出血和缺血性卒中在血液中具有不同的交替剪接mRNA谱:一项RNA-seq初步研究。Transl Stroke Res. 2015; 6:284-9。
文章中科院PubMed公共医学中心谷歌学者
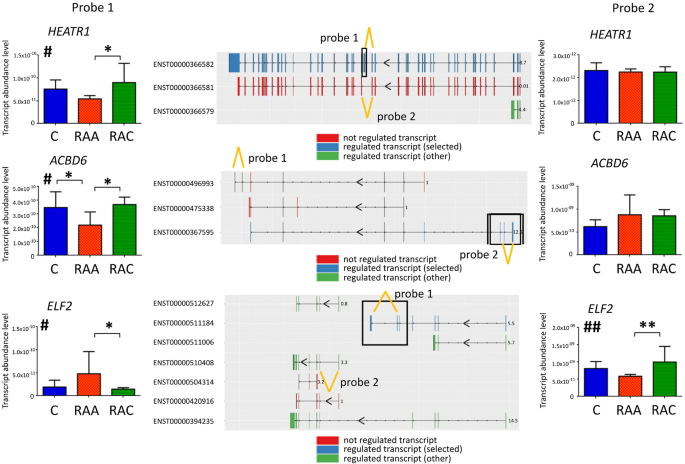
管芳华,Bailey CG, Metierre C, O 'Young P,高D, Khoo TL, Holst J, Rasko JE。抗增殖的ELF2亚型,ELF2B,在体外诱导细胞凋亡,在体内干扰早期淋巴细胞发育。中华血液学杂志。2017;10:75。
文章PubMed公共医学中心谷歌学者
Soupene, Serikov V, kypers FA。酰基辅酶的特征一种主要在人类原始祖细胞中表达的结合蛋白。《油脂杂志》2008;49:1103-12。
文章中科院PubMed公共医学中心谷歌学者
Soupene, Kuypers FA。配体与ACBD6蛋白结合调节膜中的酰基辅酶a转移酶反应。中国医学杂志,2015;
文章中科院PubMed公共医学中心谷歌学者
吴志斌,邱超,张爱林,蔡林,林世杰,姚勇,唐启勤,徐敏,华伟,褚耀文,毛勇,朱建华,徐娟,周立龙。胶质瘤相关抗原HEATR1诱导胶质瘤患者功能性细胞毒性T淋巴细胞。中华免疫杂志2014;2014:131494。
PubMed公共医学中心谷歌学者
Turi Z, Senkyrikova M, Mistrik M, Bartek J, Moudry P.通过烧蚀heat1干扰RNA聚合酶I转录机制触发RPL5/RPL11-MDM2-p53核糖体生物发生应激检查点通路细胞周期。2018;17:92-101。
文章中科院PubMed谷歌学者
Kataoka K,经营着Y, Kitanaka Shiraishi Y, Shimamura T, Yasunaga J, Totoki Y,千叶K, Sato-Otsubo,卡G, Ishii R, Muto年代,Kotani年代,Watatani Y,武田J, Sanada M,田中H,铃木H,佐藤Y, Y Shiozawa Yoshizato T,吉田K, Makishima H, Iwanaga M,马G, Nosaka K, Hishizawa M, Itonaga H, Imaizumi Y,宗像W,小笠原H,佐藤T, Sasai K, K村,Penova M,川口T,中村H,哈马N,大连实德K, Kubuki Y, Hidaka T, Kameda T, Nakamaki T,西山贵子K, Miyawaki年代,Yoon党卫军,Toninai K, Miyazaki Y, Takaori-Kondo A, Matsuda F, Takeuchi K, Nureki O, Aburatani H, Watanabe T, Shibata T, Matsuoka M, Miyano S, Shimoda K, Ogawa S.成人T细胞白血病/淋巴瘤的整合分子分析。Nat Genet. 2015; 47:1304-15。
文章中科院PubMed谷歌学者
brit VH, Arumugam TV, Drummond GR, Sobey CG。T淋巴细胞在脑损伤、免疫缺陷和脑缺血后恢复中的重要性。中国脑血流学杂志,2012;32:598-611。
文章中科院PubMed公共医学中心谷歌学者
刘强,金文文,刘勇,史凯,孙华,张峰,张超,Gonzakes RJ, Sheth KN, La Cava A,史fd。脑缺血可通过不同的神经源性神经抑制外周和脑内的免疫功能。免疫力。2017;46:474 - 87。
文章中科院PubMed谷歌学者
石凯,木K,石fd,王霞,刘强。脑卒中诱导免疫抑制与脑卒中后感染。中风血管神经。2018;3:34-41。
文章PubMed公共医学中心谷歌学者