摘要
背景
在过去的几年里,下一代测序(NGS)已经变得可靠和具有成本效益,并在临床实践中的应用已成为现实。NGS的一个相关作用是预测转移性结直肠癌(mCRC)对抗egfr药物的反应,其中来自KRAS、NRAS和BRAF的多个外显子必须同时测序。
方法
我们优化了14个扩增子NGS小组,在219例mCRC患者的连续队列中评估KRAS、NRAS、BRAF和PIK3CA基因突变的存在及其临床-病理关联,这些突变来自于在诊断时为诊断和研究而收集的福尔马林固定、石蜡包封标本。
结果
我们观察到RAS突变与性别、年轻年龄和肿瘤部位有统计学意义的相关性。我们证明RAS/RAF通路的伴随突变在mCRC中并不少见,并且正如全基因组研究所预期的那样,RAS和PIK3CA倾向于同时突变。我们证实了右侧mCRC肿瘤中BRAF突变与微卫星不稳定性的相关性。我们将肿瘤侧作为独立于突变状态的预后参数。
结论
据我们所知,这是第一个由NGS在现实环境中测试KRAS、NRAS、BRAF和PIK3CA的单中心、连续积累的临床mCRC癌症队列。我们的研究在临床实践中突出了RAS/RAF通路突变的伴随性、单基因中存在多个突变、RAS和PIK3CA突变的共同发生、肿瘤侧的预后价值以及性别与特定突变的可能关联等发现。
背景
近年来,由于引入了新的治疗方法,如针对特定分子靶点设计的单克隆抗体(moAbs),转移性结直肠癌(mCRC)的治疗取得了重大进展[1].两种靶向表皮生长因子受体(EGFR)的moAbs,西妥昔单抗和帕尼单抗,已经在以特定分子畸变为特征的mCRC患者亚组中证明了它们的疗效。然而,只有一小部分患者(10%至20%)对抗egfr moAb单药治疗产生反应[2].这种低应答率可以部分解释为激活EGFR下游信号通路中的突变,如RAS/RAF通路[3.].原发性抗egfr耐药因子首次在KRAS外显子2编码基因突变的患者中观察到[4].其他主要抗egfr耐药因子已被描述,包括KRAS(外显子3,4处)和NRAS(外显子2,3和4处)的额外突变[5].同样,BRAF基因突变被描述为预后标志物,在一些研究中,BRAF基因突变被描述为抗egfr moAb耐药的预测因素[6].此外,外显子20中的PIK3CA突变与野生型KRAS患者抗egfr治疗的耐药性有关[7].然而,由于PIK3CA的突变通常与KRAS的突变相关,因此PIK3CA作为抗egfr应答的独立预测标志物的作用还有待证实。
下一代测序(NGS)可以同时分析多个基因,成本更低,人员时间更短,比传统的毛细管测序方法灵敏度更高。NGS已用于回顾性评估mCRC患者抗egfr治疗的反应[8].在这项研究中,我们使用定制设计的14个扩增子NGS组来评估219例连续mCRC患者的单中心队列中KRAS、NRAS、BRAF和PIK3CA基因突变的存在。我们还研究了这些突变的临床病理意义及其对我们队列患者的预后影响。
方法
NGS面板设计和测序
已知与mCRC相关的KRAS、NRAS、BRAF和PIK3CA中的体细胞热点从COSMIC v69中获得,并用作Ion AmpliSeq Designer™在线工具的输入。总体而言,在分别使用已知KRAS突变型和野生型的两个mCRC样本进行滴定实验后,设计并使用了14个涵盖1556个基因组DNA碱基对的多重引物对。在上述基因中已知突变的100个预先存储的连续样本,之前通过毛细管测序作为常规诊断的一部分进行了评估,通过NGS在Ion Torrent™314™芯片上重新测序,使用AmpliSeq™条形码试剂盒平均每个芯片复用8个样本。连续采集了119份样品,用NGS进行分析。当测序深度大于1000×时,我们的平台对等位基因突变分数大于5%的FFPE样品的敏感性和特异性均大于99%。
分析与统计
使用的分析管道如下:简单地说,在戴尔工作站上使用Ion Torrent™3.4校准和调用管道分析运行,使用hg19作为参考基因组。为了增加结果的特异性,根据制造商的说明,我们将分析限制在COSMIC v69定义的目标和热点区域,并由Ion AmpliSeq Designer™工具作为输出提供(可向相应作者请求的文件)。当发现的突变在COSMIC识别的已知热点之外时,其有效存在和危害性可以通过使用IGV对堆的人工检查来确认,并根据SIFT、PolyPhen2和MutationAssessor的大多数共识进行功能预测[9,10,11].下游统计分析的突变变量是使用R包中实现的一个完善的惩罚最大似然回归模型选择的glmnet[12].为了比较突变变量和临床变量,我们采用Firth方法校正的多元逻辑回归,在适当时调整分期、年龄、解剖部位和性别。类别变量之间的两两关联采用Fisher精确检验进行评估,而连续变量在两个或两个以上组之间的差异分别采用Wilcoxon或Kruskal-Wallis检验进行评估。
在生存分析中,我们将转移性患者开始一线化疗后的无进展生存期作为主要终点。使用包survcomp生成的Kaplan-Meier估计器绘制生存曲线[13], p值采用log-rank检验计算。对于包含多个变量的生存分析,从上述所有临床和病理变量开始,采用逐步向后向前的Cox比例风险回归模型,直到实现Akaike信息标准的最小化(包MASS) [14].
多重对应分析(MCA)使用FactoMineR (http://factominer.free.fr/contact/index.html),按描述对变量进行分类,结果用ggplot2[表示13].图中的互斥性和棒棒糖图。4使用在线工具OncoPrinter和MutationMapper生成[15,16].所有统计分析均在R环境中进行统计计算[17].
利用数字PCR定量罕见体细胞癌突变
我们使用数字PCR (dPCR)检测了在KRAS (G12S, g12v, G12I, G12C, G12F, G12D, G15S, G13C), NRAS (G13S), BRAF (S467L), PIK3CA (G1050S)中发现的共发生体细胞突变。目标的选择是基于我们的突变共发生的流行度以及预先验证的TaqMan的商业可用性®SNP基因分型分析。这些是包含dPCR引物和野生型和突变等位基因探针的单管分析。我们为每个样品制备了两次技术重复(2个芯片)的反应混合物:4 μL DNA (20 ng/µL)和11.7 μL无核酸酶水,17.4 μL QuantStudio™3D Digital PCR Master mix, 1.7 μL Custom TaqMan®SNP基因分型分析(20×)。将dPCR反应加载到QuantStudio™3D数字PCR芯片v2上,使用ProFlex 2× Flat PCR系统进行PCR,程序在附加文件中概述1:表S1。我们使用QuantStudio™3D数字PCR仪和QuantStudio分析芯片®3D分析套件™软件。
结果
病人
在超过24个月的时间里,来自结直肠癌(CRC)患者的264个标本被带到我们的实验室进行KRAS、NRAS和BRAF鉴定(见附加文件)1:图S1)。根据方案,目前的研究也评估了PIK3CA热点区域,但当发生潜在病理意义的突变时,没有报告给负责患者的肿瘤学家。在全部来自原发肿瘤的264个样本中,45个未进行评估,因为没有进行RAS检测的指征(非转移性患者)。然后对219例患者的样本进行NGS分析。虽然我们有13例因材料质量差而需要重新提取肿瘤DNA,有10例因文库制备管道实验失败而需要两次生成扩增子文库,但没有样本NGS检测不合格。
患者特征在附加文件中报告1:表S2。中位年龄为70岁(四分位数范围为61-76),分析队列中52%的患者为男性,69%具有可用分期数据的肿瘤(n = 156)与左结肠有关,大多数患者在首次诊断时表现为较大(T3或更大)的淋巴结阳性肿瘤。113例患者进行免疫组化微卫星染色,9例患者(占评估病例的8%)MLH1(8例)、MSH6(1例)、MSH2(无患者)缺失。这些人口统计学和解剖病理学特征根据性别很好地平衡了,并且符合我们地区诊断的mCRC患者的流行病学特征。相对较高的中位数年龄确实与我们医院的患者相一致,我们医院位于欧洲人口最老的地区。整个人群中有101例患者的结局数据。
临床NGS中临床相关突变的无偏倚检测
在分析的219个评估样本中,143个(65%)在四个测序基因中的任何一个中至少出现了一个有害突变。单基因突变患者为109例;有两个突变,31;3个突变,3个。在76例(35%)肿瘤中,KRAS、NRAS、BRAF和PIK3CA基因(四重突变阴性患者)均未检测到突变。
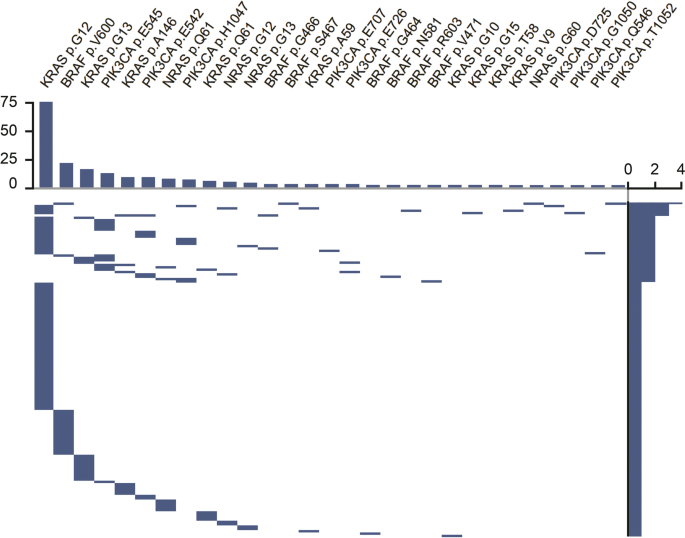
我们鉴定出104个(47%)KRAS突变肿瘤,其中一个肿瘤具有3个KRAS p.G12C、p.G12V和pG13C突变,6个肿瘤具有2个KRAS突变p.G12V和p.G15S;pG12S和p.G12V;p.G12D及p.V9F;p.G12S及p.A59E;p.G12D及p.T58I;p.G12C和p.G13D。92例(42%)外显子2,7例(3.2%)外显子3,8例(3.6%)外显子4。p.G12D、p.G12V和p.G13D是我们的结直肠癌队列中最常见的KRAS突变(见图)。1).19例(8%)肿瘤观察到位于外显子2外的突变。
15个肿瘤(7%)存在NRAS突变。7个(3%)突变位于外显子2,8个(4%)突变位于外显子3。外显子4未发现突变。我们在密码子12中发现了4个NRAS突变p.G12C、p.G12D、p.G12V,在密码子13中发现3个突变p.G13D、p.G13R、p.G12S,在密码子61中发现7个突变p.Q61 K、p.Q61R,在密码子60中发现1个突变p.G60E。
28个肿瘤(13%)有BRAF突变,其中一个肿瘤有两个BRAF突变p.S467L和p.V600M。23个(10%)突变位于外显子15,6个(2.7%)突变位于外显子11。p.V600E是BRAF最常见的突变,因为它在20个肿瘤中被发现(9%)。一个肿瘤含有不寻常的p.V600M突变,具有有害作用。8例肿瘤(3.6%)存在非v600突变。
33个肿瘤(15%)有PIK3CA突变,其中一个肿瘤有两个PIK3CA突变p.D725 N和p.H1047Y。外显子9有20个突变(9%),外显子20有8个突变(3.6%),外显子13有6个突变(2.7%)。3个密码子(p.E542、p.E545和p.H1047)占33个PIK3CA突变的26个(78%)。只有3例(1.3%)肿瘤的特征是单一的PIK3CA突变,而评估的基因中没有任何伴随的改变。
基因改变和生物学特征之间的联系
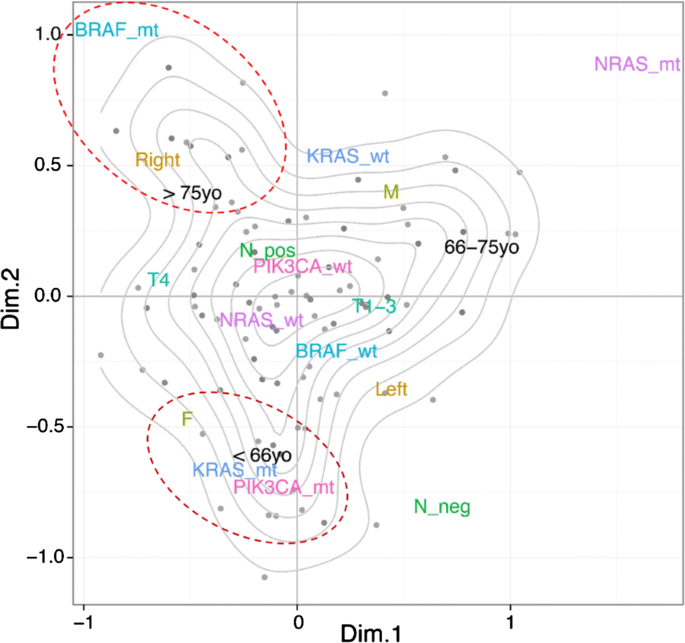
68个(31%)肿瘤位于右结肠,151个(69%)肿瘤位于左结肠。13例右侧结肠直肠癌观察到四组突变阴性肿瘤,而49例左侧结肠直肠癌观察到四组突变阴性肿瘤(19 vs 41%, p = 0.001)。右侧结直肠癌的BRAF突变发生率显著较高(附加文件)1:表S3, 8% vs 5%, p = 0.0001)。尽管219例患者中有113例可进行MSI染色,但我们发现7例患者(6%)存在BRAF突变和MSI状态。BRAF突变的肿瘤更常与微卫星不稳定性相关(6% vs. 2%, p = 0.0009)。KRAS突变在女性中比男性更频繁(26%比22%,p = 0.0460), BRAF突变也是如此(8%比5%,p = 0.0269)。为了不偏不倚地探讨RAS/RAF通路与结直肠癌分期、肿瘤部位、淋巴结状态、性别、年龄等临床和病理变量之间的关系,我们采用多重对应分析(multiple correspondence analysis, MCA)。MCA是一种类似于主成分分析的多元统计方法,但适用于分类数据;因此,我们将感兴趣的变量减少到两个维度,这解释了在我们的数据集中观察到的方差的最大比例。临床和病理变量与KRAS、NRAS、BRAF和PIK3CA状态一起作为向量投影在这两个维度所定义的空间中(见图。2).变量类别在这个二维空间中的位置反映了它们的相互关联,对数据的底层结构没有先验假设。我们观察到具有BRAF突变的肿瘤在“高龄”和“右结肠侧”附近下降。相反,RAS突变与PIK3CA突变、“年轻”和“女性”聚集在一起。综上所述,通过MCA分析和经典的统计学检验,我们可以观察到两组患者特异性突变和临床病理特征丰富(第1组为“BRAF突变”、“右侧”、“老年”,第2组为“RAS突变”、“PIK3CA突变”、“年轻”、“女性”)。
临床实践NGS揭示的互斥基因突变共存
我们发现34例肿瘤(15%)伴有KRAS、NRAS、BRAF和PIK3CA基因突变。31例肿瘤伴发两种基因突变;3个肿瘤同时存在3个基因突变,其中1个肿瘤同时存在BRAF、NRAS和PIK3CA突变,2个肿瘤同时存在BRAF、KRAS和PIK3CA突变。在33个pik3ca突变的肿瘤中有23个(63%),15个nras突变的肿瘤中有2个(13%),29个BRAF突变的肿瘤中有4个(13%)。与KRAS(26%)或BRAF(28%)突变的肿瘤相比,PIK3CA突变的肿瘤伴随突变的发生率明显更高(90%)。KRAS和PIK3CA倾向于同时突变,具有统计学和生物学意义(OR = 2.97, 95% CI 1.27-7.40,pvalue = 0.0076,见表1).
在伴有PIK3CA外显子9突变的21个肿瘤中有18个(85%)和伴有PIK3CA外显子20突变的8个(100%)肿瘤中检测到伴有KRAS、BRAF或NRAS突变。此外,我们发现在同一基因中存在多个突变的肿瘤,包括6个具有2个KRAS突变的肿瘤,1个具有3个KRAS突变的肿瘤,以及1个具有2个BRAF突变的肿瘤。其中,两个肿瘤在同一密码子中有两个KRAS突变。这种由不同等位基因频率突出显示的同一基因多个突变的组合见表2.
生存分析
我们收集了101例患者的无进展生存期(PFS)和化疗类型的临床数据。其中75人接受了一线化疗。特别是,24例患者接受了基于氟尿嘧啶的化疗和抗egfr moAb(西妥昔单抗或帕尼单抗)的联合治疗,26例患者接受了类似的抗vegf moAb(贝伐珠单抗)的主干化疗方案,25例患者接受了仅化疗的一线治疗(单药卡培他滨或氟尿嘧啶或联合伊立替康或奥沙利铂)。肿瘤侧(直肠、乙状结肠和后代简化为左侧;67例患者有上行或横切右侧。63例患者获得了肿瘤侧、突变状态和化疗类型的信息。
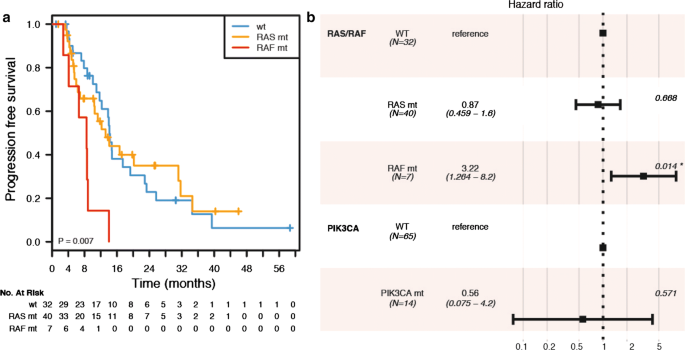
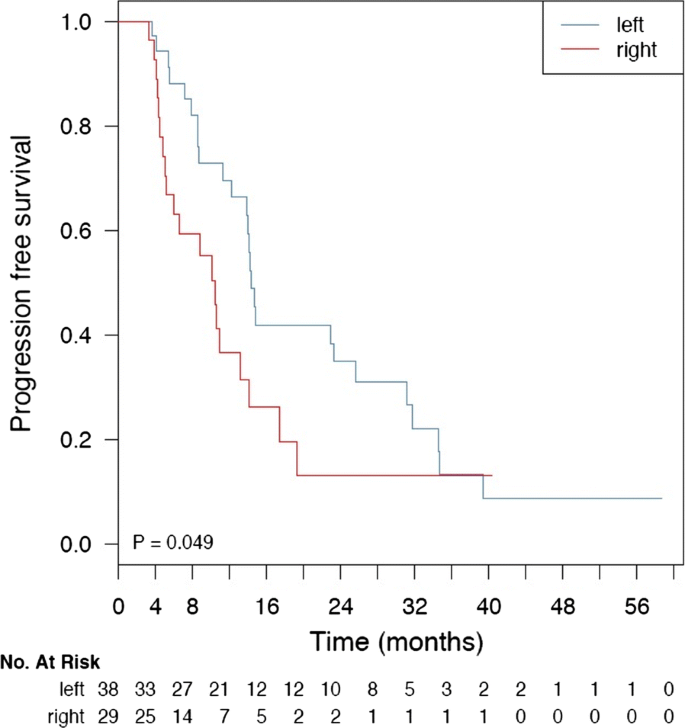
通过单因素分析,braf突变患者(N = 7)与KRAS/NRAS突变患者(N = 40,危险比- HR = 3.58, 95%置信区间- CI 1.48-8.66)和野生型患者(N = 32, HR = 3.44, 95% CI 1.42-8.30) (p值= 0.0073,对数检验,双侧)相比,PFS更短,见图。3.a.考虑到PIK3CA状态(调整后HR = 3.22, 95% CI 1.26-8.20, Cox比例风险回归p值= 0.0142)以及PIK3CA状态与KRAS/NRAS或BRAF状态的相互作用(相互作用p值分别为0.4620和0.5870),多变量分析保守了BRAF突变相关的较差预后,见图。3.b.由于大多数PIK3CA突变与KRAS/NRAS/BRAF突变同时发生(25% vs. 6%),我们评估了PIK3CA状态是否可以将突变患者亚组(N = 47)划分为不同的预后组,但该分析结果不显著(p值= 0.5686,logrank检验,双侧)。由于所有PIK3CA外显子20突变都与RAS突变同时发生,我们无法对PIK3CA外显子9和20突变进行分层分析。最后,我们的目的是评估肿瘤侧在单独考虑或与BRAF状态、一线化疗类型以及这两个变量的相互作用一起进行多变量分析时是否具有预后意义。的确,通过单因素统计评估(p值= 0.0494,对数检验,双侧),右侧与PFS较差相关,见图。4.我们的Cox比例风险模型对于超过4-5个自由度的分析是不足的,有44个事件和9个自由度。因此,我们的结果只是探索性的。然而,值得注意的是,肿瘤侧是唯一与PFS独立相关的变量,其影响方向与单变量log-rank检验一致。由于功率大小的限制,我们不报告有关这一最新分析的正式结果。
讨论
在这项现实世界的研究中,我们在临床实践中使用NGS对219例转移性结直肠癌进行了回顾性分析。我们探讨了涉及包括结直肠癌在内的不同实体肿瘤主要通路的KRAS、NRAS、BRAF和PIK3CA基因突变状态相关的临床病理变量的相关性。由于NGS的高分析灵敏度,我们能够评估伴随存在的低频像差,而低频像差只能通过非标准和通常繁琐的方法进行评估[18].
在我们的队列中,47%的患者有KRAS突变(外显子2为42%,外显子3和4为7%)。7%的患者有NRAS突变(外显子2为3%,外显子3为4%)。13%的患者有BRAF突变,9%的患者有BRAF V600E突变。这些百分比与以往临床研究中描述的百分比没有差异[19].
BRAF V600E的负面预后作用是已知的,然而其对抗egfr治疗反应的预测价值更有争议,部分原因是在临床试验中描述了少量具有这种突变的患者[6,20.,21].最近,SWOG S1406试验的结果表明,BRAF V600E对vemurafenib的反应具有预测价值[22].
相反,密码子600外BRAF突变的患者可能会有不同的结果。与需要积极治疗的V600 BRAF突变患者相比[23],非v600 BRAF突变的患者似乎预后良好[24].因此,识别非v600 BRAF突变可以更好地对具有不同治疗需求的mCRC患者进行分层。在我们的队列中,我们发现8例(3.5%)肿瘤携带非v600 BRAF突变。考虑到CRC的流行病学,这是一个不可忽视的患者比例,在抗egfr moAbs上市后的时代,常规NGS的临床表征似乎是一个明智的目标。
同时发生RAS和BRAF突变被认为是罕见的。事实上,文献数据显示此类事件的发生率非常低[25].然而,这些流行病学数据主要依赖于毛细管测序结果(低敏感性)或基础转译研究中相对低覆盖率的肿瘤外显子组测序。在本研究中,我们发现4例患者(1.8%)伴有RAS和BRAF改变。有趣的是,所有四名患者都存在非v600e突变,这可能表明这种资助缺乏功能相关性,或者更有趣的是,KRAS/非v600e BRAF共突变肿瘤的潜在特殊生物学。
据其他作者报道[25], PIK3CA倾向于与我们研究的其他基因同时突变。最常见的关联是KRAS(在我们的队列患者中占10%)。
根据解剖部位的突变分布与前人工作一致[26].詹森等人。[27]描述BRAF突变在右结肠中更为频繁。同样,KRAS的突变往往更频繁地出现在这样的解剖区域,尽管这种关联在统计学上不如与BRAF的关联那么强。此外,微卫星的不稳定性与BRAF突变密切相关,这是由BRAF基因序列驱动的一种公认的生物学现象[28].
mCRC基因突变与性别的相关性尚不确定。在目前的工作中,我们发现BRAF和KRAS的突变更频繁地与女性相关。虽然我们不能完全排除导致这种发现的选择偏差,但我们无法找到任何明显的解释来解释这种相关性。如果在未来更大规模的流行病学研究中得到证实,结直肠癌中特定突变与性别的关系将具有潜在的生物学意义。
通过多变量非先验方法,我们确定了两种不同的临床突变特征。前者在BRAF突变、右半结肠癌和高龄患者中富集,与先前的研究结果一致[29,30.].第二组在年轻女性中出现KRAS和PIK3CA突变。正如所强调的,这种关联在文献中没有明确报道,因此有必要进一步分析来证实它并确定其潜在的意义。
据我们所知,只有少数著作详细研究了单个基因中多重突变的伴随存在[31].在这里,我们描述了我们队列中由这一特殊特征定义的几个病例。尽管与大型多面板NGS研究相比,我们评估的基因更少[32,33],目前工作的力量在于它的真实的文字性质:据我们所知,这是第一个这样的性质的报告。
因此,我们可以确定8名患者(3.5%)在单个基因中有一个以上的突变,这并不令人意外。这些多重和伴随突变的存在,其中一些等位基因频率较低,反映了肿瘤内可能存在亚克隆群体,作为肿瘤内异质性的一种表达[34].目前,尚不清楚肿瘤特性是否会导致更具侵袭性的表型[35,36].此外,早期鉴定这些亚克隆种群是否会影响治疗策略是一个积极争论的问题[37].
我们研究的一个主要价值是评估RAS、PIK3CA和BRAF肿瘤突变状态与转移性患者临床化疗反应之间的关系。通过单因素和多因素分析,BRAF突变是无进展生存不良(PFS)的预后因素,并对PIK3CA状态与KRAS/NRAS或BRAF状态的相互作用进行了调整。PIK3CA状态本身并不能对不同预后组的突变患者亚组进行分层,如以前的工作所报道的[38].PIK3CA突变与RAS畸变共存可能是PIK3CA突变在mCRC中的独立预后和预测作用仍不确定的原因之一[39].事实上,我们无法证明共同突变的KRAS/PIK3CA病例与仅突变的KRAS病例相比具有不同的临床后果。
在接受一线治疗的野生型或ras突变患者中,我们没有观察到PFS的显著差异,可能是由于纳入分析的患者数量较少。然而,我们能够确定肿瘤侧的阴性预后价值,与BRAF状态和一线化疗类型无关。事实上,正如其他同事最近报道的那样,肿瘤侧似乎是唯一独立与PFS相关的变量[40].
由于加隆等人的景观作品。[41],其中首次描述了基于CRC淋巴细胞浸润的具有预后价值的免疫评分,对癌症免疫知识的不断增长已经改变了肿瘤治疗。随着新型免疫作用药物的引入,这种现象在肺癌和黑素瘤中尤为明显[42,43].目前,免疫治疗在CRC中仅表现出适度的疗效,但在微卫星不稳定肿瘤中可能存在例外[44].这种适度的有效性部分与基于分子亚型的CRC的极端异质性有关,但不能完全用它们来解释。例如,有报道称KRAS突变与CRC中Th1/细胞毒性免疫抑制有关[45],而另一项研究表明,RAS/RAF或PI3KCA通路突变与肿瘤白细胞分数的不同表达相关[46].因此,我们建议在未来的研究中,结合免疫相关参数研究CRC驱动基因的体细胞突变,以获得更精确的患者免疫生物学分层。
我们意识到我们研究的局限性。例如,我们只有一半的患者存在肿瘤微卫星不稳定状态,这可能导致我们在mCRC中描述的MSI频率低于其他研究。此外,由于缺乏一半患者的结果数据,生存分析的统计能力有限。尽管如此,我们相信目前工作的主要优势在于其现实世界的性质和我们面板设计的固有简单性。因此,我们能够传达真正适用于普通人群的生物学和临床发现,并对临床实践产生相关影响。此外,我们的NGS小组是针对癌症类型的,适合临床环境,根据送到我们中心的CRC标本的特征和特定突变的科学证据,需要最大化诊断和预测分析的成本/效用比。当然,NGS靶板的试剂成本和分析周转时间是将NGS扩展到多癌分析的简单理由。然而,我们个人的感觉是,在临床试验和癌症景观美化工作之外,这种扩展的面板可能具有重要的用途,在某些情况下甚至可能导致潜在的有害影响(例如,在临床解释和随后使用新确定的改变方面的困难)。需要实施更广泛、多中心、更标准化的方法,以适当评估大型、多癌症NGS小组的有效医疗效用。
结论
我们目前的研究强烈支持NGS在临床实践背景下诊断mCRC突变的常规应用。与市售的非NGS试剂盒相比,NGS确实可以更准确地对受益于抗egfr治疗的患者进行分层。同样,我们在临床实践中提供了证据,表明在原始结直肠肿瘤中存在异质性但已经抗egfr耐药克隆的低频亚克隆,这对靶向治疗计划和未来临床试验的设计具有重要意义。
缩写
- 房颤:
-
等位基因频率
- 儿童权利公约:
-
结肠直肠癌
- 表皮生长因子受体:
-
表皮生长因子受体
- dPCR:
-
数字聚合酶链反应
- FFPE:
-
formalin-fixed石蜡包埋
- MCA:
-
多重对应分析
- mCRC:
-
转移性结直肠癌
- 摩押人:
-
单克隆抗体
- 门店:
-
新一代测序
- PFS:
-
无进展生存
- VEGF:
-
血管内皮生长因子
参考文献
Ballestrero A, Garuti A, Cirmena G, Rocco I, Palermo C, Nencioni A,等。针对晚期结直肠癌患者的抗egfr单克隆抗体治疗:KRAS及其他。癌症药物靶点。2012;12(4):316-28。
Karapetis CS, Khambata-Ford S, Jonker DJ, O 'Callaghan CJ, Tu D, Tebbutt NC,等。K-ras突变和西妥昔单抗治疗晚期结直肠癌的益处中华实用医学杂志,2008;29(4):344 - 344。
Zoppoli G, Moran E, Soncini D, Cea M, Garuti A, Rocco I,等。ras诱导的拉帕替尼耐药性可通过MEK抑制来克服。当代癌症药物靶点。2010;10(2):168-75。
范凯森,张建军,张志强,等。西妥昔单抗和化疗作为转移性结直肠癌的初始治疗。中华实用医学杂志,2009;36(4):344 - 344。
Sorich MJ, Wiese MD, Rowland A, Kichenadasse G, McKinnon RA, Karapetis CS。扩展RAS突变和抗egfr单克隆抗体在转移性结直肠癌中的生存益处:一项随机对照试验的荟萃分析南京大学学报:自然科学版,2015;26(1):13-21。
Pietrantonio F, Petrelli F, Coinu A, Di Bartolomeo M, Borgonovo K, Maggi C,等。BRAF突变在接受西妥昔单抗和帕尼单抗的晚期结直肠癌患者中的预测作用:一项荟萃分析。中华肿瘤学杂志,2015;26(5):588 - 588。
Sartore-Bianchi A, Martini M, Molinari F, Veronese S, Nichelatti M, Artale S,等。结直肠癌中PIK3CA突变与egfr靶向单克隆抗体的临床耐药相关。癌症杂志2009;69(5):1851-7。
Ciardiello F, Normanno N, Maiello E, Martinelli E, Troiani T, Pisconti S,等。FOLFIRI和西妥昔单抗根据下一代测序扩展基因突变状态的临床活性:来自CAPRI-GOIM试验的发现中国科学,2014;25(9):1756-61。
库马尔P, Henikoff S, Ng PC。使用SIFT算法预测编码非同义变体对蛋白质功能的影响。网络学报。2009;4(7):1073-81。
Adzhubei I, Jordan DM, Sunyaev SR.利用polyphen2预测人类错义突变的功能效应。Curr Protocols Hum Genet, 2013;第7章20。
Reva B, Antipin Y, Sander C.预测蛋白质突变的功能影响:应用于癌症基因组学。中国生物工程学报,2011;39(17):e118。
傅瑞敏,李志强,李志强,等。广义线性模型的正则化路径。统计软件,2010;33(1):1 - 22。
Schroder MS, Culhane AC, Quackenbush J, Haibe-Kains B. survcomp:用于生存模型性能评估和比较的R/Bioconductor包。生物信息学。2011;27(22):3206 - 8。
维纳布尔斯WN,雷普利BD.现代应用统计学与S. 4版。纽约:施普林格;2002.p。495。
高娟,王志强,王志强,王志强,等。使用cBioPortal对复杂癌症基因组学和临床资料进行综合分析。科学通报,2013;6(6):1。
张志强,张志强,张志强,张志强,等。cBio癌症基因组学门户:探索多维癌症基因组学数据的开放平台。癌症杂志,2012;2(5):401-4。
R核心团队。R:一种统计计算的语言和环境。R统计计算基金会,维也纳,奥地利;2014.
Dono M, Massucco C, Chiara S, Sonaglio C, Mora M, Truini A,等。锁锁核酸聚合酶链反应显示低百分比的KRAS突变:对转移性结直肠癌治疗的意义。《Mol medical》2013;18:1519-26。
杜亚德,李志强,李志强,等。Panitumumab-FOLFOX4治疗与结直肠癌RAS基因突变。中华实用医学杂志,2013;29(4):344 - 344。
Rowland A, Dias MM, Wiese MD, Kichenadasse G, McKinnon RA, Karapetis CS,等。BRAF突变作为RAS野生型转移性结直肠癌抗egfr单克隆抗体治疗获益的预测生物标志物的meta分析中华肿瘤学杂志,2015;29(4):344 - 344。
Van Cutsem E, Cervantes A, Adam R, Sobrero A, Van Krieken JH, Aderka D,等。ESMO对转移性结直肠癌患者管理的共识指南。中国科学,2016;27(8):1386-422。
Kopetz S, McDonough SL, Morris VK, Lenz HJ, Magliocco AM, Atreya CE,等。伊立替康和西妥昔单抗联合或不联合vemurafenib治疗braf突变转移性结直肠癌的随机试验(SWOG 1406)。中华临床医学杂志,2017;35(4):516。
Cremolini C, Loupakis F, Antoniotti C, Lupi C, Sensi E, Lonardi S,等。FOLFOXIRI联合贝伐珠单抗与FOLFIRI联合贝伐珠单抗作为转移性结直肠癌患者的一线治疗:开放标签三期TRIBE研究的最新总生存期和分子亚组分析中华肿瘤学杂志,2015;16(13):1306-15。
Jones JC, Renfro LA, al - shamsi HO, Schrock AB, Rankin A, Zhang BY,等。(非v600) BRAF突变定义了一种临床独特的转移性结直肠癌分子亚型。中华临床肿瘤学杂志,2017;35(23):2624-30。
De rock W, Claes B, Bernasconi D, De Schutter J, Biesmans B, Fountzilas G,等。KRAS、BRAF、NRAS和PIK3CA突变对化疗难治性转移性结直肠癌西妥昔单抗联合化疗疗效的影响:一项回顾性联盟分析《医学杂志》2010;11(8):753-62。
Holch JW, Ricard I, Stintzing S, Modest DP, Heinemann V.转移性结直肠癌患者原发肿瘤位置的相关性:一线临床试验的荟萃分析。中华癌症杂志,2017;
Jensen CE, Loaiza-Bonilla A, Villanueva JY, Morrissette JJ。右侧和左侧结直肠腺癌突变率的差异。中华临床医学杂志,2017;35(4):422。
罗海德P,久叶A,今村Y,廖X,山内M,西原R,等。微卫星不稳定性和BRAF突变检测在结直肠癌预测中的应用。中华肿瘤学杂志,2013;29(4):516 - 516。
Gonsalves WI, Mahoney MR, Sargent DJ, Nelson GD, Alberts SR, Sinicrope FA等。结肠癌患者和肿瘤特征以及BRAF和KRAS突变,NCCTG/Alliance N0147。中华肿瘤学杂志,2014;
张志刚,张志刚,张志刚,张志刚,等。KRAS和BRAF在II期和III期切除结肠癌中的预后作用:PETACC-3、EORTC 40993、SAKK 60-00试验的转化研究结果中华临床肿瘤学杂志,2010;28(3):466-74。
马塞多MP,安德拉德Lde B,库德里R,克雷斯波R,戈梅斯M,里斯本BC,等。Kras基因在结直肠癌中的多重突变:回顾两例病例报告的文献。中华结直肠癌杂志2011;26(10):1241-8。
杰辛格豪斯M, Pfarr N, Endris V, Kloor M, Volckmar AL, Brandt R,等。用于癌症精准医疗的结直肠癌基因分型:来自IPH分子病理学中心的结果。基因染色体癌。2016;55(6):505-21。
杰辛格豪斯M, Pfarr N, Kloor M, Endris V, Tavernar L, Muckenhuber A,等。同步性结直肠癌的遗传异质性影响基因分型方法和治疗策略。基因染色体癌。2016;55(3):268-77。
Schmitt MW, Loeb LA, Salk JJ。亚克隆抗性突变对癌症靶向治疗的影响。中华儿科杂志,2016;13(6):335-47。
Summers M, Smith CG, Maughan TS, Kaplan R, Escott-Price V, Cheadle JP。BRAF和NRAS位点特异性变异对结直肠癌生存率有不同的影响。临床癌症杂志2016;23(11):2742-9。
Morkel M, Riemer P, Blaker H, Sers C.相似但不同:KRAS和BRAF癌基因在结直肠癌发展和治疗耐药中的不同作用。Oncotarget。2015;6(25):20785 - 800。
姜玲,黄娟,Morehouse C,朱伟,Korolevich S,隋迪,等。结直肠癌患者中KRAS低频突变,非小细胞肺癌患者中致癌驱动因子存在多突变。中华肿瘤学杂志,2013;29(6):344 - 344。
刘志强,李志强,李志强,等。KRAS、BRAF、PIK3CA和PTEN在结直肠癌中的预后作用中华肿瘤学杂志,2013;29(3):344 - 344。
梅志斌,段春春,李长波,崔玲,Ogino S.肿瘤PIK3CA突变在结直肠癌中的预后作用:系统综述和荟萃分析。中国科学,2016;27(10):1836-48。
郭文杰,李志强,李志强,等。在六项随机试验中,RAS野生型转移性结直肠癌患者接受化疗和EGFR定向抗体治疗的原发肿瘤侧的预后和预测价值中国科学院学报,2017;28(8):1713-29。
Galon J, Costes A, Sanchez-Cabo F, Kirilovsky A, Mlecnik B, Lagorce-Pages C,等。人结直肠肿瘤内免疫细胞的类型、密度和位置可预测临床结果。科学。2006;313(5795):1960 - 4。
Gandhi L, Rodriguez-Abreu D, Gadgeel S, Esteban E, Felip E, De Angelis F,等。派姆单抗联合化疗治疗转移性非小细胞肺癌中华实用医学杂志,2018;29(3):344 - 344。
埃格蒙特AMM, Blank CU, Mandala M, Long GV, Atkinson V, Dalle S,等。在切除的III期黑色素瘤中,辅助派姆单抗与安慰剂的比较。中华实用医学杂志,2018;29(4):369 - 369。
Diaz LA, Marabelle A, Delord J-P, shapiro - frommer R, Geva R, Peled N,等。Pembrolizumab治疗微卫星不稳定性高(MSI-H)结直肠癌(CRC)和非CRC。中华肿瘤学杂志,2017;35(15):381。
Lal N, White BS, Goussous G, Pickles O, Mason MJ, Beggs AD,等。KRAS突变和共识分子亚型2和3与结直肠癌免疫浸润和反应性降低独立相关。临床癌症杂志2018;24(1):224-33。
王志强,王志强,王志强,等。巨蟹座的免疫系统。免疫力。2018;48(4):812 - 30。
作者的贡献
EI, GZ, AB, SS, ER, AG设计了研究。GZ, AB, SS, ER, ERi, RM, ML, LT, LM提供研究材料或患者。FG、LMa、RF对组织样本进行组织学检查。EI, AG, GC, SS, ER, LF, ML, RM, LT, EC, AP, MG, FG, LM, LMa, RF, ERi, GZ, AB收集并组装数据。EI、AG、GC、LF、GZ、AB对数据进行分析和解释。我写了手稿。GZ, AB对手稿进行了修改和编辑。所有作者都阅读并批准了最终的手稿。
确认
作者要感谢A. Di Liscia博士在数据检索方面的宝贵支持。GZ要感谢P. Blandini博士,医学博士,在这个项目的各个阶段所提供的宝贵的科学见解。
相互竞争的利益
作者宣称他们之间没有利益冲突。
数据和材料的可用性
当前研究中使用的扩增子的数据集和序列可根据要求从通讯作者处获得。
发表同意书
不适用。
伦理批准并同意参与
本研究是根据《赫尔辛基宣言》的原则进行的,由我们的内部委员会批准,并获得了所有患者的分子检测书面知情同意书,并得到了主办机构的批准。
资金
这项研究没有从任何公共、商业或非营利部门的资助机构获得特定的资助。
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
作者信息
作者及隶属关系
相应的作者
额外的文件
附加文件1。
附加的表格和图表。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
伊斯纳尔迪,E.,加鲁蒂,A.,西梅纳,G.。et al。RAS/RAF通路在转移性结直肠癌中的临床病理关联和伴随突变翻译医学杂志17, 137(2019)。https://doi.org/10.1186/s12967-019-1879-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-019-1879-2
关键字
- 转移性结直肠癌
- 延长拉
- RAS / RAF通路
- Anti-EGFR
- 伴随的突变