摘要
背景
SETD2作为组蛋白3在赖氨酸36位点三甲基化的单一介质,已被报道与急性髓系白血病(AML)的起始进展和化疗耐药有关。基因的多态性SETD2对AML预后和化疗反应的影响仍不明确。
方法
的三种标记单核苷酸多态性(tagSNPs)SETD2采用Sequenom Massarray系统对579例AML患者进行基因分型。分析单核苷酸多态性与Ara-C诱导治疗后完全缓解(CR)率、总生存期(OS)和无复发生存期(RFS)的相关性。
结果
生存分析表明SETD2rs76208147 TT基因型与AML不良预后显著相关(TT vs. CC + CT的危险比:HR = 1.838, 95%可信区间(CI) 1.005 ~ 3.360,p= 0.048)。在对已知预后因素(包括风险分层、年龄、异基因sct、WBC计数和LDH计数)进行调整后,在多因素分析中,rs76208147 TT基因型仍与OS相关(TT vs. CC + CT HR = 1.923, 95% CI 1.007-3.675,p= 0.048)。此外,经其他临床特征调整后,rs4082155等位基因G携带者的完全缓解率较高,其CR率(AG + GG vs. AA奇比(OR) = 0.544, 95% CI 0.338-0.876,p= 0.012)。
结论
SETD2基因多态性与AML预后和化疗结果相关,提示AML诊断和治疗的发展可能SETD2.
背景
急性髓系白血病(AML)是一种遗传和临床异质性疾病,以造血干细胞不完全成熟和正常血细胞计数降低为特征[1].尽管在新疗法的开发上已经做出了巨大的努力,阿糖胞苷和蒽环素的化疗仍然是目前AML的治疗方案,其完全缓解率(CR)为70-80% [2].然而,超过一半的成年患者和约80%的老年患者发展为原发性顽固性、复发或治疗相关死亡[3.].此外,患者预后存在巨大的个体差异:5年生存率从18%到82%不等,复发率从33%到80%不等,这可能与疾病亚型、年龄、体细胞突变、基因表达异常和其他分子改变有关。基因变异,比如NPM1, FLT3-Itd, cebpa, wt1已被证实是预后的标志[4,5,6],但这些因素只能解释部分AML个体变异。
最近的研究强调了表观遗传机制在AML化疗敏感性和疾病预后中的重要作用。如DNA(胞嘧啶-5)甲基转移酶3 α (DNMT3A) R882突变,导致局灶性低甲基化表型,与AML不良预后相关[7,8].10 - 11 -易位(TET)酶(TET2)的突变,催化5-甲基胞嘧啶氧化为5-羟甲基胞嘧啶(5hmC),在具有中危细胞遗传学的AML患者中给予不利的预后因素[9].
SETD2属于赖氨酸甲基转移酶超家族,赖氨酸甲基转移酶是哺乳动物中唯一的H3K36三甲基化甲基转移酶。H3K36三甲基化也涉及多种细胞生物学功能,包括转录激活、选择性剪接、剂量补偿、DNA复制和修复以及同源重组[10].SETD2是一个2-hit的肿瘤抑制基因,因为在一系列肿瘤类型中检测到功能丧失突变和缺失,最显著的是透明细胞肾细胞癌(ccRCC) [11]和高度胶质瘤[12]并随后出现在急性淋巴细胞白血病患者亚群中[13]及急性髓系白血病[14].大多数的突变或异常SETD2已被报道与ccRCC患者更糟糕的结局相关,建议保护价值为SETD2[15].而且,选择性的富集SETD2复发性急性白血病失活突变提示与化疗耐药有关[16].然而,单核苷酸多态性(SNPs)是否在SETD2与疾病进展和药物反应的关系尚不清楚。
在本研究中,我们进行了候选基因关联研究,以找出是否SETD2SNPs与AML生存期和化疗反应相关,将探索导致AML预后个体差异的因素,为新的治疗方法提供新方向。
材料与方法
临床分析样本
从2009年5月至2017年12月湘雅医院血液科招募中国汉族患者579例。所有患者均根据FAB标准进行诊断和分类。排除标准为(1)M3亚型,因为其特殊的治疗和结局。(2)患有严重疾病或其他癌症、继发性白血病及资料缺失(如细胞遗传学或分子异常)的患者。(3)本研究剔除随访失败的患者。详细的治疗方案已在其他地方描述[17,18,19].采用完全缓解(CR)评价药物反应。CR的定义参照国际推荐标准,包括无白血病临床表现、无髓外疾病证据、骨髓母细胞< 5%、中性粒细胞计数> 1.0 × 109/L,血小板计数为> 100 × 109/L化疗后[20.].使用总生存期(OS)和无复发生存期(RFS)作为疾病结局,事件定义为符合前面描述的标准的任何复发或死亡。当未观察到复发或死亡时,在最后一次随访日期对所有生存终点进行审查[21].
本研究由中南大学临床药理研究所伦理委员会批准。ctxy - 120025 - 2)。中国临床试验注册号:ChiCTR-PPC-14005297。根据《赫尔辛基宣言》及其后来修订的建议,从每位患者那里获得了书面知情同意。
TagSNPs选择和基因分型和单倍型
的tagsnp的选择标准如下SETD2.首先,我们根据1000个人类基因组数据库(https://www.ncbi.nlm.nih.gov/variation/tools/1000genomes/).然后,我们通过设置r检验连杆不平衡分析2阈值为0.8。选择3个误义突变的tagSNPs来代表每个区块(表1,附加文件1:图S1)。Polyphen数据库(http://genetics.bwh.harvard.edu)用于预测候选snp的潜在结构和功能变化,表达数量性状位点(eQTL)数据库(https://gtexportal.org/home/)用于预测snp对相应基因表达的潜在影响(附加文件2:图S2)。
根据提供的方案,使用E.Z.N.A.VR SQ血液DNA试剂盒II (Omega Bio-Tek)从外周血细胞中提取基因组DNA。通过等位基因特异性基质辅助激光解吸/电离飞行时间质谱(Sequenom, San Diego, CA)进行SNP基因分型。随机选取约10%的样本,通过Sanger测序验证基因型。结果达到100%的符合性。的三个tagsnpSETD2, (rs4082155, rs6767907, rs76208147)最终被选中进行进一步研究。
统计分析
采用SPSS 20.0 (SPSS INc.)软件进行统计分析。芝加哥,伊利诺伊州,美国)。χ2用试验确定SNPs的基因型分布是否符合Hardy-Weinberg平衡。用Kaplan-Meier曲线和单变量Cox回归分析说明OS/RFS的分布。独立显著性因素经多变量分析调整,Cox比例风险模型,包括临床因素和临床因素SETD2单核苷酸多态性。对CR率进行敏感性分析。用Logistic回归评价基因型与化疗反应之间的关系。有限的后向选择程序用于调整潜在的混杂协变量,包括临床因素。当p < 0.05并定义两边时,接受统计学意义。
结果
AML患者的基线特征和总体CR状态
本研究579例AML患者的基本情况及临床特征记录于表中2.患者的中位年龄为43岁(范围14-79岁)。其中男性313例,女性266例。白细胞数中位数为14.6 × 109诊断时LDH平均水平为363.5 U/L。其他重要临床资料也汇总于表中2.根据FAB标准将所有患者分为7个亚型。M3亚型因其特定的治疗策略和疗效而被排除。M2亚型最多见(45.25%),M5亚型次之(19.69%)。根据细胞遗传学和分子异常,分为低危90例,中危262例,高危112例。共有368例(63.6%)患者在化疗1 ~ 2个疗程后达到CR, 33例(5.7%)患者因临床证据不足无法准确评估CR。84例(14.51%)行造血干细胞移植。所有患者均接受随访,中位随访期为554天(范围17-4742天)。
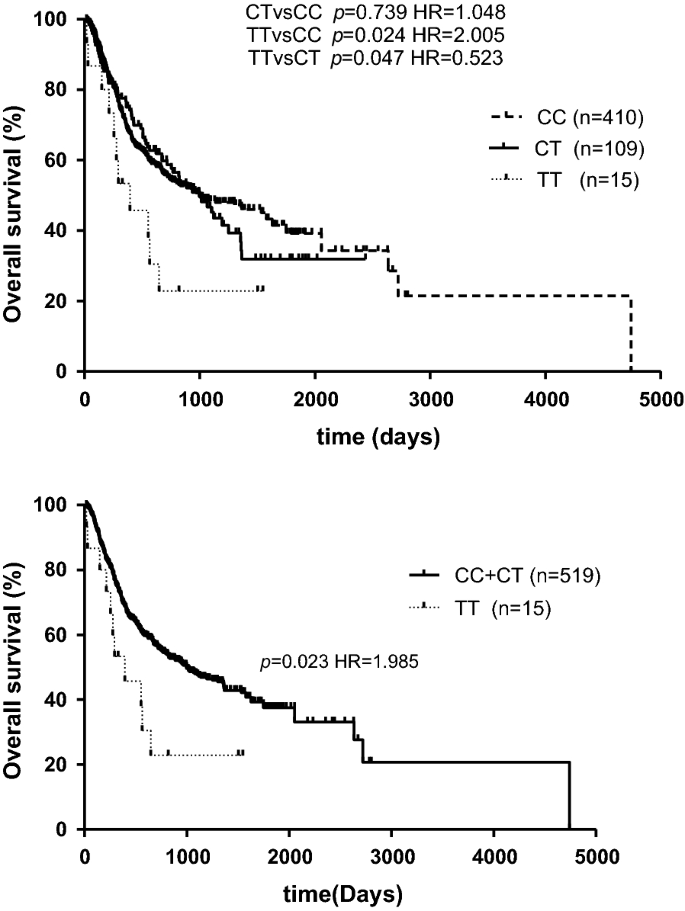
SETD2rs76208147与AML患者的总生存期相关
这个系列的Kaplan-Meier生存分析表明SETD2rs76208147罕见纯合基因型TT与普通纯合基因型CC相比生存率较差(p= 0.024;无花果。1).由于CC患者与CT患者的总生存期(OS)无明显差异,我们将C等位基因携带者合并为一组,建立隐性模型。在隐性模型中,rs7620147 TT基因型的OS显著低于C等位基因个体(p= 0.023;无花果。1).单变量结果表明SETD2与CC基因型携带者相比,rs76208147 TT基因型患者的OS较差(TT vs CC风险比:HR = 1.836, 95%可信区间(CI) 1.001 ~ 3.369,p= 0.049;表格3.).与携带rs76208147 C等位基因的患者(CC + CT)相比,TT基因型患者OS的危险比为1.838 (95% CI 1.005-3.360,p= 0.048;表格3.).CC + CT基因型患者的中位总生存时间为885天(95% CI 697-1073天),明显长于TT基因型患者(中位OS = 395天,95% CI 71-718天)。
在对已知的预后因素进行校正后,包括风险分层、年龄、异基因sct、白细胞计数和乳酸脱氢酶计数(校正后p < 0.001,附加文件)3.:表S1),在多因素分析中,rs76208147 TT基因型仍与较差的OS相关(TT vs. CC + CT HR = 1.923, 95% CI 1.007-3.675,p= 0.048,表3.).
而在单因素分析中,其他tagSNPs、rs4082155、rs6767907与AML患者的OS无关(表4082155、rs6767907)3.).当RFS作为终点时,没有显著标记的snpsSETD2采用单因素和多因素分析进行观察。
候选snp与AML基于Ara-C的化疗相关
与CC基因型相比,rs76208147 CT基因型化疗耐药风险较低(OR = 0.567, 95% CI 0.35 ~ 0.919,p= 0.021,表4).CC和CT基因型的CR率分别为64.7%和76.4%。该SNP未通过年龄、危险分层、LDH和WBC校正(校正后p < 0.05,附加文件4:表S2) logistic回归分析。然而,当考虑rs76208147 TT基因型时p值不符合统计学差异(OR = 0.500, 95% CI 0.14-1.82,p= 0.293)。这可能是由于样本量小,只有3例TT基因型的非cr组患者参与。值得注意的是,等位基因T的纯合携带者与CT基因型有相同的倾向,CR患者TT基因型的比例远高于CC基因型。
为SETD2rs4082155,等位基因G携带者的化疗敏感性显著高于AA携带者(GG + AG vs. AA: OR = 0.677, 95% CI 0.460 ~ 0.997,p= 0.048)。Logistic回归分析显示,风险分层、年龄、预处理WBC计数和LDH水平与非cr风险显著相关(附加文件)4:表S2)。经这些危险因素调整后,rs4082155等位基因G携带者仍显著影响化疗敏感性。与AA基因型相比,AG和GG基因型均表现出较低的耐药风险(AG vs. AA: OR = 0.562, 95% CI 0.340-0.931,p= 0.025;GG vs. AA: OR = 0.501, 95% CI 0.265-0.946,p= 0.033,表4).AG和GG基因型合并为一组建立优势模型后,rs4082155等位基因G携带者的化疗敏感性明显高于AA基因型(AG + GG vs. AA: OR = 0.544, 95% CI 0.338-0.876,p= 0.012)。rs4082155三种基因型携带者的完全缓解率分别为61.1% (AA)、69.2% (AG)和71.5% (GG)。
单体型分析
我们进一步研究了这三个snp的单倍型SETD2使用PHASE 2.0软件,并分析其与临床结果和化疗的关系。筛选出3个频率高于5%的单倍型。单倍型AGC(单倍型1)、GAC(单倍型2)、GGT(单倍型3)的频率分别为53.7%、34.4%、11.9%。具有1个或2个拷贝数的单倍型GGT较无拷贝数的患者化疗反应更好(or: 0.576, 95% CI 0.38-0.88,p= 0.01,表5).化疗与其他单倍型之间未观察到显著相关性。单变量分析中采用log-rank检验分析这三种单倍型与OS/RFS的相关性。然而,没有单倍型是患者OS或RFS的可预测因素。
讨论
在本研究中,我们研究了SETD2在中国AML患者中首次发现对Ara-C基治疗和疾病预后有化学敏感性反应的snp。我们发现SETD2rs76208147 TT基因型预测AML患者OS较差,而rs76208147 TT基因型预测AML患者OS较差SETD2rs4082155 AA基因型与以Ara-C为基础的治疗后的耐药相关。此外,具有一个或两个GGT副本的单倍型比没有副本的个体表现出更好的化疗反应。
的SETD2该基因编码一个230 kDa蛋白,该蛋白非冗余地负责组蛋白H3上赖氨酸36的三甲基化(H3K36me3),这是一个参与多种重要细胞过程的关键标记,如转录延伸、突变剪接、错配修复调控和同源重组修复[22,23,24,25,26,27].最近,SETD2被鉴定为肿瘤抑制因子,作为功能丧失突变SETD2已在各种肿瘤中发现,包括ccRCC、肺腺癌、胶质瘤、AML、ALL和肥大细胞增多症[12,28,29,30.,31,32].此外,功能丧失突变SETD2和/或H3K36me3水平降低与肺癌和ccRCC的临床预后不良有关[15,33].在AML,SETD2突变是反复发生的事件,并与已知是白血病发生的驱动突变的染色体异常有关,如mml重排[14].在存在染色体易位的情况下,如mll重排、敲除等SETD2通过加速白血病干细胞自我更新的潜能,促进肿瘤的发生和发展[14].值得注意的是,在正常造血条件下,SETD2是维持造血干细胞自我更新能力所必需的SETD2-缺失的造血干细胞最终发生恶性转化[34].与我们的发现一致,SETD2rs76208147 TT基因型提示AML患者预后较差,其机制有待进一步研究。
最近,人们普遍认为SETD2与化疗敏感性相关。研究已经确定突变的富集SETD2复发性急性淋巴细胞白血病和mll重排急性白血病[16].此外,SETD2突变导致对DNA损伤剂、阿糖胞苷、6-硫鸟嘌呤、阿霉素和依托泊苷产生耐药性,但不通过损害DNA损伤识别而对非DNA损伤剂产生耐药性[35].此外,获得性功能丧失突变SETD2使转移性非小细胞肺癌对顺铂产生耐药性[36].所有这些报告都表明SETD2对DNA错配修复(MMR)机制产生了微妙的影响[37].据报道,MSH6是MMR机制的重要组成部分,它通过与H3K36三甲基标记结合而定位于染色质SETD2使。SETD2敲低已被证明会导致MSH6的错误定位和微卫星的不稳定性,并在几种细胞类型中产生突变表型。至少有两种可能的解释SETD2失活对白血病细胞存活的影响。首先,由突变体诱导表型SETD2失活可以增加突变多样性,从而增加白血病的适应性,从而导致克隆生存。第二,由于完整的MMR对于触发细胞凋亡和/或细胞周期停止对许多DNA损伤化疗的反应很重要,SETD2损失可能导致化疗耐受[35].的功能SETD2也参与同源重组,这种缺乏通常导致对dna损伤剂敏感,如顺铂[24].话虽如此,影响SETD2同源重组的改变有待进一步研究。
SETD2由于其催化H3K36三甲基转移酶的能力而被发现,主要研究局限于其组蛋白修饰作用。但是,在最近的研究中,很明显SETD2发挥与组蛋白修饰无关的多种功能。例如,据报道SETD2直接介导STAT1在赖氨酸525上的甲基化,从而放大IFN-a的抗病毒免疫[38],以及赖氨酸40上的a-微管蛋白甲基化,后者通过微管甲基化维持基因组的稳定性[39].总的来说,这些附加功能的贡献SETD2对AML的预后和治疗的影响仍有待充分阐明。
本研究存在一些局限性。首先,我们的研究结果未能进行多次检验调整,可能由于我们的研究样本量有限,在进行Bonferroni校正时P值失去统计学意义。第二,Ara-C反应受多种遗传因素的影响,单个独特基因对药物暴露的贡献可能有限。
结论
综上所述,我们的研究首次表明表观遗传学调节基因如SETD2与中国AML患者对以Ara-C为基础的化疗药物敏感性及预后相关。由于适用于AML预后预测的因素仍然有限,我们的研究结果提供了深刻的信息,即表观遗传调节剂中的snp可能被认为是评估AML预后的潜在标志物。为SETD2通过不同的机制参与肿瘤的发生、发展以及化疗敏感性。现在有必要对其进行功能研究,以阐明其确切的生物学功能SETD2但我们的数据增加了越来越多的证据,表明它在AML中发挥了作用SETD2和H3K36me3在AML中的作用,这可能被开发为新的治疗靶点。
参考文献
ferara F, Schiffer CA.成人急性髓系白血病。《柳叶刀》杂志。2013;381:484 - 95。
Derolf AR, Kristinsson SY, Andersson TM, Landgren O, Dickman PW, Bjorkholm M.提高急性髓系白血病患者的生存率:一项基于人群的研究,对1973年至2005年间在瑞典诊断的9729例患者进行了研究。血。2009;113:3666 - 72。
McGregor AK, Moulton D, Bown N, Cuthbert G, Bourn D, Mathew S, Dang R, Mounter P, Jones G.英格兰北部成人急性髓系白血病的发病率和结局:一项真实世界的研究。Leuk淋巴瘤,2016;57:1575-84。
张大元,闫辉,曹松,张伟,李小玲,曾华,陈小鹏。Wilms Tumor 1 rs16754预测中国南方人群急性髓系白血病患者有良好的临床预后。Leuk Res. 2015; 39:568-74。
陆景文,王安,廖哈,陈春春,侯哈,胡春春,田海峰,欧戴林,李林。Cabozantinib对flt3 -内部串联复制(FLT3-ITD)的急性髓系白血病细胞具有选择性细胞毒性。癌症杂志2016;376:218-25。
Papaemmanuil E, gersping M, Bullinger L, Gaidzik VI, Paschka P, Roberts ND, Potter NE, Heuser M, Thol F, Bolli N, Gundem G, Van Loo P, Martincorena I, Ganly P, Mudie L, McLaren S, O 'Meara S, Raine K, Jones DR, Teague JW, Butler AP, Greaves MF, Ganser A, Dohner K, Schlenk RF, Dohner H, Campbell PJ。急性髓系白血病的基因组分类与预后。中华医学杂志。2016;374:2209-21。
Ribeiro AF, Pratcorona M, Erpelinck-Verschueren C, Rockova V, Sanders M, Abbas S, Figueroa ME, Zeilemaker A, Melnick A, Lowenberg B, Valk PJ, Delwel R.突变体DNMT3A:急性髓系白血病预后不良的标志。血。2012;119:5824-31。
袁小强,张岱元,闫慧,杨玉玲,朱广伟,陈玉华,李旭,尹建勇,李小玲,曾宏,陈小鹏。DNMT3A基因多态性作为AML患者预后预测因子的评估。Oncotarget。2016;7:60555 - 74。
周卫东、周志强、刘春春、陈春春、侯夏、郭友友、李志强、柯斌斌、唐建利、姚敏、蔡伟、吴世杰、黄淑云、许志强、陈玉春、张玉春、郭友友、郭KT、李飞、刘志强、刘长泉、曾兆明、黄芳芳、田芳芳。TET2突变是具有中危细胞遗传学的急性髓系白血病患者的不利预后因素。血。2011;118:3803-10。
瓦格纳EJ,卡朋特PB。了解Lys36在组蛋白H3上甲基化的语言。中国生物医学工程学报。2012;13:115-26。
达格利什GL店员,陈Furge K,格林曼C、L, Bignell G,巴特勒,戴维斯H, Edkins年代,哈代C,拉蒂默C,爱尔兰人J,安德鲁J, Barthorpe年代,贝尔D,巴克G,坎贝尔PJ,《福布斯》年代,贾米,琼斯D, H,乐园Kok CY,刘千瓦,Leroy C,林ML,麦克布莱德DJ,麦迪森M,马奎尔,McLay K,孟席斯,米罗年科T, Mulderrig L, Mudie L O ' meara年代,游乐园E, Rajasingham,牧羊人R, R,史密斯Stebbings L,斯蒂芬斯P,唐G, Tarpey PS, Turrell K, Dykema KJ,邱SK, Petillo D, Wondergem B, Anema J,Kahnoski RJ, Teh BT, Stratton MR, Futreal PA。肾癌的系统测序显示组蛋白修饰基因失活。大自然。2010;463:360-3。
Fontebasso AM, Schwartzentruber J, Khuong-Quang DA, Liu XY, Sturm D, Korshunov A, Jones DT, Witt H, Kool M, Albrecht S, Fleming A, Hadjadj D, Busche S, Lepage P, Montpetit A, Staffa, Gerges N, Zakrzewska M, Zakrzewski K, Liberski PP, Hauser P, Garami M, Klekner A, Bognar L, Zadeh G, Faury D, Pfister SM, Jabado N, Majewski J。神经病理学杂志2013;125:659-69。
吴张J,丁L, Holmfeldt L G, Heatley SL, Payne-Turner D,伊斯顿J,陈X,王J, Rusch M,陆C,陈SC L, Collins-Underwood JR,马J,罗伯茨公斤,磅某人,乌里扬诺夫,Becksfort J,古普塔P, Huether R, Kriwacki RW,帕克M, McGoldrick DJ,赵D,阿尔弗德D,发现年代,Bobba KC,歌G,裴D,程C,罗伯茨年代,索尔,坎帕纳D, Coustan-Smith E, Shurtleff SA Raimondi SC, Kleppe M,冷却J, Shimano KA, Hermiston ML, Doulatov年代,Eppert K, Laurenti E, F Notta,迪克我,低音部G,Hunger SP, Loh ML, Devidas M, Wood B, Winter S, Dunsmore KP, Fulton RS, Fulton LL, Hong X, Harris CC, Dooling DJ, Ochoa K, Johnson KJ, Obenauer JC, Evans WE, Pui CH, Naeve CW, Ley TJ, Mardis ER, Wilson RK, Downing JR, Mullighan CG。早期t细胞前体急性淋巴细胞白血病的遗传基础。大自然。2012;481:157 - 63。
朱鑫,何峰,曾辉,凌山,陈安,王勇,闫鑫,魏伟,庞勇,程宏,华超,张勇,杨鑫,陆旭,曹磊,郝林,董林,邹伟,吴娟,李鑫,郑松,闫娟,周娟,张磊,米生,王鑫,张磊,邹勇,陈勇,耿震,王杰,周杰,刘鑫,王杰,袁伟,黄刚,程涛,王庆峰。人急性白血病中SETD2功能性协同突变的鉴定。Nat Genet, 2014; 46:287-93。
刘伟,付强,安慧,常勇,张伟,朱颖,徐玲,徐娟。SETD2表达降低预示着非转移性透明细胞肾细胞癌患者预后不良。医学。2015;94:e2004。
Mar BG, Bullinger LB, McLean KM, Grauman PV, Harris MH, Stevenson K, Neuberg DS, Sinha AU, salan SE, Silverman LB, Kung AL, Lo Nigro L, Ebert BL, Armstrong SA。包括SETD2在内的表观遗传调控基因突变在儿童急性淋巴细胞白血病复发期间获得。Nat Commun. 2014;5:3469。
朱伟伟,陈鹏,张达元,闫红,刘辉,岑丽宁,刘玉玲,曹松,周刚,曾华,陈世平,赵小林,陈小鹏。Ara-C和dNTP代谢通路相关基因的遗传多态性与成人急性髓系白血病(AML)药敏性和预后的关系中华医学杂志。2018;16:90。
陈鹏,朱广伟,张德元,闫慧,刘辉,刘益林,曹松,周刚,曾华,陈世平,赵小玲,杨杰,陈小鹏。UGT1A1多态性对阿糖胞苷基方案治疗急性髓系白血病患者结局的影响中华医学杂志。2018;16:197。
闫慧,张德元,李旭,袁小强,杨玉玲,朱广伟,曾辉,李小林,曹松,周海辉,张伟,陈小鹏。长链非编码RNA GAS5多态性通过影响造血重建预测中国急性髓系白血病患者预后不良。Leuk淋巴瘤,2017;58:48 - 57。
Cheson BD, Bennett JM, Kopecky KJ, Buchner T, Willman CL, Estey EH, Schiffer CA, Doehner H, Tallman MS, Lister TA, Lo-Coco F, Willemze R, Biondi A, Hiddemann W, Larson RA, Lowenberg B, Sanz MA, Head DR, Ohno R, Bloomfield CD,国际诊断工作组,s.o. r.c. t.o.,急性髓系治疗试验报告标准,l,国际工作组诊断、反应标准标准化、治疗结果的修订建议,以及急性髓系白血病治疗试验的报告标准。中华临床医学杂志,2003;21(4):442 - 442。
张德元,袁小强,闫慧,曹松,张伟,李小玲,曾辉,陈小鹏。中国南方急性髓系白血病患者DCK 35708 T > C变异与临床转归的关系药物基因组学。2016;17:1519-31。
李桂梅。组蛋白编码解码:H3K36me3在错配修复中的作用及其对癌症易感性和治疗的影响。癌症决议2013;73:6379-83。
Pfister SX, Markkanen E, Jiang Y, Sarkar S, Woodcock M, Orlando G, Mavrommati, Pai CC, Zalmas LP, Drobnitzky N, Dianov GL, Verrill C, Macaulay VM, Ying S, La Thangue NB, D 'Angiolella V, Ryan AJ, Humphrey TC。抑制WEE1通过dNTP饥饿选择性地杀死组蛋白h3k36me3缺陷的癌症。《癌症杂志》2015;28:557-68。
卡瓦略S,维特尔AC,斯里达哈拉SC,马丁斯FB,拉波索AC,德斯特罗JM,费雷拉J,德阿尔梅达SF。SETD2是DNA双链断裂修复和p53介导的检查点激活所必需的。Elife。2014;3:e02482。
Aymard F, Bugler B, Schmidt CK, Guillou E, Caron P, Briois S, Iacovoni JS, Daburon V, Miller KM, Jackson SP, Legube G.转录活性染色质在DNA双链断裂处进行同源重组。分子生物学。2014;21:366-74。
Neri F, Rapelli S, Krepelova A, Incarnato D, Parlato C, Basile G, Maldotti M, Anselmi F, Oliviero S.基因内DNA甲基化阻止假转录启动。大自然。2017;543:72-7。
杜楠拉朱,李志刚,张志刚,张志刚,张志刚,张志刚,张志刚。甲基转移酶在细胞周期进程中的调控作用。核酸决议2018;46:1331-44。
Duns G, van den Berg E, van Duivenbode I, Osinga J, Hollema H, Hofstra RM, Kok K.组蛋白甲基转移酶基因SETD2是透明细胞肾细胞癌中一种新的抑癌基因。癌症法案2010;70:4287-91。
王强,程涛。组蛋白修饰基因SETD2突变在白血病发展中的关键驱动因素的证据。中国生命科学,2014;
Parker H、Rose-Zerilli MJ、Larrayoz M、Clifford R、Edelmann J、Blakemore S、Gibson J、Wang J、Ljungstrom V、Wojdacz TK、Chaplin T、Roghanian A、Davis Z、Parker A、Tausch E、Ntoufa S、Ramos S、Robbe P、Alsolami R、Steele AJ、Packham G、Rodriguez-Vicente AE、Brown L、McNicholl F、Forconi F、Pettitt A、Hillmen P、Dyer M、Cragg MS、Chelala C、Oakes CC、Rosenquist R、Stamatopoulos K、Stilgenbauer S、Knight S、Schuh A、Oscier DG、Strefford JC。组蛋白甲基转移酶SETD2在慢性淋巴细胞白血病中的基因组破坏。白血病。2016;30:2179 - 86。
Martinelli G, Mancini M, De Benedittis C, Rondoni M, Papayannidis C, Manfrini M, Meggendorfer M, Calogero R, Guadagnuolo V, Fontana MC, Bavaro L, Padella A, Zago E, Pagano L, Zanotti R, Scaffidi L, Specchia G, Albano F, Merante S, Elena C, Savini P, Gangemi D, Tosi P, Ciceri F, Poletti G, Riccioni L, Morigi F, Delledonne M, Haferlach T, Cavo M, Valent P, Soverini S.晚期系统性肥大细胞增生症中的SETD2和组蛋白H3赖氨酸36甲基化缺陷。白血病。2018;32:139-48。
Walter DM, Venancio OS, Buza EL, Tobias JW, Deshpande C, Gudiel AA, kimkiselak C, Cicchini M, Yates TJ, Feldser DM.体内染色质调节酶系统失活证实Setd2在肺腺癌中是一种有效的肿瘤抑制因子。癌症决议2017;77:1719-29。
Kadara H, Choi M, Zhang J, Parra ER,罗吉- canales J, Gaffney SG, Zhao Z, Behrens C, Fujimoto J, Chow C, Yoo Y, Kalhor N, Moran C, Rimm D, Swisher S, Gibbons DL, Heymach J, Kaftan E, Townsend JP, Lynch TJ, Schlessinger J, Lee J, Lifton RP, Wistuba II, Herbst RS.早期肺腺癌全外显子组测序和免疫谱分析及全注释临床随访。安·昂科尔,2018;29:1072。
张玉玲,孙景文,谢永杰,周勇,刘鹏,宋景杰,徐超,王磊,刘东,徐安,陈忠,陈世杰,孙晓军,黄秋华。Setd2缺乏会损害造血干细胞的自我更新,导致恶性转化。28:476-90。
Mar BG, Chu SH, Kahn JD, Krivtsov AV, Koche R, Castellano CA, Kotlier JL, Zon RL, McConkey ME, Chabon J, Chappell R, Grauman PV, Hsieh JJ, Armstrong SA, Ebert BL. SETD2改变损害DNA损伤识别并导致白血病化疗耐药。血。2017;130:2631-41。
金IK, McCutcheon JN,饶g,刘sv, Pommier Y, Skrzypski M,张耀文,Giaccone G.转移性非小细胞肺癌获得性SETD2突变和CREB1激活受损导致顺铂耐药。致癌基因。2018;38:180 - 93。
李峰,毛刚,佟东,黄娟,顾磊,杨伟,李桂梅。组蛋白标记H3K36me3通过与MutSalpha相互作用调控人DNA错配修复。细胞。2013;153:590 - 600。
陈凯,刘娟,刘松,夏敏,张鑫,韩东,姜艳,王超,曹霞。甲基转移酶setd2介导的STAT1甲基化对干扰素抗病毒活性的影响。细胞。2017;170 (492 - 506):e414。
Park IY, Powell RT, Tripathi DN, Dere R, Ho TH, Blasius TL, Chiang YC, Davis IJ, Fahey CC, Hacker KE, Verhey KJ, Bedford MT, Jonasch E, Rathmell WK, Walker CL。双染色质与SETD2的细胞骨架重塑。细胞。2016;166:950 - 62。
作者的贡献
WSW在标本采集、日期整理、日期分析等方面做出了主要贡献;YXQ分析了数据;LYZ、ZKW、CP、YH、ZHY协助标本采集、临床资料获取、随访信息获取;LX给出了有用的建议;ZH、ZXL有助于标本采集的顺利进行;CXP帮助设计研究并提供指导;CS和ZG提供了大量的指导,设计了研究,并起草和修改了手稿。所有作者都阅读并批准了最终的手稿。
确认
作者感谢曾辉、蒋志平、赵谢兰教授在标本收集和临床资料获取方面的无私帮助。
相互竞争的利益
作者宣称他们之间没有利益冲突。
数据和材料的可用性
支持本文结论的数据集包含在本文(及其附加文件)中。
发表同意书
不适用。
伦理批准并同意参与
本研究由中南大学临床药理研究所伦理委员会批准(注册号:CTXY-120025-2)。临床研究(注册号:ChiCTR-PPC-14005297)经中国临床试验注册中心批准,并获得每位患者或其家庭成员的知情同意。
资金
国家科学基金资助项目(No. 81503073 No. 81170091, No. 81422052);国家科技重大课题专题(2012ZX09509-107);国家科技重大专项(2017ZX09304014)。
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
作者信息
作者及隶属关系
相应的作者
附加文件
附加文件1:图S1。
SETD2中3个snp的位置。
附加文件2:图S2。
SETD2多态性的eQTL分析。
附加文件3:表S1。
影响AML OS的临床特征的多因素Cox回归分析。
附加文件4:表S2。
AML非cr风险相关临床特征的无条件logistic回归分析。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
王珊珊,袁,X,刘,Y。et al。组蛋白甲基转移酶的遗传多态性SETD2预测中国急性髓系白血病患者的预后和化疗反应。翻译医学杂志17, 101(2019)。https://doi.org/10.1186/s12967-019-1848-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-019-1848-9
关键字
- 急性髓系白血病
- SETD2
- 组蛋白3赖氨酸36三甲基化
- 单核苷酸多态性
- 化疗
- 阿糖胞苷