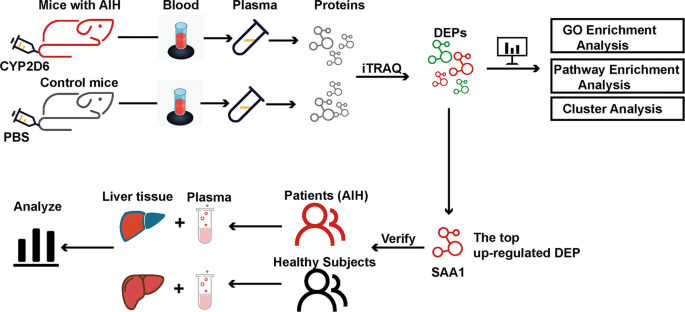
- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
改良AIH小鼠自身免疫性肝炎血浆蛋白质组学分析gydF4y2Ba
转化医学杂志gydF4y2Ba体积gydF4y2Ba18gydF4y2Ba,文章号:gydF4y2Ba3.gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
自身免疫性肝炎(AIH)的患病率越来越高,临床早期诊断困难。AIH发病机制尚不清楚,由于缺乏合适的小鼠模型,AIH相关研究在很大程度上受到限制。gydF4y2Ba
方法gydF4y2Ba
为了获得研究AIH的良好工具,我们首先通过反复注射人细胞色素P450 2D6 (gydF4y2BaCYP2D6gydF4y2Ba)质粒。接下来,采用等压标记(IBT)技术进行蛋白质组学分析,检测AIH和正常小鼠血浆中的差异表达蛋白(DEPs)及其生物学功能和通路。最后,我们进行了酶联免疫吸附试验(ELISA),进一步确认AIH患者血浆中DEP含量最高。gydF4y2Ba
结果gydF4y2Ba
在我们的小鼠模型中观察到自身抗体和AIH的特征性病理。随着时间的推移,AIH小鼠肝脏的炎症浸润也增加,并在第一次注射后的第42天达到平稳。慢性肝炎在第35天最严重,同时纤维化也在发展,收集AIH小鼠血浆进行蛋白质组学分析。本实验共检测到176个DEPs,其中148个上调,28个下调。检测到30条KEGG (Kyoto Encyclopedia of Genes and Genomes)显著通路(P < 0.05)。精氨酸生物合成被发现是AIH过程中最重要的途径。在基因本体论(GO)分析中,发现大多数DEPs参与结合、细胞和代谢过程。ELISA结果证实,与其他慢性肝炎相比,AIH患者血浆中过表达最多的DEP血清淀粉样蛋白a1 (SAA1)特异性升高。不同血浆SAA1水平也被发现与AIH患者肝脏不同程度的炎症和纤维化阶段相关。gydF4y2Ba
结论gydF4y2Ba
我们的研究首次描述了真正意义上AIH小鼠模型的蛋白质组学分析,有助于更好地了解AIH的发病机制,并为临床诊断识别潜在的生物标志物。gydF4y2Ba
背景gydF4y2Ba
自身免疫性肝炎(AIH)是一种相对罕见的炎症性肝病,以肝脏免疫耐受失败导致肝实质破坏为特征。近年,AIH的发病率有所上升[gydF4y2Ba1gydF4y2Ba],除了使用免疫抑制剂外,AIH没有有效的治疗方法[gydF4y2Ba2gydF4y2Ba].由于缺乏可靠的动物模型来研究AIH,其确切的病因和发病机制在很大程度上仍不清楚[gydF4y2Ba3.gydF4y2Ba].刀豆素A (ConA)可诱导典型的T细胞介导的小鼠肝炎,其特征为免疫细胞浸润和严重的肝损伤[gydF4y2Ba4gydF4y2Ba].许多与免疫介导的肝脏疾病(如自身免疫性慢性活动性肝炎)的病理生理学相关的研究都是基于该小鼠模型[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].小鼠出现严重的肝损伤,通过静脉注射1.5 mg/kg ConA剂量>时8小时内转氨酶释放来评估,仅肝脏受到影响[gydF4y2Ba8gydF4y2Ba].然而,cona诱导的肝炎小鼠模型可能不能完全模拟人体内的AIH,因为急性肝损伤通常在48 h后消失,而且在该小鼠模型中未观察到自身抗体的产生、肝纤维化和AIH的特征性病理。gydF4y2Ba
在过去的几十年里,一些研究人员试图建立合适的动物模型,但广泛接受的AIH小鼠模型尚未得到认可[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].AIH根据血清学自身抗体谱分为两种主要类型:1型AIH和2型AIH [gydF4y2Ba2gydF4y2Ba].1型AIH的特征是抗核抗体(ANA)和/或抗平滑肌抗体(SMA)阳性,而2型AIH的特征是存在抗肝肾微粒体1 (LKM-1)抗体[gydF4y2Ba11gydF4y2Ba].细胞色素P450 2D6 (CYP2D6)是2型AIH中公认的人类自身抗原,也是抗lkm -1抗体的抗原靶点[gydF4y2Ba12gydF4y2Ba].Christen等人首先用表达人类的腺病毒感染小鼠gydF4y2BaCYP2D6gydF4y2Ba(广告-gydF4y2Ba2 d6gydF4y2Ba)建立AIH小鼠模型[gydF4y2Ba13gydF4y2Ba].此外,已知人类白细胞抗原(HLA)-DR3和-DR4等位基因与1型和2型AIH密切相关;因此,关于AIH小鼠模型的相关研究也有报道[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
患者AIH的早期诊断很重要,但在临床实践中可能具有挑战性。目前AIH的诊断采用国际自身免疫性肝炎组织(IAIHG)的标准[gydF4y2Ba15gydF4y2Ba].然而,诊断标准是一个评分系统,准确的诊断通常需要肝活检的结果。自身抗体在AIH诊断中具有重要作用,但在临床中不具有特异性。它们可能不存在于某些特殊的AIH患者中,但可在其他自身免疫性疾病中检测到[gydF4y2Ba16gydF4y2Ba].由于AIH是一种全身性疾病,从人体内获取血液样本更容易,因此在血清/血浆中发现新的生物标志物是AIH临床早期诊断的迫切要求。目前,研究数量有限[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba]已经研究了AIH的潜在生物标志物,部分原因是AIH诊断的困难或缺乏这一研究领域的动物模型。gydF4y2Ba
不像一次性的广告gydF4y2BaCYP2D6gydF4y2Ba(gydF4y2BaCYP2D6gydF4y2Ba基于Christen等人所确定的基因合并到腺病毒)感染,本研究首次将初始一次性腺病毒感染与人反复注射相结合,建立了在体不断模拟AIH病理过程的小鼠模型gydF4y2BaCYP2D6gydF4y2Ba质粒。这是一种改进的、新颖的AIH小鼠模型建立方法。在小鼠中观察到慢性炎症、肝纤维化、自身抗体以及AIH的特征性病理,这表明我们的小鼠模型几乎可以准确地模拟人体内AIH的发病机制。我们还将该小鼠模型中观察到的自身抗体与自身免疫性肝病患者的自身抗体进行了比较,我们发现该小鼠模型中的自身抗体与2型AIH患者的自身抗体相似。然后,我们利用等压标签(IBT)技术,这是一种基于IBTs的等压标签相对定量和绝对定量(iTRAQ)的优化分析方法,对AIH小鼠和正常小鼠血浆中的蛋白质进行定量测定。此外,还探讨了AIH小鼠模型的生物代谢过程及其相关通路。根据IBT结果,血清淀粉样蛋白A (SAA)蛋白水平在AIH小鼠血浆中显著增加。SAA蛋白作为细胞因子样蛋白,其功能最近已在细胞-细胞通信以及几种炎症过程中的反馈中得到确认[gydF4y2Ba20.gydF4y2Ba].此外,SAA1是我们研究中含量最多的DEP,已被证明在ConA小鼠模型中通过诱导趋化因子加重T细胞介导的肝炎[gydF4y2Ba21gydF4y2Ba].然而,SAA家族蛋白在AIH患者血浆中的表达却鲜有研究。gydF4y2Ba
总的来说,我们的工作描述了一种改进的、稳定的AIH小鼠模型,它可以模拟2型AIH患者的疾病状况,这可能是该研究领域的一个很好的工具。此外,我们利用IBT分析了该模型中的DEPs和生物学通路,这可能为我们更好地理解AIH提供了依据。gydF4y2Ba
方法gydF4y2Ba
AIH小鼠模型gydF4y2Ba
无特异性病原体(SPF)雄性C57BL/6小鼠(6 - 8周龄,18-20 g)购自北京生命河实验动物科技有限公司。小鼠被安置在SPF级的环境中,在24±2°C和55-60%的相对湿度下,明暗交替循环12小时。表达人类的质粒gydF4y2BaCYP2D6gydF4y2Ba(pgydF4y2BaCYP2D6gydF4y2Ba)。第0天通过尾静脉注射腺病毒感染小鼠,促进人AIH的诱导gydF4y2BaCYP2D6gydF4y2Ba.接下来我们注入pgydF4y2BaCYP2D6gydF4y2Ba质粒在第1、4、9、13天通过尾静脉快速注射(每次50 μg)转染人gydF4y2BaCYP2D6gydF4y2Ba利用基于水动力学的肝脏靶向基因传递技术将其注入小鼠肝脏[gydF4y2Ba22gydF4y2Ba].质粒注射可在腺病毒注射前进行1次,以增强免疫原性(第1天)。详细的协议显示在附加文件gydF4y2Ba1gydF4y2Ba:图S1。在第一次注射后的第14、28、35和42天处死小鼠。采集小鼠血液和肝脏组织进行苏木素和伊红(H&E)染色、天狼星红染色、免疫荧光(IF)分析、免疫组化(IHC)、western blot分析和定量聚合酶链式反应(qPCR)。第35天从角静脉采集的小鼠血浆用于IBT分析。下面的研究装置设计如图所示。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
小鼠血浆制备和高丰度蛋白消耗gydF4y2Ba
使用抗凝管从角静脉中采集5只AIH小鼠和5只正常小鼠的静脉血,抗凝管用柠檬酸-葡萄糖溶液预处理(Sigma-Aldrich, St. Louis, MO USA),然后在500℃下离心gydF4y2BaggydF4y2Ba10分钟,获得上清液(血浆)。为了获得和浓缩尽可能多的低丰度蛋白质,根据制造商的说明,使用ProteoMiner蛋白质富集试剂盒(Bio-rad laboratories, Hercules, CA, USA)对样品进行均衡。每个柱上加载样品,首先通过0.22-μm过滤器。未观察到颗粒团聚现象。使用两步洗脱过程对蛋白质进行解吸。首先,用100 μL试剂盒洗脱试剂(4 M尿素,1% (w/v) CHAPS, 5% (v/v)乙酸)处理珠粒两次15 min。然后,加入100 μL 6 M胍-盐酸(pH 6.0)两次,孵育15 min。最后,从每柱中提取4个洗脱馏分,在−80℃下保存以供进一步分析。gydF4y2Ba
蛋白质定量和消化gydF4y2Ba
蛋白采用Bradford法定量,SDS-PAGE双验证。将含有8 M尿素的100 μg蛋白溶液用100 mM TEAB稀释4倍用于消化。用Trypsin Gold (Promega, Madison, WI, USA)在37°C下消化蛋白质,蛋白质:Trypsin = 40:1。胰蛋白酶消化后,肽用Strata X C18色谱柱(Phenomenex)脱盐,并根据制造商的方案进行真空干燥。gydF4y2Ba
肽标记和分馏gydF4y2Ba
多肽在25 μL 0.2 M TEAB中溶解,充分混合。室温保存后,用80 μL异丙醇涡流溶解IBT标记试剂。接下来,我们将这些混合物与适当的样品混合。根据制造商的方案,使用IBT试剂试剂盒进行肽标记。用不同试剂标记的多肽被组合并真空干燥以供进一步使用。对于肽的分离,我们使用岛津LC-20AB高效液相色谱泵系统与高pH值RP柱耦合。肽在缓冲液A (5% ACN, 95% HgydF4y2Ba2gydF4y2BaO,用氨调节pH值至9.8)至2ml体积,并加载到含有5 μm颗粒的色谱柱上(Phenomenex)。在流速为1ml /min的条件下,以5%缓冲液B (5% HgydF4y2Ba2gydF4y2BaO, 95% ACN, pH调至9.8用氨水)10 min, 5-35%缓冲液B 40 min, 35-95%缓冲液B 1 min。整个体系在95%缓冲液B中维持3 min, 1 min内缓冲液B浓度降至5%。然后,用5%的B缓冲液平衡它们10分钟。在214 nm处通过检测吸光度来监测洗脱,每1分钟收集一次馏分。将洗脱的肽集成20个馏分并真空干燥。gydF4y2Ba
高效液相色谱和质谱分析gydF4y2Ba
每个馏分在缓冲液A中重新悬浮(2% ACN和0.1% FA在水中),并在20000下离心gydF4y2BaggydF4y2Ba采用LC-20AD纳米高效液相色谱仪(Shimadzu, Kyoto, Japan),以5 μL/min的流速将上清液加载到C18捕集柱上,持续8 min。使用串联质谱Q EXACTIVE HF系统(Thermo Fisher Scientific, San Jose, CA)通过纳米电喷雾电离对纳米高效液相色谱分离的肽进行分析,用于DDA(数据依赖采集)。MS分析参数如下:电喷雾电压1.6 kV;前驱体扫描范围,350-1500 m/z,在Orbitrap中分辨率为35000;MS/MS片段扫描范围,> 100 m/z, HCD模式分辨率35000;归一化碰撞能量设置,30%;动态排除时间,15 s;自动增益控制(AGC)对全MS目标和MS2目标,分别为3e6和1e5;在一次MS扫描之后的MS/MS扫描数量,20个最丰富的前体离子高于阈值离子计数20,000。gydF4y2Ba
蛋白定量gydF4y2Ba
我们使用了一种名为IQuant的自动化软件[gydF4y2Ba23gydF4y2Ba]用于用IBTs定量分析标记肽。基于一个简单的原理(简约原理),将识别出的肽序列组装成一组自信的蛋白质。为了控制蛋白水平的假阳性结果率,1%的蛋白FDR,这是基于挑选蛋白FDR策略[gydF4y2Ba24gydF4y2Ba]作为蛋白质鉴定的标准(蛋白水平FDR≤0.01)。蛋白质定量过程包括以下步骤:蛋白质鉴定、标签杂质校正、数据归一化、缺失值归一化、蛋白质比例计算、统计分析、结果展示。gydF4y2Ba
生物信息学分析gydF4y2Ba
使用相应工具将MS/MS原始数据转换为MGF格式,并使用本地Mascot服务器在相关数据库中搜索导出的MGF文件。此外,质量控制(QC)被执行,以确定是否需要重新分析。利用IQuant对蛋白质进行定量。所有FDR小于1%的蛋白质都进行了下游分析,包括基因本体论(GO)和京都基因和基因组百科全书(KEGG)途径分析。我们进一步基于差异表达蛋白(DEPs)进行了更深入的分析,包括聚类分析、GO富集分析和KEGG通路富集分析。我们还分析了重要KEGG通路之间的相互作用,并进行了蛋白-蛋白相互作用(PPI)分析。gydF4y2Ba
患者血浆和肝组织gydF4y2Ba
样本的采集得到了当地伦理委员会和华中科技大学机构审查委员会的批准。每位患者提供书面知情同意书。在同济医院诊断AIH、原发性胆汁性肝硬化(PBC)、乙型肝炎和丙型肝炎,所选患者无免疫抑制剂使用史。所有入选的AIH患者均行肝活检,按照IAIHG诊断标准评分达到7分。同济医院病理学家用改良的Scheuer组织学评分系统诊断AIH患者肝脏炎症分级及纤维化分期[gydF4y2Ba25gydF4y2Ba].收集30例AIH患者、30例乙型肝炎患者、30例丙型肝炎患者和30例健康人静脉血进行酶联免疫吸附试验(ELISA), 3例PBC患者、3例1型AIH患者和3例2型AIH患者血浆进行免疫荧光分析。用抗凝管采集患者血样(3ml),置于冰上20min, 400离心gydF4y2BaggydF4y2Ba在- 80°C保存,直到ELISA分析。采集需要病理检查的AIH患者肝脏组织。对照组肝组织取自良性肝肿瘤切除术患者。肝活检组织用4%多聚甲醛固定48h后,石蜡包埋,切片得到5 μm厚的标本。组织切片进行免疫组化染色。gydF4y2Ba
Western blot分析和Real-time qPCRgydF4y2Ba
免疫印迹gydF4y2Ba
细胞提取物和肝组织在含有磷酸酶抑制剂、鸡尾酒和PMSF的1× RIPA缓冲液中消化(Boster, Wuhan, China)。组织蛋白(30 μg)在SDS聚丙烯酰胺凝胶中分离,转移到PVDF膜上。用5% BSA在TBST中在室温下阻断膜1小时,并与以下一抗在摇床上4℃孵育过夜:抗cyp2d6 (1:1000;sc-130366, Santa Cruz Biotechnology, CA, USA)和anti-GAPDH (1:2000;GB11002,促进者生物技术,中国武汉)。清洗膜,用辣根过氧化物酶偶联二抗(Promoter Biotechnology China Wuhan)在室温下孵育1小时。采用ECL检测试剂盒(Boster, Wuhan, China)增强化学发光法检测抗体连接蛋白的表达。gydF4y2Ba
实时定量PCRgydF4y2Ba
使用TRIzol试剂(Takara, Otsu, Japan)从肝组织中分离和提取总RNA。根据制造商的协议,使用逆转录试剂盒(RR036A, Takara, Otsu, Japan)将其转录成cDNA。使用Maxima SYBR Green qPCR Master Mix (Takara, Otsu, Japan)定量PCR评估相对mRNA水平。用于实时定量PCR的引物在附加文件中列出gydF4y2Ba2gydF4y2Ba:表S1。gydF4y2Ba
组织病理学、免疫荧光和免疫组织化学分析gydF4y2Ba
切取小鼠肝左叶,4%多聚甲醛固定24 h以上,石蜡包埋,5 μm厚切片。在乙醇梯度降低的条件下水化后,所有切片脱蜡,用哈里斯苏木精溶液在37℃下染色5分钟。对于免疫荧光,冷冻的肝组织样本切片用5%的马血清在室温下封闭30分钟,并用一级抗-αSMA (1:100;55135-1-AP, Proteintech,武汉,中国),抗cd4 (1:100;11056-2-AP, Proteintech,武汉,中国),anti-CD8a (1:200;#98941,细胞信号技术,丹佛斯,马萨诸塞州美国)过夜4°C。然后,用Alexa Fluor 488偶联和cy3偶联山羊抗兔二抗(1:100;促进者生物技术,中国武汉)室温1小时。核用Hoechst 33258染色(1:1000;17520, AAT生物探索公司,美国加利福尼亚州森尼维尔)。 Indirect immunofluorescence staining for the detection of antibodies was performed on rat liver sections. The plasma from AIH mice and patients were diluted 1:300 and used as the primary antibody and then detected using DyLight 488 conjugated goat anti-mouse IgG (1:100; A23210, Abbkine, Waltham, MA USA) and FITC-conjugated goat anti-human IgG (1:100; SA00003-12, Proteintech, Rosemont, IL USA). The detailed protocol has been described previously [10gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].最后的切片用共聚焦激光扫描显微镜检查。gydF4y2Ba
为了用免疫组化法检测SAA1在人肝组织中的表达,组织样本玻片用二甲苯脱蜡,然后梯度酒精脱水。内源性过氧化物酶被3%的过氧化氢阻断。SAA1一抗(1:100;16721-1-AP, Proteintech, Rosemont, IL USA)在4°C下孵育过夜。二抗在室温下孵育1 h,用过氧化物酶偶联链霉亲和素和DAB制备。最后用苏木精反染色,显微镜下分析。gydF4y2Ba
Elisa分析gydF4y2Ba
采集患者血浆,采用SAA1 Elisa试剂盒(#ELH-SAA-1, RayBiotech, Peachtree Corners, GA USA),按照厂家说明书检测SAA1水平的表达。使用Elisa检测小鼠血浆中的特异性抗体,详细方案在先前的研究中有描述[gydF4y2Ba13gydF4y2Ba].gydF4y2Ba
RT-qPCR、Western blot和Elisa的统计分析gydF4y2Ba
结果以均数±标准误差表示,所有实验均独立进行,每次重复3次。采用单因素方差分析评估显著性差异,p值显著时采用Tukey多元比较检验或Dunnett多元比较检验进行后验。采用Mann-Whitney和Kruskal-Wallis非参数检验比较人血浆中SAA1水平。采用GraphPad Prism 5.0 (GraphPad Software, La Jolla, CA, USA)进行统计学分析,以P < 0.05为差异有统计学意义。gydF4y2Ba
结果gydF4y2Ba
小鼠慢性肝炎症与AIH的病理特征gydF4y2Ba
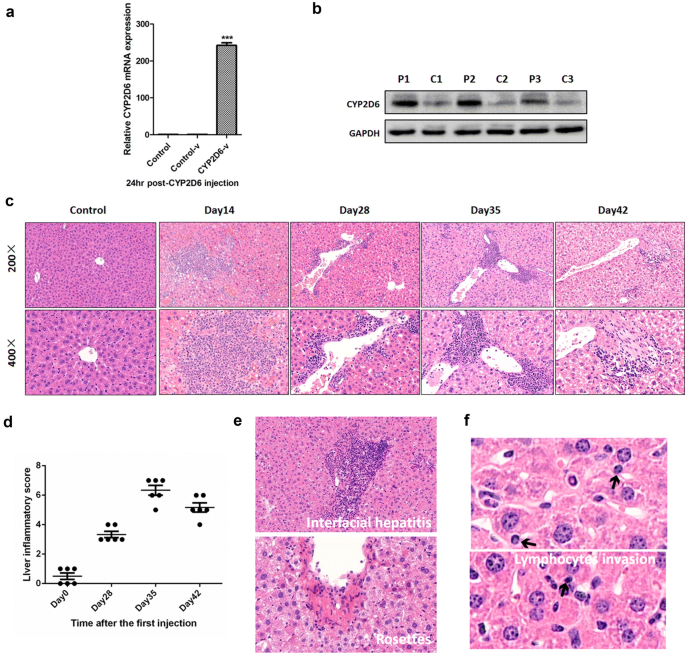
为了检测p的效率gydF4y2BaCYP2D6gydF4y2Ba使用基于水动力学的肝脏靶向基因传递技术,qRT-PCR转染小鼠肝脏(图;gydF4y2Ba2gydF4y2Baa)和western blotting分析检测CYP2D6在小鼠肝脏中的表达(图。gydF4y2Ba2gydF4y2Bab).在第一次腺病毒注射后的不同天(第14天、第28天、第35天和第42天)处死小鼠。不同组小鼠肝脏的代表性H&E染色如图所示。gydF4y2Ba2gydF4y2Bac;对照组(只注射腺病毒或只注射pgydF4y2BaCYP2D6gydF4y2Ba)在附加文件中描述gydF4y2Ba3.gydF4y2Ba:图S2第14天肝脏开始出现炎症细胞浸润,门静脉周围出现慢性淋巴细胞。肝脏炎症在第35天最严重,有明显的纤维化。第42天观察到肝细胞水样变性,炎症细胞浸润变轻,但可见明显纤维化。由同济医院病病科3名医生使用肝炎评分系统Knodell组织活性指数(Knodell, HAI)评估不同日的肝脏炎症评分(图。gydF4y2Ba2gydF4y2Bad)。此外,在第35天,在小鼠肝脏中检测到AIH的特征性病理特征,包括界面肝炎和玫瑰花结(图。gydF4y2Ba2gydF4y2Bae).侵袭性淋巴细胞,即淋巴细胞延伸到肝细胞并消失的现象,在AIH小鼠肝脏中也可见到(图。gydF4y2Ba2gydF4y2Baf).我们研究结果中观察到的组织学特征支持该小鼠模型作为研究AIH的自适应模型。gydF4y2Ba
小鼠慢性肝脏炎症和自身免疫性肝炎的病理特征gydF4y2Ba一个gydF4y2Ba采用实时荧光定量PCR检测转染效率gydF4y2BaCYP2D6gydF4y2Ba(n = 6,与对照组相比***P < 0.001)。gydF4y2BabgydF4y2Bawestern blotting法检测小鼠肝脏中CYP2D6蛋白的表达(n = 3;P1-3为注射gydF4y2BaCYP2D6gydF4y2Ba质粒和C1-3为对照组注射PBS)。gydF4y2BacgydF4y2BaC57 BL/6小鼠分别于第一次注射后第14、28、36、42天处死。采集肝组织,进行H&E染色(n = 6, ×200和×400放大)。图中只有一个注射PBS的对照组。其他对照组(仅注射腺病毒或质粒)在附加文件中显示gydF4y2Ba3.gydF4y2Ba:图S2gydF4y2BadgydF4y2BaAIH小鼠模型在不同日子的肝脏炎症评分(基于诺德尔组织活性指数,HAI,一种肝炎评分系统)。gydF4y2BaegydF4y2Ba第36天小鼠肝脏出现界面性肝炎,同时检测到玫瑰花结和淋巴细胞侵袭(gydF4y2BafgydF4y2Ba);箭头表示淋巴细胞gydF4y2Ba
AIH小鼠模型中肝纤维化的发生gydF4y2Ba
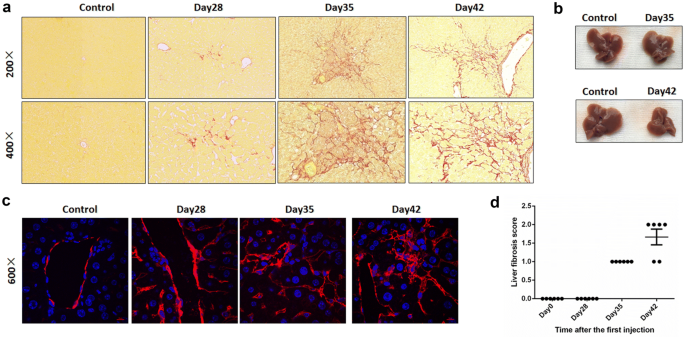
考虑到纤维化是终末期AIH的主要特征之一,我们使用天狼星红染色检测小鼠肝脏在不同日子的纤维化水平(图。gydF4y2Ba3.gydF4y2Baa).第28天出现轻度肝纤维化,肝脏静脉周围生长更多的胶原纤维。然而,肝纤维化在第35天变得更加严重,肝实质中出现了更多的胶原纤维。根据大体外观,小鼠肝脏变得略小。gydF4y2Ba3.gydF4y2Bab).第42天,胶原纤维连接不同静脉,促进小鼠肝脏假小叶的形成。此时,小鼠肝脏呈现出干瘪、硬化的外观,也比正常肝脏小得多(图2)。gydF4y2Ba3.gydF4y2Bab).我们还使用免疫荧光分析检测小鼠肝脏中α-SMA的表达(图。gydF4y2Ba3.gydF4y2Bac). α-平滑肌肌动蛋白(α-SMA)在血管周围正常表达,AIH小鼠肝脏中α-SMA水平在28天升高。它在肝实质也有表达,且荧光强度较强,从另一个角度为AIH小鼠肝脏纤维化提供了证据。同样,使用HAI评分系统评估肝纤维化评分(图。gydF4y2Ba3.gydF4y2Bad).我们的数据表明,我们小鼠模型中的肝纤维化是进行性的,与AIH患者的特征一致。gydF4y2Ba
AIH小鼠模型中自身抗体的产生和免疫细胞的浸润gydF4y2Ba
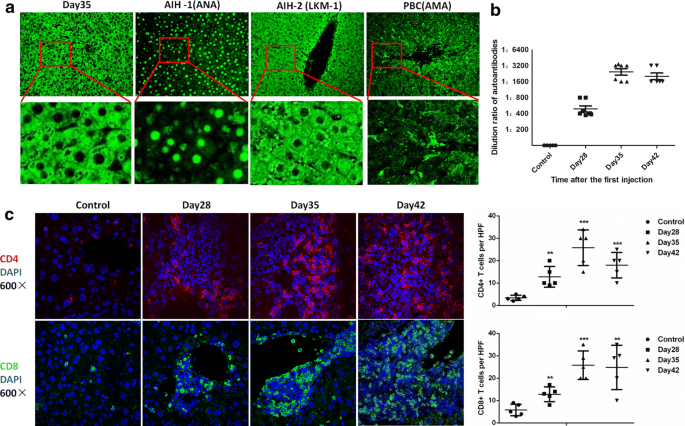
患者血浆中自身抗体的存在是诊断AIH的基本要素。这也是建立准确AIH小鼠模型的重要标准。因此,我们收集了AIH小鼠的血浆,并将其稀释作为一抗。同时,我们还使用1型AIH、2型AIH和PBC患者的血浆进行比较。gydF4y2Ba4gydF4y2Baa). AIH小鼠自身抗体与2型AIH患者抗LKM-1抗体相似。以1型AIH患者的抗ana和PBC患者的抗线粒体抗体(AMAs)作为对照。ELISA法检测自身抗体效价;结果如图所示。gydF4y2Ba4gydF4y2Bab.自身抗体浓度在第35天达到峰值,在第42天下降。考虑到AIH是典型的t细胞介导型肝炎,我们进一步检测了CD4的浸润gydF4y2Ba+gydF4y2BaT和CD8gydF4y2Ba+gydF4y2BaAIH小鼠肝脏中的T细胞。如代表性的免疫荧光图像所示(图。gydF4y2Ba4gydF4y2Bac), CD4数量的增加gydF4y2Ba+gydF4y2BaT细胞和CD8gydF4y2Ba+gydF4y2Ba第28天,T细胞从血管中浸润。在第35和42天,细胞数量进一步增加,并浸润肝实质。这些发现表明,在我们的小鼠模型中,确实存在自身抗体的产生和T细胞浸润的增加。这些结果充分证实了我们改进的AIH小鼠模型可以模拟人体内AIH的发病机制和特征。gydF4y2Ba
AIH小鼠模型中自身抗体的产生和免疫细胞浸润gydF4y2Ba一个gydF4y2Ba第35天AIH小鼠(一抗)血浆染色大鼠肝脏切片的代表图片,随后用Alexa Fluor 488偶联抗小鼠IgG(二抗)染色。AIH-1(1型自身免疫性肝炎)患者的血浆(抗核抗体,ANAs)、AIH-2(2型自身免疫性肝炎)患者的血浆(抗肝-肾微粒体-1 (LKM-1)抗体)和PBC患者的血浆(抗线粒体抗体,AMAs)被用于与原发抗体相同的大鼠肝脏切片染色。采用fitc偶联抗人IgG作为二抗(n = 3,上列×200放大,下列×800放大)。gydF4y2BabgydF4y2Ba第一次注射后AIH小鼠血浆中自身抗体的稀释率(n = 7)。gydF4y2BacgydF4y2BaCD4gydF4y2Ba+gydF4y2BaT细胞和CD8gydF4y2Ba+gydF4y2Ba在第一次注射后的不同日子,我们发现T细胞在AIH小鼠肝脏中聚集,CD4(红色)和CD8(绿色)分别为它们的标记。核用Hoechst染色(蓝色)(n = 5, ×600倍率)。**P < 0.01, ***P < 0.001gydF4y2Ba
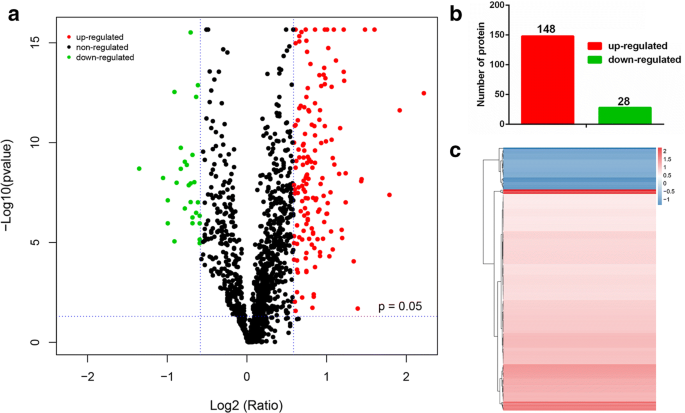
AIH组和正常小鼠IBT定量的Venn和聚类结果gydF4y2Ba
为了更全面地了解AIH并确定AIH小鼠与正常小鼠之间的蛋白质组学变化,在第35天处死5只AIH小鼠和5只正常小鼠,采用IBT定量技术采集血浆进行分析。本实验共发现6545个多肽和1365个蛋白质。此外,共检测到176个dep,并生成了这些dep的火山图(图2)。gydF4y2Ba5gydF4y2Baa).其中上调的DEPs有148个(红点),下调的DEPs有28个(绿点),而其他检测到的蛋白表达无差异(灰点)。DEPs上调和下调的直方图如图所示。gydF4y2Ba5gydF4y2Bab.显著调控蛋白的层次聚类结果如图所示。gydF4y2Ba5gydF4y2Bac.右侧有颜色梯度的面板表示蛋白质丰度由下调到上调的变化。gydF4y2Ba
AIH与正常小鼠IBT定量的Venn和聚类结果。gydF4y2Ba一个gydF4y2Ba两组差异表达蛋白的火山图(AIH vs. Normal)。每个点代表一个检测到的蛋白质。红点表示表达上调的蛋白,绿点表示表达下调的蛋白,灰点表示表达差异不显著的蛋白。该图是log2折叠变化(x轴)与−log10 q值(y轴,表示蛋白质差异表达的概率)的火山图。对于单次检测的差异表达蛋白,以q值< 0.05和> 1.5为差异表达的显著阈值。当重复实验时,根据1.5倍变化(所有对照组的平均值)和p值(所有对照组的t检验)小于0.05来定义差异表达蛋白。gydF4y2BabgydF4y2Ba直方图显示AIH组和正常组中显著上调蛋白148个,显著下调蛋白28个。gydF4y2BacgydF4y2BaAIH组与正常组DEPs的层次聚类分析结果。蓝色表示下调的DEPs,红色表示上调的DEPs,白色表示没有检测到表达变化的DEPs。基于欧氏距离和层次算法进行聚类分析gydF4y2Ba
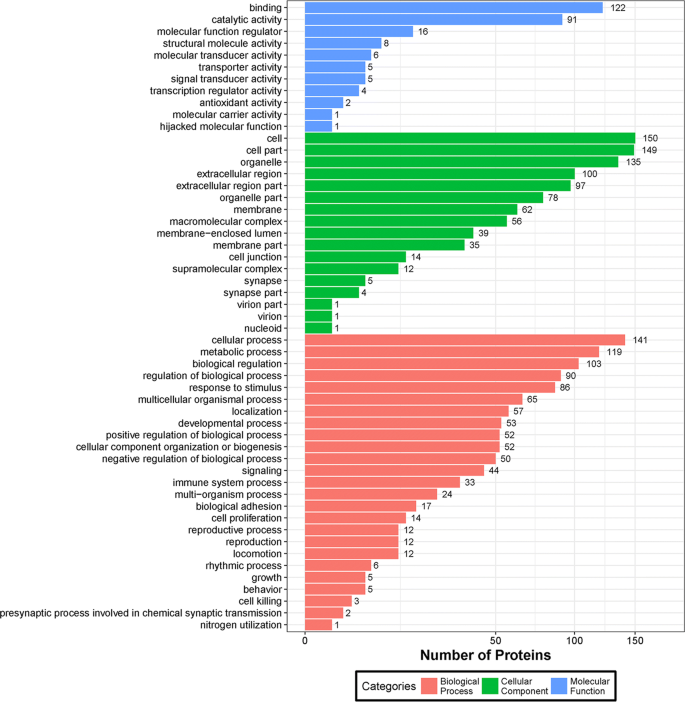
DEPs的GO富集分析gydF4y2Ba
GO分析涵盖三个领域:(1)生物过程,由一个或多个有序的分子功能组合完成的一系列事件,(2)细胞成分,细胞的每个成分和细胞外环境,(3)分子功能,活动,如催化或结合活动,发生在分子水平上。图中给出了描述这三种本体分析的条形图。gydF4y2Ba6gydF4y2Ba.参与分子功能的DEPs较少,而参与细胞成分和生物过程的DEPs较少。然而,分子功能分析表明,大多数DEPs参与了结合过程和催化活性,可能在免疫细胞相互作用和抗原提呈中发挥重要作用。细胞、细胞部分、细胞器、细胞外区、细胞外区部分是五大细胞成分,它们也可能参与多种免疫反应。在生物过程中,涉及DEPs最多的是细胞过程、单生物过程、代谢过程和生物调控。dep的三种本体的所有显著项(P < 0.01)均列在附加文件中gydF4y2Ba4gydF4y2Ba:表S2-S4。gydF4y2Ba
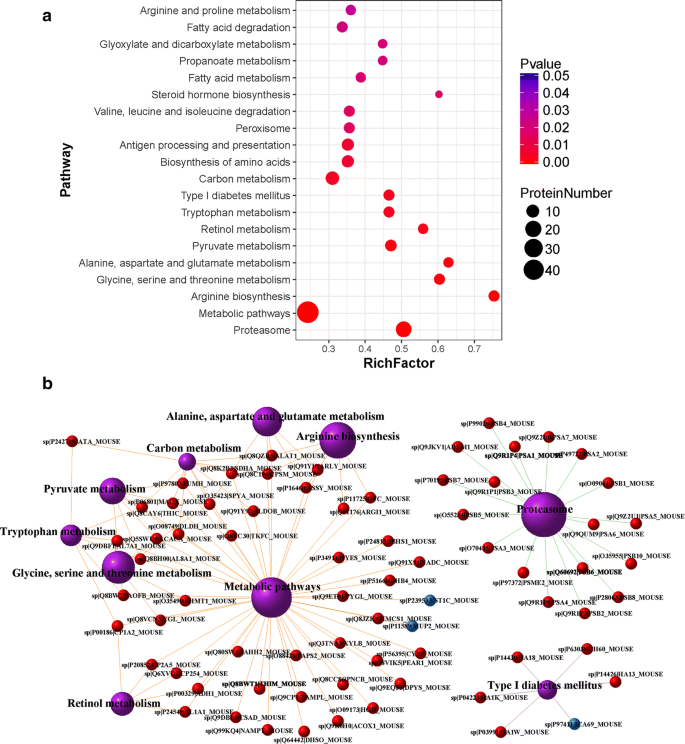
DEPs通路富集分析gydF4y2Ba
基于KEGG数据库对DEPs进行通路富集分析,分析蛋白质之间在某些生物学功能上的相互作用。DEPs参与194条KEGG通路,其中30条KEGG显著通路(P < 0.05)gydF4y2Ba5gydF4y2Ba:表S5)。图中列出了前20个通路及相应的dep数量。gydF4y2Ba7gydF4y2Baa.所有dep路径分析的柱状图见附加文件gydF4y2Ba6gydF4y2Ba:图S3。根据数据,代谢途径在过程类别中起着最重要的作用,它们涉及最多的DEPs。此外,抗原加工和呈递途径被检测为高度显著。考虑到抗原的加工和呈递在免疫应答,特别是AIH中很重要,我们在附加文件中展示了这一通路的图谱gydF4y2Ba7gydF4y2Ba:图S4在分析图谱中,我们发现上调的DEPs、热休克蛋白(Heat shock protein, HSP) 70和HSP90参与了主要组织相容性复合体(major histocompatibility complex, MHC) I通路,有助于增强CD8的功能gydF4y2Ba+gydF4y2BaT细胞和NK细胞。为了更好地理解不同蛋白质在这些通路中的相互作用,图中给出了前10个重要KEGG通路术语和相关dep的网络分析。gydF4y2Ba7gydF4y2Bab.网络中标记的dep作为不同路径之间的介质。例如,HSP90不仅参与抗原的加工和呈递,还参与了许多其他途径,如坏死中的蛋白质加工、癌症中的IL-17信号通路和Th17细胞分化通路(数据未显示),提示其可能是AIH发病的关键因素。gydF4y2Ba
DEPs通路富集分析。gydF4y2Ba一个gydF4y2Ba路径富集分析截图如图所示。显示了前20个富集通路术语。p值表示通路项的富集水平,取值范围为0 ~ 1。p值越小,强度越大。Rich Factor是在通路项中标注的差异表达蛋白数量与在该通路项中标注的所有蛋白数量之比。富因子越大,密集程度越高。gydF4y2BabgydF4y2Ba路径项的网络分析。十个紫色的球代表前10个重要的KEGG路径。红色和蓝色的球分别代表上调和下调的dep。球越大,表示相关途径的富集水平越高。不同颜色的边表示KEGG通路分析中的类别(sp数表示蛋白质的瑞士质子号;基因名称和物种也显示在球上;橙色:新陈代谢;绿色:遗传信息处理;紫色:人类疾病)gydF4y2Ba
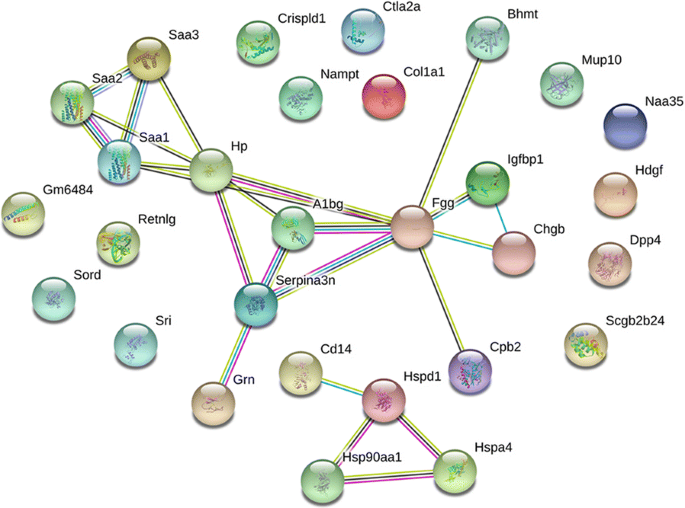
重要DEPs之间的蛋白质-蛋白质相互作用gydF4y2Ba
蛋白质通常通过与其他分子相互作用而起复合体的作用。为了检测新的生物标志物并确定它们之间的潜在相互作用,我们首先关注了几种重要的分泌DEPs。这些dep的折叠变化和相应的基因名称列在附加文件中gydF4y2Ba8gydF4y2Ba:表S6。我们使用STRING数据库分析这些dep的已知和预测PPIs (gydF4y2Bahttp://www.string-db.orggydF4y2Ba) [gydF4y2Ba26gydF4y2Ba].然后,我们绘制了一个PPIs的地图(图。gydF4y2Ba8gydF4y2Ba).这些蛋白质可以通过已知或预测的相互作用相互作用。例如,SAA1、SAA2和SAA3彼此具有同源性,可能与HP共表达。根据策展数据库,SAA3可能与SAA1或SAA2结合使用。A1BG似乎是所列dep的中心、中介环节。此外,HSP家族成员如hsp60、HSP90与CD14形成了另一种相互作用图谱。基于我们的研究结果,我们得出结论,这些重要的蛋白质可能在AIH的发病机制中起着至关重要的作用,并且可能相互影响或相互作用。gydF4y2Ba
AIH患者血浆中DEPs的验证gydF4y2Ba
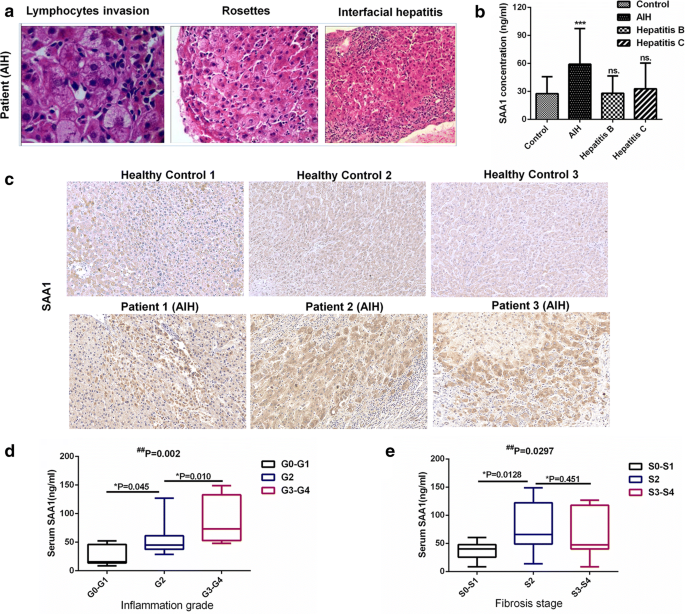
为了进一步验证在AIH小鼠中检测到的DEPs是否在人类患者中发生变化,我们收集了30名AIH患者、30名乙型肝炎患者、30名丙型肝炎患者和30名健康人(对照组)的血浆。AIH患者采用IAIHG评分进行诊断,所有患者均有肝活检结果。AIH患者的典型病理特征如淋巴细胞侵袭、玫瑰花结、界面肝炎如图所示。gydF4y2Ba9gydF4y2Baa. ELISA结果显示,AIH患者血浆SAA1表达与健康人存在显著性差异(图。gydF4y2Ba9gydF4y2Bab). AIH患者血浆SAA1水平普遍高于健康人。然而,在乙型肝炎和丙型肝炎患者中,SAA1的血浆水平并没有升高。我们还通过免疫化学分析检测AIH患者肝组织中SAA1的表达(图。gydF4y2Ba9gydF4y2Bac). SAA1在肝细胞细胞质中表达,并分泌到细胞外间隙。接下来,我们根据AIH患者的肝活检结果将其分为不同的组。根据肝脏炎症分期,将患者分为三组:不存在或仅存在门静脉炎症(G0-G1)、轻度界面肝炎(G2)和中度或重度界面肝炎(G3-G4)。根据肝纤维化程度,将患者分为无或轻度纤维化(S0-S1)、中度纤维化(S2)、重度纤维化或肝硬化(S3-S4)三组。并检测各组AIH患者血浆中SAA1的表达。在比较血浆SAA1水平时,我们发现不同级别炎症之间存在显著差异。gydF4y2Ba9gydF4y2Bad).总体而言,AIH合并中重度界面肝炎(G3-G4)患者血浆SAA1水平高于不存在或仅存在门脉炎症(G0-G1)患者。然而,尽管与无或轻度纤维化患者相比,中度纤维化患者血浆SAA1水平升高,但在S2和S3-S4组之间并无明显差异(图4)。gydF4y2Ba9gydF4y2Bae),表明它们不能准确预测AIH患者的纤维化水平。gydF4y2Ba
AIH患者的重要DEPs验证。gydF4y2Ba一个gydF4y2BaAIH患者肝组织切片代表性H&E染色。gydF4y2BabgydF4y2Ba收集AIH患者、乙型肝炎患者、丙型肝炎患者及健康人血浆,ELISA检测SAA1在血浆中的表达水平(n = 30, ***P < 0.001)。gydF4y2BacgydF4y2Ba示人肝组织免疫组化染色检测SAA1 (n = 3, ×200放大)。gydF4y2BadgydF4y2Ba不同炎症级别AIH患者血浆SAA1水平箱线图(G0-G1组n = 7, G2组n = 14, G3-G4组n = 8,gydF4y2Ba#gydF4y2BaKruskal-Wallis非参数检验* Mann-Whitney检验)。每个方框中间的线代表中间值。方框的长度表示水平范围。gydF4y2BaegydF4y2Ba不同纤维化阶段AIH患者血浆SAA1水平的箱线图(S0-S1组n = 14, S2组n = 8, S3-S4组n = 7,gydF4y2Ba#gydF4y2BaKruskal-Wallis非参数检验* Mann-Whitney检验gydF4y2Ba
讨论gydF4y2Ba
AIH是一种器官特异性疾病,其特征是对肝细胞的自身免疫攻击[gydF4y2Ba27gydF4y2Ba].AIH的确切发病机制和相关机制尚不清楚。糖皮质激素联合或不联合硫唑嘌呤是AIH患者的标准临床治疗方法。AIH在大多数情况下对免疫抑制剂有良好的反应;然而,如果治疗延迟,则与不良预后有关[gydF4y2Ba28gydF4y2Ba].因此,AIH的早期干预和准确诊断至关重要。然而,肝脏炎症和纤维化的严重程度很大程度上取决于肝活检。近年来,关于识别AIH生物标志物的研究有所增加,但由于AIH诊断困难,且缺乏稳定的慢性AIH动物模型,这方面的研究数量有限[gydF4y2Ba29gydF4y2Ba].1992年,Tiegs等人用ConA建立了t细胞介导的急性肝炎小鼠模型。然而,在该模型中,没有慢性炎症、进行性纤维化和自身抗体的产生。因此,为了更全面地了解AIH的发病机制,需要合适的小鼠模型。gydF4y2Ba
2008年,Christen等人利用表达人的腺病毒干扰小鼠肝脏免疫耐受,首次建立了AIH小鼠模型gydF4y2BaCYP2D6gydF4y2Ba[gydF4y2Ba13gydF4y2Ba],已被鉴定为抗lkm -1抗体识别的肝细胞表面抗原。然而,几年后,Matthias等人的结果与Christen等人的结果有所不同,Christen等人在腺病毒感染诱导小鼠后未观察到AIH [gydF4y2Ba10gydF4y2Ba].虽然腺病毒具有较高的转导效率,但其转基因表达是短暂的。此外,腺病毒可诱导强烈的免疫原性反应;因此,注射多种腺病毒可能会干扰AIH的发病机制。考虑到这些因素,我们将阴性腺病毒载体一次性注射到小鼠体内,诱导急性炎症反应,使小鼠对自身抗原敏感。接下来,我们进行转染gydF4y2BaCYP2D6gydF4y2Ba基因多次注入小鼠肝细胞gydF4y2BaCYP2D6gydF4y2Ba质粒经小鼠尾静脉注射,基于流体动力学技术[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].在我们的小鼠模型中观察到持续的肝脏炎症,表现为细胞浸润、肝纤维化和坏死。更重要的是,荧光图像显示我们的AIH小鼠模型中的自身抗体与2型AIH患者相似。gydF4y2Ba4gydF4y2Baa).这些证据证明我们的AIH小鼠模型能够模拟人体内AIH的发病机制和临床特征;因此,它可能是AIH研究的有用工具。gydF4y2Ba
AIH的早期诊断和治疗可使患者预后良好。抗lkm -1、抗ana和抗sma等自身抗体的检测是IAIHG制定的AIH诊断标准的重要组成部分[gydF4y2Ba15gydF4y2Ba].然而,这些自身抗体对AIH并不是特异性的,也可在许多其他自身免疫性肝病中检测到,如原发性胆汁性肝硬化、原发性硬化性胆管炎[gydF4y2Ba31gydF4y2Ba],以及病毒性肝炎[gydF4y2Ba32gydF4y2Ba].因此,识别AIH诊断特异性的新生物标志物至关重要。在过去的几十年里,已经报道了一些基于蛋白质组学的分析,以确定AIH的潜在血清学标记[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].Ballot等人通过蛋白质组学分析首次发现异质核核糖核蛋白A2/B1作为1型AIH的自身抗原[gydF4y2Ba33gydF4y2Ba].在另一项研究中,通过基于血清蛋白质组学的分析,磷酸甘油酸突变酶同工酶B (pgama -B)也被确定为AIH的生物标志物[gydF4y2Ba19gydF4y2Ba].此外,Hongbin等人在cona诱导的肝炎小鼠模型中对AIH进行血清蛋白质组学分析,发现cona诱导的肝炎小鼠和AIH患者的补体第三成分(C3)和α -2-巨球蛋白(A2M)水平均升高[gydF4y2Ba29gydF4y2Ba].然而,由于患者的异质性以及从患者身上采集血液样本进行分析的数量的限制,进行的研究很少。gydF4y2Ba
在本研究中,我们从我们的AIH小鼠模型中收集血浆,使用IBT技术检测DEPs,然后在AIH患者中证实了这些发现。通过pathway和GO分析,对AIH的发病机制有了新的认识。通过GO分析,我们发现大多数DEPs参与了结合、细胞和代谢过程,这些过程可能在免疫过程和AIH发病过程中发挥重要作用。基于DEPs的最重要的代谢途径是精氨酸生物合成途径。当遇到入侵的病原体时,精氨酸在宿主防御中至关重要;会影响Th1/Th2反应的平衡[gydF4y2Ba34gydF4y2Ba].研究表明新陈代谢的增加gydF4y2BalgydF4y2Ba-精氨酸可导致淋巴细胞反应受损[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].此外,精氨酸在特定蛋白质环境下的修饰可导致特定的b细胞免疫反应,这与抗体的产生密切相关[gydF4y2Ba37gydF4y2Ba].这些数据表明,一些代谢过程也可能在AIH的发病机制中发挥作用,这是一个以前很少研究的方面。然而,最重要的途径是蛋白酶体途径,它涉及的dep数量第二高(附加文件)gydF4y2Ba5gydF4y2Ba:表S5)。蛋白酶体途径参与许多基本的细胞功能,如蛋白QC、免疫反应、细胞信号转导和凋亡[gydF4y2Ba38gydF4y2Ba].越来越多的证据表明蛋白酶体抑制剂干扰抗原的加工和呈递,以及抗体的产生。此外,它们还阻断了免疫细胞功能和生存中的信号级联[gydF4y2Ba39gydF4y2Ba].在临床实践中,蛋白酶体抑制剂已用于多种自身免疫性疾病的治疗[gydF4y2Ba40gydF4y2Ba].因此,从这些结果来看,我们认为蛋白酶体抑制剂也可能是未来治疗AIH的新策略。gydF4y2Ba
基于对DEPs的分析,我们发现血清淀粉样蛋白A家族的成员(SAA1, SAA2和SAA3)是最丰富的DEPs(附加文件)gydF4y2Ba8gydF4y2Ba:表S6)。SAA蛋白代表了一个急性期应答蛋白家族[gydF4y2Ba41gydF4y2Ba].SAA1是最广泛表达、最具特征和最活跃的SAA蛋白,它是肝细胞的组成部分,并由肝细胞分泌[gydF4y2Ba20.gydF4y2Ba].近年来,SAA1被发现在细菌清除、免疫调节和肿瘤发病机制中发挥关键作用[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba],也被认为是炎症性肠病患者黏膜T细胞、微生物群落及其组织环境之间的重要联系[gydF4y2Ba44gydF4y2Ba].基于iTRAQ的分析显示,SAA1在hbv相关HCC中上调[gydF4y2Ba45gydF4y2Ba].此外,SAA1和HP在我们的结果中发现上调的DEPs,在早期肝硬化患者的HCC监测中发挥重要作用[gydF4y2Ba46gydF4y2Ba].Young等进一步利用SAA1转基因小鼠模型,发现SAA1加重cona诱导的T细胞介导的肝炎。然而,SAA1在慢性肝炎中的作用尚未明确阐明。我们的结果显示,SAA1在AIH小鼠中的表达比正常小鼠高3倍。我们还在AIH患者的血浆和肝脏组织中验证了这一发现,这表明SAA1可能确实参与了AIH相关的免疫疾病。此外,与患有乙型肝炎和丙型肝炎的患者相比,AIH患者中SAA1的增加更为特异性(图2)。gydF4y2Ba9gydF4y2Bac)根据改良的Scheuer组织学评分系统,SAA1水平越高,炎症越严重。SAA1在伴有严重纤维化的AIH患者中也可能增加,但它可能不能准确预测纤维化的状态。结合我们的结果和上述描述,我们推测SAA1可能作为AIH患者潜在的血浆生物标志物。但是,考虑到AIH的病因和机制复杂,需要进一步的研究来加强本研究的结果。gydF4y2Ba
结论gydF4y2Ba
综上所述,这些蛋白质组学结果为AIH的诊断、发病机制和治疗提供了一些新的思路。此外,我们进一步证实了我们研究中最显著的DEPs SAA1在AIH患者血浆中升高,可能是AIH临床诊断的生物标志物。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在本研究过程中产生或分析的主要数据包括在本手稿及其附加文件中。本文中提到的其他蛋白质组学数据可根据合理要求从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- AIH:gydF4y2Ba
-
自身免疫性肝炎gydF4y2Ba
- 中国人民银行:gydF4y2Ba
-
原发性胆汁性肝硬化gydF4y2Ba
- IAIHG:gydF4y2Ba
-
国际自身免疫性肝炎组织gydF4y2Ba
- CYP2D6:gydF4y2Ba
-
细胞色素P450 2D6gydF4y2Ba
- Ad-2D6:gydF4y2Ba
-
表达人细胞色素P450 2D6的腺病毒gydF4y2Ba
- pCYP2D6:gydF4y2Ba
-
细胞色素P450 2D6质粒gydF4y2Ba
- ConA:gydF4y2Ba
-
伴刀豆球蛋白一gydF4y2Ba
- 安娜:gydF4y2Ba
-
抗核抗体gydF4y2Ba
- AMA:gydF4y2Ba
-
anti-mitochondrial抗体gydF4y2Ba
- LKM-1:gydF4y2Ba
-
抗肝肾微粒体抗体gydF4y2Ba
- MHC:gydF4y2Ba
-
主要组织相容性复合体gydF4y2Ba
- 应付托福考试:gydF4y2Ba
-
等压标签gydF4y2Ba
- iTRAQ:gydF4y2Ba
-
等压标签的相对和绝对定量gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因和基因组百科全书gydF4y2Ba
- 部:gydF4y2Ba
-
不同的表达蛋白gydF4y2Ba
- 南非航空公司:gydF4y2Ba
-
血清淀粉样蛋白a1gydF4y2Ba
- HSP:gydF4y2Ba
-
热休克蛋白gydF4y2Ba
- A2M:gydF4y2Ba
-
alpha-2-macroglobulingydF4y2Ba
- C3:gydF4y2Ba
-
补体成分gydF4y2Ba
参考文献gydF4y2Ba
Czaja AJ。自身免疫性肝炎的发生和结局的全球差异及其意义中国生物医学工程学报,2017;gydF4y2Ba
Manns MP, Lohse AW, Vergani D.自身免疫性肝炎更新2015。中国肝病杂志2015;62:S100-11。gydF4y2Ba
Heneghan MA, McFarlane IG。小鼠和女性:自身免疫性肝炎的小鼠模型。肝脏病学。2005;42:17-20。gydF4y2Ba
叶涛,王涛,杨霞,范霞,文敏,沈勇,席霞,门荣,杨玲。刀豆素a诱导小鼠自身免疫性肝炎模型的比较。细胞物理与生物化学。2018;46:1241-51。gydF4y2Ba
Kato J, Okamoto T, Motoyama H, Uchiyama R, Kirchhofer D, Van Rooijen N, Enomoto H, Nishiguchi S, Kawada N, Fujimoto J, Tsutsui H.干扰素- γ介导的组织因子表达通过诱导小鼠高凝参与T细胞介导的肝炎。肝脏病学。2013;57:362 - 72。gydF4y2Ba
李志强,李志强,李志强,等。干扰素γ在肝损伤中的作用。中华胃肠病学杂志,1996;gydF4y2Ba
Nakaya M, Hashimoto M, Nakagawa R, Wakabayashi Y, Ishizaki T, Takada I, Komai K, Yoshida H, Yoshimura A. T和NKT细胞中的SOCS3负向调节细胞因子的产生并改善cona诱导的肝炎。中华免疫杂志2009;183:7047-53。gydF4y2Ba
张志强,张志强,张志强,等。刀豆碱诱导小鼠肝损伤的实验研究。中华临床医学杂志,1999,20(3):369 - 369。gydF4y2Ba
Webb GJ, Hirschfield GM, Krawitt EL, Gershwin ME。自身免疫性肝炎的细胞和分子机制。《病理学年鉴》2018;13:247-92。gydF4y2Ba
Hardtke-Wolenski M, Dywicki J, Fischer K, Hapke M, Sievers M, Schlue J, Anderson MS, Taubert R, Noyan F, Manns MP, Jaeckel E.遗传易感和自身免疫性肝炎诱导抗原在疾病发展中的影响。《中国科学》,2017;78:39-45。gydF4y2Ba
Liberal R, Krawitt EL, Vierling JM, Manns MP, Mieli-Vergani G, Vergani D.自身免疫性肝炎前沿问题。《中国科学》2016;75:6-19。gydF4y2Ba
Yuksel M,王勇,Tai N, Peng J,郭杰,Beland K, Lapierre P, David C, Alvarez F, Colle I,等。一种新型的自身免疫性肝炎“人源化小鼠”模型以及肠道菌群与肝脏炎症的关系。肝脏病学。2015;62:1536-50。gydF4y2Ba
Holdener M, Hintermann E, Bayer M, Rhode A, Rodrigo E, Hintereder G, Johnson EF, Gonzalez FJ, Pfeilschifter J, Manns MP,等。病毒感染打破对人肝脏自身抗原细胞色素P450 2D6的耐受性。中华实验医学杂志2008;205:1409-22。gydF4y2Ba
Yuksel M, Xiao X, Tai N, Vijay GM, Gulden E, Beland K, Lapierre P, Alvarez F, Hu Z, Colle I,等。人白细胞抗原- dr4非肥胖糖尿病小鼠自身免疫性肝炎模型的诱导临床免疫学杂志,2016;186:164-76。gydF4y2Ba
Hennes EM, Zeniya M, Czaja AJ, Pares A, Dalekos GN, Krawitt EL, Bittencourt PL, Porta G, Boberg KM, Hofer H,等。自身免疫性肝炎的简化诊断标准。肝脏病学。2008;48:169 - 76。gydF4y2Ba
李志强,李志强,李志强。自身免疫性肝病中自身抗体的临床和诊断意义。前沿免疫,2018;9:609。gydF4y2Ba
Bowlus CL, Seeley EH, Roder J, Grigorieva J, Roder H, Caprioli RM, Gershwin M.原位质谱分析自身免疫性肝病。细胞免疫杂志2011;8:237-42。gydF4y2Ba
Tahiri F, Le Naour F, Huguet S, Lai-Kuen R, Samuel D, Johanet C, Saubamea B, Tricottet V, duclo - vallee JC, Ballot E.利用蛋白质组学工具鉴定自身免疫性1型肝炎的质膜自身抗原。肝脏病学。2008;47:937-48。gydF4y2Ba
陆飞,夏强,马勇,袁刚,闫红,钱林,胡敏,王敏,陆红,王辉,等。基于血清蛋白质组学的分析鉴定自身免疫性肝炎的潜在血清学标记物。生物化学与生物物理学报。2008;367:284-90。gydF4y2Ba
Sack GH Jr.血清淀粉样蛋白a综述。Mol medical . 2018;24:46。gydF4y2Ba
池烨,金海杰,裴凯波,李山,金默,柳志智。肝血清淀粉样蛋白A1通过toll样受体2诱导趋化因子加重小鼠T细胞介导的肝炎中国生物化学杂志,2015;29:12804 - 11。gydF4y2Ba
闫松,付强,周勇,王娟,刘勇,段鑫,贾松,彭杰,高斌,杜娟,等。通过眶窦后水动力注射裸质粒DNA,在成年小鼠、新生小鼠和树鼩的肝细胞中获得高水平的基因表达。J Control Release, 2012;gydF4y2Ba
文斌,周荣,冯强,王强,王娟,刘松。基于等压标记的蛋白质组学定量自动化管道。蛋白质组学。2014;14:2280-5。gydF4y2Ba
Savitski MM, Wilhelm M, Hahne H, Kuster B, Bantscheff M.一种可扩展的蛋白质组学数据集蛋白质错误发现率估计方法。中国生物医学工程学报。2015;14:2394-404。gydF4y2Ba
Scheuer PJ, Standish RA, Dhillon AP.慢性肝炎评分。临床肝病杂志2002;6:335-47。gydF4y2Ba
von Mering C, Jensen LJ, Snel B, Hooper SD, Krupp M, Foglierini M, Jouffre N, Huynen MA, Bork P. STRING:已知和预测的蛋白质-蛋白质关联,在生物间整合和转移。核酸研究,2005;33:D433-7。gydF4y2Ba
Taubert R, Hupa-Breier KL, Jaeckel E, Manns MP。自身免疫性肝炎的新治疗靶点中国机械工程学报,2018;gydF4y2Ba
Malekzadeh R, Mohamadnejad M, Nasseri-Moghaddam S, Rakhshani N, Tavangar SM, Sohrabpour AA, Tahaghoghi S.自身免疫性肝炎肝硬化的可逆性。中华医学杂志2004;117:125-9。gydF4y2Ba
李海林,赵霞,吴勇,马伟,刘勇,龚峰,梁松。小鼠与患者自身免疫性肝炎互补血清蛋白质组学分析。《翻译医学》2013;11:46。gydF4y2Ba
希克曼MA,马龙RW,莱曼-布鲁因斯马K,西赫TR,克诺尔D,斯卡FC,瓦尔泽姆R,卡尔森DM,鲍威尔JS。DNA直接注入肝脏后的基因表达。胡姆·吉恩·瑟,1994;5:1477-83。gydF4y2Ba
胆汁淤积性肝病中自身抗体的意义。临床肝病杂志2016;20:33-46。gydF4y2Ba
陈志伟,陈志伟,陈志伟,等。病毒性肝炎的自身免疫表现。中国生物医学工程杂志,2013;gydF4y2Ba
Huguet S, Labas V, Duclos-Vallee JC, Bruneel A, Vinh J, Samuel D, Johanet C, Ballot E.异质核核糖核蛋白A2/B1在自身免疫性肝炎中的作用蛋白质组学。2004;4:1341-5。gydF4y2Ba
郭戈文,陈志伟,陈志伟。精氨酸代谢在建立发病机制中的双重作用。《微生物学杂志》2016;29:43-8。gydF4y2Ba
勃朗特V, Zanovello P.免疫反应的调节gydF4y2BalgydF4y2Ba精氨酸代谢。中华免疫杂志2005;5:641-54。gydF4y2Ba
波波维奇PJ,泽HJ III,奥乔亚JB。精氨酸和免疫力杨文华,2007;gydF4y2Ba
van Boekel MAM, van Venrooij WJ。精氨酸的修饰及其在自身免疫中的作用。Autoimmun Rev. 2003; 2:57-62。gydF4y2Ba
Kammerl IE, Meiners S.蛋白酶体功能形成先天和适应性免疫反应。中国生物医学工程杂志,2016;31(2):344 - 344。gydF4y2Ba
Moran E, Carbone F, Augusti V, Patrone F, Ballestrero A, Nencioni A.蛋白酶体抑制剂作为免疫抑制剂:生物学原理和临床经验。《中华血液学杂志》2012;49:270-6。gydF4y2Ba
吴娟。论蛋白酶体在细胞生物学中的作用及蛋白酶体抑制作为免疫抑制剂发展的新前沿。中华外科杂志。2002;2:904-12。gydF4y2Ba
Getz GS, Krishack PA, Reardon CA.血清淀粉样蛋白A与动脉粥样硬化。Curr Opin Lipidol, 2016; 27:531-5。gydF4y2Ba
孙玲,叶仁仁。血清淀粉样蛋白A1的结构、功能及基因多态性。基因。2016;583:48-57。gydF4y2Ba
Hansen MT, Forst B, Cremers N, Quagliata L, Ambartsumian N, Grum-Schwensen B, Klingelhofer J, Abdul-Al A, Herrmann P, Osterland M,等。炎症和转移之间的联系:血清淀粉样蛋白A1和A3诱导转移,是诱导转移的S100A4的靶标。致癌基因。2015;34:424-35。gydF4y2Ba
Tang MS, Bowcutt R, Leung JM, Wolff MJ, Gundra UM, Hudesman D, Malter LB, pole MA, Chen LA, Pei Z,等。炎症性肠病患者活检的综合分析确定SAA1是粘膜微生物与TH17和TH22细胞之间的联系。肠炎,2017;23:1544-54。gydF4y2Ba
何欣,王颖,张伟,李红,罗蓉,周颖,廖丽梅,黄红,吕霞,谢震,何敏。应用iTRAQ-MALDI-MS /MS筛查afp阴性hbv相关肝细胞癌血清蛋白差异表达。赘生物。2014;61:17-26。gydF4y2Ba
舒鸿科,康鑫,郭凯,李松,李敏,孙玲,甘霖,刘艳,秦霞。血清结合珠蛋白作为α胎蛋白补充的肝癌候选标志物的诊断价值。Oncol代表2010;24:1271-6。gydF4y2Ba
确认gydF4y2Ba
作者对患者愿意参与本研究表示感谢。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金资助项目(81600448)冯欣霞(81600448),田院长(81974071)gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
DT设计了整个研究;XF和ZF参与AIH小鼠模型设计;HW进行主要研究,分析数据;YG协助进行动物实验;LZ对人体样本采集有贡献;WY和HW写了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
本研究方案经华中科技大学同济医学院同济医院伦理委员会批准,所有参与研究的患者均提供书面知情同意书。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
AIH小鼠模型建立示意图。向上的箭头为尾静脉注射时间,向下的箭头为小鼠牺牲时间。gydF4y2Ba
附加文件2:表S1。gydF4y2Ba
聚合酶链反应引物序列。gydF4y2Ba
附加文件3:图S2。gydF4y2Ba
对照组小鼠模型代表性H&E染色图(放大200×和400×)gydF4y2Ba
附加文件4:表S2-S4。gydF4y2Ba
细胞成分(表S2)、分子功能(表S3)、生物过程(表S4)中GO极显著富集项(P值< 0.01)。gydF4y2Ba
附加文件5:表S5。gydF4y2Ba
DEPs涉及显著KEGG通路(p值< 0.05)。gydF4y2Ba
附加文件6:图S3。gydF4y2Ba
一个gydF4y2Ba)所有dep通路分析的条形图。gydF4y2BaBgydF4y2Ba)显著通路中DEPs的上调和下调。红色表示上调蛋白,蓝色表示下调蛋白;x轴显示路径名称;y轴为差异表达蛋白的计数。gydF4y2Ba
附加文件7:图S4。gydF4y2Ba
抗原加工和呈递的通路图。红色表示上调DEPs,绿色表示下调DEPs。gydF4y2Ba
附加文件8:表S6。gydF4y2Ba
图中列出的dep的描述和平均比例。gydF4y2Ba8gydF4y2Ba.AIH小鼠组与正常小鼠组进行比较。Mean Ratio, SD, P-value代表AIH小鼠与正常小鼠经IBT处理后的统计数据(n = 5)。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
王宏,严,伟,冯,珍。gydF4y2Baet al。gydF4y2Ba改良AIH小鼠自身免疫性肝炎血浆蛋白质组学分析gydF4y2Ba翻译医学杂志gydF4y2Ba18gydF4y2Ba, 3(2020)。https://doi.org/10.1186/s12967-019-02180-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12967-019-02180-3gydF4y2Ba
关键字gydF4y2Ba
- 自身免疫性肝炎gydF4y2Ba
- 小鼠模型gydF4y2Ba
- 蛋白质组gydF4y2Ba
- KEGGgydF4y2Ba
- SAA1gydF4y2Ba