摘要
背景
肾移植越来越多地与血脂异常等共病因素相关,这可能会影响移植结果。我们假设高胆固醇血症可能通过抗血管生成血栓反应蛋白-1的过度表达与血管内皮生长因子-a水平相互作用而影响血管修复过程并促进移植后肾血管重塑。
方法
我们在体外、体内和人类队列中测试了这一假设,使用(1)内皮细胞;(2)肾自动移植猪(n = 5)或不(n = 6)给予高胆固醇饮食;(3)肾移植患者队列(16例)。
结果
暴露于氧化LDL的细胞显示增殖减少和血栓反应蛋白-1表达增加。在猪肾移植3个月后,我们观察到在高胆固醇饮食动物中诱导的缺氧诱导因子1a -血管内皮生长因子- a轴的失调,同时伴有血栓反应蛋白-1的过表达和促进血管重塑的皮质微血管密度的降低。在患者中,高胆固醇血症与肾移植术后早期随访中血管内皮生长因子- a血浆水平下降和慢性移植物功能障碍增加有关。
结论
这些结果支持了高脂肪饮食阻碍移植肾血管修复的潜在机制,并提示即使在肾移植早期控制受者胆固醇血症的价值。
背景
在肾移植方面,由于人口老龄化,老年受者的增加加剧了目前的器官短缺,促进了平均供体年龄的提高。这些增加引起了可能影响肾移植结果的共病因素的更高流行率。在移植过程中,移植肾不可避免地遭受缺血再灌注损伤。I/R在确定再生或有害通路与不可逆移植物结果规划之间的平衡方面发挥的关键作用,意味着确定可能早期与移植物生存能力相互作用的因素或共发病因素至关重要。
心血管疾病的危险因素,如糖尿病、高血压和血浆低密度脂蛋白(LDL)水平升高,在肾脏疾病的进展以及移植或肾动脉狭窄损伤中都有很好的记录[1].高脂血症的高患病率,加上使用老年供体和免疫抑制剂的高脂血症作用,加强了高胆固醇血症与肾移植之间的联系[2,3.].因此,考虑到移植物对受体环境的后续暴露时间,受体的高脂血症与钙调神经磷酸酶或mTOR抑制剂的暴露有关。一般来说,高胆固醇血症与氧化低密度脂蛋白(OxLDL)的全身水平升高有关,众所周知,氧化低密度脂蛋白与内皮细胞功能障碍有关[4,5].肾微循环是I/R损伤的关键靶标之一,在早期再生阶段起着至关重要的作用,但通过增殖、再生和毛细血管损失之间的复杂相互作用,它也在慢性肾病的延伸中发挥着重要作用[6,7,8].在健康器官中,血管内皮细胞通过释放自分泌信号分子,如血管内皮生长因子- a (VEGF-A),免受中度损伤[9].然而,I/R引起的内皮损伤会影响这种再生反应[10,11].
此前,Cui等人报道了血栓反应蛋白-1 (TSP-1)作为高脂饮食诱导的以巨噬细胞浸润和纤维化发展为特征的小鼠肾功能障碍的重要中介物的作用[12].TSP-1也参与了肾脏I/R诱导的许多有害过程,但对其在肾移植结果中的影响以及TSP-1与OxLDL之间的联系知之甚少[13].TSP-1是一种与不同受体相互作用的基质细胞糖蛋白,具有多种功能,包括促进凝块形成或纤维化,也被称为通过不同机制抑制血管生成,如与VEGF-A水平相互作用或调节NO可用性,这可能会阻止肾脏修复[14].
本研究旨在确定高胆固醇血症,特别是氧化低密度脂蛋白(OxLDL)在肾移植I/R损伤后早期血管再生过程中的作用,这与血脂异常引起的动脉粥样硬化慢性损伤不同。我们推测OxLDL可能通过刺激TSP-1的表达并影响VEGF-A的产生来阻碍I/R诱导的保护性血管生成机制。
方法
OxLDL在人主动脉内皮细胞上的体外培养
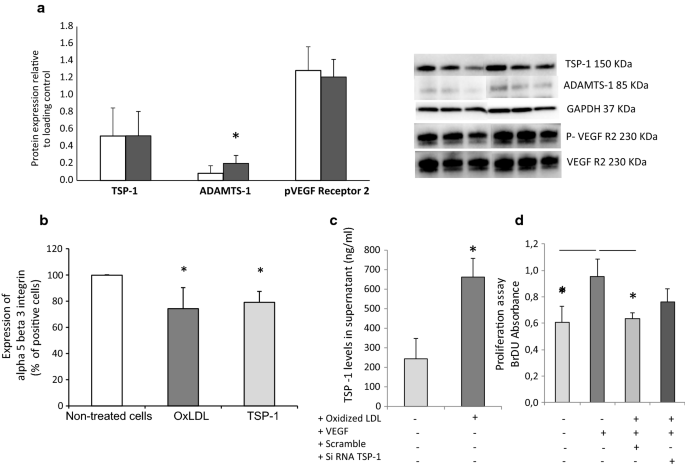
OxLDL对人主动脉内皮细胞(HAEC)的影响分别在添加或不添加OxLDL (25 μg/mL)的培养基中处理24 h。简单地说,从Gibco (Saint Aubin, France)获得的HAEC在添加10%胎牛血清(Invitrogen, Saint Aubin, France)的medium 200 (M200, Gibco)中培养,在5% CO的潮湿气氛中培养237°C。细胞血清饥饿12 h后处理。处理后,去除条件培养基,收集细胞进行蛋白印迹分析,检测TSP-1(1/500,圣克鲁斯生物技术,圣克鲁斯,加利福尼亚州,美国)、ADAMTS-1(1/500,圣克鲁斯生物技术,圣克鲁斯,加利福尼亚州,美国)、PhosphoVEGF-R2(1/1000,细胞信号,莱顿,荷兰)和VEGF-R2(1/1000,细胞信号,莱顿,荷兰)的蛋白表达。采用ELISA试剂盒(RnD Systems, Minneapolis, USA)测定上清液中的TSP-1水平。流式细胞仪分析了alpha5beta3整合素在HAEC细胞上的表达(1/100,Millipore, Billerica,马萨诸塞州,美国)。重组人TSP-1(0.5µg/ml;研究了RD System, Lille, France)对alpha5beta3整合素蛋白表达的影响。细胞增殖采用BrDU试验(细胞增殖ELISA, BrDU, Roche, USA),遵循制造商指南,在重组VEGF (Gibco)和SiRNa靶向TSP-1 (Qiagen, Courtaboeuf, France)存在的情况下,用添加或不添加OxLDL的培养基处理细胞24小时。
动物模型和手术程序
雄性大白猪(Sus Scrofa)在断奶后立即喂食标准或高脂肪饲料(标准饲料+ 20%猪油和2%胆固醇),并维持至安乐死,即在先前研究中描述的移植后3个月[1,15].根据实验动物使用和护理机构委员会(CEEA Poitou-Charentes CE2012-4)的规定,在断奶2个月后进行肾自体移植模型[16].简单地,取左肾,用300 ml UW保存液冲洗,4℃相同溶液静态保存24 h。移植当天,取右肾,模拟移植情况下肾元块移植左肾。研究了两个实验组:正常饮食:术后3个月从喂食标准饮食的动物身上收集移植肾(n = 6),高脂肪饮食:术后3个月从喂食高脂肪饮食的动物身上收集移植肾(n = 5)。其中一只移植的高脂日粮猪在研究完成前因手术并发症死亡,未纳入数据分析。使用自动分析仪(Modular, Roche diagnostics, Meylan, France)测量尿和血浆肌酐或蛋白尿。肌酐清除率按公式计算:(尿量×尿肌酐水平)/血浆肌酐水平。分别于肾移植前、再灌注后3、7天和1、3个月采集外周血。分别于再灌注后3、7天和1、3个月采集尿液。
Western blotting,免疫组织化学和标准光镜
这些研究对移植肾移植3个月后的肾组织进行,以评估肾微血管和血管重塑的形成和维持机制。我们通过标准的western blotting协议进行了研究[17抗缺氧诱导因子1a (HIF1a, 1/500, BD生物科学,圣何塞,加利福尼亚,美国),VEGF(1/500,圣克鲁斯生物技术),基质细胞衍生因子-1 (SDF-1, 1/1000, Abbiotech,圣地亚哥,加利福尼亚,美国),参与内皮细胞增殖和迁移的因子:基质金属蛋白酶9 (MMP-9, 1/1000, Millipore), alpha5beta3整合素(1/1000,Millipore),和抗血管生成因子:一种具有血栓反应蛋白Motif-1的分解蛋白和金属蛋白酶(adamts - 1,1 /200,圣克鲁斯生物技术)。负荷对照为β肌动蛋白(1/ 20000,Sigma,圣路易斯,密苏里州,美国)。使用AlphaEase FC软件(Alpha Innotech Corporation, San Leandro, CA)显示蛋白带并量化其强度。如前所述,使用半定量分析对皮层样本进行染色评估,并由病理学家和肾脏学家在盲条件下进行检查[18].简单地说,石蜡切片用三色马尾松染色评价小管间质纤维化。采用二氨基联苯胺染色法检测α平滑肌肌动蛋白(αSMA, 1/100, Dako, Stockholm, Sweden)表达。在直径小于500µm的α sma阳性大血管中测量微血管介质与管腔比。采用苏木精-伊红-赛峰(HES)染色评估管状萎缩[19].冷冻切片用于皮质切片免疫荧光检测TSP-1 (1/100, Santa Cruz Biotechnology)、VEGF (1/100, Santa Cruz Biotechnology)、HIF1a (1/100, BD Biosciences)表达,以及巨噬细胞和单核细胞ED-1抗原标记物(1/100,AbD Serotec, Oxford, UK)。
凋亡信号
凋亡肾细胞采用TUNEL方法,使用DeadEnd Fluorometric TUNEL系统(Promega, Fitchburg, Massachusetts, USA),如前所示[20.].
实时定量PCR
我们使用RNA提取试剂盒(Qiagen, Courtaboeuf,法国)。使用无DNA试剂盒(Applied Biosystems, Foster City, California, USA)去除基因组DNA,并进行第一链逆转录(Applied)。实时PCR检测在ABI Prism 7300(应用)上进行,采用猪VEGF和TSP-1 mRNA表达引物(附加文件)1:表S1)。
组织的准备,高分辨率显微计算机断层扫描图像的采集和分析
移植后3个月,取肾移植物,灌注含5000 IU/L肝素的生理盐水。然后,用血管内放射性不透明硅聚合物(Microfil MV122;Flow Tech, Carver,马萨诸塞州,美国)。4°C将肾脏浸泡在福尔马林溶液中,进行圆筒活检(直径:1cm;深度:1.5 cm),用石蜡包裹聚合物填充肾脏。进行高分辨率微计算机断层扫描,然后使用特定算法进行图像重建[21].计算微血管皮层血管段的平均直径和空间密度,如前所述[17,22],空间密度按直径分为小(< 40µm)、中(40 - 80µm)、大(80-120µm)或超大型(> 120µm)血管。
病人
2010年1月至2010年6月,在普瓦捷大学医院移植科对16名肾移植患者进行了一项前瞻性队列研究。第一次或第二次肾移植的成年受者符合入选条件,有优先移植、感染并发症和早期急性移植排斥反应的患者被排除在外。血液样本是在对患者进行正常随访时采集的,并且是匿名的,由于该研究不需要额外的血液样本,根据《公共卫生法》L.1121-1条,法国法律不需要道德委员会的批准。根据《赫尔辛基宣言》,获得每位患者的书面知情同意。我们根据血浆胆固醇水平的阈值1.80 g/L将患者分为两组。根据肾脏疾病配方MDRD中饮食的简化修改,通过尿蛋白排泄和eGFR评估肾功能。于肾移植前0天(D0),术后1、3、7、14天(分别为D1、D3、D7、D14),术后1、3、12个月静脉穿刺采集外周血。在OxLDL (Mercodia, France)和VEGF-A (RD系统)酶联免疫吸附试验(ELISA)定量蛋白质之前,将血浆样本储存在−80°C。
统计数据
结果以均数±标准差表示。当两组之间的方差不相等时,我们使用学生t检验进行两组比较,或者使用曼-惠特尼检验。多组比较采用Kruskal-Wallis检验。费雪精确检验用于比例的统计分析。p < 0.05,差异有统计学意义。
结果
OxLDL对内皮细胞增殖的抑制作用由TSP-1介导
富含oxldl的培养基诱导HAEC中ADAMTS-1的表达,促进上清中TSP-1分泌的增加,而不影响VEGF-R2的磷酸化(图2)。1a, c).在富含OxLDL或补充TSP-1人重组蛋白的培养基中,内皮细胞增殖的标记物——HAEC上的Alpha5beta3整合素表达在两种条件下均有所下降(图5)。1b).有趣的是,SiRNA靶向TSP-1(附加文件2:图S1)限制了在VEGF存在的情况下OxLDL诱导的细胞增殖抑制,强调了TSP-1在这些抑制条件下的作用(图S1)。1d)。
高脂饲料降低肾自动移植猪促血管生成途径
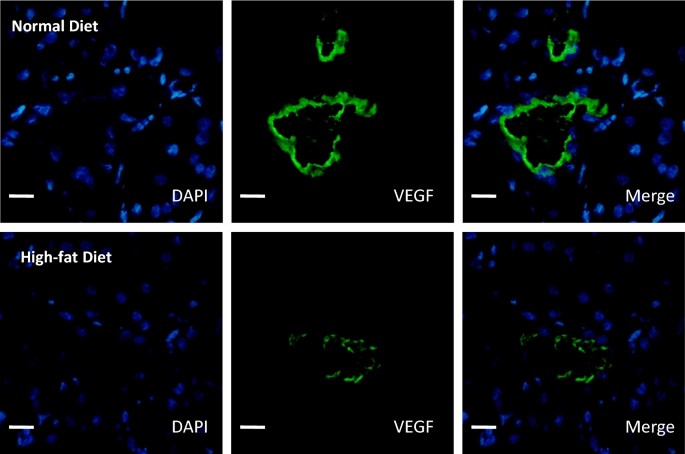
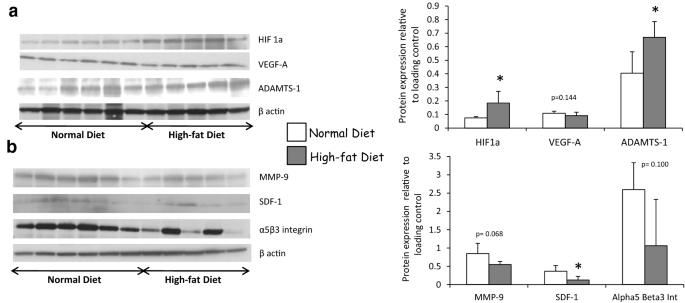
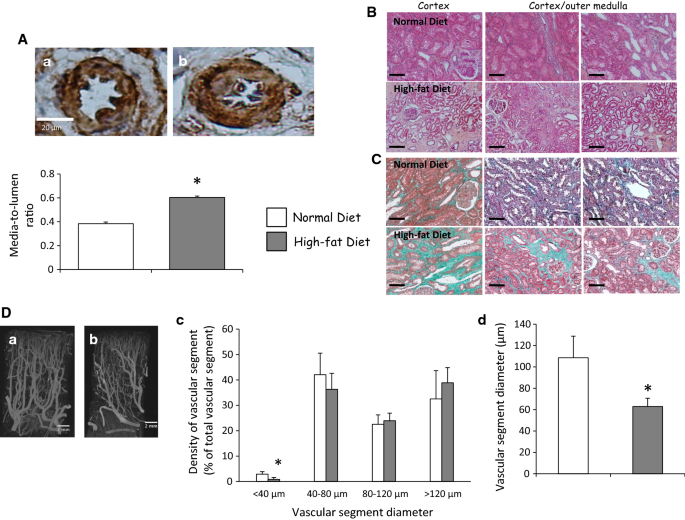
如前所述,在临床相关的猪模型中,即使在手术当天和移植后3个月OxLDL血浆水平显著升高,但在随访的最后一部分,高脂血饮食导致血浆胆固醇水平升高[15].正如先前的报道,只有高脂肪饮食与1个月和3个月时蛋白尿增加有关,而两种实验条件,有或没有高脂肪饮食,都诱导了相似的肌酐清除动力学(表1) [15].体外实验结果表明OxLDL对血管再生过程的影响,我们在再灌注后3个月通过测量这些途径相关蛋白的表达来进一步评估。众所周知,由HIF1a介导的低氧途径可促进VEGF的产生,但高脂饮食取消了这一途径。血脂异常的猪在肾移植3个月后HIF1a表达增加,而VEGF-A表达分别通过western blotting和免疫组化评估保持稳定甚至下降(图2)。2,3.,4a, b,表2,附加文件3.:图S2,附加文件4:图S3)。此外,高脂饮食增加了ADAMTS-1的表达(图。4a)被称为TSP-1通路的激活剂,并降低内皮细胞增殖和迁移相关蛋白的表达,如SDF-1(图。4b).观察到MMP-9和alpha5beta3整合素的趋势(图5)。4b)。
高脂饮食可激活移植肾中TSP-1通路
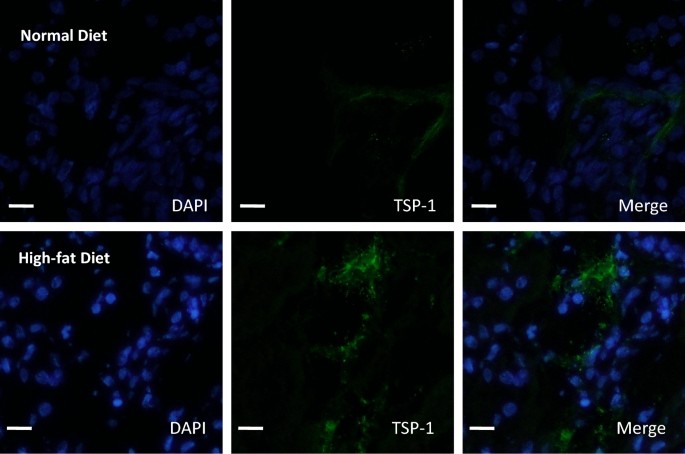
为了研究TSP-1在高脂饮食诱导的HIF1a促血管生成途径抑制中的作用,我们评估了TSP-1在移植肾中的表达。我们观察到高脂饮食组TSP-1蛋白表达增加(图2)。5;表格2,附加文件5:图S4)。免疫组织学观察结果显示,高脂饮食组大鼠间质、小管和肾小球TSP-1染色升高,而肾小球壁细胞TSP-1染色差异不显著(表2)2).高脂饮食不影响VEGF-A和TSP-1 mRNA的表达,这表明这些通路的转录后调控(附加文件)6:图S5)。
高脂饮食诱导移植肾血管和组织重塑
高脂饮食组大血管中膜与管腔比值升高,表明与正常组相比,高脂饮食组大血管重构加剧(图2)。6A)。此外,管状萎缩增加,提示高血脂饮食诱导的有害机制,导致无功能的纤维组织发育,通过三色马尾松染色评估(图。6B, C;表格2)如先前所建议的[15].高分辨率显微计算机断层扫描显示,在高血脂饮食肾移植中,直径小于40µm的血管段密度下降,表明高度微血管损伤(图2)。6D).这些结果得到氨基肽酶染色的支持,表明高血脂饮食组毛细血管密度降低(附加文件)7;额外的文件8:图S6)。在皮层,实验组表现出支持高脂肪饮食刺激的血管重塑的平均血管段直径的减少(图。6D)。这些损伤与促炎环境有关,在血脂异常的猪中,ed1阳性细胞浸润显著增加,细胞凋亡刺激也显著增加。7A、B)。
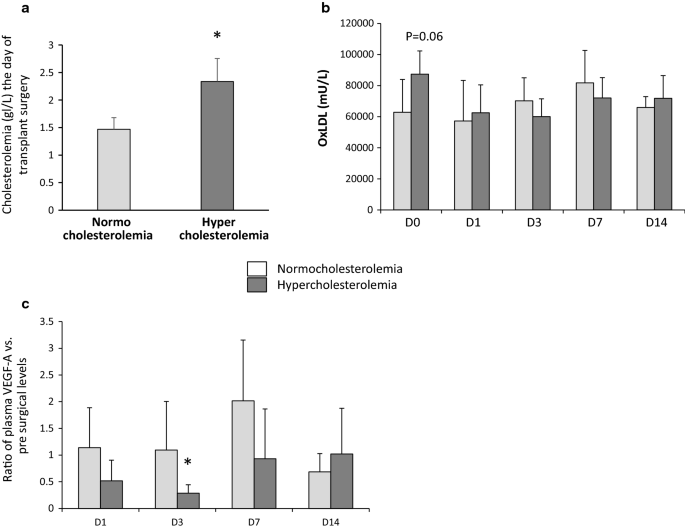
手术当天的高胆固醇血症会影响VEGF-A的分泌,并促进患者的慢性移植物功能障碍
这项单中心研究共招募了16名白种人肾移植受者。受者和同种异体肾移植供者的特征列于表中3..所有患者都接受了来自已故捐赠者的肾移植。在肾移植前一天,我们以1.80 g/L的血浆胆固醇水平为阈值,将患者分为高胆固醇组和正常胆固醇组。8a).随访期间无患者死亡,2例移植物丢失(每组1例)。术前采集的血液样本中OxLDL的测量结果显示高胆固醇血症组较高,但未达到统计学差异(p = 0.061;无花果。8b).有趣的是,我们观察到高胆固醇血症组术后1天血浆VEGF-A水平下降,在D3达到统计学意义,从D7恢复到基础水平(图7)。8c).高胆固醇血症组术前血浆TSP-1水平升高(附加文件)9:图S7)。术后3个月,两组的肾小球滤过率(eGFR)相似。然而,移植后1年,高胆固醇血症组的eGFR显著降低(表2)3.)和尿蛋白排泄增加(表3.).
讨论
肾移植器官短缺有两个主要后果:(1)它迫使移植中心使用来自老年捐献者的器官;(2)它增加了花在等待名单上的时间,因此增加了接受者的平均年龄。这种类型的供体/受体与年龄相关的共发病因素有关,如高血压或高胆固醇血症,对移植结果产生负面影响,并导致患者重新进行透析[23].识别涉及的机制可以改善这些情况下受体的管理,并促进新的治疗策略。此前,Cui等首次从饮食诱导的肥胖小鼠中报道了TSP-1在肾小球系膜和肾小管系统中显著积累的肾脏上调[12].他们还证明了TSP-1缺失可以保护小鼠免受肥胖诱导的肾纤维化[12].在同基因大鼠肾移植模型中也观察到这种有害影响。简而言之,在供体肾脏灌注期间使用的CD47单克隆抗体,可以阻断配体TSP-1与其受体CD47之间的相互作用,诱导移植后生存的显著改善[24].这些结果也在肾缺血再灌注损伤模型中观察到[25].在本研究中,我们在具有较高临床相关性的猪肾移植模型中研究了高脂肪饮食对促血管生成途径抑制和TSP-1表达的早期影响。这使我们能够在没有任何异体反应的情况下专注于I/R损伤,并很容易将结果推断到人类,因为猪和人类肾脏具有相同的多小叶结构和相似的皮质微循环[26].高胆固醇血症与OxLDL循环水平升高有关[4].这些氧化脂蛋白与内皮细胞功能障碍有关[5],是器官移植中最先受到I/R损伤的细胞类型。然而,血管内皮细胞受到自分泌信号分子(如关键的VEGF-A)释放的保护,并且众所周知,血管内皮细胞可以增殖、迁移和再生受损组织[9].在之前的一项研究中,酪氨酸激酶抑制剂舒尼替尼(Sunitinib)可抑制VEGF和PDGF受体,可预防实验性肾移植的慢性排斥变化,并在移植后显著保留肾移植功能,突出了VEGF在早期肾移植功能中的作用[27].
在本研究的第一部分,我们在内皮细胞模型中研究了OxLDL培养对TSP-1表达的影响。我们首次报道了OxLDL通过增加ADAMTS-1的表达来促进内皮动脉细胞中TSP-1的分泌,并降低血管生成和内皮细胞增殖所需的整合素alpha5beta3的表达[28].TSP-1通过多种途径调节内皮细胞迁移[29].TSP-1被认为是通过alpha5beta3连接的alpha5beta3整合素的天然拮抗剂,已被证明可以负向调节纤维连接蛋白的局点粘连形成,这表明整合素的功能可能受损[29].这些结果表明,通过SiRNA实验强调的tsp -1依赖通路,高血脂饮食刺激OxLDL产生对血管生成的抑制作用。肾脏I/R诱导再生过程,如血管生成,这可能受到OxLDL永久生成的影响。由于我们的体外模型依赖于一种细胞类型的培养,远远不能模拟肾脏生理学的复杂性,我们决定在仅由饮食影响调节的肾自体移植猪模型中进一步验证我们的假设。
在先前的研究中,高脂肪饮食影响肾VEGF-A蛋白的表达,并损害原生猪肾的微血管结构,但没有缺血性损伤[30.,31].这方面有充分的文献记载,并表明移植条件下的高脂肪饮食可能影响由VEGF-A介导的促血管生成过程。本研究我们只关注高脂饮食在肾移植I/R损伤后早期血管再生过程中的作用,排除了高脂饮食对原生肾的影响,因为之前有报道[30.,31].在断奶后开始以高脂肪饮食喂养的猪中,我们之前报告了手术当天和移植后3个月血浆中OxLDL水平的升高[15].后来的增加伴随着总胆固醇水平的上升。手术当天血浆胆固醇和OxLDL水平之间的差异可以解释为手术前要求快速,并强调了高水平的血浆OxLDL在再灌注早期的作用。随访期间,两组肌酐清除率评估的肾功能相似。3个月的监测窗口可能太短,无法观察到移植物功能的显著差异。然而,我们观察到移植后3个月高脂饮食组蛋白尿显著升高,这被描述为研究组织和血管重塑以及促血管生成途径的关键时间点[10,17].
肾组织缺血是慢性肾脏疾病发生发展的重要因素之一。已知高脂饮食组经三色马松染色观察,重度纤维化区域HIF1a表达增加[9].氧张力降低激活HIF1a的稳定,诱导大范围的促生存反应,如VEGF-A表达[32].然而,在本研究中,高脂肪饮食促进了HIF1a的稳定,但未观察到对VEGF-A表达的转录影响。此外,通过抑制SDF-1和VEGF-A蛋白的表达,高脂饮食降低了肾移植的促血管生成能力[9,28,33].综上所述,这些结果表明高血脂饮食的抗血管生成作用可能是由TSP-1介导的。血管生成因子诱导的新生血管被血管生成抑制剂的作用所抵消,如TSP-1,一种在健康肾皮质中表达水平极低的糖蛋白,在某些肾脏疾病中表达上调[12].Thakar等人此前报道,TSP-1缺失小鼠对肾缺血表现出显著的保护作用,支持了TSP-1作为肾缺血损伤调节因子的事实[34].TSP-1通过直接作用于内皮细胞和间接作用于生长因子的动员和激活来抑制血管生成[9].为了研究TSP-1在我们的条件下的作用,我们评估了它在移植物中的表达。移植后3个月,高脂饮食诱导肾小球中TSP-1蛋白过度表达,在小管和间质中密集表达,但mRNA表达无变化,提示转录后TSP-1的调控。这一假设得到ADAMTS-1过表达的支持。事实上,ADAMTS-1是一种可溶性基质金属蛋白酶分子,其抑制血管生成的机制可能涉及直接隔离VEGF或释放激活抗血管生成的血栓反应蛋白衍生肽,如TSP-1 [35,36].在I/R后,大鼠近端小管中ADAMTS-1已被描述为增强[37]以及在动脉粥样硬化中巨噬细胞侵入组织[38].我们观察到高脂饮食组ed1阳性巨噬细胞浸润间质增多,与ADAMTS-1表达水平升高一致。暴露于高OxLDL水平的肾移植物间质中ED-1阳性巨噬细胞的显著增加与与管状萎缩相关的前纤维化环境有关。此外,在该组中,TUNEL染色显示TSP-1可刺激细胞凋亡过程[39].为了研究这些促炎和再生通路对血管重塑的影响,我们对皮层微血管化损伤进行了表征。根据观察到的毛细血管密度降低和促血管生成途径的抑制,高脂饮食增加了肾移植模型I/R损伤引起的微血管稀疏,特别是直径小于40µm的小血管段。此外,血管段直径的减小支持了血管重塑,根据介质与管腔的高比率和纤维化的发展。
为了检验我们的结果在人类移植中的相关性,我们在肾移植后的短期随访中研究了高胆固醇血症对关键血管生成血管生长因子(VEGF-A)全身水平的影响。我们观察到,手术当天胆固醇水平较高的受者在移植后的前3天内血浆VEGF-A水平下降,这表明移植物的再生过程减少。此外,在这项初步研究中,我们强调了手术当天的胆固醇血症水平可以影响移植结果,这可以通过再灌注后1年高胆固醇血症患者滤过功能(eGFR)的降低和尿蛋白排泄的增加来表明。虽然两组患者的特征相似,但我们应该注意到,这些差异可能涉及其他混杂因素,如免疫抑制疗法。术前在血浆受体中观察到的TSP-1水平升高与其在移植后早期对血浆VEGF-A水平的作用之间的相关性还需要进一步的分析。
结论
综上所述,这些结果支持:(1)OxLDL参与了肾移植再生能力的丧失;(2)TSP-1在高脂饮食暴露的猪肾移植中过表达,并与促血管生成途径的抑制有关;(3)高脂饮食诱导微血管稀疏和血管重塑;(4)高胆固醇血症患者移植手术后血浆VEGF-A水平早期下降。
总之,我们的研究强调了短期高脂肪饮食对肾移植后早期再生过程的影响,与血脂异常引起的动脉粥样硬化慢性损伤不同。此外,肾移植受者的高脂肪饮食或血脂异常可能会影响器官结局,从而确定TSP-1是一个感兴趣的治疗靶点,并强调需要在肾移植早期更好地控制受者的胆固醇或OxLDL血浆水平。
缩写
- ADAMTS-1:
-
一种分解素和金属蛋白酶与血栓反应蛋白基序-1
- αSMA:
-
平滑肌肌动蛋白
- 表皮生长因子受体:
-
估计肾小球滤过率
- HAEC:
-
人主动脉内皮细胞
- HIF1a:
-
缺氧诱导因子1a
- 我/ R:
-
缺血再灌注
- 低密度脂蛋白:
-
低密度脂蛋白
- MMP-9:
-
基质金属蛋白酶9
- OxLDL:
-
氧化低密度脂蛋白
- SDF-1:
-
基质细胞衍生因子-1
- TGFβ:
-
转化生长因子β
- TSP-1:
-
血小板反应蛋白- 1
- VEGF-A:
-
血管内皮生长因子- a
参考文献
Chade AR, Mushin OP, Zhu X, Rodriguez-Porcel M, Grande JP, Textor SC, Lerman A, Lerman LO。实验性高胆固醇血症中肾纤维化的途径和基质转换的调节。高血压。2005;46:772-9。
Grundy SM, Stone NJ, Bailey AL, Beam C, Birtcher KK, Blumenthal RS, Braun LT, de Ferranti S, Faiella-Tommasino J, Forman de等。2018年AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA指南关于血液胆固醇管理:美国心脏病学会/美国心脏协会临床实践指南工作组的报告。J Am Coll Cardiol, 2018。https://doi.org/10.1016/j.jacc.2018.11.002
Wilson PWF, Polonsky TS, Miedema MD, Khera A, Kosinski AS, Kuvin JT。2018年AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA血液胆固醇管理指南的系统回顾:美国心脏病学会/美国心脏协会临床实践指南工作组的报告。J Am Coll Cardiol, 2018。https://doi.org/10.1016/j.jacc.2018.11.004
Duarte MM, Rocha JB, Moresco RN, Duarte T, Da Cruz IB, Loro VL, Schetinger mr高胆固醇血症患者缺血修饰白蛋白、脂质和炎症生物标志物之间的关系中国生物化学杂志。2009;42:666-71。
Raman KG, Gandley RE, Rohland J, Zenati MS, Tzeng E.早期高胆固醇血症有助于血管舒缩功能障碍和损伤相关的动脉粥样硬化,可被一氧化氮抑制。中华血管外科杂志,2011;
Basile DP。缺血性急性肾功能衰竭后小管周围毛细血管稀疏:一个潜在的因素,易发进行性肾病。《中国日报》2004;13:1-7。
Basile DP。缺血性急性肾损伤中的内皮细胞:对急性和慢性功能的影响。肾内科杂志2007;72:151-6。
Cicco G, Panzera PC, Catalano G, Memeo V.器官移植微循环和再灌注损伤。Adv Exp医学生物学,2005;566:363-73。
田中平,田中平。肾血管生成与缺氧。奈弗尔,2013;9:211-22。
Rossard L, Favreau F, Giraud S, Thuillier R, Le Pape S, Goujon JM, Valagier A, Hauet T.热缺血对临床前自体肾移植猪模型先天和适应性反应的作用。《中华医学杂志》2013;11:29。
Rossard L, Favreau F, Demars J, Robert R, Nadeau C, Cau J, Thuillier R, Hauet T.急性肾损伤临床前模型早期再生过程的评估。中华医学杂志,2012;12:502-5。
崔伟,买买提一鸣,祁霞,Norman H,王山。血栓反应蛋白1在高脂饮食诱导的肥胖小鼠模型中的作用。中国生物医学工程杂志,2013;
血栓反应蛋白在肾脏疾病中的作用。中国生物医学工程学报(英文版),2009;
adam JC, Lawler J.血栓反应。中国生物化学杂志,2004;36:961 - 68。
Chatauret N, Favreau F, Giraud S, Thierry A, Rossard L, Le Pape S, Lerman LO, Hauet T.饮食诱导的血浆氧化低密度脂蛋白升高促进肾猪自体移植模型的早期纤维化。《翻译医学杂志》2014;12:76。
Favreau F, Thuillier R, Cau J, Milin S, Manguy E, Mauco G, Zhu X, Lerman LO, Hauet T.抗凝血酶治疗在DCD模型中预防慢性移植肾纤维化。中华外科杂志。2007;10:30-9。
Favreau F, Zhu XY, Krier JD, Lin J, Warner L, Textor SC, Lerman LO。猪肾动脉狭窄的血运重建术可以改善肾功能,但对血管结构的改变没有改善作用。肾脏杂志2010;78:1110-8。
Hauet T, Goujon JM, Baumert H, Petit I, Carretier M, Eugene M, Vandewalle A.聚乙二醇减轻自体移植猪肾冷缺血/再灌注引起的炎症损伤。肾脏杂志2002;62:654-67。
Jayle C, Favreau F, Zhang K, Doucet C, Goujon JM, Hebrard W, Carretier M, Eugene M, Mauco G, Tillement JP, Hauet T.曲美他嗪对不同时间实验性热缺血保护作用的比较:对猪肾模型的早期和长期影响。中国医学杂志,2007;29:F1082-93。
朱xy, Chade AR, Rodriguez-Porcel M, Bentley MD, Ritman EL, Lerman A, Lerman LO。狭窄肾的皮质微血管重塑:氧化应激增加的作用。动脉血栓血管生物学杂志2004;24:1854-9。
费尔德坎普,戴维斯,克瑞斯。实用锥束算法。Josa a . 1984; 1:612-9。
Maiga S, Allain G, Hauet T, Roumy J, Baulier E, Scepi M, Dierick M, Van Hoorebeke L, Hannaert P, Guy F, Favreau F.肾自体移植促进临床前猪模型皮层微血管网络重塑。PLoS ONE。2017; 12: e0181067。
欧洲肾移植最佳实践指南。第四部分:移植受者的长期管理。IV.13患者和移植物生存分析。《肾移植杂志》2002;17(4):60-7。
林勇,Manning PT,贾杰,Gaut JP,肖z, Capoccia BJ,陈cc, Hiebsch RR, Upadhya G, Mohanakumar T,等。CD47阻断降低大鼠肾移植模型的缺血-再灌注损伤并改善预后。移植。2014;98:394 - 401。
Yao M, Rogers NM, Csanyi G, Rodriguez AI, Ross MA, St Croix C, Knupp H, Novelli EM, Thomson AW, Pagano PJ, Isenberg JS。血栓反应蛋白-1激活信号调节蛋白- α刺激活性氧产生,促进肾缺血再灌注损伤。中国生物医学工程学报,2014;
Giraud S, Favreau F, Chatauret N, Thuillier R, Maiga S, Hauet T.大型猪对肾缺血-再灌注和移植研究的贡献:临床前模型。中国生物医学工程学报。2011;
Rintala JM, Savikko J, Palin N, Rintala SE, Koskinen PK, von Willebrand E.口服血小板源性生长因子和血管内皮生长因子抑制剂舒尼替尼预防实验性肾移植模型慢性移植物损伤。移植。2016;100:103-10。
Brooks PC, Clark RA, Cheresh DA。血管整合素α v β 3对血管生成的要求。科学。1994;264:569 - 71。
Ashton AW, Cheng Y, Helisch A, Ware J.血栓素A2受体激动剂拮抗成纤维细胞生长因子-2的促血管生成作用:受体内化,血栓反应蛋白-1和α (v) β a3的作用。Circ res 2004; 94:735-42。
Chade AR, Lerman A, Lerman LO。肾早期动脉粥样硬化。高血压。2005;45:1042-9。
Chade AR, Bentley MD, Zhu X, Rodriguez-Porcel M, Niemeyer S, amos - arriaga B, Napoli C, Ritman EL, Lerman A, Lerman LO。抗氧化剂干预防止高胆固醇血症猪肾脏新生血管。中国农业大学学报。2004;15:1816-25。
Schley G, Klanke B, Schodel J, Forstreuter F, Shukla D, Kurtz A, Amann K, Wiesener MS, Rosen S, Eckardt KU,等。低氧诱导的转录因子稳定在厚升肢保护缺血性急性肾损伤。中国农业大学学报(自然科学版),2011;22(4):344 - 344。
Liekens S, schold, Hatse S. CXCL12-CXCR4轴在血管生成,转移和干细胞动员中的作用。Curr Pharm Des 2010; 16:3903-20。
塔卡罗,王震,王震,王震,王震,王震,王震,王震,王震,王震。血栓反应蛋白1 (TSP-1)在肾缺血细胞损伤中的作用。中国临床医学杂志,2005;
李妮v, Sato M, Annis DS, Loo JA, Wu L, Mosher DF, iruella - arispe ML. ADAMTS1介导TSP1和2抗血管生成多肽的释放。Embo j . 2006; 25:5270-83。
Luque A, Carpizo DR, Iruela-Arispe ML. ADAMTS1/METH1通过直接结合和隔离VEGF165抑制内皮细胞增殖。中国生物化学杂志,2003;
Basile DP, Fredrich K, Chelladurai B, Leonard EC, Parrish AR.肾缺血再灌注抑制VEGF表达并诱导新型VEGF抑制剂ADAMTS-1。中国医学杂志。2008;29:F928-36。
Ashlin TG, Kwan AP, Ramji DP。ADAMTS-1、-4和-5在人巨噬细胞中的表达调控:与动脉粥样硬化有关的关键细胞因子的差异调控以及TL1A和IL-17之间的新协同作用。细胞因子。2013;64:234-42。
郭宁,郭晓明,郭晓明,张晓明。血栓反应蛋白1和I型重复肽对内皮细胞凋亡的诱导作用。癌症法案1997;57:1735-42。
作者的贡献
TK对患者资料进行分析和解释,进行蛋白质研究并进行统计分析;FF对实验数据进行分析和解释,是论文手稿的主要贡献者,参与了本研究的构思和设计;TK进行了蛋白质研究;SM进行了显微ct研究;GA进行动物手术;AT对患者资料进行分析和解释;MD进行了显微ct研究;EB进行了蛋白质研究;CS进行细胞实验,并参与对重要知识内容的稿件进行批判性修改;TH分析和解释了组织化学和免疫组织化学数据,起草了手稿,并参与了本研究的构思和设计。 All authors read and approved the final manuscript.
确认
我们非常感谢William Hebrard (Département de Génétique Animale, INRA, Surgères), Sandrine Joffrion, Virginie Ameteau和Maite Jacquard提供的出色的技术支持。
相互竞争的利益
作者宣称他们之间没有利益冲突。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
发表同意书
不适用。
伦理批准并同意参与
根据实验动物使用和护理机构委员会(CEEA Poitou-Charentes CE2012-4)的规定,在断奶2个月后进行肾自体移植模型。
资金
本研究由Société de Néphrologie,移植基金会和康塞尔Régional Poitou-Charentes的研究资助。
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
作者信息
作者及隶属关系
相应的作者
附加文件
附加文件1:表S1。
猪肾RT-qPCR引物序列分析。
附加文件2:图S1。
用western blotting检测TSP1在HAEC(第一通道)和Si TSP1在HAEC(最后通道)中的表达。
附加文件3:图S2。
猪肾组织中HIF1α免疫组化阴性对照。
附加文件4:图S3。
猪肾组织VEGF免疫组化阴性对照。
附加文件5:图S4。
猪肾组织TSP1免疫组化阴性对照。
附加文件6:图S5。
自体移植后3个月,高脂肪组和正常饮食组VEGFA、HIF1α、ADAMTS1和TSP1 mRNA的实时定量PCR表达(n= 5-6)。
附加文件7。
猪肾组织中氨基肽酶染色和人血浆TSP1定量的补充材料。
附加文件8:图S6。
自体移植后3个月,接受或不接受高脂血饮食的肾脏,用免疫染色法定量氨肽酶。
附加文件9:图S7。
高胆固醇血症与血浆TSP-1的上调有关。根据肾移植前一天的血浆胆固醇水平将患者分为两组,并测量TSP-1水平(n= 6-7)。与正常胆固醇血症组有显著差异的值用* p < 0.05表示。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
科弗恩,T.,费儒,F.,哈利菲,T.。et al。高胆固醇血症诱导的血浆氧化低密度脂蛋白的增加取消了肾移植的促血管生成反应。翻译医学杂志17, 26(2019)。https://doi.org/10.1186/s12967-018-1764-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-018-1764-4
关键字
- 氧化低密度脂蛋白
- 肾移植
- 血管重建