摘要
背景
在乳腺癌(BC)患者中,近40%为绝经后,70%-80%为激素受体(HR)阳性。大约30%-40%被诊断为浸润性癌的BC患者最终会发展为转移性乳腺癌。2016年,FALCON试验证明Fulvestrant是绝经后hr阳性晚期BC (ABC)患者的有效一线内分泌治疗。但即使在FALCON发表文章之后,Fulvestrant也很少被用于中国现实世界中ABC患者的一线治疗。
方法
在这项研究中,从2015年开始招募了136名Fulvestrant用户。采用生物统计学和生物信息学分析工具,探讨影响氟维司汀治疗反应的临床和遗传危险因素。
结果
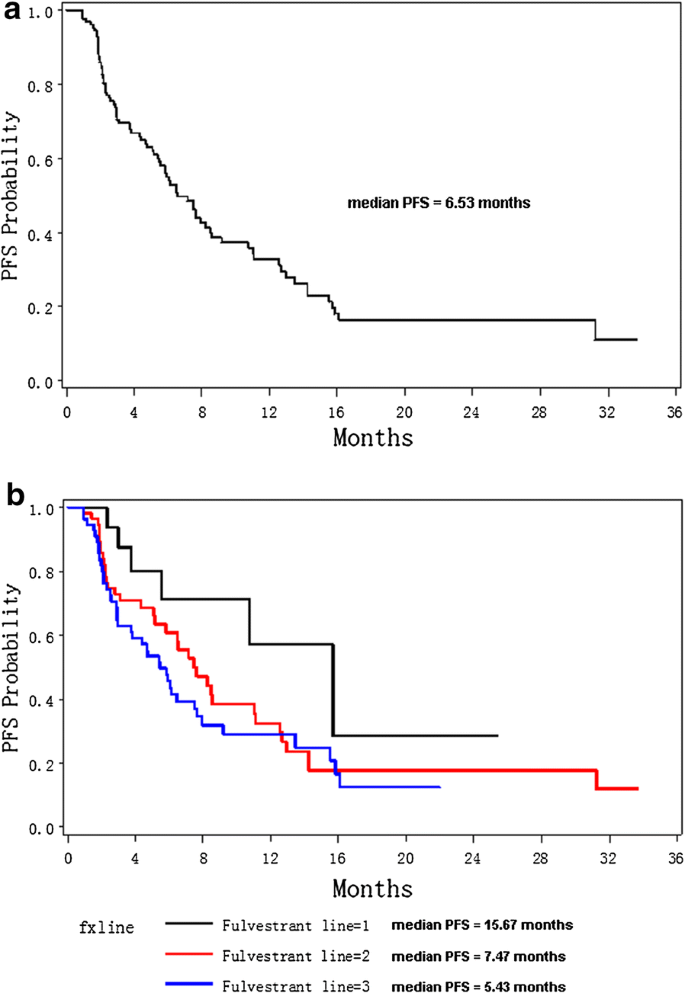
KM曲线显示,Fulvestrant一线患者的中位无进展生存期(mPFS)为15.67个月,比二线和三线(或更高)患者(mPFS分别为7.47和5.43个月)更长。16 s(或更长时间)线使用者在进展后自愿接受循环肿瘤DNA (ctDNA)检测。ctDNA检测结果显示,与PFS大于6个月的患者相比,PFS小于6个月的富维司汀使用者具有明显更高的突变率ESR1或ERBB2基因(0/6 vs 6/10,费雪精确p值= 0.03)。多因素COX回归分析显示,淋巴结转移、HER-2阳性等临床特征是PFS差的重要危险因素[危险比(HR)分别为2.396、2.863];高比例的雌激素受体阳性细胞是显著的保护因子(HR = 0.663)。倾向评分匹配(PMS)分析显示,内脏转移、既往姑息性化疗和使用富维司汀的年龄不是PFS的显著影响因素。
结论
一线使用富维司康比一线使用富维司康能保证更好的预后。ESR1或ERBB2突变被发现与高线富尔维斯特汀使用者的PFS差有关。
背景
乳腺癌是全世界女性死亡的主要原因[1]。自2000年以来,乳腺癌发病率显著上升,已成为女性最常见的恶性疾病。在乳腺癌患者中,近40%为绝经后,70%-80%为激素受体(HR)阳性。在患有早期激素受体阳性乳腺癌的妇女中,高达40%的人最终会发生转移性疾病,尽管复发可能很晚,在最初诊断后长达30年[2]。晚期乳腺癌(ABC)患者的治疗目标包括缓解症状、改善生活质量(QOL)和延长生存期[3.]。为了实现这一目标,内分泌治疗是一种有效的治疗策略,以雌激素受体(ER)为靶点,阻断ER与雌激素的相互作用,抑制ER下游通路。内分泌治疗是er阳性ABC患者的一线治疗方案[4],但需要迅速控制疾病的严重内脏疾病除外。
Fulvestrant是一种选择性内质网降解剂(SERD),能够与内质网结合,下调内质网蛋白,阻断内质网功能[j]。5]。基于一项开放获取、随机和多中心的III期临床试验No. 0021,在一线内分泌治疗失败的绝经后er阳性ABC患者中,Fulvestrant与Anatrozole具有相似的疗效;氟维司汀组和阿曲唑组的中位进展时间(TTP)分别为5.4个月和5.1个月[风险比(HR) = 0.98, 95%可信区间(CI) = 0.8 ~ 1.21, p = 0.84] [5]。体内和体外研究都证明,Fulvestrant以剂量依赖的方式抑制内质网转录并促进内质网降解[6,7,8,9]。临床研究进一步证实,富维司汀500 mg显著优于250 mg [HR (95% CI) = 0.8 (0.68, 0.94), p = 0.006];Fulvestrant 500 mg组的中位总生存期(OS)为25.1个月,而Fulvestrant 250 mg组的中位总生存期为22.8个月[10]。因此,美国临床肿瘤学会(ASCO)推荐富维司汀500mg作为一线内分泌治疗失败的绝经后er阳性ABC患者的标准治疗。
根据FALCON试验(一项III期临床试验),Fulvestrant 500 mg被批准为绝经后er阳性ABC患者的一线内分泌治疗。与Anatrozole组相比,Fulvestrant 500 mg可显著改善PFS [HR (95% CI) = 0.797 (0.637, 0.999), p = 0.0486];富维司汀500 mg组的中位PFS为16.6个月,而安那曲唑组的中位PFS为13.8个月[11]。但对于内脏转移患者,氟维司汀和安那曲唑的中位PFS分别为13.5个月和15.9个月;在非内脏转移患者中,氟维司汀使用者的中位PFS为22.3个月(HR = 0.59,非内脏转移亚组vs内脏转移亚组)[11]。这一发现表明内脏转移性富维司坦使用者预后较差。基于对ABC富维司汀使用者的多中心回顾性分析,一线用药、既往无姑息性化疗、组织学/核分级较低的患者预后较好;内脏转移对预后无明显影响[12]。从Graham的研究成果中获得了一些其他的观点;他们支持内脏转移患者从富维司汀治疗中获益更多[13,14]。
在现实世界中,除了HR状况和肿瘤负担外,药物敏感性和抗癌效率一直是临床治疗决策的首要考虑因素[3.]。虽然Fulvestrant是一种很有前景的耐药抗乳腺癌药物,但与其他内分泌药物一样,仍存在耐药问题[15]。最近的研究表明,PIK3CA突变,ESR1突变和ER/HER2串扰是富维司汀耐药的潜在分子机制[15,16,17,18,19]。出现这些耐药相关事件的患者预后通常较差。因此,治疗前的分子评价可以为肿瘤学家提供未来药物敏感性和预后的线索。循环肿瘤DNA (ctDNA)检测是一种高效的检测方法ESR1,PI3K和TP53转移性BC患者的基因突变[20.,21,22]。由于乳腺转移的空间异质性,ctDNA检测甚至比肿瘤组织基因检测更有用。
在这项研究中,我们旨在收集真实世界的数据,回顾性分析富维司汀治疗的潜在风险因素,其中风险候选因素包括临床因素和基因突变。
材料与方法
患者队列和临床数据收集
136例接受富维司汀治疗的BC复发或转移患者参加了这项研究。这些患者于2015年6月至2018年8月在湖南省肿瘤医院乳腺癌内科肿瘤科接受治疗。该研究得到了湖南省肿瘤医院伦理委员会的批准。
在研究开始前获得每位患者的知情同意。特别地,纳入标准包括:(1)细胞学或组织学证实的AJCC IIIB-IV期乳腺癌患者,包括局部不可切除的ABC,复发和转移性BC;(2)绝经后患者;(3)根据ASCO定义,ER为阳性和/或PR为阳性;(4)根据RECIST 1.1标准[23],患者至少有一个可检测到的目标病变;(5)性能评分(PS)为1-2分。排除标准为:(1)多发原发肿瘤患者;(2)绝经前女性;(3)氟维司汀联合其他内分泌治疗、化疗或靶向治疗。
收集基本的人口学和临床信息,包括原发性BC诊断的年龄、使用富维司汀治疗的年龄、无病生存期(DFS)、HR/人表皮生长因子受体2 (HER2)状态、原发性BC诊断时的TNM分期、诊断时的治疗史(包括原发性BC手术/放疗、化疗和内分泌治疗史)、复发或转移后的姑息治疗史和转移部位。
进度和进度时间的定义
RECIST已经建立了测量肿瘤靶点和评估治疗反应的指南。根据RECIST 1.1标准,肿瘤进展被定义为肿瘤目标体积增加20%。在转移性BC患者的靶向治疗试验中,PFS与总生存率高度相关[24,25]。因此,在本研究中,PFS被用于评估患者对Fulvestrant的反应。
治疗失败时间(TTF)是本研究的第二个测量指标。根据以前的出版物[12], TTF定义为富维司汀治疗开始和终止之间的时间。如果患者被认为是疾病进展(PD),则终止日为疾病进展日;如果患者接受了姑息治疗或替代治疗,则终止日为富维司汀治疗最后一天的28天后;如果患者要求停止使用富维司汀并改用其他药物,终止日为富维司汀最后一次治疗日后28天或下一个方案的开始日,取决于哪一天更早;如果患者患有PD,但无法确定进展日,则终止日为最后一个富维司汀治疗日加28天,或下一个方案的开始日,取决于哪一天更早。
循环肿瘤DNA检测
为了研究与富维司坦耐药和不良预后相关的遗传危险因素,我们对136名富维司坦服用者中的16名志愿者进行了ctDNA检测。采集外周血样本,DNA提取程序按照前面所述的方案进行[20.]。基因组DNA (gDNA)作为正常对照样本进行测序。捕获探针被设计用于覆盖实体肿瘤中经常突变的1021个基因的编码序列和热外显子。有关捕获实验的详细描述已报告[20.]。使用MuTect(1.1.4版)和NChot软件调用单核苷酸变异(SNV) [20.]。使用GATK调用小的插入和删除(Indels)。体细胞拷贝数改变用CONTRA (v2.0.8)鉴定。显着拷贝数变化表示为ctDNA与对照gDNA之间调整深度的比值。最终的候选变异都在整合基因组学查看器中手工验证。
倾向得分匹配
进行1:1倾向评分匹配(PSM)分析,以减少两个亚组之间的潜在偏倚。为了无偏倚地评估潜在因素对氟维司汀治疗的影响,通过逻辑回归计算比较亚组中每个患者的倾向评分。纳入逻辑回归的协变量为除psm评估外的所有其他临床候选变量。根据倾向性评分对两组患者进行匹配。两组间的协变量平衡采用卡方检验。然后使用与未匹配患者相同的方法对匹配患者进行生存比较。
统计分析
数值变量总结为平均值(标准差)和中位数(四分位间距)。分类变量以计数(百分比)报告。方差分析用于比较各子组间对称分布的连续变量。使用卡方检验和Fisher精确检验(n < 5)比较亚组间的分类变量。当组数大于2时,采用Mentel-Haenszel卡方检验。采用Cox回归分析评价候选进展危险因素的单因素和多因素风险。Kaplan-Meier (KM)曲线用于绘制进展情况下的生存分布,log-rank检验用于评估亚组间PFS的差异。然后计算受试者工作特征(ROC)曲线,以确定使用富维司汀时年龄的最佳截止点,该截止点在预测更好的PFS方面具有最大的灵敏度和特异性。所有假设检验均采用双尾检验,显著性水平为0.05,边际显著性水平为0.15。采用SAS 9.4进行统计学分析。
结果
人口学和临床特征
136名Fulvestrant使用者参加了这项研究。17例(12.5%)患者接受富维司汀作为一线内分泌治疗。61例(44.85%)患者接受富维司汀作为二线内分泌治疗。58例(42.65%)患者将富维司汀作为内分泌治疗的第三线或更后线。在后期(≥三线)使用富维司汀的患者在诊断和使用富维司汀时更年轻,并且DFS更短(表1)1)。此外,更多的晚期使用者有手术、绝经、内脏转移和姑息性化疗(表1)1)。其他临床特征,如HR/HER2状态、核或组织学分级、分期、绝经方式、初次治疗史、骨和淋巴结转移在富维司汀早期和晚期使用者中无显著差异。
治疗反应不良的临床危险因素
为了评估富维司坦使用者不良反应的危险因素,进行了单因素COX回归分析。如表所示2与一线治疗相比,二线治疗是疾病进展(HR [95% CI] = 1.911 [0.803, 4.547], p = 0.14)和治疗失败(HR [95% CI] = 2.008 [0.849, 4.745], p = 0.11)的边缘危险因素;与一线使用相比,晚期使用富维司汀(≥三线)是疾病进展(HR [95% CI] = 2.420 [1.026, 5.711], p = 0.04)和治疗失败(HR [95% CI] = 2.668 [1.135, 6.272], p = 0.03)的重要危险因素。其他重要的危险因素包括her2阳性状态,较高的核/组织学分级,诊断时的晚期BC,癌症复发或转移时的淋巴结转移。
为避免混杂效应,采用多因素COX回归分析。如附加文件所示1表S1,在多变量COX模型中,与一线用药相比,二线和≥三线用药均存在进展和治疗失败的风险。her2阳性为进展风险(HR = 2.396, p = 0.04), 50% ~ 100% er阳性为进展保护(HR = 0.663, p = 0.02)。在多变量COX模型中,诊断晚期和淋巴结转移也是进展和治疗失败的重要危险因素。有趣的是,在多变量COX模型中,使用富维司汀的年龄较大是显著的保护因素(HR = 0.88, p = 0.03,附加文件)1:表1)。
按显著候选患者分层的患者生存分析
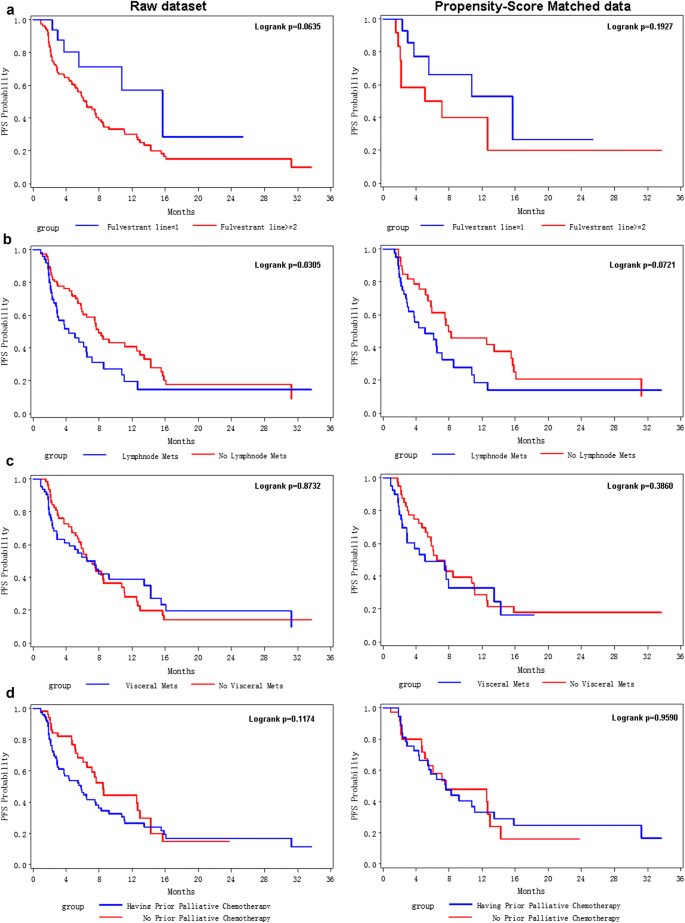
为了进一步评价上述显著性因素对氟维司坦使用者的影响,我们进行了寿命试验和PSM分析。如图所示。1,所有入组患者的中位PFS仅为6.53个月。但是,使用Fulvestrant一线治疗的患者的mPFS(15.67个月)更长,远长于使用Fulvestrant二线(mPFS = 7.47个月)和使用Fulvestrant≥3线治疗的患者(mPFS = 5.43个月)。Lifetest显示,一线用户的PFS显著优于二线(或以上)用户(p值= 0.0635,图3)。2左)。在PSM数据中(图右面板)2a),由于样本量小(PS匹配后共30个样本),p值不显著,但一线Fulvestrant用户的Kaplan-Merier (KM)曲线(蓝线)显著高于高线用户的KM曲线(红线)。
在单因素和多因素COX模型中,淋巴结转移是不良PFS的重要危险因素;PSM分析进一步证实了这种效应(图2)。2b, PSM数据中p = 0.07)。然而,在原始数据和PSM数据中,内脏转移并没有显示出对富维司汀使用者PFS的显著风险影响(图2)。2c).对于富维司汀治疗前的姑息性化疗,KM曲线分析显示PFS存在边际风险效应(图2)。2d左面板,logrank p = 0.11)和单变量COX分析(p = 0.16,表2);但在PSM数据中,分层KM曲线基本相同(图2)。2D右面板,logrank p = 0.96)。此外,由于既往姑息性化疗的患者都是二线或更高线的富维司汀使用者(表1)1),既往姑息性化疗对PFS有边际风险效应(表2)2);当PSM消除了既往姑息性化疗患者在不同类型氟维司汀使用者之间的不平衡分布时,既往姑息性化疗的风险效应消失(图2)。2e)。
ctDNA突变与Fulvestrant耐药和不良预后相关
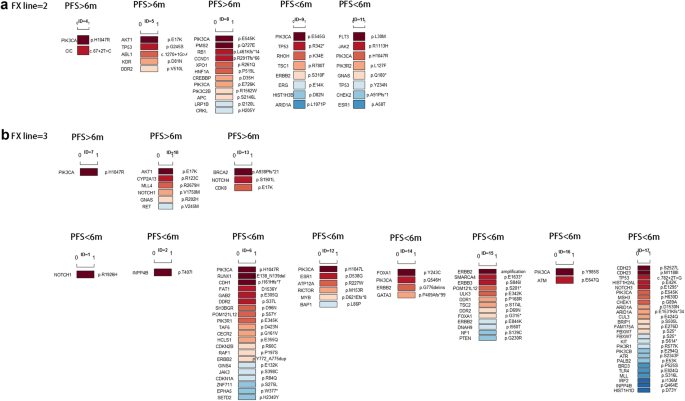
为了探索富维司坦耐药的分子基础,16名富维司坦二线或二线以上使用者参加了ctDNA检测。根据PFS的长短,将患者分为PFS < 6个月和PFS < 6个月两个亚组。数字3.对突变基因进行排序。如果1名患者在一个基因中有两个突变(例如,患者ID = 8有两个PIK3CA突变,p.E545K和p.E726K,图2)。4a),该基因将在图中计数两次。3.。如图所示。3.预后不良(PFS < 6个月)患者;TP53,ERBB2和ESR1基因突变是最常见的突变;其他基因包括ARD1A,FBXW7,DDR2等也是频繁的突变。对于PFS超过6个月的患者,没有ERBB2和ESR1检测基因突变。
探究…的相关性TP53,PIK3CA,ERBB2和ESR1采用fisher精确检验比较两个PFS亚组患者的基因突变频率。在这里,如果1名患者有一个基因突变,无论1名患者有多少个突变,只计算1名患者进行频率比较。如表所示3.与PFS < 6个月亚组相比,PFS < 6个月亚组的突变频率显著高于PFS < 6个月亚组ESR1或ERBB2突变(p = 0.03)。此外,PFS < 6个月的患者中有略多的患者TP53,ESR1或ERBB2突变(p = 0.011)。
氟韦斯特林抗性与ESR1突变或ERBB2突变
在16名接受ctDNA检测的富维司汀使用者中,5名患者接受了二线富维司汀治疗,11名患者接受了≥三线富维司汀治疗2:图S1)。在二线氟维司汀使用者中,2/5(40%)患者的PFS小于6个月(ID = 9和ID = 11),而其余3/5(60%)患者的PFS大于6个月(ID = 4,5,8,图4)。4a).在≥三线氟维司汀使用者中,8/11(73%)患者的PFS小于6个月,3/11(27%)患者的PFS大于6个月(ID = 7,10,13,图1)。4b).在所有10例PFS < 6个月的患者中,2例有ESR1错义突变(ID = 11 p.A58T和ID = 12 p.D538G) 4例ERBB2突变(ID = 6 p.Y772_A775dup;ID = 9 p.S310F;ID = 14 p.G776delins;ID = 15两者都有ERBB2放大和ERBB2p.E844K错义突变4B), 3例TP53突变(ID = 9、11和17)。在所有6例PFS患者中,6个月的患者都没有ESR1或ERBB2突变。
讨论
在本研究中,我们回顾性分析了可能影响晚期er阳性乳腺癌患者对Fulvestrant治疗反应的临床因素。我们还利用ctDNA检测来调查富尔维斯特兰特相关的耐药突变。通过COX回归分析,我们发现富维司汀一线治疗、使用富维司汀的年龄较大、er阳性百分比高是富维司汀使用者PFS的保护因素。但是,≥二线氟维司汀使用、her2阳性、较高的核或组织学分级、BC诊断晚期(III/IV期)和淋巴结转移是氟维司汀使用者PFS预后不良的重要危险因素(表1)2和附加文件1:表1)。PSM分析进一步证实了晚期治疗和淋巴结转移的风险效应(图2)。2)。
目前,Fulvestrant被推荐作为绝经后er阳性晚期BC患者的标准一线内分泌治疗。但是,根据我们的研究,只有17/136(12.5%)绝经后er阳性ABC患者接受一线富维司汀治疗,61/136(44.85%)患者接受二线富维司汀治疗,58/136(42.65%)患者接受三线(及更高线)富维司汀治疗。据估计,一线、二线和三线(包括高线)患者的中位PFS分别为15.67个月、7.47个月和5.43个月。1)。因此,越早使用富维司汀,患者预后越好。此外,与诊断或手术活检时的ER状态相比,ER状态会随着疾病的晚期进展而改变。多线内分泌治疗后也会出现耐药性。因此,基于本研究结果,我们建议er阳性ABC患者尽早接受富维司汀治疗。多因素COX回归分析提示高er阳性百分比(50-100%)是预后的有利因素(附加文件)1:表1)。这与临床观察结果一致,ER水平高的患者对内分泌治疗更敏感,预后也会更好。
单因素COX分析显示,既往姑息性化疗是预后不良的边缘危险因素。先前没有姑息性化疗的富维司汀使用者的中位PFS为8.47个月,而先前有姑息性化疗的患者的中位PFS为5.8个月(logrank p值= 0.1174,图2)。2d).通常情况下,肿瘤快速生长和有症状的内脏转移的患者首先进行姑息性化疗,因为这些患者需要快速控制病情。因此,Fulvestrant被用作这些患者的二线甚至更高的方案。毫无疑问,这些患者对晚期富维司汀治疗的反应很差。当PSM用于评估既往姑息性化疗时,不包括一线使用者;既往姑息性化疗的PSM患者均为二线或高线患者;在本例中,既往姑息性化疗患者的PFS与既往其他姑息性药物治疗患者无显著差异。
根据目前的临床研究,尚未有关于富维司汀使用者淋巴结转移与PFS预后关系的报道。在我们的研究中,COX回归分析和PSM分析均显示,淋巴结转移对氟维司汀使用者PFS有显著的风险效应(图2)。2但是,这些结果需要仔细解释。需要更多精心设计的前瞻性研究来证实我们的结果。
至于内脏转移,是另一个重要的临床评价事件。FALCON试验表明,非内脏转移患者从Fulvestrant中获益更多[11]。然而,Kawaguchi H报道内脏转移与氟维司坦使用者的PFS无关[12],这与我们的发现相似。我们认为,不同的入学标准导致了这种差异。FALCON试验的入组患者为er阳性/ her2阴性患者,既往未接受过内分泌治疗。但在我们的回顾性研究中,大多数(73.53%)患者在手术后接受过辅助内分泌治疗(表3)1)。经过长期治疗,我们的患者或多或少存在内在或必要的耐药,因此他们对Fulvestrant的治疗反应会低于FALCON试验中的患者。此外,不可见的内脏微转移可能是造成这种差异的另一个原因。正如我们所知,微转移有时甚至在乳房切除术和辅助化疗后仍然存在[26,27];但目前的临床工具无法检测到这些微转移,尤其是内脏微转移。因此,对ABC患者疾病状态的评估不充分将导致治疗不足和肿瘤快速进展。
到目前为止,还没有关于Fulvestrant使用者中ctDNA基因突变的研究报道。因此,在本研究中,我们招募了16名志愿者,在Fulvestrant治疗后疾病进展时筛查他们的ctDNA谱。虽然样本量相对较小,但我们仍然获得了一些关于Fulvestrant耐药分子基础的重要线索。所有入选的16名患者都接受了二线或更高级别的富维司汀治疗。通过使用ctDNA测试,PIK3CA是这16例患者中最常见的突变基因(62.5%)。PIK3CA突变患者ESR1或ERBB2突变的PFS最短。如表所示3.PFS < 6个月组60%的患者有ESR1或ERBB2突变。两个ESR1突变患者(ID = 11和ID = 12)均为先前接受芳香酶抑制剂(AI)治疗的ABC患者。在er阳性患者中,ESR1突变不仅与AI治疗失败有关[28],还会诱发对富维司汀的耐药性[19]。PI3K与ER通路、PI3K/ERBB2通路之间的串扰也导致患者对内分泌治疗产生耐药性[17]。在COX回归分析中,her2阳性也被证实是不良预后的危险因素(表2)2和附加文件1:表1)。
本研究存在一些局限性。首先,在本单中心回顾性研究中,样本量较小,缺乏富维司汀与其他内分泌药物的药效比较。其次,在这项回顾性观察性研究中,没有一线富维司汀使用者接受ctDNA检测。因此,我们无法获得一线用户的突变情况信息。事实上,只有16名Fulvestrant二线或二线以上的用户接受了ctDNA检测。对我们来说,检测治疗失败患者的ctDNA谱是很好的,但在Fulvestrant治疗期间,我们没有获得动态的ctDNA监测,以发现其他潜在的耐药相关突变。在进一步的调查中,我们将继续关注Fulvestrant的一线用户,并进行ctDNA测试。
近年来,临床研究通过优化临床环境,针对特定的生物学特征,努力实现个体化治疗[29]。目前,抗乳腺癌治疗已进入精准用药时代[30.]。一项双盲III期临床试验PALOMA-3研究了帕博西尼联合富维司汀与单独使用富维司汀在HR+/HER2−绝经后既往内分泌治疗失败患者中的疗效;与单药组相比,帕博西尼加药组预后更好[31]。另一项随机双盲安慰剂对照II期临床试验(PrE0102)显示,mTOR抑制剂依维莫司可以改善ai耐药er阳性转移性乳腺癌(MBC)患者的Fulvetrant治疗效果[32];与单用依维莫司相比,富维司汀联合依维莫司可显著延长中位PFS,从5.1个月延长至10.3个月[HR (95% CI) = 0.61 (0.40, 0.92), p = 0.02]。此外,MONALEESA-3试验证明,无论是单药治疗还是联合用药,Fulvestrant均具有良好的治疗效果[33,34,35]。未来,更多的大规模视角研究和ctDNA监测将为富维司特治疗提供更多有用的临床和遗传信息。以fulvestrant为基础的联合靶向治疗将使乳腺癌患者有更多的生存机会。
结论
一线使用富维司康比一线使用富维司康能保证更好的预后。Fulvestrant一线患者的中位PFS为15.67个月,比二线和三线(或更高)患者(mPFS分别为7.47和5.43个月)更长。COX回归分析显示,淋巴结转移和HER-2阳性是PFS较差的重要危险因素;高er阳性是显著的保护因素。此外,ESR1或ERBB2突变被发现与高线富尔维斯特汀使用者的PFS差有关。
缩写
- 公元前:
-
乳腺癌
- 人力资源:
-
激素受体
- 美国广播公司(ABC):
-
晚期乳腺癌
- 强积金:
-
中位无进展生存期
- PFS:
-
无进展生存
- ctDNA:
-
循环肿瘤DNA
- 人力资源:
-
风险比
- 呃:
-
雌激素受体
- 生命质量:
-
生活质量
- SERD:
-
选择性内电降解器
- TTP:
-
time-to-progression
- 置信区间:
-
置信区间
- 操作系统:
-
总生存期
- ASCO:
-
美国临床肿瘤学会
- DFS:
-
无病生存期
- HER2:
-
人表皮生长因子受体2
- gDNA:
-
基因组DNA
- SNV:
-
单核苷酸变异
- Indels:
-
插入和删除
- PSM:
-
倾向评分匹配
- 公里:
-
kaplan meier
- 中华民国:
-
接收机工作特性
- TTF:
-
治疗失败的时间
- MBC:
-
转移性乳腺癌
参考文献
[1]刘建军,刘建军,刘建军,等。全球癌症发病率和死亡率的变化趋势。癌症流行病学杂志,2016;25:16-27。
引用本文:朴诗,韩伟,金俊,金明明,李娥,刘tk,李洪波,姜玉军,金玉刚,Moon HG, Noh DY.乳腺癌局部区域复发患者远处转移和生存结局的相关危险因素。[J]乳腺癌杂志,2015;18:160-6。
李晓明,李晓明,李晓明,等。晚期乳腺癌(abc4)诊断与诊断的国际共识。[j] .中国科学院学报。2018;29:1634-57。
Wakeling AE。不同种类的抗雌激素作用方式的异同。内源性癌症。2000;7:17-28。
Howell A, Robertson JF, Quaresma Albano J, Aschermannova A, Mauriac L, Kleeberg UR, Vergote I, Erikstein B, Webster A, Morris C. Fulvestrant,原ICI 182,780,绝经后晚期乳腺癌患者既往内分泌治疗后与阿那曲唑一样有效。中华临床医学杂志,2002;20(3):396 - 396。
Pritchard KI, Rolski J, Papai Z, Mauriac L, Cardoso F, Chang J, Panasci L, Ianuli C, Kahan Z, Fukase K,等。一项比较三种氟维司汀给药方案治疗绝经后晚期乳腺癌的II期研究结果(FINDER2)。中国医学杂志。2010;33(2):357 - 361。
Ohno S, Rai Y, Iwata H, Yamamoto N, Yoshida M, Iwase H, Masuda N, Nakamura S, Taniguchi H, Kamigaki S, Noguchi S。三种剂量的氟维司汀治疗绝经后晚期乳腺癌:一项双盲II期比较研究(FINDER1)。[j] .中国科学院学报。2010;21(1):442 - 447。
Kuter I, Gee JM, Hegg R, Singer CF, Badwe RA, Lowe ES, Emeribe UA, Anderson E, Sapunar F, Finlay P,等。氟维司汀新辅助内分泌治疗期间生物标志物的剂量依赖性变化:一项随机II期研究latest的结果。中国医学杂志,2012;33(3):391 - 391。
李建军,李建军,李建军,李建军,李建军,李建军。富维司汀与阿那曲唑治疗晚期乳腺癌:两项多中心试验的前瞻性计划联合生存分析癌症。2005;104:236-9。
Di Leo A, Jerusalem G, Petruzelka L, Torres R, Bondarenko IN, Khasanov R, Verhoeven D, Pedrini JL, Smirnova I, Lichinitser MR,等。绝经后雌激素受体阳性晚期乳腺癌妇女中氟维司汀250 mg与500 mg的比较III期临床试验结果中华临床医学杂志,2010;28(4):591 - 596。
Robertson JFR, Bondarenko IM, Trishkina E, Dvorkin M, Panasci L, Manikhas A, Shparyk Y, Cardona-Huerta S,张KL, Philco-Salas MJ,等。富维司汀500 mg与阿那曲唑1 mg治疗激素受体阳性晚期乳腺癌(FALCON):一项国际随机、双盲、3期试验《柳叶刀》杂志。2016;388:2997 - 3005。
Kawaguchi H, Masuda N, Nakayama T, Aogi K, Anan K, Ito Y, Ohtani S, Sato N, Saji S, Tokunaga E,等。福维司汀治疗日本晚期乳腺癌妇女的结局:一项回顾性多中心队列研究(JBCRG-C06;Safari)。乳腺癌杂志,2017;33(3):545 - 554。
Graham J, Pitz M, Gordon V, Grenier D, Amir E, Niraula S.氟维司汀治疗晚期乳腺癌获益的临床预测因素:随机对照试验的荟萃分析。癌症治疗,2016;45:1-6。
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。中国生物医学工程学报,2018;38(5):579 - 584。
Tsuboi K, Kaneko Y, nagatomt, Fujii R, Hanamura T, Gohno T, Yamaguchi Y, Niwa T, Hayashi SI。erα的不同表观遗传机制与氟维司汀耐药乳腺癌的命运有关。[J]中国生物医学工程学报,2017;37(4):557 - 557。
刘晓明,刘新祥,刘晓明,刘晓明。雌激素受体对乳腺癌p53依赖性细胞凋亡的影响。美国国家科学促进会。2012; 109:18060-5。
Ribas R, Pancholi S, Rani A, Schuster E, Guest SK, Nikitorowicz-Buniak J, Simigdala N, Thornhill A, avogadrii - connors F, Cutler RE Jr .等。通过三重阻断mTORC1、表皮生长因子和雌激素受体信号通路在内分泌抵抗性乳腺癌中靶向肿瘤重新布线乳腺癌杂志,2018;20:44。
李建军,张建军,张建军,等。雌激素受体基因在内分泌治疗抵抗性乳腺癌中的作用。中华医学杂志,2017;19:35。
Kuang Y, Siddiqui B, Hu J, Pun M, Cornwell M, Buchwalter G, Hughes ME, Wagle N, Kirschmeier P, Janne PA,等。揭示导致转移性乳腺癌中ESR1突变出现的临床病理特征。中华医学杂志,2018;4:22。
鉴别多药耐药转移性乳腺癌患者循环肿瘤DNA突变谱。EBioMedicine。2018; 32:111-8。
董淑娟,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。乳腺癌治疗杂志,2010;20(1):461 - 467。
Madic J, Kiialainen A, Bidard FC, Birzele F, Ramey G, Leroy Q,里约热内卢Frio T, Vaucher I, Raynal V, Bernard V,等。转移性三阴性乳腺癌患者的循环肿瘤DNA和循环肿瘤细胞。中华医学杂志,2015;36(6):558 - 561。
Lalchandani UR, Sahai V, Hersberger K, Francis IR, Wasnik AP.放射学家对实体瘤反应评价标准的指南。现代诊断与放射,2018。https://doi.org/10.1067/j.cpradiol.2018.07.016。
无进展生存期和进展时间作为晚期乳腺癌的主要终点:经常使用,有时定义不明确。Ann Oncol. 2009;20:46 - 4。
李磊,潘忠。晚期乳腺癌无进展生存期和进展时间作为总生存期的替代终点:一项37项试验的荟萃分析。临床乳腺癌杂志,2018;18:63-70。
杨建军,杨建军,杨建军,等。乳腺癌肺转移的分子和细胞机制研究进展。细胞肿瘤(Dordr)。2018; 41:123-40。
陆X,μE,魏Y, Riethdorf年代,杨问,元M,燕J,华Y, Tiede BJ, Haffty BG, et al。VCAM-1通过参与alpha4beta1阳性破骨细胞祖细胞促进乳腺癌惰性骨微转移的溶骨扩张。癌症杂志,2011;20:701 - 714。
张建军,张建军,张建军,等。ESR1基因突变对乳腺癌获得性内分泌耐药的影响。中华医学杂志,2015;12:573-83。
孙健,黄震,胡震,孙锐。鼻咽癌局部肿瘤切除和咽切除术对鼻咽癌患者生存的益处:基于SEER数据库的回顾性观察研究。中华检验医学杂志,2017;15:116。
刘建军,李建军,李建军,李建军,李建军。精准医疗在乳腺癌治疗中的应用:现实或理想?[J]中华医学杂志,2017;15:139。
Cristofanilli M, Turner NC, Bondarenko I, Ro J, Im SA, Masuda N, Colleoni M, DeMichele A, Loi S, Verma S等。富维司汀加帕博西尼与富维司汀加安慰剂治疗激素受体阳性,her2阴性转移性乳腺癌,既往内分泌治疗进展(PALOMA-3):多中心,双盲,3期随机对照试验的最终分析。中华医学杂志,2016;17:425-39。
Kornblum N, Zhao F, Manola J, Klein P, Ramaswamy B, Brufsky A, Stella PJ, Burnette B, Telli M, Makower DF,等。绝经后妇女激素受体阳性,人表皮生长因子受体2阴性转移性乳腺癌对芳香酶抑制剂治疗耐药,氟维司汀加依维莫司或安慰剂的随机II期试验:PrE0102的结果中华临床医学杂志,2018;36(6):556 - 563。
Slamon DJ, Neven P, Chia S, Fasching PA, De Laurentiis M, Im SA, Petrakova K, Bianchi GV, Esteva FJ, Martin M,等。核糖环尼和氟维群在激素受体阳性、人表皮生长因子受体2阴性的晚期乳腺癌MONALEESA-3中的III期随机研究。中华临床医学杂志,2018;36(6):2465 - 2472。
孔迪格,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军。组织微阵列技术在乳腺癌干细胞特征和肿瘤进展标志物检测中的应用。中华检验医学杂志,2018;16(1):118。
王霞,杨强,郭玲,李小红,赵小红,宋宝玲,林红霞。flotilin -2与乳腺癌进展和不良生存预后相关。中华检验医学杂志,2013;11(1):391。
作者的贡献
QO可以完全访问研究中的所有数据,并对数据分析的完整性和准确性负责。研究理念和设计:QO和ZH。数据采集:JL1、JL2、QH。数据分析和解释:ZH, JL1和JL2。撰写稿件:JL1、JL2、ZH、YW。对重要知识内容的稿件进行关键性修改:JL1、ZH、JL2、HW、YW、QH、XX、QQ。所有作者都阅读并批准了最终的手稿。
致谢
我们要感谢Geneplus北京研究所的研究人员,因为他们为本研究对所有患者的ctDNA和gDNA样本进行了测序。
相互竞争的利益
作者宣称他们没有竞争利益。
数据和材料的可用性
不适用。
发表同意书
在研究开始前获得每位患者的知情同意。
伦理批准并同意参与
本研究经湖南省肿瘤医院/中南大学湘雅医学院附属肿瘤医院伦理委员会批准。
资金
本研究得到湖南省自然科学基金(2018SK2124)和湖南省卫生卫生委员会基金(B2019085)的资助。
出版商的注意
伟德体育在线b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
作者信息
作者及单位
相应的作者
附加文件
附加文件1:表S1。
富维司汀患者进展(PFS)和失效时间(TTF)危险因素的多变量COX回归分析。
附加文件2:图S1。
富维司汀服用者的ctDNA基因突变谱,按富维司汀系、二线服用者分层(一个),以及第三线或更高线用户(B)。深红色代表最常见的突变基因,深蓝色代表最罕见的突变。如果突变基因以相同的频率出现,则按字母顺序排列。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
J。J。刘,李,王,H。et al。富维司汀治疗绝经后er阳性晚期乳腺癌患者的临床和遗传危险因素J翻译医学17, 27(2019)。https://doi.org/10.1186/s12967-018-1734-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-018-1734-x
关键字
- 绝经后hr阳性晚期乳腺癌
- Fulvestrant
- 一线
- ctDNAERBB2和ESR1突变
- 无进展生存期(PFS)差