摘要
背景
为了建立实施涉及患者样本多组学分析的实时过程所需的工作流程,以支持精确引导的治疗干预,实施了组织采集和分析试验。本报告描述了我们迄今为止的发现,包括突变检测导致精确指导治疗的频率和这些患者的结果。
方法
俄勒冈健康与科学大学奈特癌症研究所的符合条件的患者被纳入了这项研究。活检证实转移性或局部晚期不能切除的前列腺癌、乳腺癌、胰腺腺癌或难治性急性骨髓性白血病接受标准治疗的患者符合条件。使用Knight诊断实验室GeneTrails综合实体肿瘤小组(124个基因)收集和分析转移部位活检。治疗医师可获得CLIA认证的基因组信息。
结果
在2017年1月26日至2018年5月30日期间,38例患者入选,其中28例成功进行了活检。其中25个样本产生了足够的肿瘤进行分析。收集的中位活检细胞数和核数分别为70%(15-90%)和5(2-20)。无手术相关并发症发生。GeneTrails分析显示,25个肿瘤样本中有22个(88%)含有至少一个潜在的可操作突变,18个(72%)样本含有2个或更多潜在的可操作突变。最常见的基因改变包括:DNA损伤修复基因、细胞周期调节基因、PIK3CA / Akt / mTOR途径和FGF基因家族。迄今为止,CLIA认证的基因组结果被治疗医师用于5例(23%)患者的精确指导治疗。
结论
我们报告了实时组织采集和分析的可行性,以支持成功的转化肿瘤学平台。该工作流程将为改善生物标志物驱动的精准肿瘤试验的获取和积累提供基础。
背景
技术的迅速发展彻底改变了我们对癌症生物学的认识。下一代测序方法使我们能够绘制不同肿瘤类型的遗传图谱[1,2,3.].这些信息为精准医疗铺平了道路,在精准医疗中,选择治疗方法来阻断患者肿瘤中存在的特定分子缺陷,以控制癌症、限制毒性和改善患者预后。精准医疗的实施改变了几种情况下的治疗范式,包括非小细胞肺癌的EGFR和ALK抑制剂[4,5,6], BRAF抑制剂在恶性黑色素瘤中的应用[7], BCR-ABL抑制剂在慢性粒细胞白血病中的应用[8],以及PARP抑制剂在乳腺癌和卵巢癌中的应用[9,10,11],以及其他几个[12].因此,由于患者和医生的需求不断增加,肿瘤基因组测序平台越来越多地用于指导护理治疗标准以及临床试验的登记。
不幸的是,利用肿瘤分子分析来实现精准医疗的承诺一直面临着几个挑战,只有少数接受测试的患者在临床试验中接受了基因型匹配的靶向治疗[13].这些挑战包括机构因素,如临床试验的可用性,患者因素,如资格标准,足够组织的可用性,确定可操作或可药物的改变,以及实验室因素,如不同测序平台之间缺乏标准化,以及报告时间延长[14].大型研究中心已发表的经验反映了这一现实,只有不到10%的患者在基因型匹配试验中接受治疗,尽管30%或更多的患者具有潜在的靶向性基因改变[15,16].此外,与标准护理疗法相比,基于已确定的可操作DNA突变的治疗的生存益处存在相互矛盾的报告[17,18].重要的是要强调如上所述,多靶向治疗方法现在被认为是标准护理,因此不包括在临床试验设计的一部分,以测试平台的效用。事实上,使用临床试验的登记人数作为效用的读数大大低估了基因检测和精准肿瘤学工作的影响。
俄勒冈健康与科学大学奈特癌症研究所(OHSU KCI)对当前形势有了清晰的认识,开始实施创新的精准肿瘤平台。该平台的概念基础是:癌症是一种由不止一种生物过程驱动的高度适应性状态,理解癌症生物学要比仅从基于dna的分析中获得的信息多得多,并且在个体患者层面上进行的更广泛的分析所获得的信息具有很高的潜力,可以为治疗决策提供信息。由此得出的推论是,单一疗法具有固有的局限性,同时针对多种途径的联合疗法可能会解决这一问题。基于这一概念基础,我们小组设计并启动了分子和建筑对治疗反应的系列测量(SMMART)试验计划。从广义上讲,SMMART计划将对难治性癌症患者的肿瘤进行多组学分析,并将使用这些信息来指导和提供靶向治疗。
为了实现这一目标,一套全面的分析方法将应用于肿瘤样本,包括:肿瘤和循环DNA的全外显子组测序、RNA转录谱、蛋白质表达分析、多重空间分辨免疫组织化学和免疫荧光染色,以及培养中转移性肿瘤药物敏感性的功能谱。认识到组织样本的数量本身就很小,并且提出的分析将需要足够的组织来支持它们,SMMART计划的最初目标是开发涉及组织采集和综合多组学分析的工作流程,特别是建立一套可以实时进行的标准操作程序,以有效地指导晚期癌症患者的治疗。该工作流程将在研究环境中进行初步评估,然后将具有高信息量的方法快速过渡到CLIA实验室。本报告描述了与对晚期癌症患者进行活检相关的指标,包括:活检成功率,分析成功率,基因组分析报告的周转时间,以及检测对治疗决策和患者结果的影响。
方法
病人
经活检证实转移性或局部晚期不可切除的前列腺癌、乳腺癌、胰腺腺癌和难治性急性骨髓性白血病的OHSU KCI患者符合该研究的条件。根据IRB批准的“肿瘤进化和治疗耐药性的分子机制”(MM-TERT)临床方案纳入患者。SMMART项目研究协调员负责征得患者同意,安排组织取样和处理,确保及时向研究科学家和治疗医生报告CLIA检测结果,并最终跟踪患者MM-TERT检测对治疗决策和患者临床结果的影响。合格标准包括:ECOG PS 0-2,转移性疾病可进行活检,以及缺乏出血素质。我们在此报告2017年1月26日至2018年5月30日期间入组的MM-TERT患者。
活检方法
有资格考虑活检的患者由具有身体和肌肉骨骼成像专业知识的经验丰富的诊断放射科医生审查其成像,以评估活检的可行性和安全性。在同意之前,对可能影响最佳体位、抗凝血或抗血小板药物使用、全血计数和凝血试验结果、过敏和依从能力的重大共病进行了回顾。病变通过超声或CT成像确定,并确定一个安全的活检轨迹。患者按照常规临床方案接受镇静治疗。随后经皮将一个17号金属介绍器插入病变,并通过CT或超声进行视觉确认。使用切芯活检针获得2 ~ 7个2厘米长的18号核心活检组织样本,并提交进行分析。为了确认没有并发症或不良事件,获得了活检后图像。
基因测试
所有测试都在clia许可,cap认证的实验室(Knight Diagnostic Laboratories (KDL), OHSU)进行。
由委员会认证的病理学家复查未染色的福尔马林固定石蜡包埋肿瘤组织切片,并通过宏观解剖丰富肿瘤区域。使用市售试剂盒(machine - nagel)提取和纯化总核酸。20纳克DNA使用定制的124癌症基因组(GeneTrails®实体肿瘤综合小组)。该小组中所代表的基因被认为具有潜在的临床操作价值,并根据其与当前临床治疗的相关性进行选择(附加文件)1:表S1)。在这124个基因中,所有编码区对103个基因进行了测序;其余22个基因的已知突变区域被覆盖。该面板基于自定义AmpliSeq引物集(5297个扩增子;使用Illumina NextSeq 500 (2 × 150 bp),每个基因的平均读取深度为> 2000。GATK工具(Broad Institute)用于序列比对和变量调用。自定义脚本用于拷贝数估计[19].来自患者的正常DNA没有测序,因此没有评估已识别突变的种系状态。
微卫星不稳定性使用市售试剂盒(Promega)进行测量,该试剂盒通过PCR和毛细管电泳结合测量5种标准单核苷酸重复标记(BAT-25, BAT-26, NR-21, NR-24和MONO-27)。
使用rna测序法(GeneTrails .)筛选基因融合®基因融合面板),基于自定义QIAseq扩增子库(Qiagen)。该方法可以检测涉及AKT3、ALK、BRAF、EFGR、EML4、ERBB4、ERG、ETV6、FGFR1、FGFR2、FGFR3、MET、NOTCH1、NOTCH2、NRG1、NTRK1、NTRK2、NTRK3、NUTM1、PDGFRA、RAF1和RET的融合。该方法旨在检测涉及这些基因的任何融合伙伴。该面板需要输入30ng的RNA,并在NextSeq 500上运行。分析需要至少100,000个唯一的映射读取。在序列比对(GATK工具)之后,使用StarFusion检测融合。
免疫组织化学
在病理部门使用商业试剂盒(Ventana, Roche Diagnostics)对以下标记物进行免疫组化染色:ER, PR, AR, HER2, Ki-67。PD-L1免疫染色(pharmDx克隆22C3)由PhenoPath实验室(Seattle, WA)进行。p16、RB、PTEN、磷酸化akt和磷酸化erk的免疫染色在德克萨斯大学休斯顿分校Robert Brown博士的实验室进行。
突变指定
临床可操作的突变被定义为可能被研究药物靶向的基因改变。改变TP53而且喀斯特基因不被认为是可行的。
临床患者资料
对电子医疗记录进行了患者人口统计学、肿瘤类型和分期、转移性疾病部位和治疗史的审查。收集活检日期、部位、不良事件和肿瘤细胞信息。
结果
患者人群
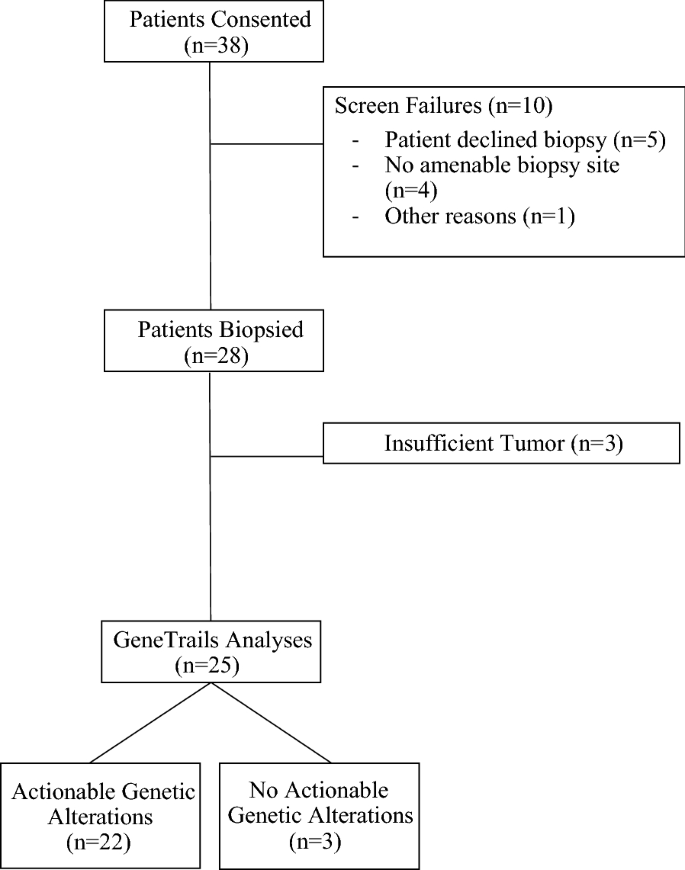
在2017年1月26日至2018年5月30日期间,38例患者接受了MM-TERT, 28例患者接受了肿瘤活检(图2)。1).所有患者都有活检证实的转移性疾病,并正在或计划开始治疗。患者人口统计数据汇总见表1.在四种可能符合条件的癌症中,n = 19人患有乳腺癌,n = 18人患有前列腺癌,n = 1人患有胰腺癌。这反映了现有的胰腺癌和AML现场项目的可用性,导致这些患者参与本研究的比例较低。
程序
在38名同意的患者中,28名患者(71%)成功接受了协议规定的活检。10例筛查失败与患者拒绝活检(n = 5)、缺乏适合活检的部位(n = 4)或其他不明原因(n = 1)有关。
活检部位包括肝脏、骨骼、皮肤、软组织和淋巴结转移。无活检相关不良事件发生。从同意到活检的中位时间为9天(范围0-49天)。值得注意的是,在某些情况下,活检与下一次计划的访问同步,以减轻患者的负担。中位活检细胞数为70%,每次活检获得的中位核数为5个(表2)1).
基因组分析
对收集的28个研究活组织检查中的25个进行GeneTrails。3例患者活检发现肿瘤不充分,无法进行分析。其中,一名乳腺癌患者随后在重新定位扫描中获得了完全的放射学反应,一名前列腺癌患者在骨活检中有硬化组织,这是活检产量的决定因素[20.].另一位前列腺癌患者的骨活检得到了正常组织。从活检日期到GeneTrails报告的中位时间为17天(范围11-46天)。
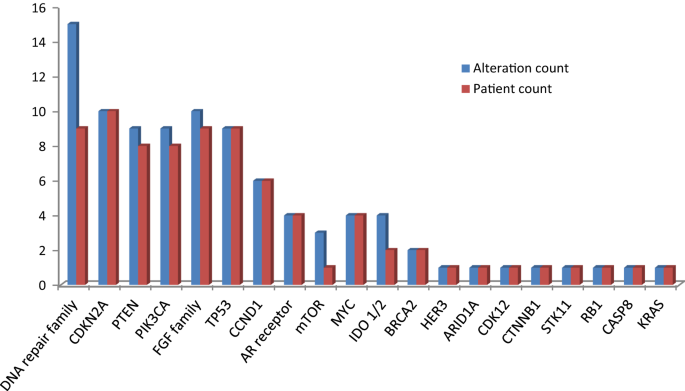
在25个可评估的患者肿瘤中,22个(88%)至少有一个潜在的可操作的基因改变。值得注意的是,18个肿瘤被发现有2个或更多潜在的可操作的基因改变。在25个可评估的肿瘤中,确定的基因改变包括:21个拷贝数改变(84%;乳房和前列腺),14个点突变(56%;乳腺、前列腺和胰腺),8个结构突变(32%;乳房和前列腺)和4个基因融合(16%;前列腺癌)(无花果。2,附加文件1:表S1)。
在25个可评估的肿瘤中,最常见的基因组通路包括细胞周期调节基因,如CDKN2A10/25(40%),和CCND16/25 (24%), DNA损伤修复基因9/25 (36%);的PIK3CA / Akt / mTOR途径,比如PTEN(8/ 25,32%),以及PIK3CA(8/25, 32%);而且FGFR改变(9/ 25,36%)。值得注意的是,TP538例(32%)发生改变喀斯特在胰腺腺癌患者中报告了改变(图。3.).由于样本量较小,频率与畸变预期频率基本一致。
乳腺癌队列
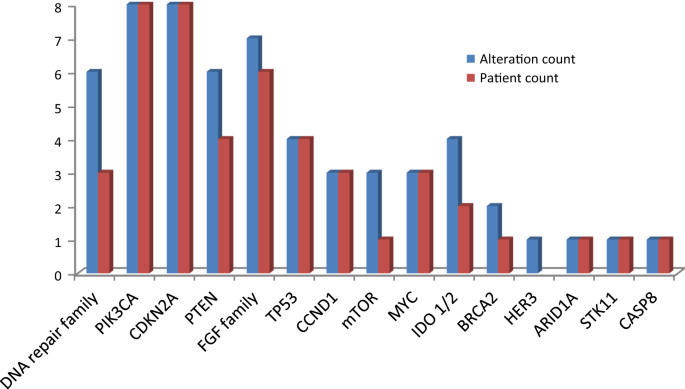
在14例接受研究活检的可评估乳腺癌患者中,9例为激素受体阳性疾病,1例为HER2扩增疾病,1例HER2状态由阳性转变为阴性,2例为三阴性乳腺癌。乳腺癌队列中最常见的可操作的基因改变包括:8PIK3CA(57%), 8CDKN2A(57%), 6FGFRDNA损伤修复改变3例(21%)PTEN(28%)(图。4).
前列腺癌队列
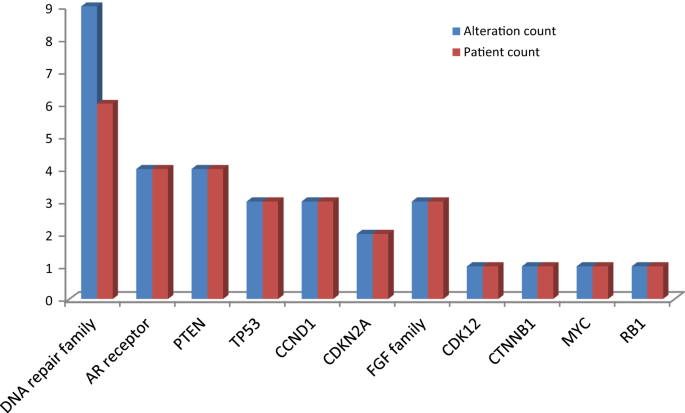
在接受研究活检的10名可评估前列腺癌患者中,9名患者患有转移性去势抵抗性前列腺癌,1名患者患有去势敏感性前列腺癌。所有患者均为前列腺腺癌。在前列腺癌队列中最常见的可操作的基因改变包括:6例DNA损伤修复改变的肿瘤(55%)PTEN(36%)、4基于“增大化现实”技术受体(36%),3CCND1(27%), 2CDKN2A(18%), 2FGF家族改变肿瘤(18%)(图。5).
胰腺癌队列
迄今为止,已有一名胰腺癌患者参与了这项研究。患者活检证实为转移性胰腺腺癌。GeneTrails分析显示基因改变TP53而且喀斯特。在该患者样本中未发现可操作的基因改变。
临床决策
在本研究中,组织采集被设计用于优化对肿瘤样本进行多组学表征。在SMMART试验的MM-TERT阶段,只有GeneTrails分析符合CLIA。因此,只有这些结果被提供给治疗医师和患者。然后,就由医生和病人来决定,如果有必要的话,应该如何处理由此产生的信息。在22例具有可评估肿瘤测序结果的受试者中,5例(23%)患者迄今为止接受了突变引导治疗,其病例如下所述。其余纳入MM-TERT的患者正在接受临床结局的随访。此外,根据已经报道的或未来可能收集的组织的CLIA分析结果,这些患者正在考虑进行后续临床试验。
病人# 1
一名70岁的妇女,转移性激素受体阳性乳腺癌,发展于辅助芳香化酶抑制剂治疗。她表现为腹部不适、不适和弥漫性肌肉骨骼疼痛。患者开始接受帕博西布和氟维司坦治疗。转移性肝活检的基因显示CDKN2A而且PIK3CA改变。基于这些结果,依维莫司被添加到治疗计划中。患者对治疗耐受良好,临床症状缓解。她对持续10个月的治疗取得了部分缓解。患者接受脂质体阿霉素治疗8个月,目前接受卡培他滨治疗。值得注意的是,患者确实在进展中进行了重复肝活检,免疫组化仍为雌激素受体阳性,孕激素受体和HER2阴性。有趣的是,雄激素受体和BCL-2染色也呈强阳性,基于此,她正在考虑采用enzalutamide或venetoclax治疗。
病人# 2
一名38岁女性,转移性激素受体阳性乳腺癌,在转移性环境中接受了两种内分泌治疗(帕博西尼/来曲唑和依维莫司/依西美坦)和两种化疗(卡培他滨,nab-紫杉醇)。胸骨损伤的基因分析显示相关的基因改变,MYC放大,FANCA拷贝号丢失。这些发现使治疗医生能够在不同的机构确定结合CHK途径抑制剂和PARP抑制剂的临床试验,对患者进行筛选。不幸的是,患者在筛查过程中出现肝病快速进展,并决定寻求临终关怀。
病人# 3
一名60岁男性,患有转移性去雄难治性前列腺癌,在转移性环境中接受了7种治疗,包括多西他赛,阿比妥龙,enzalutamide。GeneTrails分析显示CDKN2A基因改变以及WNT途径激活。基于这些发现,患者接受了周期蛋白依赖性激酶4/6抑制剂(palbociclib)靶向联合治疗CDKN2A选择性COX-2抑制剂(西乐葆)靶向WNT通路(21].治疗2个月后,PSA呈上升趋势(但未达到疾病进展参数),患者选择改用卡巴他赛。患者继续接受另外两种标准治疗,但不幸的是,疾病进展,患者在卡巴他赛治疗进展后约6个月去世。
病人# 4
68岁女性,在完成早期乳腺癌局部区域治疗2年后发生转移性激素受体阳性乳腺癌。患者曾接受来曲唑和氟维司坦治疗,转移性伴疾病进展。GeneTrails分析显示CDKN2A拷贝数丢失,PIK3CA致病突变,以及PTEN拷贝号丢失。基于这些发现,在单药氟维司坦治疗进展后,在氟维司坦治疗中加入阿贝马昔利(CDK 4/6抑制剂),患者病情稳定10个月。根据GeneTrail的结果,患者被考虑以依维莫司为基础的治疗,但在阿贝西库和氟维司坦治疗后,她经历了快速的局部进展。她确实在MM-TERT上进行了重复活检以评估肿瘤的演变,然后开始单药卡培他滨治疗,她目前正在接受这种治疗。
病人# 5
一名37岁女性,转移性激素受体阳性乳腺癌,在转移性设置中接受帕博西布/来曲唑和依维莫司依西美坦治疗。患者接受了MM-TERT治疗,并进行了肝活检,结果显示肿瘤雌激素和孕激素阴性,但通过免疫组化和GeneTrails扩增为HER2。GeneTrails分析还揭示了:PIK3CA致病突变,MYC扩增,13号染色体局部丢失(BRCA2, RB1)。根据重复活检的结果,患者在标准护理下不会进行活检,她一直接受紫杉醇/曲妥珠单抗/帕妥珠单抗HER2定向治疗,并对治疗取得了部分反应。
讨论
肿瘤学中的精准医学旨在成功地将患者肿瘤内的基因改变与有效的靶向治疗相匹配,从而提高患者的生存率。随着肿瘤DNA测序技术的广泛应用,我们已经见证了肿瘤学基因组检测的大规模增长,以指导治疗。例如,提供商业测试的基础医学(Foundation medicine)在2017年进行了67375次测试。不幸的是,这种对基因组检测的指数级采用并没有在临床上取得相应的成功。精准医疗在肿瘤学领域的实施面临着若干挑战[14,15],迄今为止,少数接受检测的患者成功地接受了匹配疗法。一些研究试图评估分子检测的效用基于临床试验患者的数量和这些患者的结果。这些方法是重要的里程碑,但未能考虑到接受靶向治疗作为标准治疗的患者,如肺癌中的EGFR抑制剂或CML中的BCR/ABL抑制剂。此外,他们还低估了这些方法在定义新出现的治疗机会方面的效用,例如最近批准的TRK抑制剂用于乳腺癌患者载重汽车融合基因。
在这项研究中,我们报告了建立和标准化组织获取工作流的第一步,以成功实现OHSU的实时空间分辨率,多组学驱动的个性化医疗平台,涵盖患者同意的分子组织分析报告。我们调整了我们的方法,以克服先前报道的精确医学的局限性。在我们的患者队列中,我们首先证明了在没有任何报道并发症的情况下进行转移性活检的安全性和可行性。基于这些发现,OHSU IRB批准了一项协议修正案,允许从纳入的患者获得系列活检。迄今为止,四名接受标准治疗的患者已同意并安全地进行了重复转移部位活检。其次,所获得的大多数活检对基因组检测的收率都很好,只有2个样本报告肿瘤不充分,无法进行分析。有趣的是,其中一例患者在放射学上获得了完全缓解,另一例患者在活检中出现了硬化骨组织,表明对当前治疗有缓解,这解释了病理学结果。第三,GeneTrails定制实体肿瘤小组在大多数肿瘤中确定了可操作的生物学。这是一个至关重要的发现,因为个性化医疗的一个主要障碍是缺乏已确定的可药物遗传改变,以及针对这些改变的可用试验。最后,从活检到分子分析的周转时间很快,中位数为17天。 This falls well within the commonly used 28 day washout period in most clinical trials, and thus is unlikely to delay patient care, either on standard regimens or investigational therapies. Moving forward, we have dedicated research staff that (1) work with Knight Diagnostic Laboratories to ensure timely processing and CLIA assay reporting, (2) ensure tissue processing and delivery to the appropriate research labs, and (3) work with clinicians and basic scientists to prioritize and track testing on each collected samples. This will ensure that we are able to deliver on required timelines as we move into the therapeutic clinical trial phase of the SMMART program.
在我们实施这个组织采集和分析过程中,我们观察到一个我们认为非常重要和有影响力的现象。具体来说,GeneTrails的结果为医生和患者提供了探索肿瘤生物学、探索新的合理疗法或相关临床试验的机会。在医生层面,癌症生物学家与治疗提供者会面,解释CLIA组学发现中所代表的潜在生物学的基础。在患者层面,这一过程极其重要,因为它为迄今为止没有治愈性治疗方法的晚期癌症提供了新的治疗途径。此外,它为晚期诊断的患者提供了一个探索各种可能性的机会,而且它是在癌症生物学的合理基础上这样做的。值得注意的是,MM-TERT招募了处于转移性癌症不同治疗阶段的患者,目的是优化分析过程。CLIA分析的结果提供给治疗医师,如果认为合适,就采取行动,但方案没有规定特定的治疗方法。因此,MM-TERT并不影响患者获得可用的标准护理疗法。在我们迄今为止的研究中,我们报告了基因组分析影响治疗决策的实例,包括开发新的药物组合,针对不同的适应症重新利用FDA批准的疗法,以及确定研究性临床试验的资格。
这项研究的发现将为下一次SMMART试验提供基础,其目标是:首先,根据实时报告的近端活检,为患者提供合理的生物驱动的靶向治疗,以改善他们的结果;其次,从广泛的分析中产生的数据将提高我们对癌症生物学以及对治疗的敏感性和耐药性机制的理解;第三,SMMART将为实验治疗领域的新方法提供信息。目前正在进行的下一步是建立一个由医学肿瘤学、分子病理学、临床前研究人员、计算生物学、研究协调员和临床药学组成的分子肿瘤委员会。肿瘤委员会将开会审查患者的临床、病理和分子数据,包括GeneTrails和更广泛的肿瘤衍生分析,并与最佳已建立的参考文献进行交叉引用,为患者的下一步治疗提供建议。重要的是,这是基于我们对癌症生物学的最新理解,以及我们从每个肿瘤的深度空间解析分析中提取尽可能多的信息的最新能力。由于每个方案都允许进行连续的治疗中活检,比较治疗前和治疗后的样本将提供关于肿瘤生物学的实时信息,以识别和靶向耐药途径,以改善患者的预后。进一步同步分析循环肿瘤DNA将支持该平台在监测反应和耐药性方面的应用,并有可能替代某些肿瘤活检。最后,随着免疫肿瘤学的出现,SMMART将包括最佳可用的生物标志物(包括迄今为止的PD-L1、微卫星不稳定性和肿瘤突变负担检测),以确定可能受益于免疫治疗组合的患者。
实施精准医疗的另一个主要障碍是获得临床试验的机会,这是基于地点、位置可用性和患者资格的。在SMMART试验计划下的治疗方案中,由FDA批准的33种疗法将在慈善机构的资助下提供给注册患者。这些疗法将包括化疗、靶向疗法以及免疫疗法。这真正使OHSU的研究人员能够实施分子肿瘤委员会的建议,因为它消除了临床医生和患者尝试应用个性化药物的巨大障碍。该治疗工具包的可用性,再加上旨在确定每个患者在其疾病临床过程中每个时间点的“最适合”治疗方案的分析过程,构成了一种设计策略,其中分析不排除患者,而是专门设计为包括所有患者。嵌入SMMART平台的综合多组学分析将用于识别新型生物标志物,并为研究新型治疗组合(包括新型靶向和免疫疗法)的下一代临床试验提供假设。
结论
总之,我们在这里报告我们迈向OHSU个性化医疗平台的第一步。利用多学科方法,我们在短时间内成功地积累了患者并优化了我们的工作流程。这将成为下一代SMMART试验计划的基础,旨在在正确的时间为正确的患者提供最好的治疗,并改善晚期癌症的结果。
缩写
- 也是OHSU科:
-
俄勒冈健康与科学大学奈特癌症研究所
- MM-TERT:
-
肿瘤进化与治疗耐药性的分子机制
- SMMART:
-
分子和结构对治疗反应的系列测量
参考文献
癌症基因组图谱N.人类乳腺肿瘤的综合分子图谱。自然。2012;490(7418):61 - 70。
原发性前列腺癌的分子分类学。细胞。2012;163(4):1011 - 25所示。
癌症基因组图谱研究网络,电子地址aadhe,癌症基因组图谱研究N.整合基因组特征的胰腺导管腺癌。中国癌症杂志,2017;32(2):185-203。
彼得斯,Camidge DR,肖AT,等。艾乐替尼与克唑替尼在未治疗alk阳性非小细胞肺癌中的比较。中华实用医学杂志,2017;29(9):829-38。
肖文华,金德伟,中川凯,等。克唑替尼与化疗在晚期alk阳性肺癌中的比较。中华实用医学杂志,2013;29(3):344 - 344。
王志强,王志强,等。厄洛替尼与标准化疗作为欧洲晚期EGFR突变阳性非小细胞肺癌(EURTAC)患者的一线治疗:一项多中心、开放标签、随机3期试验《医学杂志》2012;13(3):239-46。
费海提KT, Infante JR, Daud A,等。结合BRAF和MEK抑制与BRAF V600突变的黑色素瘤。中华实用医学杂志,2012;29(3):344 - 344。
何贺豪斯,拉尔森,吉侯特,等。伊马替尼治疗慢性髓系白血病的长期结果。中华实用医学杂志,2017;29(3):344 - 344。
张志刚,张志刚,张志刚,等。尼拉帕尼维持治疗铂敏感、复发性卵巢癌。中华实用医学杂志,2016;29(4):344 - 344。
张志强,李志强,张志强,等。奥拉帕尼片作为铂敏感、复发性卵巢癌和BRCA1/2突变(SOLO2/ENGOT-Ov21)患者的维持治疗:一项双盲、随机、安慰剂对照、3期试验《医学杂志》2017;18(9):1274-84。
罗布森M, Goessl C, Domchek S. Olaparib转移种系brca突变乳腺癌。中华实用医学杂志,2017;29(3):344 - 344。
Subbiah V, Kurzrock R.揭穿了精确肿瘤学是一种幻觉的错觉。肿瘤学家。2017;22(8):881 - 2。
普拉萨德V.精准肿瘤学的错觉。大自然。2016;537 (7619):S63。
坦诺克是,希克曼是。个体化癌症药物的局限性。中华实用医学杂志,2016;29(3):349 - 349。
李志强,李志强,等。大规模基因组检测的可行性,以促进基因组匹配临床试验的登记。中华临床肿瘤学杂志,2015;33(25):2753-62。
苏哈尔DP,瑞尼BI,霍拉纳AA,等。实体瘤精密肿瘤学的前瞻性临床研究。中华肿瘤学杂志,2015;36(3):334。
李志强,李志强,李志强,等。基于肿瘤分子分析的分子靶向治疗与晚期癌症的传统治疗(SHIVA):一项多中心、开放标签、概念证明、随机、对照的2期试验。《医学杂志》2015;16(13):1324-34。
Schwaederle M,赵敏,李俊杰,等。精准医疗对不同癌症的影响:ii期临床试验的荟萃分析。中华临床肿瘤学杂志,2015;33(32):3817-25。
郭志强,王志强,等。评估靶向的、基于扩增子的下一代测序数据中的拷贝数变化。中华分子病理学杂志,2015;17(1):53-63。
李文强,李志强,等。ct引导下转移性去势抵抗性前列腺癌的骨活检:最大肿瘤产量的预测因素。血管放射学杂志,2017;28(8):1073-81。
陆伟,Tinsley HN, Keeton A, Qu Z, Piazza GA, Li Y.抑制Wnt/ β -catenin信号通路抑制前列腺癌细胞增殖。中国药物学杂志。2009;602(1):8-14。
作者的贡献
ZM:概念化、数据管理、形式分析、调查、方法论、监督、验证、可视化、写作-初稿、写作-审查和编辑。SW:概念化,数据管理,调查,方法论,监督,可视化,资源,验证,项目管理,写作-审查和编辑。BJ, JMK:概念化,数据管理,形式分析,调查,方法论,项目管理,资源,软件,验证,可视化,写作-审查和编辑。AK:概念化,项目管理,资源,资金获取,资源,监督,写作-审查和编辑。MM:数据管理,资源。ARG, JJA, CLC:数据管理,形式分析,调查,方法论,项目管理,资源,监督,验证,写作-原稿,写作-审查和编辑。BRB:数据管理,形式分析,调查,方法论,项目管理,资源,监督,验证。UB, CDL, KAK, TMB:调查,方法,项目管理,资源,监督。GBM:概念化、资金获取、调查、方法论、项目管理、资源、监督、验证、可视化、写作-审查和编辑。JWG, RCB:概念化,数据管理,形式分析,资金获取,调查,方法论,项目管理,资源,软件,监督,验证,可视化,写作-原始草案,写作-审查和编辑。 All authors read and approved the final manuscript.
确认
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
数据和材料的可用性
在这项研究中产生或分析的所有数据都包含在这篇发表的文章[及其附加文件]中。
发表同意书
不适用。
伦理批准并同意参与
所有人体调查均经OHSU机构审查委员会批准后进行。研究人员获得了每位研究参与者的知情同意。
资金
前景溪基金会。资助机构没有参与研究设计;数据的收集、分析或解释;在写手稿的时候。
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
作者信息
作者及隶属关系
相应的作者
额外的文件
附加文件1:图S1。
GeneTrails综合实体肿瘤小组。表S1。每个MM-TERT患者的基因组改变列表。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
米特里,z。i。帕玛尔,S。约翰逊,B。et al。实施综合转化肿瘤学平台:从分子检测到可操作性。翻译医学杂志16, 358(2018)。https://doi.org/10.1186/s12967-018-1733-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-018-1733-y
关键字
- 精密肿瘤学
- 转化研究
- 靶向治疗
- 生物标记物
- 临床试验