病人
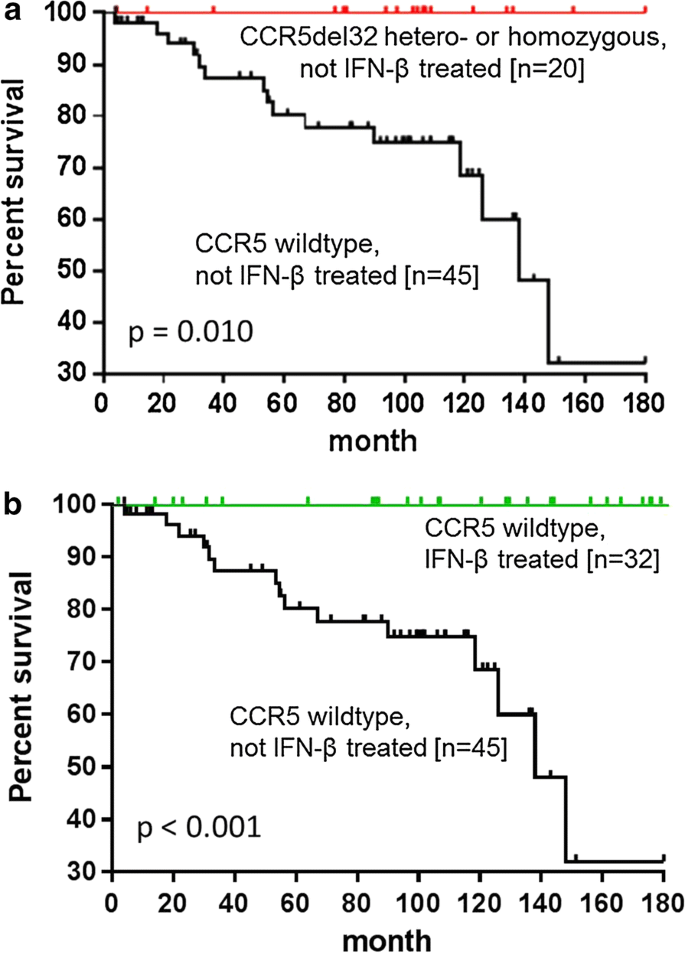
与我们最近的研究相似[9],纳入97例患者(平均年龄±标准差50.5±13.8岁;基于活检的基线和PCR证实肠道病毒感染过程与CCR5多态性和15年全因死亡率相关的随访信息(平均±SD随访期99±55个月)。在1998年至2013年期间获得的5000多例患者样本中,只有97例EMB患者被证实感染了肠道病毒,并随访发现了EMB。所有患者在> ~ 6个月内均表现为中重度心衰症状,包括用力时呼吸困难、虚弱、乏力、体力下降或休息时心绞痛和非缺血性壁运动异常。其他合并疾病如冠状动脉疾病、肥厚性或限制性心肌病、右心室发育不良、瓣膜疾病、无控制的高血压史(> 170/95 mmHg)、酒精或药物摄取增加、肾功能衰竭、慢性阻塞性肺疾病、或已知心脏受累、可解释左心室功能障碍的系统性和自身免疫性疾病的患者通过血管造影、超声心动图和实验室计数被排除。所有患者首次就诊时均接受EMB检查是否存在心肌内炎症和心源性病毒,并在随访6个月时接受EMB检查以确定EV感染的过程[5,9].与2012年的初步报告相比[9],死亡率回顾性分析的时间窗口已延长至15年,并考虑了CCR5基因型作为额外的预测标记。此外,由于CCR5基因分型和血清细胞因子分析样本的可用性,纳入的患者数量与最初的报告有所不同。
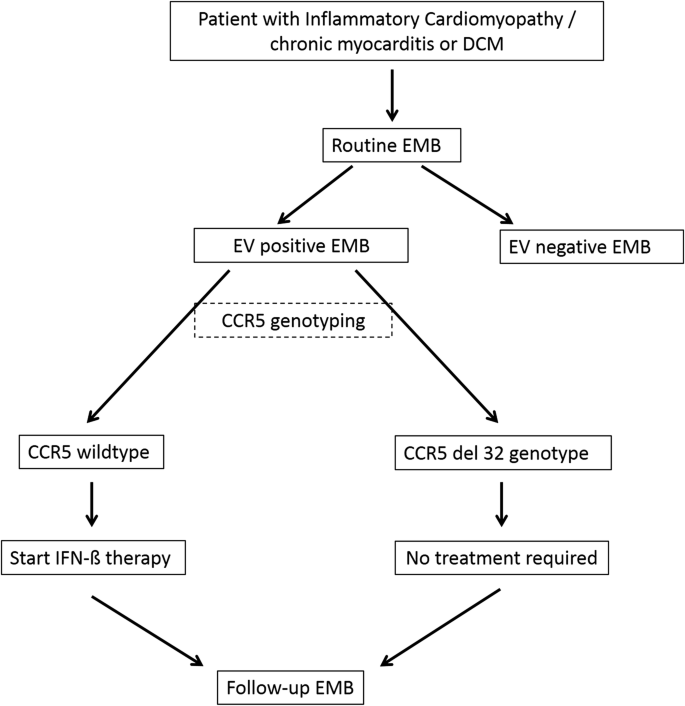
最初,根据以前的分类,根据患者的疾病结局治疗定义了三组患者[9]:自发清除EV者为EV清除,6个月内不能自行清除病毒者为EV持续,EV持续6个月且接受IFN-β治疗导致病毒清除者为EV + IFN-β [10].治疗患者的选择如前所述[9].简而言之,在干扰素治疗组,在病毒阳性的随访活检后4个月内(平均±标准差2.3±1.9个月)开始治疗,因为病毒持续6个月被认为是慢性感染。除了持续心力衰竭药物外,6个月内每隔一天服用800万单位的IFN-β [10].临床参数、用药、性别和年龄在患者组间无显著差异。终点(死亡)的发生是通过直接了解患者的状态、与家庭成员的联系或在登记处询问来确定的。所有患者均书面知情同意进行数据存储和评估。这项研究符合《赫尔辛基宣言》中概述的原则,并得到了当地伦理委员会的批准。患者的数据被匿名化以供分析。临床资料见表1.
EMB总RNA的分离、逆转录和巢式pcr检测肠道病毒RNA
在常规EMB诊断过程中,使用Trizol试剂(Life Technologies, Darmstadt, Germany)分离总rna,用DNAse (PeqLab, Erlangen, Germany)处理以去除任何基因组DNA痕迹,并使用随机六聚体用High Capacity Kit (Life Technologies, Darmstadt, Germany)反转录为cDNA。采用嵌套pcr检测肠道病毒基因组,如其他地方所述[4,5].
PBMC基因组DNA分离及CCR5基因分型
从红细胞裂解的EDTA血液(1ml)中提取基因组DNA,使用Puregene Mousetail Kit (Gentra, Minneapolis, MN, USA)根据制造商的协议进行提取。
进行PCR检测CCR5多态性,得到长度为262 bp、230 bp或两者均为的PCR产物[22].将分离的DNA进行PCR扩增,引物为染色体3p21.31 (Accession No: NM_000579)上可能缺失的32 bp CCR5基因,正向引物HRF 5 ' -CTTCATCATCCTCCTGACAATCG-3 '和反向引物HRR 5 ' -GACCAGCCCCAAGATGACTATC-3 '。反应混合物为:2.5µL 10× AmpliTaq缓冲液,1µL正向引物和1µL反向引物,4µL 100mm dNTPs, 0.25µL 5u /µL AmpliTaq酶,13.75µL水溶液,将体积调整为22.5µL和2.5µL患者样本gDNA。PCR在Eppendorf Mastercycler (Eppendorf, Hamburg, Germany)中进行,条件如下:95℃初始变性步骤7 min, 95℃变性45 s 35个循环,57℃退火45 s, 72℃延伸45 s, 72℃最终延伸10 min。PCR产物在溴化乙粒染色的2%琼脂糖凝胶上进行电泳分离,并用紫外光进行观察。PCR产物长度为262 bp的CCR5基因为野生型,230 bp的CCR5纯合缺失32 bp,均为杂合表型(具体内容见附加文件)1:图S1)。
血清细胞因子水平的多重测量
使用17-plex Human Cytokine Panel Kit (Bio-Rad Laboratories, Inc.)检测血清中总共17种细胞因子和趋化因子。Hercules, CA, USA)在第一次活检时。使用基于流量的Luminex™100悬浮阵列系统(Bio-Plex 100, Bio-Rad实验室)对珠组进行分析。样本细胞因子浓度由Bio-Plex Manager软件(Bio-Rad Laboratories)计算,使用由制造商提供的已知参考细胞因子浓度衍生的标准曲线的五参数模型。
统计分析
描述性统计包括分类变量的绝对频率和相对频率以及定量测量的平均值和标准偏差。学生的t-test、Fisher精确检验、单因素方差分析、卡方分布和Kaplan-Meier对数秩统计用于组间比较。所有Kaplan-Meier生存分析均使用从抽样到死亡/普查的时间进行。进行逻辑回归以确定独立区分诊断组的CCR5基因型。所有概率值均为双尾:p值低于0.05认为有统计学意义,*p < 0.05 **p < 0.01 ***p < 0.001用星号标记。未进行Bonferroni校正。使用IBM SPSS Statistics 23(国际商业机器公司,纽约,纽约,美国)进行所有统计分析,使用GraphPad Prism 4 (GraphPad软件公司,拉霍亚,加州,美国)软件生成所有图表。