摘要
背景
胰腺腺泡细胞癌(PACC)是一种罕见的恶性肿瘤,占所有胰腺肿瘤的< 1%。很少有回顾性研究可以帮助指导管理。我们之前报道了一例转移性PACC患者在接受阿霉素治疗后延长了生存期。个性化治疗是基于从肝转移的原代细胞中收集的分子和体外数据。我们现在报告了一种源于该患者PACC肝转移的患者源性肿瘤异种移植(PDTX)小鼠模型的特征。
方法
活检组织碎片(5毫米)3.)移植到无胸腺裸鼠体内。肿瘤生长并从宿主小鼠转移到新的小鼠,以测试治疗反应。免疫组化(IHC)生物标志物被用来证实PDTX模型代表人类PACC。检测5-FU、伊立替康、奥沙利铂、吉西他滨、贝伐单抗、厄洛替尼、阿霉素、伊马替尼等多种药物的抗肿瘤活性。测量肿瘤大小超过74天或直到它们达到终点体积约800毫米3..测定血清脂肪酶水平的试验和肿瘤组织的组织学分析也用于评估PACC的进展和再分化。
结果
这里提出的模型表达了在人类PACC中发现的相同的IHC标记。在化疗研究中,奥沙利铂产生了延长的持久生长反应,与凋亡增加、血清脂肪酶水平降低和健康腺泡细胞增加相关。贝伐珠单抗也产生了显著的生长反应,但效果并没有像奥沙利铂治疗所证明的那样延长。其他化疗效果中等或很小,特别是在治疗停止后。DNA修复基因突变在PACC中很常见,并增加肿瘤对奥沙利铂的易感性。为了探索这一点,我们进行了免疫组化,在我们的模型中没有发现BRCA2的核表达,这表明突变影响了核定位。基因测序证实BRCA2在外显子10上有纯合基因缺失,这通常会导致蛋白质截断。
结论
总之,我们报告了首个也是唯一一个临床前PACC PDTX模型的发展和特征。在这里,我们展示了单一药物奥沙利铂的持续抗肿瘤活性,这种化合物在DNA修复基因突变的肿瘤中更有效。我们的数据显示,BRCA2在我们的PACC模型中发生突变,这可能有助于观察到奥沙利铂的敏感性。对这种罕见的PACC模型的进一步研究可以用于阐明其他新的治疗方法、生物标志物和信号传导和耐药性的分子机制。
背景
胰腺腺泡细胞癌(PACC)是一种罕见的致命疾病,占所有胰腺肿瘤的不到1% [1- - - - - -4].672例PACC患者的回顾性研究报告中位生存期为47个月[5].对斯隆凯特琳纪念医院1981年至2001年患者的回顾发现,转移患者的中位生存期为14个月,而无转移患者的中位生存期为38个月[1].一项随访回顾性研究回顾了2000年至2011年的患者,发现局部切除肿瘤患者的中位生存期为57个月,转移性肿瘤患者的中位生存期为19个月[6].
PACC患者常以腹痛和腹胀为主要症状,在某些病例中,其初步临床诊断为急性胰腺炎[1,7,8].血清脂肪酶水平升高可能与全身性脂肪坏死有关,这是PACC患者发病的重要原因[9- - - - - -12].然而,在PACC和急性胰腺炎中均可见血清脂肪酶和淀粉酶水平升高,导致难以建立正确的诊断[13,14].可靠的PACC标记物已经慢慢出现,如癌胚抗原(CEA) [15],细胞角蛋白18 (CK18) [16]及b细胞淋巴瘤/白血病10 (BCL10) [17,18]使我们能够从组织学上区分腺泡细胞癌与正常腺泡细胞或其他胰腺癌。
导致PACC的遗传和分子异常尚未完全确定。近年来的研究发现,PACC患者中调节DNA修复的基因可能发生突变。45%的PACC肿瘤存在DNA修复突变,其中BRCA2是最常见的基因,其次是BRCA1和ATM20 [3.,6,19].此前,我们报道了一例PACC患者接受基于其肿瘤基因和分子谱的个人设计的治疗[20.].我们将患者的肿瘤活检组织培养成原代细胞系,并用不同的化疗药物对其进行处理[20.].结果表明,DNA复制抑制剂(伊立替康)、DNA插层剂和转录抑制剂(阿霉素)和酪氨酸激酶抑制剂(伊马替尼)在细胞培养中对他的肿瘤细胞最有效[20.].根据体外观察结果,给予阿霉素脂质体,患者在整个治疗方案中有持续临床反应的证据[20.].
在这里,我们报告了一个PACC患者来源的肿瘤异种移植(PDTX)小鼠模型(PA-018)的特征,该模型来自患者的肿瘤活检。使用PA-018,在体内测试了多种化疗(5-FU、奥沙利铂、吉西他滨、脂质体阿霉素)和靶向药物(伊立替康、贝伐单抗、厄洛替尼、伊马替尼)。在测试的疗法中,奥沙利铂是最有希望的,仅在3周治疗后就表现出持续的抗肿瘤活性。因此,使用PDTX模型评估潜在的有效治疗方法是一种可行的技术,可能有助于发现针对这种罕见肿瘤的有效治疗方法。我们为PACC科学界提供了第一个人类来源的PACC肿瘤模型。
方法
PDTX模型的开发
根据IACUC批准的程序,将PACC肝转移的活检组织皮下植入2只5周龄麻醉的无胸腺裸鼠069株(Harlan Laboratories, Indianapolis, IN)。收获植入的肿瘤并冷冻成5毫米3.在10% DMSO-DMEM培养基中进行多次传代,并在无胸腺裸鼠中继续进行。将该技术应用于患者的肿瘤,创造了PACC组织的可再生来源和具有代表性的体内模型,以测试有前景的药物。这种PACC PDTX型号可在Charles Rivers (CR) Discovery Services (Morrisville, NC)购买。
体内移植与肿瘤生长
在体内研究中,6周龄雌性无胸腺裸鼠品系#490 (CR Discovery Services)被皮下植入5毫米3.肿瘤碎片进入右侧。他们被随意喂食NIH 31改良和辐照的实验室饮食®由18.0%粗蛋白质、5%粗脂肪和5%粗纤维组成,放置在经过辐照的Enrich-o 'cobs™实验动物床上,置于静态微隔离器中,在20-22°C(68-72°F)和40 - 60%湿度下,光照周期12小时。CR探索服务特别遵守《实验动物护理和使用指南》关于约束,饲养,外科手术,饲料和液体调节,以及兽医护理。CR探索服务的动物护理和使用计划得到了国际实验动物护理评估和认可协会的认可,该协会确保符合公认的护理和使用实验动物的标准。
55天后(约14周龄),即研究的第一天,小鼠被分为治疗组,每个肿瘤体积从75到245毫米不等3.组平均肿瘤体积164 ~ 170 mm3..肿瘤大小,单位:毫米3.的计算公式为:
在哪里w是宽度和l是肿瘤的长度,单位为毫米。肿瘤重量的估计假设为1mg相当于1mm3.肿瘤体积。
试验用品和给药方案
在给药的每一天准备以下治疗方法:5-氟尿嘧啶或5- fu (TEVA制药公司,50 mg/mL, Lot# 6102655)用无菌5%葡萄糖水(D5 W)稀释至10 mg/mL,并以100 mg/kg腹腔内(ip)每周给药,持续3周。注射用伊立替康溶液(山德士制药公司,20mg /mL,批号# CF0165)用D5 W稀释至10mg /mL,每周一次,以100mg /kg ip给药,持续3周。奥沙利铂原液(Eloxatin®,赛诺菲安万特,5mg /mL,批号CH630)用无菌D5 W稀释至1mg /mL,提供10mg /kg的剂量,每周一次,连续3周。吉西他滨(吉®(Eli Lilly, Lot# A906313D)用无菌生理盐水(0.9% NaCl)重组至12 mg/mL,每天ip给药120 mg/kg,每3天一次,共4次。贝伐珠单抗(Avastin®, Genentech, Lot# 956583, 25mg /mL)用生理盐水稀释至0.5 mg/mL,提供5mg /kg的剂量,每周两次,连续5周。脂质体阿霉素(Doxil, Sequus Pharmaceuticals, Inc., 2 mg/mL, Lot# 1107161)在生理盐水中稀释至0.3 mg/mL,提供3mg /kg的剂量,每周一次静脉注射(静脉注射),持续3周。甲磺酸伊马替尼(格列卫®(诺华制药公司,100 mg片剂)通过在注射用无菌水中重悬所需剂量的片剂制备给药悬液,以产生最终浓度为10 mg/mL,然后以100 mg/kg口服(po),每天一次,连续28天。厄洛替尼(特罗凯®(OSI Pharmaceuticals, Inc., Lot# 1121701CW, 100 mg片剂)的制备方法是将所需剂量的片剂在1% CMC: 0.1% Tween80的无菌水中重悬,以产生8 mg/mL的最终浓度,然后以80 mg/kg的剂量口服,每天一次,持续15天。在所有组中,将10 mL/kg (0.2 mL/20 g小鼠)的给药量缩放到每只动物的体重。
端点
使用卡尺每周测量两次肿瘤。当肿瘤体积达到终点800毫米时,每只动物被安乐死3.或者第74天,看哪个先来。每只小鼠到终点的时间(TTE)由以下公式计算:
TTE以天为单位,端点体积以毫米为单位3., b为截距,m为对数变换肿瘤生长数据集线性回归得到的直线斜率。数据集由超过分析中使用的终点量的第一个观测值和在达到该终点量之前的三个连续观测值组成。任何没有达到终点的动物都在研究结束时被安乐死,并分配一个与研究最后一天相等的TTE值。任何被确定死于治疗相关(TR)原因的动物都应被赋予与死亡日期相等的TTE值。任何死于非治疗相关(NTR)原因的动物都被排除在分析之外。
治疗效果由肿瘤生长延迟(TGD)确定,TGD定义为治疗组与对照组相比中位TTE的增加:
以天为单位,或以对照组TTE中位数的百分比表示:
其中T为治疗组TTE的中位数,C为对照组1的TTE中位数。
毒性
经常观察试验动物是否有明显的不良症状,治疗相关的副作用,并记录毒性的临床症状。测试动物也每周称重两次,任何超过可接受体重(BW)损失限制的动物都将被安乐死。任何超过可接受的平均体重损失限度的组都暂停给药。如果平均体重恢复,则该组可以恢复给药,但剂量较低或给药频率较低。最大耐受剂量(MTD)的可接受毒性定义为试验期间各组平均体重损失小于20%,且TR死亡率不超过10%。由临床体征和/或尸检证明的治疗副作用导致的死亡,或在给药期间或最后一次给药后14天内未知原因导致的死亡,被归类为TR。如果没有证据表明死亡与治疗副作用有关,则将死亡归为NTR。
统计分析和图形演示
所有统计分析和图形演示均使用Prism (GraphPad) for Windows 6.02。采用logrank检验来评估两组患者总体生存经历差异的显著性。logrank检验分析了一组中所有动物的个体tte,除了那些因NTR死亡而失去研究的动物。双尾统计分析在P= 0.05。Prism报告结果为无显著性(ns)P> 0.05,在0.01 <时显著(用“*”表示)P≤0.05,在0.001 <时非常显著(“**”)P≤0.01且极显著(“***”)P≤0.001。由于logrank检验是一种显著性检验,不提供组间差异大小的估计,因此在本报告中,所有显著性水平都报告为显著性或不显著性。当动物因肿瘤大小或TR死亡退出研究时,该动物记录的最终肿瘤体积与用于计算后续时间点的中位体积的数据一起计入。当一组可评估动物中超过50%的肿瘤生长到终点体积或治疗超过MTD(≥20%体重减轻或> 10% TR相关死亡率)时,肿瘤生长曲线被截断。
血清脂肪酶
在给药前和第15天,每组n = 5只小鼠在EDTA收集管中无麻醉下舌下采血。由IDEXX实验室(Westbrook, Maine)收集并分析血清脂肪酶水平。
免疫组化(IHC)和免疫荧光(IF)
收集福尔马林固定的组织,并将其包埋在石蜡中。为每个治疗组的所有肿瘤组织构建组织芯片(TMA),并用于IHC分析。将TMA组织切成5mm切片,脱蜡、水化,提取抗原,用含有背景还原成分的稀释剂阻断(Dakocytomation,丹麦)。分别用癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)、嗜色粒蛋白A (CgA)和细胞角蛋白19 (CK19)[1:100,抗小鼠啮齿动物阻断(Dakocytomation)]对TMA或PA-018单独进行免疫染色;Mist-1[1:2000]和cleaved caspase-3 (CC3) [1:100 hi pH值,抗兔(Cell Signaling, Beverly, MA)];淀粉酶[1:1000,抗兔子(Sigma-Aldrich, St.Louis, MO)];脂肪酶[1:1600]、BRCA1[1:10 00]和I型胶原蛋白[1:1500,抗兔(Abcam, Cambridge, MA)];BCL-10[1:200,抗兔]和CD31[1:100,抗山羊(Santa Cruz, CA)];BRCA2[1:500,抗小鼠(研发系统)]。对于免疫组化,根据制造商的说明使用Envision双标记聚合物试剂盒(DakoCytomation),然后在脱水和安装前用Gill I苏木精(Sigma-Aldrich)轻微反染色。 Images were obtained using Scanscope XT (Aperio Technologies, Vista, CA) and the staining of the TMA punches were scored using an algorithm in the Imagescope software (Aperio Technologies) created by a histologist based upon signal intensity (0, 1+ , 2+ , 3+) and percentage. For immunofluorescence, tissue was incubated with AlexaFlour 594-conjugated secondary antibody (Invitrogen) and mounted with Vectashield containing DAPI (Vector Laboratories, Burlingame, CA). Images were acquired on a Zeiss LSM 880 confocal laser scanning microscope (Carl Zeiss MicroImaging, Inc, Thornwood, NY).
基因突变分析
从PA-018的新鲜冷冻样本中分离出DNA,并进行定制捕获(eArray;BRCA2编码外显子的编码区和内含子/外显子边界的Agilent, Santa Clara, CA)。每个捕获反应的产物在HiSeq 2000 (Illumina, San Diego, CA)上测序,并按照Couch等人的描述进行分析。[21].
结果
PACC PDTX小鼠模型的表征
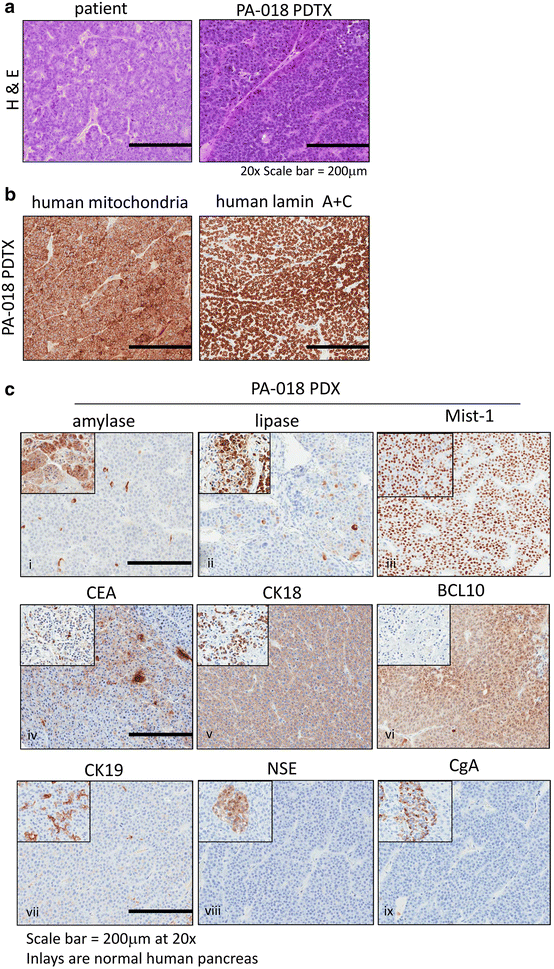
PA-018是一种胰腺腺泡细胞癌(PACC) PDTX小鼠模型,来源于既往病例报告中描述的患者的转移性肝活检[20.].PA-018的组织学特征与患者胰腺原代组织的组织学特征相似。1a).这些特征包括细胞核未分化和细胞质双性的实性、腺泡样生长模式。免疫组化(IHC)检测人特异性线粒体表面蛋白和人层蛋白A+C,证实异种移植瘤细胞来源于人(图2)。1b).短串联重复序列(STR)分析显示,我们的PDTX肿瘤的遗传特征(传代5)与患者的遗传特征密切匹配(注意到等位基因缺失)。用于比较的DNA来自PA-018活检前3年的样本,因为无法获得组织(附加文件)1:表S1)。
与正常人胰腺相比,PA-018的免疫组化表征显示淀粉酶和脂肪酶的细胞质表达减少,而胰腺腺泡标志物Mist-1 [22,在肿瘤组织中广泛表达(图;1C,面板i-iii)。PA-018也表达了先前记录的PACC标记物,包括CEA [15], ck18 [16]及BCL10 [17,18(图。1c,图iv, vi),缺乏细胞角蛋白19 (CK19)表达,CK19是导管和胰腺导管肿瘤的标记物[23(图。1c, vii)。由于PACC可能具有异质性肿瘤群体,其中包括神经内分泌来源的癌细胞,我们对神经内分泌标志物进行染色,如神经元特异性烯醇化酶(NSE)和嗜铬粒蛋白A (CgA)。与正常人胰腺胰岛细胞相比,PA-018 NSE和CgA均为阴性[24(图。1C,面板8 - ix)。
对不同化疗方法的评估表明,奥沙利铂在PACC PDTX小鼠模型中维持肿瘤生长抑制作用
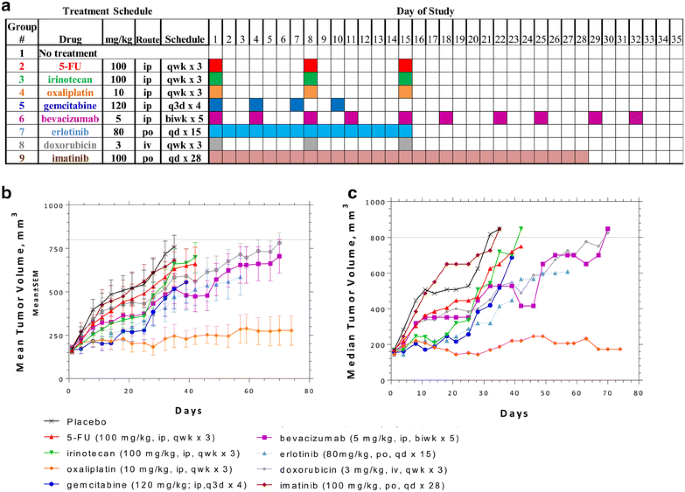
为了研究不同单一疗法的效果,PA-018被扩大和4毫米3.将组织(段落5)体外植入无胸腺裸雌性小鼠的侧翼。一旦肿瘤达到平均100毫米,就开始治疗3..测试的药剂包括;DNA合成抑制剂(5-FU,吉西他滨),DNA烷化剂(奥沙利铂),DNA插层剂(脂质体阿柔比星),拓扑异构酶抑制剂(伊立替康),EGFR抑制剂(厄洛替尼),c-kit抑制剂(伊马替尼)和血管生成抑制剂(贝伐单抗)。这些药物选择的基本原理是基于先前对患者肿瘤组织进行的基因阵列和蛋白质分析[20.].可能的药物治疗和与上调基因的相互作用包括:CES2(伊立替康),TOP2B(脂质体阿霉素)和DNA修复基因(奥沙利铂)。上调的蛋白包括EGFR(厄洛替尼)和c-kit(伊马替尼)[20.].治疗计划、剂量、路径和频率总结在图中。2一个。
附表和给药剂量是根据查尔斯河发现公司进行的几项实验得出的最大有效剂量和/或最大耐受剂量的混合。剂量的范围反映了以前在文献中看到的临床前研究[25- - - - - -33].
即使在治疗方案结束后,肿瘤生长也被单独监测,并允许生长到650-800毫米的终点3.最多74天。该策略测试了抗肿瘤活性的治疗持久性,以确定“到终点时间”(TTE)。一旦肿瘤负荷达到终点,或如果一组可评估动物中仍有少于50%的动物留在研究中,该组就终止。当个别小鼠因“治疗相关”(TR)死亡而退出研究时,将动物记录的最终肿瘤体积与数据一起计算后续时间点的平均和中位肿瘤体积,如图虚线所示。2b, c.评估为“非治疗相关”(NTR)的死亡不包括肿瘤生长量。在NTR死亡的情况下,对样本量(n)进行了调整。2;表格1).
绘制每个治疗组的平均和中位肿瘤体积图显示,伊马替尼对肿瘤生长没有影响,TTE为33.3天,而安慰剂的TTE为32.7天。T-C仅为0.6,即“治疗组TTE中位数与安慰剂对照组的差异”。伊立替康(T-C = 8.1)、吉西他滨(T-C = 5.1)和5-FU (T-C = 4.6)在治疗期间保持了强烈的反应,但一旦停药,肿瘤迅速生长。厄洛替尼(T-C = 21.7),贝伐珠单抗(T-C = 36.1)和脂质体阿霉素(T-C = 33.1)在治疗期间保持中等反应,肿瘤体积随着时间慢慢增加。到目前为止,最有效的药物是奥沙利铂,它在整个研究过程(74天)中保持了很强的抗肿瘤反应,仅3周治疗(图。2;表格1).通过对数秩检验评估统计学意义,奥沙利铂(P = 0.0001)和贝伐单抗(P = 0.0413)治疗均表现出显著的抗肿瘤活性,而阿霉素脂质体被认为是趋势(P = 0.112)。厄洛替尼也被认为是趋势,但由于体重(BW)百分比变化为- 15.3%和2例TR死亡的毒性最低,数据不可评估(表2)1).
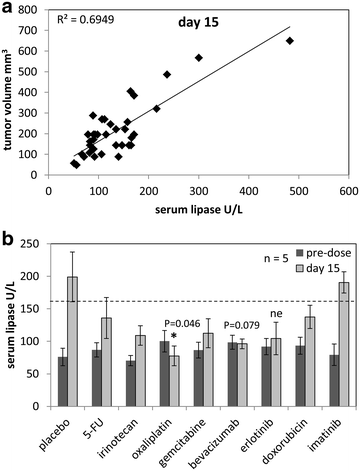
血清脂肪酶水平与化疗反应相关
监测异种移植物血液中的血清脂肪酶水平,以检查胰腺脂肪酶分泌与肿瘤体积的比较[20.].第15天,用R2= 0.6949(图3.a).各组中,仅奥沙利铂治疗后血清脂肪酶分泌量(第15天)显著降低(P = 0.046),低于治疗前水平。与安慰剂相比,贝伐单抗治疗也导致血清脂肪酶水平降低,但不显著(P = 0.079)。在8种单一治疗中,与安慰剂对照组相比,只有5-FU和伊马替尼不能降低血清脂肪酶水平(图2)。3.b)。
增殖、肿瘤血管和凋亡的终点治疗评估表明,奥沙利铂诱导PACC细胞死亡
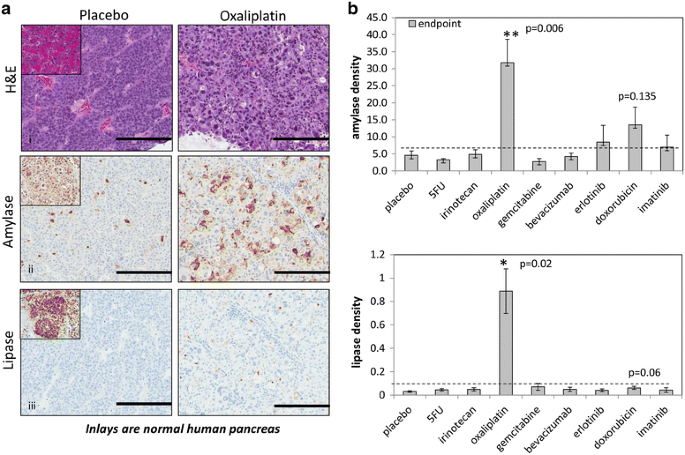
通过免疫组化分析终点肿瘤的增殖(Ki-67)、肿瘤血管(CD31)和程序性细胞死亡(cleaved caspase 3, CC3)。ki - 67%阳性表达在所有治疗组中保持相似,这表明在收集时增殖是相似的(图。4a).与安慰剂对照组相比,奥沙利铂、厄洛替尼和阿霉素组cd31%阳性表达增加,但只有厄洛替尼治疗有统计学意义(P = 0.044)(图。4b).另一方面,与安慰剂对照相比,仅奥沙利铂治疗组织的CC3染色显著增加(P = 0.019)(图。4c, d)。
奥沙利铂可诱导PACC形态改变和消化酶的重新表达
在进一步检查奥沙利铂的作用时,显微镜分析显示,与安慰剂对照相比,奥沙利铂的细胞质含量和细胞质大小都有所增加(图2)。5a,图i)。在组织学改变的同时,奥沙利铂治疗的与正常胰腺相似的肿瘤中,淀粉酶和脂肪酶的细胞质保留也显著增加(P < 0.05)。5a组ii, iii, b)。我们还注意到,与安慰剂相比,奥沙利铂治疗组织的某些部分中I型胶原蛋白的表达上调。先前的研究表明,I型胶原蛋白在正常腺泡细胞和导管的边缘有稀疏表达[34,35].在某些区域,I型胶原染色类似于正常组织的表达模式(附加文件2:图S1)。
基因分析结合免疫荧光(IF)和免疫组化(IHC)表明PACC患者和PA-018 PDTX模型有BRCA2突变
在正常胰腺、胰腺导管腺癌(PDAC)和PACC PDTX模型上进行BRCA1和BRCA2表达的IF和IHC检测。两种技术都表明BRCA1核存在于所有组织样本中,并伴有一些细胞质表达(图2)。6面板i;额外的文件3.:图S2面板i).免疫荧光显示,PDTX模型没有BRCA2和DAPI核染色共定位(图S2)。6a,图ii).患者PACC组织及其PDTX (PA-018)的IHC也显示缺乏BRCA2核表达。相反,仅在胰岛和PACC组织中观察到细胞质表达(附加文件3.采用PA-018 PDX组织突变基因分析,鉴定BRCA2中5个碱基对缺失(c.1755_1759del5)(图S2面板ii)。6b;额外的文件4:图S3)。所有序列读取都包含突变等位基因,表明没有野生型BRCA2等位基因存在。提示肿瘤中存在杂合性缺失(LOH)。
讨论
罕见的胰腺腺泡细胞癌(PACC)导致缺乏有效的标准治疗这种致命的疾病。了解疾病和测试潜在治疗方法的一种方法是拥有体内实验室模型。迄今为止,只有少数有记录的研究能够概括小鼠的PACC。最古老的PACC模型是通过创建一个转基因小鼠,该小鼠在胰腺特异性启动子弹性蛋白酶I的控制下表达SV40病毒的转化基因(t抗原)[36].该模型已被修改,表达荧光素酶以记录肿瘤负荷,并可用于测试化疗[2].最近,通过删除一个阻止mTOR信号的基因,已经建立了另一个小鼠模型[37].在这两种PACC小鼠模型中,当使用雷帕霉素治疗时,肿瘤负荷的降低证实了mTOR的重要性[2,37].虽然基因工程小鼠模型(GEMM)是成功的模型系统的一种方法,但PDTXs的生成也具有独特的好处。
在癌症内部,肿瘤存在异质性,同一种癌症可能有多种产生途径[38,39].通过创建PDTX模型,我们可以了解来自不同患者的肿瘤之间的异同。我们还能够测试对特定化合物具有化学抗性的肿瘤,并发现可能的替代品[40,41].因此,PDTXs提供了涉及疾病进展和治疗反应的代表性信号,概括了在患者中所见的[39,42- - - - - -47].这是第一个具有完全特征的PACC人性化模型的报道。我们的人PACC体内模型可以为进一步研究这种疾病的遗传和细胞机制提供一种新的手段。因此,我们通过STR谱证实了PDTX肿瘤是由人腺泡细胞癌细胞组成的,证实了PACC患者组织中生物标志物的表达[15- - - - - -18]以及分泌脂肪酶进入血液[14,48](附加文件1:表S1;无花果。1,3.).根据这些数据,我们认为PDTX肿瘤模型(PA-018)可以代表我们患者的PACC,这为我们根据患者过去的治疗史以及基因阵列和蛋白质表达数据测试多种单一疗法提供了依据[20.(图。2).
伊马替尼在PA-018中几乎没有反应,这模拟了患者对伊马替尼的混合和短暂的临床反应[20.].脂质体阿柔比星(Doxil)导致患者肝脏多处肿瘤显著缩小,血清脂肪酶降低,生活质量改善[20.].由于已知的阿霉素心脏毒性和患者的癌症进展而停止治疗。同样,PDTX模型显示出对阿霉素脂质体的生长抑制,但由于治疗结束后肿瘤重新生长,总体结果不显著(P = 0.112)。2;表格1).贝伐单抗是一种血管生成抑制剂,在患者转移性疾病进展后被短暂使用,但由于混淆症状,在药物疗效评估之前就停止了治疗。在本研究中,我们发现贝伐单抗治疗小鼠距离终点肿瘤体积(TTE)的时间具有统计学意义(P = 0.0413)。2;表格1).这些数据为贝伐单抗作为一种有效的化疗药物提供了可能性。
我们的目标是测试标准疗法和新的合理设计的单一疗法。5-FU和吉西他滨都是临床推荐的胰腺癌化疗药物[49],并加入到这项研究中,与给PA-018患者的药物进行比较。这两种治疗均不能维持肿瘤缩小,仅优于伊马替尼(图。2;表格1).在我们之前的PACC研究中,我们测量了PA-018肿瘤活检组织的RNA水平,发现TOPO1升高了2.5倍,而TOPO1可被伊立替康靶向[20.].正如预期的那样,伊立替康在治疗PA-018时表现出强烈的反应,但治疗后肿瘤继续生长。EGFR表达也升高,因此测试了厄洛替尼[20.].有太多与治疗相关的死亡,无法真正评估这组数据。在未来的检查中可能不得不考虑降低药物剂量。在PDTX模型中最显著的反应是在奥沙利铂治疗后观察到的,奥沙利铂在治疗停止数周后阻止了肿瘤生长,导致持久的反应(图。2;表格1).事实上,奥沙利铂是PACC模型中唯一能显著诱导细胞凋亡的化合物。4).
与其他铂类化合物一样,奥沙利铂通过在DNA中形成链间和链内交联来抑制DNA合成,从而阻止DNA复制和转录,导致细胞死亡[50].奥沙利铂与亚叶酸和5-氟尿嘧啶联合应用,可用于结直肠癌的治疗[51].此外,目前晚期胰腺癌的护理标准是FOLFIRINOX (5-FU/folinic acid,伊立替康和奥沙利铂)[52].我们追踪奥沙利铂治疗的有益效果,观察到PACC组织在细胞质中保留了淀粉酶和脂肪酶,并停止向血流释放脂肪酶(图2)。3.b,5).血液中监测血清脂肪酶水平可作为肿瘤负荷的衡量指标,其值越高,肿瘤负荷越大[20.].与安慰剂对照组相比,奥沙利铂治疗小鼠的血清样本在治疗第15天显著减少。3.b).这些数据表明,提示疾病的不是脂肪酶的产生,而是脂肪酶的分泌,因为正常胰腺在细胞质中积累了脂肪酶(图。5A,面板iii)但几乎不分泌它[11].研究结束时,奥沙利铂治疗小鼠的组织形态显示,癌细胞变大,比PACC组织更像正常的腺泡细胞(图2)。5i).确实,有报道称铂类药物在体内和体外均可诱导癌细胞分化[53,54].我们的数据表明,奥沙利铂通过诱导再分化和促进细胞凋亡抑制PACC肿瘤生长(图2)。4c, d,5).接下来,我们评估了为什么我们的PACC PDTX模型对奥沙利铂反应良好。
先前的文献表明,乳腺癌和卵巢癌中BRCA突变(参与DNA修复的基因突变)的存在与对铂化合物的敏感性增加有关[55- - - - - -57].这种敏感性也显示在卵巢肿瘤的种系或散发性体细胞突变[57].此外,在携带种系BRCA基因突变的一小部分PDAC患者中,接受铂类化合物治疗的患者总生存率增加[58].这些发现特别令人感兴趣,因为对44例PACC患者肿瘤的基因组分析发现45%的样本中存在DNA修复突变[19].在我们的PDTX模型中,BRCA1主要定位在细胞核中,而BRCA2主要定位在细胞质中,并在细胞核中缺失,这表明该蛋白被截断并失去了其核定位序列[59,60(图。6一个;额外的文件3.:图S2)。BRCA2的截断阻止细胞进入细胞核并参与DNA同源重组修复途径[57].BRCA2突变基因分析证实,在我们的PDX模型中,外显子10 (c.1755_1759del5)上存在5个碱基对的缺失。6b). BRCA2缺失经常与有害的蛋白质截断有关[61,62].同样的基因缺失(乳腺癌信息核心称为1983del5)甚至被报道为家族性BRCA2突变[63].利用这一证据,我们得出结论,BRCA2截断突变可能是我们的PACC模型对奥沙利铂诱导的细胞死亡敏感的一个潜在原因。事实上,之前的文献报道了一例遗传性BRCA2突变的PACC患者。该患者接受吉西他滨和奥沙利铂的联合治疗,这延长了他们的生存期,比PACC患者的平均预期寿命长了几年[64].总的来说,先前的研究结果以及我们的数据表明,奥沙利铂可能对肿瘤携带DNA修复突变(如BRCA2)的PACC患者有益。
结论
综上所述,我们支持这种新特征的PACC PDTX模型首先概括了在其匹配的患者组织中看到的单药治疗反应,并在此过程中发现奥沙利铂作为单药治疗在该PACC模型中非常有效。由于PACC的罕见性,只有少量的回顾性文章和病例报告描述实验治疗已经发表。我们在PDTX模型中使用奥沙利铂的研究结果为进一步评价其对胰腺腺泡细胞癌的治疗提供了依据。作为第一个也是唯一一个临床前人类PACC衍生模型,科学界可以用它来更好地了解这种疾病的病理生物学。
缩写
- 扣带皮层部位:
-
胰腺腺泡细胞癌
- PDTX:
-
患者源性肿瘤异种移植
- 东航:
-
癌胚抗原
- CK18:
-
细胞角蛋白18
- BCL10:
-
10 . B细胞淋巴瘤/白血病
- 克雷格:
-
查尔斯河
- 研究者用:
-
5 -氟尿嘧啶
- D5W:
-
5%葡萄糖在水中
- TTE:
-
time-to-endpoint
- TR:
-
治疗相关的
- 正常:关系
-
non-treatment-related
- TGD:
-
肿瘤生长延迟
- BW:
-
体重
- MTD:
-
最大耐受剂量
- 包含IHC:
-
免疫组织化学
- TMA,
-
组织微阵列
- 分析了无:
-
神经元特异性烯醇化酶
- 注册会计师:
-
chromogranin一
- CK19:
-
细胞角蛋白19
- CC3:
-
裂解caspase-3
- STR:
-
短串联重复
- CK19:
-
细胞角蛋白19
- FOLFOX:
-
叶酸和5-氟尿嘧啶
- FOLFIRINOX:
-
5-FU/叶酸,伊立替康和奥沙利铂
参考文献
Holen KD, Klimstra DS, Hummer A, Gonen M, Conlon K, Brennan M, Saltz LB.一系列胰腺腺泡细胞癌及相关肿瘤的临床特征和结局。中华临床医学杂志,2002;20(4):489 - 497。
张楠,李丽娟,李志强,李志强。一种基于非侵入性生物发光成像的自发性腺泡细胞癌模型。临床癌症决议2009;15:4915-24。
古川T,坂本H,竹内S, Ameri M,久保木Y,山本T, Hatori T,山本M,杉山M, Ohike N,等。全外显子组测序显示,在胰腺腺泡细胞癌中,BRCA2和FAT基因反复突变。科学通报2015;5:8829。
Schmidt CM, Matos JM, Bentrem DJ, Talamonti MS, Lillemoe KD, Bilimoria KY。美国胰腺腺泡细胞癌:预后因素及与导管腺癌的比较。中华胃肠外科杂志,2008;12:2078-86。
Wisnoski NC, Townsend CM Jr, Nealon WH, Freeman JL, Riall TS. 672例胰腺腺泡细胞癌:基于人群的胰腺腺癌比较。手术。2008;144:141-8。
Lowery MA, Klimstra DS, Shia J, Yu KH, Allen PJ, Brennan MF, O 'Reilly EM.胰腺腺泡细胞癌:一种罕见恶性肿瘤的遗传学和治疗新见解。肿瘤学家。2011;16:1714-20。
伍德LD,克林姆斯特拉DS腺泡分化胰腺肿瘤的病理学和遗传学研究。中华实用诊断学杂志(英文版);2014;
Thomas PC, Nash GF, Aldridge MC.表现为急性胰腺炎的胰腺腺泡细胞癌。HPB(牛津大学)。2003; 5:111-3。
郭丽娟,李志强,李志强,等。功能性胰腺腺泡细胞癌的免疫组化和超微结构分析。李文杰。1997;20(1):1 - 7。
Martin SK, Agarwal G, Lynch GR.皮下脂肪坏死作为胰腺癌的表现特征:胰腺内分泌和腺泡肿瘤的鉴别挑战。胰腺。2009;38:219-22。
大野勇,李志刚,李志刚,李志刚。脂肪酶腺泡细胞癌合并皮下结节性脂肪坏死1例。国际皮肤医学杂志,2003;42:384-5。
郑志军,龚军,向桂梅,麦刚,刘小波。胰腺腺泡细胞癌合并胰胰膜炎1例。安皮肤杂志2011;23:225-8。
JC堂,Crawford HC急性胰腺炎自噬、应激和炎症的共谋。中国胃肠杂志。2014;30:495-9。
Klimstra DS, Heffess CS, Oertel JE, Rosai J.胰腺腺泡细胞癌。28例临床病理分析。中华外科杂志。1992;16:815-37。
Horie Y, Gomyoda M, Kishimoto Y, Ueki J, Ikeda F, Murawaki Y, Kawamura M, Hirayama C.血浆癌胚抗原与胰腺腺泡细胞癌。癌症。1984;53:1137-42。
王洪辉,朱平。胃肠道肿瘤的免疫组化特征。中华胃肠病杂志,2012;3:262-84。
Hosoda W, Sasaki E, Murakami Y, Yamao K, Shimizu Y, Yatabe Y. BCL10作为胰腺腺泡细胞癌的有用标记物,尤其是内镜下超声细胞学标本。《病理学杂志》2013;63:176-82。
La Rosa S, Franzi F, Marchet S, Finzi G, Clerici M, Vigetti D, Chiaravalli AM, Sessa F, Capella C.抗bcl10单克隆抗体(克隆号331.1)是胰腺腺泡细胞癌和胰腺化生的敏感特异性标志物。Virchows Arch. 2009; 454:133-42。
Chmielecki J, Hutchinson KE, Frampton GM, Chalmers ZR, Johnson A, Shi C, Elvin J, Ali SM, Ross JS, Basturk O,等。胰腺腺泡细胞癌的综合基因组分析发现复发的RAF融合和频繁的DNA修复基因失活。癌症发现,2014;4:1398-405。
Armstrong M, Von Hoff D, Barber B, Marlow L, Von Roemeling C, Cooper S, Travis P, Campbell E, Paz-Fumagalli R, Copland J, Colon-Otero G.一种有效的个体化治疗罕见肿瘤的方法:基于遗传分析和细胞系发育的转移性胰腺腺泡细胞癌延长生存期。中华癌症杂志。2011;2:142-52。
Couch FJ, Hart SN, Sharma P, Toland AE, Wang X, Miron P, Olson JE, Godwin AK, Pankratz VS, Olswold C,等。在一个未被选择为乳腺癌家族史的大型三阴性乳腺癌队列中,17个乳腺癌易感基因的遗传突变。中华临床医学杂志。2015;33:304-11。
Pin CL, Rukstalis JM, Johnson C, Konieczny SF。bHLH转录因子Mist1是维持外分泌胰腺细胞组织和腺泡细胞特性所必需的。中国生物医学工程学报,2001;
Jimenez RE, Z 'Graggen K, Hartwig W, grame - cook F, Warshaw AL, Fernandez-del Castillo C.二甲基苯蒽诱导大鼠胰腺肿瘤的免疫组织化学特征。Am J Pathol. 1999; 154:1223-9。
Notohara K, Hamazaki S, Tsukayama C, Nakamoto S, Kawabata K, Mizobuchi K, Sakamoto K, Okada S胰腺固体性假乳头状肿瘤:神经内分泌标志物和CD10的免疫组化定位。中华外科杂志2000;24:1361-71。
Schottle J, Chatterjee S, Volz C, Siobal M, Florin A, Rokitta D, Hinze Y, Dietlein F, Plenker D, Konig K,等。厄洛替尼间歇性大剂量治疗提高egfr突变型肺癌的疗效。Oncotarget。2015;6:38458 - 68。
Shahin M, Soudy R, Aliabadi HM, Kneteman N, Kaur K, Lavasanifar A.工程乳腺肿瘤靶向肽配体修饰的脂质体阿霉素及其抗肿瘤活性的影响。生物材料。2013;34:4089 - 97。
Maj E, Filip-Psurska B, Switalska M, Kutner A, Wietrzyk J.维生素D类似物增强甲磺酸伊马替尼在人A549肺肿瘤模型中的抗肿瘤作用。中国生物化学学报(英文版);2015;
Rolff J, Becker M, Merk J, Hoffmann J, Fichtner I.厄洛替尼联合贝伐单抗在早期非小细胞肺癌患者源性异种移植中的临床前研究。目标Oncol 2016;15:190。
邰佳杰,王华,王志强,黄明山,吴超,陈荣军,郭丽娟,魏培良,常玉军,常春成等。贝伐单抗和西妥昔单抗联合常规化疗可降低小鼠胰腺癌异种移植胰腺肿瘤重量。2016年临床实验医学。doi:10.1007 / s10238 - 016 - 0409 - 2
阿霉素、顺铂、伊立替康或拓扑替康治疗人结肠癌、肺癌和乳腺癌异种移植的疗效。抗癌决议1999;19:2269-74。
Nakajima Y, Nakamura T, Enomoto T, Murata Y.在转基因小鼠晶状体上皮肿瘤中p53基因的一个等位基因的缺失抑制了拓扑异构酶I抑制剂(CPT-11)诱导的细胞凋亡。癌症杂志2002;179:165-73。
法德尔JE,瓦尔迪J,蒙兹LA,约翰斯顿IN。奥沙利铂化疗对啮齿动物认知和周围神经病变的长期影响。Behav Brain res 2015; 291:80-8。
Nukatsuka M, Nakagawa F, Takechi T.一种新型口服化疗药物TAS-102联合奥沙利铂治疗人结直肠癌和胃癌异种移植的疗效。抗癌法案2015;35:4605-15。
Armstrong T, Packham G, Murphy LB, Bateman AC, Conti JA, Fine DR, Johnson CD, Benyon RC, Iredale JP。I型胶原促进胰腺导管腺癌的恶性表型。临床癌症决议2004;10:7427-37。
德维卡·CR, Tod J, Loeffler AG,刘勇,Thomas GJ, Eliceiri KW,高文杰。胰腺导管腺癌的导管周围基质胶原结构与正常和慢性胰腺炎不同。Mod Pathol. 2015; 28:1470-80。
Ornitz DM, Hammer RE, Messing A, Palmiter RD, Brinster RL。SV40 t抗原表达诱导转基因小鼠腺泡细胞发生胰腺瘤。科学。1987;238:188 - 93。
丁玲,韩玲,李艳,赵娟,何萍,张伟。神经原素3-定向cre基因缺失导致胰腺腺泡癌。瘤。2014;16:909-17。
Konstantinopoulos PA, Matulonis UA。上皮性卵巢癌临床前药物开发模型的现状与发展。Front Oncol. 2013;3:296。
Morton CL, Houghton PJ。免疫缺陷小鼠人肿瘤异种移植的建立。Nat protocol . 2007; 2:247-50。
Bid HK, Kibler A, Phelps DA, Manap S, Xiao L, Lin J, Capper D, Oswald D, Geier B, DeWire M,等。在一项研究中,MEK1抑制剂selumetinib (AZD6244)获得性耐药性的发展、表征和逆转在活的有机体内儿童星形细胞瘤模型。临床癌症,2013;19:6716-29。
Gandara DR, Mack PC, Bult C, Li T, Lara PN Jr, Riess JW, Astrow SH, Gandour-Edwards R, Cooke DT, Yoneda KY,等。通过整合患者来源的异种移植平台,将肿瘤基因组学与患者预后联系起来。临床肺癌。2015;16:165-72。
Monsma DJ, Cherba DM, Richardson PJ, Vance S, Rangarajan S, Dylewski D, Eugster E, Scott SB, Beuschel NL, Davidson PJ,等。使用横纹肌肉瘤患者来源的异种移植来检查精准医疗方法和获得性耐药性模型。儿科血癌。2014;61:1570-7。
徐松,李松,郭震,罗杰,Ellis MJ,马春霞。联合靶向mTOR和AKT是治疗患者源性异种移植模型中基底样乳腺癌的有效策略。中华癌症杂志,2013;
史建平,陈建平,陈建平,等。卵巢上皮性肿瘤的临床研究进展。Front Oncol. 2013;3:295。
李松,沈东,邵杰,克劳德R,刘伟,Prat A,何欣,刘松,胡杰,陆超,等。乳腺癌源性异种移植的基因组特征揭示内分泌治疗耐药ESR1变异。细胞报告,2013;4:1116-30。
科佩茨S,莱莫斯R,波伊斯G.患者来源的异种移植的前景:小鼠和人的最佳计划。临床癌症决议案2012;18:5160-2。
Bertotti A, Migliardi G, Galimi F, Sassi F, Torti D, Isella C, Cora D, Nicolantonio F, Buscarino M.患者来源的异种移植(“xenoppatients”)分子注释平台确定HER2是西妥昔单抗耐药结直肠癌的有效治疗靶点。癌症发现,2011;1:508-23。
滕纳,Baillie J, DeWitt J, Vege SS.美国胃肠病学学院指南:急性胰腺炎的管理。中华胃肠病杂志。2013;38(11):516。
Neoptolemos JP, Cunningham D, Friess H, Bassi C, Stocken DD, Tait DM, Dunn JA, Dervenis C, Lacaine F, Hickey H,等。胰腺癌辅助治疗:历史与现状。杨文华,2003;14:675-92。
app MG, Choi EH, Wheate NJ。铂类药物的现状和未来。中国癌症杂志。2015;22:R219-33。
李志强,李志强,李志强,李志强。局部晚期和转移性直肠癌系统治疗的研究进展。中华胃肠杂志2015;6:185-200。
海涅曼V, Haas M, Boeck S.晚期胰腺癌的全身治疗。癌症治疗Rev. 2012; 38:843-53。
水谷Y,佐藤N,川内A,野村N,福岛M,三木,顺铂诱导在活的有机体内人胚胎癌的分化。BJU国际杂志,2002;89:454-8。
Prabhakaran P, Hassiotou F, Blancafort P, Filgueira L.顺铂诱导乳腺癌细胞分化。《Front Oncol》2013;3:134。
Dann RB, DeLoia JA, Timms KM, Zorn KK, Potter J, Flake DD 2nd, Lanchbury JS, Krivak TC。BRCA1/2突变和表达:晚期上皮性卵巢癌患者对铂化疗的反应中华妇产科杂志2012;125:677-82。
特纳NC,塔特AN。铂化疗治疗brca1相关乳腺癌:我们还需要更多证据吗?乳腺癌决议2012;14:15 5。
Wiedemeyer WR, Beach JA, Karlan BY。逆转高级别浆液性卵巢癌铂耐药:靶向BRCA和同源重组系统。Front Oncol. 2014;4:34。
Golan T, Kanji ZS, Epelbaum R, Devaud N, Dagan E, Holter S, Aderka D, Paluch-Shimon S, Kaufman B, Gershoni-Baruch R,等。BRCA突变携带者胰腺癌的总生存期和临床特征。中华癌症杂志,2014;
西班牙BH,拉尔森CJ,希哈布丁LS,盖奇FH,维尔马IM。截断的BRCA2是细胞质的:癌症相关突变的意义。中国科学院学报(自然科学版),1999;
沃森P,利伯曼R,斯奈德C,克拉克VJ,林奇HT,霍尔特JT。在组织活检中检测BRCA2蛋白截断,以识别BRCA2基因突变携带者中出现的乳腺癌。中华临床医学杂志,2009;
Frank TS, Manley SA, Olopade OI, Cummings S, Garber JE, Bernhardt B, Antman K, Russo D, Wood ME, Mullineau L,等。BRCA1和BRCA2的序列分析:突变与家族史和卵巢癌风险的相关性中华临床医学杂志,1998;16(4):344 - 344。
Montagna M, Agata S, De Nicolo A, Menin C, Sordi G, Chieco-Bianchi L, D 'Andrea E. BRCA1和BRCA2携带者的等位基因特异性基因表达(AGE)鉴定。中华癌症杂志,2002;
Lubinski J, Phelan CM, Ghadirian P, Lynch HT, Garber J, Weber B, Tung N, Horsman D, Isaacs C, Monteiro AN,等。癌症变异与BRCA2基因突变位置相关。癌症。2004;3:1-10。
Ploquin A, Baldini C, Vuagnat P, Makhloufi S, Desauw C, Hebbar M.延长胰腺腺泡细胞癌患者的生存期。Case Rep Oncol 2015; 8:447-50。
作者的贡献
JCH和LAM负责构思、实验设计、进行实验和准备手稿。ACM负责动物实验的构思和实验设计。LKD和WFD负责动物实验的实验设计,并进行实验。KAM对动物数据进行了统计分析。r&m和AJS负责动物实验的构思和实验设计。DLS负责动物实验的构思、实验设计、稿件准备。MK提供病理组织和分析。DvH参与了概念设计和文稿准备。JS对PDTX模型进行外显子组测序。SNH和FJC提供了突变分析。 GCO contributed to concept design, manuscript preparation. JAC contributed to concept design, experimental design, and manuscript preparation. All authors read and approved the final manuscript.
确认
我们感谢Brandy Edenfield在组织学样本制备方面的专业知识。
相互竞争的利益
丹尼尔·斯莫尔、威廉·达勒姆、罗伯特·穆林、路易斯·道森和茱莉亚Schüler是查尔斯·里弗斯探索服务公司的员工。亚当·马蒂亚斯曾是查尔斯·里弗斯发现服务公司的员工,现在在德尔塔合成有限公司工作。Gerardo Colon-Otero获得诺华公司的研究支持。John A. Copland和Laura A. Marlow从授权给Charles River Discovery Services的PDTX模型中获得版税。
资金
这项工作的部分资金来自NIH/NCI Grant R01CA136665 (JA Copland)和Ellis博士和Dona Brunton (JA Copland和G Colon-Otero)的罕见癌症补助金。
作者信息
作者及隶属关系
相应的作者
额外的信息
Jason C. Hall和Laura A. Marlow对这项工作做出了同样的贡献
附加文件
12967 _2016_875_moesm1_esm.docx
附加文件1:表S1。患者肿瘤活检与PA-018 PDTX的STR剖面比较。短串联重复序列(STR)分析显示,我们的PDTX肿瘤的遗传特征(第5篇)与患者的特征密切匹配。用于比较的DNA来自PA-018活检前3年的样本,因为无法获得组织。5个等位基因缺失事件被注意到发生。
12967 _2016_875_moesm2_esm.tif
附加文件2:图S1。I型胶原蛋白在正常胰腺和PACC中的表达。I型胶原毗邻腺泡细胞群和正常导管结构。这些边界在PA-018中通常是最小的,除非用奥沙利铂治疗,奥沙利铂恢复了PDTX组织某些区域I型胶原蛋白的表达。
12967 _2016_875_moesm3_esm.tif
附加文件3:图S2。IHC提示患者和PA-018 PDTX模型存在截断型BRCA2突变。在正常胰腺、胰腺导管腺癌(PDAC)、患者PACC及其PDTX (PA-018)进行IHC检测BRCA1和BRCA2表达。图一:BRCA1在所有样本中既是细胞核的也是细胞质的(图一)。与PDAC相比,BRCA2在患者原发肿瘤和PA-018的PACC组织中均无核表达。仅在正常组织和PACC组织的胰岛中观察到细胞质表达。
12967 _2016_875_moesm4_esm.tif
附加文件4:图S3。BRCA2基因集成基因组观察器(IGV)。IGV显示PA-018 PAAC PDTX模型的基因组数据。如图13号染色体(Chr 13),在BRCA2外显子10上的32907365 (c.1755_1759del5)位置上发现了5bp的缺失。图像底部显示了与BRCA2基因和蛋白质的参考序列相对应的核苷酸和氨基酸。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
霍尔,j.c.,马洛,洛杉矶,马蒂亚斯,A.C.et al。新的患者来源的胰腺腺泡细胞癌异种移植小鼠模型显示了奥沙利铂的单药活性。翻译医学杂志14, 129(2016)。https://doi.org/10.1186/s12967-016-0875-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-016-0875-z
关键字
- 铂
- 患者源性肿瘤异种移植
- 肿瘤
- 胰腺腺泡细胞癌
- 化疗
- 个性化的医学
- 精密医学
- BRCA2