摘要
背景
平滑肌肉瘤(LMS)是一种常见的软组织肉瘤,对标准化疗反应不佳。因此,本研究的目标是通过包含480个激酶抑制剂的小分子文库筛选细胞系,从功能上确定哪些信号通路可能对LMS生长至关重要,从而确定可能对平滑肌肉瘤有效的新型选择性疗法。
方法
用OICR激酶库筛选LMS细胞系,并使用细胞活力测定来鉴定潜在有效化合物。命中的前10%进行了二次验证以确定其EC50并进行免疫印迹试验,以确定药物的选择性作用。在体外使用Calcusyn程序分析了阿霉素(Dox)联合药物治疗的疗效,治疗方案为三种给药方案之一:同时治疗,初始治疗时使用选择性化合物,然后再使用Dox,或初始治疗时使用选择性化合物。然后使用LMS异种移植在体内验证了单一和联合药物治疗。
结果
靶向PI3K/AKT/mTOR通路的化合物(52%)最为有效。电子商务50在11个确认的命中点中,有10个靶向PI3K和/或mTOR通路与EC50值<1 μM。因此,我们研究了这些途径中的两种选择性化合物BEZ235和BKM120是否会在体外抑制平滑肌肉瘤的生长。免疫印迹证实了这些化合物在PI3K和/或mTOR通路中的靶向作用。接下来,我们调查了这些药物与一线化疗药物阿霉素(Dox)是否有协同作用,这将允许更早地引入患者护理。只有BEZ235和Dox联合处理在体外具有协同作用。为了在临床前模型中验证这些发现,对异种平滑肌肉瘤进行了单药和联合治疗。BEZ235处理的异种移植(n = 8)肿瘤体积减少42%,而与单独使用相比,BEZ235与Dox联合使用(n = 8)肿瘤体积减少68%。
结论
总之,这项研究支持进一步研究PI3K和mTOR抑制剂单独使用和联合标准治疗平滑肌肉瘤患者。
背景
肉瘤是一种不同类型的恶性间质肿瘤,有超过50种组织学上不同的亚型[1].它们可被广泛地分为两组:包含简单核型缺陷(包括反复易位)或具有以多个改变基因为特征的复杂细胞遗传学病变,如平滑肌肉瘤(LMS) [1,2].LMS占软组织肉瘤(STS)的11%,虽然其遗传基础尚未完全确定,但常见的遗传异常包括p53或PTEN功能突变的丧失以及PI3K/AKT/mTOR通路的激活突变[3.- - - - - -6].LMS的常规治疗通常包括手术切除、化疗和/或放疗[2].不幸的是,目前可切除的非转移性LMS的5年特异性生存率在腹膜后为60%,在四肢患者为75% [7,8].由于失败的主要模式是转移性疾病和多灶性局部复发,有效的化疗方案对于改善更持久的疾病控制至关重要。
一线LMS化疗目前由阿霉素(Dox)和异环磷酰胺联合使用,阿霉素是一种抑制拓扑异构酶II从而破坏DNA修复的蒽环类药物[9].然而,局部晚期、复发或转移性子宫LMS在以60-80 mg/m剂量给药时,对Dox的反应率仅为25%2IV每3周[10].阿Dox在癌症治疗中的应用受到心脏毒性、白细胞减少、血小板减少和耐药性发展的限制[10].另一种常用的方案是吉西他滨(900 mg/m2第1天和第8天)和多西他赛(100 mg/m2第8天),对子宫平滑肌肉瘤和非子宫平滑肌肉瘤的有效率为27%至53% [11].因此,LMS患者的总体反应率较低,毒性显著,因此需要开发更有效、毒性更小的选择性疗法来改善患者的预后。
为了提高治疗效果,选择性抑制剂正被广泛开发,以靶向肿瘤特异性分子通路。最近,STS和其他实体肿瘤(包括乳腺癌、肺癌和结肠癌)被认为表现出PI3K/AKT/mTOR失调[12- - - - - -16].PI3K/AKT/mTOR通路由受体酪氨酸激酶(RTK)激活,RTK从肿瘤微环境传递细胞外信号。这些通路的失调不仅可以通过生长因子信号的过度激活,还可以通过激活或丧失影响AKT和PTEN等关键分子的功能突变。靶向这些途径已成为药物开发中一个迅速发展的领域,因为针对这些蛋白质的几种小分子抑制剂最近已在临床试验中进行了研究(BKM120, BEZ235和MK2206) [17- - - - - -20.].然而,PI3K/mTOR通路的复杂调控包括反馈回路,允许绕过目标蛋白。越来越多的证据表明,MAPK和ERK通路之间的串音/冗余功能与针对PI3K/mTOR通路时的适应性耐药性的发展有关[21,22].因此,有人认为靶向多种途径的小分子药物或将这些药物与传统的细胞毒性药物联合使用可能会阻止耐药性的发展,并导致更持久的药物治疗[23].
为了确定有效且毒性可能更小的新型LMS选择性疗法,我们利用了480个小分子激酶抑制剂的选择性药物库。基于我们最初的体外筛选验证研究,我们报告了PI3K/AKT/mTOR通路对LMS细胞存活具有重要功能的新发现。此外,我们发现一种PI3K/mTOR双抑制剂BEZ235在体内显著抑制LMS的生长。最后,这种小分子与目前的护理标准阿霉素具有协同作用,这为LMS患者提供了一种有前途的联合治疗方法。
方法
细胞系培养条件及特性
根据西奈山医院研究伦理委员会的同意(从人体组织MSH reb# 10-0310-C中创建肉瘤细胞系生物库),LMS细胞系STS39是通过手动分离患者样本(骨盆LMS)获得的,该患者样本在37℃下与2 μg/ml胶原酶(SigmaAldrich, Oakville, CA)在补充的DMEM/F-12 10% FBS中孵育一夜(Life Technologies, Burlington, CA)。反复抽吸细胞以形成单细胞悬液,以1000转/分钟离心5分钟,并镀至T75烧瓶中。从ATCC中获得的SKLMS1细胞在DMEM (Life Technologies)、10% FBS培养基中培养。细胞在标准条件下连续传代,并在全基因组人类SNP阵列6.0上使用阵列比较基因组杂交(aCGH)分析拷贝数变异,并使用短串联重复序列(STR)分析(应用基因组学中心(tcg) Sick Kids, Toronto, CA)进行绘制。免疫细胞化学染色为desmin[克隆DE-U-10] (AbCam, Toronto ON, CAN) 1:200,平滑肌动蛋白(SMA)(克隆1A4) (Dako, Burlington, CA) 1:200,小鼠IgG (Santa Cruz Biotechnology, Dallas, US) 1:400作为背景对照。为了确保细胞系是肿瘤起源的代表,STS39细胞的免疫细胞化学与西奈山医院病理科进行的患者肿瘤免疫组织化学相匹配。用ImageJ (148v)定量Ki67和TUNEL染色,用染色分布和染色强度评价p-AKTS473染色。tccag测序PI3K的p85亚基9号和20号外显子(Ensembl:ENSG00000145675), mTOR的14号和15号外显子(Ensembl:ENSG00000198793)。
激酶图书馆
安大略癌症研究所(OICR)的药物发现小组组装了480个化合物激酶库。所有药物均作为100% DMSO溶液使用。这些药物包括多种靶点,包括但不限于PI3K/AKT、EGFR/ErbB2、CDKs和GSK3。BEZ235和BKM120由药物化学平台提供或从ChemieTek(印第安纳波利斯,美国)购买。
主屏幕
在Lunenfeld-Tanenbaum研究所(LTRI)的SMART设施进行了一次药物筛选,在384孔板(VWR)中分别以600个细胞/孔和700个细胞/孔的密度播种SKLMS1和STS39细胞。培养皿孵育6小时以确保细胞附着,此时药物分别以0.2、1和5的浓度固定。37°C孵育96 h后,取45 μl AlamarBlue®(LifeTechnologies)。5小时后,在BMG Pherastar平板阅读器上测量荧光强度。在0.1%二甲基亚砜(DMSO) (SigmaAldrich)中单独生长的细胞作为对照,结果归一化,而不含细胞的培养基用于背景校正。
药物选择标准和撞击验证
与两种细胞系中所有三个剂量组的对照组相比,来自主屏幕的命中量被定义为导致信号下降的前10%的药物。命中的前10%通过执行10点,三倍连续稀释EC来验证50曲线。将冻干粉形式的原液用DMSO重组至50 mM浓度。SKLMS1和STS39细胞分别以5000 c/孔和10,000 c/孔的密度播种到96孔板(Fisher, Ottawa,CA)和化合物以0.25 nM至5 μM的最终浓度加入,孵育72小时。然后根据制造商的说明进行ATPlite检测(PerkinElmer),并在PerkinElmer Enspire 2300多模平板阅读器上读取荧光。电子商务50使用GraphPad Prism 4.0生成并分析曲线。
免疫印迹
SKLMS1和STS39细胞分别以25万c/孔和50万c/孔的密度在6个孔板中播种。细胞在收获前用BKM120或BEZ235 (5-1000 nM)处理72小时。冷PBS (Sigma)冲洗后,用RIPA缓冲液(50 mM pH 7.4 Tris-HCl, 150 mM NaCl, 1% np - 40,1 mM EDTA)补充磷酸酶和蛋白酶抑制剂(Sigma)在冰上溶解细胞20分钟。采用DC蛋白浓度测定法(BioRad)测定蛋白浓度。电泳使用MiniProtean TGX凝胶(Bio-Rad)进行,并通过湿转移转移到PVDF。用以下抗体进行免疫印迹:p-AKTS473,总AKT, p-S6KT389,共S6K, p-4EBP1T37/46,共4EBP1, PARP-1,均来自Cell Signaling Technology (Denver, US)和tubulin[克隆DM1A] (Sigma, St. Louis, USA)。所有显示的免疫印迹至少代表三个独立的实验。
结合研究
体外联合研究通过在96个孔板上播种SKLMS1和STS39细胞(分别为5000 c/孔和10000 c/孔)进行。用BEZ235和Dox在4 × IC浓度下处理细胞50, 2 × IC50,集成电路50, 0.5 × IC50, 0.25 × IC50按照以下时间表:(1)同时用Dox和选择性抑制剂(SI)治疗72小时,(2)单独用SI治疗24小时,然后再用Dox治疗48小时,(3)单独用Dox治疗24小时,然后再用SI治疗48小时。在PerkinElmer Enspire 2300多模平板阅读器上使用ATPlite法定量细胞活力,并如下所述进行分析。
用BEZ235和/或Dox治疗LMS异种移植
所有的体内实验都是根据加拿大多伦多表型基因组学中心的动物护理委员会进行的。女点头。Cg -PrkdcscidIL2rgtm1Wjl/SzJ小鼠购自JAX实验室。6 ~ 8周龄时,右后肢肌注5 × 106SKLMS1细胞。触手可及后,用卡尺测量肿瘤,按以下公式计算肿瘤体积:长×宽×高× 0.5236 [24].当肿瘤长到0.5厘米左右时3.(SKLMS1细胞系约4-5周),动物分为4组:1组;第2组:由10% NMP(1-甲基-2-吡罗烷酮)/PEG300组成的单独载体,每日口服灌胃,并每两周腹腔注射PBS。单独的BEZ235 (25mg /kg的BEZ235每日口服灌胃溶解在10% NMP/PEG300 90%如前所述[25]),第三组。阿Dox单独(1.2 mg/kg,双周i.p.注射溶解在PBS中的阿Dox)和第4组。同时处理BEZ235和Dox。在研究期间(治疗12天),每周记录两次体重和肿瘤测量。动物被CO安乐死2当肿瘤长到大约1.5厘米时窒息3.大小。
所有组织分别储存在液氮或10%福尔马林中。对异种移植瘤进行desmin (Dako)、SMA[克隆1A4] (Dako)、Ki-67[克隆SP6] (ThermoScientific)、TUNEL (Roche, TdT)和p-AKT染色S473(细胞信号技术)1:100。采用标准方案完成免疫组化(IHC)。对于小鼠一抗,使用小鼠对小鼠过氧化物酶试剂盒(Vector Laboratories, Burlington, ON, CAN)来防止小鼠源性抗原的假阳性。
统计数据
通过计算联合指数(CI)来分析药物协同作用,以衡量两种药物之间的相互作用。使用CalcuSyn软件2.1 (BioSoft, UK),根据Chou和Talalay方法的中位数效应原理计算CI [26,27].采用Mann-Whitney检验确定治疗组间肿瘤体积的差异。p < 0.05为差异有统计学意义。采用单因素方差分析(One-way ANOVA)来确定治疗组间小鼠体重是否存在差异。
结果
激酶抑制剂筛选确定PI3K和/或mTOR通路为有希望的LMS靶点
为了确定LMS的有效治疗方法,我们用激酶抑制剂库筛选了两种细胞系(图2)。1a). Hits定义为在两种LMS细胞系(33种化合物)的所有剂量中常见的化合物的前10%。根据它们的主要激酶靶点进行聚集(图2)。1b).有趣的是,我们发现靶向PI3K/AKT/mTOR通路(52%)、细胞周期调节剂(PLK1, CHK1, Wee-1)(27%)和其他RTK包括PDGFR和FLT3(21%)的化合物占优势。总体而言,OICR板上包含的42种PI3K/AKT/mTOR抑制剂中有20种(48%)被认为是命中的。我们定义了有前途药物的选择标准如下:在我们研究设计时,具有纳摩尔效价的药物可以预测更好的临床疗效和/或在I/II期临床试验中的化合物。
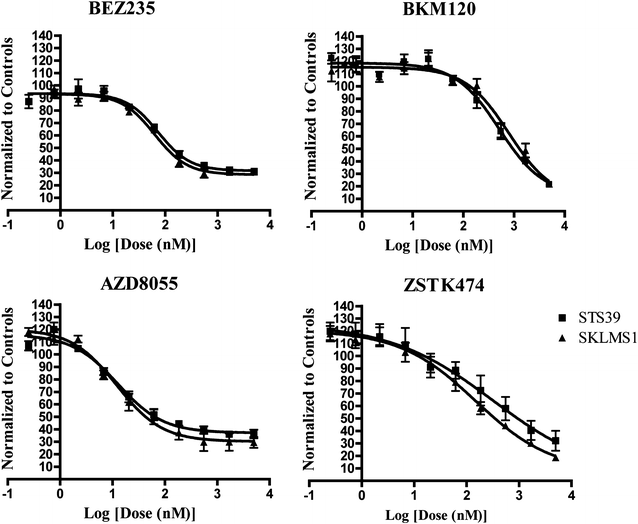
为了验证从主屏幕中选择的命中,我们重新测试了20种化合物并确定了它们的EC50在两种细胞系中的值(图;2).至少在一个细胞系中确认了70%以上的原发性命中(14/20),55%的原发性命中在两个细胞系中都确认了(11/20)。此外,在11个确认的命中位点中,有10个是针对PI3K和/或mTOR通路的分子,其中大多数是EC50值小于1 μM1).其中,我们研究了BEZ235和BKM120,以确定它们抑制LMS的能力,因为这两种药物目前都处于I/II期试验和低EC的研究中50数值表明可能有较宽的治疗窗口[28,29].BEZ235是一种针对PI3K和mTOR的双atp竞争性抑制剂,表现出优异的纳摩尔范围效力(EC50在SKLMS1和STS39中分别为62.8和73.5 nM)。BKM120仅抑制PI3K,且药效稍弱(EC50SKLMS1和STS39中分别为800.0和513.2 nM)。
LMS细胞系中BEZ235和BKM120在PI3K/mTOR通路中的选择性活性
接下来,我们分析了我们的细胞系,以确定它们是否在PI3K/mTOR轴上有任何共同的突变。由于PI3K的p85亚基突变是肉瘤中PI3K通路激活的常见机制[1],我们对两种细胞系进行了测序,但没有发现激活突变(数据未显示)。为了确定LMS细胞系在连续传代中是否基因组稳定,进行了aCGH,这表明这些细胞系随着时间的推移基因组稳定(附加文件)1:图S1A)。我们还对desmin和SMA进行了免疫细胞化学检测,以确认原代细胞株STS39是其来源的原发肿瘤的代表(附加文件)1:图S1B)。此外,我们通过免疫印迹评估了内源性pi3k和mTOR通路蛋白水平,发现SKLMS1中p110和p-p85水平升高(附加文件)1:图S1C)。RICTOR是mTOR的结合伙伴,其活性与癌变有关,在SKLMS1中升高,这与最近在分化良好的LMS中的发现一致[30.].最后,我们证明了下游效应子的蛋白质水平通常与串行传代一致(附加文件)1:图S1C)。
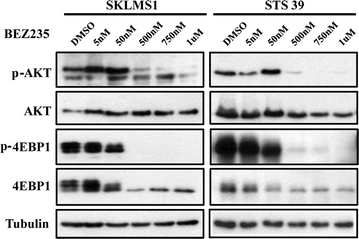
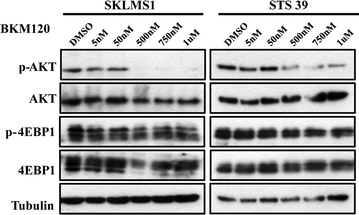
为了确定PI3K/AKT/mTOR通路在LMS细胞中是否被选择性抑制,我们用BEZ235或BKM120以5种不同剂量(0-1000 nM)处理这两种细胞系72小时。STS39和SKLMS1细胞系的剂量反应实验表明,BEZ235抑制AKT的磷酸化S473, PI3K的下游靶点。抑制4EBP1T37/46在50 nM时,mTOR通路下游的一个分子也被观察到,然而在更高的浓度(>500 nM)下,4EBP1的水平下降,尤其是在SKLMS1中(图5)。3.).bkm120处理的细胞显示p-AKT水平下降S473而不是p-4EBP1T37/46在500-1000 nM的剂量下(图;4).这些数据表明,在LMS细胞中,BEZ235处理抑制了PI3K和mTOR通路的下游效应物,而BKM120处理则如预期的那样抑制了两种LMS细胞系中的PI3K通路靶点。
同时使用阿霉素和BEZ235对LMS细胞系有协同作用
阿霉素是LMS患者辅助治疗和转移治疗的一线药物[31].PI3K/AKT通路的遗传畸变在STS和最近的LMS中越来越普遍[1,32,33].因此,我们测试了Dox和PI3K和/或mTOR选择性抑制剂的疗效,以确定联合治疗是否会产生协同作用,这可能会降低药物剂量,从而限制毒性,并可能提高LMS患者药物治疗的总体疗效。
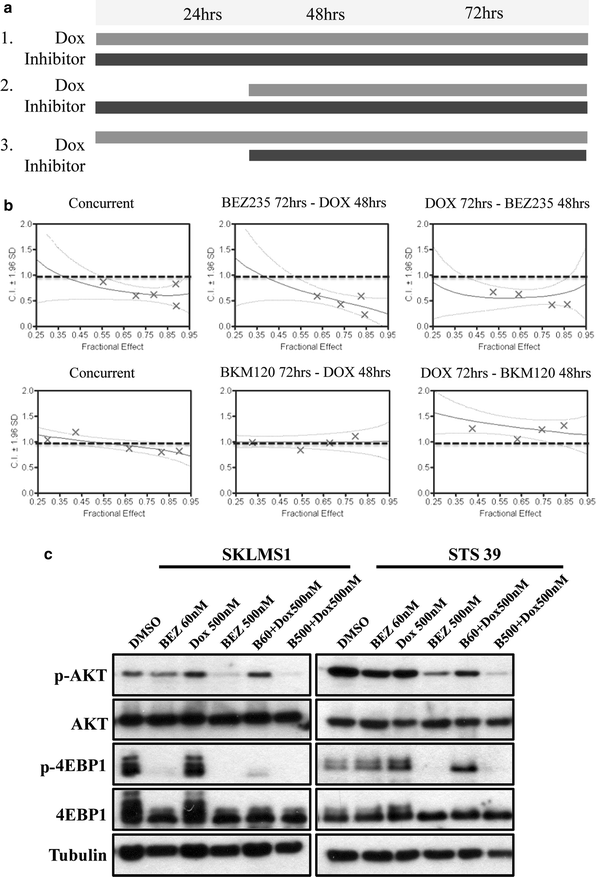
为了确定最佳的治疗策略,我们研究了三种给药计划:72小时的伴随治疗,或两种不同的顺序治疗(在阿霉素治疗后24小时添加抑制剂或在抑制剂后24小时添加阿霉素)(图。5a).为了得到有效的剂量范围和剂量密度,根据两种药物的EC比值计算出两种药物组合的固定(或恒定)比50s的数据,由Chou-Talalay [27].具体来说,BEZ235和Dox以1:4的固定比例使用,以测试潜在的协同作用,BKM120和Dox以1:1的固定比例一起使用。设定比例后,连续稀释两种药物的混合物,并按上述时间表培养细胞。用ATPlite分析细胞活力。
BEZ235和Dox的联合研究表明,在体外LMS细胞系中具有协同作用。一个联合治疗中使用的剂量计划。研究了三种治疗方案:方案1 -联合治疗72小时,方案2 -单药联合抑制剂治疗前24小时,随后48小时联合Dox治疗,方案3 -单药联合Dox治疗前24小时,随后联合inhibitor治疗48小时。b组合指数(CI)图由BEZ235或BKM120和Dox按3个剂量计划处理SKLMS1细胞产生,以确定最佳治疗方案。生存力用ATPlite测定,用CalcuSyn软件分析。BEZ235 (15-240 nM)和Dox (125-2000 nM)在所有3个治疗方案中均表现出协同作用(CI < 0.9),而BKM120和Dox联合治疗在任何一个治疗方案中均无协同作用(n = 3)。详细的CI范围见附加文件1:表S2。c免疫印迹显示p-AKT下降S473, p-4EBP1T37/46用BEZ235处理STS39细胞,在指定浓度下并与Dox联合处理72小时,检测总裂解物的水平。总AKT, 4EBP1和微管蛋白水平显示为加载对照
计算每种剂量组合的组合指数(CI)。CI < 1表示协同作用,CI = 1表示加性作用,CI > 1表示拮抗作用。在SKLMS1和STS39的中位联合指数为0.62的剂量范围内,在两种细胞系中观察到BEZ235和Dox的协同效应。5b).在所有三种给药计划中观察到协同作用,因此表明治疗方案之间没有差异。BKM120和Dox联合使用仅产生加性效应(CI范围在1.0左右),因此在我们的体内研究中没有进一步进行(附加文件)1:表S2)。
我们进一步研究了单独和联合使用BEZ235和Dox抑制PI3K/mTOR通路下游效应物的能力。用低(60 nM)或高(500 nM)浓度的BEZ235处理两种LMS细胞系,并添加或不添加500 nM Dox。BEZ235 (60 nM)单独和与Dox联合使用均能抑制4EBP1的磷酸化T37/46在SKLMS1细胞中(图;5c).在60 nM下用BEZ235处理STS39细胞可减少AKT的磷酸化S473,下游效应子p-4EBP1没有变化T37/46.正如预期的那样,将BEZ235的剂量增加到500 nM会显著降低AKT的磷酸化S473并消除了4EBP1的磷酸化T37/46.这种效果随着Dox的加入而增强。因此,与单一Dox或BEZ235处理相比,联合治疗导致PI3K/mTOR下游效应物磷酸化水平下降,加强了对这些途径的选择性抑制,这证明了在体内的证实(图2)。5c)。
BEZ235-Dox联合治疗通过体外凋亡诱导细胞死亡
为了确定BEZ235处理后的细胞死亡是否由凋亡引起,我们用流式细胞术评估了Annexin V与药物处理的LMS细胞表面的结合(附加文件)1:图S2)。Annexin v阳性、7- aad阴性的细胞代表早期凋亡细胞,Annexin v阳性、7- aad阳性的细胞代表晚期凋亡细胞,在单剂BEZ235或Dox处理72 h的细胞中均低水平出现(凋亡细胞的比例为0.5% - 3.1%)。BEZ235和Dox联合处理72 h后,SKLMS1细胞数量增加(早期和晚期凋亡细胞分别为15.3%和9.6%,p < 0.01;STS39中早期和晚期凋亡细胞分别为8%和8.2%,p < 0.01),提示联合治疗可能通过凋亡抑制LMS存活。此外,与对照组相比,在浓度为500 nM的BEZ235和BEZ235与Dox联合处理时,细胞凋亡的标记物PARP-1水平升高(数据未显示)。
阿霉素和BEZ235联合治疗可抑制体内肿瘤生长
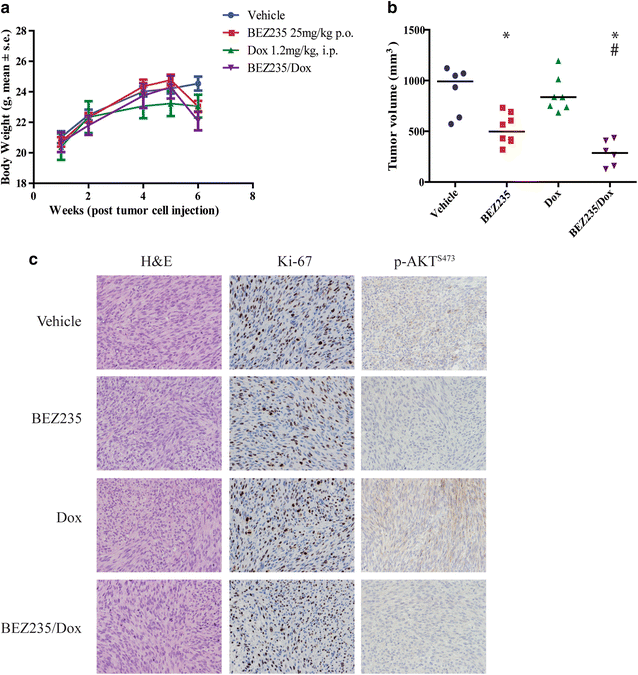
接下来,我们试图确定Dox和BEZ235在体内是否具有协同作用。因此,即时注射SKLMS1细胞系,以重现LMS形成中常见的微环境。有可触及肿瘤的NSG小鼠随机分为4组,分别接受载体、BEZ235、Dox或两种药物的联合使用。BEZ235以每天25mg /kg po的剂量给药12天,这是一个已被证明对其他体内癌症模型有效的剂量和时间表[25].阿霉素给予1.2 mg/kg,每两周一次,i.p,这将达到与人类剂量相当的血浆水平[34,35].治疗耐受性良好,在研究期间,所有治疗组的体重减轻均<基线的10%。6a).总的来说,单独使用BEZ235后,肿瘤生长被抑制了50%,与仅使用对照剂相比,联合治疗进一步降低了71%(图2)。6b).病理上,未治疗和治疗的肿瘤都有很好的分界线,由梭形细胞组成,细胞质嗜酸性,呈束状。细胞核呈卵形,细长,多形性轻至中度,有丝分裂活跃。6c).将异种移植瘤的肿瘤形态和免疫表型分类为LMS。两组间增殖和凋亡标志物Ki67和TUNEL染色均无差异(图2)。6C和未显示的数据)与我们的体外数据相比。单独使用BEZ235或联合使用Dox均可降低p-AKTS473与车辆和Dox对照相比(图;6c).因此,与单药治疗相比,Dox和BEZ235双重治疗在体内更有效地抑制LMS肿瘤生长。尽管增殖和凋亡的表达没有统计学意义,但根据pAKT染色,AKT的体内调控在治疗组之间似乎存在差异(图2)。6c)。
BEZ235/Dox组合在体内抑制LMS肿瘤生长。一个在给药后的实验过程中,任何治疗组的体重均无显著变化(p = ns);b箱形图描述实验终点(药物治疗12天后)的中位肿瘤体积,其中对照组(n = 6)中位肿瘤体积为991.3±236.0 mm3.而BEZ235 (n = 7)、Dox (n = 7)和BEZ235/Dox (n = 6)组中位体积分别为498.3±149.0 mm、836.6±179.8 mm、286.7±125.6 mm3.(*p < 0.05, BEZ235处理组与双制剂处理组比较#p < 0.05);c代表性的显微照片显示肿瘤形态(H和E),细胞增殖(Ki-67)和p-AKTS473在SKLMS1肿瘤异种移植标本中,BEZ235或BEZ235和Dox联合治疗后的状态。所有显微照片都是100倍放大
讨论
选择性治疗药物的发展已经使实体肿瘤的治疗前景发生了令人兴奋的变化;然而,治疗肉瘤患者的成功仍然有限。PI3K/AKT/mTOR通路通过不同的机制激活,包括IGFR或PI3K的激活,PTEN的缺失,RICTOR扩增和/或p-AKT的增加,已在LMS和其他肉瘤亚型中报道[1,36].最近的选择性PI3K和/或mTOR抑制剂的临床试验报告了实体肿瘤的良好疗效和可接受的毒性[37,38].
激酶抑制剂筛选确定PI3K/AKT/mTOR抑制剂为LMS的潜在治疗靶点
在这项临床前研究中,我们使用两种LMS细胞系筛选了480种激酶抑制剂,一种是患者来源的,另一种是市售的。两种细胞系在形态和免疫表型上都与LMS相容,并在体内形成异种移植,从而验证了LMS模型系统。在我们的主屏幕上发现了11个潜在目标;11个分子中有10个靶向PI3K和/或mTOR通路(表1).虽然有几种化合物符合效价标准,但由于在临床试验中的表现不佳,本研究将它们排除在进一步分析之外。因此,在我们的研究开始时,我们选择了两种表现出良好选择性的化合物,BEZ235(一种双重PI3K和mTOR抑制剂)和BKM120 (PI3K抑制剂)进行进一步评估。BEZ235和BKM120已在许多类型的癌症中显示出疗效,如激活PI3K突变的乳腺癌[39]、卵巢癌[40]、胰腺癌[41],横纹肌肉瘤[42,43]、肝细胞癌[44],在细胞系和/或动物模型中未分化多形性肉瘤(UPS) [45].尽管BEZ235已不再作为PI3K/mTOR抑制剂(即BYL719, PF-05212384;http://www.clinicaltrials.gov)正在临床推广。
PI3K/AKT/mTOR信号异常与多种上皮性癌症的肿瘤进展和转移有关[46],最近的数据已经开始阐明这些信号通路可能在STS中至关重要。具体而言,在小鼠模型中,使用条件平滑肌启动子灭活PTEN(一种已知的肿瘤抑制因子),AKT活性在平滑肌转化和LMS发展中发挥关键作用[5].斑马鱼也表达了组成型活性AKTSer473在间充质祖细胞中导致分化良好的脂肪肉瘤[32].此外,PI3K受体突变常见于粘液样圆形细胞脂肪肉瘤[1].最后,在对人类LMS RICTOR的详细病理评估中,mTOR2复合物的一个主要成分显著过表达[29].
PI3K/mTOR通路抑制增强了阿霉素诱导的LMS细胞死亡
阿霉素是一种有效的抗癌药物,用于治疗包括肉瘤在内的几种实体肿瘤。尽管是用于LMS的主要治疗方法,Dox只有部分疗效,其心脏毒性是一个限制因素。此外,对阿Dox的耐药性的发展是阻碍癌症治疗成功的主要挑战[10].Dox已被证明可在细胞凋亡发生前激活AKT [47].AKT的早期诱导可能有助于产生对Dox的化疗耐药性,并为使用PI3K/AKT抑制剂治疗提供了一个窗口期。因此,PI3K/mTOR抑制剂联合常规化疗药物治疗LMS可能是有益的,可以提高Dox的疗效,从而可能提高联合治疗LMS患者的成功率。
因此,我们研究了Dox和PI3K/mTOR抑制剂联合使用是否会对LMS的体外生长产生协同作用。此外,我们通过评估3种治疗方案(细胞预处理药物或同时治疗)来调查这些药物组合是否应该同时施用或依次施用。CI结果表明,BEZ235和Dox的联合抗增殖作用在所有剂量水平测试的LMS细胞系中都是协同的。然而,BKM120和Dox联合治疗LMS细胞并没有产生协同作用。基于这些结果,在LMS肌肉异种移植模型中仅使用BEZ235和Dox组合进行体内实验。虽然与对照动物相比,单药Dox对肿瘤生长没有显著抑制作用,但单独使用BEZ235或与Dox联合使用均可显著减小肿瘤体积。我们的发现与Kirsch等人的报道相似,后者在治疗另一种常见的肉瘤亚型UPS时,BEZ235治疗后的有效率为11.1%,联合Dox治疗后增加到50% [45].我。
结论
总之,我们证明了抑制PI3K和mTOR通路会损害LMS在体外和体内的生长。此外,我们还描述了PI3K和mTOR抑制剂的使用可能与阿霉素(该疾病的标准化疗)具有协同作用。因此,未来针对这些途径的抑制剂的研究是有必要的。
缩写
- LMS:
-
平滑肌肉瘤
- 阿霉素:
-
阿霉素
- STS:
-
软组织肉瘤
- RTK:
-
受体酪氨酸激酶
- aCGH:
-
阵列比较基因组杂交
- STR:
-
短串联重复
- TCAG:
-
应用基因组学中心
- OICR:
-
安大略癌症研究所
- LTRI:
-
Lunenfeld-Tanenbaum研究所
- DMSO溶液:
-
二甲亚砜
- 如果:
-
选择性抑制剂
- NMP:
-
1-methyl-2-pyrrolidone
- 置信区间:
-
组合索引
参考文献
Barretina J,等。亚型特异性基因组改变定义了软组织肉瘤治疗的新靶点。中国科学。2010;42(8):715-21。
Sinha S, Peach啊。软组织肉瘤的诊断与处理。BMJ。2010; 341: c7170。
杨杰,等。软组织平滑肌肉瘤的遗传畸变。中华癌症杂志,2009;27(1):1 - 8。
Vivanco I, sawyer CL。磷脂酰肌醇3-激酶AKT通路在人类癌症中的作用。中华癌症杂志2002;2(7):489-501。
Hernando E,等人。AKT-mTOR通路在平滑肌肉瘤的发生发展中起关键作用。中华外科杂志,2007;13(6):748-53。
Bathan AJ, Constantinidou A, Pollack SM, Jones RJ。平滑肌肉瘤的诊断、预后和治疗:解剖变异的识别。《中国日报》,2013;025(4):6。
Weiss SW, Goldblum, John R.平滑肌肉瘤。第五版。在:Weiss S, Goldblum W, John R.编辑。软组织肿瘤。费城:莫斯比爱思唯尔;2008.便士。1258.
格拉迪·拉等人。原发性平滑肌肉瘤生存和复发的预测因素。中华外科杂志,2013;20(6):1851-7。
Lambert LA,等。自噬:阿霉素和罗scovitine在肉瘤模型中协同细胞毒作用的新机制。癌症决议2008;68(19):7966-74。
Gupta, A, Yao S, Mackay H, Hopkins L.化疗(即吉西他滨,多西他赛+吉西他滨,阿霉素,或曲贝丁)用于不能手术的,局部晚期的,复发的,或转移性子宫平滑肌肉瘤,在一项基于证据的护理计划(PEBC)的质量计划中。安大略癌症护理中心;2012.
化疗和生物分子疗法在子宫肉瘤治疗中的作用。中华妇产科杂志。2011;25(6):773-82。
克罗斯LE,线性CM。受体酪氨酸激酶作为横纹肌肉瘤的治疗靶点。肉瘤。2011;2011:756982。
万X,赫曼LJ。肉瘤中mTOR抑制背后的生物学。肿瘤学家。2007;12(8):1007 - 18。
Pandurangan正义与发展党。预防结直肠癌的潜在靶点:关注PI3K/Akt/mTOR和Wnt通路亚洲太平洋癌症预防。2013; 14(4): 2201 - 5。
Paplomata E, O 'Regan R. PI3K/AKT/mTOR通路在乳腺癌中的作用:靶标、试验和生物标志物。中华流行病学杂志,2014;6(4):154-66。
Sarris EG, Saif MW, Syrigos KN。PI3K通路在肺癌中的生物学作用药品。2012;5(11):1236 - 64。
刘鹏,等。针对磷酸肌醇3-激酶途径在癌症。新药品发现,2009;8(8):627-44。
杨晓明,杨晓明,杨晓明。新型磷脂酰肌醇3-激酶抑制剂治疗癌症。专家意见调查药物。2011;20(4):507-18。
安藤Y,等。buparisib (BKM120)是一种口服泛I类PI3K抑制剂,用于日本晚期实体瘤患者的I期剂量递增研究。中华癌症杂志,2014;30(3):347-53。
Molife LR,等。口服AKT抑制剂MK-2206联合卡铂/紫杉醇、多西他赛或厄洛替尼治疗晚期实体瘤患者的一期试验。中华血液病杂志,2014;7(1):1。
陈志强,陈志强,陈志强,等。横纹肌肉瘤中PI3K/Akt/mTOR和Ras/MEK/ERK通路抑制的合成致死性相互作用。中华癌症杂志,2013;37(2):200-9。
Renshaw J,等。双重阻断PI3K/AKT/mTOR (AZD8055)和RAS/MEK/ERK (AZD6244)通路可协同抑制横纹肌肉瘤细胞在体外和体内的生长。中国临床癌症杂志,2013;19(21):5940-51。
Leroy C, Amante RJ, Bentires-Alj M.预测乳腺癌对PI3K抑制的耐药机制:精准医疗时代的挑战。生物化学学报,2014;42(4):733-41。
黄志刚,李志刚,李志刚,等。雌激素-孕酮对GR小鼠乳腺肿瘤细胞增殖动力学的影响。癌症决议1975;35(12):3698-704。
Maira SM,等。NVP-BEZ235是一种新的口服双磷脂酰肌醇3-激酶/哺乳动物靶点雷帕霉素抑制剂,具有强大的体内抗肿瘤活性。中华癌症杂志2008;7(7):1851-63。
周TC。药物联合研究中协同拮抗作用的理论基础、实验设计和计算机模拟。药典,2006;58(3):621-81。
周TC。使用Chou-Talalay方法进行药物联合研究及其协同效应量化。癌症杂志2010;70(2):440-6。
Brachmann SM,等。描述泛I类PI3K抑制剂NVP-BKM120在大范围浓度下的作用机制。中华癌症杂志,2012;11(8):1747-57。
Maira SM,等。NVP-BKM120的鉴定和表征,一种口服的泛I类pi3激酶抑制剂。中华癌症杂志,2012;11(2):317-28。
Gibault L等人。从PTEN表达缺失到RICTOR在平滑肌分化中的作用:mTOR通路在平滑肌肉瘤和多形性肉瘤中的复杂参与中国中医药大学学报(自然科学版),2012;25(2):197-211。
Ryan CW, Desai J.细胞毒性化疗和通路定向靶向药物治疗软组织肉瘤的过去、现在和未来。Am Soc Clin Oncol教育书籍。2013;2013:386 - 93。
Gutierrez A,等。异常的AKT激活导致分化良好的脂肪肉瘤。美国国家科学研究院。2011; 108(39): 16386 - 91。
埃利斯L等。HDAC和PI3K-Akt-mTOR通路抑制在Pten缺陷前列腺癌模型中的组合抗肿瘤作用Oncotarget。2013;4(12):2225 - 36。
黄志伟,刘志伟,陈志伟,等。两种不同工艺合成的多柔比星聚氰基丙烯酸丁酯纳米颗粒的药代动力学和生物分布研究。中华人民共和国生物医学大学学报。2004;29(2):344 - 344。
Synold TW, Doroshow JH。蒽环类药物剂量强度:大剂量阿霉素连续静脉输注96 h的临床药理学和药代动力学。中华感染化学杂志。1996;6(2):69-73。
Gibault L等人。肉瘤肿瘤发生的新见解:对160例具有复杂基因组学的软组织肉瘤的大系列的综合分析。中华病理学杂志。2011;223(1):64-71。
Bendell JC等。I期,口服泛I类PI3K抑制剂BKM120在晚期实体瘤患者中的剂量递增研究。中华临床肿瘤学杂志,2012;30(3):282-90。
Janku F,等。PI3K/AKT/mTOR抑制剂在患有PIK3CA突变的乳腺和妇科恶性肿瘤患者中的应用中国临床临床肿瘤学杂志,2012;30(8):773 - 773。
Serra V,等。NVP-BEZ235是一种双重PI3K/mTOR抑制剂,可阻止PI3K信号通路,并通过激活PI3K突变抑制癌细胞的生长。癌症决议2008;68(19):8022-30。
Santiskulvong C,等。利用NVP-BEZ235双重靶向3-磷酸肌醇激酶和哺乳动物雷帕霉素靶点作为一种新的治疗人类卵巢癌的方法。中华医学会癌症杂志,2011;17(8):2373-84。
曹鹏,等。一种新型的双pi3 -激酶/mTor抑制剂NVP-BEZ235对原位异种移植生长的原发性人胰腺癌的活性中华肿瘤学杂志,2009;20(8):369 - 369。
普鲁斯E等人。泛哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂AZD8055通过下调Mcl-1蛋白启动abt -737诱导的横纹肌肉瘤细胞凋亡。中国生物医学工程学报,2013;29(4):457 - 457。
Manara MC,等。NVP-BEZ235作为一种新的肉瘤治疗选择。中国临床癌症杂志,2010;16(2):530-40。
Kirstein MM,等。mTOR抑制剂RAD001、双mTOR和pi3 -激酶抑制剂BEZ235和pi3 -激酶抑制剂BKM120在肝细胞癌中的活性中国肝病杂志,2013;33(5):780-93。
Kim S,等。磷脂酰肌醇-3激酶抑制剂在原发性小鼠未分化多形性肉瘤模型中的疗效。肉瘤。2012;2012:680708。
Sheng S, Qiao M, Pardee AB.转移和AKT活化。中国生物医学工程学报。2009;29(3):344 - 344。
West KA, Castillo SS, Dennis PA。PI3K/Akt通路的激活与化疗耐药。耐药更新评述。2002;5(6):234-48。
作者的贡献
YB进行了免疫印迹试验、药物协同试验和异种移植试验,并对补充数据进行了分析和解释,并使用数字起草了手稿。LK进行药物筛选,生成EC50绘制曲线,进行免疫组化实验,用数字起草稿件。AD监督并协助药物筛选分析。DU, MI, RA和MP生成激酶库,辅助数据解释和感兴趣的药物选择。RXS和PCB进行了生物信息学分析。RV进行小鼠成像并起草手稿。BD对所有免疫细胞化学和免疫组织化学实验进行病理回顾。RG构思了这项研究,参与了研究的设计和协调,并编辑了手稿。所有作者都阅读并批准了最终的手稿。
确认
作者要感谢Aaron Schimmer博士和Mantek Yeung博士在执行和分析CalcuSyn方面的专业知识。
相互竞争的利益
作者宣称他们之间没有利益冲突。
给予的支持
这项工作得到了安大略癌症研究所临床科学家奖(RG)的资助。安大略癌症研究所由安大略政府资助。PCB得到了Terry Fox研究所新研究者奖和CIHR新研究者奖的支持。
作者信息
作者及隶属关系
相应的作者
额外的信息
Yael Babichev和Leah Kabaroff对这项工作同样做出了贡献
额外的文件
12967 _2016_814_moesm1_esm.pdf
附加文件1:图S1。LMS细胞系的特征:a . STS39肿瘤、STS39细胞系传代4、9、14、24、34、SKLMS1和HUVEC(人脐静脉内皮细胞)之间拷贝数变化的热图,显示细胞系随时间的基因组稳定性。刻度代表遗传差异的百分比,其中白色代表最小或没有遗传变化,深紫色代表最大遗传变化。例如,HUVEC和STS39之间的遗传差异为23%。B.使用DAPI、Desmin、平滑肌肌动蛋白(SMA)和小鼠IgG (msIgG)进行两种细胞系的免疫细胞化学,作为同型对照。SKLMS1为局灶性SMA阳性,STS39为局灶性Desmin阳性和SMA阳性(n=3)。C.通过STS39和SKLMS1细胞的连续传代,免疫印迹分析显示PI3K通路蛋白的蛋白稳定性。在SKLMS1细胞中可以看到PI3K受体亚基p85的磷酸化增加。此外,观察到mTOR的结合伙伴RICTOR水平升高。这两种修饰都可能导致通路激活的增加。以HeLa和Jurkat细胞系为蛋白表达对照。 siRNA against 4EBP1 was used to create a negative control for 4EBP1 and p-4EBP1 antibodies.图S2。用BEZ235和/或Dox处理可通过凋亡诱导细胞死亡。A.用BEZ235 (500nM)、Dox (500nM)和BEZ/Dox处理细胞72h,然后用流式细胞仪检测Annexin V和7-ADD染色分析细胞凋亡情况。BEZ235和Dox联合使用可显著诱导SKLMS1和STS-39细胞凋亡(数据未显示)。B. SKLMS1细胞(n=3)和STS39细胞(n=3)处理后72h凋亡细胞的定量。表S1。测序引物(5 ' -3 ')用于确定mTOR和PI3K激酶结构域外显子9和20中突变的存在。表S2。结合指数(CI)表与BEZ235, BKM120和/或Dox在3个剂量计划。使用ATPlite法测定生存力,并使用CalcuSyn软件进行分析。BEZ235 (15-240nM)和Dox (125-2000nM)在3种方案中均表现出协同作用(CI<0.9),而BKM120和Dox联合使用则无协同作用(n=3)。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
巴比切夫,Y,卡巴洛夫,L,达蒂,A。et al。抑制PI3K/AKT/mTOR联合阿霉素是治疗平滑肌肉瘤的有效方法。翻译医学杂志14, 67(2016)。https://doi.org/10.1186/s12967-016-0814-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-016-0814-z
关键字
- 平滑肌肉瘤
- PI3K
- mTOR
- 药物发现
- 肉瘤
- 阿霉素