摘要
在后基因组时代,很明显,仅靠基因变化不足以理解包括胰腺癌在内的大多数疾病过程。基因组测序揭示了胰腺癌中一系列复杂的基因改变,如点突变、染色体丢失、基因扩增和端粒缩短,这些改变通过特定的信号通路驱动癌症生长。基于蛋白质组的方法是基因组数据的重要补充,并提供了目标驱动分子及其翻译后修饰的关键信息。通过应用定量质谱法,这是一种用于早期诊断和个性化医疗的识别生物标志物的替代方法。我们回顾了目前的定量质谱技术和分析,已经发展和应用在胰腺癌的背景下,在过去十年。从这些胰腺研究中鉴定出的候选生物标志物的例子包括,孢子素,CD9, CXC趋化因子配体7,纤维连接蛋白1,半乳糖凝集素-1,凝胶蛋白,细胞间粘附分子1,胰岛素样生长因子结合蛋白2,金属蛋白酶抑制剂1,基质细胞衍生因子4和转化生长因子β诱导蛋白。其中许多蛋白质参与了胰腺肿瘤进展的各个步骤,包括细胞增殖、粘附、迁移、侵袭、转移、免疫反应和血管生成。这些新的候选蛋白可能为蛋白质诊断和靶向治疗的发展提供必要的信息。我们进一步认为,必须推进和建立新的策略,以整合蛋白质组学、转录组学和基因组学数据,以加强生物标志物的翻译。大规模的研究元数据处理过程将为胰腺癌内部新颖和意想不到的相关性铺平道路,这将有利于患者的靶向治疗。
简介
今天,不断增长的医疗保健需求对研究界提出了很高的期望和指示,以开发能够改善临床结果的解决方案,提高成本效益。新的诊断生物标记物的开发具有巨大的潜力,制药行业和学术医学环境都在测试解决方案[1- - - - - -4].胰腺癌的诊断和治疗就是这样一个需求未得到满足的领域。
胰腺癌是西方世界第十大常见癌症[5].癌症的总体5年生存率不足5%,是人类癌症中生存率最低的,已成为癌症相关死亡的第四大原因[6].据估计,全球每年诊断出27.7万例胰腺癌新发病例,约有26.6万例死亡[7].与胰腺癌相关的总保健费用和生产力损失很高,而且还在不断增加。在瑞典(人口950万),胰腺癌每年的经济成本估计在8300万欧元至9300万欧元之间[8].胰腺癌的生存率很低,因为症状通常很模糊,而且目前还没有确定的筛查和早期诊断标志物。大约85-90%的胰腺癌患者被诊断为晚期且不能手术。研究表明,如果肿瘤在早期被发现,生存率是可以提高的。例如,据报道,在<2厘米的肿瘤中,5年生存率为50% [9]而对于<1厘米的肿瘤,报告的5年生存率接近100% [10].
对于胰腺癌,FDA批准并临床使用的唯一生物标志物是碳水化合物抗原19-9 (CA 19-9)。自20世纪80年代以来,基于一项研究,CA 19-9在预测手术后复发方面优于致癌抗原(CEA),它被用作复发和进展的标记物[11].CA 19-9具有较高的敏感性和特异性(22项研究显示约为80%)[12]优于CEA、CA-50、DUPAN-2等标志物[12- - - - - -14].然而,低阳性预测值加上良性原因和各种形式的胆道梗阻可引起CA 19-9血清水平升高,降低了其作为筛查工具的实用性[12,15].此外,10%的人群不具有酶活性基因型(le/le),因此不能合成CA 19-9 [16].尽管如此,CA 19-9被认为是胰腺癌的最佳血清标记物,也是新标记物的判断依据[17].
系统生物学及其支持学科之一的蛋白质组学在过去十年中得到了广泛的发展,为应对卫生保健领域日益增加的挑战提供了新的方法。随着知识的增长和技术的改进,蛋白质组学领域已经引入了一种在早期可治愈阶段检测疾病的新范式。蛋白质组学不再是专门研究蛋白质表达的方法论。相反,蛋白质组学被应用于今天生命科学的所有领域。蛋白质组学尤其适用于胰腺癌的治疗,胰腺癌的成功治疗与早期干预直接相关[18].如今,蛋白质组学的准确性、敏感性和特异性与用于临床样本中分析物测量的高性能质谱仪器的发展直接相关。现代高端质谱平台可在测序中实现高分辨率功率,以及识别翻译后修饰[19].质谱还提供了一种方法来定位新的疾病调节蛋白的靶向抗癌药物,重新燃起了在胰腺癌的治疗结果上取得突破的希望,就像在其他恶性肿瘤中看到的那样,使用个性化药物,如费城染色体阳性急性髓系白血病(Ph+AML)的伊马替尼[20.]和吉非替尼(易瑞沙),以及特罗凯(厄洛替尼)治疗非小细胞肺癌[2].
健康和疾病在基因和蛋白质调控网络上的差异这一基本概念已经得到很好的确立。基因组测序揭示了胰腺癌中一系列复杂的基因改变,如点突变、染色体丢失、基因扩增和端粒缩短,这些改变通过特定的信号通路驱动癌症生长[21,22].为了研究哪些通路在蛋白质水平上是关键的,需要进行功能研究。今天的质谱仪器及其优点是由芬恩的电喷雾电离小组首创的[23],而Karas和Hillenkamp [24]和田中[25]开发了基质辅助激光解吸电离-“MALDI”质谱。这些具有里程碑意义的发明彻底改变了现代后基因组研究,并在2002年被授予诺贝尔奖。这些发明进一步改变了我们与临床蛋白质科学的合作方式。
增加我们对胰腺癌的生物学驱动因素的了解可以帮助我们识别新的诊断和治疗生物标志物。在这里,我们概述了定量质谱在胰腺癌患者新生物标志物的发现、验证和翻译中的作用。我们认为,在胰腺肿瘤的分析中,蛋白质组学和转录组学的工作流程是全球化的。必须建立自定义数据库并与ENCODE等基因组数据进行比较,以便在疾病机制中发现和利用新的分子实体。
生物标志物的概念
生物标志物的概念并不是一项新发明本身.它的利用已经在医学和药物开发过程中被开发。然而,应该对替代标记物进行区分,这是医学或病理生理事件的明确指标。美国国立卫生研究院(NIH)生物标志物工作组将生物标志物定义为作为正常生物过程、致病过程或对治疗干预的药理学反应的指标而客观测量和评估的一种特征[26].”
生物标记物可根据其在护理中的效用进一步划分[27]:
诊断生物标记:发现发病,术后复发,提供治疗指导,或确定疾病进展。
预后的生物标记物:说明自然疾病过程,并能协助治疗计划。提供关于生存和复发模式的见解。
预测生物标记:预测对治疗的反应。
考虑到临床研究中的倾向,生物标记物可分为几类[2]:
- 1.
主要生物标志物(低丰度),如受体信号激酶。
- 2.
次要生物标志物(低/中丰度),间接生物标志物是信号通路生物学的结果。
- 3.
第三类生物标志物(中/高丰度)是与疾病功能变化相关的蛋白质。
- 4.
疾病生物标志物(可低/中/高丰富)。
在胰腺癌生物标志物的研究中,蛋白质组学分析通常基于组织、胰液(胰腺外分泌部分的分泌物)和/或血液(血清或血浆)。
由于胰腺癌涉及许多疾病机制,我们目前还没有找到一种与疾病相关的靶向途径来提供有效的结果。这本身就是一个挑战。这是使用代表胰腺大疾病区域的组织样本来寻找疾病相关生物标志物的重要原因之一。因此,通过研究疾病发生的组织腔室,我们了解了疾病的起源和疾病机制的基础,以及参与起源的蛋白质驱动因素,以及疾病的进展。一旦我们了解了病变组织中蛋白质表达的变化,我们就可以在血液等其他体液中检测类似的标记物。当在蛋白质组学研究中分析组织时,福尔马林固定,石蜡包埋(FFPE)组织比快照冷冻组织标本更容易获得。FFPE组织标本在临床和病理上定义良好,这使得组织学观察与蛋白质组学分析直接相关[28,29].从FFPE样品中提取蛋白质技术方法的最新发展为更大的研究材料用于蛋白质表达的调查提供了新的机会。激光显微解剖和FFPE的应用,以及随后的蛋白质组学研究,可能允许分离癌细胞和基质细胞,以准确确定不同肿瘤区室的蛋白质组谱[30.,31].
胰液是一种与胰管直接分泌的蛋白质接触的生物液。癌细胞脱落的可能性使果汁成为丰富的生物标志物来源,并且由于这些样品中表达的癌症特异性蛋白质而成为一个机会。
人类血浆蛋白质组是最容易获得的生物流体,具有显著改善疾病诊断和治疗监测的潜力[32].然而,鉴于已知的癌症生物标志物在血清和血浆中的丰度较低[33],新的蛋白质组学技术正在不断开发和完善,为生物标志物量化提供足够深度的分析。
现代高端质谱法
传统上,二维凝胶电泳(2-DE)在蛋白质水平上解析蛋白质组,在过去被广泛用于蛋白质组学研究。该方法利用蛋白质在不同pH值下的净电荷(等电聚焦)和蛋白质的分子量在凝胶介质中以二维模式进行分离。生成的蛋白质“斑点”可以被染色(荧光标签),然后用不同的方法进行分析,以识别和量化特定的蛋白质。2-DE在1975年由O 'Farell首次提出[34]而凝胶电泳在胰腺癌方面也有了很大的改进[35,36].但在凝胶重现性方面仍存在局限性,对高碱性/酸性、低丰度蛋白和膜蛋白的表达能力较差。2-DE的一个主要限制是通过ms测序识别蛋白质的固有困难,因为从凝胶的聚合基质中切除蛋白质存在限制。此外,该方法在比较多种蛋白质时精度较低,自动化困难,因此不可靠,可能需要为新的无凝胶质谱技术让路[37].在临床蛋白质科学中,新的和未来的互补技术,如定量质谱,包括蛋白质鸟枪测序,在这些成就中发挥了重要作用[38- - - - - -40].在过去十年中最被接受的一种方法是液相分离与质谱联机接口[2,41,42].它可以用于跨多个样本集的蛋白质鉴定和定量。它可以用于蛋白质深度挖掘研究(生物标志物发现)和靶向蛋白质定量(生物标志物验证)。它也可以用于检测翻译后修饰(PTMs)。
蛋白质深层开采
蛋白质深度挖掘研究可以使用无标记或标记质谱方法进行。这些方法最近在胰腺癌的背景下引起了人们的兴趣。候选蛋白的例子已经被鉴定出来。所有这些候选生物标志物都已在胰腺癌患者的组织或生物液(胰液、血清或血浆)中得到验证(见表)1).
Label-free量化
无标签定量是基于多肽在质谱仪中产生的信号强度。定量通常使用峰值强度[43,44]或谱计数[45- - - - - -47].与标记程序相比,这些技术是直接的。首先,对单个样品进行LC-MS处理和分析。LC分离步骤用于降低样品中分析物的复杂性。人类血浆中已鉴定出超过2万种循环肽[48].归一化是为了尽量减少样品的细微不同的组成的影响。每个蛋白质应该量化几个肽,以证明正确的注释。为了检测低丰度蛋白质,需要高分辨率的多维色谱法。为了利用蛋白质结构中的附加部分来辅助色谱分离机制,正交法是至关重要的[2].
最近在一项研究中,Turtoi等人。[49]使用胰腺癌和正常胰腺组织的无标签定量来识别系统可达的蛋白质,定义为位于细胞膜外表面和/或细胞外基质中的蛋白质,具有作为诊断和治疗方法靶点的潜力。经western blot和多反应监测(MRM)蛋白定量进一步证实,11个候选蛋白表达上调。其中,转化生长因子β -诱导(TGFBI)、潜在转化生长因子β -结合2 (LTBP2)和孢素(ASPN)通过免疫组化进一步研究发现,与正常和炎症组织相比,它们在大量胰腺癌组织中过表达。这些候选基因之前并没有在蛋白质表达水平上与胰腺癌联系起来。TGFBI是一种分泌的细胞外基质蛋白,在几种癌症类型中过表达,并被认为促进转移进展[50- - - - - -53].TGFBI可诱导VE-cadherin连接解离,并通过整合素α -v β -5和Src信号通路最终破坏内皮屏障,导致癌细胞外渗增加[52].据报道,另一种候选蛋白LTBP2在细胞粘附中起作用,TGF-beta1在转录水平上增加LTBP2的表达[54,55].ASPN是富含亮氨酸的小蛋白聚糖(SLRP)家族的一员。关于ASPN在胰腺癌中的功能知之甚少,但它应该在TGF-beta/Smad信号传导中发挥作用[56].
在另一项深度采矿蛋白质组学研究中,Takadate等人[30.]使用无标签定量的胰腺癌组织与较差和较好的生存结果,以及非癌胰管。在这些蛋白中,选择170个用于MRM蛋白定量。其中,与正常组织相比,有14种蛋白质在胰腺癌中被发现过表达。此外,肿瘤中表达烯酰coa水合酶1 (ECH1)、嗅化素-4 (OLFM4)、口蛋白样蛋白2 (STML2)和葡萄糖转运体成员1 (GLUT1或GTR2)蛋白的患者生存期明显较差,提示这些蛋白可能具有预后价值,并可能作为新的治疗靶点。ECH1是一种在脂肪酸-氧化途径的辅助步骤中起作用的酶。ECH1的上调与癌细胞增殖、S期与G1期细胞比例增加、迁移能力增强有关,并可能在淋巴转移的发展中发挥重要作用[57].OLFM4是一种调节细胞粘附的细胞外基质糖蛋白,也被认为是一种促进肿瘤生长的抗凋亡因子[58].STML2是气孔蛋白超家族的一员。它已被确定为一种致癌相关蛋白,并发现在几种癌症中过表达[59- - - - - -61].下调STML2可依赖MMP2抑制癌细胞侵袭[60].此外,STML2的上调也参与了MAPK/ERK通路的激活[60].GLUT1是促进性葡萄糖转运蛋白家族的一员。GLUT1蛋白被认为在肿瘤细胞中上调,其代谢增强,葡萄糖需求增加[62].GLUT1表达增加也与胰腺癌侵袭性和不良预后有关[63,64].
保罗等人的另一项研究[65]使用无标签量化胰腺癌、慢性胰腺炎和正常胰腺组织。在这些蛋白中,有21种蛋白仅在胰腺癌标本中被鉴定,包括膜联蛋白4A (ANXA4)和纤维连接蛋白(FN1)。ANXA4是钙依赖性磷脂结合蛋白膜联蛋白家族的成员。研究表明,ANXA4与癌细胞的增殖、迁移和化疗耐药有关[66,67].另一种候选蛋白FN1是一种参与细胞粘附和迁移过程的糖蛋白。细胞和间质FN1的存在及其与整合素的相互作用对于胰腺癌的进展是必要的,抑制FN1信号通路先前被证明是一种有效的治疗策略在活的有机体内[68].
松原等人。[69]对胰腺癌患者和健康对照组的血浆进行了无标签定量。在MS峰值中,来自CXC趋化因子配体7 (CXCL7)的肽在胰腺癌患者中显著减少。在一个验证队列中也观察到胰腺癌中CXCL7蛋白的减少。有趣的是,他们发现CA19-9与CXCL7的组合显著提高了CA19-9的AUC值至0.961。CXCL7属于CXC趋化因子家族,是一种促血管生成和促炎症细胞因子。胰腺癌患者循环CXCL7的减少可能在抑制血管生成中起作用,并可能反映胰腺癌组织的缺氧性质[69].血浆CXCL7可被胰腺癌细胞分泌到血浆中的基质金属蛋白酶-9 (MMP9)等外蛋白酶降解[70- - - - - -72].
被量化
用稳定的重同位素(氘,碳-13,氮-15和氧-18)标记蛋白质和多肽已经在临床和药理学环境中使用了几十年,但最近发现了当代蛋白质组研究所承诺的可能性的主要部分。代谢和代谢后标记,通过化学或酶反应,可以用来合并标记同位素。碎片化后,多肽或报告离子在质谱分析中根据其信号强度对目标蛋白进行定量[73].同位素标记的加入,使标记的多肽成为分析的内部标准。该程序提供了一个独特的功能,以识别样品中的内源性分析物,即使是高度复杂的样品也可以通过该方法进行筛选[74].利用同位素标记的内部标准的优势还在于,这些蛋白质序列在人类样本中并不自然存在。基于标记试剂的残留特异性化学衍生化方法具有很大的灵活性,普遍适用,但有时可能变得过于复杂,导致不必要的副反应。代谢方法不需要对蛋白质进行任何操作,但仅限于可以完全控制培养的细胞[75].定量分析可以是“同位素法”或“等压法”,主要区别在于同位素法(SILAC。ICAT和ICPL)基于肽的轻同位素和重同位素的离子强度在MS水平定量多肽。而等压法(TMT和iTRAQ)基于测量报告离子强度的比较,在MS/MS水平上定量多肽[76].
代谢标记
细胞培养氨基酸稳定同位素标记(SILAC)是一种代谢同位素标记技术,将体内特定的氨基酸结合到哺乳动物蛋白质中[77- - - - - -79].细胞系在培养基中生长,其中标准必需氨基酸通过非放射性的、同位素标记的形式交换,从而纳入所有合成的蛋白质中。这一步已被证明不会影响细胞的生长。将同位素标记的类似物完全合并到所研究的蛋白质中需要一定数量的细胞加倍。来自实验和对照样品的蛋白质混合,质谱测量用于相对定量。这是一种简单、廉价和准确的技术,适用于任何细胞培养系统。化学标记和亲和纯化步骤不涉及这一过程,但缺点是它需要活细胞。然而,Geiger等人[80他最近开发了一种称为Super-SILAC的方法,用于人类肿瘤组织的定量蛋白质组学。
Grønborg等[81]是第一批提供蛋白质表达数据库注释的研究团队之一,使用SILAC来比较人类胰腺癌细胞系PANC1和正常胰腺细胞系HPDE的分泌组。western blot检测11个异常蛋白。随后通过免疫组化在人胰腺癌组织上验证了CD9、perlecan (HSPG2)、载脂蛋白E (APOE)、基质细胞衍生因子4 (SDF4)和纤连蛋白受体/整合素β1 (ITGB1)等5种蛋白。CD9是一种细胞表面糖蛋白,属于四胱甘肽家族。它参与许多细胞过程,包括细胞粘附和信号转导,并在抑制癌细胞运动和转移中发挥关键作用[82].CD9低表达与包括胰腺癌在内的几种癌症的不良预后有关[82,83].HSPG2是一种控制细胞迁移、增殖和分化的细胞周蛋白聚糖[84].HSPG2可与生长因子相互作用,促进肿瘤生长和血管生成[84,85].载脂蛋白e是低密度脂蛋白受体的配体[86].载脂蛋白e除了在胆固醇运输和代谢中起作用外,还参与了几种疾病过程。载脂蛋白e可影响细胞生长、增殖和免疫反应[87,88].载脂蛋白e在几种恶性肿瘤中升高,包括胰腺癌[89,90].已有研究表明APOE的促瘤作用可能与抑制tnf -有关[91].SDFs是指由基质细胞产生的一组蛋白质。研究表明,SDF1在侵袭性胰腺肿瘤中过度表达,高水平的SDF1与不良预后有关[92], SDF4在胰腺癌中的意义尚不清楚。ITGB1是整合素家族的膜受体,参与细胞黏附,通过与细胞外基质相互作用促进癌细胞转移扩散[93].
在最近的另一项研究中,Yu等人。94]使用SILAC收集人类胰腺癌细胞系CAPAN-2的分泌蛋白。由此产生的稳定同位素标记蛋白质组(SILAP)标准被添加到每个汇集的胰腺癌和良性胰腺疾病的样本中。在2D-LC-MS/MS分析之前,通过等电聚焦分离蛋白质。对细胞间粘附分子1 (ICAM1)和基底细胞粘附分子(BCAM)两种蛋白进行了ELISA独立验证。ICAM1在细胞-细胞和细胞-细胞外基质粘附中起作用。此前有报道称ICAM1在胰腺癌中过表达,并作为多形核细胞的重要停靠点,在功能上促进肿瘤细胞转移[95,96].BCAM是一种层粘连蛋白受体,是免疫球蛋白超家族的一员。BCAM在胰腺癌中的作用尚不清楚,但层粘连蛋白α 5广泛表达于基底膜,因此有人认为BCAM可能在肿瘤侵袭过程中发挥作用[97].
同位素标记
同位素编码亲和标记(ICATs)是一类试剂,由三个功能元素组成;一种对半胱氨酸(巯基)反应的化学基团,一种同位素编码的连接物和一种亲和标记(生物素),用于分离icat标记的多肽。这是一种用于细胞或组织相对定量的高精度技术,因为它基于稳定同位素稀释。每种试剂都有一种重元素(氘)和一种轻元素(氢)。被比较的两个样品被引入到共价连接到每个蛋白质中的每个半胱氨酸残基的ICAT试剂中。一个样品接收轻的形式,另一个接收重的形式。然后将这两个样品结合起来,并与蛋白水解酶反应生成肽片段。icat标记的(含半胱氨酸)多肽及其生物素标签,然后可以通过亲和亲和层析分离。然后分离出的多肽,并通过液相色谱-MS/MS程序进行分析。自动多级质谱生成原始标记蛋白的数量和序列身份。 The ratio of signal intensities of peptide pairs between the samples (differing with 8 Dalton mass) utilized with MS provides an accurate measure of the relative quantities. It is thus important to have the same ratios of the original amounts of proteins from the two samples through the whole process [98].使用氘以外的其他同位素也取得了改进。最近,一种使用碳-13作为重元素的方法导致每次实验鉴定出的蛋白质数量增加。这种方法也可以避免标记技术中由于氘化化合物氢键的显著改变而引起的保留时间偏移[99].
在最近的一项研究中,Chen等人。One hundred.]将ICAT应用于胰腺癌组织和匹配的正常胰腺样本。膜联蛋白A2 (ANXA2)被确定为胰腺癌的生物标志物。ANXA2是膜联蛋白家族的一部分。研究表明,在胰腺癌中,ANXA2可以介导上皮细胞向间充质细胞的转变、侵袭和转移,例如通过从细胞质转位到细胞膜[101,102].陈等人。[One hundred.]使用western blotting和免疫组织化学方法验证了ANXA2和另一个发现的蛋白ITGB1。
在另一项研究中,Chen等人。103]使用ICAT检测胰腺癌患者和正常对照组的胰液。其中一种被鉴定的蛋白质,胰岛素样生长因子结合蛋白-2 (IGFBP2),通过western blotting进一步证实在胰腺癌汁液中升高并在胰腺癌组织中过表达。IGFBP2已被发现在包括胰腺癌在内的多种恶性组织中过表达[35,104,105].胰岛素样生长因子(IGF)和IGF结合蛋白(IGFBPs)通过自分泌和旁分泌有丝分裂信号负责肿瘤细胞的生长[104].
作为这些研究的补充,Pan等人。106]使用来自胰腺癌患者、慢性胰腺炎患者和非胰腺疾病对照组的血浆的稳定同位素重和轻丙烯酰胺标签。他们发现,金属肽酶抑制剂1 (TIMP1),一种降解细胞外基质的基质金属蛋白酶(MMPs)的天然组织抑制剂,被确定为胰腺癌的生物标志物候选人。TIMP1先前已被证明可以减少胰腺癌细胞的生长、转移和血管生成,同时增加肿瘤凋亡[107].潘等人[106]发现TIMP1和ICAM1在区分胰腺癌和对照组方面表现出明显优于CA19-9的表现。
等压标签
串联质量标签(TMTs)是一种基于MS/MS的策略,使用同位素等压标签对多肽和蛋白质进行精确定量。标签由不同的区域组成。敏化和质量分化组在碰撞诱导解离(CID)过程中裂解,构成被检测和用于定量的TMT片段。与其他方法不同,tmt标记的肽对由于质量归一化基团而具有相同的总体质量,因此在色谱分离中共迁移,从而导致更精确的定量。共迁移意味着每个肽对的MS信号峰值不会分裂,提高了MS模式下的灵敏度。标签的反应性功能可以被操纵,因此它允许对任何肽进行耦合和标记。第二代标签与第一代标签的不同之处在于引入了一个额外的碎片增强组[108].TMT标记允许同时在MS/MS碎片上进行识别和相对定量。改进的6-plex tmt已设计成能够比较多达六种不同的提取物。在之前的2-plex tmt中使用13C或15n而不是H,保证了LC分离过程中的共洗脱[109].
辛克莱等人最近举了一个很好的例子。[110他们表明,他们可以使用蛋白质的氨基标记与来自预诊断胰腺癌病例的血清的TMT,并匹配健康对照样本。一直到胰腺癌的临床诊断,一致性蛋白表达变化的例子有;凝胶蛋白(GSN),载脂蛋白A4 (APOA4),凝血因子12 (F12)和乳转铁蛋白(LTF)。GSN是一种肌动蛋白盖顶蛋白,GSN水平在胰腺癌中被积极下调,而泛素-蛋白酶体途径是这一效应的重要贡献因素[111].胰腺癌患者的APOA4水平也显著降低[112].F12可能通过将单核-巨噬细胞转化为肿瘤相关的巨噬样细胞而促进癌细胞转移[113].LTF在先天免疫中发挥重要作用,已有研究表明LTF在胰腺癌中显著下调[114].LTF可能通过抑制AKT信号通路来抑制肿瘤[115].
等压标记相对和绝对定量(iTRAQ)是基于n端和赖氨酸侧链的共价标记。它包含一个报告基团,一个胺反应基团,以及它们之间的平衡基团。它可以是4 plex或8 plex,均为等压,质量分别为145至305 Da。平衡子基不能被MS检测到,因为它在检测中作为中性片段被释放出来。在CID生成可量化的同位素碎片时,报告组被裂解。定量完全在MS/MS水平上进行,与基于MS的技术相比,降低了化学噪声,提高了精度[116].使用iTRAQ,最多可以在一次运行中同时进行8个相对定量。等压标记的一个缺点是由于前驱体离子重叠可能会产生干扰。为了克服这一限制,已经采取了几种方法,例如采用隔离和碎片化的额外步骤[117,118].
潘等人[119]对胰腺癌直接前体(PanIN 3)、胰腺癌、慢性胰腺炎和正常胰腺组织进行iTRAQ和ICAT检测。蛋白质网络分析发现c-MYC是PanIN 3病变的重要调节蛋白。此外,通过免疫组织化学分析验证了其中三种过表达蛋白:层粘连蛋白β -1 (LAMB1)、半乳糖凝集素-1 (LGALS1)和肌动素-4 (ACTN4)。所有这三种蛋白都在晚期PanIN病变的间质或导管上皮细胞以及胰腺癌组织中过表达。LAMB1属于一组显著增强胰腺癌细胞侵袭行为的基底膜蛋白[120].GAL1是一种β -半乳糖苷结合凝集素,可诱导胰腺星状细胞中趋化因子的产生和增殖,促进胰腺纤维化和肿瘤进展[121,122].肌动蛋白-4是一种肌动蛋白结合蛋白,与胰腺癌中增强的细胞运动性、侵袭性生长和较差的生存率相关[123,124].E-cadherin调节-连环蛋白和肌动蛋白-4之间的联系[125].
靶向蛋白定量
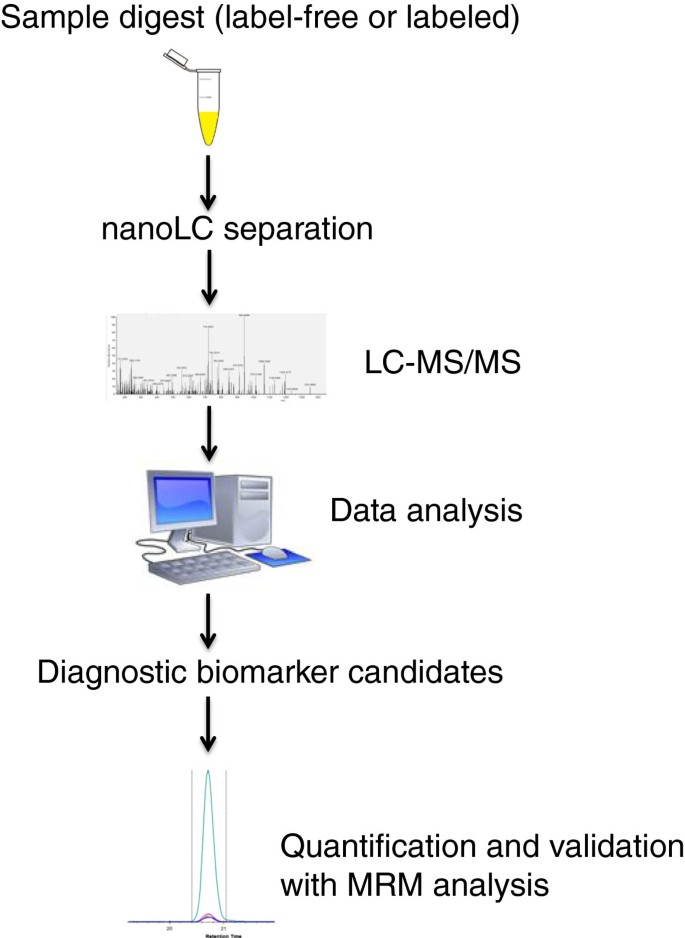
在基于发现的深度挖掘研究之后,需要根据表型特异性和/或在疾病中的直接机制作用,选择几个候选生物标志物进行进一步研究。使用更有针对性的蛋白质分析,如选择性反应监测(SRM;或MRM复数),这些生物标志物可以在大型患者队列中验证(见图)1).靶向蛋白分析允许在单次LC-MS/MS运行中以高灵敏度同时定量和身份确认。利用同位素标记的内标,可以确定每种蛋白质的绝对丰度。
MRM检测原理
利用LC-MS技术在MRM模式下对单个或多个蛋白质(multiple)进行靶向分析,近年来受到广泛关注。MRM是一种具有最高占空比的质谱扫描类型,可以高灵敏度监测一个或多个特定的离子转变。MRM检测正成为ELISA检测的真正补充。已经证明MRM检测能够同时监测50种蛋白质[126].为了从技术上提高低丰度蛋白质的灵敏度,需要进行样品制备。为了能够与ELISA的灵敏度竞争,ELISA能够以低皮克/毫升水平定量蛋白质,免疫亲和辅助LC-MS/MS分析已经出现。免疫亲和辅助LC-MS/MS分析的最新进展已能够显示每毫升picogram敏感性[127,128].MRM是一种比标准ELISA分析更具成本效益和省时的分析方法,具有在一次分析中定量多种蛋白质的能力,具有高重复性。
MRM分析的发展是基于在分析中为每个蛋白质选择一个或几个目标肽。样品通常用胰蛋白酶消化,然后进行LC-MS。化学稳定的同位素标记多肽最常用于多重MRM检测发展中基于ms的蛋白质绝对定量。
在网上处理
当建立MRM检测方法时,第一步是在网上处理。在网上方法学专门用于选择过程,以建立多重蛋白质测定[129,130].为目标蛋白或其特定异构体选择具有代表性的独特肽是产生真实和可复制结果的关键步骤。这些肽被称为蛋白型肽(PTPs),从这些片段离子产生最佳信号强度和区分目标肽必须被识别。为了获得最可靠的选择,目标肽的片段离子质量可以通过三四极杆仪器上的SRM测量来计算和实验测试。为了节省时间和帮助选择目标肽集,可以从以前的实验或新兴的在线数据库(包括PRIDE, PeptideAtlas和Human Proteinpedia)中收集信息[131].
为了获得更可靠的定量,每个目标蛋白至少应监测两个多肽,其中任何调控差异都可以假定是由翻译后修饰和/或重叠蛋白序列引起的[131].研究评估了MRM在确定翻译后修饰中的应用。mrm启动的检测和测序(MIDAS)技术已被证明在检测蛋白质磷酸化和识别乙酰化位点方面高度敏感[132,133].
哺乳动物系统的复杂性使得多种蛋白质可能充当单一肽的前体,从而导致对已发现的候选标记的低估或高估[134].含有蛋氨酸或色氨酸残基侧链的多肽易于氧化,而含有谷氨酰胺或天冬酰胺残基的多肽可转化为谷氨酸或天冬氨酸。在散弹枪分析中观察到的多肽有缺失的解理位点或非胰蛋白酶解理位点,应提高警惕。两个相邻的碱性氨基酸在任何一个解理位点上都容易出现高的解理漏失率。拥有一组独特的过渡是很重要的;否则,具有相似质量的前体/片段离子对会产生非特异性信号。因此,丰度高的蛋白质或产生强信号的蛋白质可能会干扰被研究蛋白质的信号[131].
有几个系统支持这个过程。它们可以帮助选择目标蛋白集,找到有代表性的pps,并管理和验证转变,以获得更可靠的数据。专用分析软件“Skyline”,支持多肽、前体和过渡产物的直接筛选在网上从蛋白质和肽片段[135].其他平台专用工具包括TIQAM、MRMPilot、SRM工作流软件、Verify和Optimizer [131].MRMer是另一个开源软件工具,用于分析高度复杂的MRM-MS实验产生的数据。它提供了超过1000个前体产品对的快速目视检查[136].
MRM-MS的最高灵敏度要求最佳的肽片段和所需产物离子的最大传输,这取决于参数的最佳设置,包括碰撞能量,锥电压和去聚类电位。已开发出微调参数的方法[137].通过干扰信号或重复样本之间不一致的恢复来帮助识别不准确的过渡的算法正在开发中,以减少人工和主观检查数据的需要,从而提高总体精度并将误差降至最低[138].
生物标志物的MRM技术平台
MRM分析的主要优点是其多路复用能力。这样就可以在一个检测周期内对蛋白质进行定量分析。原则上,任何蛋白质都可以成为分析物。尽管基于抗体的技术,如ELISA,代表了目前蛋白质生物标志物定量的金标准,但开发高质量的抗体分析需要时间和资源,并且一直是生物标志物翻译的限制。MRM检测的多路复用能力和通用概念使其优于目前的ELISA检测[139].近年来,一些研究已经证明了使用靶向MRM蛋白质组学用于候选胰腺癌生物标志物验证的价值。
Tortoi等人的研究[49]和Takadate等人。[30.]使用蛋白质深度挖掘,然后进行MRM分析,如前一节所述。
潘等人[85]应用基于mrm的靶向蛋白质组学平台直接检测血浆中的候选生物标志物蛋白。这项研究包括胰腺癌和慢性胰腺炎患者,以及健康个体。首先消耗血浆以去除白蛋白和IgG。5个候选蛋白中的3个,包括GSN、lumican (LUM;(SLRP家族成员)和TIMP1在区分胰腺癌与对照组时表现出高于0.75的AUC值。
米山等人。[140]使用MRM定量α -纤维蛋白原残基530和565处的脯氨酸羟基化。结果表明,PTMs可以作为胰腺癌的生物标志物,也可以识别ca19 -9阴性患者。
大型元数据研究
大规模的研究元数据处理是一个新的发展领域,其中存档生物样本的分析正在并将在新的生物标志物和新的诊断发展领域发挥主要作用。可以看到,工业界和学术界都在投资并增加大量资源,寻找方法来改进新技术发挥核心作用的发现成功。在这里,ENCODE计划多年来已经产生了广泛的dna序列资源,蛋白质组学社区正在利用[141].包括最新一代深度测序平台在内的人类基因组测序平台,使我们能够将新数据与遗传风险因素整合起来,与蛋白质组学数据保持一致[19,142].
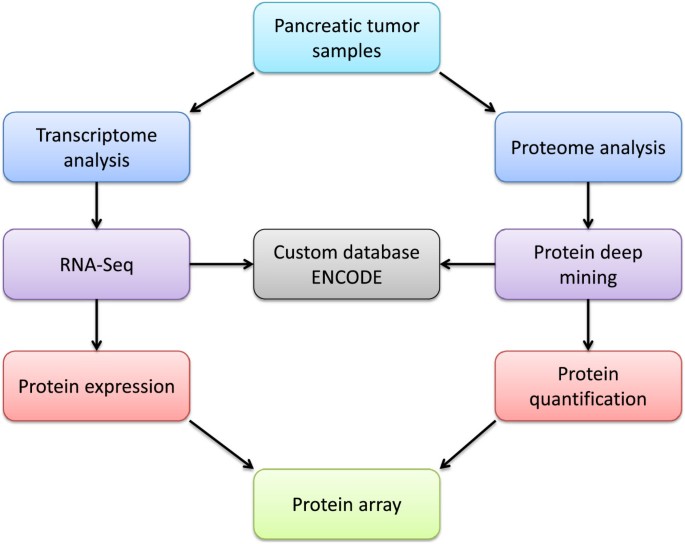
为了全面了解疾病中的蛋白质变化,需要从蛋白质组学、转录组学和基因组学数据中获得定量信息。最近,使用RNA测序的整个转录组分析显示,胰腺癌中平均有1.09亿个测序reads, 877个基因和异构体被鉴定为显示显著表达变化[143].我们建议整合转录组学和蛋白质组学数据,以增强生物标记物的翻译,如图所示2.我们建议用定量蛋白质组学和RNA-Seq分析胰腺肿瘤样本。在蛋白质和转录水平上进行鉴定和定量,并从RNA-Seq数据生成定制的蛋白质数据库。比较蛋白质和转录数据,并使用定制的蛋白质数据库来搜索蛋白质。已验证的蛋白质鉴定可在蛋白质数据库中查询,如Human protein Atlas [144]和neXtProt [145]以确定蛋白质证据的水平,定量蛋白质组学数据用于生成匠心途径分析中的网络。蛋白质和转录本与ENCODE中的基因组数据相关。
总结
胰腺癌蛋白质组的特征将不可避免地增加我们对胰腺肿瘤发生的认识。迄今为止发现的许多蛋白质参与了胰腺癌进展的关键步骤,如细胞增殖、粘附、迁移、侵袭、转移、免疫反应和血管生成。这些新的蛋白质生物标志物候选物将为筛选试验和靶向治疗的发展提供必要的信息。定量质谱法也可用于识别胰腺癌异常激活的信号[146]或识别胰腺癌患者的代谢物[147].随着改进的蛋白质组学技术的引入,我们正朝着更加个性化的医疗(PM)方法前进,有能力在选择合适的患者进行PM治疗时提供有用的指导。质谱仪器、样品制备方法和蛋白质鉴定方法的技术发展正在迅速改变临床研究测量患者样本中生物标志物的方式。我们现在可以在低丰度水平上测量蛋白质,并且有许多研究已经利用抗体探针进行微量富集,以达到每毫升皮克图的灵敏度[127,128].Lopez及其同事最近的一篇论文提供了数据,其中他们利用免疫亲和富集定量了大量蛋白质[148].除了测量技术的进步外,商用专用小型机器人通常用于处理多步样品制备,因此成为临床研究工作过程中必要且有效的步骤。可以预见,基于序列的质谱分析和提供多重读出的平台将受到广泛关注,并将成为未来临床科学的一个里程碑。具有绝对定量的数百种蛋白质生物标记物面板筛选患者样本的能力提供了更高的价值。未来一代的个性化医疗将推动整个诊断学领域向前发展,个体患者将获得针对正确疾病的最佳药物。公开的NCI临床蛋白质组学癌症技术评估计划(NCI- cptac)等研究是正在改变临床科学日常惯例的里程碑式成就的例子。有关国家癌症研究所倡议的大纲、细节和信息可在以下网址找到http://proteomics.cancer.gov/programs/cptacnetwork.这项新计划提供了应用新技术进行血浆生物标志物验证的数据[149].
结束语
以染色体为中心的人类蛋白质组计划(C-HPP,http://www.c-hpp.org)提供资源,使新注释能够得到验证。C-HPP联盟旨在识别所有由人类染色体编码的蛋白质[19].与ENCODE联盟的联系最近被提出,基因组学外显子验证可以在蛋白质序列水平上被识别[150].
挑战是利用ENCODE生物信息学引擎将基因序列与相关氨基酸序列耦合。这种方法最近在一项脑肿瘤研究中提出,可以适用于胰腺癌[151].
参考文献
Anderson NL:多种蛋白质组学平台在新诊断管道中的作用。蛋白质组学学报,2005,4:441- 444。
Vegvari A, Marko-Varga G:临床蛋白质科学和生物分析质谱,重点研究肺癌。化学学报,2010,30(3):388 - 388。
Végvári Á, Rezeli M, Döme B, Fehniger TE, Marko-Varga G:靶向个体化医疗的翻译科学研究,见《2011中美临床与转化医学学术研讨会报告选集》。2011年,华盛顿:科学/美国科学促进会
Zolg JW, Langen H:工业界是如何寻找新的诊断标志物和生物标志物的。蛋白质组学学报,2004,3:345-354。
席格尔·R, Naishadham D, Jemal A:癌症统计,2013。中华肿瘤学杂志,2013,30(3):344 - 344。
Vincent A, Herman J, Schulick R, Hruban RH, Goggins M:胰腺癌。《柳叶刀》,2011,378:607-620。
Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM: 2008年全球癌症负担估算:GLOBOCAN 2008。中华癌症杂志,2010,27(3):329 - 329。
Tingstedt B, Andersson E, Flink A, Bolin K, Lindgren B, Andersson R:胰腺癌,医疗保健成本和生产力损失:基于登记册的方法。中华外科杂志,2011,30(3):344 - 344。
Egawa S, Takeda K, fuyama S, Motoi F, Sunamura M, Matsuno S:小胰腺癌的临床病理特征。中华胰腺杂志,2004,28:235-240。
李志刚,李志刚,李志刚,李志刚:小胰导管腺癌的临床诊断。中华胰腺杂志,1998,16:396-401。
Glenn JSW, Kurtzman SH, Steinberg SM, Sindelar WF:放射免疫分析在胰腺癌治疗前后患者血清ca19 - 9水平的效用评估。中华临床医学杂志,1998,6:462-468。
Goonetilleke KSSA:碳水化合物抗原(CA 19-9)作为胰腺癌诊断的生化标志物的系统综述。中华实用外科杂志,2007,33(3):366 - 366。
世界卫生组织消化系统肿瘤分类。编辑:博斯曼FT,卡内罗F,赫鲁班RH,泰泽ND。2010年,里昂:国际癌症研究机构出版社
Klöppel G, Hruban RH, Longnecker DS, Adler G, Kern SE, Partanen TJ:胰腺导管腺癌。收录:Hamilton SR, Aaltonen LA,主编。世界卫生组织肿瘤分类。《消化系统肿瘤的病理学和遗传学》,2000年,里昂:IARC出版社
Kim JELK, Lee JK, Paik SW, Rhee JC, Choi KW:碳水化合物抗原19-9在无症状人群中作为胰腺癌筛查试验的临床应用。中华胃肠病杂志,2004,19:182-186。
Kawai S, Suzuki K, Nishio K, Ishida Y, Okada R, Goto Y, Naito M, Wakai K, Ito Y, Hamajima N:根据Lewis和分泌基因型,吸烟和血清CA19-9水平。中华癌症杂志,2008,29(4):489 - 497。
Duffy MJ, Sturgeon C, Lamerz R, Haglund C, Holubec VL, Klapdor R, Nicolini A, Topolcan O, Heinemann V:胰腺癌中的肿瘤标志物:欧洲肿瘤标志物组(EGTM)状态报告。杨文华,2010,21:441-447。
Wulfkuhle JD, Liotta LA, Petricoin EF:蛋白质组学在癌症早期检测中的应用。中华癌症杂志,2003,3:267-275。
Paik YK, Jeong SK, Omenn GS, Uhlen M, Hanash S, Cho SY, Lee HJ, Na K, Choi EY, Yan F, Zhang F, Zhang Y, Snyder M, Cheng Y, Chen R, Marko-Varga G, Deutsch EW, Kim H, Kwon JY, Aebersold R, Bairoch A, Taylor AD, Kim KY, Lee EY, Hochstrasser D, Legrain P, Hancock WS:以染色体为中心的人类蛋白质组项目,用于编目基因组中编码的蛋白质。生物技术学报,2012,30:221-223。
Kondo T, Tasaka T, Sano F, Matsuda K, Kubo Y, Matsuhashi Y, Nakanishi H, Sadahira Y, Wada H, Sugihara T, Tohyama K:使用甲酸伊马替尼(IM)治疗费城染色体阳性急性髓系白血病(Ph+AML):一份IM血浆浓度和bcr-abl转录本的报告。地球科学进展,2009,33:e137-e138。
Campbell PJ, Yachida S, Mudie LJ, Stephens PJ, Pleasance ED, Stebbings LA, Morsberger LA, Latimer C, McLaren S, Lin ML, McBride DJ, Varela I, nick - zainal SA, Leroy C, Jia M, Menzies A, Butler AP, Teague JW, Griffin CA, Burton J, Swerdlow H, Quail MA, Stratton MR, Iacobuzio-Donahue C, Futreal PA:转移性胰腺癌基因组不稳定性的模式和动态。自然科学学报,2010,37(4):344 - 344。
Jones S, Zhang X, Parsons DW, Lin JC, Leary RJ, Angenendt P, Mankoo P, Carter H, Kamiyama H, Jimeno A, Hong SM, Fu B, Lin MT, Calhoun ES, Kamiyama M, Walter K, Nikolskaya T, Nikolsky Y, Hartigan J, Smith DR, Hidalgo M, Leach SD, Klein AP, Jaffee EM, Goggins M, Maitra A, Iacobuzio-Donahue C, Eshleman JR, Kern SE, Hruban RH:全球基因组分析揭示的人类胰腺癌核心信号通路。科学通报,2008,29(3):344 - 344。
芬杰,曼M,孟CK,王淑芬,Whitehouse CM:电喷雾电离技术在生物大分子质谱分析中的应用。科学通报,1998,46(3):344 - 344。
王晓明,王晓明,王晓明,王晓明。蛋白质在10万道尔顿范围内的紫外激光基质解吸/电离质谱分析。离子质谱分析与应用,1998,19(3):329 - 329。
田中K, Waki H, Ido Y, Akita S, Yoshida Y, Yoshida T, Matsuo T:用激光电离飞行时间质谱分析m/z 100000的蛋白质和聚合物。快速共质谱。1988,2:151-153。
生物标记物定义工作组:生物标记物和替代终点:首选定义和概念框架。临床药物学杂志,2001,29(4):489 - 497。
Winter JM, Yeo CJ, Brody JR:胰腺癌的诊断、预后和预测生物标志物。中华外科杂志,2013,27(3):344 - 344。
Baumgart S, Ellenrieder V, Fernandez-Zapico ME:致癌转录因子:炎症相关胰腺癌发生的基石。肠道杂志,2013,62:310-316。
Donnarumma F, Végvári A, Rezeli M, Welinder C, Jansson B, Marko-Varga G: ffpe组织微环境区蛋白表达分析。《生物分析》2013年出版
Takadate T, Onogawa T, Fukuda T, Motoi F, Suzuki T, Fujii K, Kihara M, Mikami S, Bando Y, Maeda S, Ishida K, Minowa T, Hanagata N, Ohtsuka H, Katayose Y, Egawa S, Nishimura T, Unno M:使用福尔曼固定石蜡包埋组织,结合鸟枪和靶向蛋白质组学鉴定可切除胰腺癌的新型预后蛋白标记物。中华肿瘤学杂志,2013,32(3):344 - 344。
Marko-Varga GA, Fehniger TE:疾病进化过程中的微尺度蛋白表达谱。中国生物医学工程学报,2004,29(3):349 - 349。
Honda K, Ono M, Shitashige M, Masuda M, Kamita M, Miura N, Yamada T:蛋白质组学方法发现癌症生物标志物,用于早期检测和个性化医疗。中华临床杂志,2013,43:103-109。
Anderson NL, Anderson NG:人类血浆蛋白质组:历史,特征和诊断前景。细胞蛋白质组学研究。2002,1:845-867。
O'Farrell PH值:蛋白质的高分辨率二维电泳。中国生物医学工程学报,2004,27(4):457 - 457。
Gronborg M, Bunkenborg J, Kristiansen TZ, Jensen ON, Yeo CJ, Hruban RH, Maitra A, Goggins MG, Pandey A:人胰液的综合蛋白质组学分析。中国生物医学工程学报,2004,27(3):344 - 344。
周玲,吕震,杨安,邓锐,麦春,桑霞,费柏凯,吕霞:人胰液蛋白质组学的比较分析。蛋白质组学,2007,7:1345-1355。
Abdallah CD-GE, Renaut J, Sergeant K:基于凝胶和无凝胶的定量蛋白质组学方法综述。中国植物学报,2012,第4期(1
M:蛋白质组学是新的基因组学吗?电子学报,2007,30(3):395-398。
Mann M:通过比较分析来指导蛋白质组学的质量改进。光子学报,2009,30(6):717-719。
Nilsson T, Mann M, Aebersold R, Yates JR, Bairoch A, Bergeron JJ:高通量蛋白质组学中的质谱:为大时代做好准备。工程物理学报,2010,7:681-685。
Rezeli M, Vegvari A, Fehniger TE, Laurell T, Marko-Varga G:利用人类蛋白质组目录开发多路质谱分析板,向高密度临床特征研究迈进。中华生物医学杂志,2011,1:7。
Choudhary C, Mann M:基于质谱的蛋白质组学解码信号网络。中国生物医学工程学报,2010,11:427-439。
Bondarenko PV, Chelius D, Shaler TA:通过酶解和毛细管反相液相色谱-串联质谱鉴定和相对定量蛋白质混合物。化学学报,2002,29(4):344 - 344。
Wang W, Zhou H, Lin H, Roy S, Shaler TA, Hill LR, Norton S, Kumar P, Anderle M, Becker CH:无同位素标记或加标标准的蛋白质和代谢物质谱定量。化学学报,2003,27(3):344 - 344。
龙仁DH,黄思,吴玲,韩冬冬:光谱计数在定量蛋白质组学中的作用。蛋白质组学杂志,2010,7:39-53。
刘浩,萨迪戈夫RG, Yates JR:鸟枪蛋白质组学中相对蛋白质丰度的随机抽样和估计模型。化学学报,2004,26(3):349 - 349。
Searle BC: Scaffold:用于验证基于MS/MS的蛋白质组学研究的生物信息学工具。蛋白质组学,2010,10:1265-1269。
Richter R, Schulz-Knappe P, Schrader M, Standker L, Jurgens M, Tammen H, Forssmann WG:人血浆中肽组分的组成:循环人肽数据库。中国生物医学工程学报,2004,26(2):326 - 326。
Turtoi A, Musmeci D, Wang Y, Dumont B, Somja J, Bevilacqua G, De Pauw E, Delvenne P, Castronovo V:人胰腺导管腺癌中具有诊断和治疗潜力的新型可达蛋白的鉴定。中国生物医学工程学报,2011,30(4):344 - 344。
Golembieski WA, Rempel SA: sparc调节胶质瘤基因表达变化的cDNA阵列分析。中华神经外科杂志,2002,30(4):326 - 326。
Ivanov SV, Ivanova AV, Salnikow K, Timofeeva O, Subramaniam M, Lerman MI:两种新的VHL靶点,TGFBI (BIGH3)及其transactivator KLF10在肾透明细胞癌和其他肿瘤中表达上调。生物化学学报,2008,37(3):344 - 344。
Ma C, Rong Y, Radiloff DR, Datto MB, Centeno B, Bao S, Cheng AW, Lin F, Jiang S, Yeatman TJ,王晓峰:细胞外基质蛋白betaig-h3/TGFBI通过增强细胞外渗促进结肠癌转移基因开发,2008,22:308-321。
Yamanaka M, Kimura F, Kagata Y, Kondoh N, Asano T, Yamamoto M, Hayakawa M: BIGH3在透明细胞肾细胞癌中过表达。中国农业科学,2008,19:865-874。
Ahmed W, Kucich U, Abrams W, Bashir M, Rosenbloom J, seade F, Mecham R, Rosenbloom J: TGF-beta1在转录水平上增加潜在TGF-beta结合蛋白-2表达的信号通路。连接组织决议1998,37:263-276。
杨晓明,李志强,李志强,等。潜在转化生长因子- β -结合蛋白2是黑色素瘤细胞的粘附蛋白。中国生物医学工程学报,2003,27(3):344 - 344。
Nakajima M, Kizawa H, Saitoh M, Kou I, Miyazono K, Ikegawa S:关节软骨中孢素功能和调节的机制。中国生物医学工程学报,2007,28(3):366 - 366。
张娟,宋敏,王娟,孙敏,王波,李锐,黄艳,侯玲,金燕,王敏,唐娟:烯酰辅酶A水合酶1是肿瘤淋巴转移的重要因素。中国生物医学工程学报,2011,29(3):344 - 344。
于磊,王磊,陈松:嗅觉蛋白4是胃肠肿瘤分化与进展的新标志物。中华肿瘤学杂志,2011,29(4):344 - 344。
张玲,丁芳,曹伟,刘铮,刘伟,余智,吴勇,李伟,李勇,刘铮:口蛋白样蛋白2在人食管鳞癌中过表达并参与调节细胞生长和细胞黏附。临床癌症杂志,2006,12:1639-1646。
曹伟,张波,丁峰,张伟,孙波,刘震:SLP-2表达与食管鳞状细胞癌侵袭相关。公共科学学报,2013,8:e63890。
崔智,张磊,华志,曹伟,冯伟,刘志:口腔蛋白样蛋白2在人子宫内膜腺癌中过表达并与细胞生长相关。农学通报,2007,17:829-833。
Chan DA, Sutphin PD, Nguyen P, Turcotte S, Lai EW, Banh A, Reynolds GE, Chi JT, Wu J, Solow-Cordero DE, Bonnet M, Flanagan JU, Bouley DM, Graves EE, Denny WA, Hay MP, Giaccia AJ:通过化学合成致死性靶向GLUT1和Warburg效应治疗肾细胞癌。中华医学杂志,2011,30(3):457 - 457。
Pizzi S, Porzionato A, Pasquali C, Guidolin D, Sperti C, Fogar P, Macchi V, De Caro R, Pedrazzoli S, Parenti A:葡萄糖转运蛋白-1的表达与胰腺癌发生的预后意义。中华病理学杂志,2009,24:175-185。
Ito H, Duxbury M, Zinner MJ, Ashley SW, Whang EE:葡萄糖转运蛋白-1基因表达与胰腺癌侵袭性和MMP-2活性相关。中华外科杂志,2004,36(4):548-556。
paul JA, Lee LS, Banks PA, Steen H, Conwell DL:用液相色谱串联质谱分析福尔马林固定石蜡包埋胰腺组织的蛋白质组学。中华胰腺杂志,2012,41:175-185。
Mogami T, Yokota N, Asai-Sato M, Yamada R, Koizume S, Sakuma Y, Yoshihara M, Nakamura Y, Takano Y, Hirahara F, Miyagi Y, Miyagi E:膜联蛋白A4参与卵巢透明细胞腺癌细胞的增殖、化疗抵抗以及迁移和侵袭。公共科学学报,2013,8:e80359。
邓松,王娟,侯玲,李娟,陈刚,景波,张霞,杨震:膜联蛋白A1、A2、A4和A5在乳腺癌、胰腺癌和喉癌中单独或协同发挥重要作用。中华医学杂志,2013,5:107-112。
Schwarz RE, Awasthi N, Konduri S, Caldwell L, Cafasso D, Schwarz MA: EMAP II通过抑制纤连蛋白依赖性增殖对胰腺癌的抗肿瘤作用。中国癌症杂志,2010,9:632-639。
Matsubara J, Honda K, Ono M, Tanaka Y, Kobayashi M, Jung G, Yanagisawa K, Sakuma T, Nakamori S, Sata N, Nagai H, Ioka T, Okusaka T, Kosuge T, Tsuchida A, Shimahara M, Yasunami Y, Chiba T, Hirohashi S, Yamada T:胰腺癌患者血浆CXC趋化因子配体7水平降低。癌症流行病学生物标志物,2011,20:160-171。
Villanueva J, Shaffer DR, Philip J, Chaparro CA, erdjumant - bromage H, Olshen AB, Fleisher M, Lilja H, Brogi E, Boyd J, Sanchez-Carbayo M, Holland EC, Cordon-Cardo C, Scher HI, Tempst P:差异外蛋白酶活性赋予肿瘤特异性血清肽结构模式。中华临床医学杂志,2006,29(4):344 - 344。
Van den Steen PE, Proost P, Wuyts A, Van Damme J, Opdenakker G:中性粒细胞明胶酶B通过氨基端处理使白细胞介素-8增强10倍,而它降解CTAP-III, PF-4和gro - α,而RANTES和MCP-2完好无损。《血液》,2000,96:2673-2681。
田敏,崔玉珍,宋宏华,宗俊梅,周晓阳,陈勇,韩建新:蛋白质组学分析发现MMP-9、DJ-1和A1BG在胰管腺癌患者胰液中过表达。中国生物医学工程杂志,2008,29(4):344 - 344。
李志刚,李志刚,李志刚。蛋白质组学中稳定同位素标记的研究。蛋白质组学,2008,8:4873-4885。
Picotti P, Aebersold R:基于反应监测的蛋白质组学:工作流程,潜力,缺陷和未来方向。工程物理学报,2012,29(3):344 - 344。
高志刚,王志刚,王志刚,王志刚,王志刚,王志刚,王志刚,王志刚,王志刚,王志刚,王志刚:等压SILAC法测定蛋白质含量的研究进展。蛋白质组学杂志,2008,7:927-937。
潘s, Brentnall TA, Kelly K,陈r:组织蛋白质组学在胰腺癌研究中的发现、新兴技术和挑战。蛋白质组学,2013,13:710-721。
王晓明,王晓明,王晓明,等:细胞培养中氨基酸稳定同位素标记技术在蛋白质丰度和翻译后修饰中的应用。科学STKE 2005。2005, 37 (2): pl2。
Everley PA, Krijgsveld J, Zetter BR, Gygi SP:定量癌症蛋白质组学:细胞培养中氨基酸稳定同位素标记(SILAC)作为前列腺癌研究的工具。蛋白质组学学报,2004,3:729-735。
Ong SEBB, Kratchmarova I, Kristensen DB, Steen H, Pandey A, Mann M:细胞培养中氨基酸稳定同位素标记(SILAC)作为一种简单准确的表达蛋白质组学方法。蛋白质组学学报,2002,1:366 - 366。
李志刚,李志刚,李志刚,李志刚。肿瘤组织蛋白质组学研究进展。光子学报,2010,34(3):383-385。
Gronborg M, Kristiansen TZ, Iwahori A, Chang R, Reddy R, Sato N, Molina H, Jensen ON, Hruban RH, Goggins MG, Maitra A, Pandey A:利用差异蛋白质组学方法从胰腺癌分泌组中发现生物标志物。细胞蛋白质组学研究。2006,5:157-171。
王海霞,李强,沙玛C, Knoblich K, Hemler ME: Tetraspanin蛋白在癌症中的作用。生物化学学报,2011,39:547-552。
Sho M, Adachi M, Taki T, hasida H, Konishi T, Huang CL, Ikeda N, Nakajima Y, Kanehiro H, Hisanaga M, Nakano H, Miyake M:跨膜4超家族作为胰腺癌的预后因素。中华肿瘤学杂志,1998,29(3):349 - 349。
白洛克,梅尔罗斯,艾佐佐RV: perlecan对细胞信号通路的调节作用。生物化学,2008,47:11174-11183。
蒋欣,陈e, Schaefer L, Schaefer RM, Couchman JR:肿瘤源性perlecan对表皮肿瘤生长和血管生成的重要贡献。中华细胞化学杂志,2004,29(3):344 - 344。
载脂蛋白E:胆固醇转运蛋白,在细胞生物学中的作用不断扩大。科学通报,1988,30(4):344 - 344。
许元元,Basford JE: apoE抑制细胞迁移和增殖的独特信号机制。神经生物学杂志,2005,26:317-323。
张慧,吴丽敏,吴娟:载脂蛋白E与细胞因子的交叉对话。介质炎症,2011,2011:949072。
陈娟,陈丽娟,杨瑞宝,夏玉玲,周慧慧,吴伟,陆燕,胡丽文,赵颖:载脂蛋白E在胰腺导管腺癌中的表达及临床意义。中华医学杂志,2013,30:583。
周陈J,吴魏,甄C, H,杨R,陈L,胡L:补体C3的表达和临床意义,补充C4b1在胰腺癌和载脂蛋白E。生态学报,2013,6:43-48。
Martinez-Clemente M, Ferre N, Gonzalez-Periz A, Lopez-Parra M, ortiillo R, Titos E, Moran-Salvador E, Miquel R, Arroyo V, Funk CD, Claria J: 5-脂氧合酶缺乏降低高脂血症易发apoe缺失小鼠的肝脏炎症和肿瘤坏死因子α诱导的肝细胞损伤。中华肝病学杂志,2010,29(3):344 - 344。
梁俊杰,朱s, Bruggeman R, Zaino RJ, Evans DB, Fleming JB, Gomez HF, Zander DS, Wang H:人基质细胞衍生因子-1高表达与II期胰腺导管腺癌患者预后不良相关。中华癌症流行病学杂志,2010,19:2598-2604。
王晓明,王晓明,王晓明,等:整合素表达改变对胰腺癌细胞侵袭的调控作用。中华临床癌症杂志,2009,29(4):349。
Yu KH, Barry CG, Austin D, Busch CM, Sangar V, Rustgi AK, Blair IA:稳定同位素稀释多维液相色谱-串联质谱技术用于胰腺癌血清生物标志物的发现。中国生物医学工程学报,2009,28(3):357 - 357。
Roland CL, Dineen SP, Toombs JE, Carbon JG, Smith CW, Brekken RA, Barnett CC:肿瘤来源的细胞间黏附分子-1介导原位异种胰腺移植中肿瘤相关白细胞浸润。Exp生物医学(梅伍德)。2010, 35(4): 457 - 457。
tempiia - caliera AA, Horvath LZ, Zimmermann A, Tihanyi TT, Korc M, Friess H, Buchler MW:黏附分子在人胰腺癌中的作用。中华外科杂志,2002,19(3):344 - 344。
Kikkawa Y, Miner JH:回顾:路德/B-CAM:红血球和各种组织上的层粘连受体。连接组织决议2005,46:193-199。
Gygi SPRB, Gerber SA, Turecek F, Gelb MH, Aebersold R:使用同位素编码亲和标记定量分析复杂蛋白质混合物。中国生物工程学报,1999,17:994-999。
Yi ECLX, Cooke K, Lee H, Raught B, Page A, Aneliunas V, Hieter P, Goodlett DR, Aebersold R:以(13)C/(12)C为基础的酸可切割同位素编码亲和标记试剂和改进的数据采集方案增加了定量蛋白质组的覆盖率。蛋白质组学,2005,5:380-387。
陈r, Yi EC, Donohoe S, Pan S, Eng J, Cooke K, Crispin DA, Lane Z, Goodlett DR, Bronner MP, Aebersold R, Brentnall TA:胰腺癌蛋白质组:侵袭、转移和免疫逃逸的基础蛋白。中华胃肠病学杂志,2005,29(4):457 - 457。
Zheng L, Foley K, Huang L, Leubner A, Mo G, Olino K, Edil BH, Mizuma M, Sharma R, Le DT, Anders RA, Illei PB, Van Eyk JE, Maitra A, Laheru D, Jaffee EM:膜联蛋白A2的酪氨酸23磷酸化依赖细胞表面定位是胰腺癌侵袭和转移的必要条件。PLoS One, 2011, 6: e19390。
张欣,刘松,郭超,宗娟,孙明志:膜联蛋白A2与癌症的关系。中华实用医学杂志,2012,14:634-640。
Chen R, Pan S, Yi EC, Donohoe S, Bronner MP, Potter JD, Goodlett DR, Aebersold R, Brentnall TA:胰腺癌汁液的定量蛋白质组学分析。蛋白质组学,2006,6:3871-3879。
Busund LT, Richardsen E, Busund R, Ukkonen T, Bjornsen T, Busch C, Stalsberg H:与良性病变相比,IGFBP2在乳腺癌中的显著表达。中华临床病理学杂志,2005,28(3):361-366。
Hsieh D, Hsieh A, Stea B, Ellsworth R: IGFBP2促进胶质瘤干细胞增殖和存活。生物化学学报,2010,37(3):367-372。
Pan S, Chen R, Crispin DA, May D, Stevens T, McIntosh MW, Bronner MP, Ziogas A, Anton-Culver H, Brentnall TA:使用全球定量蛋白质组学分析在人类血浆中发现与胰腺癌和慢性胰腺炎相关的蛋白质改变。中国生物医学工程学报,2011,27(3):344 - 344。
Bloomston M, Shafii A, Zervos EE, Rosemurgy AS: TIMP-1在胰腺癌中的过表达降低肿瘤生长,减少植入和转移,抑制血管生成。中华外科杂志,2002,22(3):344 - 344。
Thompson ASJ, Kuhn K, Kienle S, Schwarz J, Schmidt G, Neumann T, Johnstone R, Mohammed AK, Hamon C:串联质量标签:一种用MS/MS比较分析复杂蛋白质混合物的新量化策略。化学学报,2003,27(3):387 - 387。
戴勇,李克V,图尔克N, Kuhn K, Hochstrasser DF, Burkhard PR, Sanchez JC:用6-plex等压标记进行人脑脊液中蛋白质的相对定量。化学学报,2008,30(4):344 - 344。
杨晓明,杨晓明,杨晓明,等。利用TMT蛋白标记、分离和LC-MS/MS对血清样本进行定量分析。方法学报,2011,54:361-369。
倪小刚,周琳,王国强,刘明明,白晓峰,刘峰,Peppelenbosch MP,赵鹏:泛素-蛋白酶体通路介导胰腺癌凝胶蛋白下调。中华医学杂志,2008,14:582-589。
Abulaizi M, Tomonaga T, Satoh M, Sogawa K, Matsushita K, Kodera Y, Obul J, Takano S, Yoshitomi H, Miyazaki M, Nomura F:三步蛋白质组分析在胰腺癌新生物标志物鉴定中的应用。中国蛋白质组学杂志,2011,31(4):457 - 457。
王锐,张涛,马志,王艳,程志,徐红,李伟,王欣:凝血因子XII与单核/巨噬细胞介导上皮性卵巢癌腹膜转移的相互作用。中华妇产科杂志,2010,27(4):489 - 497。
Fedail SS, Harvey RF, Salmon PR, Brown P, Read AE:胰腺疾病患者纯胰液中胰蛋白酶和乳铁蛋白水平。肠道杂志,1979,20:983-986。
邓M,张W,唐H,你们问,廖Q,周Y,吴M,熊W,郑Y,郭X, Z秦,他W,周M,湘J,李X,马J,李G: Lactotransferrin作为肿瘤抑制鼻咽癌的压抑AKT通过多种机制。中国生物医学工程学报,2013,32:4273-4283。
Beck F, Burkhart JM, Geiger J, Zahedi RP, Sickmann A:基于itraq的肽和蛋白质定量的鲁棒工作流。方法Mol biology, 2012, 893: 101-113。
丁玲,Rad R, Gygi SP, Haas W: MS3消除等压多重定量蛋白质组学中的比例失真。岩石力学与工程学报,2011,29(3):344 - 344。
Ow SY, Salim M, Noirel J, Evans C, Rehman I, Wright PC:简单和复杂混合物中的iTRAQ低估:“好,坏和丑陋”。中国生物医学工程学报,2009,28(3):344 - 344。
Pan S, Chen R, Reimel BA, Crispin DA, Mirzaei H, Cooke K, Coleman JF, Lane Z, Bronner MP, Goodlett DR, McIntosh MW, Traverso W, Aebersold R, Brentnall TA:胰腺上皮内瘤变定量蛋白质组学研究。电泳,2009,30:1132-1144。
Sawai H, Okada Y, Funahashi H, Takahashi H, Matsuo Y, Yasuda A, Ochi N, Takeyama H, Manabe T:基底膜蛋白在人胰腺癌细胞侵袭过程中发挥重要作用。中华外科杂志,2008,34(3):344 - 344。
Fitzner B, Walzel H, Sparmann G, Emmrich J, Liebe S, Jaster R:半凝集素-1是胰腺星状细胞激活的诱导因子。手机信号,2005,17:1240-1247。
Masamune A, Satoh M, Hirabayashi J, Kasai K, Satoh K, Shimosegawa T:半乳糖凝集素-1诱导胰腺星状细胞趋化因子产生和增殖。中华实用医学杂志,2006,29(3):329 - 329。
Kikuchi S, Honda K, Tsuda H, Hiraoka N, Imoto I, Kosuge T, Umaki T, Onozato K, Shitashige M, Yamaguchi U, Ono M, Tsuchida A, Aoki T, Inazawa J, Hirohashi S, Yamada T: actinin-4在胰腺浸润性导管癌中的表达和基因扩增。临床癌症杂志,2008,14:5348-5356。
Welsch T, Keleg S, Bergmann F, Bauer S, Hinz U, Schmidt J: Actinin-4在原发性和转移性胰腺导管腺癌中的表达。中华胰腺杂志,2009,38:968-976。
Hayashida Y, Honda K, Idogawa M, Ino Y, Ono M, Tsuchida A, Aoki T, Hirohashi S, Yamada T: E-cadherin调节β -连环蛋白和actitinin -4之间的关联。中国癌症杂志,2005,30(4):344 - 344。
Anderson L, Hunter CL:主要血浆蛋白的定量质谱多反应监测分析。细胞蛋白质组学研究。2006,5:573-588。
Whiteaker JR, Zhao L, Abbatiello SE, Burgess M, Kuhn E, Lin C, Pope ME, Razavi M, Anderson NL, Pearson TW, Carr SA, Paulovich AG:基于肽亲和质谱的大规模定量蛋白质组学分析发展评价。蛋白质组学杂志,2011,10:M110 005645。
Whiteaker JR, Zhao L, Anderson L, Paulovich AG:一种基于高通量肽免疫亲和富集和多反应监测质谱的蛋白质生物标志物定量方法。蛋白质组学学报,2010,9:184-196。
Kamiie J, Ohtsuki S, Iwase R, Ohmine K, Katsukura Y, Yanai K, Sekine Y, Uchida Y, Ito S, Terasaki T:膜转运蛋白定量图谱:高灵敏度同时LC/MS/MS方法结合新的硅内肽选择标准的开发和应用。医药学报,2008,25:1469-1483。
Scherl A, Shaffer SA, Taylor GK, Kulasekara HD, Miller SI, Goodlett DR:改进蛋白质型肽的霰弹枪蛋白质组学分析的基因组特异性气相分馏策略。中国生物医学工程学报,2008,29(4):344 - 344。
Lange V, Picotti P, Domon B, Aebersold R:定量蛋白质组学的选择反应监测:教程。中国生物医学工程学报,2008,4:422。
Unwin RD, Griffiths JR, Leverentz MK, Grallert A, Hagan IM, Whetton AD:多重反应监测以高灵敏度识别蛋白质磷酸化位点。细胞蛋白质组学研究,2005,4:344 - 344。
Griffiths JR, Unwin RD, Evans CA, Leech SH, Corfe BM, Whetton AD:假设驱动策略在乙酰化赖氨酸残基敏感检测和定位中的应用。中国生物化学学报,2007,29(3):344 - 344。
Duncan MWYA, Patterson SD:用质谱定量蛋白质:SRM的选择性只是问题的一部分。蛋白质组学,2009,9:1124-1127。
MacLean B, Tomazela DM, Shulman N, Chambers M, Finney GL, Frewen B, Kern R, Tabb DL, Liebler DC, MacCoss MJ: Skyline:用于创建和分析靶向蛋白质组学实验的开源文档编辑器。生物信息学,2010,26:966-968。
Martin DB, Holzman T, May D, Peterson A, Eastham A, Eng J, McIntosh M: MRMer,用于多反应监测实验数据提取和可视化的交互式开源和跨平台系统。蛋白质组学学报,2008,27(3):344 - 344。
Sherwood CA, Eastham A, Lee LW, Risler J, Mirzaei H, Falkner JA, Martin DB:通过前驱体和产物m/z目标的细微改变快速优化MRM-MS仪器参数。中国生物医学工程学报,2009,29(4):457 - 457。
Abbatiello SE, Mani DR, Keshishian H, Carr SA:多反应监测质谱自动检测肽定量中的不准确和不精确过渡。中国生物医学工程学报,2010,29(4):344 - 344。
Whiteaker JR, Lin C, Kennedy J, Hou L, Trute M, Sokal I, Yan P, Schoenherr RM, Zhao L, Voytovich UJ, Kelly-Spratt KS, Krasnoselsky A, Gafken PR, Hogan JM, Jones LA, Wang P, Amon L, Chodosh LA, Nelson PS, McIntosh MW, Kemp CJ, Paulovich AG:一种基于靶向蛋白质组学的血浆生物标志物验证管道。生物技术学报,2011,29:625-634。
Yoneyama T, Ohtsuki S, Ono M, Ohmine K, Uchida Y, Yamada T, Tachikawa M, Terasaki T:基于定量靶向绝对蛋白质组学的血浆脯氨酸羟化α -纤维蛋白原大规模定量诊断胰腺癌。中国生物医学工程学报,2013,29(3):344 - 344。
Baker M:生物储存库:建立更好的生物库。自然科学进展,2012,27(3):344 - 344。
Marko-Varga G, Omenn GS, Paik YK, Hancock WS:完成人类蛋白质组全基因组特征的第一步。中国生物医学工程学报,2013,29(1):1-5。
Liang WS, Craig DW, Carpten J, Borad MJ, Demeure MJ, Weiss GJ, Izatt T, Sinari S, Christoforides A, Aldrich J, Kurdoglu A, Barrett M, Phillips L, Benson H, Tembe W, Braggio E, Kiefer JA, Legendre C, Posner R, Hostetter GH, Baker A, Egan JB, Han H, Lake D, Stites EC, Ramanathan RK, Fonseca R, Stewart AK, Von Hoff D:使用下一代测序对胰腺腺癌患者进行全基因组表征。公共科学学报,2012,7:e43192。
Fagerberg L, Oksvold P, Skogs M, Algenas C, Lundberg E, Ponten F, Sivertsson A, Odeberg J, Klevebring D, Kampf C, Asplund A, Sjöstedt E, Al-Khalili Szigyarto C, Edqvist PH, Olsson I, Rydberg U, Hudson P, Ottosson Takanen J, Berling H, Björling L, Tegel H, Rockberg J, Nilsson P, Navani S, Jirström K, Mulder J, Schwenk JM, Zwahlen M, Hober S, Forsberg M:基于抗体的蛋白质分析对人类染色体中心蛋白质组计划(C- hpp)的贡献。中国生物医学工程学报,2013,29(3):344 - 344。
Lane L, Argoud-Puy G, brita, Cusin I, Duek PD, Evalet O, Gateau A, Gaudet P, gleize A, Masselot A, Zwahlen C, Bairoch A: neXtProt:人类蛋白质知识平台。中国生物医学工程学报,2012,40:D76-D83。
Harsha HC, Jimeno A, Molina H, Mihalas AB, Goggins MG, Hruban RH, Schulick RD, Kamath U, Maitra A, Hidalgo M, Pandey A:活化表皮生长因子受体作为胰腺癌治疗的新靶点。中国生物医学工程学报,2008,27(4):344 - 344。
Ritchie SA, Akita H, Takemasa I, Eguchi H, Pastural E, Nagano H, Monden M, Doki Y, Mori M, Jin W, Sajobi TT, Jayasinghe D, Chitou B, Yamazaki Y, White T, Goodenowe DB:胰腺癌患者血清代谢系统改变:早期发现的潜力。癌症杂志,2013,13:416。
Krastins B, Prakash A, Sarracino DA, Nedelkov D, Niederkofler EE, Kiernan UA, Nelson R, Vogelsang MS, Vadali G, Garces A, Sutton JN, Peterman S, Byram G, Darbouret B, Pérusse JR, Seidah NG, Coulombe B, Gobom J, Portelius E, Pannee J, Blennow K, Kulasingam V, Couchman L, Moniz C, Lopez MF:快速发展灵敏,高通量,定量和高选择性的质谱靶向免疫测定人类血浆和血清中临床重要蛋白。中国生物化学杂志,2013,46:399-410。
Addona TA, Abbatiello SE, Schilling B, Skates SJ, Mani DR, Bunk DM, Spiegelman CH, Zimmerman LJ, Ham A- jl, Keshishian H, Hall SC, Allen S, Blackman RK, Borchers CH, Buck C, Cardasis HL, Cusack MP, Dodder NG, Gibson BW, Held JM, Hiltke T, Jackson A, Johansen EB, Kinsinger CR, Li J, Mesri M, Neubert TA, Niles RK, Pulsipher TC, Ransohoff D:血浆中蛋白质多反应监测测量精度和可重复性的多点评估。生物技术学报,2009,27:633-641。
Paik YK, Hancock WS:将ENCODE与全基因组蛋白质组学结合起来。生物技术学报,2012,30:1065-1067。
Lichti CF, Liu H, Shavkunov AS, Mostovenko E, Sulman EP, Ezhilarasan R, Wang Q, Kroes RA, Moskal JC, Fenyo D, Oksuz BA, Conrad CA, Lang FF, Berven FS, Végvári A, Rezeli M, Marko-Varga G, Hober S, Nilsson CL:来自胶质瘤癌干细胞系的整合染色体19转录组和蛋白质组数据集。中国生物医学工程学报,2014,29(3):344 - 344。
确认
这项工作得到了瑞典药物科学院、C-HPP (HUPO)、瑞典研究委员会、瑞典战略研究基金会(SSF, TOTAL AMI)、Vinnova、Ingabritt & Arne Lundbergs forskningsstiftelse和Crafoord基金会的资助。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
DA和LA进行了文献检索并起草了手稿。AS、CW、MR、GMV、RA对稿件进行了修改。GMV和RA构思了这项研究。所有作者审阅并批准了最终的手稿。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
安萨里,D.,阿伦森,L.,沙索,A.。et al。定量质谱在胰腺癌生物标志物转化科学发现中的作用。翻译医学杂志12, 87(2014)。https://doi.org/10.1186/1479-5876-12-87
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1479-5876-12-87
关键字
- 生物标志物
- 质谱分析
- 诊断
- 胰腺癌
- 蛋白质组学