摘要
背景
本研究旨在通过分析国民健康保险研究资料库,提供14年全国流行病学资料,评估台湾地区APS发生率及共病情况。
方法
分析了2000-2013年期间新诊断为APS的19163名患者和76652名对照组(年龄和性别分布相似)。
结果
2000-2013年,APS在台湾人口中的发病率从4.87 / 10000人-年增加到6.49 / 10000人-年。APS的发病率在20岁以后随着年龄的增长而增加,尤其是女性人群,在60岁以后发病率迅速上升。此外,APS队列中糖尿病、高血压、高脂血症、中风、心力衰竭、心房颤动、心肌梗死、pad、慢性肾脏疾病、COPD、深静脉血栓形成、肺栓塞、SLE、类风湿关节炎、干燥综合征和多发性肌炎的比例更高。
结论
我们的研究表明台湾人群中APS发病率呈上升趋势,APS与潜在合并症之间存在关系。这项大型的全国性研究发现,APS风险在很大程度上受性别和年龄的影响。因此,在探索潜在的因果机制时,独特的性别和年龄模式可能是建设性的。此外,我们的研究结果表明,临床医生应该提高对APS发生概率的认识,特别是在某些年龄组中出现APS症状的女性。
简介
抗磷脂综合征(APS)是一种与抗磷脂抗体(apl)相关的自身免疫性疾病,如抗心磷脂抗体、抗β2-糖蛋白1抗体和狼疮抗凝剂。APS的诊断是基于临床特征的结合,包括动脉静脉或小血管血栓形成和/或产科并发症,如复发性流产,以及循环apl的检测[1].然而,APS的病理生理机制在很大程度上仍然未知。目前已经提出了几种机制,包括apl与β2-糖蛋白1受体结合、内皮细胞功能障碍、上皮一氧化氮系统(eNOS)低活性以及补体激活和处置。APS最终导致产科或血栓并发症[2].
由于APS是一种罕见疾病,因此需要来自不同种族或不同共病人群的高质量流行病学数据。最近,一项涉及144,248名参与者的基于人群的研究报告称,在16年的研究期间,记录了33例事件,APS的年发病率和估计患病率约为10人中2人5人年和50 / 105人,分别[3.].另一项基于韩国健康保险审查机构数据库的研究显示,2009年至2016年期间,共有3088例新诊断的事故病例(男性1215例,女性1873例),该数据库包含5200多万韩国人的数据。发病率为0.75 / 1052016年患病率为6.19 / 105个人(4].
本研究旨在提供10年全国流行病学数据,评估APS的发生率和合并症的情况,这也影响血栓形成的风险。
方法
数据源
台湾的国民健康保险(NHI)计划开始于1995年,覆盖了台湾2300万人口中的约99% [5,6,7,8].本研究使用来自国民健康保险研究资料库的住院资料,其中包含1996年至2013年台湾所有住院病人的保险理赔。该数据库包括住院治疗的全面信息,并为研究人员提供与相关索赔信息相关的加密个人数据,包括人口统计数据、疾病诊断和治疗。疾病的诊断是基于国际疾病分类,第九版,临床修订(ICD-9-CM)代码[9].
APS和非APS队列的定义
本研究选取2000年1月1日至2013年12月31日诊断为APS的所有患者,以计算台湾地区APS的发病率。所有根据2006年修订的抗磷脂综合征分类标准诊断为APS的患者[1].ICD-9-CM编码286.53、289.8、287.3、795.7和649.3归为病例组。以最初诊断为APS的日期为指标日期。对于每个APS患者,从同一数据库中随机选择4个无APS的队列,并根据年龄、性别和索引年份以1:4的比例进行频率匹配。没有APS的(对照)参与者的指数年份是随机分配的。
潜在并发症
研究人群中与aps相关的共病包括糖尿病[10] (ICD-9-CM 250),高血压[11,12,13] (ICD-9-CM 401-405)、高脂血症[14] (ICD-9-CM 272),中风[10](ICD-9-CM 430-438),心力衰竭[15(ICD-9-CM 428),房颤[16[ICD-9-CM 427.32],心肌梗死[17[ICD-9-CM 410-410.9, 412],外周动脉闭塞性疾病[10) (PAOD;ICD-9-CM 440-444)、慢性肾脏疾病[13] (ICD-9-CM 580-589)、慢性阻塞性肺病[18)(慢性阻塞性肺病;ICD-9-CM 490-496)、深静脉血栓[10] (ICD-9-CM 451.1, 451.2, 451.8, and 453),肺栓塞[10] (ICD-9-CM 415.1),系统性红斑狼疮[10)(系统性红斑狼疮;ICD-9-CM 710.0)、类风湿性关节炎[19] (ICD-9-CM 714)、系统性硬化症[20.] (ICD-9-CM 710.1)、干燥综合征[21] (ICD-9-CM 710.2),以及多发性肌炎[22] (icd-9-cm 710.4)。
统计分析
我们计算了2000-2013年期间的年发病率和年龄特异性发病率。年发病率定义为APS患者人数除以每年参加国家健康倡议计划的总人年(每10,000人年)[23].APS的年龄特异性发病率通过除以每个年龄组的总人年(每10,000人年)(10年间隔)来计算。研究人群的年龄定义为他们在随访期中期的年龄。我们进一步按性别亚组对发病率进行分层。采用泊松回归分析各指标年份及各年龄组的发病趋势。有APS和没有APS的参与者的描述性统计被总结为连续变量的均值和标准差;数据以分类变量的案例和百分比形式呈现。使用卡方检验检查有无APS患者的年龄、性别和共病的差异;年龄分布采用独立样本t检验进行分析。所有统计分析均使用SAS包(版本9.4; SAS Institute Inc., Cary, NC, United States). The incidence curve was generated using R software (R Foundation for Statistical Computing, Vienna, Austria). A two-tailedp-value小于0.05为有统计学意义。
声明
根据先前建立的研究设计,我们使用LHID的数据进行了本研究。目前的研究是分析去识别和加密二级数据;因此,不需要知情同意。本研究由中国医科大学机构审查委员会(CMUH-104-REC2-115 (CR-6))、民生总医院(NO:2022001)和麦凯纪念医院(16MMHIS074)批准。我们确认本研究的所有方法都是按照相关指南和规定进行的。
结果
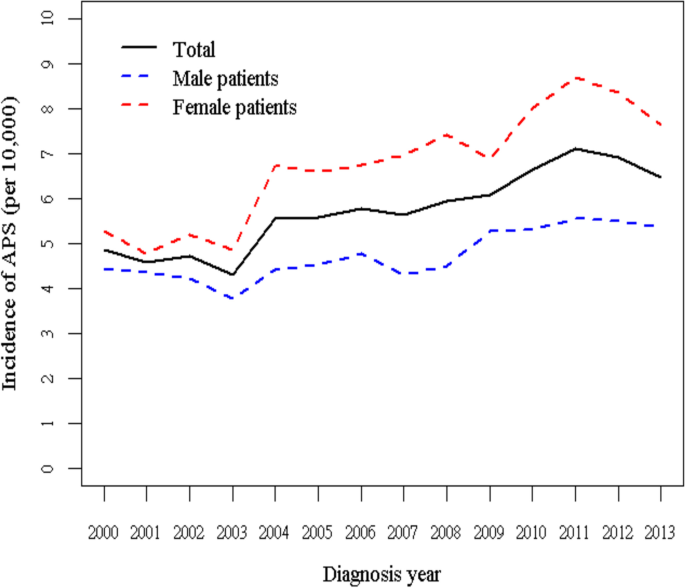
表格1和无花果。1分别显示2000-2013年期间男性和女性参与者的APS年发病率。研究人群包括19,163例新诊断为APS的患者,其中7926例(41.36%)为男性患者,11,237例(58.64%)为女性患者2).2000-2013年期间,APS在总人口中的发病率从每万人年4.87例增加到6.49例。在性别亚群方面,男性人群的发病率从每1万人年4.44增加到5.36,女性人群的发病率从每1万人年5.27增加到7.62。总体而言,女性的年度APS发病率高于男性。
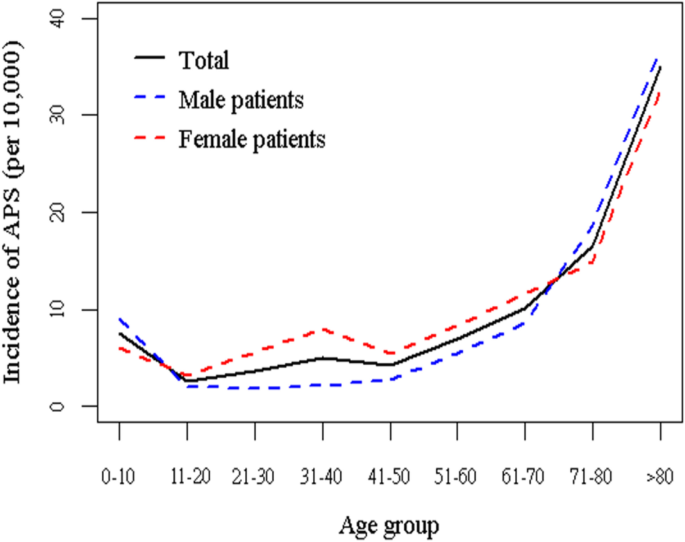
不同年龄的APS发病率见表3.和无花果。2.与0-10岁年龄组相比,11-20岁年龄组的病例显著减少,从0-10岁年龄组的7.52例/ 10,000人年下降到11-20岁年龄组的2.67例/ 10,000人年。20岁以后,无论男性还是女性,APS的发病率都随着年龄的增长而增加,60岁以后迅速上升。女性人群中11-80年龄段的APS发病率较高,而男性人群中0-10和> - 80年龄段的APS发病率较高。
泊松回归模型结果显示,年龄、性别、发病年份与APS发病率显著相关(p< 0.0001)。这表明,APS的年发病率随着年龄的增加而显著增加,并且主要发生在女性人群中。
表格4详细描述了有和没有APS的参与者的年龄、性别和共病特征。在频率匹配后,分析了19,163例APS患者和76,652例对照组(年龄和性别分布相似)。APS患者和非APS患者的平均年龄分别为43.02±26.45岁和42.71±26.21岁(p= 0.49)。因此,超过40%的病例年龄在40岁以上。与无APS的参与者相比,更多的APS患者还存在心血管危险因素(糖尿病、高血压、高血脂、中风、心力衰竭、心房颤动和心肌梗死)、自身免疫性疾病(SLE、类风湿关节炎、干燥综合征和多发性肌炎)、慢性肾脏疾病和COPD。APS组以PAOD、深静脉血栓形成、肺栓塞、(p< 0.001)。
讨论
这是迄今为止最广泛的APS发病率研究,包括19,163名APS患者,并使用了基于全国人口的登记数据。据我们所知,这也是第一个调查APS在人群中按性别和年龄分布的研究。由于研究人群较少,大多数流行病学研究没有报告年龄分布,或者只宣布了女性和男性的年龄分布。我们的研究发现,女性人群的APS年发病率高于男性人群。一项研究报告的男女比例为5:1至2:1 [24].此外,在我们的研究中观察到台湾人群的APS发病率呈上升趋势。环境因素影响自身免疫性疾病的发病。然而,早前的一项研究表明,感染和药物暴露与APS相关[25].性病研究实验室测试,包括使用纯化的心磷脂-卵磷脂-胆固醇抗原来检测抗心磷脂抗体,是一种梅毒筛查测试;它还可以积极识别自身免疫性疾病,如APS和SLE [26].接触各种细菌和病毒,包括肺炎支原体,化脓性链球菌,幽门螺杆菌, eb病毒和巨细胞病毒,与apl患病率增加有关[25].一些药物参与自身免疫,包括那些产生药物性狼疮和药物性自身免疫性肝炎的药物。具体来说,某些药物,如普鲁卡因酰胺、氯噻嗪、吩噻嗪、奎宁和口服避孕药,与apl水平升高有关[27].未来的研究需要确定APS和环境因素之间的相关性。
APS的特征是血管血栓和与持续升高的apl相关的妊娠相关发病率[1],它们是识别多种磷脂结合血浆蛋白β -糖蛋白I、凝血酶原和膜联蛋白A5的自身抗体。apl致血栓形成的主要发病机制包括刺激外源性凝血途径、血小板聚集、补体激活和抑制tPA、蛋白C和蛋白S [28].据报道,氧化应激会影响β a2-糖蛋白I的结构和功能,β a2-糖蛋白I是一种由五个结构域组成的补体控制蛋白[29].有两种形式的β -糖蛋白I -无硫醇形式(在半胱氨酸(Cys) 32和Cys 60结构域含有断裂的二硫键,在V结构域含有Cys 288和Cys 326)和氧化形式(在这些位置含有二硫键)[30.].在APS患者中,氧化形式的水平明显更高。较低水平的游离硫醇形式会导致缺乏对抗氧化应激的缓冲器[31].外源性氧化应激伴血管内皮损伤可刺激血小板聚集和血管性血友病因子表达[32].与β a2-糖蛋白I结构域I中特定表位结合的抗体已被证明可增加血栓形成的风险[33].此外,β a2-糖蛋白I免疫复合物可诱导浆细胞样树突状细胞和单核细胞中toll样受体7 (TLR7)的上调激活,释放促炎细胞因子,并为进一步产生自身抗体创建正反馈循环[34) . .了解这些病理生理学有助于了解APS的管理。利妥昔单抗是一种靶向CD20的嵌合单克隆抗体,可抑制参与apl诱导的APS临床表现的B细胞[35].据报道,羟氯喹可降低apl激活血小板膜上GPIIbIIIa的过表达,并抑制血小板聚集[36].在妊娠相关的发病率中,20%的APS女性患者在妊娠的任何阶段经历复发性妊娠丢失,包括流产、胎儿丢失和死产[37].aPL与单核细胞、内皮细胞、血小板和凝血级联的血浆成分结合诱导血栓形成,导致APS胎儿死亡。抗-β2GPI自身抗体对胎盘的直接作用包括导致滋养层损伤的炎症反应,与培养的细胞滋养层细胞结合导致滋养层膜扰动,以及减少人绒毛膜促性腺激素的分泌[38,39].
我们的研究发现,APS患者有更多的合并症,如高血压、高脂血症、心力衰竭、心房颤动和慢性肾病。据我们所知,一项研究表明,高血压患者的内皮细胞和β2GPI (β -2-糖蛋白I)抗体IgG水平高于对照组。此外,胰岛素水平升高、胰岛素样生长因子结合蛋白-1和更强的胰岛素抵抗与抗β 2gp1水平相关。这些发现与我们的结果相关,并为APS和代谢变量之间的联系提供了证据[40].脂肪细胞因子是脂肪组织产生的一种产物,被认为有助于轻度炎症和多种疾病,如代谢综合征、动脉粥样硬化和2型糖尿病[41].据报道,原发性APS并发代谢综合征患者因现有内皮细胞功能障碍恶化而有更大的动脉事件风险[42].
自APS的最初描述被开发以来,高血压一直被认为是与该疾病相关的常见症状之一。Hughes发现,网状活蝇和血压升高之间的联系有助于肾血管病因学;研究人群包括患有不同程度高血压的APS患者,从轻度升高到恶性。11,12].肾受累是APS患者血压升高的病因之一[13].一项研究表明,在有肾脏表现的APS患者中进行了广泛的肾活检。血管肾病如小血管闭塞病变,动脉和小动脉血栓再通,局灶性皮质萎缩。此外,93%的参与者患有全身性高血压;鉴于APS肾病(APSN)中高血压的高患病率,血压升高被认为是肾脏状况的一个关键标志[43].一项研究表明,抗凝血酶原抗体与高血压有关,通过对严重原发性高血压患者组与匹配的健康对照组进行比较;结果显示,患者组中8%的参与者具有抗凝血酶原抗体,而健康对照组中没有[44].Shajit Sadanand等人提到了血脂和apl之间的关系。研究人群中最常见的血脂异常病例是TG水平> 150 mg/dL(51.9%),而LDL > 150 mg/dL(40.2%)排在第二位。据统计,抗β 2g IgG水平与HDL、LDL水平、aCL IgM水平与LDL之间存在显著相关性[14].早在1993年,抗氧化ldl和心磷脂的抗体就与SLE患者的血栓形成和动脉粥样硬化并发症有关[45].这些抗体干扰血小板、内皮细胞和凝血因子之间的调节,扰乱凝血和纤溶的平衡[46,47].一项研究表明,狼疮抗凝剂抗-β2GP1检测可用于早期发现APS和e血栓栓塞事件[48].
我们的研究人群主要由居住在台湾的东亚人组成。我们证实APS与其他自身免疫性疾病密切相关,这一发现与西方国家开展的研究一致。在一项此类队列研究中,高达36%的APS患者被观察到有SLE病史[10].与诊断为原发性APS的患者相比,具有APS和SLE病史的患者出现关节痛和关节炎、白细胞减少、自身免疫性溶血性贫血、网状纤维化、癫痫和心肌梗死的发生率增加[17].此外,这些患者表现出较高的高血压、血脂异常、糖尿病和严重狼疮的发病率,并累及主要器官和较高的死亡率[10,49].他们的病情需要长期抗凝治疗和免疫抑制治疗,包括大剂量皮质类固醇、环磷酰胺和硫唑嘌呤[50].
这项研究的优势在于它使用了一个数据库,其中包含了生活在台湾的2300万人口中约99%的全国人口数据。该数据库用于流行病学调查的可靠性和有效性已在以前报道过[51].使用ICD-10定义的APS并不常见,而不是更标准的ICD-9-CM定义。然而,我们建议未来的研究寻求获得医疗记录和实验室数据,以调查适用于个人医疗检查的诊断标准。本研究的局限性在于NHIRD的匿名性。患者的个人信息、家族史和实验室数据无法获得。
我们目前的研究结果表明APS与非自身免疫性合并症(如高血压、高脂血症、心力衰竭、心房颤动和慢性肾脏疾病)之间的关系。
结论
总之,除了已知的疾病病理生理学外,各种与血栓相关的疾病可能会影响APS的风险。了解APS在人群中如何按性别和年龄分布有助于了解APS和并发症之间的关系。进一步研究是非自身免疫性合并症与APS之间的关系是有必要的。此外,本研究强调临床医生应密切关注aps相关并发症,特别是在此类并发症高发的患者群体中。
数据和材料的可用性
本研究的数据来自国家健康保险研究数据库(NHIRD)。有兴趣的研究人员可向台湾卫生福利部正式申请获得资料。
缩写
- APS:
-
Antiphospholipid综合症
- 杀伤人员地雷:
-
Antiphospholipid抗体
- 简介:
-
国民健康保险
- PAOD:
-
外周动脉闭塞性疾病
- 慢性阻塞性肺病:
-
慢性阻塞性肺疾病
- 系统性红斑狼疮:
-
系统性红斑狼疮
- 免疫球蛋白:
-
免疫球蛋白G
- IgM:
-
免疫球蛋白M
- APSN:
-
APS肾病
- β2 gpi:
-
Beta-2-Glycoprotein我
参考文献
Miyakis S,等。关于明确抗磷脂综合征(APS)分类标准更新的国际共识声明。中华血栓血液学杂志,2006;4(2):295-306。
Oliveira DC, Correia A, Oliveira C.抗磷脂抗体综合征的问题。中华临床医学杂志,2020;12(5):286-92。
Duarte-Garcia A等人。抗磷脂综合征的流行病学:基于人群的研究。风湿性关节炎。2019;71(9):1545-52。
黄俊杰,等。韩国抗磷脂综合征的流行病学:一项基于全国人群的研究。中华医学杂志2020;35(5):e35。
蔡雪云,等。烧伤后患慢性疲劳综合征的风险增加。中华医学杂志,2018;16(1):342。
蔡雪云,等。炎症性肠病患者慢性疲劳综合征风险增加:一项基于人群的回顾性队列研究中华医学杂志2019;17(1):55。
郭CF,等。消化性溃疡如何可能导致慢性疲劳综合征的终身衰弱影响:一种见解。科学通报2021;11(1):7520。
石磊,等。溶血性贫血导致骨质疏松的风险——什么会加重骨质流失?中华临床医学杂志,2021;10(15):3364。
姚卫文,等。缺铁性贫血患者纤维肌痛的风险:一项全国人群为基础的队列研究科学通报2021;11(1):10496。
Cervera R,等。抗磷脂综合征:1000例患者的临床和免疫表现及疾病表达模式风湿性关节炎。2002;46(4):1019-27。
休斯,普罗瑟-怀特演说1983。结缔组织疾病和皮肤中华临床医学杂志,1984;9(6):535 - 544。
休斯GR,哈里斯NN,加拉维AE。抗心磷脂综合征。中华风湿病杂志,1986;13(3):486-9。
Turrent-Carriles A, Herrera-Felix JP, Amigo MC.抗磷脂综合征的肾脏受累。前沿免疫,2018;9:1008。
Sadanand S,等。喀拉拉邦北部APS患者血脂异常及其与抗磷脂抗体的关系。中华风湿病杂志。2016;3(4):161-4。
Pastori D,等。抗磷脂抗体和心脏衰竭与保留射血分数。多中心动脉粥样硬化- aps研究。中华临床医学杂志,2021;10(14):3180。
Booth S,等。抗磷脂综合征和直接口服抗凝剂的挑战。Br J Hosp Med(伦敦)。2020年,81(5):1 - 11。
庞斯-埃斯特尔GJ,等。系统性红斑狼疮患者的抗磷脂综合征。《中国日报》,2017;76:10-20。
Tanaseanu C,等。血管内皮生长因子、脂蛋白相关磷脂酶A2、sp -选择素和抗磷脂抗体,在慢性阻塞性肺疾病和系统性红斑狼疮相关肺动脉高压中具有预后价值的生物标志物。欧洲医学杂志,2007;12(4):145-51。
欧立克,梅里尔,JT。抗磷脂抗体在类风湿关节炎中的患病率及临床意义。中国风湿病杂志2006;8(2):100-8。
查特吉S,鲍林JD。在系统性硬化症和相关疾病中导致指位缺血和罕见器官并发症的抗磷脂综合征。临床风湿病杂志。2021;40(6):2457-65。
Fauchais AL,等。原发性干燥综合征的抗磷脂抗体:74例患者的患病率和临床意义狼疮。2004;13(4):245 - 8。
Sherer Y,等。与抗磷脂综合征相关的皮肌炎和多发性肌炎——一种新的重叠综合征。狼疮。2000;9(1):42-6。
蔡雪云,等。银屑病后慢性疲劳综合征风险增加:一项全国性人群队列研究中华医学杂志2019;17(1):154。
Vianna JL,等。原发性和继发性抗磷脂综合征的比较:欧洲114例患者的多中心研究中华医学杂志,1994;19(1):1 - 9。
Levy Y等人。环境与抗磷脂综合征。狼疮。2006;(11):784 - 90。
哈里斯EN,等。抗心磷脂抗体:放射免疫法检测与系统性红斑狼疮血栓形成的关系。《柳叶刀》杂志。1983;2(8361):1211 - 4。
Cervera R, Asherson RA。抗磷脂综合征的临床和流行病学研究。免疫生物学。2003;第5 - 11(1):207。
Mehdi AA, Uthman I, khaashta M.抗磷脂综合征:发病机制和未来治疗机会的窗口。中国科学(d辑),2010;
施瓦岑巴赫R等。人β 2-糖蛋白I的晶体结构:磷脂结合和抗磷脂综合征的意义。中国科学d辑。1999;18(22):6228-39。
Ioannou Y,等。基于主要自身抗原β -糖蛋白分子氧化修饰检测抗磷脂综合征血栓形成致病性的新方法。风湿性关节炎杂志,2011;63(9):2774-82。
Ioannou Y,等。体内β 2-糖蛋白I中自然存在的游离硫醇:亚硝基化,内皮细胞的氧化还原修饰,以及氧化应激诱导的细胞损伤的调节。116血。2010;(11):1961 - 70。
Giannakopoulos B, Krilis SA。抗磷脂综合征的发病机制。中华实用医学杂志,2013;29(4):344 - 344。
de Laat B,等。识别β 2-糖蛋白I结构域的表位Gly40-Arg43的IgG抗体导致LAC,它们的存在与血栓形成密切相关。血。2005;105(4):1540 - 5。
刘cm,等。rna相关的自身抗原通过B细胞抗原受体/toll样受体7结合激活B细胞。中华检验医学杂志,2005;26(3):342 - 344。
杨晓明,杨晓明。抗磷脂综合征与B细胞诱导的自身免疫性疾病的关系。血栓研究,2004;14(5):363-9。
Espinola RG,等。羟氯喹逆转由人IgG抗磷脂抗体诱导的血小板活化。中华血液病杂志,2002;37(3):518-22。
De Carolis S,等。抗磷脂综合征:妊娠结局危险因素的最新进展。科学通报,2018;17(10):956-66。
Meroni PL,等。抗磷脂综合征的发病机制:了解抗体。中华风湿病杂志,2011;7(6):330-9。
Ruiz-Irastorza G等。Antiphospholipid综合症。柳叶刀》。2010;376(9751):1498 - 509。
Frostegard J,等。边缘性高血压患者的内皮细胞抗体。循环。1998;98(11):1092 - 8。
Rodrigues CE,等人。原发性抗磷脂综合征中的脂肪细胞因子:低度炎症、胰岛素抵抗和代谢综合征的潜在标志物。临床经验风湿病杂志,2012;30(6):871-8。
Rodrigues CE,等人。动脉事件与代谢综合征和原发性抗磷脂综合征共存的关系。关节炎护理Res(霍博肯)。2012, 64(10): 1576 - 83。
Nochy D,等人。原发性抗磷脂综合征相关的肾内血管病变。中国生物医学杂志,1999;10(3):507-18。
Rollino C,等。抗磷脂抗体和高血压。狼疮。2004;13(10):769 - 72。
Vaarala O,等。系统性红斑狼疮中氧化低密度脂蛋白抗体与心磷脂抗体的交叉反应。柳叶刀》。1993;341(8850):923 - 5。
Mackworth-Young CG。抗磷脂综合征:多种机制。中国临床免疫学杂志,2004;36(3):393-401。
Espinosa G,等。抗磷脂综合征:发病机制。自动化学报,2003;2(2):86-93。
β -糖蛋白i依赖性狼疮抗凝剂与抗磷脂综合征血栓形成高度相关血。2004;104(12):3598 - 602。
Riancho-Zarrabeitia L,等。系统性红斑狼疮(SLE)患者的抗磷脂综合征(APS)意味着更严重的疾病,更大的损害和更高的死亡率。狼疮。2020;29(12):1556 - 65。
Deak M,等。系统性红斑狼疮与抗磷脂综合征相关的非血栓栓塞风险。狼疮。2014;23(9):913 - 8。
谢春英,等。台湾国民健康保险研究资料库:过去与未来。临床流行病学,2019;11:349-58。
致谢
我们要向白少宇博士的物质支持和对本项目的资助机构表示感谢。
资金
本研究由台湾卫生福利部临床试验中心(mohw109 - tdub -212-114004), MOST中风临床试验联盟(MOST 109-2321-B-039-002),中国医科大学医院(DMR-109-231),台湾台中市曾连林基金会,麦凯医学院(1082A03)和麦凯纪念医院医学研究部(MMH-107-135;MMH-109-103)和民生医院(2019002;2020001;2021003;2022007)。APC由麦凯纪念医院医学研究部和通讯作者蔡信义博士资助。
作者信息
作者及隶属关系
贡献
概念化:蔡信义;研究方法:姚伟成,赵璐婷,吴丽芝,蔡信义;软件:Lu-Ting Chiu;验证:Lu-Ting Chiu和Shin-Yi Tsai;形式分析:赵璐婷蔡信义;调查:姚伟成、梁锦亨、赵璐婷、郭建锋、蔡信义;资料来源:赵璐婷、蔡信义;数据策划:Lu-Ting Chiu;写作-初稿准备:所有作者;撰文及编辑:姚伟成、梁锦亨、郭建锋、蔡信义; Visualization: Lu-Ting Chiu and Shin-Yi Tsai; Supervision: Shin-Yi Tsai; Project administration: Shin-Yi Tsai; Funding acquisition: Wei-Cheng Yao, Lu-Ting Chiu and Shin-Yi Tsai; Submission: Kam-Hang Leong and Shin-Yi Tsai. The authors read and approved the final manuscript.
相应的作者
道德声明
伦理批准并同意参与
本研究由中国医科大学附属医院研究伦理委员会(CMUH104-REC2-115(CR-6))、民生总医院制度审查委员会(NO:2022001)和麦凯纪念医院制度审查委员会(16MMHIS074)批准。
发表同意书
作者同意本文的发表。
相互竞争的利益
作者声明,这篇论文的发表不存在利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
姚明,WC。,Leong, KH., Chiu, LT.et al。抗磷脂综合征发病率和血栓相关共病的趋势:一项14年全国人群基础研究血栓形成J20., 50(2022)。https://doi.org/10.1186/s12959-022-00409-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12959-022-00409-8
关键字
- Antiphospholipid综合症
- 流行病学
- 发病率
- 国家健康计划
- 基于全国人口的研究