摘要
简介
曲妥珠单抗作为HER2阳性BC治疗的金标准,是一线HER2靶向药物。然而,一些研究报告称,与标准曲妥珠单抗治疗相比,拉帕替尼和拉帕替尼联合曲妥珠单抗治疗患者受益更多。本研究对拉帕替尼和拉帕替尼加曲妥珠单抗治疗与曲妥珠单抗治疗的系统综述和荟萃分析进行了更新。
目的
我们确定在her2阳性乳腺癌患者中曲妥珠单抗加拉帕替尼或拉帕替尼治疗是否不如曲妥珠单抗治疗。
方法
相关试验在中国知网(CNKI)、万方(Wanfang)、维普(VIP)、Sinomed、PubMed、Embase和Cochrane CENTRAL数据库中检索,检索时间从开始到2021年10月25日。主要转归为OS、DFS/EFS和PFS,次要转归为pCR (ypT0/is ypN0)、pCR (ypT0/is ypN0/+)、ORR、DCR、BCS、RFS、心脏毒性和其他毒性。
结果
本研究包括13项随机对照试验。曲妥珠单抗联合拉帕替尼治疗在总生存期、无病生存期/无事件生存期、病理完全缓解期(ypT0/为ypN0)、病理完全缓解期(ypT0/为ypN0/+)、无复发生存期、更高的腹泻发生率和皮疹/皮肤毒性方面优于单曲妥珠单抗标准治疗。拉帕替尼治疗在总生存期、无进展生存期、无病生存期/无事件生存期、病理完全缓解期(ypT0/is ypN0)和病理完全缓解期(ypT0/is ypN0/+)、腹泻和皮疹/皮肤毒性方面均低于曲妥珠单抗治疗,且左室射血分数下降的发生率较低。
结论
曲妥珠单抗联合拉帕替尼治疗的疗效优于标准曲妥珠单抗单独治疗;然而,它有更多的非心脏III/IV级毒性。此外,拉帕替尼治疗的疗效不如单独的标准曲妥珠单抗治疗。
简介
在全球范围内,乳腺癌(BC)是最常见的癌症,也是妇女肿瘤相关死亡的主要原因。它约占女性癌症发病率的30%,占所有癌症死亡的15% [1,2,3.].卑诗病的发病率和死亡率持续上升,每年分别增长约0.5%和0.7 / 10万[3.,4].此外,BC作为一种异质性疾病,按基因表达划分有四种主要的分子亚型[5].其中,人表皮生长因子受体2−(HER2−)过表达的BC约发生在20-30%的BC中,并与预后不良有关[6].
HER2全长185 ku,具有酪氨酸激酶活性的跨膜糖蛋白,由17q21染色体原癌基因编码,由1255个氨基酸组成[7].HER2基因的扩增是影响乳腺癌生长和转移的重要因素之一。HER2基因激活后,可通过抑制肿瘤细胞凋亡、促进肿瘤细胞增殖、增强肿瘤细胞侵袭性、促进血管生成和淋巴管生成等方式刺激肿瘤细胞[8].因此,HER2是临床监测乳腺癌治疗的独立而有力的预后指标,也是肿瘤靶向药物选择的重要靶点。HER2过表达乳腺癌患者的特点是疾病进展快,化疗缓解期短,内分泌治疗效果差,无病生存期(DFS)低,总生存期(OS)低[9].因此,近期针对HER2的靶向治疗已成为乳腺癌靶向治疗的重点[10].
曲妥珠单抗(T)作为HER2阳性BC治疗的金标准,是美国食品和药物管理局(FDA)批准的一线HER2靶向药物,也是首个被批准用于HER2阳性BC的人源化单克隆抗体[11,12].曲妥珠单抗结合HER2的膜外亚域IV,通过多种机制发挥抗肿瘤活性,包括抑制信号转导和调节抗体依赖的细胞介导的细胞毒性。曲妥珠单抗诱导HER2受体内化和降解,吸引细胞毒性免疫细胞进入肿瘤微环境,抑制细胞生长和增殖信号通路,最终杀死肿瘤细胞[13,14].在一项涉及5102名her2阳性早期乳腺癌女性的III期HERA临床试验中,曲妥珠单抗治疗患者无病生存事件的危险比显著降低(HR=0.76) [15].虽然曲妥珠单抗改变了her2阳性乳腺癌的治疗模式,并显著改善了患者的预后,但约35%的患者存在天然耐药性,约70%的患者在最初对曲妥珠单抗治疗有反应后,在1年内进展为转移性疾病并产生耐药性[12,16].此外,曲妥珠单抗相关的心脏毒性限制了其临床应用。因此,需要额外的治疗来为这些患者提供进一步的临床益处。
拉帕替尼(L)是一种酪氨酸激酶抑制剂(TKI),通过与细胞内ATP竞争阻断HER2信号,从而阻断磷酸化和分子通路的下游变化,发挥其抗肿瘤作用[17].由于其与单克隆抗体的作用机制不同,在克服耐药方面可能具有一定的优势[18].在一项Alternative III临床研究中,接受拉帕替尼+曲妥珠单抗+芳香化酶抑制剂(AIs)治疗的患者比接受曲妥珠单抗+ AI治疗的患者表现出明显更长的中位无进展生存期(PFS)结局(11个月对5.6个月)。此外,拉帕替尼+ AI治疗的患者比曲妥珠单抗+ AI治疗的患者表现出更长的中位PFS(8.3个月vs. 5.6个月)[19].然而,在ALLTO试验中[20.],拉帕替尼的疗效不如曲妥珠单抗。曲妥珠单抗联合拉帕替尼治疗也被报道比曲妥珠单抗治疗更有效。CHER-Lob和TRIO-US B07证明曲妥珠单抗联合拉帕替尼治疗有更好的病理完全缓解(pCR)结局[21,22].然而,ALTTO显示,在无病生存(DFS)方面,曲妥珠单抗+拉帕替尼、曲妥珠单抗和拉帕替尼治疗组之间没有明显差异,联合组表现出更高的毒性[20.].在那里,尚未最终确定曲妥珠单抗加拉帕替尼或拉帕替尼治疗的疗效是否不低于曲妥珠单抗治疗。
因此,我们确定在her阳性乳腺癌中曲妥珠单抗加拉帕替尼或拉帕替尼治疗是否比曲妥珠单抗治疗无劣势。
材料与方法
研究设计
本研究按照系统评价和荟萃分析首选报告项目指南(PRISMA)进行[23并在PROSPERO注册(CRD42021285865)。
搜索策略
两名研究人员(YY和LXM)从PubMed、Embase、Cochrane图书馆、CNKI、万方和Sinomed数据库中检索了相关研究。中文搜索词是“如xianai”、“如xianzhongliu”、“ruai”、“lapatini”和“去妥妥的单康”。英文检索词见表1.
入选标准
本研究的纳入标准如下:(i)基于临床、组织学或病理诊断的her2阳性(3+免疫组织化学染色或/和荧光原位杂交(FISH)阳性)乳腺癌患者;(ii)用化疗联合曲妥珠单抗、拉帕替尼或曲妥珠单抗联合拉帕替尼或随后使用拉帕替尼治疗T、L或T + L组;(iii)主要转归为OS、DFS/无事件生存期(EFS)和PFS,次要转归为pCR (ypT0/is ypN0)、pCR (ypT0/is ypN0/+)、总缓解率(ORR)、疾病控制率(DCR)、保乳手术率(BCS)、无复发生存期(RFS)、心脏毒性和其他毒性;(iv)随机对照试验(rct)。
排除标准
排除标准如下:(i)不同组间采用不同化疗方案的研究;除其他外,会议摘要和信件;以及(iii)没有可用结果的研究。
数据提取和质量评估
两位研究者使用预定义的数据提取表提取相关信息,包括文献基本信息(试验名称、题目、作者、注册号、发表年份)、人口统计学信息(L + T组、L组、T组参与者人数、激素受体阳性和激素受体阴性参与者百分比和数量、患者肿瘤分期和诊断、纳入和排除标准)、干预特征信息(化疗和抗her - 2治疗的持续时间和剂量),方法元素(随机序列生成、分配隐藏、参与者和人员盲化、结局评估盲化、结局数据不完整、选择性报告和其他偏倚)。两名研究人员使用Cochrane协作网的偏倚风险工具评估试验质量[24].任何分歧都通过与第三位研究人员讨论来解决。
统计分析和证据质量评估
我们使用RevMan 5.3和Stata 14进行所有数据分析。分别根据抗her2方案(L + T vs T或L vs T)进行meta分析。评估了生存结局的合并风险比(HRs),包括OS、DFS/EFS、RFS和PFS,而使用逆方差或Mantel-Haenszel方法确定了二元结局的风险比(RRs),包括pCR、ORR、BCS率、心脏毒性和其他95%置信区间(ci)的毒性[24].异质性由χ2测试和我2统计数据。本研究采用固定效应模型分析所有效应量。
亚组分析采用基于以下条件的随机效应模型进行:肿瘤分期(I-III期或转移性乳腺癌(MBC)、激素受体(HR)状态或治疗类型(新辅助、辅助或姑息治疗)。采用省略法进行敏感性分析,以确定主要结果的异质性。此外,还进行了灵敏度分析,以确定是否有任何结果受到模型变化的影响。去除明显异质性研究后,采用固定效应模型分析效应量。通过Egger 's检验检测发表偏倚,并考虑发表偏倚的时间p≤0.05 [25].采用GRADE profiler 3.6从风险偏倚、不精确性、间接性、发表偏倚、不一致性五个方面对证据质量进行评估。证据质量分为高质量、中质量、低质量和极低质量。
结果
研究选择及特点
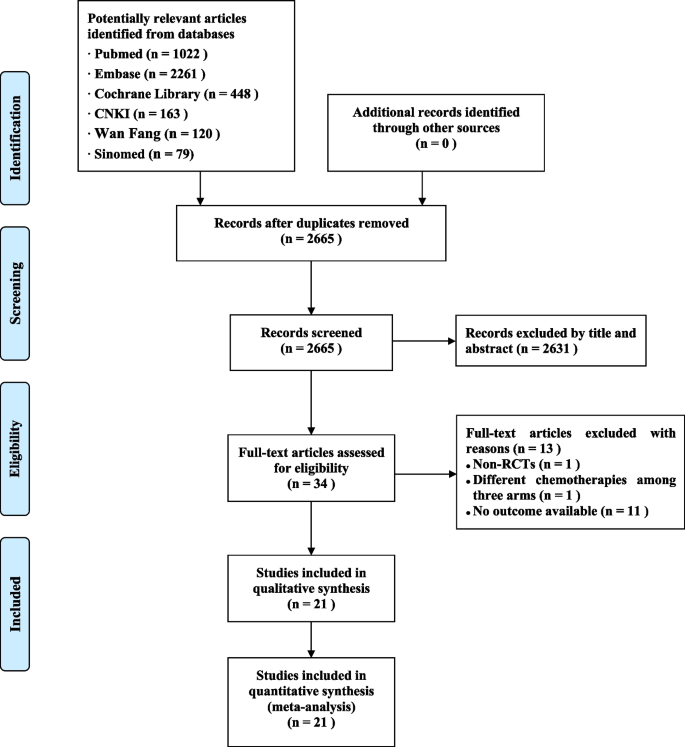
从中文及英文资料库下载的参赛作品共4093项。在删除重复记录和那些通过阅读标题、摘要和全文文章不符合条件的记录后,21项研究[21,22,23,26,27,28,29,30.,31,32,33,34,35,36,37,38,39,40,41,42,43],包括13个rct。1).
纳入的研究发表于2012年至2021年之间。总体而言,研究共纳入12024名符合条件的参与者(T+L: 4817, L: 3570, T: 3637),中位随访时间从21.5个月到9年不等。10项随机对照试验评估I-III期乳腺癌[21,22,23,26,27,28,29,30.,31,32,33,34,35,36,40,41,42,43],而3项rct评估了转移性乳腺癌[37,38,39].9项rct,其中7项rct采用双重HER2阻断[22,23,27,28,29,30.,31,32,33,34,40,42,432个rct采用单一HER2阻断[35,36,41]评估了抗her2治疗在新辅助治疗中的作用[22,23,27,28,29,30.,31,32,33,34,35,36,40,41,42,43, 1 RCT评估了辅助治疗中的双HER2阻断[21,26], 3个rct评估了姑息性环境下单一HER2阻断[37,38,39].纳入研究的特征见表2.更多细节显示在附加文件3.:表S1。
纳入研究的质量评估
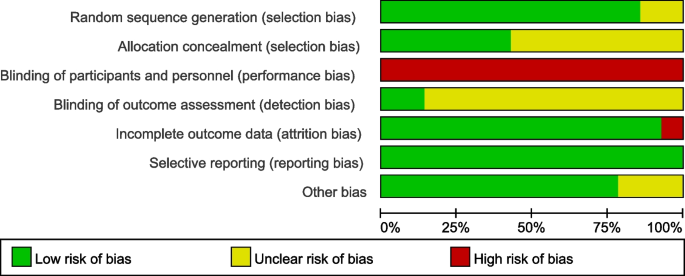
2个rct (CALGB 40601和WJOG6110B/ELTOP)没有描述随机序列生成,7个rct (ALTTO、CALGB 40601、LPT109096、NCIC CTG MA.31、TRIO-US B07、WJOG6110B/ELTOP和CEREBEL)没有详细说明分配隐藏。任何随机对照试验均未采用盲法。两项随机对照试验(NeoALTTO和GeparQuinto)采用结果评价盲法。一项RCT (LPT109096)未报告完整的结果数据,而所有RCT均无报告偏倚,2项RCT (ALTTO和CHER-Lob)的其他偏倚风险不明确。偏倚风险的具体情况见图。2而且3..
主要的结果
总生存期
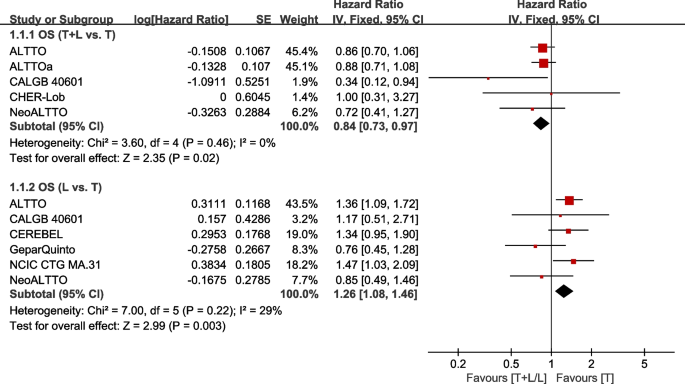
八次试验[21,22,26,29,31,35,38,39]报告了用于荟萃分析的OS数据(从随机到任何原因死亡或最后一次随访计算)。数据来自WJOG6110B/ELTOP [37]的研究被排除在外,该研究的参与者之前都接受过曲妥珠单抗治疗。异质性检验p= 0.46,我2= 0,p= 0.22,我2=29%,在OS (T+L vs. T)和OS (L vs. T)中进行了测试。与T组相比,T+L组在OS方面有显著改善(HR: 0.84, 95% CI: 0.73-0.97,p= 0.02;无花果。4).与T组相比,L组在OS方面的疗效明显较低(HR: 1.26, 95% CI: 1.08-1.46,p= 0.003;无花果。4).
亚组分析
L组与T组相比,新辅助治疗患者的OS无统计学意义(HR: 0.85, 95% CI: 0.60-1.20,p= 0.36;无花果。5).L支与T支相比,姑息治疗患者的OS无统计学意义(HR: 1.40, 95% CI: 1.10-1.80,p= 0.007;无花果。5).亚组差异(相互作用检验,p= 0.02)。
无进展生存
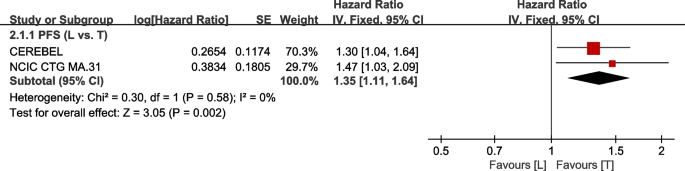
共2次试验[38,39]提供了PFS(定义为从随机化到疾病进展的时间)的数据,用于荟萃分析。数据来自WJOG6110B/ELTOP [37],该研究排除了既往使用曲妥珠单抗治疗进展的参与者。的异质性检验p= 0.58,我2PFS (L vs. T) =0未显示异质性。与T组相比,L组在PFS方面的疗效较低(HR: 1.35, 95% CI: 1.11-1.64,p= 0.002;无花果。6).
无病生存/无事件生存
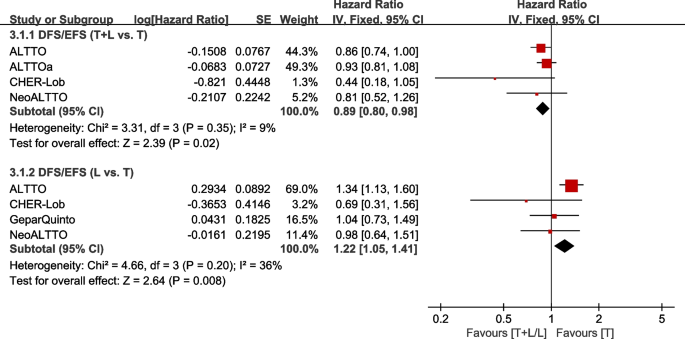
四次试验[21,26,31,35包括I-III期患者提供的DFS/EFS数据(定义为从随机到局部、区域或远处浸润性乳腺癌复发的时间;对侧浸润性乳腺癌;第二种非乳腺恶性肿瘤;或任何原因导致的死亡,以先发生的为准),以纳入元分析。据CHER-Lob报道[22], RFS定义为从随机化到乳腺癌复发的时间(局部或远处;对侧BC除外)或任何原因死亡,以先发生者为准,这与DFS/EFS的定义相似。因此,CHER-Lob中的RFS [22]也被纳入荟萃分析。异质性检验p= 0.35,我2=9%的DFS/EFS (T+L vs. T)显示低异质性。与T组相比,T+L组DFS/EFS显著改善(HR: 0.89, 95% CI: 0.80-0.98,p= 0.02;无花果。7).异质性检验p= 0.20,我2DFS/EFS =36% (L vs. T)异质性较低。与T组相比,L组在DFS/EFS方面的疗效明显较低(HR: 1.22, 95% CI: 1.05-1.41,p= 0.008;无花果。7).
二次结果
pCR (ypT0/is ypN0)
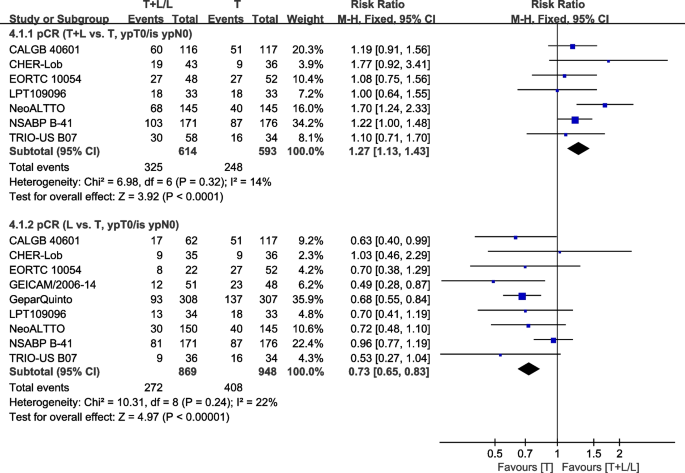
九次试验[22,23,30.,34,36,40,41,42,43]的新辅助治疗提供了pCR (ypT0/is ypN0)(定义为乳腺和腋窝淋巴结无残留浸润性肿瘤)的数据,用于荟萃分析。异质性检验p= 0.32,我2pCR (T+L vs. T, ypT0/is ypN0) =14%,异质性较低。与T组相比,T+L组的pCR有显著改善(ypT0/is ypN0) (RR: 1.27, 95% CI: 1.13-1.43,p< 0.0001;无花果。8).异质性检验p= 0.24,我2pCR (L vs T, ypT0/is ypN0) =22%,异质性较低。与L组相比,T组的pCR (ypT0/is ypN0)有显著改善(RR: 0.73, 95% CI: 0.65-0.83,p< 0.00001;无花果。8).
pCR (ypT0/is ypN0/+)
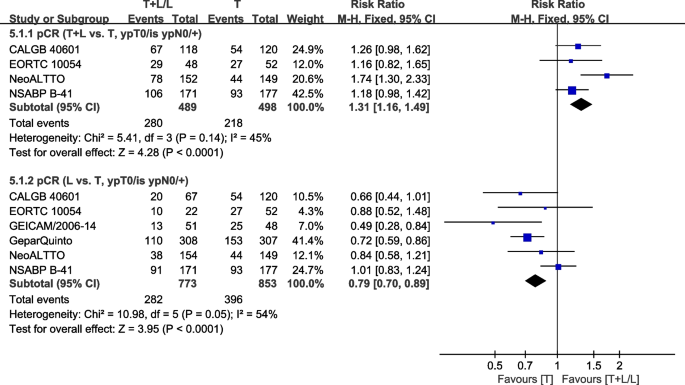
六次试验[29,34,36,40,41,42]的新辅助治疗提供了pCR (ypT0/is ypN0/+)(定义为乳腺内无残留浸润性肿瘤)的数据,用于荟萃分析。异质性检验p= 0.14,我2=45%,在pCR中(T+L vs. T, ypT0/is ypN0/+)呈现低异质性。与T组相比,T+L组的pCR有显著改善(ypT0/is ypN0/+) (RR: 1.31, 95% CI: 1.16-1.49,p< 0.0001;无花果。9).异质性检验p= 0.05,我2=54%,在pCR中(L vs. T, ypT0/is ypN0/+)表现出较高的异质性。与L组相比,T组的pCR有显著改善(ypT0/is ypN0/+) (RR: 0.79, 95% CI: 0.70-0.89,p< 0.0001;无花果。9).
Recurrence-free生存
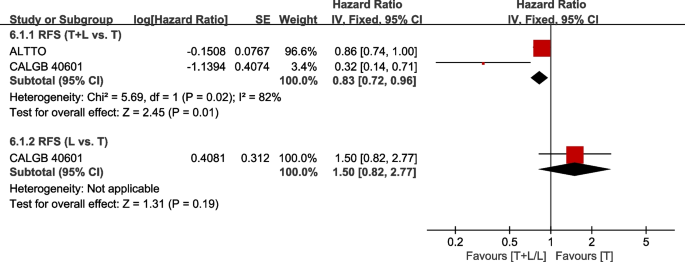
两次试验[21,29]提供了RFS(定义为从手术到同侧浸润性乳腺肿瘤复发、区域复发、远处复发或任何原因死亡的间隔,以先发生者为准)的数据,用于荟萃分析。数据来自CHER-Lob [22]和GeparQuinto [35]没有纳入荟萃分析,因为RFS被定义为从随机化开始的时间。异质性检验p= 0.02,我2=82%,在RFS (T+L vs. T)中表现出较高的异质性。与T组相比,T+L组的RFS有显著改善(HR: 0.83, 95% CI: 0.72-0.96,p= 0.01;无花果。10).CALGB 40601(30)在L组和T组RFS方面没有发现显著差异(HR: 1.50, 95% CI: 0.82-2.77,p= 0.19;无花果。10).
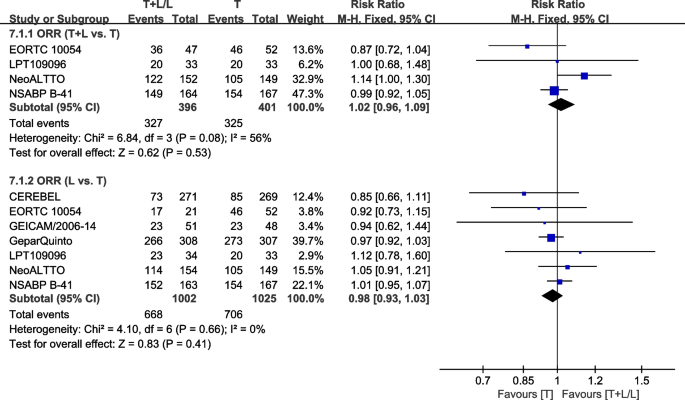
整体回应率
八次试验[34,36,37,38,40,41,42,43]提供了ORR(基于世界卫生组织(WHO)标准或实体瘤反应评估标准(RECIST))的数据,用于荟萃分析。数据来自NCIC CTG MA.31 [39]没有纳入荟萃分析,因为her2阳性和her2阴性患者在ORR中是一起评估的。数据来自WJOG6110B/ELTOP [37]的研究被排除在外,该研究的参与者之前都接受过曲妥珠单抗治疗。异质性检验p= 0.08,我2ORR (T+L vs. T) =56%,异质性较高。T组和T+L组ORR差异无统计学意义(RR: 1.02, 95% CI: 0.96-1.09,p= 0.53;无花果。11).异质性检验p= 0.66,我2=0%,在ORR (L vs. T)中未显示任何异质性。T组和L组ORR差异无统计学意义(RR: 0.98, 95% CI: 0.93-1.03,p= 0.41;无花果。11).
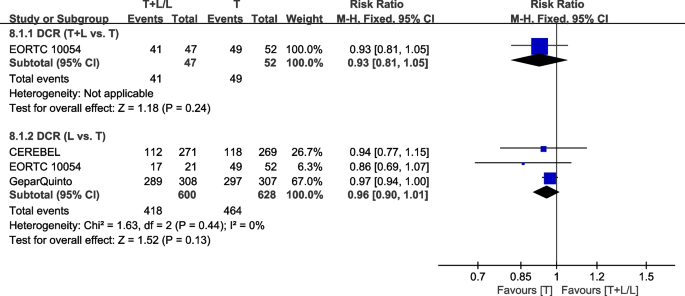
疾病控制率
四次试验[35,37,38,40]提供了DCR数据(基于世界卫生组织(WHO)标准或实体瘤反应评估标准(RECIST)),用于荟萃分析。数据来自NCIC CTG MA.31 [39]在荟萃分析中没有合并,因为her2阳性和her2阴性患者在DCR中是一起评估的。数据来自WJOG6110B/ELTOP [37]的研究被排除在外,该研究的参与者之前都接受过曲妥珠单抗治疗。eortc10054 [40]报道T+L组和T组有相似的DCR率(图2)。12).异质性检验p= 0.44,我2=0%,在DCR (L vs. T)中未显示任何异质性。L组和T组DCR差异无统计学意义(RR: 0.96, 95% CI: 0.90-1.01,p= 0.13;无花果。12).
保乳手术率
六次试验[27,33,36,40,41,42]的新辅助治疗报告了荟萃分析中合并BCS率的数据。异质性检验p= 0.69,我2=0%,在BCS (T+L vs. T)中未显示任何异质性。T组和T+L组BCS发生率差异无统计学意义(RR: 1.01, 95% CI: 0.88-1.15,p= 0.94;无花果。13).异质性检验p= 0.32,我2=14%,在BCS中(L vs T)表现出低异质性。L组和T组的BCS发生率差异无统计学意义(RR: 0.94, 95% CI: 0.86-1.04,p= 0.24;无花果。13).
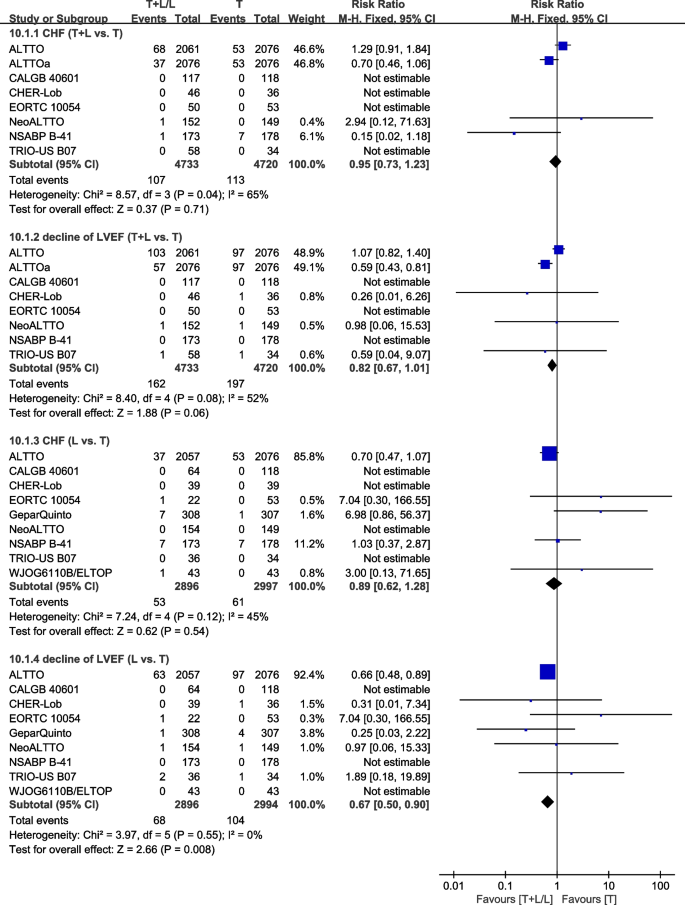
心脏毒性
九次试验[23,26,27,30.,34,36,37,40,42]提供了心脏毒性(充血性心力衰竭(CHF)和左室射血分数(LVEF)下降的数据。CHF定义为纽约心脏协会级别心功能障碍、严重CHF、症状性CHF或确诊CHF。LVEF下降的定义由纳入研究的作者报告,因为使用了不同的阈值。数据来自NCIC CTG MA.31 [39]和GEICAM/2006-14 [41]没有纳入荟萃分析,因为her2阳性和her2阴性患者是一起评估的。异质性检验p= 0.04,我2=65%,在CHF中(T+L vs. T)表现出较高的异质性。T组和T+L组CHF差异无统计学意义(RR: 0.95, 95% CI: 0.73-1.23,p= 0.71;无花果。14).异质性检验p= 0.08,我2=52%,在LVEF下降(T+L vs. T)表现出较高的异质性。T+L组和T组LVEF下降差异无统计学意义(RR: 0.82, 95% CI: 0.67-1.01,p= 0.06;无花果。14).异质性检验p= 0.12,我2=45%,在CHF中(L vs. T)表现出低异质性。L组和T组CHF差异无统计学意义(RR: 0.89, 95% CI: 0.62-1.28,p= 0.54;无花果。14).异质性检验p= 0.55,我2LVEF下降=0% (L vs. T)无异质性。与T组相比,L组LVEF下降的发生率较低(RR: 0.67, 95% CI: 0.50-0.90,p= 0.008;无花果。14).
其他毒性
获得了超过半数试验中报告的III/IV级毒性数据[44].十一项试验[23,26,28,30.,32,36,37,38,40,42,43]提供了其他毒性(化疗不良反应根据国家癌症研究所不良事件通用术语标准进行分级)的数据,以便纳入荟萃分析。数据来自NCIC CTG MA.31 [39]和GEICAM/2006-14 [41]没有纳入荟萃分析,因为her2阳性和her2阴性患者是一起评估的。
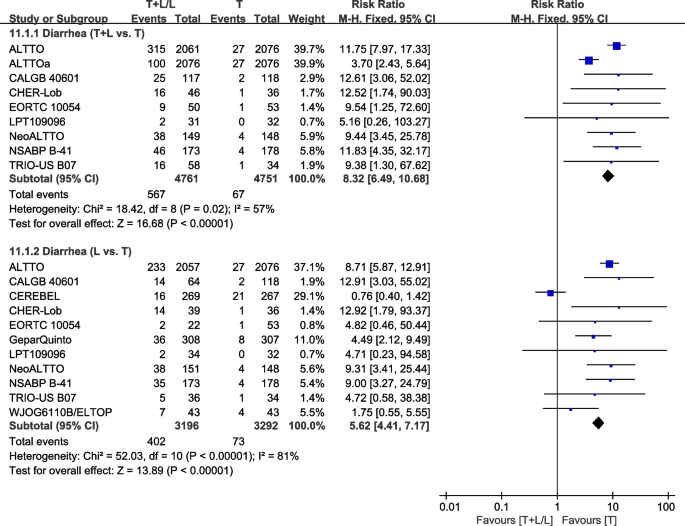
腹泻
十一项试验[23,26,28,30.,32,36,37,38,40,42,43]在荟萃分析中提供了III/IV级腹泻的数据。异质性检验p= 0.02,我2=57%,在腹泻中(T+L vs. T)表现出较高的异质性。与T组相比,T+L组III/IV级腹泻的发生率更高(RR: 8.32, 95% CI: 6.49-10.68,p< 0.00001;无花果。15).异质性检验p< 0.00001,我2=81%,在腹泻中(L vs T)表现出较高的异质性。与T组相比,L组III/IV级腹泻的发生率更高(RR: 5.62, 95% CI: 4.41-7.17,p< 0.00001;无花果。15).
亚组分析
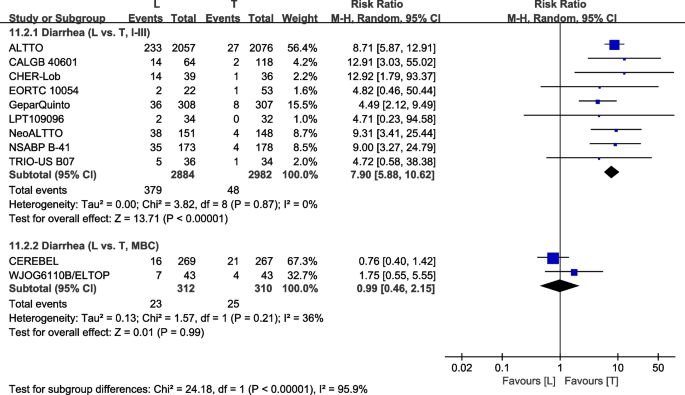
按肿瘤I-III期划分亚组[23,26,28,30.,32,36,40,42,43]或MBC [37,38].在I-III期患者中,L组III/IV级腹泻的发生率更高(RR: 7.90, 95% CI: 5.88-10.62,p< 0.00001;无花果。16).L臂显示MBC患者III/IV级腹泻无统计学意义(RR: 0.99, 95% CI: 0.46-2.15,p= 0.99;无花果。16).亚组差异(相互作用检验,p< 0.00001)。
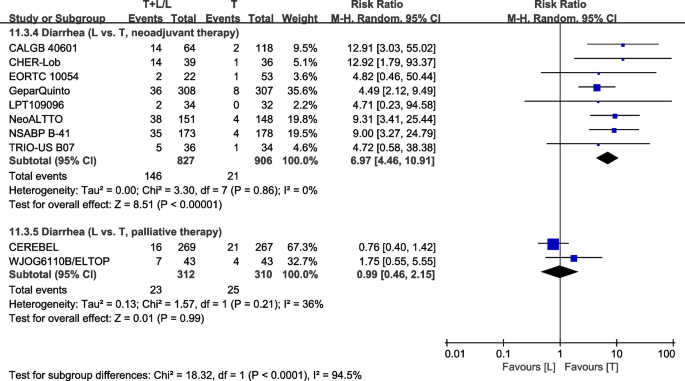
根据治疗类型分为亚组,包括新辅助治疗[23,28,30.,32,36,40,42,43]和姑息治疗[37,38].在接受新辅助治疗的患者中,L组III/IV级腹泻的发生率更高(RR: 6.97, 95% CI: 4.46-10.91p< 0.00001;无花果。17).L臂显示姑息治疗患者III/IV级腹泻无统计学意义(RR: 0.99, 95% CI: 0.46-2.15,P= 0.99;无花果。17).亚组差异(相互作用检验,p< 0.00001)。
嗜中性白血球减少症
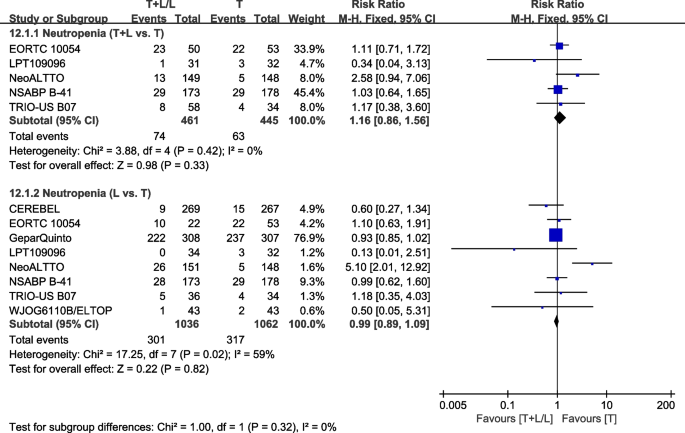
八次试验[23,32,36,37,38,40,42,43]提供了III/IV级中性粒细胞减少症的数据,用于荟萃分析。异质性检验p= 0.42,我2=0%,中性粒细胞减少症(T+L vs. T)无异质性。T组和T+L组之间III/IV级中性粒细胞减少症的差异无统计学意义(RR: 1.16, 95% CI: 0.86-1.56,p= 0.33;无花果。18).异质性检验p= 0.02,我2=59%,在中性粒细胞减少症(L vs T)表现出较高的异质性。T组和L组之间III/IV级中性粒细胞减少症差异不显著(RR: 0.99, 95% CI: 0.89-1.09,p= 0.82;无花果。18).
乏力
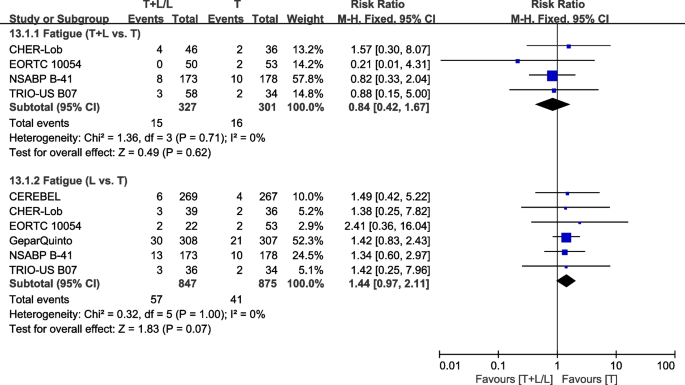
六次试验[23,28,36,38,40,42]提供了III/IV级疲劳数据,用于荟萃分析。异质性检验p= 0.71,我2=0%,在疲劳方面(T+L vs. T)无异质性。T组和T+L组之间III/IV级疲劳差异不显著(RR: 0.84, 95% CI: 0.42-1.67,p= 0.62;无花果。19).异质性检验p= 1.00,我2=0%,在疲劳(L vs. T)没有显示任何异质性。T组和L组之间III/IV级疲劳差异不显著(RR: 1.44, 95% CI: 0.97-2.11,p= 0.07;无花果。19).
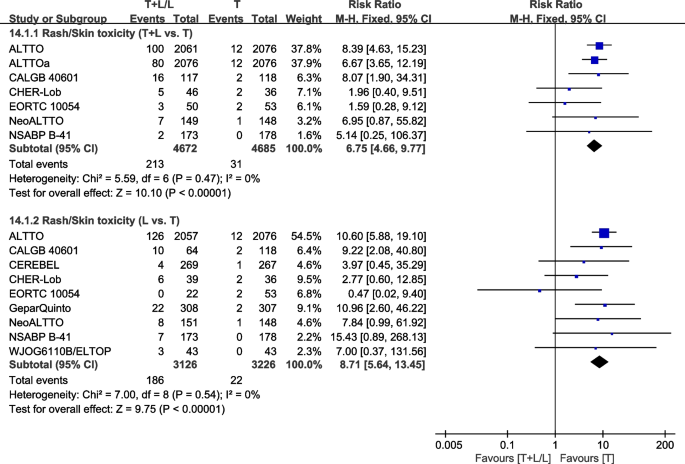
皮疹/皮肤毒性
九次试验[26,28,30.,32,36,37,38,40,42]提供了III/IV级皮疹或皮肤毒性的数据,用于荟萃分析。异质性检验p= 0.47,我2=0%,在皮疹/皮肤毒性(T+L vs. T)中无异质性。与T组相比,T+L组III/IV级皮疹或皮肤毒性的发生率更高(RR: 6.75, 95% CI: 4.66-9.77,p< 0.00001;无花果。20.).异质性检验p= 0.54,我2=0%,在皮疹/皮肤毒性(L vs. T)中无异质性。与T组相比,L组III/IV级皮疹或皮肤毒性的发生率更高(RR: 8.71, 95% CI: 5.64-13.45,p< 0.00001;无花果。20.).
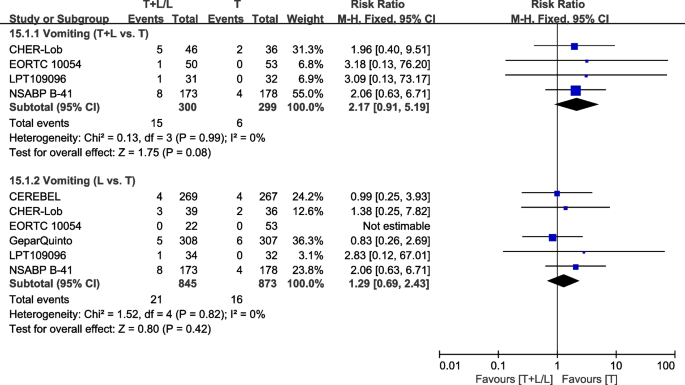
呕吐
六次试验[28,36,38,40,42,43]提供了III/IV级呕吐的数据,用于荟萃分析。异质性检验p= 0.99,我2=0%,在呕吐(T+L vs. T)没有显示任何异质性。T+L组和T组之间III/IV级呕吐差异无统计学意义(RR: 2.17, 95% CI: 0.91-5.19,p= 0.08;无花果。21).异质性检验p= 0.82,我2=0%,在呕吐(L vs T)没有显示任何异质性。L组和T组III/IV级呕吐差异无统计学意义(RR: 1.29, 95% CI: 0.69-2.43,p= 0.42;无花果。21).
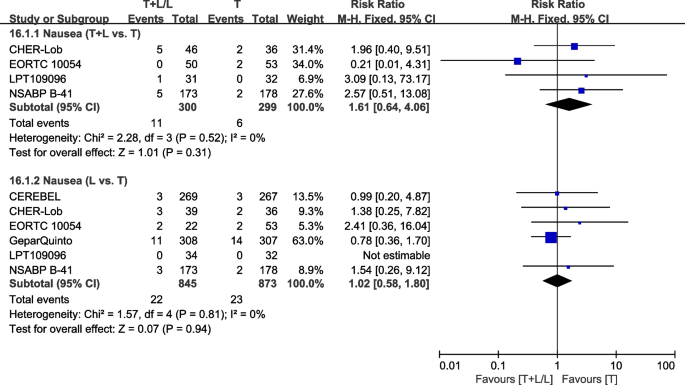
恶心想吐
六次试验[28,36,38,40,42,43]提供了III/IV级恶心的数据,用于荟萃分析。异质性检验p= 0.52,我2=0%,在恶心(T+L vs. T)没有显示任何异质性。T+L组和T组之间III/IV级恶心的差异无统计学意义(RR: 1.61, 95% CI: 0.64-4.06,p= 0.31;无花果。22).异质性检验p= 0.81,我2=0%,在恶心(L vs. T)没有显示任何异质性。T组和L组之间III/IV级恶心的差异无统计学意义(RR: 1.02, 95% CI: 0.58-1.80,p= 0.94;无花果。22).
在这篇稿件中,我们只报道了亚群分析,亚群效应的可能性很高。meta分析和亚组分析的结果总结在附加文件中4:表S2。来自子群分析的所有描述和森林图,包括未报告的子群,都显示在附加文件中1(图S1-S20)。
发表偏倚
评估主要结果的发表偏倚。Egger’s检验未发现OS (T+L vs. T)有任何发表偏倚(t=−1.43,p= 0.248,p>0.05)和OS (L vs. T) (t=−1.71,p= 0.163,p> 0.05)。由于PFS仅纳入2项试验(L vs. T),因此未确定该结果的发表偏倚。Egger’s检验未发现DFS/EFS (T+L vs. T;t=−2.56,p= 0.051,p> 0.05);然而,关于DFS/EFS存在发表偏倚(L vs. T;t=−10.88,p= 0.008,p≤0.05)。这些发现显示在附加文件中2(图S1-S4)。
敏感性分析
DFS/EFS的结果(L vs. T)通过模型的改变与之前的结果有显著差异[RR = 1.13, 95%CI: 0.91 ~ 1.42,p= 0.27,雷姆]。RFS (T+L vs. T)的结果与之前的结果有显著差异,模型改变[RR = 0.57, 95%CI: 0.22 ~ 1.48,p= 0.25,雷姆]。pCR的异质性检验(L vs. T, ypT0/为ypN0/+;p= 0.05,我2= 54%)显示出较高的异质性。在排除NSABP B-41 AC临床试验数据后,Doc化疗无异质性(p= 0.52,我2= 0)。因此,本研究是异质性的来源。去除异质性源后,固定效应模型pCR结果(L vs. T, ypT0/is ypN0/+)与之前结果差异不显著[RR = 0.72, 95%CI: 0.62 ~ 0.83,p< 0.00001)。ORR的异质性检验(T+L vs. T)显示出较高的异质性(p= 0.08,我2= 56%)。排除NeoALTTO试验的数据后(NeoALTTO试验以wP化疗作为新辅助治疗,FEC化疗作为辅助治疗),无异质性(p= 0.41,我2= 0)。因此,本研究是异质性的来源。在删除异质性来源后,采用固定效应模型的ORR (T+L vs. T)结果与之前的结果差异不显著[RR = 0.96, 95%CI: 0.90 ~ 1.03,p= 0.28)。CHF的异质性检验(T+L vs. T)显示高异质性(p= 0.04,我2= 65%)。在排除使用抗her2治疗作为辅助治疗的ALTTO试验数据后,异质性较低(p= 0.23,我2= 31%)。因此,本研究是异质性的来源。在删除异质性来源后,采用固定效应模型计算的CHF (T+L vs. T)与之前的结果差异不显著[RR = 0.65, 95%CI: 0.44 ~ 0.97,p= 0.04)。LVEF下降的异质性检验(T+L vs. T)显示高度异质性(p= 0.08,我2= 52%)。排除使用抗her2治疗作为辅助治疗的ALTTO试验(ALTTO和ALTTOa)的数据后,无异质性(p= 0.83,我2= 0%)。因此,本研究是异质性的来源。剔除异质性来源后,固定效应模型LVEF下降(T+L vs. T)结果与之前结果差异不显著[RR = 0.55, 95%CI: 0.11 ~ 2.73,p= 0.46)。腹泻的异质性检验(T+L vs. T)显示出较高的异质性(p= 0.02,我2= 57%)。排除ALTTOa使用曲妥珠单抗和拉帕替尼作为抗her2治疗的数据后,没有异质性(p= 1.00,我2= 0%)。因此,本研究为异质性来源。去除异质性来源后,采用固定效应模型的腹泻(T+L vs. T)结果与既往结果差异不显著[RR = 11.39, 95%CI: 8.30 ~ 15.63,p< 0.00001)。腹泻的异质性检验(L vs. T)显示出较高的异质性(p< 0.00001,我2= 81%)。在采用低方法学方法排除CEREBEL试验数据后,异质性很小(p= 0.34,我2= 11%)。因此,本研究是异质性的来源。在剔除异质性源后,采用固定效应模型的腹泻(L vs. T)结果与既往结果差异不显著[RR = 7.62, 95%CI: 5.73 ~ 10.11,p< 0.00001)。中性粒细胞减少症的异质性检验(L vs. T)显示高异质性(p= 0.02,我2= 59%)。排除NeoALTTO试验的数据(该试验使用wP化疗作为新辅助治疗)后,异质性很小(p= 0.71,我2= 0%)。因此,本研究是异质性的来源。去除异质性来源后,采用固定效应模型对中性粒细胞减少症(L vs. T)的结果与既往结果差异不显著[RR = 0.92, 95%CI: 0.83 ~ 1.02,p= 0.10)。所有结果均稳定。敏感性分析结果见表3..
证据质量评估
用GRADE评估37项结果。风险的偏见:几乎所有的结果被认为是严重的风险由于不清楚分配隐藏包括的研究,除了BCS的结果率T + L与T和L与T .不一致:高异构性问题被发现在pCR的结果(L与T, ypT0 / ypN0 / +), RFS (T + L和T),或者(T + L和T),瑞士法郎(T + L和T), LVEF (T + L和T)下降,腹泻(T + L和T),腹泻(L和T)和中性粒细胞减少(L和T)。因此,这些结果被认为是严重不一致的风险。间接性:所有结果均无显著的间接性,因为所有试验均为直接比较。不精确:结果的操作系统(L / T,新辅助治疗),DFS / EFS (L和T), RFS (T + L和T),或者(T + L和T),或者(L和T)及(L和T), BCS率(T + L和T), BCS (L和T),瑞士法郎(T + L和T),瑞士法郎(L和T), LVEF (T + L和T)下降,腹泻(T + L和MBC),腹泻(T + L和姑息疗法),中性粒细胞减少(T + L和T),中性粒细胞减少(L和T),疲劳(T + L和T),疲劳(L和T),呕吐(T + L和T),呕吐(L和T),恶心(T + L和T),由于样本量不足,认为恶心(L vs. T)存在严重的不精确风险。发表偏倚:DFS/EFS (L vs. T)、CHF (L vs. T)和恶心(L vs. T)表现出发表偏倚。总体而言:没有结果具有高质量证据,15项结果具有中等质量证据,14项结果具有低质量证据,8项结果具有极低质量证据(表2)4).
讨论
这是一项最新的系统综述和荟萃分析,最终确定曲妥珠单抗加拉帕替尼或拉帕替尼治疗的疗效是否不低于曲妥珠单抗治疗。在之前的研究中,Yu et al.和Clavarezza et al. [44,45]没有比较拉帕替尼治疗和标准曲妥珠单抗治疗,最新纳入的研究发表于2017年。徐等。[46]报道了三组(T+L, T, L)间的meta分析结果。然而,这项研究[46]与2012 - 2015年纳入的随机对照试验的研究结果不包括所有相关研究。此外,本研究包括了所有治疗类型(新辅助治疗、辅助治疗或姑息治疗),但与Ma等人的研究不同。[47]和Guarneri等人。[48],其中仅包括新辅助治疗的rct。因此,我们的研究纳入了所有相关的rct,扩大了样本量,几乎分析了所有重要的结果,这可能会使meta分析结果更加科学和全面。与以往的研究相比,我们的研究结果基本没有显著差异,大部分结果高度相似。
本荟萃分析显示,曲妥珠单抗联合拉帕替尼治疗的疗效优于单曲妥珠单抗标准治疗,OS、DFS/EFS、pCR (ypT0/为ypN0)、pCR (ypT0/为ypN0/+)、RFS均有明显改善,但安全性风险较大,腹泻和皮疹/皮肤毒性发生率较高。此外,单曲妥珠单抗标准治疗被证明在疗效上优于拉帕替尼治疗,OS、PFS、DFS/EFS、pCR (ypT0/is ypN0)和pCR (ypT0/is ypN0/+)均有显著改善。在安全性方面,与拉帕替尼单独治疗相比,标准曲妥珠单抗单独治疗LVEF下降的发生率更高,但III级或IV级腹泻和皮疹/皮肤毒性的发生率较低。在之前的研究中,Clavarezza等人。[45]报道了曲妥珠单抗联合拉帕替尼治疗与单曲妥珠单抗治疗相比显著提高了pCR率,这与我们的研究结果一致。徐等。[46]报道,曲妥珠单抗联合拉帕替尼治疗显著改善pCR、EFS和OS,但与单独拉帕替尼或曲妥珠单抗治疗相比,III/IV级腹泻、皮疹或红斑以及中性粒细胞减少率更高,这与我们的研究结果一致。Ma等人。[47]报道了标准曲妥珠单抗治疗单独加化疗在pCR (ypT0/is ypN0/+) (RR=0.82, 95% CI: 0.72-0.93)和pCR (ypT0/is ypN0) (RR=0.77, 95% CI:0.67-0.88),而拉帕替尼联合曲妥珠单抗治疗和拉帕替尼治疗的BCS发生率与化疗加曲妥珠单抗治疗相比差异无统计学意义,拉帕替尼联合曲妥珠单抗治疗和拉帕替尼治疗的腹泻和皮疹发生率高于化疗加曲妥珠单抗治疗。瓜内利等人。[48]报道,与标准曲妥珠单抗治疗相比,曲妥珠单抗联合拉帕替尼治疗显著改善了RFS和OS。
OS、PFS和DFS/EFS是重要的临床结果。我们发现,与标准曲妥珠单抗治疗相比,曲妥珠单抗联合拉帕替尼治疗显著改善OS和DFS/EFS,而与标准曲妥珠单抗治疗相比,拉帕替尼联合化疗在OS、PFS和DFS/EFS方面的疗效较低。基于GRADE,除DFS/EFS (L vs. T)被认为质量较低外,这些结果的证据质量一般为中等。因此,曲妥珠单抗联合拉帕替尼是增加患者生存时间的更好选择。虽然拉帕替尼联合曲妥珠单抗治疗的pCR率较高,但与标准曲妥珠单抗治疗相比,曲妥珠单抗优于拉帕替尼,但三种抗her2治疗保乳率差异不显著。因此,我们认为对于重视乳房保存的患者,更好的pCR疗效的治疗可能没有明显的临床意义。但如果早期乳腺癌患者高度重视短期疗效,那么曲妥珠单抗联合拉帕替尼可能是更好的选择。我们还证实,具有更好pCR疗效的患者具有更好的长期生存结果。然而,目前尚不清楚pCR是否与长期生存结果相关。
曲妥珠单抗相关的心脏毒性已被评估。一些研究报道曲妥珠单抗诱导的心脏毒性可能是由于其对小鼠双分钟2 (MDM2)和p53的负调控。同时,曲妥珠单抗诱导的心肌细胞凋亡与炎症浸润有关。TLR4介导的TNFα、MCP-1和ICAM-1趋化因子表达参与炎症反应。拉帕替尼通过激活AMPK通路保存细胞能量并抑制tnf α诱导的心肌细胞凋亡[49,50].在本研究中,与曲妥珠单抗治疗相比,拉帕替尼显示LVEF下降的发生率较低,且证据质量中等。因此,对于心脏状况较差的患者,应评估拉帕替尼联合曲妥珠单抗的疗效。在其他毒性方面,曲妥珠单抗与拉帕替尼治疗和拉帕替尼加曲妥珠单抗治疗相比,III/IV级腹泻和皮疹/皮肤毒性的发生率较低。Mayo等报道拉帕替尼可降低肠道微生物多样性,这可能是腹泻高发的原因[51].然而,在拉帕替尼和联合治疗期间,皮疹的高发可能不是一件坏事。Amir Sonnenblick报道,早期皮疹患者从基于拉帕替尼的治疗中获益更大[52].然而,这种轻率行为的原因尚不清楚。研究人员推断拉帕替尼药代动力学或药动力学影响皮疹的发展。正常的表皮生长依赖于表皮生长因子受体,它在增殖的皮肤上表达[52].
在以往的研究中[44,45,46,47,48],未进行证据质量评估。为了确定meta分析结果的可靠性,本研究采用GRADE对证据质量进行评估。在长期生存结果(不包括亚组分析结果)中,由于纳入研究的分配不明确,几乎所有结果都被评估为中等质量的证据,除了DFS/EFS (L vs. T)和RFS (T+L vs. T)被评估为非常低的证据质量。因此,我们认为与标准曲妥珠单抗治疗相比,拉帕替尼联合曲妥珠单抗治疗具有更好的长期疗效,而曲妥珠单抗优于拉帕替尼,这是普遍可信的。在短期生存结果中,由于纳入研究的分配不明确、异质性高或样本量不足,超过一半的结果被评估为低质量或极低质量证据。虽然本研究显示拉帕替尼联合曲妥珠单抗治疗短期疗效更好,但与标准曲妥珠单抗治疗相比,曲妥珠单抗优于拉帕替尼,但仍难以得出哪种治疗短期疗效更好的结论,而由于样本量不足,BCS发生率的结果评估为中质证据。本研究证明三种治疗方法的BCS发生率无明显差异,我们认为这是可信的。在心脏毒性和其他毒性方面(不包括亚组分析结果),由于纳入研究的分配不明确、异质性高、样本量不足或发表偏倚,几乎所有结果的评估均为低质量或极低质量证据。因此,需要进一步的验证来确定哪种疗法更安全。总体而言,没有一项结果具有高质量证据,15项结果具有中等质量证据,14项结果具有低质量证据,8项结果具有极低质量证据。 More than half of the outcomes were assessed low- or very low-quality evidence. We inferred that it was probably caused by the following reasons. First, most included studies did not design well, which caused serious risk bias. Second, insufficient sample size led to insignificant differences in some results, which caused serious imprecision. Third, publication bias and high heterogeneity downgraded the level of evidence. To upgrade the evidence quality, more well-designed long-term large sample RCTS are needed. Apart from that, more strict inclusion and exclusion criteria should be made in future studies, so that more studies with low heterogeneity can be included.
为了确定异质性的来源,亚组分析揭示了组间的亚组效应。与MBC患者相比,新辅助治疗患者的OS更长,而在拉帕替尼治疗期间,I-III期乳腺癌患者或新辅助治疗患者的腹泻发生率高于MBC患者或姑息治疗患者。亚组分析的结果可能受到小样本量引起的不稳定性的影响。我们还评估了证据质量,发现了中等质量的OS (L vs. T,姑息治疗)、腹泻(L vs. T, I-III)和腹泻(L vs. T,新辅助治疗)的证据,以及低质量的OS (L vs. T,新辅助治疗)、腹泻(L vs. T, MBC)和腹泻(L vs. T,姑息治疗)的证据,这可以为临床医生和患者选择治疗方案提供信息。
近年来,研究越来越多地评估双靶向治疗与单靶向治疗的疗效。评估双靶向和单靶向治疗的疗效和安全性,对临床医生和患者进行更好的治疗选择具有重要意义。本研究存在诸多局限性;首先,大多数纳入的研究没有明确提到分配隐藏,这降低了纳入研究的可靠性。第二,纳入研究的不同化疗方案可能导致临床异质性。第三,除ALTTO外,大多数试验的样本量都很小。最后,研究中安全事件发生率低可能导致对治疗效果的过度判断。未来需要相关的、精心设计的长期大样本rct,更多的研究应评估拉帕替尼和曲妥珠单抗的心脏和非心脏毒性机制。此外,确定拉帕替尼与曲妥珠单抗联合使用时,pCR是否对长期生存有影响,拉帕替尼与曲妥珠单抗联合使用是否能降低心脏毒性的发生率具有重要意义。
结论
曲妥珠单抗联合拉帕替尼治疗的疗效优于标准曲妥珠单抗单独治疗,但具有更多的非心脏III/IV级毒性。拉帕替尼治疗的疗效不如单用标准曲妥珠单抗治疗。然而,拉帕替尼治疗的心脏安全性优于标准曲妥珠单抗治疗。
数据和材料的可用性
在本研究期间生成和/或分析的数据集可在CNKI、万方、VIP、Sinomed、PubMed、Embase和Cochrane CENTRAL数据库中获得。
参考文献
王志强,王志强,王志强。中国癌症研究杂志,2021。中华癌症杂志。2021年1月;71(1):7-33。
乳腺癌:当前的分子治疗靶点和新参与者。中国医药科学,2017;17(2):152-63。
李志刚,李志刚,李志刚,等。全球乳腺癌死亡率变化趋势分析。中华癌症杂志2019;20(7):2015-20。
Pfeiffer RM, Webb-Vargas Y, Wheeler W, Gail MH.美国乳腺癌发病率趋势的比例归因于风险因素分布的长期变化。癌症流行病学生物标志物,2018;27(10):1214-22。
杨sk,管建林。乳腺癌:肿瘤内有多种亚型?癌症杂志,2017;3(11):753-60。
阿巴古什,利玛伊姆F. HER2。2020.: StatPearls。《金银岛》(FL): StatPearls Publishing;2021.
安硕,禹建伟,李凯,朴世永。HER2在乳腺癌中的地位:指导方针的变化和解释的复杂因素。中华流行病学杂志2020年1月54(1):34-44。
Loibl S, Gianni L., her2阳性乳腺癌。柳叶刀》。2017;389(10087):2415 - 29。
DY, YJ。her2靶向治疗——超越乳腺癌的作用。中华儿科杂志,2020年1月;17(1):33-48。
Escrivá-de-Romaní S, Arumí M, Bellet M, Saura C. her2阳性乳腺癌:当前和新的治疗策略。乳房。2018年6月;39:80-8。
Maximiano S, Magalhães P, Guerreiro MP, Morgado M.曲妥珠单抗在乳腺癌治疗中的应用。BioDrugs。2016; 30(2): 75 - 86。
Kreutzfeldt J, Rozeboom B, Dey N, De P.曲妥珠单抗时代:当前和即将到来的靶向HER2+乳腺癌治疗。中国癌症杂志,2020;10(4):1045-67。
张志刚,张志刚,张志刚。曲妥珠单抗诱导的心肌病。心脏临床杂志2019;37(4):407-18。
Greenblatt K, Khaddour K.曲妥珠单抗,2021年7月18日。在:StatPearls[互联网]。《金银岛》(FL): StatPearls Publishing;2021年1月。
Cameron D, Piccart-Gebhart MJ, Gelber RD, Procter M, Goldhirsch A, de Azambuja E,等。her2阳性早期乳腺癌患者辅助化疗后曲妥珠单抗的11年随访:Herceptin辅助(HERA)试验的最终分析。柳叶刀》。2017;389(10075):1195 - 205。
Luque-Cabal M, García-Teijido P, Fernández-Pérez Y, Sánchez-Lorenzo L, Palacio-Vázquez I. her2扩增型乳腺癌曲妥珠单抗耐药的机制及克服策略。中国临床医学杂志,2016;10(增刊1):21-30。
傅景德,施耐德-默克,崔佩尔。癌症决议2018;211:19-44。
第一傻瓜,第二傻瓜。her2阳性乳腺癌和酪氨酸激酶抑制剂:现在是时候了。中国乳腺癌杂志。2021;7(1):56。
Johnston SRD, Hegg R, Im SA, Park IH, Burdaeva O, Kurteva G,等。III期,双重人表皮生长因子受体2 (HER2)阻断与拉帕替尼+曲妥珠单抗联合芳香化酶抑制剂治疗绝经后HER2阳性、激素受体阳性转移性乳腺癌的随机研究:ALTERNATIVE的最新结果中华临床杂志,2021;39(1):79-89。
Moreno-Aspitia A, Holmes EM, Jackisch C, de Azambuja E, Boyle F, Hillman DW,等。ALTTO指导委员会和调查人员。国际III期ALTTO试验(BIG 2-06/Alliance N063D)的更新结果。欧洲癌症杂志。2021;148:287-96。
Guarneri V, Dieci MV, Griguolo G, Miglietta F, Girardi F, Bisagni G,等。曲妥珠单抗-拉帕替尼作为her2阳性早期乳腺癌的新辅助治疗:CHER-Lob试验的生存分析欧洲癌症杂志。2021;153:133-41。
Hurvitz SA, Caswell-Jin JL, McNamara KL, Zoeller JJ, Bean GR, Dichmann R,等。her2阳性乳腺癌的II期随机试验(TRIO-US B07)对新辅助曲妥珠单抗和/或拉帕替尼的病理和分子反应。网络学报。2020;11(1):5824。
Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JPA,等。用于报告评估医疗保健干预研究的系统评价和元分析的PRISMA声明:解释和阐述。BMJ。2009; 339: b2700。
希金斯JP。科克伦干预系统评价手册。霍博肯,新泽西州,美国:John Wiley & Sons;2010.
艾格,戴维·史密斯G,施耐德M,敏德C.通过简单的图形测试检测元分析中的偏倚。BMJ。1997, 315(7109): 629 - 34。
Piccart-Gebhart M, Holmes E, Baselga J, de Azambuja E, Dueck AC, Viale G,等。辅助拉帕替尼和曲妥珠单抗治疗早期人表皮生长因子受体2阳性乳腺癌:来自随机III期辅助拉帕替尼和/或曲妥珠单抗治疗优化试验的结果中华临床肿瘤学杂志,2016;34(10):1034-42。
Guarneri V, Dieci MV, Frassoldati A, Maiorana A, Ficarra G, Bettelli S,等。随机CHER-LOB研究的前瞻性生物标志物分析,评估曲妥珠单抗和拉帕替尼双重抗her2治疗加化疗作为her2阳性乳腺癌的新辅助治疗。2015年9月20日(9):1001-10。
Guarneri V, Frassoldati A, Bottini A, Cagossi K, Bisagni G, Sarti S,等。术前化疗加曲妥珠单抗,拉帕替尼,或两者都用于人表皮生长因子受体2阳性的可手术乳腺癌:随机II期CHER-LOB研究结果中华临床肿瘤学杂志,2012;30(16):1989-95。
Fernandez-Martinez A, Krop IE, Hillman DW, Polley MY, Parker JS, Huebner L,等。CALGB 40601(联盟)的生存、病理反应和基因组学,这是一项紫杉醇-曲妥珠单抗联合或不联合拉帕替尼治疗her2阳性乳腺癌的新辅助III期试验。中华临床杂志,2020;38(35):4184-93。
Carey LA, Berry DA, Cirrincione CT, Barry WT, Pitcher BN, Harris LN,等。CALGB 40601靶向新辅助人类表皮生长因子受体2的分子异质性和反应,这是一项紫杉醇+曲妥珠单抗联合或不联合拉帕替尼的随机III期试验。中华临床肿瘤学杂志,2016;34(6):542-9。
胡文杰,李志强,李志强,等。NeoALTTO研究的生存结果(BIG 1-06):一项针对her2阳性原发性乳腺癌患者的随机多中心III期新辅助临床试验的最新结果。欧洲癌症杂志,2019;118:169-77。
de Azambuja E, Holmes AP, piccarter - gebhart M, Holmes E, Di Cosimo S, Swaby RF,等。拉帕替尼联合曲妥珠单抗治疗her2阳性早期乳腺癌(NeoALTTO):一项随机、开放标签、多中心、3期试验的生存结果及其与病理完全缓解的相关性《医学杂志》2014;15(10):1137-46。
张志刚,张志刚,张志刚,张志刚,等。原发性her2阳性乳腺癌患者新辅助治疗后手术管理的相关因素:来自NeoALTTO III期试验的结果安·昂科尔,2013年8月;24(8):1980-5。
王志强,王志强,王志强,等。NeoALTTO研究小组。拉帕替尼联合曲妥珠单抗治疗her2阳性早期乳腺癌(NeoALTTO):一项随机、开放标签、多中心、3期试验柳叶刀》。2012;379(9816):633 - 40。
冯明克维茨G,郭贝尔B,方案C,雷扎M,法辛PA,等。GeparQuinto (G5)研究(GBG 44)中,人表皮生长因子受体2阳性乳腺癌患者接受曲妥珠单抗或拉帕替尼新辅助化疗后的生存分析。中华临床肿瘤学杂志,2018;36(13):1308-16。
李文杰,李文杰,李文杰,等。拉帕替尼与曲妥珠单抗联合新辅助蒽环类紫杉烷化疗(GeparQuinto, GBG 44):一项随机3期试验《医学杂志》2012;13(2):135-44。
高野T,鹤谷J,高桥M,山中T,酒井K,伊藤Y,等。在先前接受曲妥珠单抗和紫杉烷治疗的her2阳性转移性乳腺癌患者中,曲妥珠单抗加卡培他滨与拉帕替尼加卡培他滨的随机II期试验:WJOG6110B/ELTOP。乳房。2018年8月;40:67-75。
Pivot X, Manikhas A, Żurawski B, Chmielowska E, Karaszewska B, Allerton R,等。CEREBEL (EGF111438):在人表皮生长因子受体2阳性转移性乳腺癌患者中,拉帕替尼加卡培他滨与曲妥珠单抗加卡培他滨的III期随机开放标签研究。中华临床肿瘤学杂志,2015;33(14):1564-73。
Gelmon KA, Boyle FM, Kaufman B, Huntsman DG, Manikhas A, Di Leo A,等。拉帕替尼或曲妥珠单抗联合紫杉烷治疗人表皮生长因子受体2阳性晚期乳腺癌:NCIC CTG ma的最终结果。中华临床肿瘤学杂志,2015;33(14):1574-83。
李文杰,李志强,李志强,等。多西他赛+拉帕替尼、曲妥珠单抗或两者结合的新辅助治疗,然后在her2阳性乳腺癌中进行蒽环类化疗:随机II期EORTC 10054研究结果南京大学学报:自然科学版,2015;26(2):325-32。
张晓东,李志强,李志强,杨晓东,Sánchez-Rovira P,等。曲妥珠单抗或拉帕替尼联合标准化疗治疗her2阳性乳腺癌:GEICAM/2006-14试验结果中华肿瘤学杂志,2014;30(5):349 - 349。
Robidoux A, Tang G, Rastogi P, Geyer CE Jr, Azar CA, Atkins JN,等。拉帕替尼作为her2阳性可手术乳腺癌新辅助治疗的组成部分(NSABP方案B-41):一项开放标签、随机3期试验。《医学杂志》2013;14(12):1183-92。
Holmes FA, Espina V, Liotta LA, Nagarwala YM, Danso M, McIntyre KJ,等。术前抗her2治疗后病理完全缓解与PTEN、FOXO、磷酸化Stat5和自噬蛋白信号的改变相关。BMC Res Notes. 2013;5(6):507。
于磊,傅峰,李娟,黄敏,曾波,林勇,等。在含曲妥珠单抗治疗HER2阳性早期乳腺癌方案中,双重HER2阻断与单一药物的比较:随机对照试验的系统回顾和荟萃分析中华医学杂志,2020;16(2020):5169278。
Clavarezza M, Puntoni M, Gennari A, Paleari L, Provinciali N, D'Amico M,等。拉帕替尼和曲妥珠单抗双阻断与单药曲妥珠单抗联合化疗作为her2阳性乳腺癌的新辅助治疗:一项随机试验的荟萃分析临床癌症杂志2016;22(18):4594-603。
徐志强,张勇,李楠,刘培军,郜林,高旭,等。拉帕替尼和曲妥珠单抗治疗her2阳性乳腺癌的疗效和安全性:随机对照试验的系统回顾和荟萃分析英国医学杂志,2017;7(3):e013053。
马伟,赵峰,周超,张颖,赵颖,李楠,等。her -2阳性乳腺癌患者的靶向新辅助治疗:系统回顾和荟萃分析科学通报,2019;3(12):379-90。
Guarneri V, Griguolo G, Miglietta F, Conte PF, Dieci MV, Girardi F. her2阳性早期乳腺癌患者在曲妥珠单抗-拉帕替尼新辅助治疗和化疗后的生存:随机试验的荟萃分析ESMO Open, 2022;7(2):100433。
马伟,魏胜,张波,李伟。药物性心脏毒性心肌细胞死亡的分子机制。前沿细胞发育生物学。2020;3(8):434。
Leemasawat K, Phrommintikul A, Chattipakorn SC, Chattipakorn N.与erbb2靶向药物心脏毒性相关的机制和潜在干预:来自乳腺癌患者体外、体内和临床研究的见解中国生物医学工程学报,2015;26(4):344 - 344。
梅奥j, Secombe KR, Wignall AD, Bateman E, Thorpe D, Pietra C,等。GLP-2类似物elsiglutide可减少酪氨酸激酶抑制剂拉帕替尼在大鼠中引起的腹泻。中国生物医学杂志。2020;85(4):793-803。
孙文杰,黄玉峰,王晓明,等。ALTTO III期随机试验中拉帕替尼相关皮疹和乳腺癌结局中华肿瘤学杂志,2016;30 (8):jw037。
确认
不适用。
资金
不适用。
作者信息
作者及隶属关系
贡献
YY为主要研究人员,对初稿负全面责任,与XL共同撰写初稿并提交PROSPERO注册。XL和YC进行了相关研究的搜索、数据收集和数据分析。WL在手稿的设计、数据分析和编辑方面提供了帮助。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
这项研究不需要伦理,因为没有参与者的私人信息。目前的研究结果将发表在同行评议的期刊上。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1
.肿瘤分期OS亚组分析(L vs T)。图S2.根据治疗设置对OS进行亚组分析(T+L vs. T)。图S3.根据治疗设置对OS进行亚组分析(L vs T)。图S4.根据激素状态对OS进行亚组分析(L vs. T)。图S5.DFS/EFS根据治疗设置进行亚组分析(T+L vs. T)。图S6.根据激素状态对DFS/EFS进行亚组分析(T+L vs. T)。图S7.根据激素状态进行DFS/EFS亚组分析(L vs. T)。图S8.根据激素状态(T+L vs. T)对pCR(ypT0/is ypN0)进行亚组分析。图S9.根据激素状态(L vs T)对pCR(ypT0/is ypN0)进行亚组分析。图S10.根据激素状态(T+L vs. T)对pCR(ypT0/is ypN0/+)进行亚组分析。图S11.根据激素状态(L vs T)对pCR(ypT0/is ypN0/+)进行亚组分析。图S12.根据治疗设置进行CHF亚组分析(T+L vs. T)。图向.LVEF随治疗方式的亚组分析(T+L vs. T)。图S14系列.肿瘤分期腹泻亚组分析(L vs T)。图S15.根据治疗方案进行腹泻亚组分析(T+L vs. T)。图S16.根据治疗方案对腹泻进行亚组分析(L vs T)。图肌力.肿瘤分期中性粒细胞减少亚组分析(L vs T)。S18图美国.根据肿瘤分期进行皮疹/皮肤毒性亚组分析(L vs. T)。图S19.根据治疗方案对皮疹/皮肤毒性进行亚组分析(T+L vs. T)。图S20.根据治疗方案对皮疹/皮肤毒性进行亚组分析(L vs. T)。
附加文件2:图S1
.OS的艾格检验(T+L vs. T)。图S2.OS (L vs. T)的艾格检验。图S3.艾格的DFS/EFS检验(T+L vs. T)。图S4.艾格的DFS/EFS检验(L vs. T)。
附加文件3:表S1
:包括试验的细节
附加文件4:表2
:元分析和亚组分析结果总结
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
元,Y,刘,X,蔡,Y。et al。HER2阳性乳腺癌患者拉帕替尼和拉帕替尼联合曲妥珠单抗治疗与曲妥珠单抗治疗:一项最新的系统综述和荟萃分析系统加速11264(2022)。https://doi.org/10.1186/s13643-022-02134-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13643-022-02134-9
关键字
- 拉帕替尼
- 曲妥珠单抗
- HER2阳性
- 乳腺癌
- 随机对照试验
- 荟萃分析
- 系统综述