摘要
背景
基于不同抗体类型的血清学检测是一种用于诊断SARS-CoV-2的替代方法,与目前的rRT-PCR金标准相比,该方法具有更高的诊断准确性。因此,本综述的目的是评估基于IgG和IgM的即时检测(POC)横向流动免疫分析法(LFIA)、化学发光酶免疫分析法(CLIA)、荧光酶联免疫分析法(FIA)和ELISA检测SARS-CoV-2抗原的诊断准确性。
方法
系统检索PubMed、Medline complete和MedRxiv文献。评估SARS-CoV-2血清学检测诊断准确性的研究符合条件。研究选择和数据提取由两位作者独立完成。使用QUADAS-2检查工具评估研究质量。采用双变量模型和分级汇总受试者工作特征曲线模型评价血清学检测的诊断准确性。采用亚组元分析探讨异质性。
结果
IgG的聚合敏感性(n= 17), IgM (n= 16)和IgG-IgM (n= 24) LFIA检测结果分别为0.5856、0.4637和0.6886。IgG的聚合敏感性(n= 9)和IgM (n= 10)与rRT-PCR相比,CLIA检测结果分别为0.9311和0.8516。IgG的聚合敏感性(n= 10), IgM (n= 11)和IgG-IgM (n= 5) ELISA检测结果与rRT-PCR相比分别为0.8292、0.8388和0.8531。所有测试均表现出较高的特异性,范围为0.9693至0.9991。在评估的测试中,基于IgG的CLIA表达了最高的敏感性,这意味着它可以准确地检测出rRT-PCR识别的最大比例的感染。ELISA和CLIA检测在敏感性方面优于LFIA。除ELISA外,基于IgG的检测均优于IgM。
结论
我们报道基于IgG-IgM的ELISA检测具有最佳的整体诊断测试准确性。此外,无论采用何种方法,就敏感性而言,IgG/IgM联合检测似乎比单独测量任一抗体类型更好。鉴于目前LFIA设备的性能不佳,有必要对高灵敏度和特异性POC LFIA进行更多的研究,以满足大多数个体患者的应用,并吸引大量的血清流行率研究。
系统评审注册
普洛斯彼罗CRD42020179112
简介
2019冠状病毒病(COVID-19)是由严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)引起的重大传染性呼吸道疾病大流行,又称新型(新)冠状病毒2019- ncov [1,2,3.].2019年12月,中国湖北省武汉市发现了第一例COVID-19病例[4].2020年11月18日,根据欧洲疾病预防和控制中心的COVID-19情况更新,全球报告确诊病例55,743,951例,死亡1339,436例[5].虽然COVID-19的临床特征尚未完全了解和了解,但临床医生报告的临床表现从无症状病例到轻、重度呼吸道疾病患者,有或无肺炎、发热、咳嗽和呼吸短促。老年人(>65岁)和患有严重慢性疾病(如肺病、心脏病和糖尿病)的所有年龄段的人似乎有更高的风险死于严重COVID-19疾病[6].
早期和准确的COVID-19诊断检测对于跟踪SARS-CoV-2、了解病毒流行病学、为病例管理提供信息、抑制传播和隔离目的至关重要[7,8].新型冠状病毒肺炎的标准诊断确证检测是基于实时逆转录聚合酶链式反应(rRT-PCR)等核酸扩增试验对新冠病毒核酸的检测。当痰液、咽拭子和下呼吸道分泌物中存在足够数量的病毒核酸时,该测试可以识别出病毒核酸。据报道,在一些患者的血液和口腔液标本中检测到SARS-CoV-2 RNA;然而,关于在这些标本中检测SARS-CoV-2是否适当的数据有限[9].rt - pcr检测耗时较长,需要4至6小时才能完成。它需要昂贵的专业设备、熟练的实验室人员进行样品制备和检测以及PCR试剂,这造成了诊断延误,并限制了在需要快速诊断以做出快速干预决策的实际情况下的使用。因此,对SARS-CoV-2的检测需要成本更低且易于实施的检测。使用rRT-PCR的另一个限制是使用来自上呼吸道的棉签,由于样本质量差或在不正确的时间获得样本,棉签可能被错误地诊断为阴性;值得注意的是,上呼吸道分泌物中的病毒载量在出现症状的第一周达到峰值,但在出现症状晚期的患者中,病毒载量可能下降到检测下限以下[8,10,11,12].错过病毒复制的时间窗口也可能提供假阴性结果。此外,经过一段时间后,由于病毒停止脱落,预计rRT-PCR结果将变为阴性[13].
在SARS-CoV-2诊断过程中,rRT-PCR结果为假阴性是常见的。北京海淀医院发热门诊从2020年1月开始收集的数据显示,rRT-PCR检测阴性的病例中,只有2 / 10的病例被确诊为真阳性。这产生了大约20%的rRT-PCR假阴性率[12].Zhang等人还表明,目前用于SARS-CoV-2诊断的口腔拭子病毒RNA检测策略并不是100%准确。在患者的肛门拭子或血液样本中检测到病毒的存在,而他们的口腔拭子诊断报告为阴性结果。这一观察表明,患者不能仅仅因为口腔拭子样本为阴性而出院[14].
错误的阴性诊断可能会造成严重后果,特别是在COVID-19大流行的现阶段,因为它会使SARS-CoV-2感染患者传播感染,从而阻碍遏制病毒传播的努力[8].尽管病毒滴度较低,但能够检测感染存在的其他筛查方法对确保及时诊断所有COVID-19患者非常有益。检测感染后迅速产生的血清特异性抗sars - cov -2抗体,即免疫球蛋白G (IgG)和M (IgM),提供了一种高度敏感和准确的替代方案,弥补了rRT-PCR的局限性。血清学方法也可能是胸部CT的一种更实用的替代方法[8,15,16].免疫球蛋白G抗体允许使用血清学工具更好地了解COVID-19的总体感染率,包括无症状感染率[8].
然而,COVID-19病例的血液或血清抗体动态没有得到很好的评估。目前,COVID-19患者的血清学动态仍然有限。此外,在广泛部署诊断性分析之前,需要评估其性能特征。因此,本文旨在评价基于IgG和IgM(联合或单独)的即时检测(POC)横向流动免疫分析法(LFIA)、化学发光酶免疫分析法(CLIA)、荧光酶联免疫分析法(FIA)和酶联免疫吸附法(ELISA)检测SARS-CoV-2抗原的诊断准确性。
审查问题
本系统综述的主要研究问题是“使用双变量模型和分层总结受试者工作特征曲线(HSROC)模型进行COVID-19抗体血清学检测的诊断准确性如何?””
材料与方法
我们根据诊断检查准确性系统评价和元分析首选报告项目(PRISMA-DTA)的建议进行了系统评价和元分析[17](附加文件1).我们使用Cochrane推荐来报告诊断准确性研究的系统回顾和荟萃分析[18].我们还使用了已发表的系统分析和荟萃分析综述中的方案来开发我们的方案[19,20.,21,22].开发的系统评价方案已在国际系统评价前瞻性登记册注册,注册号为CRD42020179112。
合格标准
横断面研究将是回答我们回顾问题的理想研究类型。然而,由于我们预计COVID-19的血清学诊断横断面研究将非常少,因此我们决定纳入病例对照研究。纳入标准包括研究人群(n≥10例)以COVID-19 rt - pcr检测或基因测序为参考标准,并进行以下一项或全部血清学检测;检测点(POC)、横向流动免疫分析法(LFIA)、化学发光酶免疫分析法(CLIA)、荧光免疫分析法(FIA)和酶联免疫分析法(ELISA)。纳入了以胸部CT图像、流行病学史、明确的临床特征并以rt - pcr作为参考标准的研究。试验的诊断准确性被定义为主要结局。原创性研究被纳入,不受语言和地理位置的限制。我们纳入了2020年1月1日至2020年4月27日之间的研究。动物实验,体外实验-本研究排除了调查血清流行率的基础研究和调查研究。
信息来源和搜索策略
研究检索了以下数据库:MEDLINE Complete (EBSCO)、PubMed和MedRxiv(一个分发完整但未发表手稿的健康科学预印本服务器)。我们对截止到2020年4月29日的研究执行了搜索策略。使用预定义的关键词搜索数据库:COVID-19和血清学测试及其同义词。附录1说明了PubMed的搜索策略,该策略适用于其他数据库。通过联系该领域的专家和搜索主要研究、综述文章和教科书章节的参考文献列表,确定了其他研究。
研究选择和数据提取
两位作者(AV和HM)评估了搜索中确定的标题,排除了那些与COVID-19血清学诊断明显无关的标题。信件,评论文章和文章显然无关根据检查的摘要和其他注释和副本被排除接下来。其余可能相关的文章的资格是根据全文出版物来判断的.
数据提取由两位作者(AV和HM)独立进行,以避免偏差和差异,并通过讨论解决。如果不能达成协议,就征求第三位作者的意见。当尚不清楚一项研究是否符合纳入条件时,就将其排除在外。在提取数据的同时,作者还必须决定这项研究是病例对照研究还是横断面研究。提取以下数据。
研究作者和出版年份
研究设计
案例定义(纳入/排除标准)
参与者人口
参考标准(包括阳性检测标准)
索引测试[截止值(是否预先指定)以及测试是商业测试还是内部测试]
数据收集的地理位置
索引/参考时间间隔
目标患者病情严重程度的分布情况
无目标条件者其他诊断
TPs、FNs、FPs和FNs的数量
其他考虑因素和排除标准
排除了无法得出包含真阳性、假阳性、假阴性和真阴性的2×2表的研究。此外,那些在报告中过于不具体而无法确保满足上述标准的研究被排除在外。
方法学质量评估
QUADAS-2工具用于评估本系统综述中纳入的所有研究的方法学质量[23].QUADAS-2包括四个关键领域:患者选择、指标测试、参考标准和流量和时间。我们评估了所有领域的潜在偏倚风险(ROB)和前三个领域的适用性问题。偏见的风险被判定为“低”、“高”或“不明确”。详见附录2.两名综述作者(AV和HM)独立完成了QUADAS-2。研究人员通过达成共识解决了分歧。
统计分析和数据综合
诊断准确性
对于每项研究,我们构建了2 × 2表,分别表示真阳性(TP)、真阴性(TN)、假阳性(FP)和假阴性(FN)。在仅报道敏感性和特异性估计的情况下,我们从报道的数据中推导出2乘2表。假设参考方法的敏感性和特异性为100%,我们从列联表中构建了显示指数检验敏感性和特异性的森林图。数据输入Windows v.5.3的Review Manager (RevMan)软件(Cochrane Collaboration, Copenhagen, Denmark),并为每项研究的敏感性和特异性创建95%置信区间(CI)的森林图。
研究在满足以下三个条件时提交元分析:样本量大于20;该指标具有敏感性和特异性,并纳入对照组进行分析。我们使用了两种推荐的随机效应分层方法:双变量模型和分层总结受试者工作特征(HSROC)模型来进行元分析。双变量模型的重点是估计一个总结点(总结敏感性和特异性)。SROC模型是在估计SROC曲线[24].敏感性和特异性的总结估计值以及95% CI和HSROC使用windows 10的OpenMeta-Analyst(开源、跨平台的高级元分析)计算。
异质性调查
我们通过加入抗原类型作为协变量来研究异质性。首先,分析基于IgG或IgM或IgG-IgM的LFIA、CLIA与ELISA血清学检测准确度的差异(表1)2).然后,在OpenMeta-analyst中使用亚组元分析研究抗原类型的影响。我^ 2接近0%的值被认为在研究之间没有异质性;值接近25%,异质性低;值接近50%,异质性中等,值接近75%,研究间异质性高[25].
发表偏倚评估
在本综述中,我们没有评估报道偏倚。纳入我们元分析的研究显示了很多异质性;因此,对报告偏差的评估可能不会产生结论性结果。这是从Ochodo等人使用的方法中采用的。[26].
根据症状出现后的时间测试敏感性
从COVID-19症状出现到标本采集,我们按天数对数据进行了分层。然后,我们使用RevMan软件for Windows v.5.3 (Cochrane Collaboration, Copenhagen, Denmark)构建森林图(95% CI),显示自症状出现以来随时间变化的测试敏感性。
结果
研究包含
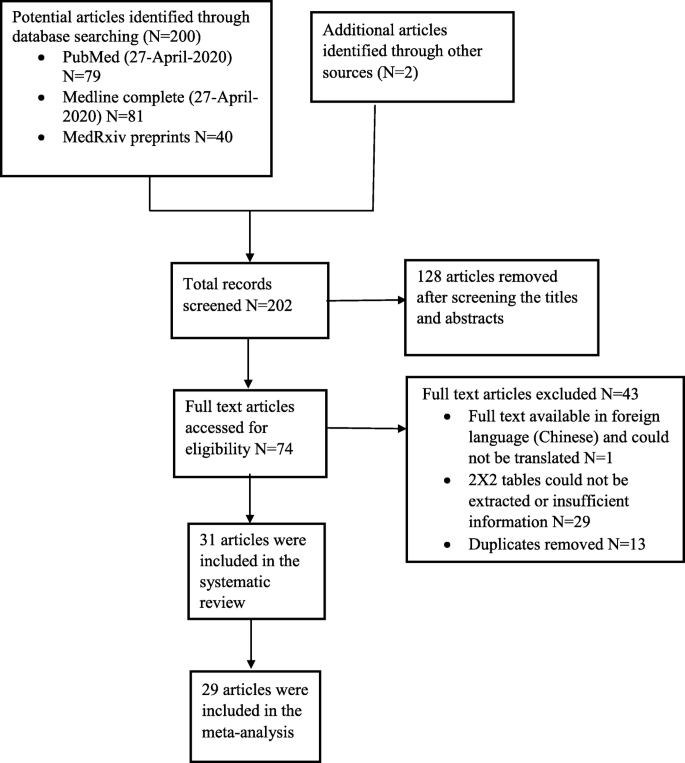
搜索和选择过程的结果如图所示。1.共鉴定出202篇文章。其中40篇是MedRxiv预印本,162篇是MEDLINE Complete (EBSCO)和PubMed的完整发表文章。两篇文章是从其他来源(例如手动搜索)确定的。经过摘要/标题排除和重复剔除后,共提交74篇文章进行全文筛选,其中31篇被纳入系统评价。大多数文章被排除在外,因为它们没有提供足够的数据,因此不可能提取数据来构建2 × 2表,有一篇文章被排除在外,因为它只有中文。共有29篇文章描述了99个独立研究/数据集的结果(分别是19、23和57篇研究LFIA、CLIA和ELISA)符合荟萃分析的条件。
研究的特点
所收录物品的一般特征见表1.所有已发表的文章(n= 14)由于COVID-19是一种新出现的疾病,因此被纳入该综述的论文于2020年发表。17篇未发表的文章是MedRxiv的预印本,已提交给不同的期刊发表。纳入该综述的25篇文章采用病例对照设计,将一组明确定义的病例与一组健康对照或疾病对照或COVID-19 rRT-PCR阴性患者进行比较,其中只有6项研究为横断面研究。一项研究没有对照组,在荟萃分析中被排除。27].大部分研究(n= 22项)研究在COVID-19大流行开始的中国进行,3项研究在意大利进行,3项研究在美国进行,英国、丹麦、德国、西班牙和日本各进行了一项研究。
大部分文章(n= 26),明确提出采用金标准核酸检测(rRT-PCR或深度测序)作为参考标准。然而,五篇文章结合流行病学风险、临床特征、胸部CT图像和rRT-PCR。在一篇文章中,没有说明使用的参考标准,但研究中的所有患者都是COVID-19患者[38].
其中14篇采用即时检测(POC)横向流动免疫分析法(LFIA), 9篇采用CLIA法,13篇采用ELISA法。我们没有确定使用FIA的文章符合我们的纳入标准。一项研究没有具体说明所使用的血清学检测方法,因此被排除在综述中[31].一项研究使用了在溶液中进行的LIPS,从而保持了原生抗原构象[54].大部分的血清学化验试剂盒是商用的(n= 21)和12个是内部的。三种SARS-CoV-2抗原,Spike蛋白(S)、核衣壳蛋白(N)和包膜蛋白(E)在综述中被一起或单独使用。以刺突蛋白和核衣壳为抗原的文章分别有9篇和6篇。5篇文章分别使用S和N作为抗原。在3篇文章中,S和N抗原(S-N)一起用作抗原。在一篇文章中,N和E抗原(N-E)一起作为抗原。在7篇文章中,使用的抗原没有给出名称。
纳入研究的方法学质量
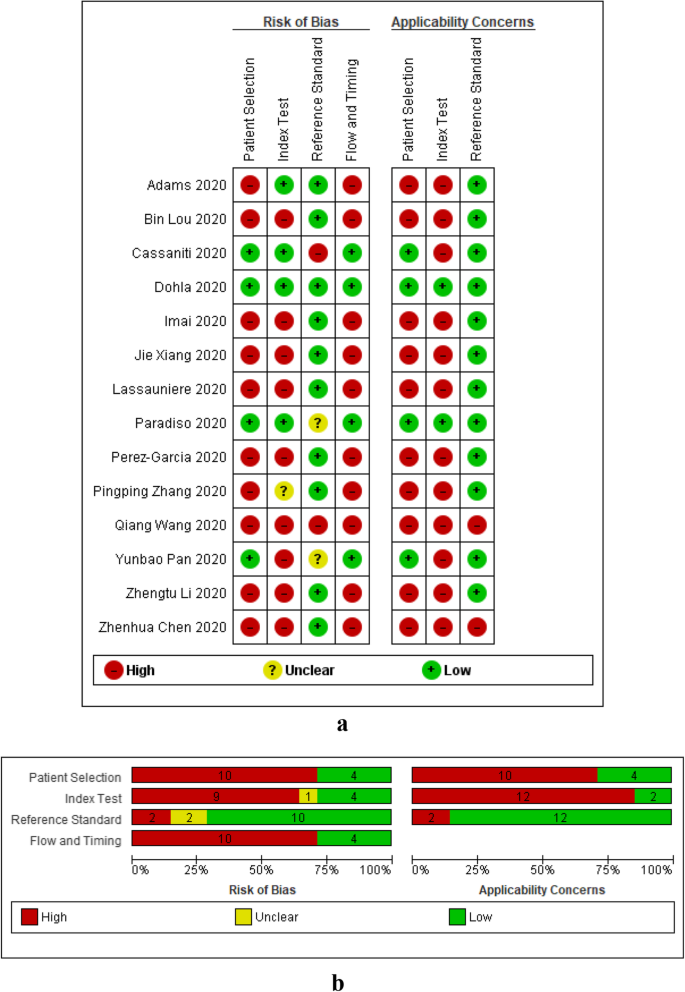
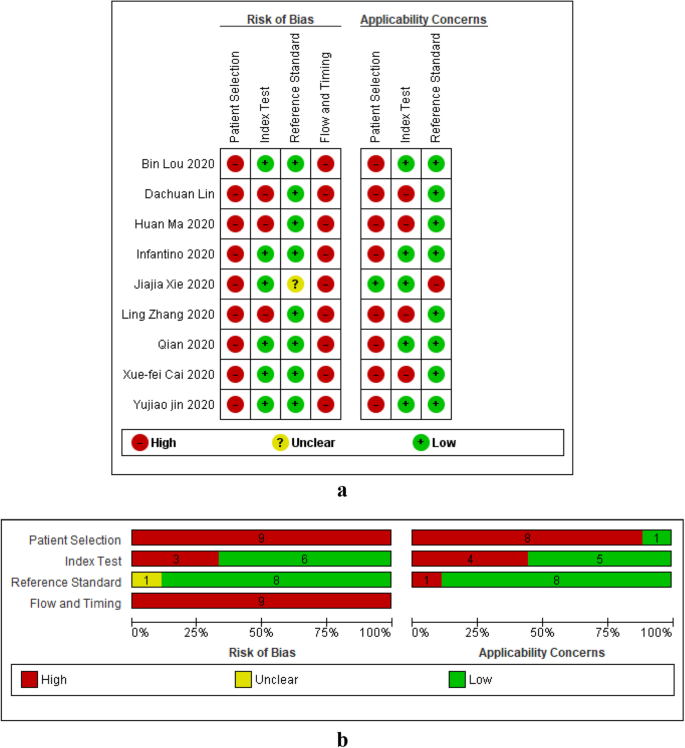
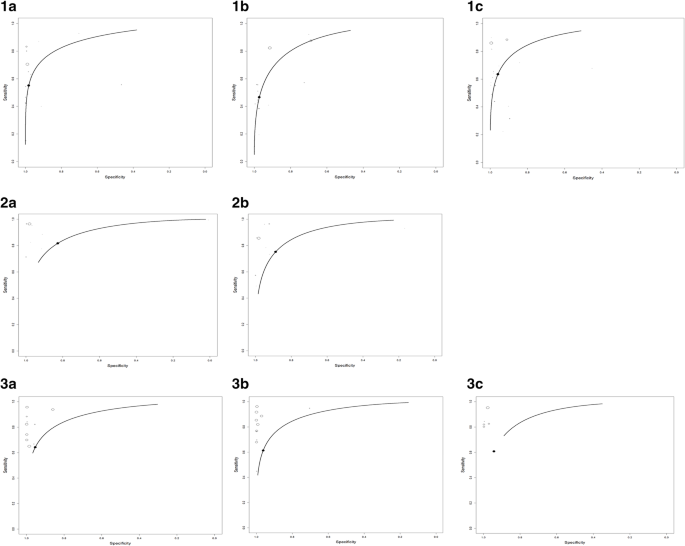
图中总结了所有研究中基于IgG或IgM或IgG-IgM的LFIA、CLIA和ELISA的方法学质量。2b,3.b和4b。的数据2一个,3.一个和4偏倚风险和适用性的显示分别涉及LFIA、CLIA和ELISA单项研究的总结结果。本综述中纳入的所有研究在所有四个QUADAS-2域均无低偏倚风险。一般来说,病例对照研究在患者、时间和血流领域具有高偏倚风险和高关注,横断面研究在所有领域均具有低偏倚风险和低关注。
患者选择领域
一般而言,所纳入的大多数研究存在偏倚风险,并对适用性有高度关注。研究大多是病例对照研究,它们不包括连续或随机系列的参与者,这意味着所包括的患者对临床使用不具有代表性。所有13项ELISA研究均存在高偏倚风险,并对适用性存在高度关注。对于CLIA,所有纳入的9项研究均存在高偏倚风险,只有1项横断面研究的适用性低。一般而言,LFIA有更多的研究(n= 4)在患者选择领域存在低偏倚风险和适用性问题,因为有4项LFIA横断面研究。
指标测试域
LFIA研究在指数测试领域存在较高的偏倚风险(9/14)和较高的适用性问题(12/14)。高偏倚风险是由于在指标检验和参考检验之间没有盲目。对适用性的高度担忧是由于使用血清或血浆而不是全血进行检测,这将使检测不太适合在护理点使用。CLIA和ELISA研究的偏倚风险一般较低(分别为6/9和8/13)。这是因为大多数研究都是自动化的,并且有预先指定的阈值(决定测试是阳性还是阴性的截止值)。具有高偏倚风险的研究没有预先指定的阈值。同样,CLIA和ELISA研究在指标测试领域的适用性普遍较低(分别为5/9和8/13),因为它们使用的是商业指标测试。
参考标准域
与指数测试领域一样,研究在参考标准领域的偏倚风险一般较低(LFIA、CLIA和ELISA分别为10/14、8/9和10/13)。LFIA、CLIA和ELISA的适用性普遍较低,分别为10/14、8/9和11/13。
流量和时间域
所有CLIA (n= 9)和ELISA (n= 13)研究在流量和时间域存在较高的偏倚风险。这些研究都是病例对照研究。大多数LFIA研究也存在较高的偏倚风险;然而,4项横断面LFIA研究的偏倚风险较低。
定量综合和元分析
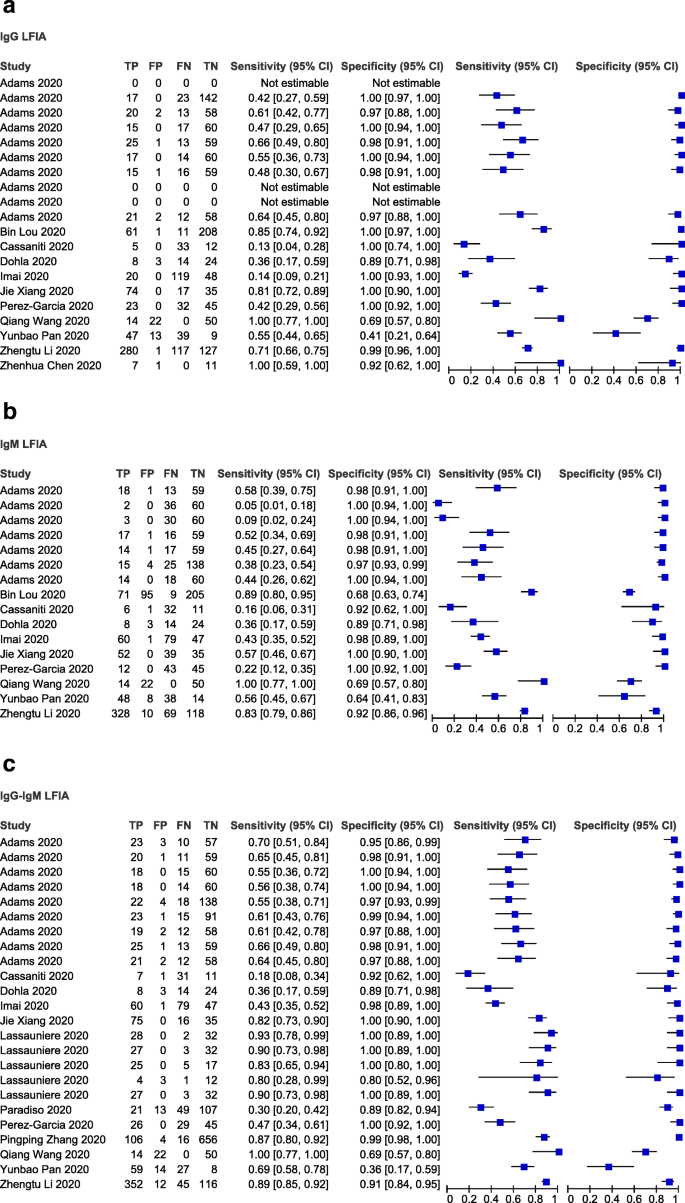
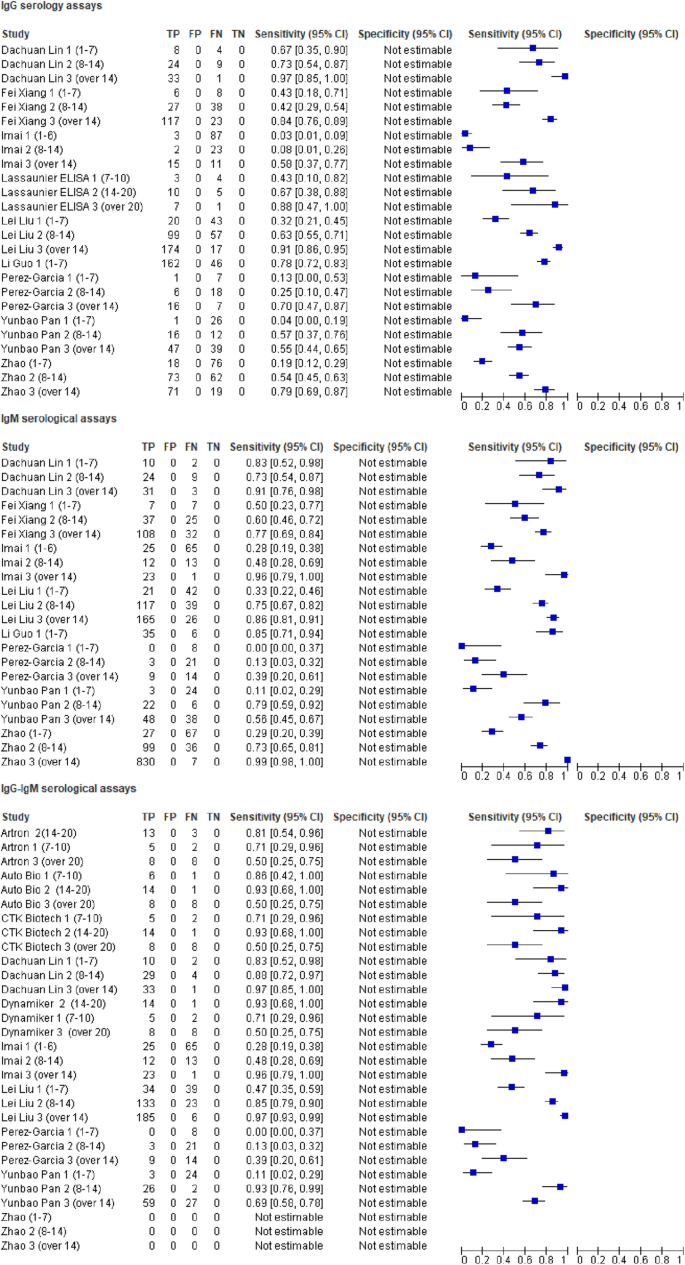
首先,我们以rrt - pcr确诊病例作为参考标准考虑LFIA设备的性能。图中的森林图。5显示所有纳入研究中基于IgG或IgM或IgG-IgM的LFIA检测COVID-19的敏感性、特异性范围和异质性。总体而言,各研究的敏感性差异很大,而特异性没有太大变化,只有两项研究(潘运宝(2020)和王强(2020))分别具有最低和次低的特异性。在以IgG为基础的LFIA测试中(n= 17),敏感性估计范围为0.14 (95% CI 0.09-0.21) (Imai, 2020)至1.00 (95% CI 0.77-1.00)(王强,2020),特异性估计范围为0.41 (95% CI 0.21-0.64)(潘运宝,2020)至1.00 (95% CI 0.97-1.00)(娄斌,2020)(图。5a).对于基于IgM的LFIA测试(n= 16),敏感性估计范围为0.05 (95% CI 0.01-0.18) Adams(试验4至1.00)(95% CI 0.77-1.00)(王强,2020),特异性估计范围为0.64 (95% CI 0.41-0.83)(潘运宝,2020)至1.00 (95% CI 0.94-1.00)(亚当斯试验4和5)(图。5b).对于基于IgG-IgM的LFIA测试(n= 24),敏感性估计值范围为0.18 (95% CI 0.08-0.34) (Cassaniti, 2020)至1.00 (95% CI 0.77-1.00)(王强,2020),大多数研究的敏感性超过0.55,特异性估计值范围为0.36 (95% CI 0.17-0.59)(潘运宝,2020)至1.00 (95% CI 0.94-1.00) (Adams试验2和3)(图。5c)。
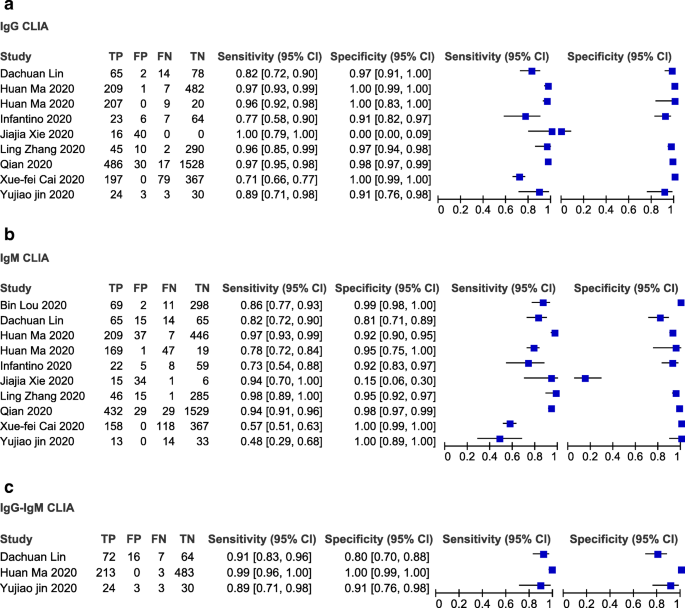
然后,我们以rrt - pcr确诊的病例作为参考标准,考虑基于不同IgG或IgM或IgG-IgM的CLIA测试的表现(图2)。6考虑到任何阳性结果(IgM阳性,IgG阳性或两者均阳性),CLIA血清学测试的敏感性范围为0.48 (95% CI 0.29-0.68%)(金玉娇,2020)至1.00 (95% CI 0.79-1.00),大多数研究在0.80 -1之间。大多数试验的特异性均超过0.80,但有2项试验除外,1项基于IgG的试验和1项基于IgM的试验,其特异性分别为最低0.00 (95% CI 0.00-0.009)和第二低0.15 (95% CI 0.06-0.30)。
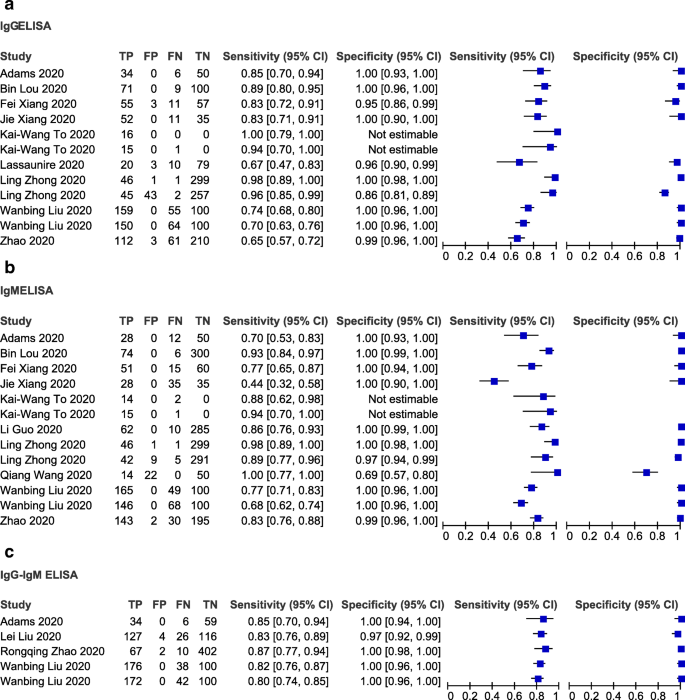
最后,我们以rrt - pcr确诊病例为参考标准,评估了不同的基于IgG或IgM或IgG-IgM的ELISA检测的性能(图2)。7a, b和c)。敏感性和特异性普遍较高,大多数研究为0.80 ~ 1.00,0.95 ~ 1.00。所有以IgG为基础的ELISA测试(n= 10),敏感性估计范围为0.65 (95% CI 0.57-0.72) (Zhao, 2020)至1.00 (95% CI 0.79-1.00) (Kai-Wang to, 2020),特异性估计范围为0.86 (95% CI 0.51-0.89)至1.00 (95% CI 0.98-1.00) (Ling Zhong, 2020)(图7a).在基于IgM的测试(n= 11),个体研究的敏感性和特异性分别为0.44 (95% CI 0.32-0.58) (Jie Xiang, 2020)至1.00 (95% CI 0.77-1.00) (Qiang Wang, 2020)和0.69 (95% CI 0.57-0.80) (Qiang Wang, 2020)至1.00 (95% CI 0.99-1.00) (Ling Zhong, 2020)(图。7b).纳入基于IgG-IgM的ELISA检测的5项研究的敏感性范围为0.80 (95% CI 0.74-0.85)(刘婉冰,2020)至0.87 (95% CI 0.77-0.94)(赵荣庆,2020)。另一方面,5项研究的特异性范围从0.97 (95% CI 0.92-0.99)(刘磊,2020)到1.00 (95% CI 0.98-1.00)(赵荣庆,2020)(图2)。7c)。
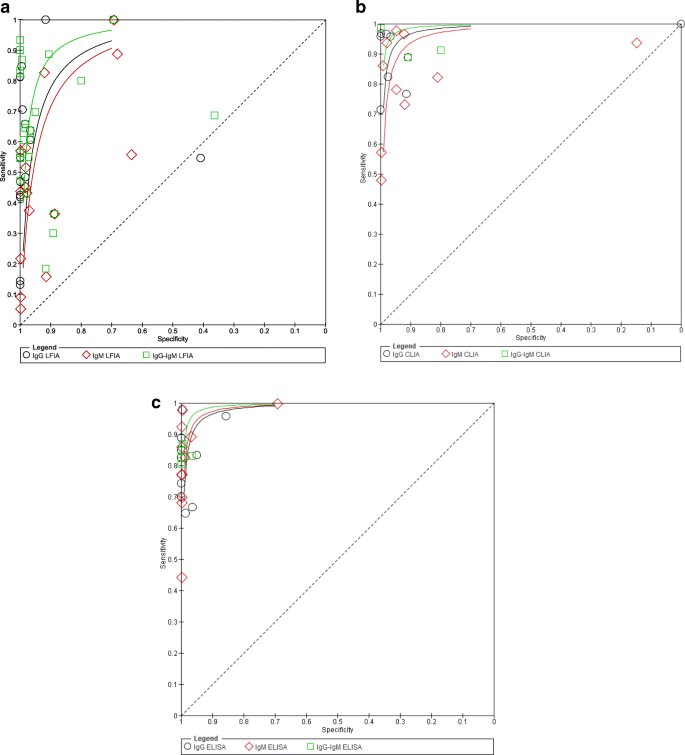
我们还构建了所有三种基于抗体的血清学测试的SROC曲线(图2)。8).但是,我们没有计算ROC (AUROC)下的面积。从SROC中,我们直观地评估了不同试验之间的异质性。对角线表示无用的测试,最好的测试集中在左上角。
采用双变量模型和分级总结受试者工作特征曲线(HSROC)模型评价血清学检测的诊断准确性。荟萃分析的结果(双变量和HSROC参数估计值,以及敏感性和特异性的总结值)见表2和无花果。9.与rt - pcr相比,基于IgG、IgM和IgG-IgM的LFIA检测的合并敏感性分别为0.5856、0.4637和0.6886。与rt - pcr相比,基于IgG和IgM的CLIA检测的合并敏感性分别为0.9311和0.8516。与rt - pcr相比,ELISA检测IgG、IgM和IgG-IgM的合并敏感性分别为0.8292、0.0.8388和0.8531。与rt - pcr相比,所有检测均具有较高的特异性,在0.9693 ~ 0.9991之间。未给出二元模型的估计SROC曲线。
hsroc还用于可视化地访问诊断测试的总体性能,访问测试的总体诊断准确性,并在综述中比较用于诊断COVID-19的不同测试的诊断准确性(图2)。9).总体诊断测试的准确性是通过曲线接近左上角来衡量的,这代表了高敏感性和特异性。曲线越靠近左上角,诊断准确率越高[55].从无花果。9,可以观察到ELISA和CLIA的诊断准确率优于LFIA,基于IgG-IgM的ELISA检测的总体诊断准确率最好。重要的是,值得注意的是,在这项研究中,证据基础太薄弱,无法明确地说明一类测试比另一类测试更准确。
我们确定了一项研究(Burbelo, 2020)报告了基于总抗体(Ab)的荧光素酶免疫沉淀测定系统(LIPS),使用N和S抗原,敏感性和特异性分别为0.91 (95% CI 0.77-0.99)和1.00(0.80-1.00)和1.00(0.92-1.00)和1.00(0.92-1.00)。我们还发现了其他基于Ab的血清学分析和基于IgA的血清学分析的研究,但在本综述中没有报道结果。
非均质性调查
总体来说是高的我^ 2除了基于IgG-IgM的ELISA外,当我们进行抗原亚群荟萃分析时,观察到敏感性和特异性均高于85%,表明高度异质性。基于IgG-IgM的ELISA具有整体敏感性我^ 252的值。12%,这被认为是中度异质性和总体特异性我^ 20%的值被认为是低异质性。然而,值得注意的是,本次亚组荟萃分析只纳入了5项研究。整体我^ 2抗原类型亚组元分析的敏感性和特异性异质性值见表3..我们没有调查LFIA的异质性,因为本综述中包括的大多数研究没有明确他们在血清学测试中使用的抗原类型。
每个测试类型和抗体类型组合的不同抗原类型敏感性和特异性的异质性的详细结果在附加文件中提出2.
根据症状出现后的时间测试敏感性
数字10显示IgG(25次试验)、IgM(22次试验)和IgG-IgM(30次试验)抗体阳性率的森林图,按从最初症状出现到标本采集的天数分层。血清学检测的敏感性一般随着症状发作时间的增加而增加。无论采用何种检测方法(ELISA、CLIA或LFIA),基于IgG和IgM的检测通常在症状出现的第一周(1-7天)敏感性较低,其次是第二周(7-14天),每次检测的敏感性通常在第三周或之后(> -14天)最高。由于症状发作,所有的研究都无法获得通过标本收集分层的特异性数据。
讨论
COVID-19是全球卫生保健面临的重大挑战。限制SARS-CoV-2传播的一个关键方面是确保早期和准确诊断病毒感染。在本研究中,我们进行了一项荟萃分析,以评估基于IgG和IgM的血清学检测用于检测rRT-PCR阳性SARS-CoV-2患者抗原的诊断准确性。荟萃分析显示,与rRT-PCR相比,所有血清学检测均具有较高的特异性,范围为0.9693 (95% CI 0.855-0.9941)至0.9991 (95% CI 0.9778-1)。Wang等人、Bastos等人和Deeks等人的荟萃分析观察到相似的汇集特异性,范围从0.95 (95% CI 0.91-0.98)到99.6 (97.3 - 99.9)[56,57,58].所有血清学检测的敏感性在各个研究中差异很大。COVID-19血清学检测依赖于与SARS-CoV-2核衣壳蛋白、刺突蛋白或刺突蛋白片段(即受体结合域)结合的抗体。一些测试或测试设备甚至使用N和S蛋白和蛋白质片段的组合。这可能导致在不同的血清学测定中观察到的不一致[59].总体而言,基于IgG-IgM的ELISA诊断准确率较高,敏感性和特异性分别为0.8531 (95% CI 0.7851 ~ 0.9023)和0.9991 (95% CI 0.9778-1)。基于IgG的CLIA敏感性最高,为0.9311 (95% CI 0.9309 ~ 0.9312)。合并敏感性结果与其他荟萃分析一致,表明在每个抗体类别中,POC LFIA的敏感性低于CLIA和ELISA [56,57,58].然而,必须指出的是,Deeks等人的荟萃分析发现,对于IgG和IgG- igm,浓度梯度免疫分析法POC LFIA的池化敏感性高于ELISA [56].
与其他荟萃分析相似,在每种测试方法中,基于IgM的血清学检测与基于IgG的血清学检测相比敏感性最低[56,57,58].低抗体浓度,特别是基于IgM的血清学检测的时机,可能解释了基于IgM的检测识别SARS-CoV-2感染者的能力较低。值得注意的是,在一个人被感染后,抗体可能还没有产生,或者IgM抗体可能已经减少或消失[60].
一般来说,以IgG-IgM为基础的联合血清学分析似乎比单独测量任何一种抗体类型的敏感性更好,尽管在本综述中,由于研究数量有限,我们没有估计以IgG-IgM为基础的CLIA的汇总敏感性。使用开放元分析的亚组元分析显示,使用S抗原的基于IgM的血清学分析比使用N抗原检测的基于IgM的血清学分析更敏感,这可能是由于对S抗原更高的敏感性和更早的免疫反应[32].然而,亚组荟萃分析显示,使用N抗原的基于IgG的血清学分析比使用S抗原的基于IgG的血清学分析更敏感。
本综述的敏感性和特异性估计值用于临床实践中使用该检测时的检测结果。使用metaDTA计算患病率估计数[61]来预测在实践中有多少患者会在给定的患病率中出现真阳性、假阳性、真阴性和假阴性结果,这是基于荟萃分析结果,并给出了一些临床背景。以总体诊断准确率最高的基于IgG-IgM的ELISA检测为例,在1000例患者和COVID-19患病率为50%的情况下,我们预计432例(95% CI 394-486)患者的SARS-CoV-2检测呈阳性,其中427例(95% CI 393-451)为真阳性(患病且检测呈阳性),5例(95% CI 1-35)为假阳性(未患病但检测呈阳性)。我们还注意到568例(95% CI 514-606)患者COVID-19检测呈阴性,其中495例(95% CI 465-499)为真阴性(未患病,检测呈阴性),73例(95% CI 49-107)为假阴性(患病,检测呈阴性)。
1%的流行率和1000例患者意味着19例(95% CI 9-79) SARS-CoV-2检测呈阳性,9例(95% CI 8-9)为真阳性,10例(95% CI 1-70)为假阳性,981例(95% CI 921-991)为阴性,980例(95% CI 920-989)为真阴性,1例(95% CI 1-2)为假阴性。这意味着假阳性患者将在患有其他疾病的同时接受COVID-19治疗,从而推迟最终诊断和随后的治疗。在假阴性的情况下,COVID-19的诊断会被遗漏或延迟,患者不会被隔离,从而将SARS-CoV-2传播给医院/诊所的其他患者。尽管如此,尽管这样的计算为测试的结果提供了洞察,但我们应该谨慎对待。
采用基于IgG-IgM的试验进行LIFA推理[敏感性0.6886(0.5878-0.7742),特异性0.9757(0.9466-0.9892)]。我们看到,在1000名患者中,COVID-19患病率为50%,我们预计356名(95% CI 299-414)患者的SARS-CoV-2检测呈阳性,其中324名(95% CI 294-387)为真阳性,12名(95% CI 5-27)为假阳性。我们还预计644名(95% CI 586-701)患者的COVID-19检测呈阴性,其中488名(95% CI 473-495)为真阴性,156名(95% CI 113-206)为假阴性。1%的患病率和1000例患者意味着31例(95% CI 16-62) SARS-CoV-2检测呈阳性,7例(95% CI 6-8)为真阳性,24例(95% CI 10-54)为假阳性,969例(95% CI 938-984)为阴性,966例(95% CI 936-980)为真阴性,3例(95% CI 2-4)为假阴性。与基于IgG-IgM的ELISA相比,基于IgG-IgM的LFIA具有更高的假阳性和假阴性率。
限制
SARS-CoV-2的血清学检测存在准确性问题,值得关注。他们测量特定的抗体反应,这些反应可能在疾病发作后需要几周才能产生,从而降低了检测的敏感性。如果在感染早期采集血液样本,可能会产生假阴性结果。它们不能直接检测到病毒的存在。此外,当SARS-CoV-2不再存在时,可能会出现抗体,从而导致假阳性病例诊断。此外,由于SARS-CoV-2和SARS-CoV的N蛋白的同一性高达91.2%,因此SARS-CoV的N蛋白与其他人类冠状病毒抗体之间存在交叉反应的可能性。其他分子包括干扰素、类风湿因子和非特异性IgM可能导致假阳性结果[42].
荟萃分析中纳入的大多数研究为病例对照研究。这些方法可能比横断面设计更容易在实验室环境中进行,但其结果在临床实践中不太具有代表性。诊断测试的性能在很大程度上取决于使用该测试的人群。因此,未来的研究应该是前瞻性的横断面研究,包括一个连续的患者样本。
需要评估指标试验以确定其敏感性和特异性,理想情况下可与标准确证试验进行比较。rRT-PCR是COVID-19的标准确证检测方法,其一个重要限制是存在假阴性结果的风险[62].两篇关于rt - pcr COVID-19检测准确性的综述报告称,基于rt - pcr检测阴性而重复rt - pcr检测阳性的假阴性率在2%至29%之间[63,64].rRT-PCR试验假阴性结果可导致血清学试验(指标试验)特异性降低。rRT-PCR阴性结果被血清学检测作为阳性检测将被视为假阳性,从而降低血清学检测的特异性。为了减少假阴性结果,Bastos等人建议,标准确认试验应包括对至少两个连续标本进行RT-PCR,如果可能,必须包括病毒培养[57].
结论
鉴于目前LFIA设备的性能不佳,我们建议进行更多的研究,以开发高灵敏度和特异性POC LFIA,以满足大多数个体患者的应用,并吸引大量的血清流行率研究。使用CLIA和ELISA进行诊断具有较高的敏感性,与使用rRT-PCR相当。它们可以被校准为特异性检测和定量SARSCoV-2 IgM和IgG。应收集更多的血清学数据,以阐明IgG和IgM血清学测量在检测COVID-19有症状和无症状病例中的临床和流行病学应用。
数据和材料的可用性
原始数据(数据提取结果)将在合理要求后提供共享。
缩写
- COVID-19:
-
2019冠状病毒病
- “非典”:
-
严重急性呼吸系统综合症
- SARS-CoV-2:
-
严重急性呼吸综合征冠状病毒2
- 标准:
-
诊断准确性研究报告标准
- QUADAS-2:
-
诊断准确性研究的质量评估
- rrt - pcr:
-
实时逆转录聚合酶链反应
- PRISMA-DTA:
-
诊断测试准确性的系统评价和元分析的首选报告项目
- DTA:
-
诊断测试的准确性
- RT-qPCR:
-
实时定量聚合酶链反应
- POC:
-
医疗点
- LFIA:
-
横向流动免疫测定
- CLIA:
-
化学发光酶免疫分析法
- FIA:
-
荧光
- EISA:
-
酶联免疫测定
- 嘴唇:
-
荧光素酶免疫沉淀测定系统
- 史:
-
SARS-CoV-2刺突蛋白
- 护士:
-
新型冠状病毒核衣壳蛋白
- 艾凡:
-
SARS-CoV-2包膜蛋白
- HSROC:
-
分级汇总接收者操作特性
- TP:
-
真阳性
- FN:
-
假阴性
- 外交政策:
-
假阳性
- TN:
-
真正的负
参考文献
Ludvigsson摩根富林明。对儿童COVID-19的系统回顾显示,病例较轻,预后优于成人。儿科学报2020;109(6):1088-95https://onlinelibrary.wiley.com/doi/abs/10.1111/apa.15270.引用2020年5月27日。
任丽丽,王永明,吴志强,项志成,郭林,徐涛,等。导致人类严重肺炎的新型冠状病毒的鉴定。中国医学杂志2020;133(9):1015-24http://journals.lww.com/10.1097/CM9.0000000000000722.引用2020年5月28日。
情况总结|疾控中心。可以从:https://www.cdc.gov/coronavirus/2019-ncov/cases-updates/summary.html.2020年5月27日
美国国立卫生研究院(NIH) COVID-19研究性疫苗临床试验开始。可以从:https://www.nih.gov/news-events/news-releases/nih-clinical-trial-investigational-vaccine-covid-19-begins.2020年5月27日
截至2020年11月11日全球COVID-19疫情最新情况。可以从:https://www.ecdc.europa.eu/en/geographical-distribution-2019-ncov-cases.引用2020年11月12日
冠状病毒可以从:https://www.who.int/health-topics/coronavirus#tab=tab_1.引用2020年11月12日
2019冠状病毒病(COVID-19)疫情报告-63要点。https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports
郭林,任林,杨松,肖明,常东,杨峰,等。临床传染病®2020;XX(XX):1-8。可以从:https://academic.oup.com/cid/advance-article-abstract/doi/10.1093/cid/ciaa310/5810754.引用2020年5月28日
SARS-CoV-2诊断检测。可以从:https://www.who.int/publications/i/item/diagnostic-testing-for-sars-cov-2.引用2020年11月18日
杜国强,曾永泰,梁文伟,谭锐,吴廷忠,龙志强,等。SARS-CoV-2感染期间后口咽唾液样本病毒载量和血清抗体反应的时间分布:一项观察性队列研究《柳叶刀》感染杂志2020;20(5):565-74。
韦克玛拉特娜P, Paton RS, Ghafari M, Lourenco J. SARS-CoV-2 RT-PCR假阴性检出率的估算。medRxiv。可从:https://doi.org/10.1101/2020.04.05.20053355.引用2020年5月28日。
李东,王东,董娟,王楠,黄辉,徐辉,等。严重急性呼吸综合征冠状病毒2的实时逆转录聚合酶链反应假阴性结果:基于深度学习的ct诊断的作用和两例病例的启示中国放射学报。2020;21(4):505-8。https://doi.org/10.3348/kjr.2020.0146.
郭林,任林,杨松,肖明,常东,杨峰,等。新型冠状病毒病(COVID-19)的早期体液反应分析。临床感染病2020;可以从:http://www.ncbi.nlm.nih.gov/pubmed/32198501.引用2020年4月2日。
张伟,杜荣荣,李波,郑秀生,娄玉玺,胡波,等。新型冠状病毒感染患者的分子和血清学调查:多种脱落途径的意义新兴微生物感染。2020;9(1):386-9https://www.tandfonline.com/doi/full/10.1080/22221751.2020.1729071.引用2020年5月28日。
钱超,周敏,程峰,林霞,龚颖,谢欣,等。首个全自动SARS-CoV-2 IgM和IgG免疫测定方法的开发和多中心性能评估。medRxiv。2020:2020.04.16.20067231。
检验医学在2019冠状病毒疾病(COVID-19)和其他病毒爆发期间的关键作用:临床化学和检验医学(CCLM) -印刷前。可以从:https://www.degruyter.com/view/journals/cclm/ahead-of-print/article-10.1515-cclm-2020-0240/article-10.1515-cclm-2020-0240.xml.引用2020年5月28日
McInnes MDF, Moher D, Thombs BD, McGrath TA, Bossuyt PM, Clifford T,等。PRISMA-DTA声明用于诊断测试准确性研究的系统评价和元分析的首选报告项目。《美国医学协会杂志》上。2018, 319(4): 388 - 96。https://doi.org/10.1001/jama.2017.19163.
Macaskill P, Gatsonis C, Deeks J, harper R, Takwoingi Y. Cochrane诊断试验准确性系统评价手册第10章分析和呈现结果。可以从:http://srdta.cochrane.org/.2020年5月31日
莱姆病血清学检测诊断准确性的系统文献综述2016.
Steingart KR, Henry M, Laal S, Hopewell PC, Ramsay A, Menzies D,等。商业血清学抗体检测试验用于肺外结核诊断的系统回顾。英国医学杂志出版集团有限公司2007;83:705-12
Volpe Chaves CE, do Valle Leone de Oliveira SM, Venturini J, Grande AJ, Sylvestre TF, Poncio Mendes R,等。慢性肺曲霉菌病血清学诊断的准确性:系统回顾和荟萃分析。PLoS One. 2020;15(3):e0222738https://dx.plos.org/10.1371/journal.pone.0222738.阿加瓦尔,编辑。引用2020年5月31日。
Abba K, Deeks JJ, Olliaro PL, Naing C-M, Jackson SM, Takwoingi Y,等。在流行国家诊断无并发症恶性疟的快速诊断试验。(7). Cochrane Database Syst Rev. 2011;
Whiting PF, Rutjes AWS, Westwood ME, Mallett S, Deeks JJ, Reitsma JB,等。Quadas-2:诊断准确性研究质量评估的修订工具。美国内科医师学会2011;155:529-36
Takwoingi Y, Riley RD, Deeks JJ。心理健康诊断准确性研究的元分析。循证心理健康。2015;18(4):103-9。https://doi.org/10.1136/eb-2015-102228.
希金斯分卫,汤普森得分后卫,Deeks JJ, Altman DG。测量元分析中的不一致性。Br Med J. 2003; 327:57 - 60英国医学杂志出版集团
Ochodo EA, Gopalakrishna G, Spek B, Reitsma JB, van Lieshout L, Polman K,等。流行地区用于诊断活动性血吸虫病的循环抗原试验和尿试剂条。Cochrane Database Syst Rev. 2015;
杜凯旺,曾德贤,梁伟生,谭伟文,吴天春,龙东,等。SARS-CoV-2感染期间后口咽唾液样本病毒载量和血清抗体反应的时间分布:一项观察性队列研究2020;可以从:www.thelancet.com/infection.2020年5月31日
Cassaniti I, Novazzi F, Giardina F, Salinaro F, Sachs M, Perlini S,等。VivaDiag COVID-19 IgM/IgG快速检测结果不适用于急诊患者的COVID-19诊断。中国医学病毒学杂志。2020:jmv.25800可以从:https://onlinelibrary.wiley.com/doi/abs/10.1002/jmv.25800.引用2020年5月28日。
林东,刘磊,张敏,胡勇,杨强,郭俊,等。COVID-19疫情期间新型冠状病毒(SARS-CoV-2)感染的血清学检测诊断评价medRxiv。可从:https://www.medrxiv.org/content/10.1101/2020.03.27.20045153v1.引用2020年5月31日。
项健,闫敏,李华,刘涛,林超,黄松,等。新型冠状病毒(SARS-Cov-2)酶联免疫分析和胶体金免疫层析检测试剂盒的评价medRxiv。2020.02.27.20028787可从:https://doi.org/10.1101/2020.02.27.20028787.引用2020年5月31日。
刘荣,刘旭,韩华,马雪玲,牛智,李东,等。IgM-IgG抗体检测在SARS-CoV-2感染诊断中的相对优势medRxiv。2020:2020.03.28.20045765。
刘伟,刘磊,寇刚,郑勇,丁勇,倪伟,等。基于核衣壳和Spike蛋白的elisa检测SARS-CoV-2抗体的评价。临床微生物学杂志,2020;58(6)。
陈娟,胡娟,龙强,邓华,范凯,廖鹏,等。肽基磁化学发光酶免疫测定1雪飞。medrxiv.org。2020.02.22.20026617可从:https://doi.org/10.1101/2020.02.22.20026617.引用2020年5月31日。
潘勇,李旭,杨刚,范军,唐勇,赵娟,等。血清免疫层析法在新型冠状病毒感染患者诊断中的应用medRxiv。2020:2020.03.13.20035428。
金勇,王敏,左智,范超,叶峰,蔡智,等。2019冠状病毒病血清抗体的诊断价值及动态方差分析。Int J infection Dis. 2020; 94:49-52https://doi.org/10.1016/j.ijid.2020.03.065.引用2020年5月31日。
赵娟,袁强,王辉,刘伟,廖旭,苏勇,等。2019年新型冠状病毒病患者对SARS-CoV-2的抗体应答临床感染病2020;可以从:http://www.ncbi.nlm.nih.gov/pubmed/32221519.引用2020年4月2日。
李震,易勇,罗旭,熊宁,刘勇,李松,等。快速诊断SARS-CoV-2感染的IgM-IgG联合抗体检测方法的建立及临床应用J Med Virol. 2020;可以从:http://www.ncbi.nlm.nih.gov/pubmed/32104917.引用2020年4月2日。
赵睿,李敏,宋辉,陈杰,任伟,冯勇,等。SARS-CoV-2抗体血清学诊断试剂盒,使用cho表达的全长sars - cov - 2s1蛋白。medRxiv。可从:https://www.medrxiv.org/content/10.1101/2020.03.26.20042184v1.引用2020年5月31日。
张鹏,高强,王涛,柯勇,莫峰,贾锐,等。重组核衣壳和刺突蛋白用于新型冠状病毒病血清学诊断的评价。medRxiv。2020.03.17.20036954可从:https://www.medrxiv.org/content/10.1101/2020.03.17.20036954v1.引用2020年5月31日。
Paradiso AV, De Summa S, Loconsole D, Procacci V, salustio A, Centrone F,等。SARS-Co2 RT-PCR快速血清学检测的临床意义medRxiv。2020:2020.04.03.20052183。
马红,曾伟,何辉,赵东,杨勇,姜东,等。新型冠状病毒肺炎的诊断及血清特异性IgA、IgM、IgG的定量敏感免疫分析medRxiv。2020:2020.04.17.20064907。
钟玲,传杰,龚波,帅鹏,周勇,张勇,等。血清IgM和IgG检测用于COVID-19诊断。中国生物医学工程学报,2020;29(5):344 - 344。https://doi.org/10.1007/s11427-020-1688-9中国科学出版社。
谢娟,丁超,李娟,王勇,郭华,陆忠,等。通过IgM-IgG抗体检测确诊的COVID-19患者的特征。中国医学病毒学杂志。2020:jmv.25930可以从:https://onlinelibrary.wiley.com/doi/abs/10.1002/jmv.25930.引用2020年5月31日。
Infantino M, Grossi V, Lari B, Bambi R, Perri A, Manneschi M,等。自动化学发光免疫测定抗sars - cov -2 IgM和IgG抗体的诊断准确性:意大利的经验中国医学病毒学杂志。2020:jmv.25932可以从:https://onlinelibrary.wiley.com/doi/abs/10.1002/jmv.25932.引用2020年5月31日。
采用ELISA和横向流动免疫分析法对SARS-CoV-2抗体检测的评估。可以从:https://doi.org/10.1101/2020.04.15.20066407.2020年5月31日
Lassaunière R, Frische A, Harboe ZB, Nielsen AC, Fomsgaard A, Krogfelt KA,等。9种商用SARS-CoV-2免疫检测方法的评估。medRxiv。2020:2020.04.09.20056325。
王强,杜强,郭波,穆东,陆霞,马强,等。一种预防SARS-CoV-2 IgM金免疫层析和酶联免疫吸附假阳性的方法临床微生物学杂志,2020;58(6)。
娄波,李涛,郑松,苏勇,李震,刘伟,等。SARS-CoV-2暴露以来及发病后的血清学特征medRxiv。2020:2020.03.23.20041707。
刘玲,刘伟,王松,郑松。238例住院患者SARS-CoV-2冠状病毒血清学检测的初步研究medRxiv。2020:2020.03.06.20031856。
今井K, Tabata S,池田M,野口S,北川Y,松冈M,等。免疫层析IgM/IgG抗体测定和胸部ct诊断COVID-19的临床评价medRxiv。2020:2020.04.22.20075564。
Garcia FP, Tanoira RP, Cabrera JPR, Serrano TA, Herruz PG, Gonzalez JC。免疫层析仪检测IgG和IgM抗体快速诊断SARS-CoV-2感染:一项前瞻性单中心研究medRxiv。2020:2020.04.11.20062158。
陈震,张震,翟旭,李勇,林林,赵华,等。基于镧掺杂纳米颗粒的横向流动免疫分析法快速、灵敏检测抗sars - cov -2 IgG。肛门化学,2020年。
Döhla M, Boesecke C, Schulte B, Diegmann C, Sib E, Richter E,等。在社区筛查环境中对SARS-CoV-2进行快速护理点检测的敏感性较低。公共卫生,2020;182:170-2。https://doi.org/10.1016/j.puhe.2020.04.009.
Burbelo PD, Riedo FX, Morishima C, Rawlings S, Smith D, Das S,等。COVID-19患者SARS-CoV-2核衣壳抗体检测比Spike蛋白抗体检测更敏感。medRxiv。2020:2020.04.20.20071423。
诊断试验评价中的受试者工作特征曲线分析技术综述。Ann Thorac外科,2005年1月1日;79(1):16-20。https://doi.org/10.1016/j.athoracsur.2004.09.040.
Deeks JJ, Dinnes J, Takwoingi Y, Davenport C, Spijker R, Taylor-Phillips S,等。用于识别当前和过去感染SARS-CoV-2的抗体检测。Cochrane数据库系统版本2020;https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013652/full.约翰威利父子有限公司引用2021年3月19日。
Lisboa Bastos M, Tavaziva G, Abidi SK, Campbell JR, Haraoui LP, Johnston JC,等。covid-19血清学检测的诊断准确性:系统综述和荟萃分析BMJ。2020;370:2516可从:https://connect.medrxiv.org/relate/content/181.引用2021年3月19日。
王慧,艾杰,Loeffelholz MJ,唐玉文,张伟。COVID-19血清学检测诊断性能的meta分析:检测方法设计和症状发作后间隔的影响。新兴微生物感染。2020;9(1):2200-11https://www.tandfonline.com/doi/full/10.1080/22221751.2020.1826362.引用2021年3月19日。
张旭,吴旭,王东,陆明,侯旭,王宏,等。早期COVID-19感染中差异表达SARS-CoV-2抗体的全蛋白质组分析medRxiv。可从:https://www.medrxiv.org/content/10.1101/2020.04.14.20064535v2?%253fcollection=.引用2020年5月31日。
孔头·皮,Braliou GG,迪穆·NL, Nikolopoulos G, Bagos PG. SARS-CoV-2感染的抗体检测:一项荟萃分析。medRxiv。2020.04.22.20074914可从:http://medrxiv.org/content/early/2020/04/25/2020.04.22.20074914.abstract.引用2020年5月31日。
Freeman SC, Kerby CR, Patel A, Cooper NJ, Quinn T, Sutton AJ。开发一个交互式的基于网络的工具来进行和询问诊断测试准确性研究的元分析:MetaDTA。中国医学杂志,2019;19(1)。
Tahamtan A, ari A.实时RT-PCR在COVID-19检测中的应用:影响结果的问题。专家Rev Mol诊断。2020;20:434 - 4可从:https://www.tandfonline.com/doi/abs/10.1080/14737159.2020.1757437.泰乐弗朗西斯有限公司引2020年11月18日。
沃森J,怀廷PF,布莱斯JE。解读covid-19检测结果。BMJ。2020;369可从:https://calculator.testingwisely.com/playground.BMJ出版集团。引2020年11月18日。
Arevalo-Rodriguez I, Buitrago-Garcia D, simanas - racines D, Zambrano-Achig P, del Campo R, Ciapponi A,等。COVID-19初始RT-PCR检测假阴性结果:一项系统综述。medRxiv。可提供方:https://doi.org/10.1101/2020.04.16.20066787.引2020年11月18日。
Ecdc。对莱姆病血清学检测诊断准确性的系统文献综述。可以从:www.ecdc.europa.eu.引用2020年11月19日
确认
不适用
资金
这项研究是由英国国家卫生研究所(NIHR)全球卫生研究项目(16/136/33)委托进行的,使用了英国政府的援助。本出版物中表达的观点是作者的观点,不一定是国家卫生研究院或卫生和社会保健部的观点。
作者信息
作者及隶属关系
贡献
AV和TM构思并设计了研究方案。AV、HM、HM、TLMJ、MK进行综合文献检索,筛选文献,提取资料。AV进行了统计分析。TN, FM, SR和TM提供指导。作者们阅读并批准了手稿的最终版本。
相应的作者
道德声明
伦理批准并同意参与
不适用
发表同意书
不适用
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
附录
附录1
PubMed中的搜索策略
| 搜索 | 查询 | 项发现 |
|---|---|---|
| # 20 | 搜索(((((COVID-19[标题/摘要])或SARS-CoV-2[标题/摘要])或2019-nCoV[标题/摘要])或武汉冠状病毒[标题/摘要]))和(((((((((((((血清学检测)或血清学方法)或血清学方法)或血清学方法)或免疫诊断(或免疫诊断)或免疫方法)或抗体检测(或抗原检测)或IgM或IgG)或免疫层析) | 78 |
| # 19 | 搜索((((((((((((血清学测试)或血清学测试)或血清学方法)或血清学诊断)或免疫诊断)或免疫测试)或免疫方法)或抗体检测)或抗原检测)或IgM或IgG)或免疫层析法 | 822733 |
| # 18 | 搜索免疫层析法 | 69624 |
| # 17 | 搜索免疫球蛋白 | 143941 |
| # 16 | 搜索IgM | 66041 |
| # 15 | 抗原检测 | 82456 |
| # 14 | 抗体检测 | 99123 |
| # 13 | 免疫学方法 | 39637 |
| # 12 | 免疫检测 | 456120 |
| # 11 | 搜索免疫诊断 | 450622 |
| # 10 | 搜索血清诊断 | 184574 |
| # 9 | 血清学方法 | 24322 |
| # 8 | 搜索血清学测试 | 191599 |
| # 7 | 血清学方法 | 16939 |
| # 6 | 血清学检查 | 184758 |
| # 5 | 搜索((COVID-19[标题/摘要])或SARS-CoV-2[标题/摘要])或2019-nCoV[标题/摘要])或武汉冠状病毒[标题/摘要] | 6734 |
| # 4 | 搜索武汉冠状病毒[标题/摘要] | 14 |
| # 3 | 搜索2019 - ncov[标题/文摘] | 547 |
| #2 | 搜索SARS-CoV-2[标题/文摘] | 1898 |
| # 1 | 搜索COVID-19[标题/文摘] | 5985 |
附录2
QUADAS-2项目的评级
1.病人的选择
1一个。偏差风险,信号问题
是否避免了病例对照设计?
▪病例对照设计,特别是包括健康对照的病例,具有很高的偏倚风险。因此,所有病例对照研究在总体判断中自动被评为高偏倚风险。
入选的患者样本是连续的还是随机的?
该研究是否避免了不恰当的排除?
总体判断:
▪病例对照研究总是被认为具有较高的偏倚风险。
▪横断面研究:只有当其他两个信号性问题的答案是“是”时,偏差风险才低。如果其中一个问题的答案是“否”,那么偏见的风险很高。否则“不清楚”。
1 b。关于适用性的关注:这涉及到纳入研究的患者(包括病例和对照组)在多大程度上具有接受这些血清学检测的患者的代表性。
是否担心纳入的患者与回顾问题不匹配?
▪所有病例对照研究默认被评为“高度关注”。所有的横断面研究都默认为“低关注”,除非用例定义不是很清楚。
2.指数测试
2 a。偏差风险,信号问题
是否在不了解参考标准结果的情况下解释了指标测试结果?
如果使用了阈值,是预先指定的吗?通过选择具有最高敏感性和/或特异性的临界值,研究人员人为地优化了测试的准确性,这可能会导致对敏感性和特异性的高估。POC LFIA阈值是预先指定的,信号是一条线或颜色的发展。
总体判断:
▪如果一项研究没有报告自动化检测的结果,并且没有明确提到盲法,则该测试自动被列为高风险。
▪如果有盲目性,第二个问题的答案是“是”,总体判断是“低”。
2 b。关于适用性的关注:这涉及评估的指数测试在多大程度上代表将在实践中使用的测试。
是否担心指数测试、其应用或解释偏离了审查问题?
▪所有内部测试都自动被评为“高度关注”。
▪如果POC LFIA使用的是血清或血浆样本,而不是血液,则检测自动被列为高度关注
对每项试验的偏倚风险和适用性问题分别进行评估。
3.参考标准
3 a。偏差风险,信号问题
参考标准可能正确地分类目标条件吗?
▪假设:使用“正确的”病例定义的病例对照研究可能会出现这种情况
▪对于使用“正确”案例定义的横断面研究也可能如此。
是否在不了解指标试验结果的情况下解释了参考标准结果?
▪假设:这可能是大多数病例对照研究的情况,但前提是血清学不属于病例定义的一部分。
▪对于横断面研究,应明确说明这一点。
总体判断偏倚风险:
▪具有明确病例定义的病例对照研究被评为“低”偏倚风险。
▪病例定义不清/错误的病例对照研究分别被评为“不清”或“高风险”偏倚
▪有明确案例定义的横断面研究,第二个问题的答案为“是”:偏倚风险低。
▪否则“不清楚”。
3 b。关于适用性的关注:是否关注参考标准所定义的目标条件与评审问题不匹配?
▪如果病例定义中包括血清学,则存在合并偏倚,因此偏倚风险较高。
▪如果病例对照研究使用明确的标准,并且这些标准中不包括血清学:偏倚的“低”担忧。
4.在流程和时间、信号问题上存在偏见的风险
指标试验与参考标准之间是否有适当的间隔?
▪我们预期采用横断面设计的研究在足够接近最终诊断的日期进行了大多数测试。如果我们有理由怀疑患者的状态在测试时间和诊断时间之间发生了变化,我们将其评级为“否”。
▪对于病例对照研究,这总是被评为“否”,因为血清学总是在定义病例定义后确定,有时会有很长时间的延迟。
患者是否接受相同的参考标准?
是否所有患者都被纳入分析?
▪在所有病例对照研究中,这被评为“否”。
总体判断:
▪病例对照研究总是被认为具有较高的偏倚风险。
▪对于横断面研究,如果三个问题的答案都是“是”,我们认为偏倚风险较低;如果至少有一个人的回答是“不”,那么就有很高的偏见风险。所有其他可能性都被评为“不清楚”。65].
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
文格赛,A,米兹,H,卡桑巴拉,M。et al。一项系统荟萃分析综述抗体在COVID-19血清学诊断中的诊断准确性。系统加速10, 155(2021)。https://doi.org/10.1186/s13643-021-01689-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13643-021-01689-3
关键字
- 血清学
- 新型冠状病毒肺炎
- SARS-CoV2
- rrt - pcr,
- 免疫球蛋白
- IgM
- 特异性
- 灵敏度