摘要
背景
乳腺柱状细胞病变(CCLs)的特征是覆盖末端导管小叶单元(TDLUs)的柱状细胞取代了常规的长方体上皮层。它还包括一系列病变,其特征是tdlu增大,腺泡变大,内衬柱状上皮细胞,范围从一层或两层良性上皮到具有非典型性的分层上皮。在过去的30年里,随着乳房x线摄影筛查扫描的使用越来越多,柱状细胞病变(CCLs)的诊断越来越频繁,通常与微钙化和异常钙化有关,需要乳房活检。本文献综述介绍了这一实体描述的历史发展,包括许多术语、CCLs类别、鉴别诊断、免疫组织化学特征和遗传改变、可重复性和临床意义。此外,还讨论了扁平上皮异型性(FEA)的意义,这是一种具有低级别细胞异型性的CCL。
实际考虑
FEA在乳腺活检中是一个常见的发现,对于病变区域内其他可能存在的实体来说,FEA应该是一个警告信号。由于ccl在乳腺增生性病变的诊断范围中越来越被认可,建议对普通病理学家进行适当的培训或指导,以教他们如何自信地识别ccl。具有复杂结构的导管内增生,如筛状模式、刚性细胞桥和真正的微乳头状模式不应归入FEA类别,最好归类为非典型导管增生(ADH)或导管原位癌(DCIS)。
结论
在ccl中,由于其异型性,FEA实际上受到更多的关注。FEA被认为是一种非专性癌前病变,据报道,这些病变向浸润性癌的进展越来越低(2-7%)。因此,对这些病变的处理仍存在争议,进一步的干预仅限于伴有其他癌前病变(ADH, DCIS)或影像学与病理不一致的病例。
定义
乳腺柱状细胞病变的特征是常规长方体上皮层被覆盖在末端导管小叶单元(TDLUs)的柱状上皮细胞所取代(Schnitt和Vincent-Salomon)2003)。在过去的30年里,随着乳房x线摄影筛查项目的增加,柱状细胞病变(CCLs)在乳房活检中被越来越多地诊断出来,通常是由于其与微钙化有关。
虽然在2003年才由Schnitt和Vincent-Salomon正式引入并正式组织为诊断实体(Schnitt和Vincent-Salomon2003), ccl一直都存在。长期以来,ccl一直困扰着研究人员,比如约翰·柯林斯·沃伦博士(Warren1905),他在1905年的一篇论文中将病变描述为“异常复旧”(abnormal involution)1906),他在1906年将这种增生描述为“老年性实质肥大的腺样囊性改变”。这种病变的描述与ccl相同。1920年,乔治·伦塔尔爵士(Sir George Lenthal Cheatle1920),描述了与腺泡扩张相同的异常,以及柱状上皮细胞群,并指出连续体到低级别导管原位癌是该病变的特征(Cheatle和Cutler1931)。五十年的冷漠终于被韦林斯等人打断了。1975),当他们将这些病变定义为“非典型性小叶,A型”时,John G. Azzopardi医生(Azzopardi . Azzopardi . Azzopardi)获得了更多的反应1979)描述,使用术语“低级别黏附癌”。
在这几十年里,ccl已被描述使用许多其他术语,如“柱状改变与突出的根尖口部和分泌物(CAPSS)”,弗雷泽等人,(弗雷泽等人。1998)“非典型囊性小叶”,作者:Oyama et al。1999),“增大的小叶单位与柱状改变(luga)”,McLaren et al. (McLaren et al.)2005)和“扁平导管上皮内瘤变(扁平DIN1a)”(Tavassoli et al。2003)和Moinfar (Moinfar .2009)。过多的术语和子类型令人困惑。这一系列病变的多个术语的存在,损害了关于患者预后管理和进化的回顾性评估,特别是当它们被认为是导管/小叶瘤变低级别雌激素受体通路的前体病变时。对术语演变的回顾可以在表中找到1.
柱状细胞病变的分类
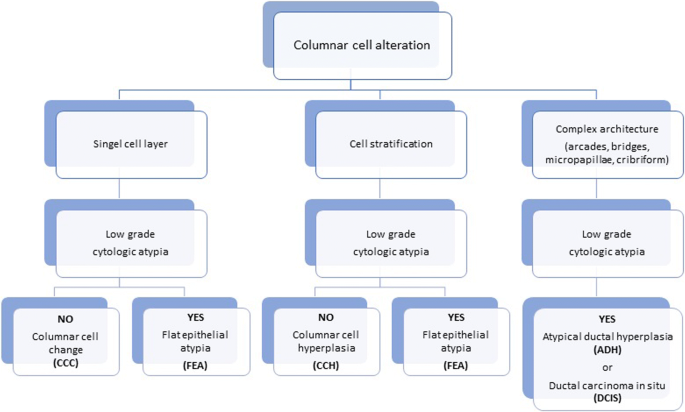
根据Schnitt和Vincent-Salomon的分类(Schnitt和Vincent-Salomon2003), CCLs分为“柱状细胞改变(CCC)”和“柱状细胞增生(CCH)”两大类。当存在非典型性时,病变进一步分为“非典型性柱状细胞改变”或“非典型性柱状细胞增生”。后两种类型后来被归为“扁平上皮异型性(FEA)”,无论是否存在增生。
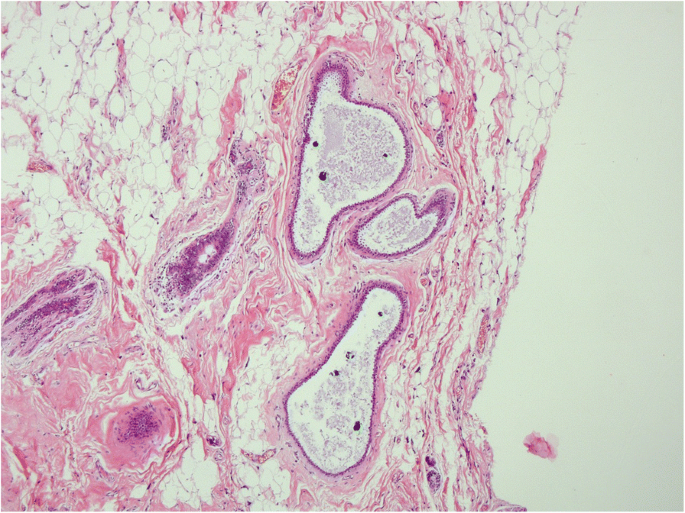
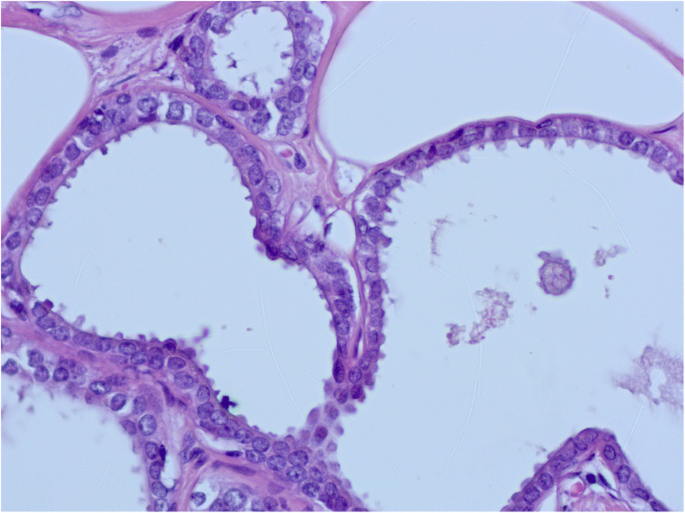
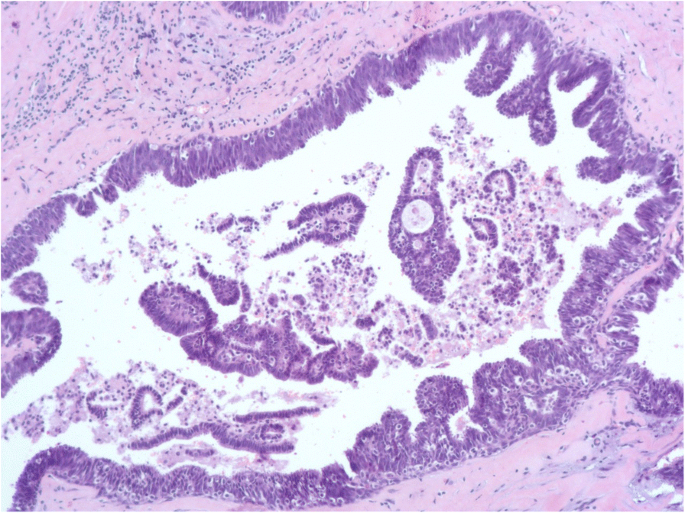
柱状细胞改变是CCL最简单的形式。其特征是TDLU扩张,上皮细胞呈高细胞,细胞核呈卵形或细长,垂直于基底膜。细胞核清淡,染色质细,无可见核仁。CCC还以存在分泌物为特征,如顶端细胞质泡或口鼻,通常与微钙化有关(Schnitt和Vincent-Salomon2003;O 'Malley等。2006;施尼特2003年,一个;Schnitt等人。1992)。CCC的增殖活性很低,在1 ~ 3%范围内,大多数细胞在免疫组化中表现出雌激素受体(ER)的表达量高于邻近正常乳腺小叶,可能是由于ER上调所致。(Dabbs2012)(无花果。1而且2)。
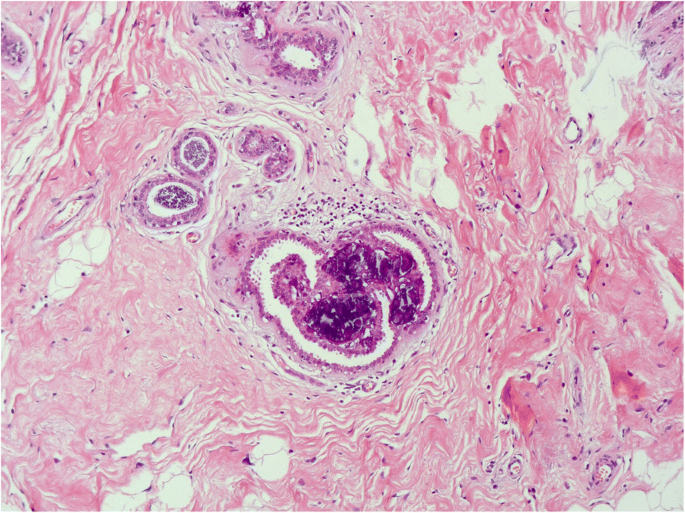
无异型性的柱状细胞增生(CCH)具有与CCC相同的细胞学标准,但表现为细胞分层,细胞层数超过两层,细胞拥挤或重叠,很少有小簇或小丘状细胞,但没有复杂的结构,有钝状微乳头突出(Schnitt和Vincent-Salomon)2003;施尼特2003年,一个;Schnitt等人。1992)。不存在异型性。与CCC相似,Ki-67指数为1 - 3%,ER表达在大多数细胞中上调(Dabbs2012)(无花果。3.而且4)。
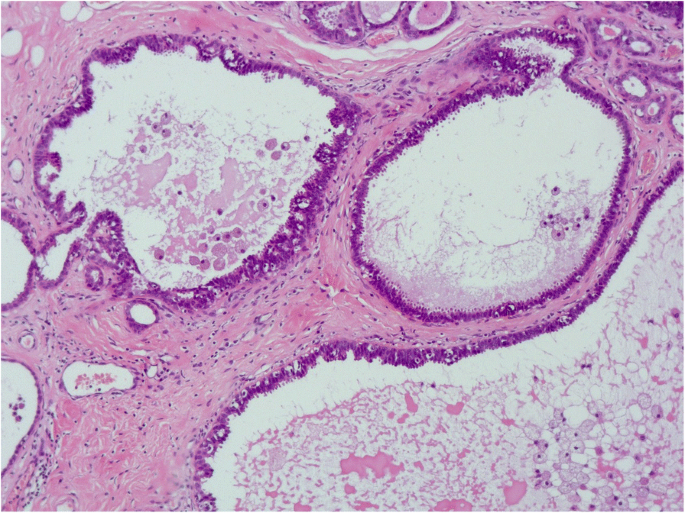
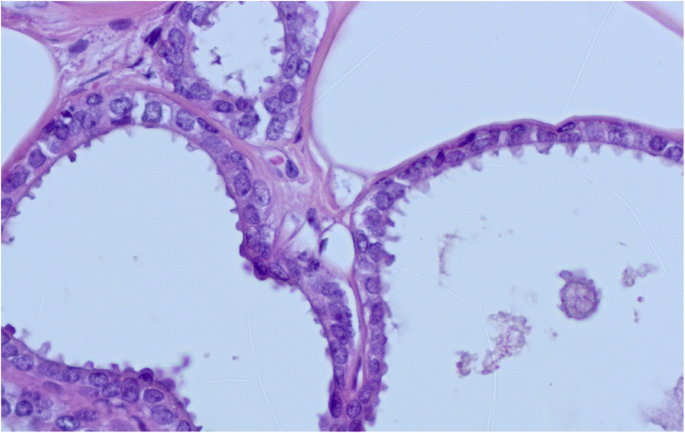
扁平上皮异型性(FEA)是一个术语,目前用于包括任何低级别细胞异型性(Schnitt2003 b)。该术语由世界卫生组织在2003年《WHO乳腺肿瘤分类》第3版中引入,以取代“依附癌,单形型”、“非典型囊性小叶”等术语,如“非典型小叶A型”、“非典型柱状改变”和“导管上皮内瘤变1A”(Tavassoli et al.)。2003)。它表现为无性增殖,多为低立方型柱状细胞。这些细胞形态单调,细胞核圆形至椭圆形(而不是拉长),明显增大,轻度深染,核质比增加,有时核仁突出,与基底膜垂直方向(极性)丧失(Dabbs)2012;施尼特2003 b)。细胞形态学特征类似于低级别导管原位癌(DCIS)。随着病变的增殖,细胞显示分层,但没有钝性、微乳头状突出或罗马桥(Schnitt2003 b)。它们保持平面模式(图。5,6而且7)。
鉴别诊断
CCC、CCH和FEA均表现为不规则扩张的tdlu,常含有分泌物和粗钙或颗粒状钙质碎片。FEA细胞核比CCC/CCH呈现更强烈的蓝色染色,反映细胞核增大和细胞拥挤。重要的是将FEA与其他ccl区分开来,因为FEA需要进一步的患者随访。
普通型导管增生(UDH):
有时,导管扩张和囊性改变伴常见增生可与扁平型异型相混淆。在UDH中,最接近细胞膜的基底细胞系可能呈现柱状特征,这导致了诊断上的挑战。然而,FEA显示增生性柱状细胞的细胞核单调深染,而UDH的细胞核呈流状且通常细长。细胞的重叠和堆积有助于区分UDH和FEA。
顶浆分泌损伤:
大汗腺化生是一种常见的鉴别诊断实体,表现为与CCC相似的扩张空间和钙化(Hicks和Lester2016)。此外,它可能有扁平或微乳头状的生长模式。这里的提示是识别低级别FEA,因为大汗腺化生通常有突出的核仁和特殊的嗜酸性颗粒,而FEA没有(Dabbs2012)。
非典型导管增生(ADH)和低级别DCIS:
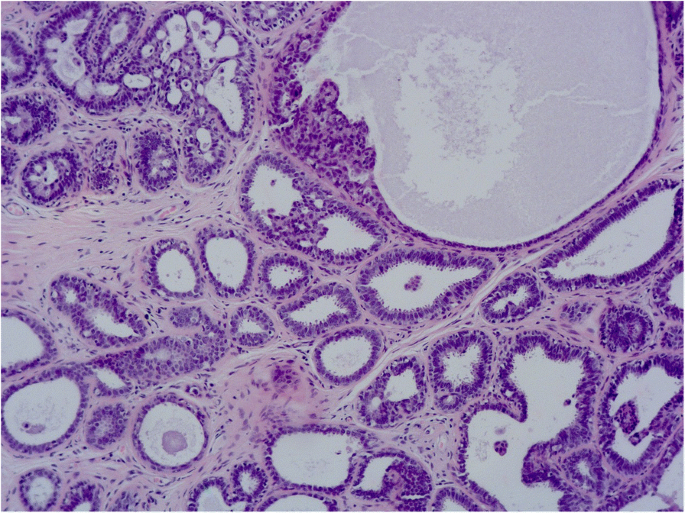
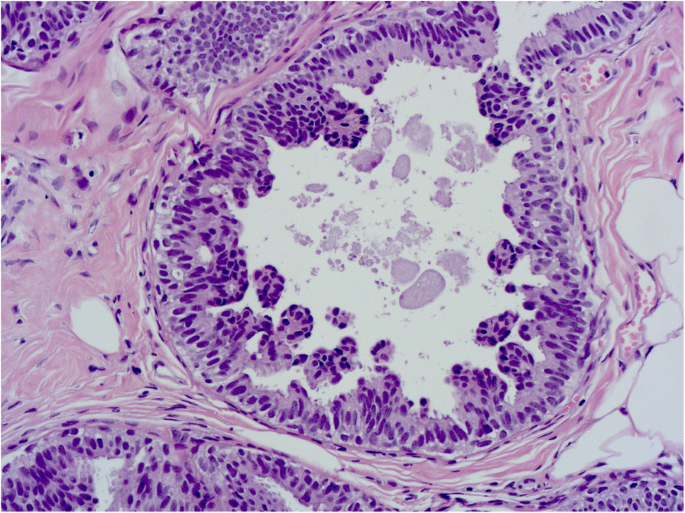
FEA与非典型导管增生(ADH)和低级别DCIS的区别在于ADH/DCIS中存在复杂的结构模式,如发育良好的微乳头、刚性细胞桥、栏杆和拱廊(罗马拱门)以及穿孔开窗(图2)。8而且9)。
高档平房DCIS:
具有显著核多形性的高级细胞异型性不是FEA的特征(Hicks和Lester2016)。在没有高级别DCIS的情况下,这种病变很少见,并伴有其他结构模式。此外,高级别DCIS常为HER-2阳性,er -阴性,有丝分裂指数高。FEA HER-2阴性,ER强阳性,很少出现有丝分裂征。
ccl的免疫组化特征
先前的研究评估了柱状细胞变化中几种标记物的免疫表达。这些细胞对广谱角蛋白混合物具有免疫反应性,如AE1/AE3和CAM 5.2。作为管腔层细胞,CCLs对CK5/CK6和34βE-12等高分子量细胞角蛋白表达呈阴性,对CK8/CK18和CK19表达呈阳性,表明其是分化良好的群体,因此不同于通常表达CK5/6的导管增生。此外,所有形式的CCLs在ER免疫染色(特别是ER-α)和PR上均呈强烈和弥漫性阳性,远高于正常上皮。雄激素受体(AR)表达增加也有报道(Schnitt2003 b)。根据CCH到FEA的进展,增殖Ki-67指数较高,从小于5%到FEA的更高水平。
虽然所有ccl的增殖都很低,但FEA通常对bcl-2(一种抗凋亡原癌基因相关蛋白)和细胞周期调节因子cyclin D1(一种细胞周期调节因子)呈阳性2012)。ER-α/ER-β在癌发生过程中表达比例增加,细胞周期蛋白D1和bcl-2的表达也增加,从而得出结论,FEA、ADH和小叶瘤可能代表了导致腔内a亚型乳腺癌发展的前体家族(Schnitt2003 b)(表2)。
目前,对于这些细胞改变的进行性行为,还没有预后或预测因素(Dabbs2012)。
ccl的基因改变
在ccl中,染色体改变在没有异型性的病变中很少见,而当存在异型性时则更常见。在有限元分析中,遗传改变是克隆性的,似乎是从无异型性的柱状细胞病变逐步积累到具有异型性的柱状细胞增生。此外,ccl在ADH或DCIS中观察到的一些染色体改变,甚至在同一样本或病变中存在的分化良好的侵袭性癌中也有相同的染色体改变(Simpson等。2005)。
Simpson等人对CCLs染色体改变进行了评估。2005)。作者通过比较基因组杂交(CGH)证明,FEA显示16q、17p和X的复发性损失,而15q、16p和19p的增加:同一标本的低级别原位癌(DCIS)和浸润性癌共有的改变。
在22例FEA中的17例中,Monfair et al. (Monfair et al.)2000)在他们的研究中评估的8个位点中,发现一个或多个位点存在杂合性缺失(LOH),特别是11q21-23.2, 16q23.1-24.2和3p14.2。同样,在邻近的原位癌或浸润性癌中也发现了这些基因改变(Monfair等。2000)。
达布斯等人。2006)在FEA中报告了9q、10q、17p和17q的LOH,与DCIS和浸润性癌相似。该研究表明,分子改变的患病率很低,但在CCC中发现的水平非常低,CCH、ADH和管状癌中携带的相同畸变越来越多,表明前体和浸润性管状癌之间存在分子“亲缘关系”。
这些结果提示,至少部分柱状细胞病变,特别是具有非典型性(即扁平上皮非典型性)的,可能是或成为肿瘤增生,甚至是低级别DCIS的非专性前兆,以及浸润性癌,特别是管状癌的前兆。另一种可能性是,它们是可能导致分化良好的癌的遗传变化的卫星表现的代表,因为它们通常是相关的。其他发现,如从CCL到DCIS的甲基化水平进展和浸润性癌证实了这一点(Park等。2011;Verschuur-Maes等人。2012)。
虽然在ccl中未证实高水平基因扩增,但在几个已知的乳腺癌相关基因中发现了拷贝数增加,如ER (ESR1)、CCND1(细胞周期蛋白D1)和CDH1,与DCIS和相同病变的浸润性癌相比,其进展模式相同(Verschuur-Maes等人)。2014)。由于观察到的拷贝数变化在DCIS和浸润性癌中比在ccl中更普遍,相应的基因改变可能代表低核级乳腺癌发生较晚的事件(Verschuur-Maes et al.)。2014)。有趣的是,在之前的免疫组化研究中,这些基因与过表达蛋白水平相关(Verschuur-Maes et al.)。2014)。
尽管CCLs早期基因改变的概念很重要,但尚未转化为临床管理。不幸的是,关于这一主题的数据仍然太少,为数不多的可用研究的特点是患者数量很少。
再现性
由于WHO书籍中对柱状细胞病变的适当描述和介绍(Tavassoli等。2003),一些作者研究了病理学家对CCLs形态诊断的可重复性。2012年,世卫组织第四版乳腺肿瘤分类(2012)对这一概念进行了重新评估,更好地描述了诊断标准(Abdel-Fatah et al.)。2007)。在此期间,一些作者试图由病理学家评估这些实体的可重复性。Haupt等人与14名病理学实习生一起工作。2010)报告了一个更好的一致性(kappa系数)后,一个适当的教程作为CCL诊断训练。谭等人(Tan et al.)2005)也在教程之后取得了同样的进步。
奥马利等人。2006)描述了一个近乎理想的一致性(91.8%,kappa = 0.83)在区分FEA与无异型性的ccl时,仅由乳腺病理学家评估乳腺活检。最近,Gomes et al. (Gomes et al.)2014)对153例由普通病理学家诊断为CCL的病例进行了更大规模的回顾性研究,这些病例后来由乳腺病理学专家进行了会诊。原始报告和后来的回顾之间的一致性很弱(FEA kappa = 0,38和0,47),这表明绝大多数普通病理学家需要适当的培训来识别ccl,因为诊断标准是近年来才定义的。
临床意义
在过去的15年里,关于CCLs患者的临床意义和适当的治疗已经发表了很多文章。1980年以后,随着筛查性乳房x线摄影项目的采用以及2003年Schnitt等人(Schnitt和Vincent-Salomon)的标准化和分类,ccl的诊断越来越多2003)。由于描述和出版物仍然缺乏统一的术语,确切的临床意义仍在发展中。然而,值得注意的重要关键特征是:1)是多灶性的,2)在围绝经期妇女中最常见,3)经常与微钙化相关,4)在乳腺活检中观察到孤立的乳腺病变或在同一区域与进行性非典型病变共存,如不典型导管增生(ADH)、小叶瘤变(小叶增生和小叶原位癌)、低级别DCIS。
在CCL的范围内,FEA是临床最关注的实体,通常在无症状患者的乳腺活检中发现频率越来越高,其中活检显示存在微钙化(Schnitt2003 c)。
有限元分析在乳腺核心活检中对患者管理的意义
FEA在世界卫生组织(WHO)的一本书(Tavassoli et al。2003),“可能是肿瘤导管内改变,其特征是将原生上皮细胞替换为多达五层没有建筑异型性的轻度非典型细胞。”这一定义使指定为FEA的病变范围更加严格和可重复。文献中关于单纯FEA患者的最佳治疗方法存在争议(在乳腺活检中未诊断出其他非典型或肿瘤病变)(Lakhani等)。2012)。一些研究小组建议切除病变,而另一些研究小组则采用更为保守的方法,仅建议进行乳房x线照相术随访评估。目前的国家综合癌症中心(NCCN)指南(国家综合癌症中心2017)表明FEA可能不需要手术切除,尽管适合观察的患者的识别尚不明确。最近,两个大型系列和一个元分析促成了一个更详细定义的建议。鲁丁等人。2017)回顾了2003年至2015年关于ADH或癌症的FEA和升级的250项研究。在对异质性进行统计调整后,根据WHO标准报告FEA的16项研究显示,癌症(DCIS或浸润性)的升级为7.5%,ADH的升级为18.6%。然而,值得注意的是,有10篇论文报道了未接受切除的FEA患者在几年后的癌症发病率仅为2%。
赛义德等人专门研究了乳腺癌的风险。2015)报道了282名FEA患者的结果,随访时间较长(平均17年),随后乳腺癌的最终相对风险仅为2。因此,我们似乎有不同的决定要考虑:通过活检诊断为FEA的乳腺病变患者的临床方法,以及根据癌症的相对风险进行长期管理。这种在FEA中明显的低估是与Rosen (Rosen1999年,一个),后来在分子生物学水平的研究中证实,FEA是包括ADH、FEA和管状癌在内的三元组的一部分(Said et al。2015)。
认识到FEA通常不是孤立的病变,可能与其他实体有关,有时更令人担忧,这表明对此类发现的适当评估和描述是重要的。
FEA常与其他柱状细胞改变相邻,如具有柱状特征的导管增生和柱状改变。它经常类似于Rosen所描述的“Rosen三位一体”,最近Abdel-Fatah等人也描述为非专定性三负途径(Rosen1999 b;阿卜杜勒-法塔赫等人。2007;Sahoo和Recant2005;阿卜杜勒-法塔赫等人。2008)。Said et al.也描述了这一特征。2015), FEA几乎普遍与其他增生性病变相关。
因此,总是建议仔细观察FEA病变周围,以发现给定乳房标本中包含的潜在增生性病变。通过提交剩余样本进行组织学检查,建议从整个样本的块或分析中获得额外的水平,以排除ADH或DCIS灶的存在(Schnitt2018)。
在手术治疗方面,一般认为只有柱状细胞改变或柱状细胞增生,无异型性的患者应继续保守观察。鲁丁等人。2017)建议对核心针活检中发现的FEA进行手术切除,这必须通过文献验证。然而,最近一些对FEA患者进行的研究表明,他们的癌症风险较低,为0-7% (Calhoum2018;Chan等人。2018;Schiaffino等人。2018)。没有其他高风险病变或放射-病理一致是避免手术切除的条件(Chan等。2018)。当然,在对有限元法有更好的理解之前,这个问题仍然存在争议。
当FEA与其他病变(如ADH或DCIS)一起报告时,与其他病变一样进行临床管理更为一致。在切除标本中,如果有DCIS或浸润性癌(Schnitt和Vincent-Salomon),边缘也应被认为是阳性2003)。
结论
在ccl中,由于其异型性,FEA实际上受到更多的关注。
具有复杂结构的导管内增生,如筛状图案、刚性细胞桥和真正的微乳头状图案不应归入FEA类别,最好归类为ADH或DCIS。
FEA被认为是一种非专性癌前病变,据报道,这些病变向浸润性癌的进展越来越低(2-7%)。这引起了对这些病变的管理的争议,进一步的干预仅限于有其他癌前病变(ADH, DCIS)或在放射学和病理学不一致的情况下。
建议对普通病理学家进行适当的培训或指导,以教他们如何自信地识别ccl。
参考文献
Abdel-Fatah TM, Powe DG, Hodi Z, Reis-Filho JS, Lee AH, Ellis IO(2008)低核级别浸润性乳腺癌及其假定的前体病变的形态学和分子进化途径:支持低核级别乳腺肿瘤家族概念的进一步证据。中华外科杂志32(4):513-523。https://doi.org/10.1097/PAS.0b013e318161d1a5PubMed midd: 18223478
Abdel-Fatah TM, Powe DG, Hodi Z等(2007)柱状细胞病变、小叶瘤变、低级别导管原位癌与浸润性小管癌和浸润性小叶癌共存的高发生率。Am J外科病理31:417-426
Azzopardi JG(1979)乳腺病理问题。在:病理学的主要问题。桑德斯,伦敦
老年女性乳腺实质肥厚与囊肿形成和癌的关系。妇科外科手术3:721-730
Calhoum BC(2018)乳房核心针活检:当代数据的评估。外科病理临床11:1-16
Chan PMY, Chotai N, Lai ES, Sin PY, Chen J, Lu SQ等(2018)大多数活检诊断的扁平上皮异型性不需要手术切除。乳房37:13-17
Cheatle GL(1920)乳腺囊肿和囊肿中的原发性癌症。Br J外科:149 - 166
Cheatle GL, Cutler M(1931)乳房肿瘤:其病理、症状、诊断和治疗。费城利平科特公司
Dabbs DJ(2012)柱状细胞改变、扁平上皮异型性和非典型导管上皮增生。19章。见:乳腺病理学,第1版。爱思唯尔,349-350页。电子书书号:9780323245982,电子书书号:9781455737567
张志刚,王志刚,王志刚,王志刚,王志刚。(2006)乳腺柱状细胞病变的分子形态学改变。Mod Pathol 19:344-349
弗雷泽JL, Raza S, Chorny K, Connolly JL, Schnitt SJ(1998)柱状改变与突出的非典型口鼻和分泌物:在乳房活检中经常出现的一系列变化。Am J外科病理22:1521-1527
Gomes DS, Porto SS, Balabram D, Gobbi H(2014)普通病理学家和乳腺病理学专家在诊断乳腺小叶瘤变、柱状细胞病变、非典型导管增生和乳腺导管原位癌时的观察者间变异。诊断病理学9:21
徐强,罗建勇(2010)柱状细胞病变:病理实习生的共识研究。Hum Pathol 41:895-901
希克斯DG,莱斯特SC(2016)良性上皮病变:柱状细胞改变,柱状细胞增生,扁平上皮异型。纳入:诊断病理学:乳腺,第二版。Elsevier,第5页100-103。电子书ISBN: 9780323442985电子书ISBN: 9780323395267精装ISBN: 9780323377126压印
Lakhani SR, Ellis IO, Schnitt SJ, Tan PH, van de Vijver MJ(2012),在:WHO (ed) WHO乳腺肿瘤分类,第四版
McLaren B, Gobbi H, Schuyler PA, Olson SJ, Parl FF, Dupont WD等(2005)良性乳腺活检中雌激素受体在扩大的小叶单元和柱状改变中的免疫组化表达:一项嵌套病例-对照研究。amj外科病理29:105-108
Moinfar F(2009)乳腺扁平导管上皮内瘤变:诊断标准、鉴别诊断、分子遗传学发现和临床相关性的回顾——是时候欣赏Azzopardi概念了。Arch Pathol实验室医学133:879-892
Monfair F, Man YG, Bratthauer GL, Ratschek M, Tavassoli FA(2000)乳腺导管上皮内肿瘤扁平型(“附着性导管原位癌”)的遗传异常:正常乳腺上皮的模拟。癌症88:2072 - 2081
国家综合癌症中心。2017年国家综合癌症网络临床指南,乳腺癌风险降低。https://www.nccn.org/about/news/ebulletin/ebulletindetail.aspx?ebulletinid=549
O 'Malley FP, Mohsin SK, Badve S, Bose S, Collins LC, Ennis M等(2006)乳腺扁平上皮异型性诊断的观察者间重复性。Mod Pathol 19:172-179
Oyama T, Maluf H, Koerner F(1999)非典型囊性小叶:低级别导管原位癌形成的早期阶段。Virchows Arch 435:413-421
Park JK, Henry JC, Jiang J, Esau C, Gusev Y, Lerner MR等(2011)miR-132和miR-212在胰腺癌中升高并靶向视网膜母细胞瘤肿瘤抑制因子。生物化学生物物理研究,406:518-523
Rosen PP (1999a)柱状细胞增生与小叶原位癌和小管癌相关。Am J外科病理23:1561
Rudin AV, Hoskin AL, Fahy A, Farrell AM, Nassar A, Ghosh K等(2017)核心活检中扁平上皮异型性并升级为癌症:系统回顾和荟萃分析。Ann Surg Oncol 24:3549-3558
Sahoo S, Recant WM(2005)乳腺柱状细胞改变、小叶原位癌和管状癌的三联征。乳房J 11:140-142
Said SM, Visscher DW, Nassar A, Frank RD, Vierkant RA, Frost MH等(2015)扁平上皮非典型增生与乳腺癌风险:Mayo队列研究。癌症121:1548 - 1555
Schiaffino S, Gristina L, Villa A, Tosto S, Monetti F, Carli F等(2018)扁平上皮异型性:真空辅助乳腺活检后无残留微钙化的患者的保守治疗。Br J Radiol 91:1081
Schnitt SJ (2003a)侵袭前乳腺疾病的诊断和治疗:扁平上皮异型性-分类、病理特征和临床意义。乳腺癌决议5:6 3 - 268
Schnitt SJ (2003b)乳腺柱状细胞病变。AJSP:审查和报告8:201-210
Schnitt SJ(2018)柱状细胞病变和扁平上皮异型性。见:Epstein JI, Schnitt SJ, Collins LC (eds)乳腺活检解释,第三版。费城的Wolters Kluwer
陈志伟,陈志伟,陈志伟,等(1992)乳腺导管增生性病变诊断的临床价值。Am J外科病理16:1133-1143
Schnitt SL, Vincent-Salomon A(2003)乳腺柱状细胞病变。Adv Anat Pathol 10:113-124
Simpson PT, Gale T, Reis-Filho J, Jones C, Parry S, Sloane JP等(2005)乳腺柱状细胞病变:乳腺癌进展中缺失的一环?形态和分子分析。Am J外科病理29:734-746
谭ph, Ho BC, Selvarajan S, Yap WM, Hanby A(2005)乳腺柱状细胞病变的病理诊断:有重复性问题吗?《临床病理学杂志》58:705-709
陈志伟,陈志伟,陈志伟(2003)导管内增生性病变。在:Tavassoli FA, Devilee P (eds)病理学和遗传学。乳房和女性生殖器官肿瘤。世界卫生组织肿瘤分类。国际癌症研究机构出版社,里昂,第63-73页https://www.iarc.fr/wp-content/uploads/2018/07/bb4-chap1.pdf.2018年评估(4月20日)
Verschuur-Maes AH, de Bruin PC, van Diest PJ(2012)乳腺柱状细胞病变向浸润性乳腺癌的表观遗传进展。乳腺癌治疗136:705-715
Verschuur-Maes AH, Moelans CB, de Bruin PC, van Diest PJ(2014)乳腺柱状细胞病变中多重结扎依赖探针扩增基因拷贝数改变的分析。Cell Oncol (Dordr) 37:147-154
沃伦·JC(1905)外科医生和病理学家。通过对乳腺良性肿瘤的分类和治疗的考虑,恳求互惠。波士顿医学外科杂志153:95-109
Wellings SR, Jensen HM, Marcum RG(1975)人类乳房大体下病理图集,特别涉及可能的癌前病变。中华肿瘤学杂志55:231-273
确认
作者感谢Patricia Logullo的文本审阅。
资金
这项研究没有得到资助。
数据和材料的可用性
本文为文献综述,无原始数据报道。
作者信息
作者及隶属关系
贡献
两位作者(AL和CN)在文献综述、手稿撰写和最终批准即将出版的版本方面贡献相同。
相应的作者
道德声明
伦理批准并同意参与
这是一篇文献综述,没有人或动物的参与。因此,放弃知情同意或伦理批准。
发表同意书
这是一篇文献综述,没有人或动物的参与。因此,放弃知情同意或伦理批准。
相互竞争的利益
作者宣称他们之间没有利益冲突。
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
洛古罗,a.f.,尼米尔,C.乳腺柱状细胞病变:病理学家的实用回顾。外科经验病理2, 2(2019)。https://doi.org/10.1186/s42047-018-0027-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s42047-018-0027-2
关键字
- 柱状细胞病变,CCL
- 有限元分析
- 乳房活组织检查