摘要
不变的左右(LR)模式或手性对胚胎发育至关重要。左下颚不对称的丧失或逆转通常与畸形和疾病有关。虽然已经提出了几种理论,但LR对称性产生的确切机制尚未完全阐明。近年来,手性已经在单细胞和多细胞结构中被检测到在体外方法。这些研究证明了细胞手性的普遍性,它依赖于细胞表型,以及物理边界的作用。本文主要讨论了发育性左脑不对称的理论,并对各种理论进行了比较在体外细胞手性模型系统,并强调细胞手性在干细胞分化中的可能作用。我们强调,在体外细胞手性系统在帮助揭示发育过程中手性形态发生的本质方面具有很大的前景。
发育和疾病的左右不对称
生物体通常采用一致的左右(LR)不对称定位和内部器官形态,这种现象被称为手性或手性。糖和DNA等生物分子的手性早已被认识,但生物体内LR不对称的起源尚未得到很好的理解。一般来说,LR模式被认为遵循四个步骤:(i)通过定位LR轴相对于前后轴和背腹轴来打破LR对称性[1];(ii)将初始手性信息传递到多细胞场的LR位置;(iii)信号分子LR不对称表达;(iv)这些分子诱导内脏器官的不对称形态发生[2- - - - - -4]。适当的LR模式需要在早期发育阶段可靠地打破LR对称性,并在后期传输和放大LR信号。这四个步骤中任何一个的缺陷都可能导致侧边畸形的严重后果。例如,在不对称基因表达过程中,中线结构起到屏障作用,使左侧信号不影响右侧信号,反之亦然[5]。中线缺陷导致正常侧边性的干扰。
LR不对称异常也与疾病密切相关。首先,LR信号异常通常会导致畸形,包括地点ambiguus(镜像位置的一个或多个器官)和内脏逆位(所有内脏都在镜像位置)。这些缺陷可能是由可遗传的遗传疾病,如卡塔格纳综合征,或产前接触致畸物造成的[6]。糖尿病等母体疾病也可引发侧侧性缺陷[7,8]。
第二,许多疾病与LR不对称有关[9,10]。肿瘤的发病率随侧边变化明显,右侧多发肺癌、睾丸癌和卵巢癌,左侧多发乳腺癌和黑色素瘤[9]。与Holt-Oram综合征相关的上肢畸形也更常见于左侧[11]。详细的分析表明,位置依赖性疾病的发病率可能不一定与不对称的器官质量或个人的利手性有关,因此仍然无法解释[12]。
第三,乳腺癌与大脑不对称异常有很强的相关性[13]。总之,这些发现表明疾病和异常LR不对称密切相关,可能具有共同的发育起源,无论是环境还是遗传[12- - - - - -15]。因此,研究左脑不对称在发育和疾病中的作用具有重要的科学意义和临床意义。
我们关注最近在体外在发育过程中LR模式的整体背景下,研究LR不对称。本文从目前两种LR对称破缺模型中尚未解决的问题出发,讨论了这一问题在体外细胞手性的研究及其可能的应用在活的有机体内.
发育中的LR对称性破缺
发育过程中LR不对称的发生,也被称为LR对称断裂,是发育生物学中最有趣的问题之一。虽然人们普遍认为LR模式最终源于生物分子的手性,但对称破缺的确切机制、时间和位置仍存在争议。核心问题是生物物理分子手性如何在发育过程中转化为LR不对称基因表达。两个重要的模型——原纤毛模型和电压梯度模型——都可以提供解释,但它们在分子手性如何以及何时产生位置信息方面存在差异。
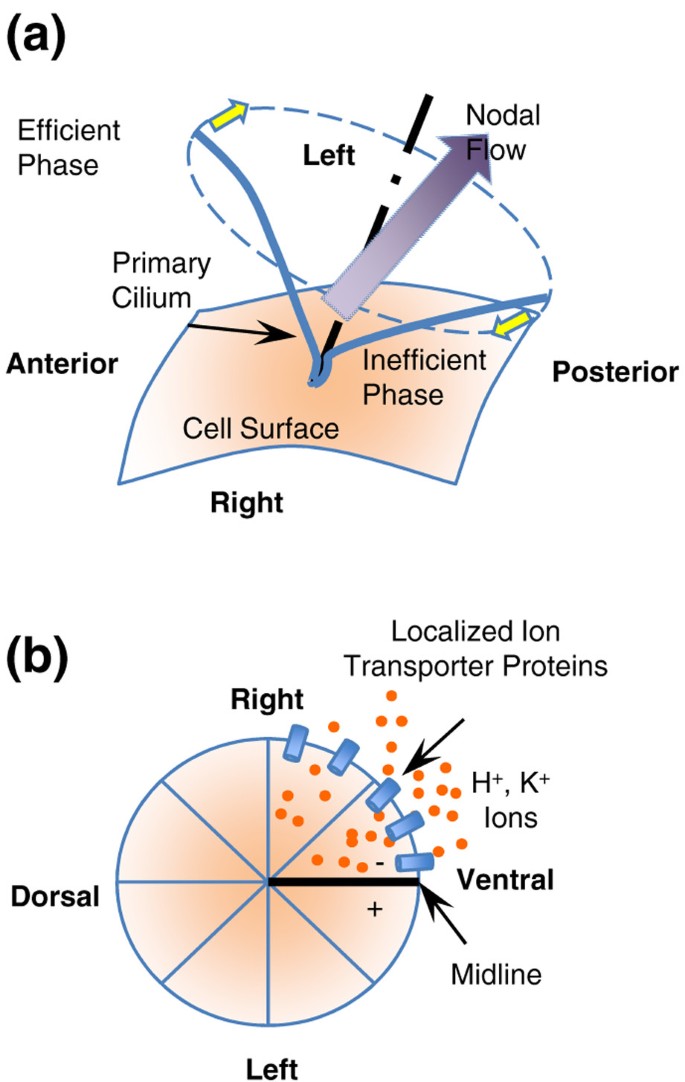
在初级纤毛模型中(图2)1),对称性破坏被认为发生在小鼠发育后期神经折叠阶段的腹侧结。结细胞组织良好,其膜上有跳动的初级纤毛,这驱动向左流动,导致Nodal和其他蛋白质的基因表达LR不对称[16- - - - - -18]。经初级纤毛的LR不对称断裂有三个基本特征:(i)纤毛一致后倾;(ii)同步跳动;(三)纤毛单向旋转(即从腹侧看时为逆时针方向)。纤毛的后向和一致的跳动被认为与节点细胞之间的相互作用有关,可能是通过平面细胞极性[19- - - - - -21]。然而,纤毛单向跳动的机制尚不清楚。此外,有证据表明,初级纤毛模型可能在所有病例中发挥的作用并不相同[22- - - - - -24]。
在蜗牛、苍蝇、鸡和猪中,纤毛在LR发育过程中不存在。此外,一些突变体有异常或没有纤毛运动,但它们的LR不对称体平面是正常的[24- - - - - -26]。这表明纤毛运动并不一定是LR模式所必需的,其他机制可能导致LR对称性破坏。
第二种机制涉及电压梯度(图1)1 b),将小的LR决定因素(如血清素)运输到身体的一侧,在那里它们启动Nodal和其他蛋白质的不对称基因表达。电压梯度是由离子通道的不对称定位决定的,早在两细胞或四细胞分裂阶段就发现了非洲爪蟾蜍鸡胚[27,28]。此外,鸡胚Hensen's结的细胞不对称迁移是H介导的左侧膜电位瞬时去极化的下游事件+/ K+atp酶活性。
据认为,离子通道mrna和蛋白质通过手性“F”分子的参与进行定向运输,因此离子转运体大多位于右腹侧。“F”分子的概念最早是由Wolpert及其同事提出的[1],这些分子有三个相互垂直的轴,分别是前后轴、背腹轴和左腹轴。F分子的性质在很大程度上是未知的。最近通过发现包裹在皮层的肌动蛋白细胞骨架的手性,证明了不对称的细胞骨架起源非洲爪蟾蜍鸡蛋(29]。此外,我们推测肌动蛋白/微管蛋白网络完成了'F'分子的功能,肌动蛋白在底部,微管在顶部沿LR方向排列,沿微管的定向运输定义了LR轴[4]。然而,这种细胞骨架网络模型仍有待于表征和验证,以确定LR轴相对于早期胚胎的其他两个轴的方向。
一般来说,左腹对称性的破坏与手性细胞结构的功能有关,如小鼠的腹侧结。重要的是,手性结构必须以特定的方式组织,以便它们的集体行为允许产生重要的生物物理信号,这些信号可以翻译为局部不对称基因表达,随后被放大为LR侧之间的差异。在这方面有两个基本问题:手性是否是细胞的基本性质,以及单细胞的手性如何转化为多细胞的手性形态发生。如果这些问题能在……中得到解决,将会大有帮助在体外系统,其中不对称的生物物理和生化线索可以排除。
在体外手性细胞
手性已在几个细胞系统中被观察到[30.- - - - - -32]。例如,细菌菌落可以形成手性形态,分支以相同的手性扭曲[30.]。这种行为被认为源于鞭毛的手性,鞭毛推动细胞体并诱导确定的手性旋转。海马外植体的神经突生长具有向右偏置,在二维基质上呈顺时针方向转动[31,32]。这种旋转已被证明是由生长锥丝状伪足的自主右旋驱动的,可能是通过肌凝蛋白(Va和Vb)和丝状动蛋白之间的相互作用。
直到最近,人们才以一种控制良好、高度可重复的方式研究了固有的细胞手性,并在几乎所有细胞类型中都能检测到[33- - - - - -35]。本文将从单细胞和多细胞两方面综述近年来细胞手性的研究进展。在这些在体外系统中,不需要节点、纤毛或流体流动来建立一致的不对称性,这表明手性是细胞固有的基本特性。
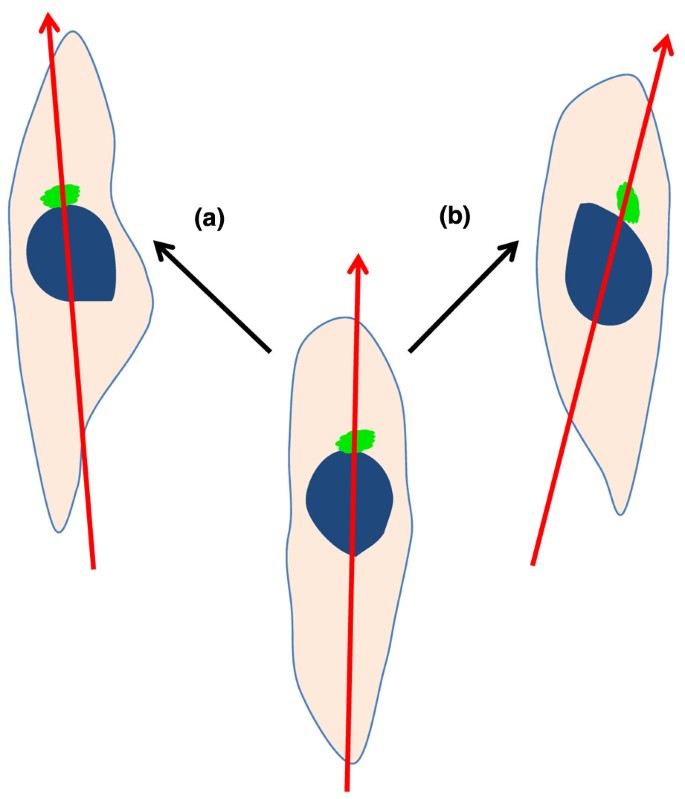
Xu和他的同事在单细胞水平上清楚地证明了手性[33]通过研究稀疏分布的中性粒细胞样分化的HL-60 (dHL-60)细胞的迁移(图2)2)。结果发现,在均匀的化学引诱剂(f-Met-Leu-Phe (fMLP))诱导极化后,细胞主要沿轴所限定的方向从细胞核中部向中心体移动,但有向左侧移动的倾向。作者认为,中心体的手性结构可能与观察到的单细胞手性有关,中心体可以使细胞极化并随后决定其对化学刺激的定向反应。通过诱导中性粒细胞在不产生空间线索的情况下极化,以及在不受邻近细胞影响的条件下研究单细胞极化,可以观察到细胞手性。作者将细胞手性定义为相对于两个预定义的细胞轴向左或向右偏置:一个轴由细胞与底物的附着定义,另一个轴由中心体与细胞核的关系定义。在dHL-60细胞中观察到左偏倚,并发现微管依赖。受神经元和星形胶质细胞研究的启发,研究了Cdc42/Par6极性通路建立细胞手性的具体机制。途径的上游破坏(即干扰Par6, Cdc42或磷脂酰肌醇(3,4,5)-三磷酸)完全阻止极性的建立,而下游破坏(即干扰蛋白激酶C-ζ或动力蛋白)只发现了手性随机化。令人惊讶的是,位于Cdc42/Par6极性通路中间的糖原合成酶激酶3β (GSK3β)的组成性激活能够逆转fML p诱导的极性偏倚,而不仅仅是随机化。最近,该系统被用于证明微管蛋白在生物界LR模式中的非纤毛作用[36]。微管蛋白的突变被证明可以改变植物、线虫和青蛙以及培养的人类细胞的LR模式。
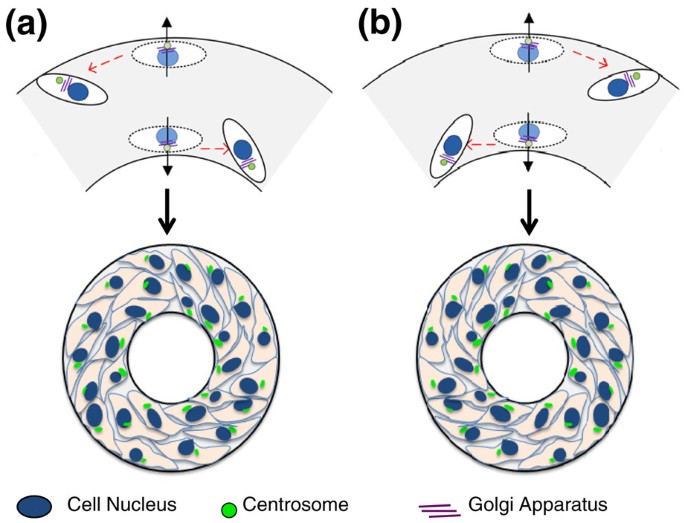
手性在多细胞水平上的建立也与细胞固有的手性有关。我们之前研究了LR轴的建立,通过表征多细胞对齐和迁移来响应微图案的相对边界(图2)3.) [34,37]。通过使用微图案技术,在几何形状内形成细胞单层,这对细胞施加了边界条件,从而迫使它们做出LR决定。形成这种手性的先决条件是两个相对的边界在几百微米的距离内的几何强加,比如那些由线形条和圆环组成的几何形状,而不是正方形或圆形几何形状。环形几何的主要使用允许使用基于图像的算法,基于单个细胞相对于圆周方向的整体对齐,以确定多细胞手性为顺时针(CW)或逆时针(CCW)。
这种LR决定在多细胞水平上是明显的,并且特定于细胞表型。大多数被研究的细胞(例如,内皮细胞、成骨细胞、成体间充质干细胞和成纤维细胞)都表现出连续向偏倚,但来源于小鼠和人类骨骼肌的两种成肌细胞系被发现具有连续向偏倚。这些结果表明,在干细胞功能分化过程中,细胞手性可能发生改变。因此,有必要研究与LR不对称发育相关的细胞手性,并检查重要的LR生化和生物物理信号的影响。
对多细胞手性机制的研究揭示了肌动蛋白在CCW细胞系建立中的作用,在引入肌动蛋白干扰药物后,CCW手性向CW手性逆转。令人惊讶的是,发现微管不稳定药物对CCW或CW手性的建立没有影响。因此,虽然方向性偏倚的建立仍未确定,但功能性肌动蛋白在建立CCW对齐方面的作用是明确的。此外,发现细胞具有一致的极化,它们的中心体(而不是细胞核)靠近几何边界[38],以及沿边界的定向细胞迁移。使用Xu和同事的相同的三轴定义[33],环上的CCW排列可以被认为是细胞的“向左”偏置,而CW则是“向右”偏置。
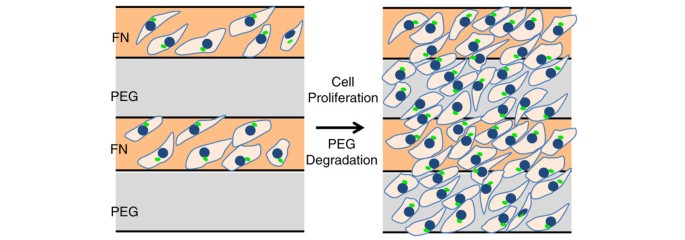
最近,陈和同事[35]也能够通过使用微加工技术在二维表面上观察到更大尺度(即几厘米)的多细胞手性(图2)4)。他们发现,在基质上交替培养血管间充质细胞,基质上含有细胞粘附包被的纤维连接蛋白通道和非粘附包被的聚乙二醇通道,导致了高度有组织的手性模式。细胞最初附着在纤维连接蛋白包裹的通道上,与Wan及其同事发现的手性排列相似[34],随后随着聚乙二醇降解扩展到整个表面,在凹槽和排列的细胞之间形成约20°角的右偏置。应力纤维在接触基体界面时的积累被推测为诱发机械线索,导致形成与这些界面对角线排列的手性图案。这一假设在非肌球蛋白ii抑制剂blebbistatin和rho相关激酶(ROCK)抑制剂Y27632的抑制研究中得到证实。
建立了一个反应-扩散数学模型来描述两种形态形成因子的可能影响:骨形态发生蛋白(BMP)-2,一种缓慢扩散的激活剂,基质γ-羧谷氨酸蛋白(MGP),一种快速扩散的BMP抑制剂[39]。在一个二维领域内,他们创造了一个化学物质的时空梯度。假设细胞对形成因子的梯度有一致的方向偏差,这是图案形成的手性的原因。然而,需要通过实验验证这两种形态因子是否以及通过何种机制可以诱导相对于化学梯度轴的可靠偏差。
总之,所有的在体外细胞手性系统依赖于明确的细胞极化,或者在暴露于化学引诱剂时瞬间确定,或者由物理边界诱导,并且手性是由于垂直于细胞极化方向的有偏细胞运动而检测到的。单细胞系统[33]首次直接证明了单细胞手性的存在,但它需要细胞中心体和细胞核的活成像,目前仅限于一种细胞类型dHL-60。Wan及其同事的微图案系统[34相反,他们以一种高度可靠的方式展示了多种细胞,在控制良好的微尺度边界内,多细胞手性结构可以从同质细胞群中产生。Chen及其同事[35进一步表明,如果允许细胞迁移到边界外,这种初始的细胞手性排列可以扩展到更大的范围。总的来说,这些研究表明,即使不是全部,大多数细胞本质上是手性的,单细胞手性可以表现为具有良好控制边界的多细胞手性形态发生,即使在大范围内也是如此。
细胞手性在LR不对称中的可能作用
所有这些在体外细胞手性系统表明,手性形态发生可以在没有特定胚胎结构的情况下产生,如腹侧结甚至跳动纤毛。大多数(如果不是全部的话)细胞本质上是手性的,就像我们发现的非洲爪蟾蜍鸡蛋(29]。因此,这些在体外研究为细胞质模型提供了进一步的支持,例如电压梯度模型中受精卵的定向运输。此外,在体外研究表明,在一定条件下,细胞手性会表现为细胞功能的偏差:迁移和排列。这些新发现可能为LR胚胎发育提供了另一种解释。
我们相信对细胞手性的理解的进步在体外系统可能有助于揭示的机制在活的有机体内LR不对称发育[37,40]。首先,固有的细胞手性可能利用了导致LR对称性破缺的相同细胞机制。目前早期LR发展的模型(即节点流和电压梯度)仍然有一些基本的未解问题,这些问题可以通过研究涉及细胞固有手性的细胞机制来解决。其次,细胞固有的手性可能导致其他LR不对称事件,如心管和肠环,以及大脑不对称[22]。第三,边界可能指导手性结构的建立。有趣的是,在鸡的发育过程中,在Hensen淋巴结(相当于小鼠的腹侧淋巴结)周围发现了偏向性细胞迁移[41]。
有趣的是,调节细胞手性的药物类似于影响LR不对称的药物。肌动蛋白的功能对图案表面的细胞手性至关重要。许多不对称断裂事件与肌动蛋白的功能有关,如不对称细胞分裂、胚胎细胞在发育早期的手性排列以及在体外肌动蛋白剪切结构诱导非洲爪蟾蜍鸡蛋。在蜗牛里椎实螺属stagnalis肌动蛋白动力学的干扰,而不是微管的干扰,改变了早期右旋胚胎的手性[42]。在后肠循环果蝇,肌动蛋白马达肌球蛋白ID突变被发现逆转后肠环的手性[43- - - - - -45]。在秀丽隐杆线虫, LR不对称被发现与肌动蛋白和皮质力有关,并受非规范信号通路的调节[46]。
最近的进展在体外细胞手性可以极大地促进发育过程中LR不对称的研究。一个在体外细胞手性系统可以通过排除可能的混杂因素,以良好控制的方式快速评估相关药物和生长因子的作用和机制。
然而,重要的是要指出,在发育过程中,细胞手性何时以及如何被准确利用仍然不清楚。特别是,二维基质上的细胞可能表现得与胚胎发育中的细胞完全不同。细胞微环境,包括可溶性因子和细胞外基质,需要更好地模拟在体外系统(47- - - - - -49],然后才能用于胚胎发育的LR不对称研究。
结论
在体外细胞手性可能为研究发育过程中LR不对称断裂中细胞内和细胞间机制的作用提供了新的范式。是否以及在多大程度上可以用内在的细胞手性来解释LR不对称事件是未来工作中需要解决的有趣问题。
请注意
本文是关于的专题系列的一部分对干细胞的物理影响Gordana Vunjak-Novakovic编辑。该系列的其他文章可以在网上找到http://stemcellres.com/series/physical
缩写
- 连续波:
-
顺时针方向
- 公约:
-
逆时针方向的
- dHL-60:
-
分化HL-60
- fMLP:
-
f-Met-Leu-Phe
- LR:
-
左右。
参考文献
左/右不对称中偏手性的发展。发展。1990,109:1-9。
Levin M:早期的左右轴是像植物、肾脏还是神经元?胚胎不对称生理信号的整合。出生缺陷与胚胎研究。2006,78:191-223。10.1002 / bdrc.20078。
李建军,李建军,李建军,李建军。动物的左、右不对称性。地理学报,2002,33(3):103-113。
Levin M, Mercola M:手性的强迫:对左右不对称的理解。中国生物医学工程学报,1998,32(2):763-769。10.1101 / gad.12.6.763。
Tabin CJ:左右不对称的关键。细胞学报,2006,27:27-32。10.1016 / j.cell.2006.09.018。
艾尔斯沃斯AS:在确定侧边缺陷的临床方面。中华医学杂志,2001,31(2):357 - 357。10.1002 / ajmg.1219。
Slavotinek A, Hellen E, Gould S, Coghill SB, Huson SM, Hurst JA:三个患有左右不对称畸形的糖尿病母亲的婴儿-糖尿病在这种畸形谱系中的病因学作用的进一步证据。中华心理医学杂志,1996,5:241-247。
Ewart-Toland A, Yankowitz J, Winder A, Imagire R, Cox VA, Aylsworth AS, Golabi M:糖尿病母亲儿童的眼耳椎畸形。中华医学杂志,2000,29(3):391 - 391。10.1002 / (SICI) 1096 - 8628 (20000214) 90:4 < 303:: AID-AJMG8 > 3.0.CO; 2 q。
royechoudhuri R, Putcha V, Moller H:肿瘤和侧边:5个主要配对器官的研究(英国)。癌症病因控制,2006,17:655-662。10.1007 / s10552 - 005 - 0615 - 9。
Paulozzi LJ, larry JM:外型先天缺陷婴儿的侧位模式。畸形学,1999,60:265-271。10.1002 / (SICI) 1096 - 9926 (199911) 60:5 < 265:: AID-TERA7 > 3.0.CO; 2 h。
Smith AT, Sack GH, Taylor GJ: Holt-Oram综合征。中华儿科杂志,1999,25(5):538-543。10.1016 / s0022 - 3476(79) 80758 - 1。
王晓东,王晓东,王晓东,等。胚胎发育与乳腺癌的分子决定因素研究。中华医学杂志,2011,18(8):519- 527。10.2174 / 092986711798347252。
Sandson TA, Wen PY, LeMay M:乳腺癌女性大脑不对称的逆转。中华医学杂志,1992,33(3):523-524。10.1016 / 0140 - 6736 (92) 90341 - y。
一个假设:乳腺癌易感性和大脑半球偏侧性可能有共同的遗传原因。乳腺杂志,2011,33:49-52。
Klar AJ:为小鼠左右体轴发育机制提供了选择性染色单体分离假说的支持。乳腺杂志,2008,29:47-56。
Hirokawa N, Tanaka Y, Okada Y, Takeda S:节点流和左右不对称的产生。细胞,2006,25(3):33-45。10.1016 / j.cell.2006.03.002。
王晓东,王晓东,王晓东,王晓东,等。节点流机制:一个守恒对称性破缺事件。Cell. 2005, 21(1): 633-644。10.1016 / j.cell.2005.04.008。
Nonaka S, Tanaka Y, Okada Y, Takeda S, Harada A, Kanai Y, Kido M, Hirokawa N:缺乏KIF3B运动蛋白小鼠胚外液左向流动的节毛缺失导致的左右不对称随机化。细胞学报,1998,35(5):829-837。10.1016 / s0092 - 8674(00) 81705 - 5。
Antic D, Stubbs JL, Suyama K, Kintner C, Scott MP, Axelrod JD:平面细胞极性对小鼠和非洲爪猴胚胎发生过程中结纤毛后定位和左右轴确定的影响。科学通报,2010,5 (5):899 -10.1371/journal.pone.0008999。
hashmoto M, Shinohara K, Wang J, Ikeuchi S, Yoshiba S, Meno C, Nonaka S, Takada S, Hatta K, Wynshaw-Boris A, Hamada H:节点细胞平面极化对节点纤毛旋转轴的影响。中国生物医学工程学报,2010,31(2):391 - 391。10.1038 / ncb2020。
宋辉,胡军,陈伟,Elliott G, Andre P,高斌,杨勇:控制纤毛定位的平面细胞极性破坏双边对称。自然科学,2010,46(6):378-382。10.1038 / nature09129。
张建军,张建军,张建军,张建军。动物左/右不对称性的研究进展。信息技术与应用,2007,17:351-358。10.1016 / j.gde.2007.05.008。
吴绍平,李文梅:左右不对称是否是平面胞极性的一种形式?生态学报,2009,36(3):355-366。10.1242 / dev.015974。
范登堡LN,莱文M:远未解决:对我们所知道的左右不对称的早期机制的看法。开发应用,2010,29(3):3131-3146。10.1002 / dvdy.22450。
Serluca FC, Xu B, Okabe N, Baker K, Lin SY, sulvan - brown J, Konieczkowski DJ, Jaffe KM, Bradner JM, Fishman MC, Burdine RD:斑马鱼富含亮氨酸的重复6样基因突变影响纤毛运动和肾原囊肿,但对左右模式的影响不同。发展,2009,36(6):1621-1631。10.1242 / dev.020735。
曹勇,孙志强,王志强,王志强,等。海马囊肾基因在纤毛介导过程和Wnt通路中的表达。开发技术,2008,14(4):954-961。10.1016 / j.devcel.2008.03.010。
Levin M, Thorlin T, Robinson KR, Nogi T, Mercola M: H+/K+- atp酶和细胞膜电位的不对称是左-右模式的早期步骤。Cell. 2002, 11(1): 77-89。10.1016 / s0092 - 8674 (02) 00939 - x。
Aw S, Adams DS, Qiu D, Levin M: H, k - atp酶蛋白定位和Kir4.1功能揭示了三轴在左右不对称早期测定中的一致性。机械发展,2008,25(3):353-372。10.1016 / j.mod.2007.10.011。
Danilchik MV, Brown EE, Riegert K:爪蟾卵皮层的固有手性特性:左右不对称的早期指标。科学通报,2006,33(3):417 - 426。10.1242 / dev.02642。
李建军,李建军,李建军,李建军,李建军。细菌菌落生长过程中手性模式的协同形成。物理学报,1995,25(3):379 - 379。10.1103 / PhysRevLett.75.2899。
Heacock AM, Agranoff BW:视网膜外植体神经突的顺时针生长。科学。1977,198:64-66。10.1126 / science.897684。
Tamada A, Kawase S, Murakami F, Kamiguchi H:生长锥体丝状伪足的自主右旋驱动神经突旋转。中国生物医学工程学报,2010,33(2):559 - 561。10.1083 / jcb.200906043。
许杰,Van Keymeulen A, Wakida NM, Carlton P, Berns MW, Bourne HR:极性揭示细胞固有手性。美国国家科学促进会。[j] .中国科学:地球科学。10.1073 / pnas.0703153104。
万立强,Ronaldson K, Park M, Taylor G, Zhang Y, Gimble JM, Vunjak-Novakovic G:从表面上看:微图案哺乳动物细胞具有表型特异性的左右不对称性。美国国家科学促进会。中国农业科学,2011,31(2):393 - 393。10.1073 / pnas.1103834108。
陈涛,徐建军,赵旭,郭超,黄敏,黄勇,李忠,Garfinkel A,何春明,Tintut Y, demmer LL:细胞骨架力学在组织形态发生中的左右对称性断裂。中国生物医学工程学报,2012,31(1):551-559。10.1161 / CIRCRESAHA.111.255927。
Lobikin M,王刚,徐军,谢云伟,chuchcf, Lemire JM, Levin M:微管蛋白在左-右模式中的早期非纤毛作用。美国国家科学促进会。科学通报,2012,31(2):586- 591。10.1073 / pnas.1202659109。
万立强,冯杰-诺瓦kovic G:微模式手性形态发生。通用集成生物学,2011,4(4):745-748。
Desai RA,高亮,Raghavan S,刘文峰,陈春春:E-cadherin介导细胞间粘附的细胞极性。中国生物医学工程学报,2009,32(2):591 - 591。10.1242 / jcs.028183。
李建军,张建军,李建军,等。血管间充质细胞模式的研究进展。美国国家科学促进会。[j] .中国科学:地球科学。10.1073 / pnas.0308436101。
McSheene JC, Burdine RD:利用本征手性研究细胞轴的建立。美国国家科学促进会。中国农业科学,2011,28(1):1- 2。10.1073 / pnas.1109367108。
Gros J, festel K, Viebahn C, Blum M, Tabin CJ:鸡Hensen's结细胞运动的左/右不对称基因表达。科学通报,2009,31(4):941-944。10.1126 / science.1172478。
Shibazaki Y, Shimizu M, Kuroda R:身体偏向性在早期胚胎中由基因决定的细胞骨架动力学指导。中国生物医学工程学报,2004,14(4):1462-1467。10.1016 / j.cub.2004.08.018。
spsamder P, Adám G, Noselli S: ID型非常规肌球蛋白控制果蝇左右不对称。自然科学,2006,44(4):803-807。10.1038 / nature04623。
Hozumi S, Maeda R, Taniguchi K, Kanai M, Shirakabe S, Sasamura T, spacimder P, Noselli S, Aigaki T, Murakami R, Matsuno K:一种非常规的肌蛋白在果蝇内脏器官中逆转了固有的手性。自然科学,2006,44(4):798-802。10.1038 / nature04625。
Taniguchi K, Maeda R, Ando T, Okumura T, Nakazawa N, Hatori R, Nakamura M, Hozumi S, Fujiwara H, Matsuno K:平面细胞形状的手性对左右不对称上皮形态发生的影响。科学通报,2011,33(3):339-341。10.1126 / science.1200940。
Pohl C., Bao Z .:手性力通过中线和前后轴的解耦来组织线虫的左右模式。软件开发学报,2010,19(4):492 - 492。10.1016 / j.devcel.2010.08.014。
王立强,王立强,王立强,等。细胞功能的几何与力控制。中国生物医学工程学报,2009,31(2):447 - 458。10.1002 / jcb.22355。
Discher DE, Mooney DJ, Zandstra PW:生长因子,基质和力量结合和控制干细胞。科学通报,2009,32(4):1673-1677。10.1126 / science.1171643。
张建军,张建军,张建军,张建军:细胞-基质黏附的三维研究。科学,2001,29(4):1708-1712。10.1126 / science.1064829。
致谢
我们感谢NIH对我们工作的支持(授权EB002520)。
作者信息
作者及单位
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有相互竞争的利益;然而,哥伦比亚大学正在申请一项与用微模式测量细胞手性的技术相关的专利。
权利和权限
关于本文
引用本文
万立强,Ronaldson, K, Guirguis, M。et al。细胞微图案化显示手性形态发生。干细胞研究4, 24(2013)。https://doi.org/10.1186/scrt172
发表:
DOI:https://doi.org/10.1186/scrt172
关键字
- 初级纤毛
- 内脏逆位
- Blebbistatin
- 手性结构
- 向右偏