摘要
睡眠相关的高运动性癫痫(SHE),以前被称为夜间额叶癫痫,是一种局灶性癫痫,其特征是癫痫发作伴复杂的多动性自动性和/或不对称的强直性/异常性姿势,主要发生在睡眠期间。SHE是一种罕见疾病,估计最低患病率为1.8/10万人,约占耐药手术病例的10%。这种疾病虽然不常见,但却引起了从儿童神经学家到神经外科医生等众多专家的极大兴趣。即使是经验丰富的癫痫学家和睡眠医生,从临床角度来看,将这种情况与睡眠期间发生的生理或病理上的非癫痫性发作行为区分开来往往很困难,有时甚至是不可能的。公认的SHE病因是多种多样的,包括获得性损伤、遗传原因和结构异常,如局灶性皮质发育不良。多种病因(结构遗传)也有可能。非特异性的临床特征区分了不同的病因,即使是因结构性病变引起的SHE,也通常表现为早发型耐药癫痫发作,并表现出较差的长期预后。
SHE的致病基因是多种的,并编码参与不同分子途径的蛋白质。胆碱能系统和mTOR通路最为相关。这篇综述将对SHE的遗传背景进行详尽的概述。
睡眠相关性高运动性癫痫(SHE)
SHE,前身为夜间额叶癫痫(NFLE),是一种局灶性癫痫,以多动性癫痫发作为特征,主要发生在非快速眼动睡眠期间。
这种疾病影响男女和任何年龄的个体,发作高峰在儿童和青少年时期(Scheffer et al。1994;Tinuper等人。2016).常染色体显性遗传(ADSHE)的家族型SHE已被描述。到目前为止,全世界已经确认了100多个家庭(Marini和Guerrini2007;Steinlein2014),但关于ADSHE的患病率没有准确的数据。
成人中非家族性SHE的患病率估计为1.8-1.9 / 10万(Vignatelli等。2015;Vignatelli等人。2017).然而,这种疾病很可能被诊断不足,或者在某些情况下被误诊。即使是经验丰富的癫痫学家和睡眠医生,从临床角度来看,将这种情况与睡眠期间发生的生理或病理上的非癫痫性发作行为区分开来往往很困难,有时甚至是不可能的。因此,误诊很常见,患者可能得不到有效治疗或治疗不当,导致长期副作用和错误癫痫诊断的社会后果(例如,影响驾驶执照)。
大多数患者对药物治疗反应良好,睡前低剂量卡马西平是首选治疗方法。然而,大约三分之一的患者耐药,在中位16年的随访后,只有22%的患者达到了最终缓解,大多数患者从疾病发作开始呈缓解模式(Licchetta et al.,2017).这些数据显示了长时间随访后的不良结果,这可能解释了为什么高达10%的手术系列报道了SHE (Menghi et al。2018).在这一人群中,手术结果似乎相对较好,特别是在脑MRI阳性的患者中。
从NPD到SHE
首次描述于1981年(Lugaresi和Cirignotta1981),这种情况最初被认为是一种新的睡眠运动障碍,即睡眠异常,并引入了误导性的术语夜间阵发性肌张力障碍(NPD)。随后,进行神经外科评估的额叶癫痫患者发作的相似性(Williamson等。1985;沃特曼等人。1987)和一些患者癫痫样放电的记录(Tinuper等。1990)证实了该综合征的癫痫起源。因此,这种疾病被重新命名为夜间额叶癫痫(NFLE)。在接下来的20年里,这种疾病的临床边界被定义了,然而许多有争议的问题强调了改变命名法的必要性(Tinuper和Bisulli2017).2014年,共识会议在意大利博洛尼亚举行(Tinuper et al。2016).该领域的专家讨论了NFLE的谱系,并根据严格的协议制定了最终的共识声明,该协议解决了命名、电临床定义、诊断标准以及现有证据支持的确定性水平、病因学和研究需求。协商一致意见会议强调了改变命名法的三个关键问题。首先,夜间发作被认为是一种误导,因为它意味着癫痫发作的时间生物学模式,而有证据表明癫痫发作发生在睡眠中是最重要的特征,而不是一天中的时间。其次,额叶这个术语并不总是合适的,因为特征性癫痫发作也可能来自额外区域(Proserpio et al。2011).第三,NFLE一词没有具体说明所涉及的典型临床符号学,主要包括多动性癫痫(Tinuper et al.)。2016).由于这些原因,术语睡眠相关运动亢进癫痫(SHE)已被提出来取代NFLE。
临床特征
SHE的癫痫发作通常很短(持续时间< 2分钟),发作突然,偏移,运动模式定型。高运动符号学是癫痫发作的主要临床模式,其特征为高运动特征,可能与不对称强直/肌张力异常姿势相关,伴或不伴头/眼偏斜。在少数病例中,不对称的肌张力异常姿势是癫痫发作的独特特征(Vignatelli等。2015).癫痫发作通常表现出不同的复杂性和持续时间,从短暂的刻板的睡眠突然觉醒(发作性觉醒或轻微运动事件)到更复杂的肌张力-动力障碍发作,以及更罕见的被称为“癫痫性夜间徘徊”的长时间活动行为(Montagna1992;Provini等人。1999;Nobili等人。2003;Terzaghi等人。2008).癫痫发作期间保持意识是常见的,受影响的个体可能报告有明显的先兆。癫痫发作通常发生在(非快速眼动)睡眠期间,即使主动清醒期间发作可能很少发生在患者一生中。
SHE患者的癫痫发作频率可能非常高,每晚发作1次至50次以上(Scheffer et al。1994;Provini等人。1999)和阵发性觉醒或轻微运动事件可能更加频繁。SHE患者可主诉夜间睡眠中断伴自发性睡眠中期觉醒、早晨睡眠惯性、醒来时疲劳和过度嗜睡(Peled和Lavie1986;马卡里奥和拉斯特曼1990;Schwalen和Jorg1998;朱可尼等人。2000;阿兰尼斯-格瓦拉等人。2005)对他们的生活质量产生负面影响。虽然日间嗜睡相关症状在SHE患者中很常见,但与对照组相比,日间过度嗜睡的频率在统计学上没有差异(Vignatelli等。2006).
神经生理学特点
后台活动通常是正常的。大约一半的病例间歇期脑电图正常(Licchetta et al。2017)或可能表现出罕见的癫痫样异常,因睡眠剥夺而增强,主要发生在睡眠中(Menghi等。2018).头皮发作期脑电图可能正常,也可能仅显示运动伪影。50-60%的病例可见癫痫样异常、节律性活动缓慢或额叶区域弥漫性背景变平(Licchetta等。2017).
头皮脑电图和侵入性颅内立体脑电图记录(SEEG)记录了大多数病例的癫痫起源于额叶(Nobili等。2007;兰斯等人。2008).然而,在高达20%的耐药病例中,发作性放电可能来自包括颞叶在内的各种额外区域(Nobili等。2004;Vaugier等。2009(Ryvlin et al.);2006;Dobesberger等人。2008;Nguyen等人。2009;Proserpio等人。2011)和顶叶(Montavont etal。2013;吉布斯等。2016)皮层,然后传播到额叶皮层,导致过度运动癫痫。
病因学
大多数患者病因不明。公认的SHE病因是多种多样的,包括获得性损伤、遗传原因和结构异常,如局灶性皮质发育不良(FCD)。多种病因(结构遗传)也有可能。非特异性临床特征区分不同的病因(Tinuper等。2016即使结构病变(FCD)引起的SHE通常表现为早发型耐药癫痫发作(Nobili等。2009),并表现出较差的长期预后(Licchetta et al。2017).在这些情况下,癫痫手术和去除致痫带可能是一种非常有效的治疗选择(Nobili等。2007).
大多数患者(86%)为散发性病例,14%的患者报告有癫痫家族史,只有5%的患者表现出明确的常染色体显性遗传模式,即ADSHE (Licchetta et al.)。2017).到目前为止,ADSHE与几种基因突变有关,这些基因编码的蛋白质涉及不同的生物学途径。尽管其发病机制涉及不同的潜在病因和网络,但根据目前的知识水平,它被认为是一种单一综合征,由临床表现(即运动亢进发作)定义,由睡眠/清醒振荡变化期间发生的假定共同下游机制引起。在临床实践中,将SHE视为单一综合征是最有帮助的,因为它需要特定的诊断检查和治疗方法e (Tinuper et al。2016).
乙酰胆碱受体基因
1994年,Scheffer et al. (Scheffer et al.;1994)描述了第一个常染色体显性遗传SHE的澳大利亚大家族,并将其命名为常染色体显性夜间额叶癫痫(adfle)。在这个家庭中,许多受影响的成员都被误诊为睡眠障碍。
在不同成员之间观察到严重程度的显著差异。进一步的分子遗传学研究在一些家族中建立了染色体20q13.2 - q13.13的连锁(Phillips et al。1995),导致随后确定了编码nAChR α 4亚基的基因的致病作用,CHRNA4(胆碱能受体nictinic Alpha 4亚基,MIM *118504)1995).在最初的确认之后,全世界已经描述了100多个家族(Marini和Guerrini2007)和两个同源基因的突变,CHRNB2(胆碱能受体烟碱β 2亚基,MIM *118507)和CHRNA2(胆碱能受体nictinic Alpha 2亚基,MIM *118502),分别编码nAChR的β2和α2亚基(De Fusco等。2000;Aridon等人。2006).由三个nAChR亚基基因突变产生的表型通常难以区分(McLellan等。2003).
到目前为止,有14种不同的突变CHRNA4,CHRNB2而且CHRNA2在20个ADSHE谱系和3个散发病例中有报道,如表1.总的来说,它们占SHE/ADSHE病例的不到20%,反映了该综合征的遗传异质性和胆碱能系统以外的系统可能在其发病机制中所起的作用(Steinlein等。2012).
对nAChR功能特性的体外分析揭示了功能增益(即乙酰胆碱敏感性的增加)(Bertrand等。2002)与ADSHE相关的突变受体,这可能是导致癫痫发作的神经元网络功能障碍的基础。ADSHE患者的正电子发射断层扫描(PET)研究表明,从脑干上升的胆碱能通路过度激活(Picard等。2006).胆碱能神经元在丘脑和皮层水平调节睡眠和觉醒,它们与睡眠相关疾病的参与是合理的,尽管其病理生理机制仍不清楚。
有趣的是,不仅SHE先证者,而且其健康亲属也报道了NREM唤醒异常的高患病率(Bisulli et al.)。2010;Licchetta等人。2017),表明可能有共同的背景。这些障碍之间的关系也得到了神经生理学和神经影像学证据的支持,这些证据表明,控制生理唤醒的通路在这两种情况下都受到了损害(Picard等。2006;Montagna等人。2008;Fedi等人。2008).
在尼古丁透皮贴片治疗后,单例难治性ADSHE患者的癫痫发作频率得到改善。2003).
尼古丁对癫痫发作频率的有利影响也被描述为来自两个欧洲ADSHE家庭的22名患者中的9名CHRNA4突变(Brodtkorb和Picard2006).考虑到胆碱能系统在唤醒调节过程中的作用,这些观察结果提示在SHE/ADSHE患者中尼古丁缺陷、唤醒调节改变和癫痫发作之间可能存在联系。然而,尽管报道了尼古丁在降低癫痫发作频率方面的积极作用,但一项病例对照家庭研究并未发现SHE患者及其亲属吸烟倾向高于对照组(Naldi等。2013).
最近,Puligheddu和同事们已经证明非诺贝特,一种过氧化物酶体增殖激活受体(PPARa)的激动剂,作为nAChRs的负调制剂,可能对SHE突变小鼠模型和耐药SHE患者都有有益的影响(Puligheddu et al.)。2017).有趣的是,非诺贝特在突变的(CHRNA2而且CHRNA4)和非突变SHE患者。
CRH
在散发性和ADSHE病例中,除了编码nAChR亚基的突变外,还报道了其他突变。2005年,Combi等人发现了两种新的核苷酸变异CRH(促肾上腺皮质激素释放激素,MIM *122560)启动子在ADSHE谱系和零星病例(Combi等。2005)但这些发现并没有在更大的系列中得到重复。第一种(g.1470G > A)在3例ADSHE谱系和2例无家族史的患者中复发,并被证明可增加CRH水平。后来在另一个家庭的两个受影响的兄弟姐妹中也发现了同样的变化,但在健康的父亲中也存在纯合子状态(Combi等。2008),从而降低这种变化是致病的可能性。第二种(g.1166G > C)只在一个科的索引情况下被发现(Combi等人。2005),后来被认为是非因果关系(Combi et al.;2008).
最后,在另外一个ADSHE家族中检测到一个新的杂合外显子错义改变。在这种情况下,体外试验显示CRH浓度降低(Sansoni等。2013).
CRH编码广泛分布于整个中枢神经系统的神经递质/神经调质,该神经递质/神经调质在下丘脑外回路中起作用,以整合对压力的多系统反应,控制睡眠和唤醒等众多行为(Combi等。2005).作者认为CHR水平的改变(降低/增加)会通过过度睡眠碎片化和大脑过度兴奋引起癫痫发作易感性的增加(Combi等。2005).
KCNT1
直到2012年,Heron和合作者将全基因组连锁分析与新型下一代测序(NGS)技术相结合,发现了一种新的SHE基因,对SHE遗传背景的进一步了解才得以实现。KCNT1(钾钠激活通道亚家族T成员1,MIM *608167),编码钠激活钾通道的一个亚单位(Heron等。2012).突变KCNT1在三个完全外显率的ADSHE家庭和一个散发病例中被检测到,这些家庭都有早发性难治性癫痫,可能的智力残疾和精神或行为问题,包括精神病、紧张症和攻击性(Heron et al.)。2012).轻度皮质发育畸形(MCD)的同时发生,即组织学证实的FCD I型和脑室周围结节性异位,最近在一些个体中有报道(Rubboli等。2018).
同时,从头获得功能突变KCNT1在12名不相关的婴儿恶性移行局灶性癫痫(MMFSI)患者中,有6人被确定(Barcia等。2012),一种罕见的早发性癫痫性脑病,其特征为难治性、多态性局灶性癫痫发作和生命前6个月内精神运动发育停滞(Coppola等。1995).
KCNT1在额叶皮层的神经元中表达(Bhattacharjee et al。2002),并与KCNT2形成异四聚体通道复合物,由一个小的氨基端结构域、一个包含六个节段的跨膜结构域和一个含有串联钾导结构域调节因子的胞内羧基端结构域和一个NAD +结合结构域组成。它的活性有助于重复放电后的缓慢超极化,调节爆发的速度,并提高动作电位锁定外来刺激的准确性(巴塔查尔吉和卡兹马雷克2005;布朗等人。2008).ADSHE和MMFSI中最初描述的所有突变都集中在钾电导调节和烟酰胺腺嘌呤二核苷酸(NAD+)结合域周围,该结合域也与蛋白质网络相互作用,包括脆性X智力迟钝蛋白。功能性研究表明KCNT1突变导致通道的本构过度激活,损害其门控并抑制其亚电导状态,这对离子电流和振幅的增加有影响。此外,它们还可能改变c端区域的构象及其与发育相关蛋白相互作用的能力(Barcia等。2012).与野生型相比,ADSHE突变与电流增大约3倍相关,而与MMFSI相关的电流增大约5倍。这些增加的离子电流振幅的差异似乎解释了与之相关的表型的多样性KCNT1突变(Milligan et al。2014).一些变异体在一些患者中复发,提示存在突变“热点”KCNT1(Møller et al.;2015).特定的突变(p.G288S和p.R398Q)可以导致ADSHE或MMFSI,即使在同一个家族中,这表明基因型-表型相关性并不直接(Kim等人)。2014;Møller等。2015).
在过去几年里,KCNT1除了ADSHE和MMFSI表型外,还涉及广泛的局灶性/多局灶性癫痫和早发型癫痫性脑病(Shimada et al.;2014;Møller等。2015;Ohba等人。2015;里佐等人。2016).
最近,一种新的奎尼丁治疗方法在少数耐药癫痫患者身上进行了测试KCNT1基因突变,没有人符合SHE表型,结果相互矛盾(Mikati et al。2015;Abdelnoura等人。2018).
三名不相关的FCD I型患者的手术治疗在两名患者(恩格尔IV类)中无效,仅在一名患者(恩格尔II类)中改善了癫痫发作频率。作者推测手术效果不佳可能是由于FCD I型的弥漫性或生殖细胞引起的更广泛的致痫网络KCNT1癫痫手术后维持癫痫发作倾向的突变(ruboli等。2018).
GATOR1-complex基因
2013年,DEPDC5 (DEP结构域包含5,MIM *614191)突变与家族性灶性变灶性癫痫(FFEVF)有关(Dibbens等。2013),以及不同比例(12.5-37%)的异质家族性fe,包括ADSHE (Ishida et al.;2013;皮卡德等人。2014).
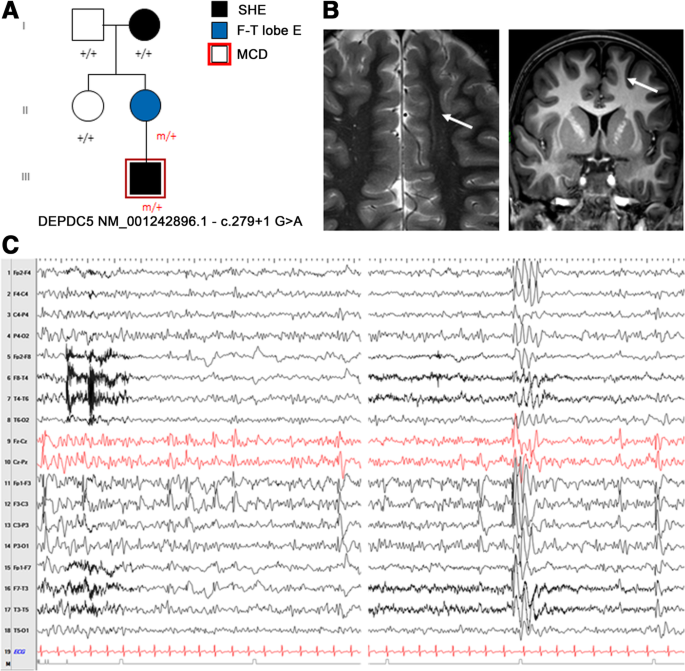
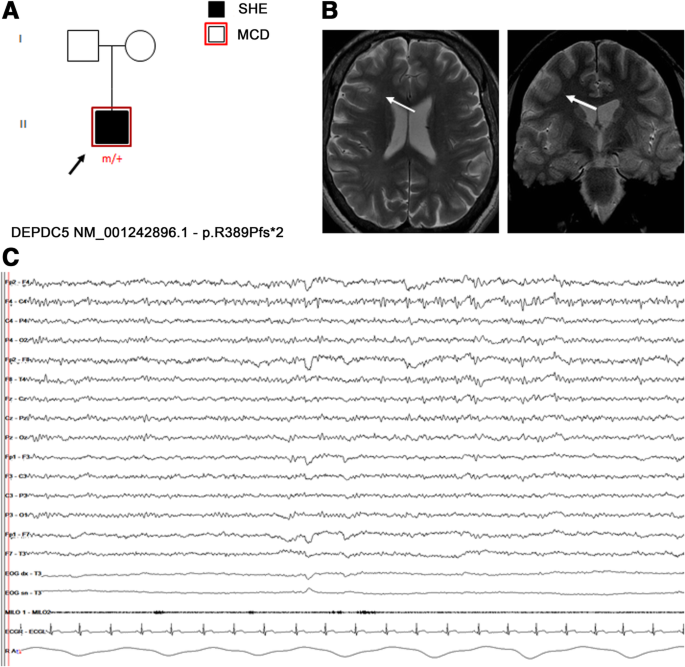
特别是,在30个ADSHE表现家族中的13%中发现了DEPDC5功能丧失突变(Picard et al。2014).电临床评估显示,与经典表型相比,耐药率和白天癫痫发作率更高(Picard等。2014).DEPDC5突变与损伤性和非损伤性癫痫有关,即使在同一个家族中也是如此。在一些个体中,脑MRI显示MCD,范围从FCD到细微的带状异位,主要模式为沟底发育不良,各种FCD IIb型(Scheffer等。2014)(图。1得了;无花果。2a - c)。
一个携带移码DEPDC5突变p.R389Pfs*2的分离SHE患者的家系先前发表在Baldassari et al.,2019(渊源者18)。b定向MRI显示右侧额中回局部皮质厚度增加,灰白色质交界处模糊(白色箭头),提示局灶性皮质发育不良。c间断期脑电图显示在右侧额中央区域出现重复的低振幅锐波,因困倦而增强
随后,基因突变NPRL2(NPR2-like Protein, MIM *607072)2016),NPRL3(氮渗透酶调节剂样3,MIM *600928) (Korenke et al.;2016)在ADSHE和散发病例中均有报道。
DEPDC5,NPRL2而且NPRL3GATOR1复合物(Gap Activity TOward Rags 1)是哺乳动物雷帕霉素靶蛋白(mTOR)复合物1 (mTORC1)的负调控因子(Bar-Peled et al.)。2013).这些基因中描述的大多数变异是功能缺失突变,影响蛋白产物,从而导致mTORC1通路的过度激活(van Kranenburg等人)。2015).根据这一证据,到目前为止,mtor途径基因的大量种系和体细胞(仅脑)突变与一系列损伤性和非损伤性FEs相关。在病变病例中,已在几种mcd中鉴定出这些基因突变,特别是高达46%的FCD IIb型(Nakashima et al.)。2015;Scheffer等人。2014;拉尔等人。2014;马丁等人。2014;Scerri等人。2015;D'Gama等人。2015;Baulac等人。2015).
的作用的额外见解DEDCD5fcd相关局灶性癫痫的研究来源于大鼠模型(Marsan等。2016).杂合子大鼠皮层神经元兴奋性和放电模式改变,皮层巨细胞畸形神经元和气球样细胞强烈表达磷酸化rpS6,支持mTORC1上调。这些神经病理异常让人联想到人类FCD的标志性脑病理。
这些数据表明,遗传和结构原因也不是相互排斥的,特别是与gator1复杂基因相关的SHE可能具有遗传-结构病因。
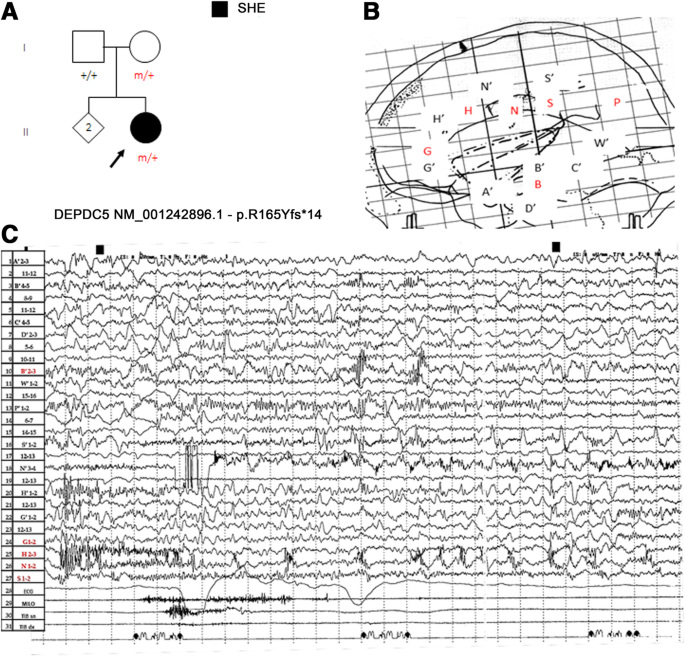
fcd是FE基础上最常见的、潜在可治疗的结构障碍,导致高达42%的耐药病例(Harvey et al。2008).一般来说,癫痫手术对这些患者来说是一种非常有效的治疗选择,可以让患者有机会实现癫痫发作自由,并有可能戒断药物,同时还可以改善生活质量、就业率和入学率(Wiebe等人)。2001).虽然接受癫痫手术的突变患者只是传闻,但手术已被证明对常规神经影像学可明显检测到MCD的病例有疗效(Baulac等。2015),这表明癫痫发生是由基因决定的局灶性大脑结构病变所支撑的,即使存在种系突变。另一方面,手术在非病变种系突变病例中的作用仍有争议/需要澄清。在引用的一系列非损伤性病例中,接受手术的结果比损伤性病例更差(Baulac等。2015).此外,在携带DEPDC5截断突变的患者中进行的SEEG研究未能确定明确的致痫区(图2)。3.a - c)。这些证据表明,DEPDC5种系突变可能在具有多个独立致痫灶或广泛致痫网络的非损害性难治性局灶性癫痫中发挥作用(Ferri等。2017).根据这一假设,mTOR基因生发突变的存在可能不仅是手术的禁忌症,而且可能是术前侵入性手术(即立体脑电图,皮质描记术)的禁忌症。然而,鉴于DEPDC5突变也与FCD I型病变相关(Baulac等。2015),在这些非病变病例中,不能排除常规脑MRI所遗漏的多个弥漫性微妙发育不良区域的存在。
一个一名57岁女性的谱系,她的健康母亲遗传了DEPDC5, p.Arg165Tyrfs*14的移码突变。先前发表在Ferri等。2017.b患者43岁时进行立体脑电图(SEEG)研究,双侧边缘探查延伸至下顶叶。所示的SEEG探查(侧位视图)包括15个主要植入左侧的脑内电极。脑电图聚焦区域主要由H电极探测。重音黑色字母(A ', B ', C ', D ', G ', H ', N ', S ', W ')表示左侧;红色字母(B, G, H, N, S, P)表示正确。cSEEG发作记录显示在典型的夜间高运动性癫痫发作前,扣带前中回均有快速多刺活动,主要表现在右侧中前扣带皮层(H电极)。注意,发作间期活动也记录在远离发作区的电极上。虽然电模式提示局灶性皮质发育不良,但量身定制的脑MRI没有揭示
CABP4
一种新的错义突变CABP4在一个中国家庭中发现了编码神经元Ca2 +−结合蛋白4 (CaBP4)的基因,其中包括11个被诊断为ADSHE的个体(Chen et al.;2017).
PRIMA1
在一个两代意大利血统的澳大利亚家庭中,Hildebrand及其合作者通过全外显子组测序(WES)分析发现PRIMA1的纯合突变(Hildebrand et al.)。2015).该基因编码了一种跨膜蛋白,该蛋白锚定乙酰胆碱酯酶(AChE),这种酶将乙酰胆碱水解为神经元的膜筏。经鉴定的C .93 + 2 T > C突变导致PRIMA1敲除,乙酰胆碱减少,突触处乙酰胆碱积累,如PRIMA1敲除小鼠所示。作者得出结论,与编码nAChR亚基的基因功能突变的增加类似,增强的胆碱能反应可能是该家庭中严重SHE和智力残疾的原因。然而,除了这一单一谱系之外,这一发现还没有被复制,因为在数百个SHE先验位点的确认队列中没有发现其他突变(Hildebrand et al.)。2015).
结论
SHE是一种异质遗传综合征,由参与不同分子途径的基因引起。尽管对SHE的遗传背景进行了大量的研究,但遗传原因可能在非常低比例的散发性病例和不到30%的ADSHE家庭中被识别出来,且外显率不完全(Kurahashi H et al.,2002).这是来自不同病例系列(主要是家族)研究的累积估计,每个病例系列都侧重于筛查单一SHE基因的突变。基于可靠的诊断标准,缺乏对家族性和散发性SHE患者人群的系统遗传特征。
此外,迄今为止,疾病严重程度、遗传结果和已知基因突变的功能影响之间没有明确的相关性(Tinuper et al.)。2016),需要进一步研究SHE的基因型-表型相关性。到目前为止,KCNT1基因突变的SHE患者似乎表现出更严重的形式(Heron等。2012),而gator1复合体基因突变与SHE的遗传结构病因学有关。
虽然目前基因检测在临床实践中的作用有限,因为遗传学解释了少数SHE患者,但从临床角度来看,即使在不主要考虑遗传病因的孤立病例中,分析SHE相关基因也有价值,因为这可能对诊断工作和临床管理产生影响。特别是,检测到gator1复合体基因突变是fcd的一个危险信号,fcd是难治性FE基础上最常见的潜在可治疗的结构疾病。在携带gator1复合体基因致病变异的非病变病例中,需要反复仔细地复查靶向的高分辨率成像,以突出易受手术影响的微妙结构异常。此外,在gator1复合体基因中鉴定致病或可能致病的突变,以及在mTOR通路上游编码蛋白的基因中鉴定,即使在被认为不适合手术的突变患者中,也可能具有重要的未来治疗意义。事实上,基于mTOR抑制剂的一类新型疗法的开发,其原型是雷帕霉素,将改善这些患者的治疗和预后。目前正在进行使用mTOR抑制剂治疗癫痫并可能预防癫痫的临床前和临床试验(Citraro等。2016).
数据和材料的可用性
不适用。
缩写
- 疼痛:
-
乙酰胆碱酯酶
- ADNFLE:
-
常染色体显性夜间额叶癫痫
- ADSHE:
-
常染色体显性睡眠相关性高运动性癫痫
- FCD:
-
局灶性皮质发育不良
- 菲:
-
局灶性癫痫
- FFEVF:
-
灶性可变的家族性局灶性癫痫
- mTOR:
-
雷帕霉素的哺乳动物靶点
- mTORC1:
-
雷帕霉素复合物的哺乳动物靶点
- 乙酰胆:
-
神经元烟碱乙酰胆碱受体
- NAD:
-
烟酰胺腺嘌呤二核苷酸
- NFLE:
-
夜间额叶癫痫
- NPD:
-
夜间阵发性肌张力障碍
- 宠物:
-
正电子发射断层扫描
- PPARa:
-
过氧化物酶体增殖物激活受体
- SEEG:
-
Stereoelectroencephalography
- 她:
-
与睡眠相关的高运动性癫痫
- 韦斯:
-
全外显子组测序
参考文献
Abdelnoura E,等。年龄是否影响KCNT1突变患者对奎尼丁的反应?报告3例新发病例并复习文献。扣押。2018;55:1-3。
阿兰尼斯-格瓦拉一世等人。睡眠障碍、社会经济地位和癫痫发作控制是癫痫患者生活质量的主要预测因素。癫痫行为学杂志2005;7:481-5。
Aridon P,等。神经元尼古丁受体α 2亚基的敏感性增加可引起家族性癫痫伴夜间徘徊和发作性恐惧。胡姆·热内。2006;79:342-50。
Baldassari S,等。与癫痫相关的GATOR1变异。国际医学杂志2019;21(2):398-408。
Barcia G,等。新生功能获得性KCNT1通道突变导致婴儿恶性迁移性部分癫痫发作。植物学报。2012;44(11):1255-9。
Bar-Peled L等人。一种具有GAP活性的肿瘤抑制复合物,用于标记mTORC1的氨基酸充足性的rag GTPases。科学。2013;340:1100-6。
Baulac S,等。家族性局灶性癫痫伴局灶性皮质发育不良因DEPDC5突变。安神经。2015;77:675-83
Bertrand D等人。nAChRs突变如何引起adfle癫痫。癫痫。2002;43(增刊5):112-22。
Bertrand D等人。CHRNB2突变I312M与癫痫和明显的记忆缺陷有关。神经生物学杂志,2005;20(3):799-804。
Bhattacharjee A, Kaczmarek LKJ。对于K+通道,Na+是新的Ca2+。神经科学2005;28:422-8。
Bhattacharjee A,等。大鼠中枢神经系统松弛钾通道的定位。中华神经外科杂志,2002;
Bisulli F,等。夜间额叶癫痫家族性唤醒异常频率增加:常见机制?Epilepsia。2010;51:1852-60。
Brodtkorb E, Picard F.烟草习惯调节常染色体显性夜间额叶癫痫。癫痫行为学。2006;9:515-20。
Brown MR等。松弛K+通道的氨基端异构体,由替代启动子调节,差异调节节律性放电和适应。中国生物医学工程学报,2008;
陈毅,等。偶发性夜间额叶癫痫中尼古丁乙酰胆碱受体基因CHRNA4的新突变。癫痫决议2009;83(2-3):152-6。
陈志华,等。外显子组测序在中国常染色体显性夜间额叶癫痫谱系中发现Ca2+−结合蛋白4 (CABP4)中出现了一个新的错义突变c.464G>a (p.G155D)。Oncotarget。2017;8:78940-7。
赵耀文,等。韩国常染色体显性夜间额叶癫痫和智力迟钝亲属。神经科学。2003;60:1625-32。
赵耀文,等。常染色体显性夜间额叶癫痫和轻度记忆障碍与神经元烟碱乙酰胆碱受体CHRNB2突变I312M相关。癫痫行为学杂志,2008;13:361-5。
Citraro R等。mTOR通路抑制作为癫痫和癫痫发生的新治疗策略。Pharmacol res 2016; 107:333-43。
Combi R,等。adfle的两个新的易感位点。Brain res 2005; 67:257-63。
Combi R,等。皮质促肾上腺皮质激素释放激素(CRH)启动子在夜间额叶癫痫病例中的复合杂合性优势。中国睡眠科学,2008;17(3):361-2。
Conti V等。由于CHRNA2功能丧失而伴有阵发性觉醒的夜间额叶癫痫。神经学。2015;84(15):1520 - 8。
科波拉G等。婴儿期移动性部分癫痫:一种伴有发育停止的恶性疾病。Epilepsia。1995;36:1017-24。
De Fusco M,等。尼古丁受体β 2亚单位在夜间额叶癫痫中发生突变。Nat Genet, 2000; 26:275-6。
D'Gama AM,等。哺乳动物雷帕霉素通路突变靶点导致半巨脑畸形和局灶性皮质发育不良。中华神经科学杂志,2015;26(4):529 - 529。
Díaz-Otero F,等。常染色体显性夜间额叶癫痫伴CHRNB2基因突变。Epilepsia。2008;49(3):516 - 20。
Dibbens LM,等。DEPDC5突变可引起灶性变的家族性灶性癫痫。Nat Genet, 2013; 45:546-51。
Dobesberger J等。成功的手术治疗岛叶癫痫伴夜间高运动性癫痫。Epilepsia。2008;49:159 - 62。
Fedi M,等。常染色体显性夜间额叶癫痫纹状体D1受体结合减少。神经学。2008;71:795-8。
Ferri L,等。由DEPDC5突变引起的睡眠相关性高运动性癫痫患者的立体脑电图研究。扣押。2017;53:51-4。
Gibbs SA,等。睡眠相关的癫痫行为和非rem相关的睡眠异常:来自立体脑电图的见解。睡眠医学Rev. 2016; 25:4-20。
哈维·阿斯,等。定义小儿癫痫手术患者的国际实践范围。Epilepsia。2008;49:146-55。
Heron SE,等。钠门控钾通道基因KCNT1的错义突变导致严重的常染色体显性夜间额叶癫痫。Nat Genet, 2012; 44:1188-90。
Hildebrand MS,等。PRIMA1突变:夜间额叶癫痫的新病因。中华神经外科杂志2015;2(8):821-30。
Hirose S,等。常染色体显性夜间额叶癫痫的一种新的CHRNA4突变神经学。1999;53(8):1749 - 53。
Hoda JC,等。人夜间额叶癫痫:离子通道孔外致病性烟碱乙酰胆碱受体β -亚基突变的药物基因组谱。中国药理学杂志。2008;74(2):379-91。
石田S,等。DEPDC5突变可引起常染色体显性局灶性癫痫。Nat Genet, 2013;45:55 - 5。
Kim GE,等。人类松弛钾通道突变增加了个体通道之间的正合作性。Cell rep 2014; 9:1661-72。
Korenke GC等人。由GATOR1复合体基因NPRL3突变引起的夜间额叶癫痫。Epilepsia。2016;(3):57 e60-3。
Kurahashi H, Hirose s,常染色体显性夜间额叶癫痫。In: Pagon RA, Adam MP, Ardinger HH, Wallace SE, Amemiya A, Bean LJH, Bird TD, Ledbetter N, Mefford HC, Smith RJH, Stephens K,编辑。GeneReviews®。西雅图:华盛顿大学西雅图分校;2002.p . 1993 - 2017。可以从http://www.ncbi.nlm.nih.gov/books/NBK1169/[首次张贴日期:二零零二年五月十六日;最后更新:2018年3月15日。
Lal D,等。儿童遗传性局灶性癫痫的DEPDC5突变。Ann Neurol. 2014; 75:788-92。
Leniger T,等。夜间额叶癫痫低外显的新的Chrna4突变。Epilepsia。2003;44(7):981 - 5。
Licchetta L,等。睡眠相关高运动性癫痫:一项大队列研究的长期结果。神经学。2017;88(1):70 - 7。
刘浩,等。在一名中国患者中发现尼古丁乙酰胆碱受体基因CHRNB2的新突变:其在非家族性夜间额叶癫痫中的可能意义。Epilepsy res 2011;95(1-2): 94-9。
催眠性阵发性肌张力障碍:癫痫发作还是一种新综合征?睡眠。1981;4(2):129 - 38。
M马卡里奥,李乐曼。阵发性夜间肌张力障碍,表现为白天过度嗜睡。神经科学。1990;47:291-4。
Marini C, Guerrini R.尼古丁乙酰胆碱受体在睡眠相关癫痫中的作用。生物化学,2007;74:1308-14。
Marsan E,等人。Depdc5基因敲除大鼠:一种新的肿瘤模型。神经生物学杂志,2016;89:180-9。
马丁C等人。在法裔加拿大人群中,反复突变的DEPDC5易患局灶性癫痫。Clin Genet, 2014; 86:570-4。
McLellan A,等。两个苏格兰家族的表型比较,不同基因突变导致常染色体显性夜间额叶癫痫。Epilepsia。2003;44:613-7。
孟嗨V,等。睡眠相关的高运动性癫痫:患病率、影响和管理策略。《睡眠科学》2018;10:317-26。
Mikati MA,等。奎尼丁治疗kcnt1阳性癫痫。中华神经科学杂志,2015;26(6):995-9。
Milligan CJ,等人。奎尼丁可逆转KCNT1在2种癫痫表型中的功能增益。安神经。2014;75:581-90。
Møller RS,等。KCNT1突变可引起一系列局灶性癫痫。Epilepsia。2015;56 (9):e114-20。
夜间阵发性肌张力障碍和夜间徘徊。神经学。1992;42:61-7。
Montagna P,等。夜间癫痫发作与唤醒性睡眠异常。Somnologie。2008;12:25-37。
Montavont A,等。侧侧和近壁癫痫的高运动性癫痫发作。癫痫行为学杂志,2013;28:408-12。
Nakashima M,等。MTOR基因的体细胞突变可导致局灶性皮质发育不良IIb型。安神经。2015;78:375-86。
Naldi I等人。吸烟习惯在夜间诱发额叶癫痫。癫痫行为学杂志,2013;26:114-7。
阮dk,等。重新探讨脑岛在难治性部分癫痫中的作用。Epilepsia。2009;50:2599 - 604。
Nobili L,等。夜间额叶癫痫:阵发性运动发作的脑内记录,其复杂性增加。睡眠。2003;26:883-6。
Nobili L,等。起源于颞叶的睡眠相关多动性癫痫。神经学。2004;62:482-5。
Nobili L,等。耐药性夜间额叶癫痫的外科治疗。大脑。2007;130:561 - 73。
Nobili L,等。泰勒的局灶性皮质发育不良会增加睡眠相关癫痫的风险。Epilepsia。2009;50:2599 - 604。
Ohba C,等。KCNT1在早发型癫痫性脑病中的新生突变。Epilepsia。2015;56 (9):e121-8。
Oldani A,等。常染色体显性夜间额叶癫痫:40例患者的视频多导睡眠描记术和遗传评估以及癫痫综合征的描述。大脑。1998;121:205-23。
与白天过度嗜睡有关的阵发性睡眠觉醒:夜间癫痫的一种形式。神经学。1986;36:95-8。
Phillips HA,等。常染色体显性夜间额叶癫痫基因定位于染色体20q13.2。纳特·热内。1995;10:117-8。
Phillips HA,等。零星夜间额叶癫痫的从头突变。神经科学进展。2000;48(2):264-7。
Phillips HA,等。CHRNB2是常染色体显性夜间额叶癫痫相关的第二个乙酰胆碱受体亚基。王文杰,王文杰。2001;26(1):1 - 5。
Picard F,等。adfle患者体内尼古丁受体密度的改变:一项PET研究。大脑。2006;129:2047-60。
Picard F,等。常染色体显性夜间额叶癫痫家族中的DEPDC5突变神经学。2014;82:2101-6。
Proserpio P,等。以睡眠相关的阵发性运动行为为表现的岛盖性癫痫:一项立体脑电图研究。Epilepsia。2011;52:1781 - 91。
Provini F,等。夜间额叶癫痫。100例连续病例的临床和测谎概述。大脑。1999;122:1017-31。
Puligheddu M,等。非诺贝特辅助治疗耐药性夜间额叶癫痫的基本原理。Epilepsia。2017;58:1762 - 70。
兰斯S,等。高运动性癫痫的临床模式及潜在致痫带分析。Epilepsia。2008;49:2030-40。
Ricos MG,等。雷帕霉素通路调控因子NPRL2和NPRL3哺乳动物靶点突变可引起局灶性癫痫。Ann Neurol, 2016; 79:120-31。
Rizzo F等人。两种新生KCNT1突变在婴儿期恶性迁移性部分癫痫患儿中的特征。神经科学,2016;72:54-63。
Rozycka A,等人。常染色体显性夜间额叶癫痫白人家族中CHRNA4 S284L突变的证据。Epilepsia。2003;44(8):1113 - 7。
ruboli G,等。KCNT1突变导致睡眠相关高运动癫痫患者皮质发育轻度畸形。中华神经外科杂志,2018;6(2):386-91。
李志强,李志强,等。夜间运动亢进,提示额叶癫痫,可起源于脑岛。Epilepsia。2006;47:755 - 65。
Sáenz A,等。常染色体显性夜间额叶癫痫在一个西班牙家族与Ser252Phe突变CHRNA4基因。中华神经外科杂志,1999;26(8):344 - 344。
桑索尼V等。一名意大利散发性夜间额叶癫痫患者的从头突变。J Sleep res 2012; 21:352-3。
桑索尼V等。adfle家族中发现的CRH错义突变的功能特征。公共科学图书馆,2013;8(4):e61306。
Scerri T,等。由DEPDC5种系突变引起的家族性IIA型皮质发育不良。中华神经外科杂志2015;2(5):575-80。
Scheffer IE等。常染色体显性额叶癫痫被误诊为睡眠障碍。《柳叶刀》杂志。1994;343:515-7。
Scheffer IE等。哺乳动物雷帕霉素调节因子DEPDC5靶基因突变导致局灶性癫痫伴脑畸形。安神经。2014;75:782-7。
主要与睡眠相关的额叶癫痫的白天疲劳。病例报告。Nervenarzt。1998;69:166 - 70。
Shimada S,等。一名日本婴儿癫痫伴移动性局灶性癫痫患者的新型KCNT1突变。Hum Genome Var. 2014;1:14027。
Steinlein OK。家族性夜间额叶癫痫的遗传异质性。Prog Brain res 2014; 213:1-15。
Steinlein,好的,等等。神经元烟碱乙酰胆碱受体α4亚基错义突变与常染色体显性夜间额叶癫痫相关。纳特·热内,1995;11:201-3。
Steinlein,好的,等等。常染色体显性夜间额叶癫痫家族CHRNA4基因插入突变胡文杰。1997;6(6):943-7。
Steinlein,好的,等等。挪威一个夜间额叶癫痫家族CHRNA4 Ser248Phe突变的独立发生。Epilepsia。2000;41(5):529 - 35。
Steinlein,好的,等等。家族性夜间额叶癫痫的突变可能与不同的神经表型有关。扣押。2012;21:118-23。
Terzaghi M,等。轻微运动事件和癫痫样放电与NFLE唤醒波动的耦合。Epilepsia。2008;49:670-6。
从夜间额叶癫痫到睡眠相关的高运动性癫痫:35年的诊断挑战。扣押。2017;44:87 - 92。
Tinuper P,等。夜间阵发性肌张力障碍伴短时间发作:3例有证据表明癫痫性额叶起源的癫痫发作。Epilepsia。1990;31(5):549 - 56。
Tinuper P,等。睡眠相关性高运动性癫痫的定义和诊断标准。神经学。2016;86:1834-42。
van Kranenburg M,等。与局灶性癫痫相关的DEPDC5变异的初步功能评估和分类。胡木,2015;36(2):200-9。
Vaugier L等。颞叶起源的多动性癫痫的神经网络。癫痫决议2009;86:200-8。
Vignatelli L等。夜间额叶癫痫患者白天过度嗜睡与主观睡眠质量:一项病例对照研究。癫痫。2006;47(增刊5):73-7。
Vignatelli L等。意大利艾米利亚-罗马涅地区博洛尼亚和摩德纳成人人群夜间额叶癫痫患病率。睡眠。2015;38:479 - 85。
Vignatelli L等。博洛尼亚和摩德纳、艾米利亚-罗马涅地区成年人群夜间额叶癫痫患病率。意大利睡眠。2017;1(2):40。
王my,等。一名中国非家族性夜间额叶癫痫患者的尼古丁乙酰胆碱受体基因CHRNA4的新突变。Epilepsy res 2014;108(10): 1927-31。
Waterman K,等。一种由前额叶近端癫痫灶引起的癫痫综合征。神经学。1987;37(4):577 - 82。
Wiebe S,等人。手术治疗颞叶癫痫的随机对照试验。中华医学杂志2001;35(4):344 - 344。
Williamson PD等人。额叶源性复杂部分癫痫发作。神经科学学报,1985;18(4):497-504。
Willoughby JO,等。尼古丁在adfle中的抗癫痫作用:一项N-of-one研究。Epilepsia。2003;44(9):1238 - 40。
Zucconi M, et al。常染色体显性夜间额叶癫痫患者睡眠的宏观结构和微观结构。中华临床神经生理学杂志2000;17:77-86。
确认
我们要感谢博洛尼亚Bellaria医院的所有合作者,尤其是Federica Pondrelli医生和Toni Francesco医生。我们还要感谢我们所有的脑电图技术人员,特别是弗朗西斯科·米尼亚尼。
资金
一个也没有。
作者信息
作者及隶属关系
贡献
BF起草了工作,并实质性地修改了它;LL起草工作;TP修改了作品。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
Bisulli, F., Licchetta, L. & Tinuper, P.睡眠相关的超运动性癫痫(SHE):一种具有异质性遗传病因的独特综合征。睡眠科学实践3., 3(2019)。https://doi.org/10.1186/s41606-019-0035-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s41606-019-0035-5
关键字
- 癫痫
- 与睡眠相关的高运动性癫痫
- 夜间额叶癫痫
- 病因
- 遗传学;structural-genetic