摘要
肢带肌营养不良症(MD) 2B型(LGMD2B)和杜氏肌营养不良症(DMD)分别由Dysferlin和Dystrophin基因突变引起。我们最近在典型的轻度铁蛋白异常和肌营养不良小鼠模型中证实,血浆胆固醇水平升高严重加剧肌肉萎缩,DMD患者表现为原发性血脂异常,其特征为血浆胆固醇和甘油三酯升高。在此,我们研究了LGMD2B的脂蛋白异常,以及他汀类药物治疗是否能保护Dysf小鼠(Dysf)免受肌肉损伤。在此,我们分析了LGMD2B患者和Dysf小鼠的脂蛋白和肝酶。辛伐他汀在DMD小鼠模型中表现出抗肌肉萎缩作用,并纠正脂质代谢和内源性胆固醇合成关键标志物的异常表达,在Dysf小鼠中进行了测试。肌肉损伤和纤维化通过免疫组织化学和胆固醇信号通路通过Western blot进行评估。与健康对照组相比,LGMD2B患者血清高密度脂蛋白胆固醇(HDL-C)水平降低,尽管没有肝功能障碍,但总胆固醇(CHOL)/HDL-C比值异常的患病率更高。虽然Dysf小鼠的CHOL和相关HDL-C和ldl - c相关部分减少,但辛伐他汀治疗不能防止股四头肌和三头肌群的肌肉萎缩,也不能纠正异常低密度脂蛋白受体(LDLR)和3-羟基-3-甲基戊二酰辅酶A还原酶(HMGCR)蛋白表达。LGMD2B患者出现HDL-C血清浓度降低,这是一种主要的代谢共病,因此,他汀类药物治疗不太可能防止该人群的肌肉萎缩。我们建议LGMD2B和DMD一样,应该被认为是一种新型的遗传性血脂异常。
简介
肌肉营养不良症(MD)是一种异质性的肌肉萎缩疾病。肢带型肌肉营养不良症(MD) 2B型(LGMD2B)是由Dysferlin基因突变引起的,而更为常见和严重的杜氏肌营养不良症(DMD)是由Dystrophin基因突变引起的[1].Dysferlin [2]是一种跨膜蛋白,可调节修复囊泡向受损肌膜的钙依赖性募集和融合,以及表面结合蛋白的转运[3.].在成年早期(10-30岁),失联蛋白正常表达或活动的丧失导致肌肉萎缩,最终在诊断后大约10-20年导致完全的行走功能障碍[2].相比之下,由于严重的骨骼肌萎缩和相关的心肺衰竭,DMD导致12岁时轮椅依赖[4,5,6].与DMD不同,DMD的药理学方法的进步有助于提高预期寿命[7,8,9],目前LGMD2B患者没有治疗方案。
我们的研究小组已经表明,使用表型轻度营养不良蛋白缺乏(Dysf)和营养不良蛋白缺乏(mdx) LGMD2B和DMD小鼠模型表明,通过载脂蛋白E (ApoE)失活(参与脂质代谢的关键基因)提高血浆胆固醇,导致肌肉疾病严重程度急剧加重[10];事实上,Dysf/ApoE双敲除(DKO)和mdx/ApoE双敲除(DKO)小鼠表现出人源化的富含脂质或纤维化的肌肉浸润、严重的肌肉萎缩和临床行走功能障碍,特别是在喂食高脂肪饮食(HFD)时[10],因此表明异常调节的血浆脂蛋白代谢可能在md相关的肌肉萎缩中起加剧作用。我们进一步在Dysf和mdx肌肉疾病的严重程度可根据血浆脂蛋白含量进行分级,更重要的是,在两种模型中,使用胆固醇阻断剂(如依zetimibe)可减轻肌肉疾病的严重程度[11].从临床角度来看,我们也报道了dystrophin-deficient DMD患者的原发性血脂异常,包括总胆固醇(CHOL)和甘油三酯(TG)水平升高[12,13,14]、未用药的DMD犬和杂合子女性携带者[12].最近对儿童DMD患者血浆的miRNA分析也强调了控制脂质代谢和内源性胆固醇合成的基因的失调,包括固醇调节结合蛋白(SREBP)和下游甲羟戊酸途径介质,如HMGCR [15].两个独立的实验室也报道了HMGCR抑制剂辛伐他汀可以有效地预防不良的心脏、骨骼和膈肌组织病理mdx老鼠(15,16,17].虽然这可能以多效性的方式发生,但其他人强调他汀类药物对营养不良蛋白缺乏的治疗价值很小mdx老鼠(18,19,20.],这让人们对内源性胆固醇合成和他汀类药物多效性在MD中的真实作用产生了怀疑。
为了更好地理解脂质处理异常在dysferlin缺乏症背景下的临床相关性,本研究比较了LGMD2B患者的脂质含量,并观察到,与DMD相比,男性和女性LGMD2B患者与对照组相比,HDL-C水平均显著降低。与WT小鼠相比,Dysf小鼠表现出较低的CHOL和相关的LDL-C和HDL-C组分,其肌肉组织表现出较高的HMGCR和LDLR蛋白表达。尽管降低了CHOL,但他汀多效性对dysf缺陷小鼠肌肉萎缩的组织学标记物没有有益影响。DMD和LGMD2B可能被认为是原发性遗传性血脂异常的一个新的异质性家族。
材料与方法
人体样本和血清学
LGMD2B和年龄匹配的对照组的血清样本来自纽卡斯尔大学管理的MRC罕见和神经肌肉疾病生物库。国家研究伦理服务(NRES)委员会纽卡斯尔和北泰恩赛德1批准事先收集所有知情同意用于研究用途的患者的样本(REC编号:19/NE/0028)。本研究中纳入的LGMD2B患者的年龄、性别、用药情况和10米计时步行试验数据集均来自于临床结果研究中有关代谢异常(COS)的研究记录。服用降胆固醇药物(包括他汀类药物和依zetimibe)或类固醇的患者的血清被排除在选择之外。值得注意的是,脂蛋白水平随食物摄入量的变化最小(甘油三酯变化最大,但最高为20%或±0.3 mmol/L) [21,22].全血在2850 g下离心10分钟,取出上清血浆,在−80°C保存,等待使用,随后在ubc附属圣保罗医院(人类伦理号:St. Paul 's Hospital)处理。H19-01573)在Siemens Advia 1800系统上用于CHOL、HDL-C和甘油三酯(TG) [10,23].低密度脂蛋白(LDL-C)胆固醇计算公式:TC-HDL-C -(TG/2.2)。通过麻醉小鼠心脏穿刺,在肝素化管中收集小鼠血浆,在4°C下以4000 RPM转速旋转10分钟,并在−80°C保存。对样品进行了如上所述的处理,并进行了微小的修改。20岁成年男女正常血脂水平描述如下:TC (< 5.2 mmol/L)、LDL-C (< 3.4 mmol/L)、HDL-C(男性>为1.03 mmol/L,女性>为1.3 mmol/L)和非HDL-C (< 4.1 mmol/L) [21,22,24].考虑到餐后对循环TG水平的影响,根据成人空腹和非空腹血浆TG的比较研究,男性正常范围的上限为< 1.7 mmol/L,女性为1.46 mmol/L [21,22,24].
动物模型和畜牧业
所有动物都被安置在一个12小时/12小时的光/暗循环,温度调节的设施中。所有动物实验程序均经UBC动物保护和伦理委员会批准,所有实验程序均符合《赫尔辛基宣言》。实验男女Dysf缺陷(Dysf;B6.129 -Dysftm1Kcam)和野生型(WT) C57BL/6小鼠经内部育种和基因分型[10,23,25].Dysf和C57BL/6小鼠随意补充常规饲料(chow;LabDiet 5001)或高脂肪饮食(HFD;Envigo TD.88137;总胆固醇0.2%,总脂肪21%,蔗糖34%),以复制正常血脂和高血脂条件。饮食干预开始于2个月大。辛伐他汀(JAMP Pharma)如前所述在饮用水中配制和给药[16,17].简单地说,将50 mg辛伐他汀溶解在1 ml乙醇中,以激活并溶解辛伐他汀的活性(羟基酸)形式,然后加入1 L碱性饮用水(pH~10) [16,17].小鼠接受辛伐他汀治疗(从2个月大开始),并每周更换两次饮用水。未经治疗的小鼠则饮用正常的碱性饮用水。
步态跟踪
从纸上记录的1.5 m距离小鼠后爪墨印完成步态分析。步长定义为来自同一脚的两个连续印记之间的距离。不包括小鼠暂停的区域,平均每只小鼠的总步长为2到3个重复。任何丧失功能导致完全无法行走的动物都被给予零分。
组织加工与免疫组化
四头肌、腓肠肌、胫骨前肌和肱三头肌,以及肝脏和附睾脂肪垫被切除,并在牺牲时称重。四头肌和肱三头肌的横切面石蜡切片(5 μm),用先前发表的马松三色染色[10,23].使用Aperio数字切片扫描仪扫描切片。通过手动追踪脂肪细胞含区来定量脂肪(先前通过周围磷脂染色来确认[10]),数据以占总肌肉面积的百分比(脂肪%)表示。通过手动追踪不含肌纤维的区域(例如,坏死和大块炎症)来量化损伤[10],数据表示为肌肉总面积的百分比(损伤%)。从总肌肉面积中进一步减去量化的脂肪和损伤面积,并用于确定健康肌纤维占据肌肉面积的百分比(健康%)。在Aperio ImageScope软件中使用正像素计数算法测量肌内胶原沉积或纤维化的百分比(色相值为0.66,色相宽度为0.25)[10].用阳性像素数乘以像素面积计算胶原蛋白阳性像素面积。像素比分别归一化为WT Chow肌肉的平均像素比,以归一化为跨组织切片的检测效率,因此表示为WT Chow值的%(归一化%)。
为了量化肌内胆固醇水平,还切割了股四头肌横向冰冻切片(5 μm),并用Filipin (no。SAE0088;σ;5毫克在1毫升DMSO)或抗hmgcr (Invitrogen;不。pa5 - 37367)。简单地说,肌肉切片横切腹部中部,安装在黄芩胶(no。G1128;SIGMA)并冷冻在液氮冷却的异戊烷中。对于Filipin,切片在1X PBS中洗涤,在4% PFA PBS中固定15分钟,在1X PBS中洗涤,然后在工作Filipin溶液(0.2 ml原液在10ml PBS中)中染色45分钟。 Samples were subsequently washed in 1X PBS, incubated in the nuclei marker DRAQ7 (no. ab109202; Abcam) for 5 min (1:400 in 1× PBS), and then cover slipped using fluorescent mounting media (no. S3023; DAKO). Images were taken on a Zeiss Axio Observer.Z1 microscope and images analyzed using ImageJ software. For HMGCR, sections were washed in 1XPBS, fixed in 4% PFA in PBS for 15 min, and then washed 3 × 5 min in PBS. Sections were blocked for 1 h at RT in 5% normal goat serum (NGS) in PBS, prior to incubation with anti-HMGCR (1:200; Thermo Fisher; no. PA5-37367) overnight at 4 °C. Slides were then washed with 1× PBS and incubated in block solution containing secondary antibody (Thermo Fisher no. A-21245) for 1 h at RT. Following antibody incubation, 3 × 5 min PBS washes were performed, and sections were mounted with VECTASHIELD Mounting Medium with DAPI (Vector Laboratories). Images were taken on a Zeiss AXIO Observer.Z1 microscope and images analyzed using Zeiss imaging software. Quantification was performed by taking the mean fluorescence intensity over 4–5 random images. Sections without incubation in Filipin solution or HMGCR antibodies were used as a negative control and are shown as insets where applicable.
免疫印迹
简单地说,冷冻腓肠肌和肝脏在液氮中研磨,粉末在冰冷的PBS、1% NP40和1mM EDTA缓冲液中均质,补充完全无EDTA蛋白酶抑制剂和PhosSTOP磷酸酶抑制剂片剂(Roche, Manheim, Germany),在4℃下以13000 g离心20分钟,并在−80℃保存至所需时。样品在10% SDS-PAGE TGX凝胶(Bio-Rad)上分离,并使用Trans - Turbo Blot系统(Bio-Rad)转移到硝化纤维膜上。LDLR和HMGCR Western blots分别在肝脏和骨骼肌中分别加载30 μg蛋白质。总AMPK和磷酸化的rpS6骨骼肌浓度为50 μg。用LDLR抗体进行免疫印迹(Proteintech;不。66414-1-Ig)和HMGCR (Invitrogen;不。pa5 - 37367)。磷酸化核糖体蛋白S6抗体(Ser235/236; p-rpS6) (no. 4858), total ribosomal protein S6 (no. 2217; t-rpS6), phosphorylated AMP-activated protein kinase α (Thr172) (no. 50081; p-AMPKα) and total AMPKα (no. 5832; t-AMPKα), and the loading control GAPDH (no. 2118S) were from cell signaling. After blocking in Tris-buffered saline with 1% casein (Bio-Rad), primary antibodies incubated in the same medium with the addition of 0.1% Tween20 each diluted 1:1000, except GAPDH (1:2500), and detected using either goat anti-rabbit DyLight680 and anti-mouse DyLight800 (both from Rockland Immunochemicals, no. 611-144-122 and no. 611-145-121; 1:1500-2500) and LI-COR Odyssey scanner. A common sample was loaded onto each gel to normalize for detection efficiencies across membranes.
统计分析
图表图例中描述了统计分析。数据使用GraphPad Prism v6进行分析。数据为均值±SEM。结果与p-值小于0.05被认为有统计学意义。
结果
基线对照和LGMD2B患者特征
为了评估LGMD2B是否导致脂蛋白异常,从LGMD2B和对照组患者中选择了生物库血清样本。表中列出了人群特征、年龄和性别分布、跑/走10米测试时间(TTRW)的速度/速度(m/s)测量值和整体行走状态(以%表示)1.由于功能性TTRW评分仅从行走患者中获得,并且在年龄为>岁的LGMD2B队列中观察到行走率降低,任何被列为不能行走或无法在通常的矫形器和行走辅助器下行走10米的患者都被赋予速度或速度值为“0”并纳入分析,其中行走速度降低(m/s)表明行走能力较差。
生物库样本的LGMD2B患者年龄在22-30岁(年轻)和41-51岁(老年)之间N= 42和N=每组33个样本。生物库对照血清也来自N= 14例患者年龄在20 ~ 39岁之间(年轻)N= 16例,年龄40 ~ 55岁。有样本的年轻对照组患者的平均年龄明显高于年轻LGMD2B患者组(P≤0.05),但在老年队列中相似(表1).老年男性和女性LGMD2B患者的步行/跑步速度分别比年轻患者低54%和81%,并与非下床活动的百分比增加相关(表2)1).
LGMD2B患者出现血清HDL-C异常
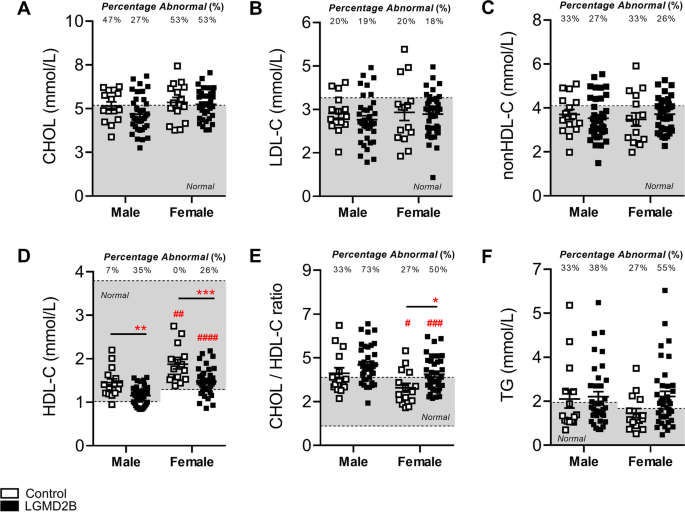
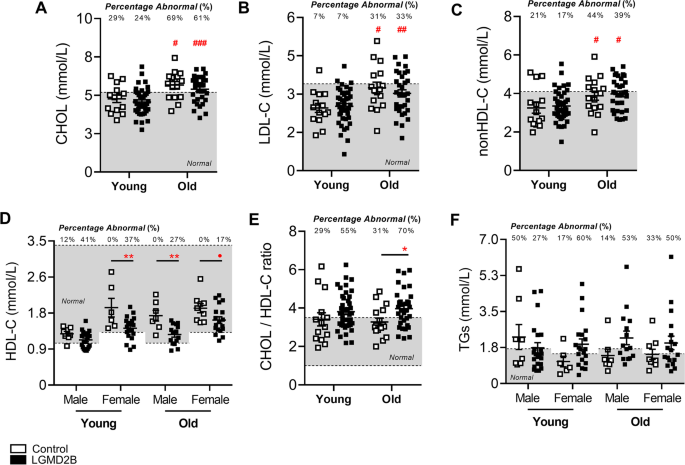
当血清脂蛋白水平按性别分层时,与各自的对照组相比,男性和女性LGMD2B患者的CHOL、LDL-C和非hdl - c水平在统计学上相似(图2)。1a - c)。有趣的是,我们观察到男性和女性LGMD2B患者的LGMD2B血清HDL-C水平分别降低了21%和19%。1D;P< 0.01)。对心血管疾病的典型指标CHOL/HDL-C比值的分析表明,73%的男性和50%的女性LGMD2B患者存在异常的CHOL/HDL-C比值(图2)。1E).男性的CHOL/HDL-C比率也高出12% (ns),女性则比对照组高25% (P< 0.05;无花果。1E)。LGMD2B患者的TG水平与对照组相比无统计学差异(图。1F).当按年龄分层(年轻vs年老)时,LGMD2B患者与年龄匹配的对照组相比,显示出相似的血清CHOL、LDL-C和非hdl - c水平(图。2a - c)。然而,在年轻的LGMD2B女性患者中观察到平均血清HDL-C显著降低(27%),而在老年LGMD2B患者中,无论性别(分别为27%的男性和15%的女性);无花果。2D)。同样,老年患者的CHOL/HDL-C比值显著增加(21%;P< 0.05) LGMD2B患者与对照组相比,但无论年轻还是老年LGMD2B患者都表现出异常高的比率异常患病率(年轻55%,老年70%)(图5)。2E).所有队列的TG水平相似(图。2F)。
成年对照组和年龄≥20岁、按性别分层的LGMD2B患者血清脂蛋白和甘油三酯分布。一个- - - - - -F对照组和LGMD2B脂蛋白血清脂蛋白(CHOL、LDL-C、非HDL-C、HDL-C和CHOL/HDL-C比值)和tg的散点图显示值在正常成人水平内外。采用双向方差分析和Sidak事后检验对对照和LGMD2B均值进行直接比较;*P< 0.05;*P< 0.01;***P< 0.001。双向方差分析与Sidak事后检验用于男性和女性均值的直接比较;#P< 0.05;# #P< 0.01;# # #P< 0.001。灰色区域表示每个特定参数的正常成人范围。超出正常范围(异常值)的患者数量以百分比形式列出。均数±SEM。男性对照组(N= 15)。女性对照组(N= 15)。男LGMD2B (N= 37)。雌性LGMD2B (N= 38)
年龄≥20岁的成人对照组和LGMD2B患者的血清脂蛋白和甘油三酯分布。一个- - - - - -F对照组和LGMD2B脂蛋白血清脂蛋白(CHOL、LDL-C、非HDL-C、HDL-C和CHOL/HDL-C比值)和tg的散点图显示值在正常成人水平内外。一个,B,C,E采用双向方差分析和Sidak事后检验对对照和LGMD2B均值进行直接比较;*P< 0.05;**P< 0.01;***P< 0.001。D而且F采用双向方差分析和Sidak事后检验对对照和LGMD2B均值进行直接比较;#P< 0.05;# #P< 0.01;# # #P< 0.001。灰色区域表示每个特定参数的正常成人范围。超出正常范围(异常值)的患者数量以百分比形式列出。均数±SEM。一个,B,C,E青少年组(N= 14);旧控制(N= 16);年轻LGMD2B (N= 42);旧LGMD2B (N= 33)。D而且F年轻男性对照组(N= 8);年轻女性对照组(N= 6);老年男性对照组(N= 7);老年女性对照组(N= 9);年轻男性LGMD2B (N= 22);年轻女性LGMD2B (N= 20);年长男性LGMD2B (N= 15);年长女性LGMD2B (N= 18)
LGMD2B引起亚临床肝酶升高
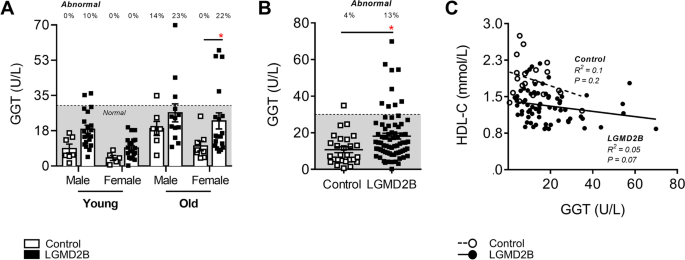
为了消除肝损伤作为LGMD2B患者低血清HDL-C水平的来源,对上述样本进行了血清γ -谷氨酰转移酶(GGT)的分析,GGT是肝病最敏感的酶指标(图。3.).在MD的情况下,肝脏异常的常规标记物包括丙氨酸和天门冬氨酸转氨酶(ALT和AST)通常被认为是不合适的,因为肌肉细胞在对损伤做出反应时也会释放转氨酶[26].当按年龄和性别进行分层时,年轻男性的GGT水平增加了110%;ns)、年轻女性(122%;ns)、年长男性(44%;ns)、高龄女性(123%;P与健康对照组相比,LGMD2B组< 0.05。3.A).总体而言,LGMD2B患者的GGT水平比健康对照组高59% (P< 0.05),尽管只有13%的LGMD2B患者表现出被认为临床异常的值(图。3.B)。此外,血清GGT与HDL-C水平之间没有明显的相关性(图。3.C)。
成年对照组和年龄≥20岁LGMD2B患者男性和女性血清-谷氨酰转移酶(GGT)水平和总体分布的比较分析。一个对照组和LGMD2B血清GGT按年龄和性别分层的散点图。采用双向方差分析和Sidak事后检验对对照和LGMD2B均值进行直接比较;*P< 0.05。B联合对照与LGMD2B血清GGT的散点图。未配对t-test用于比较均值;*P< 0.05。灰色区域表示正常的临床成人范围。C对照组和LGMD2B患者血清GGT和HDL-C水平的相关性皮尔森相关R2而且P列出的-值是适用的。均数±SEM。一个年轻男性对照组(N= 7);年轻女性对照组(N= 5);老年男性对照组(N= 7);老年女性对照组(N= 8);年轻男性LGMD2B (N= 20);年轻女性LGMD2B (N= 19);年长男性LGMD2B (N= 13);年长女性LGMD2B (N= 18)。B- - - - - -C控制(N= 27);LGMD2B (N= 70)
辛伐他汀没有减弱小鼠lgmd2b相关疾病的病理,尽管显示出生物活性
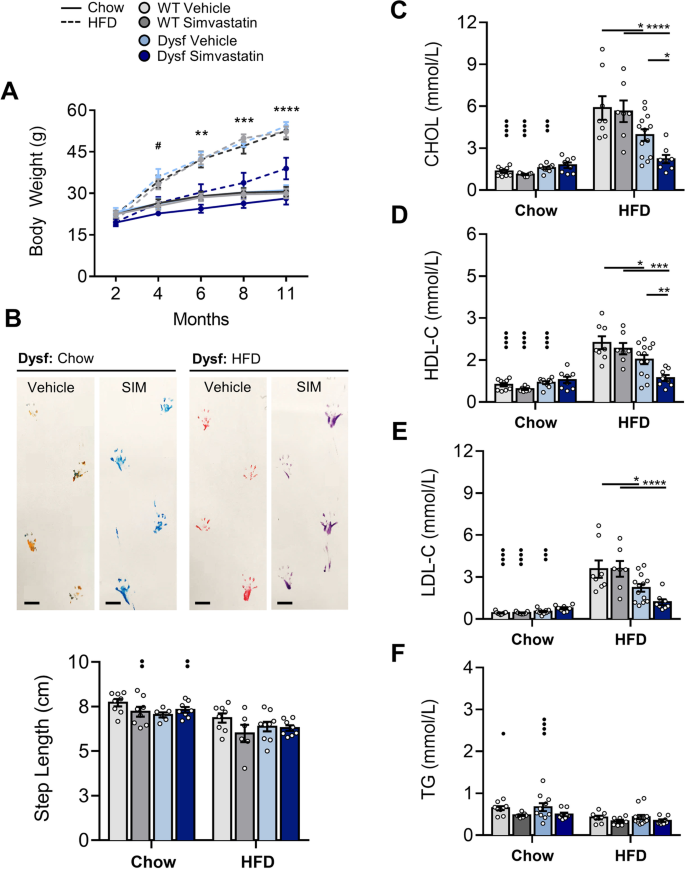
他汀类药物抑制肌萎缩蛋白缺乏的肌肉萎缩mdxDMD的模型仍有争议[15,16],我们在2至11个月的Dysf-null LGMD2B模型中测试辛伐他汀,在正常血脂的食物和高血脂的HFD条件下。在Dysf小鼠中,口服辛伐他汀可防止hfd诱导的体重增加(图2)。4A),由于附睾脂肪堆积减少和肝脏肿大(补充图。2),但辛伐他汀对行走功能和步长读数没有影响(图。4B).值得注意的是,辛伐他汀没有改变饮食喂养小鼠的CHOL、HDL-C或LDL-C水平,对tg有轻微影响(图2)。4氟)。在hfd喂养的动物中,Dysf小鼠的CHOL、HDL-C、LDL-C和tg水平低于WT对照组(图2)。4C-F)和辛伐他汀诱导血浆CHOL和HDL-C降低46%和43%,但TG水平未受影响(图。4一部)。对照图中包含了处理过的WT和Dysf-null脂质水平之间的直接比较。2f。在两种饮食中,辛伐他汀对饮食喂养小鼠或WT对照组小鼠的身体、脂肪垫或肝脏重量均未观察到明显的影响(见图2)。3.a - b)。
辛伐他汀减轻hfd引起的体重增加和dysf缺失小鼠的血浆脂蛋白增加,但不能防止活动功能障碍。一个每月体重测量(2、4、6、8和11个月)在Chow和hfd喂养,车辆和辛伐他汀(SIM)治疗的WT和Dysf小鼠。采用双向方差分析和Tukey事后检验进行直接平均比较;#P< 0.05,比较所选年龄组的WT SIM和Dysf SIM。**P< 0.01和***P在所选年龄组中,独立比较WT SIM与Dysf SIM以及Dysf载具与Dysf SIM均< 0.001。B用对照剂或辛伐他汀治疗的Chow和hfd喂养的Dysf小鼠的终点(11米)步长图像及其对各组的量化。使用双向方差分析和Sidak事后检验进行直接平均比较;••P< 0.01以内;未检测到显著性。C- - - - - -E终点血浆总胆固醇(CHOL)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)和甘油三酯(TG)来自饲粮小鼠和hfd喂养小鼠、WT小鼠和Dysf-null小鼠,分别用对照或辛伐他汀治疗。使用双向方差分析和Sidak事后检验进行直接平均比较,•••P< 0.001和••••P< 0.0001,且在*之内P< 0.05, ****P< 0.0001。均数±SEM。一个- - - - - -BN= 6 - 9。C- - - - - -FN= 8日至13日
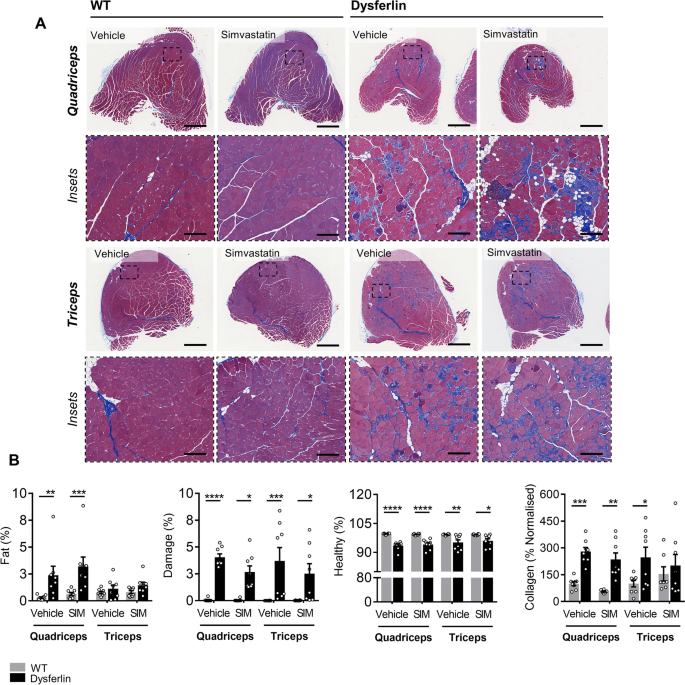
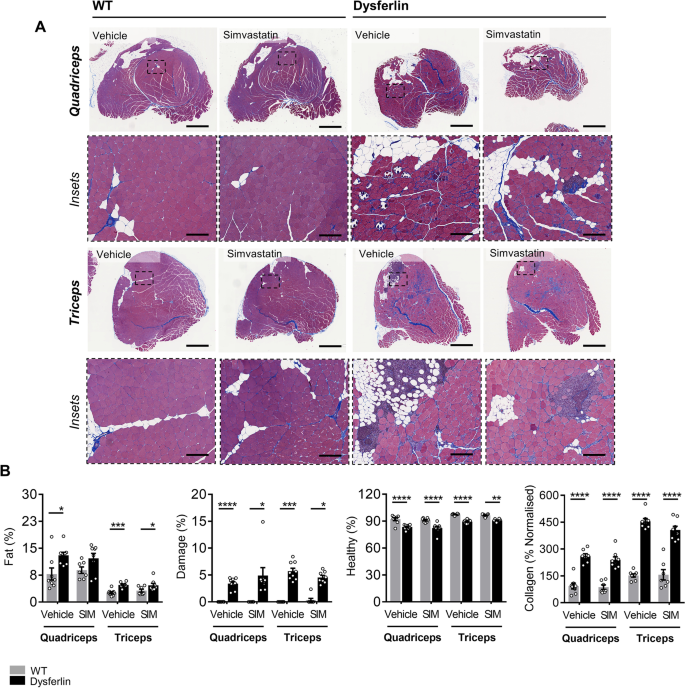
尽管辛伐他汀对身体组成和关键代谢参数有深刻的影响,这证实了生物活性,但在任何一种饮食条件下,辛伐他汀都未能防止lgmd2b相关的四头肌和三头肌肌肉萎缩(表2)2).此外,在马松氏三色染色的四头肌和三头肌切片中,辛伐他汀无法减轻lgmd2b相关的脂肪浸润、肌肉损伤和胶原沉积(图2)。5a - b和6a - b)。在年龄和饮食相匹配的WT小鼠中,没有观察到辛伐他汀对肌肉病理的有害影响(图2)。5a - b和6a - b)。
Dysf缺乏导致骨骼肌中胆固醇代谢调节剂的过表达,而不是肝脏
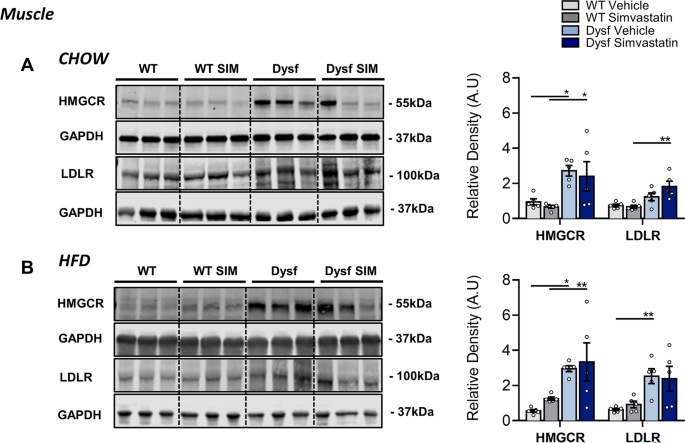
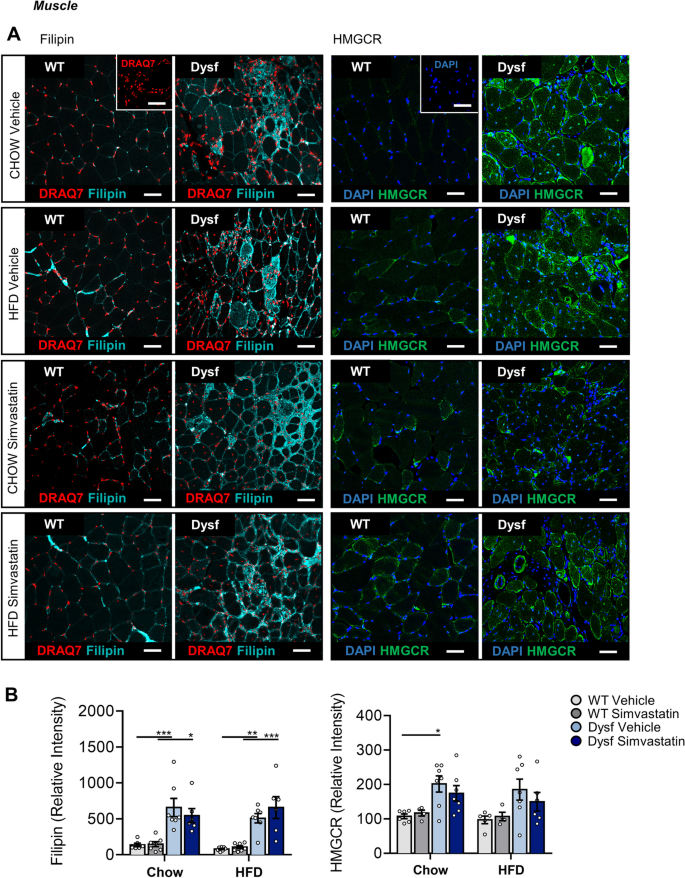
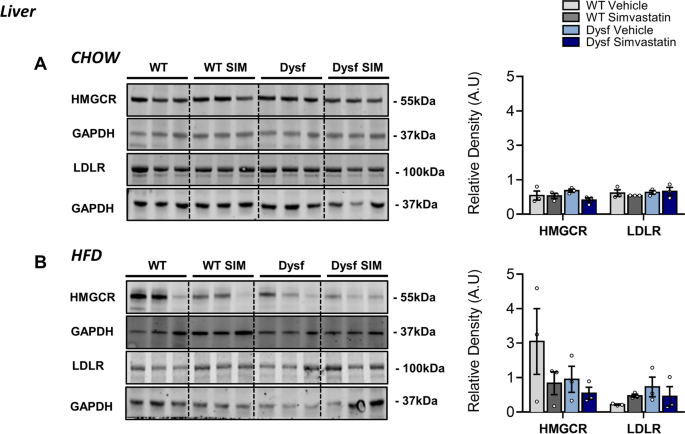
为了进一步研究胆固醇在LGMD2B肌肉病理中的作用,我们测量了HMGCR和LDLR的肌肉蛋白水平,它们是非hdl - c胆固醇代谢的主要调节因子和他汀类药物生物活性的效应物。Western blot分析显示,与饮食匹配的WT对照相比,喂食hffd的Dysf小鼠腓肠肌中HMGCR和LDLR蛋白表达增加,辛伐他汀治疗未能使这两种蛋白的肌内水平恢复正常(图2)。7B).使用HMGCR和Filipin的免疫荧光组织染色进一步证实了这些数据,后者检测富含胆固醇的结构域以及细胞内未酯化的胆固醇水平[15].与WT相比,两种饲料下Dysf-null股四头肌切片的Filipin染色显著升高(380%;P< 0.001)和hfd喂养条件(775%;P< 0.001)(图8a - b)。同样,HMGCR的水平升高了87% (P< 0.05)和94% (ns)在Chow和hfd喂养的Dysf-null小鼠的股四头肌中,分别与WT对照相比(图。8a - b)。在辛伐他汀治疗后,这两种蛋白的肌内水平再次没有显著降低(图2)。8a - b)。在肝脏这个全身胆固醇调节的主要部位,我们观察到与骨骼肌相比,HMGCR和LDLR均不受基因型、饮食或辛伐他汀治疗的影响(图2)。9a - b)。综上所述,这些数据表明dysferlin的丢失会干扰甲羟戊酸/HMGCR和LDLR的正常肌肉表达,这是胆固醇代谢的两个关键调节因子,在过去的研究中均被证明是升高的mdx用辛伐他汀减少肌肉组织[15].
辛伐他汀未能下调Chow或hfd喂养的Dysf-null小鼠骨骼肌中的HMGCR和LDLR信号。一个周食、WT和Dysf小鼠腓肠肌HMGCR和LDLR的代表性图像和免疫印迹定量。采用双向方差分析和Sidak事后检验进行直接平均比较;*P< 0.05, **P< 0.01, ****P< 0.0001。B周食、WT和Dysf小鼠腓肠肌HMGCR和LDLR的代表性图像和免疫印迹定量。采用双向方差分析和Sidak事后检验进行直接平均比较;*P< 0.05, **P< 0.01, ****P< 0.0001。HMGCR和LDLR标准化为加载控制GAPDH。Y-轴表示任意单位(AU)。全印迹分别成像,因此有不同的曝光。一个普通的样品被加载到每个凝胶上,以标准化跨膜检测效率。均数±SEM。N每组= 5
辛伐他汀未能使Chow或hfd喂养的Dysf-null小鼠的股四头肌中Filipin和HMGCR的肌内水平正常化。一个Filipin和HMGCR在Chow和hfd喂养的小鼠,WT和Dysf小鼠中均有代表性的图像,分别用对照或辛伐他汀治疗。BFilipin和HMGCR平均荧光强度的定量研究。相对强度值通过归一化到WT (Chow)水平来生成,以考虑检测效率。主图和插图尺寸均为50 μm。插图:没有菲律宾控件(只有DRAQ7)和HMGCR控件只有DAPI)。采用双向方差分析和Sidak事后检验对WT和Dysf小鼠进行直接比较;*P< 0.05;**P< 0.01;***P< 0.001。均数±SEM。每个队列N = 4-7人
辛伐他汀对HMGCR和LDLR的肝脏表达无影响。一个用对照或辛伐他汀处理的chow - feeding小鼠、WT小鼠和Dysf小鼠肝脏中HMGCR和LDLR的代表性图像和免疫印迹定量。采用双向方差分析和Sidak事后检验进行直接平均比较;没有意义.B用对照或辛伐他汀处理的chow - feeding、WT和Dysf小鼠肝脏HMGCR和LDLR的代表性图像和免疫印迹定量。采用双向方差分析和Sidak事后检验进行直接平均比较;没有意义。HMGCR和LDLR标准化为加载控制GAPDH。Y-轴表示任意单位(AU)。全印迹分别成像,因此有不同的曝光。一个普通的样品被加载到每个凝胶上,以标准化跨膜检测效率。均数±SEM。N每组= 3
辛伐他汀治疗对肌肉裂解物中mTORC1或AMPK通路的激活没有影响
mTORC1信号是骨骼肌中蛋白质合成的关键调节因子。无论是AKT下游还是直接通过营养物质激活mTORC1,都可以通过磷酸化两个主要靶点促进蛋白质合成:S6K1和4E-BP1,这也可以通过下游rpS6(Ser235/236)表达来评估[27].由于辛伐他汀已被证明可以抑制rpS6的磷酸化(Ser235/236;p-rpS6)和mTORC1信号通路在骨骼肌中的作用,并有助于他汀类药物诱导的肌病[28],因此,我们测量了辛伐他汀治疗的WT和Dysf-null小鼠骨骼肌裂解液中p-rpS6的激活率。Western blot分析表明,辛伐他汀在标准化至总rpS6(t-rpS6)时,对p-rpS6(Ser235/236)水平没有影响。4在dysf缺失的组织中,标准化为GAPDH的总rpS6水平(t-rpS6)也不受辛伐他汀治疗的影响,尽管与WT肌肉相比,显示出标准化为GAPDH的t-rpS6蛋白增加(图2)。4而AMPK磷酸化是mTORC1通路的抑制性调节因子[29],在其他组织(如肝脏)中,AMPKα的磷酸化(Thr172)也可以直接下调HMGCR活性,从而抑制细胞内胆固醇合成速率[30.],尽管应该指出的是,描述ampk介导的胆固醇合成抑制的研究是有限的。与mTORC1激活相似,辛伐他汀治疗对WT和Dysf-null小鼠的p-AMPKα(Thr172)标准化为t-AMPKα的水平没有显著影响,无论是喂食饲料还是高热量食物。4虽然与WT相比,在饲料和hfd喂养的dysf缺失肌肉中,与负荷控制GAPDH标准化的AMPKα总量显著升高(分别提高113%和200%),但表达水平不足以拮抗肌内胆固醇合成(也不影响mTORC1基础激活)(图2)。4此外,辛伐他汀治疗对t-AMPKα水平没有影响(补充图。4A和C)。
讨论
目前的研究首次使用常规临床方法对LGMD2B和对照组的血脂谱进行了比较分析,并报告称,无论年龄或性别差异,LGMD2B患者的保护性HDL-C均显著降低。重要的是,本文研究的小鼠血浆脂谱与先前报道的比较评估证实了疾病晚期dysf相关脂蛋白异常[31],为LGMD2B的主要代谢成分提供了证据。在LGMD2B样本中缺乏临床升高的GGT,这反驳了肝损伤是其主要原因,虽然有报道称LGMD2B中转氨酶升高,但它通常是对肌肉而不是肝损伤的反应[26].然而,尽管MD类型之间存在显著的遗传异质性,我们也在人类和犬类DMD中描述了临床显著的脂蛋白异常,这与当前的研究一起支持了MD代表一种新的遗传性血脂异常的新理论。事实上,高胆固醇血症和TG升高在LGMD 1C型患者中也有报道[32](小穴蛋白-3突变)和肌强直性营养不良1型和2型(分别为DMPK和CNBP突变)[33,34-尽管通常在没有控制条件或使用实验方法的情况下。
我们的分析与最近的研究相结合,表明MD与脂代谢调节因子紊乱有关,尽管这是发生在肌肉萎缩的主要还是次要方式尚不清楚。最近对DMD样本的miRNA分析强调了固醇调节结合蛋白(SREBPs)和下游甲羟丙酸途径介质的调控异常,这些发现得到了我们目前对LGMD2B肌肉中HMGCR、LDLR和Filipin的分析的进一步支持。值得注意的是,抗hmgcr抗体升高的患者表现出明显的lgmd样肌病[35].含有apob的脂蛋白在肌肉中的沉积增加,如LDL-C,也可以增加炎症细胞的募集,这是我们在DMD和LGMD2B的血脂异常模型中的一个关键观察结果[11,23],并可能解释了LGMD2B误诊为多发性肌炎的合理性。由于HDL-C在胆固醇反向转运(RCT)中扮演重要角色,并通过将多余的胆固醇从外周组织运送至肝脏以供胆道处置而发挥保护作用[36], HDL-C缺乏可能导致有害的肌肉胆固醇积累,尽管HDL-C也可以介导骨骼肌细胞内葡萄糖和线粒体内平衡过程,独立于其在脂质运输中的作用[37].因此,这种脂肪代谢异常可能协同影响细胞内胆固醇机制,因为肌纤维的胆固醇含量似乎受到严格调控。的确,骨骼肌特异性HMGCR缺失可诱导严重和早期骨骼肌萎缩[38],尽管肌肉从头合成的胆固醇相当少[39].然而,多种脂类物质的积累,包括胆固醇、鞘脂、磷脂,以及调节其代谢的基因的过度表达,在失联蛋白缺乏的啮齿动物中已被广泛报道[40]及LGMD2B患者肌肉活组织检查[41].
用降脂药物治疗MD的可能性是一个值得更多考虑的有趣概念。在严重mdx和缺乏ApoE的Dysf小鼠,我们发现胆固醇吸收阻滞剂依zetimibe可以靶向减轻疾病的严重程度[42].在温和的mdx辛伐他汀可阻断小鼠肌内炎症和纤维化[15]并通过抗炎和抗氧化多效性改善功能性骨骼肌、膈肌和心脏参数[15,16,17],尽管其他研究未能复制辛伐他汀的这些治疗特性[19,20.]或瑞舒伐他汀[18].在我们的研究中,我们证明辛伐他汀不能降低喂食Dysf小鼠的CHOL水平,但在HFD组中却能降低HDL-C水平以及肌肉特异性HMGCR和LDLR蛋白的表达,这可能是其在LGMD2B模型中缺乏治疗特性的合理解释。由于小鼠的胆固醇和脂蛋白代谢与人类非常不同,这是否由于缺乏治疗性多效性或异常的胆固醇依赖反应尚不清楚;人类的血清胆固醇主要是低密度脂蛋白c,而小鼠的血清胆固醇通常富含高密度脂蛋白c [43].在患者中,他汀类药物主要降低LDL-C,并有轻微的HDL-C增强作用,与我们在此报告的结果形成鲜明对比。然而,Dysf可能会影响HMGCR和LDLR的稳态,这可能导致他汀类药物治疗的异常反应。他汀类药物在MD患者中是否仍然是可行的治疗选择,根据报道的危险因素,包括肌病、肌炎和横纹肌溶解(在[44])。然而,我们观察到辛伐他汀在WT或Dysf小鼠的肌肉中没有进一步的有害作用,这与使用相同或相似剂量和给药途径的原则研究一致[16].有可能患有不同形式MD的患者对脂蛋白代谢(LDL-C)或细胞内胆固醇合成(HMGCR)的调节反应不一致,在这两种途径之间有潜在的意想不到的代偿反应,因为他汀类药物诱导主要的LDLR上调。
数据和材料的可用性
如有合理要求,我们会提供资料。
参考文献
埃尔瓦斯蒂JM,坎贝尔KP。肌萎缩蛋白-糖蛋白复合物作为层粘连蛋白和肌动蛋白之间的跨膜连接物的作用。中国生物医学工程学报(英文版),1993;
Fernández-Eulate G,等。国际系列迟发性神经失调患者的深层表型研究。《神经科学》2021;28:2092-102。
Bansal D,等。dysferin缺乏性肌营养不良的膜修复缺陷。大自然。2003;423:168 - 72。
Birnkrant DJ等人。杜氏肌营养不良症的诊断和治疗,第2部分:呼吸、心脏、骨骼健康和矫形外科管理。《柳叶刀神经杂志》2018;17:347-61。
Birnkrant DJ等人。杜氏肌营养不良症的诊断和管理,第3部分:初级护理、急救管理、心理社会护理和整个生命周期的护理过渡。《柳叶刀神经杂志》2018;17:45 - 55。
Birnkrant DJ等人。杜氏肌营养不良症的诊断和治疗,第1部分:诊断,神经肌肉,康复,内分泌,胃肠道和营养管理。《柳叶刀神经杂志》2018;17:251-67。
史密斯EC,等。vamorolone治疗杜氏肌营养不良的疗效和安全性:一项非随机开放标签扩展研究的18个月中期分析。PLoS Med 2020;17:e1003222。
Hoffman EP,等。对杜氏肌营养不良症的Vamorolone试验显示,与剂量相关的肌肉功能改善。神经学。2019;93:e1312-23。
麦克唐纳CM,等。德伐克拉特vs强的松治疗杜氏肌营养不良:近期多中心临床试验中疾病进展率的荟萃分析肌肉神经。2020;61:26-35。
Sellers SL,等。在LGMD2B小鼠模型中,增加的非hdl胆固醇水平导致肌肉萎缩和活动功能障碍。中国医学杂志,2018;59:261-72。
白Z,等。胆固醇吸收阻滞剂依折麦布可预防严重失联素缺乏小鼠和mdx小鼠的肌肉萎缩。恶病质肌减少肌。2021。https://doi.org/10.1002/jcsm.12879.
白Z,等。高流行的血脂异常在人类和犬杜氏和贝克尔肌肉营养不良描绘了一种新的类型的原发性遗传性血脂异常。J clini Lipidol, 2020。https://doi.org/10.1016/j.jacl.2020.05.098.
Saure C, Caminiti C, Weglinski J, de Castro Perez F, Monges S.杜氏肌营养不良患者的能量消耗、身体成分和代谢障碍患病率糖尿病代谢综合征。2018;12:81-5。
Srivastava NK, Pradhan S, Mittal B, Gowda GAN。杜氏肌萎缩症患者血脂的高分辨率核磁共振分析及其可能的诊断意义。核磁共振生物化学。2010;23:13-22。
Amor F,等。胆固醇代谢是杜氏肌营养不良的潜在治疗靶点。恶病质肌减少肌。2021。https://doi.org/10.1002/jcsm.12708.
白head NP, Kim MJ, Bible KL, Adams ME, Froehner SC.辛伐他汀对肌肉萎缩症功能改善的新疗效。中国科学院学报(自然科学版)2015;
Kim MJ,等。辛伐他汀可长期改善肌萎缩症患者左心室功能并预防心肌纤维化。Physiol代表2019;7:e14018。
芬克勒JMG,德卡瓦略SC,圣内托H,马奎斯MJ。瑞舒伐他汀治疗对营养不良mdx小鼠心脏和骨骼肌的影响。阿纳特Rec(霍博肯)。2020; 303:2202-12。
Mucha O,等。辛伐他汀不能减轻杜氏肌营养不良小鼠模型的肌肉病理。骨骼肌,2021;11:21。
Verhaart IEC,等。辛伐他汀治疗不能改善杜氏肌营养不良小鼠模型的肌肉病理生理。神经肌肉杂志。2020。https://doi.org/10.3233/JND-200524.
Langsted A, Freiberg JJ, Nordestgaard BG。空腹和非空腹血脂水平:正常食物摄入对血脂、脂蛋白、载脂蛋白和心血管风险预测的影响循环。2008;118:2047-56。
Sidhu D, Naugler C.基于社区人群的禁食时间和血脂水平:一项横断面研究。2012; 172:1707-10。
Milad N,等。在mdx小鼠杜氏肌营养不良模型中,升高的血脂水平加剧肌肉病理。骨骼肌。2017;7:19。
Nantsupawat N,等。低心血管风险人群中检测异常低密度脂蛋白胆固醇和非高密度脂蛋白胆固醇的适当总胆固醇临界值《脂质健康杂志》2019;18:28。
申建华,张凯,段东。利用引物竞争聚合酶链反应对mdx, mdx3cv和mdx4cv小鼠进行基因分型。《肌肉神经》2011;43:283-6。
朱毅,等。血清酶谱区分五种类型的肌肉萎缩症。Dis marker . 2015;2015:543282。
White Z, White RB, McMahon C, Grounds MD, Shavlakadze T.空腹状态下,老龄小鼠骨骼肌维持高mTORC1信号,而蛋白降解途径受到干扰。国际生物化学杂志,2016;78:10-21。
Bonifacio A, Sanvee GM, Bouitbir J, Krähenbühl S. AKT/mTOR信号通路在他汀类药物诱导的肌毒性中起关键作用。生物化学学报,2015;
桑切斯AMJ,等。amp活化蛋白激酶在协调骨骼肌周转和能量稳态中的作用。中国生物医学工程学报。2012;29(3):344 - 344。
杨丽娟,李志刚,李志刚,李志刚。AMPK与动脉粥样硬化和肿瘤的临床研究进展。物理学报。2006;574:63-71。
白志强,李志强,李志强,等。高脂血症患者血脂异常对动脉粥样硬化和血浆脂蛋白组成的影响。前沿物理。2021;12:675322。
布鲁诺G等人。一个意大利家族持续性高血钾、肌痛和高胆固醇血症中CAV3基因的新错义突变:双重麻烦。临床神经外科杂志。2020;191:105687。
Spaziani M,等。肌强直性营养不良1型受试者的激素和代谢性别差异:一项回顾性病例对照研究。《内分泌投资杂志》2020;43:663-75。
Peric S,等。肌强直性营养不良1型和2型患者体成分分析。神经科学杂志。2019;40:1035-40。
Mohassel P,等。抗hmgcr肌病可能类似于肢带肌营养不良。神经免疫。2019;6:e523。
罗健,杨华,宋宝林。胆固醇内稳态的机制与调控。细胞生物学,2020;21:25 25 - 45。
Lehti M,等。高密度脂蛋白通过调节细胞呼吸维持小鼠骨骼肌功能。循环。2013;128:2364 - 71。
Osaki Y,等。骨骼肌特异性HMG-CoA还原酶敲除小鼠表现出横纹肌溶解:他汀类药物诱导肌病的模型。生物化学学报。2015;466:536-40。
横山M,等。脂蛋白脂肪酶和他汀类药物对胆固醇吸收到心脏和骨骼肌的影响。《脂质杂志》2007;48:646-55。
Haynes VR等。Dysferlin缺乏症改变小鼠的脂质代谢,重塑骨骼肌脂质组。《油脂学报》2019;
李国强,李国强,李国强。肌营养不良患者骨骼肌组织脂质代谢异常的研究进展:基于高分辨率核磁共振光谱的体外观察。磁共振成像。2017;38:163-73。
白Z,等。胆固醇吸收阻滞剂依折麦布可预防严重失联素缺乏小鼠和mdx小鼠的肌肉萎缩。J恶病质肌少症肌肉。2022;13:544-60。
Sari G,等。一种人肝小鼠模型显示出类似人肝的脂质,但在西餐后不形成动脉粥样硬化斑块。生物化学生物物理研究,2020;524:510-5。
他汀类药物、肌痛和横纹肌溶解症。Jt骨脊柱。2020;87:37-42。
资金
这项工作得到了Jain基金会(PB)、MITACS、普罗维登斯医疗保健、心脏与中风基金会和加拿大健康研究所的资助。
作者信息
作者及隶属关系
贡献
PB和ZW对研究的概念和设计做出了贡献。PB, ZW, ES, ZS, DP, GD进行实验,解释结果,分析数据,制作图表。VS和DC有助于样本采集。PB和ZW撰写并准备了手稿。作者们阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
适用于人类和/或动物研究。必须列出伦理委员会、内部审查委员会和遵循的指导方针。在适用的情况下,还需要附加标题,声明同意参与和同意发表。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:支持图1。
≥20岁LGMD2B患者血清HDL-C与功能性TTRW评分的相关性A:按性别分层的相关散点图,B:年龄。皮尔森相关R2而且P列出的值是适用的。A: LGMD2B男N= 35, LGMD2B女性N= 32;B:年轻的LGMD2BN= 39;老LGMD2BN= 28。
附加文件2:支持图2。
11m龄,Chow和hfd喂养的WT和Dysf-null小鼠血浆脂蛋白和甘油三酯分布。A-F: WT和dysf缺失血浆脂蛋白(CHOL、LDL-C、nonHDL-C、HDL-C和CHOL/HDL-C比值)和tg的散点图。采用双因素方差分析和Sidak事后检验对WT和Dysf-null均值进行直接比较;(*)P< 0.05。两种方差分析与Sidak的事后检验用于直接比较Chow和HFD方法;(#)P< 0.05;(# #)P< 0.01;(# # #)P< 0.001。意味着±SEM。f:N= 8 - 12。
附加文件3:支持图3。
辛伐他汀减轻hfd诱导的dysf缺失小鼠腹部肥胖和肝脏增大。A:终点附睾脂肪垫和B:饲粮和hfd、对照和辛伐他汀(SIM)处理小鼠、WT和Dysf小鼠的肝脏重量(11个月)。两种方差分析与Sidak事后检验用于直接平均比较;(••••)P< 0.0001,且在;(**)P< 0.01;(* * *)P< 0.001。意味着±SEM。N=每个队列7-9。
附加文件4:支持图4。
A:用Vehicle或辛伐他汀治疗的周食喂养、WT和Dysf小鼠的股四头肌中p-rpS6(Ser235/236)、t-rpS6、p-AMPKα(Thr172)、t-AMPKα和GAPDH的代表性免疫印迹图像。B:免疫印迹检测p-rpS6(Ser235/236) / t-rpS6和t-rpS6 / GAPDH。两种方差分析与Sidak事后检验用于直接平均比较;(*)P< 0.05;(**)P< 0.01;(* * * *)P< 0.0001。B:免疫印迹定量检测p-AMPKα(Thr172)、/ t-AMPKα和t-AMPKα / GAPDH。两种方差分析与Sidak事后检验用于直接平均比较;(**)P< 0.01;(***)P< 0.001;(* * * *)P< 0.0001。y轴表示任意单位(A.U)。全印迹分别成像,因此有不同的曝光。一个普通的样品被加载到每个凝胶上,以标准化跨膜检测效率。意味着±SEM。N每组= 4。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
White, Z, Sun, Z, Sauge, E。et al。2B型肢带肌营养不良症导致患者HDL-C异常,并导致失联素缺乏小鼠的他汀类药物抵抗性肌肉萎缩。骨骼肌12, 25(2022)。https://doi.org/10.1186/s13395-022-00308-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-022-00308-6
关键字
- Dysferlin
- 血脂异常
- 辛伐他汀
- 胆固醇