摘要
背景
杜氏肌营养不良症(DMD)是一种x连锁肌肉疾病,由完全缺乏营养不良蛋白引起,营养不良蛋白可以稳定肌纤维的质膜。在DMD的晚期,口面功能受到影响,这通常会导致进食障碍,如吞咽困难。吞咽困难是由多种病因引起的,包括咀嚼和吞咽能力下降。因此,预防DMD患者咀嚼和吞咽功能的下降对提高患者的生活质量具有重要意义。在本研究中,使用我们之前生成的DMD大鼠模型,我们对咬肌和舌头肌肉进行了分析,这两者都是正常进食功能所必需的。
方法
对DMD大鼠咬肌和舌肌的年龄相关变化进行形态学、组织学和免疫组化分析。此外,细胞衰老标记物的转录,以及utrophin (Utrn),一种功能类似的抗肌萎缩蛋白。
结果
DMD大鼠的咬肌表现为进行性营养不良的变化,在他们的后肢肌肉中观察到p16而且p19.另一方面,DMD大鼠的舌头由于肌纤维肥大而出现大舌,营养不良变化较少。舌肌卫星细胞增殖活性保持不变,咬肌卫星细胞增殖活性受到严重干扰。而Utrn与WT大鼠相比,DMD大鼠咬肌中的转录水平升高,可能是由于代偿机制,其在舌肌中的表达水平在WT和DMD大鼠之间相当,在DMD大鼠的咬肌中表达水平相似。
结论
与DMD大鼠的咬肌相比,舌肌的肌肉营养不良程度较低。
背景
杜氏肌营养不良症(DMD)是一种x连锁肌肉疾病,由肌营养不良蛋白基因框外突变引起,导致肌营养不良蛋白完全丧失[9].Dystrophin是一种结构蛋白,可以稳定肌纤维的质膜,缺乏Dystrophin蛋白会导致肌纤维变得脆弱[9].骨骼肌肌纤维通常具有非凡的再生能力[11].一旦肌纤维受损,肌源性干/祖细胞,即卫星细胞,被激活并增殖,然后最终相互融合形成多核肌管。肌管发育成熟,形成新的再生肌纤维。DMD的特征是肌纤维的变性和再生的反复循环,最终由于卫星细胞池的耗尽而导致再生能力的丧失[21].DMD患者表现为进行性虚弱,并因失去行走能力而过早死亡[9].
在DMD的晚期,口面功能受到影响[3.]而进食障碍(如吞咽困难)也常常是个问题[37].吞咽困难由多种病因引起。咀嚼能力下降是吞咽困难的原因之一。咀嚼运动包括咬肌、颞肌、翼肌内侧肌和翼肌外侧肌[17].咀嚼过的食物用口腔中的舌肌吞下。吞咽是由收缩二腹肌和舌肌对腭移动药丸进入口咽开始的,随后是咽肌和食管肌的复杂协调。舌头肌肉由外部肌肉和内部肌肉组成,外部肌肉从外部移动舌头,内部肌肉改变舌头的形状。前者由四种舌肌组成:颏舌肌、舌舌肌、茎舌肌和腭舌肌;后者由四种肌组成:上纵肌、下纵肌、横肌和垂直肌。一些报道表明,DMD患者的吞咽困难与咀嚼相关肌肉的营养不良变化有关[36].大舌音症常见于DMD患者[28,37],被定义为舌头肿大,常伴有吞咽困难[5].因此,预防DMD患者咀嚼和吞咽功能的恶化对提高患者的生活质量至关重要。
我们之前报道了DMD大鼠模型(DMD rat)的生成[22,33].DMD大鼠的后肢肌肉和膈肌表现出与人类DMD一样的进行性肌肉病理[22,33].DMD大鼠肌肉的病理变化包括力量下降、纤维化加重、脂肪浸润[22,33].我们进一步证明了DMD大鼠肌肉中细胞过早衰老的发生,并提出这可能是卫星细胞衰竭的原因之一,从而导致再生能力的丧失[33].
在上述研究中,我们使用DMD大鼠[22,33],我们只分析了后肢和膈肌的肌肉。在DMD大鼠的繁殖和维持过程中,我们经历了随着晚年体重的下降而减少的摄食量,这促使我们研究与摄食量相关的肌肉是否也受到了影响。因此,在本研究中,我们以咀嚼肌和舌肌作为咀嚼和吞咽的肌肉,研究了它们的发育和组织学变化,以及卫星细胞的动态。
方法
动物
我们先前生成并鉴定了一株DMD大鼠[22,33].在该株DMD大鼠中,内含子2剪接位点周围329 bp的缺失导致外显子3的跳跃,外显子16插入1 bp导致停止密码子的产生,导致dystrophin蛋白的丢失[22,33].成人XDmd雌性大鼠X只与野生型(WT)雄性大鼠交配,得到雄性WT (XY)和DMD (XDmd老鼠Y)。它们在受控的环境条件下保存,温度为23°C,光照/暗循环(光照在0800-2000)。实验室饲料(Labo MR Standard, Nihon Nousan Co.,横滨,日本)和水被随意给予。本研究中所进行的所有动物实验均符合东京大学实验动物护理和使用指南,并得到东京大学机构动物护理和使用委员会的批准(P18-125)。
测量食物摄入量
在3或7个月大时,将大鼠单独转移到一个塑料笼子中,连续两天测量它们的摄取量。测量值除以2,表示为每天的食物摄入量。
组织学和免疫组化分析
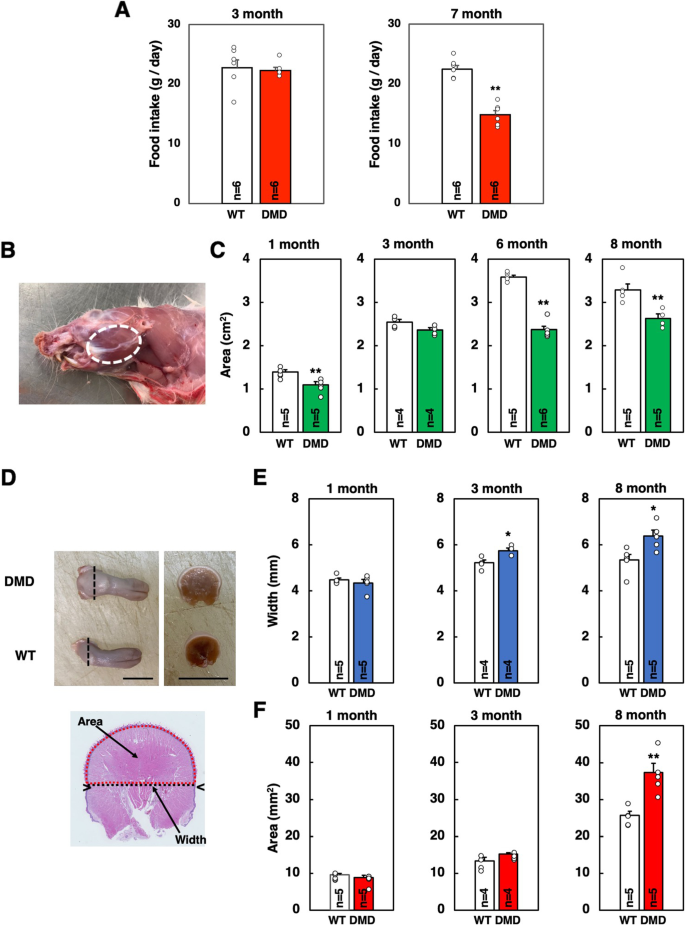
在指定年龄时,通过吸入二氧化碳气体杀死大鼠。去除面部皮肤后,测量咬肌对应的面积。咬肌被认为是一个椭圆形(图。1B),用卡尺测量其长径和短径,计算面积。然后,咬肌下半部分被切除。舌头被连根拔起。收集的组织在4%多聚甲醛(PFA)的磷酸盐缓冲盐水(PBS)中固定用于石蜡包埋切片,或在液氮冷却的异戊烷中快速冷冻用于冷冻切片。
石蜡包埋切片用于苏木精-伊红(HE)或马松三色染色。使用显微镜(BX51, Olympus, Tokyo, Japan)和数码相机(DP73, Olympus)观察和拍摄切片。用he染色的舌片测量舌的宽度和面积(图。1D).使用Masson三色染色切片定量分析纤维化区域。用4 ×物镜在切片中随机选取两个视野,用ImageJ软件(v1.47;国立卫生研究院,Bethesda, MD, USA)。
冷冻切片(7 μm)进行免疫组化。用4%的PFA在PBS中固定切片15分钟,然后用5%的正常驴血清(NDS)在PBS中阻塞。切片与一抗在4°C孵育过夜,然后二抗孵育1小时。
用于卫星细胞、血管内皮细胞和间充质祖细胞的鉴定,抗pax7 (1:200, 5% NDS在PBS中,小鼠,克隆P3U1;发育研究杂杂瘤库(DSHB),爱荷华市,IA,美国),抗cd31 (1:400, PBS中5% NDS,兔,NB100-2284, Novus Biological, Centennial, CO,美国),抗硫酸软骨素蛋白聚糖4 (CSPG4) (1:50, PBS中5% NDS,小鼠,克隆5C12 [34])分别作为一抗,然后用alexafluor标记的驴抗小鼠IgG (1:500, 5% NDS在PBS中,Jackson免疫研究,West Grove, PA, USA)。
为了鉴定坏死肌纤维,抗层粘胶蛋白(1:400,5% NDS在PBS中,兔子,L9393 Sigma,圣路易斯,美国)被用作一抗,alexafluor标记的山羊抗大鼠IgG和驴抗兔IgG (1:500, 2.5% NDS/2.5%正常山羊血清(NGS)在PBS中,杰克逊免疫研究,西格拉夫)被用作二抗。
为了鉴定新形成的再生肌纤维,用抗胚胎肌球蛋白重链(eMHC) (1:400, 5% NDS在PBS中,小鼠,克隆F1.652, DSHB)和抗层粘胶蛋白作为一抗,用alexafluor标记的驴抗小鼠IgG和驴抗兔IgG (1:500, 5% NDS在PBS中,Jackson ImmunoResearch)作为二抗。与二抗反应后,用Hoechst 33258反染细胞核。使用配有数码相机的显微镜观察和拍摄切片。
为了定量pax7阳性细胞、igg阳性坏死肌纤维和胚胎肌球蛋白重链(eMHC)阳性肌纤维,用× 4或× 10物镜拍摄几个数字的视野,并计数阳性细胞或肌纤维的数量。肌纤维用抗层粘连蛋白抗体双染色鉴定。数据以阳性肌纤维百分比或每个区域阳性细胞数表示。
为了定量肌纤维大小和每条肌纤维的核数,切片用抗层粘连蛋白免疫染色,然后用alexafluor标记的二抗标记。核用Hoechst 33258反染色。这些部分的照片如上所述。肌纤维由Cellpose谷歌Colab脚本自动识别(https://colab.research.google.com/drive/1958UQIH-XAYogKvbxnaUHALYvR73KLj2) [38],并用ImageJ软件测量它们的直径(最小Feret直径)和数量。每条肌纤维的核数由总核数除以肌纤维数计算。
用ImageJ计算cd31阳性细胞和cspg4阳性细胞所占面积。
细胞培养和免疫细胞化学
如前所述,从骨骼肌中分离单个核细胞[39].简而言之,老鼠被吸入二氧化碳气体杀死,它们的舌头和咬肌被切除。如上所述,咬肌下半部分和舌根被切下来用于细胞分离。用剪刀将其切碎,用1.25 mg/mL蛋白酶消化链霉菌属将, XIV型;Sigma)在37°C下1 h。通过差速离心从肌纤维碎片中分离细胞,并镀在聚l-赖氨酸和纤维连接蛋白涂层48孔板。每块肌肉的细胞被分成两等份(一份用于Pax7免疫细胞化学,另一份用于MyoD)并被镀。细胞在含有10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素和50 μg/mL庆大霉素的Dulbecco改良Eagle培养基(Gibco, Life Technologies, Palo Alto, CA, USA)中培养4天。
细胞用4% PFA/PBS固定15分钟,然后用含0.1% Triton X-100的5% NGS/PBS堵塞10分钟。细胞用抗pax7 (1:200, 5% NGS/PBS)或抗myod (1:200, 5% NGS/PBS,小鼠,克隆5.8A, Novocastra, Newcastle upon Tyne, UK)在4℃下孵育一夜。洗涤后,用alexafluor标记的二抗孵育1小时。核用Hoechst 33258反染色。在荧光显微镜(BX50, Olympus) 20 ×物镜下,随机选择5个场,计数Pax7和myod阳性细胞。核的总数也被计算。数据以阳性细胞百分比表示。
实时定量PCR
用FastGene RNA Basic kit (Nippon Genetics Co., Ltd, Tokyo, Japan)从100个冷冻切片(7 μm)中提取总RNA,用Super Script II kit (Invitrogen)逆转录为cDNA。在Light Cycler 2.0 (Roche Diagnostics, Roche, Basel, Switzerland)上使用Thunderbird SYBR qPCR Mix (TOYOBO, Osaka, Japan)进行实时定量PCR。使用以下引物组:p16:向前,5 ' -TTC ACC AAA CGC CCC GAA CA-3 ';反向,5 ' -CAG GAG AGC TGC CAC TTT GAC-3 ';p19:转发,5ʹ-GTG TTG AGG CCA GAG AGG AT-3ʹ;反向,5ʹ-TTG CCC ATC ATC ATC ACC T-3ʹ;p21:转发,5ʹ-GAC ATC TCA GGG CCG AAA-3ʹ;反向,5ʹ-GGC GCT TGG AGT GAT AGA AA-3ʹ;p53:转发,5ʹ-AGA GAG CAC TGC CCA CCA-3ʹ;反向,5ʹ-AAC ATC TCG AAG CGC TCA C-3ʹ;Utrn:向前,5ʹ‐TAG AGC AAT ACG CCA CAC GA‐3ʹ;反向,5ʹ‐ACG CTC TTC CTT CTC CAC AG‐3ʹ;MuRF1: forward, 5ʹ‐AGG ACT CCT GCC GAG TGA C-3 ';反向,5 ' -TTG TGG CTC AGT TCC TCC TT-3 ';Atrogin1:向前,5 ' -GAA GAC CGG CTA CTG TGG AA-3 ';Atrogin1:反向,5 ' -ATC AAT CGC TTG CGG ATC T-3 ',和产生HPRT:转发,5ʹ‐GAC CGG TTC TGT CAT GTC G‐3ʹ;反向,5ʹ‐ACC TGG TTC ATC ATC ACT AAT CAC‐3ʹ。用交叉点法分析各基因的表达,与的归一化后进行表达产生HPRT.
西方墨点法
采用放射免疫沉淀试验(RIPA)缓冲液[10 mM NaH .]对200个舌肌冷冻切片(7 μm)进行均质2阿宝4、150 mM NaCl、2 mM乙二胺四乙酸(EDTA)、0.1%脱氧胆酸钠、1%壬二胺P-40、10 μg/mL leupeptin、5 μg/mL pepstatin、1.84 g/L Na3.签证官4, 10 mg/mLp-硝基苯磷酸(PNPP), 100 KIU/mL抑肽酶,20 μg/mL苯基甲烷磺酰氟(PMSF)],使用Pierce BCA蛋白检测试剂盒(Thermo Fisher Scientific, Waltham, MA, USA)测定裂解物的蛋白浓度。然后,用RIPA缓冲液将裂解物稀释到相同浓度的蛋白质。对样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和western blotting,如之前的研究所述[1].使用的抗体如下:抗phospho- akt抗体(Ser473, Cell Signaling Technology, Danvers, MA, USA, #9271),抗akt抗体(Cell Signaling Technology, #9272),抗phospho-p70 S6K抗体(Thr389, Cell Signaling Technology, #9234),抗p70 S6K抗体(Santa Cruz Biotechnology, C-18, sc-230),抗phospho- s6核糖体蛋白抗体(Ser240/244, Cell Signaling Technology, #2215),抗s6核糖体蛋白抗体(Cell Signaling Technology, 54D2, #2317),抗4ebp1抗体(Cell Signaling Technology, #9272),抗phospho- s6核糖体蛋白抗体(Cell Signaling Technology, 54D2, #2317),#9452),抗-α-微管蛋白抗体(Sigma Aldrich, T9026),抗兔IgG,辣根过氧化物酶(HRP)链接的驴全抗体(GE healthcare, NA934V),抗小鼠IgG, HRP链接的羊全抗体(GE healthcare, NA931V)。用ImageJ对每个印迹的条带强度进行量化。
统计分析
除肌纤维直径分析外,图形数据均以均数±SE表示。未配对学生的t采用-检验(两组间)和单因素方差分析(ANOVA),然后采用Tukey-Kramer检验(多组比较)评价统计学差异。为了评估肌纤维直径的差异,本实验采用p-value使用Wilcoxon秩和检验确定。p-值小于0.05被认为有统计学意义。
结果
我们之前报道过DMD大鼠6月龄后体重逐渐下降[33].我们怀疑DMD大鼠存在进食障碍,测量了3月龄(体重开始下降前)和7月龄(体重开始下降后)大鼠的摄食量。WT和DMD大鼠在3月龄时的食物摄取量具有可比性(图2)。1然而,在7个月大时,观察到DMD大鼠的食物摄入量显著减少,这表明饮食失调的发生(图。1一个)。
以上结果提示,参与进食的肌肉受到疾病进展的影响。然后,我们对与食物摄入有关的肌肉进行了形态计量学分析。我们选择咬肌和舌肌是因为这两块肌肉很容易接近,并且与其他肌肉区分开来。如图所示。1B,考虑咬肌对应的面积为椭圆形,用卡尺测量其长短径,计算面积。从1 ~ 8月龄测量咬肌面积。DMD大鼠在1月龄和6月龄后咬肌面积较WT大鼠明显减小。特别是在6个月和8个月大时观察到更大的减少(图2)。1C)。
8个月大时舌头的外观如图所示。1D. DMD大鼠舌后部的横截面比WT大鼠大(图2)。1D).然后测量舌头上半部分的面积和宽度。定量分析显示,3月龄后DMD大鼠舌宽明显大于WT大鼠(图2)。1E)。此外,DMD大鼠在8月龄时舌头的面积明显大于WT大鼠(图2)。1F).这些结果表明DMD大鼠出现了巨舌症。
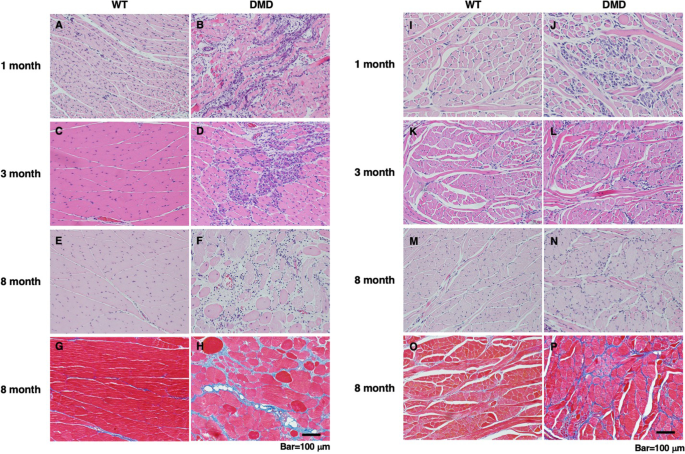
为了进一步了解DMD大鼠咬肌和舌肌的年龄相关变化,进行了组织学分析。对于舌头肌肉,内部肌肉和外部肌肉是分开检查的。DMD大鼠咬肌在1月龄时出现肌纤维变性和坏死,伴有嗜中性粒细胞和巨噬细胞浸润(图2)。2B)和3个月大时细胞核扩大、嗜碱性细胞质增多的再生肌纤维(图。2D)。8个月大时,除了炎症和退行性改变外,还观察到严重的纤维化和脂肪浸润(图。2F, H)。各年龄段WT大鼠咬肌均未见明显病理改变(图。2A, c, e, g)。
相比之下,在DMD大鼠的固有舌肌中,在1月龄时观察到具有扩大的中央核和嗜碱性细胞质的再生肌纤维(图。2J),这些再生改变在3个月大时伴有轻度纤维化(图。2L)。8个月大时,轻度纤维化,也被马松三色染色证实(图。2P),被持久化(图。2N)。虽然DMD大鼠3和8月龄的舌肌部分部位出现再生变化,但舌外肌总体上表现出与舌内肌相似的结果(补充图)。1).各年龄段WT大鼠舌内肌和舌外肌均未见明显病变(F ig。2I, k, m, o)。
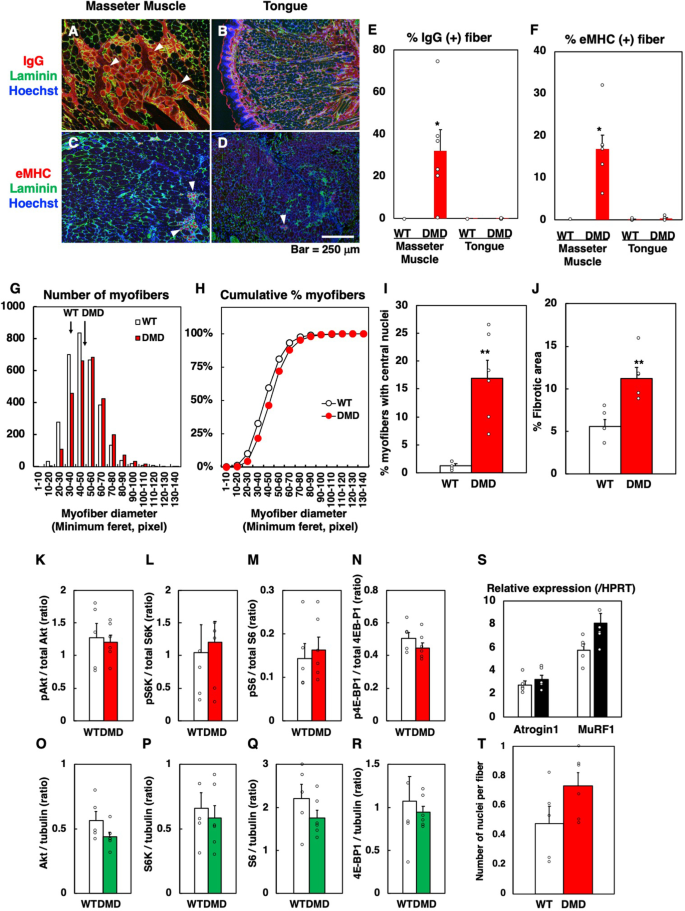
为了进一步研究DMD大鼠舌肌发生大舌滑症时,6月龄时肌纤维坏死和肌肉再生是否仍在进行,对内源性IgG(肌纤维坏死)和胚胎MHC(肌肉再生)进行免疫组织化学分析。DMD大鼠咬肌虽然个体间存在差异,但均表现出明显的肌纤维坏死(图2)。3.A, E)和肌肉再生(图。3.C, F),而舌内肌肉没有显示任何这些(图。3.B, D-F)。这些结果表明,虽然DMD大鼠咬肌和舌肌发生了WT大鼠未见的病理变化,但舌肌的变化比DMD大鼠咬肌的变化要温和得多。
WT和DMD大鼠咬肌和舌肌坏死和再生肌纤维的分析(一个- - - - - -F).一个,B咬肌内源性IgG(红色)和层粘连蛋白(绿色)的代表性免疫组化(一个)和舌头(B) 6月龄DMD大鼠肌肉。核用Hoechst 33258染色(蓝色)。箭头(白色)表示坏死肌纤维。C,D咬肌胚胎肌球蛋白重链(eMHC)(红色)和层粘连蛋白(绿色)的代表性免疫组化(一个)和舌头(B) 6月龄DMD大鼠肌肉。核用Hoechst 33258染色(蓝色)。箭头(白色)表示再生肌纤维。E大鼠咬肌和舌肌坏死和再生肌纤维的定量分析(n=5)和DMD (n=6个月大的大鼠。数据以均数±标准差表示。*,pTukey-Kramer检验<0.05。WT和DMD大鼠舌肌结构分析(G- - - - - -J).G,H6月龄时肌纤维直径分布。左面板(G)表示一定直径的肌纤维的相对分布。右侧面板(H)描述了基于左面板所示数据的相对累积图。DMD大鼠肌纤维直径(n=6)均大于WT大鼠(n= 5)。pWilcoxon秩和检验<0.01(分析肌纤维数,WT=3112, DMD=2662)。我6个月大时肌纤维与中心核的比例。数据以均数±标准差表示。**p<0.01的未配对学生t以及。J6个月大时相对纤维化区。数据以均数±标准差表示。**p<0.01的未配对学生t以及。WT舌肌中Akt-mTOR通路下游相关分子的定量分析(n=5)和DMD大鼠(n=6) 6个月大时(K- - - - - -R).K- - - - - -N磷酸化Akt、S6K (S6激酶)、S6 (S6核糖体蛋白)、4E-BP1的比值。O,PAkt、S6K (S6激酶)、S6 (S6核糖体蛋白)和4E-BP1的总量归一化至α-微管蛋白水平。数据以均数±标准差表示。两种肌肉特异性E3泛素连接酶(Atrogin1和MuRF1)在WT舌肌中的表达定量分析n=5)和DMD大鼠(n=6) 6个月大时(年代).数据以均数±标准差表示。WT舌肌每根肌纤维核数的定量分析(n=5)和DMD大鼠(n=6) 6个月大时(T).数据以均数±标准差表示
为了探讨造成DMD大鼠巨舌症的因素,我们在6月龄时测量了WT和DMD大鼠舌内肌的肌纤维直径。DMD大鼠的肌纤维直径大于WT大鼠(图2)。3.G H;pWilcoxon秩和检验< 0.01)。DMD大鼠具有中心核的肌纤维比例明显高于WT大鼠,表明过去发生过肌肉再生(F ig。3.此外,对Masson三色染色切片进行定量分析,如图所示。2DMD大鼠舌肌纤维化面积约为WT大鼠的两倍(图2)。3.J).因此,这些结果表明,肌纤维的增厚反应和肌纤维间胶原蛋白的积累共同作用产生了大光泽症。考虑到间质区细胞可能受到影响,比较6月龄WT和DMD大鼠舌肌血管内皮细胞和间充质祖细胞数量。cd31阳性(内皮细胞)和cspg4阳性(间充质祖细胞)细胞所占的面积具有可比性(补充图。2).
肌纤维肥大通过两种机制发生:通过激活PI3K-Akt-mTOR途径增加蛋白质合成和通过卫星细胞融合增加新的肌核[12].为了更深入地了解在DMD大鼠舌肌中观察到的肌纤维肥大的机制,我们研究了在6个月大的舌肌中PI3K-Akt-mTOR通路下游作用的分子的数量和磷酸化,以及每条肌纤维的核数。WT和DMD大鼠在S6K、S6和4E-BP1的数量和磷酸化程度上没有差异(图5)。3.K-R;补充图。3.).Foxo1的表达和磷酸化均未被检测到,而Foxo1被认为与蛋白质降解有关(数据未显示)。此外,在两种骨骼肌特异性泛素连接酶基因的转录上没有观察到显著差异,Atrogin 1而且MuRF1,它们参与蛋白质的降解[2(图。3.S)。当计算横切面上每根肌纤维的核数时,在DMD大鼠中观察到核数增加的趋势,尽管这在统计学上不显著(图2)。3.这些结果表明,至少在6个月大时,蛋白质合成既没有增加,也没有抑制蛋白质降解,融合卫星细胞数量的增加更有可能参与肌纤维的肥大。
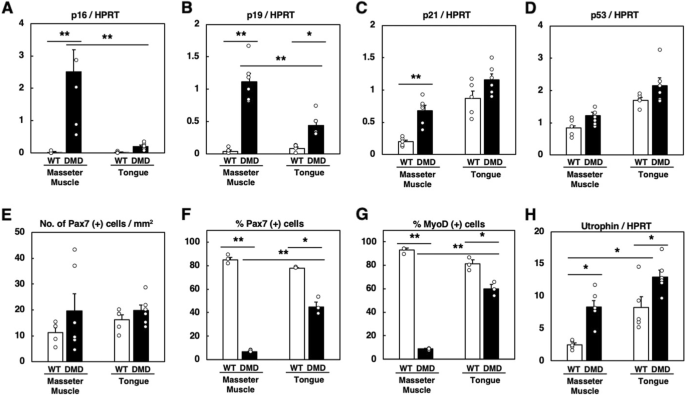
我们以前报道过,细胞衰老与转录的增加p16而且p19在DMD大鼠的后肢肌肉中发生,并且肌肉卫星细胞的增殖在培养中明显受到抑制[33].因此,我们检测了9个月大时咬肌和舌头肌肉中衰老相关基因的转录。p16而且p19与WT大鼠相比,DMD大鼠咬肌中明显上调。4A, B,另一方面,两者都有p16而且p19在DMD大鼠舌肌中有轻微上调,但幅度明显低于咬肌(图2)。4A、B)。p21转录仅在DMD大鼠咬肌中显著上调(图。4C),而在p53WT和DMD大鼠肌肉中转录水平的变化(图2)。4D).切片中pax7阳性卫星细胞数量无显著差异,但个体间差异较大(图。4E).另一方面,DMD大鼠咬肌来源的Pax7或myod阳性卫星细胞在体外培养4天后数量明显低于WT大鼠(图2)。4F, G,补充图4A和B),而DMD大鼠舌肌衍生的卫星细胞数量仅略低于WT大鼠(图。4F, G,补充图4A和B)。这些结果表明,细胞衰老可能通过p16和p19依赖途径广泛发生在DMD大鼠的咬肌中,可见于它们的后肢肌肉[33],而舌头肌肉的症状明显不那么严重。
WT和DMD大鼠肌肉中基因表达和卫星细胞的定量分析。一个p16,Bp19,Cp21,Dp539个月大时咬肌和舌肌的转录。数据以均数±标准差表示。*和**,p< 0.05和p< 0.01的未配对学生t-test,分别为(WT,n= 5;模式,n= 6)。E9月龄切片pax7阳性卫星细胞数。数据以均数±标准差表示。Tukey-Kramer检验各组间差异无统计学意义(WT,n= 5;模式,n= 6)。F,G9月龄大鼠体外培养4天后Pax7和myod阳性卫星细胞的相对数量。数据以均数±标准差表示。*和**,p< 0.05和p< 0.01的未配对学生t-test,分别为(WT,n= 3;模式,n= 3)。HUtrn9个月大时咬肌和舌肌的转录。数据以均数±标准差表示。*,p未配对学生的< 0.05t以及(WT、n= 5;模式,n= 6)
上述结果表明,DMD大鼠舌肌营养不良的改变进展较慢。营养不良蛋白是一种与营养不良蛋白相关的蛋白质,已被证明可以补偿营养不良蛋白的功能[7,13,20.,26].在DMD小鼠模型mdx小鼠中,骨骼肌表型比在DMD患者中看到的要温和[20.],这曾被认为是由于utrophin的上调[20.].因此,我们检查了UtrnWT和DMD大鼠9月龄咬肌和舌肌的转录水平。在咬肌中,Utrn转录因营养不良蛋白的缺失而显著上调(图。4H).有趣的是,在舌头肌肉中,Utrn转录也上调,但在存在营养不良蛋白(WT大鼠)时,其基础表达与DMD大鼠咬肌中的表达相当(图2)。4H).这一结果表明,舌头肌肉在本质上表达了更高水平的Utrn即使在存在肌萎缩蛋白的情况下也能转录,这可能与该组织在没有肌萎缩蛋白的情况下对退行性变化的抵抗力有关。
讨论
在本研究中,我们证明了DMD大鼠的舌头显示出大舌,退行性改变仅在生命早期被短暂观察到。另一方面,DMD大鼠咬肌出现慢性退行性和坏死变化。
细胞衰老是由慢性炎症引起的氧化应激引起的[6].我们之前报道了进行性肌纤维变性和坏死,以及细胞衰老和转录增加p16而且p19,在DMD大鼠的胫骨前肌(TA)和膈肌[33].p16转录本主要存在于卫星细胞和间充质祖细胞中,体外增殖活性受到严重抑制。本研究中发现的DMD大鼠咬肌表型与我们之前的报道相似;咬肌呈现进行性肌纤维变性和坏死,相应地,p16而且p19转录上调。相反,转录p16而且p19DMD大鼠舌肌的细胞增殖活性明显低于咬肌,且卫星细胞的增殖活性在体外保存较好。这与DMD大鼠舌肌未见肌纤维坏死和炎症的组织学观察相一致,提示不存在诱导细胞衰老的氧化应激。
在mdx小鼠的后肢肌肉中观察到与DMD大鼠舌肌相似的表型[10,19,35].在DMD大鼠舌肌中,在1月龄时观察到肌纤维的短暂再生,在它们生命的后期,具有中央核的肌纤维持续存在,没有任何退行性变化。在mdx小鼠的骨骼肌中,只有在1 - 2个月大时才观察到坏死再生,并且具有中心核的再生肌纤维在很长时间内仍然存在[10,19,35].目前,尚不清楚为什么mdx小鼠的肌纤维坏死仅发生短暂性,但有人认为其中一个原因是肌营养不良蛋白的功能同源物——肌营养蛋白的代偿性增加可能取代了肌营养不良蛋白的功能[20.].在本研究中UtrnWT大鼠舌肌的转录水平高于咬肌。因此,其中一种可能是某种机制可能导致转录的增加Utrn在大鼠舌肌中,即使在肌营养不良蛋白缺乏的情况下,也可能不会发生肌纤维坏死。然而,本研究仅通过定量RT-PCR显示了utrophin转录水平的差异,需要通过免疫组化分析确定定位,以及western blotting定量分析蛋白水平,才能得出准确的结论。
不同部位损伤后骨骼肌再生程度不同;有报道称,100日龄MDX小鼠咀嚼肌的肌纤维直径和纤维化程度因肌肉而异[31].此外,Yoshioka等报道WT和mdx小鼠心脏毒素注射诱导骨骼肌损伤及随后再生时,再生速度和再生后肌肉重量增加程度存在差异[40].特别是咬肌损伤后恢复肌肉重量的时间较TA肌长,且未出现再生肌纤维肥大[40].他们认为,这些差异是由于每块骨骼肌中存在的卫星细胞的不同性质。关于这一点,不同肌肉的卫星细胞来源不同[27].包括卫星细胞在内的舌头肌肉被认为是由混合的中胚层起源[23,27,但还没有对这些肌肉进行详细的、令人信服的谱系追踪实验。另一方面,咬肌的卫星细胞来源于颅旁中胚层的第一和第二咽弓,内脏中胚层也有贡献[27].目前,尚不清楚这些卫星细胞的不同来源最终如何影响骨骼肌的性质。然而,在包括DMD在内的多种肌病类型中,已有研究表明卫星细胞来源的差异可能导致不同肌肉之间不同的病理易感性[27].因此,在DMD大鼠中观察到的咬肌和舌肌之间的表型差异可能是由于卫星细胞性质的差异。然而,我们不能排除每块肌肉营养不良变化的差异仅仅是由于每块肌肉上机械负荷的差异造成的可能性。在这方面,验证大鼠肌肉负荷差异的研究是必要的。
舌肌在骨骼肌中有一个独特的结构特征,即舌肌被上皮细胞覆盖,舌肌的发育受到上皮细胞的间接影响[14,18].在发育过程中,上皮来源的超音hedgehog基因(shh)作用于颅神经嵴细胞(CNCC),这些细胞构成间质[14].当CNCC中的hedgehog信号有缺陷时,枕骨肌母细胞的迁移受到干扰,导致舌头发育不良。虽然成人舌头上皮细胞的参与尚未报道,但来自上皮细胞的因子可能直接或间接地通过间质作用于舌头肌肉,这可能对营养不良蛋白缺乏引起的舌头肌纤维退行性改变具有保护作用。这一点有待进一步调查。
据报道,大舌音症不仅发生在人类DMD中,也发生在犬x -连锁肌肉营养不良(CXMD)中[30.].在人类DMD中,大舌音症会干扰舌头功能[36,37],但未进行详细的组织学研究。另一方面,也有人认为肌纤维肥大是CXMD大舌症的原因[30.].这与目前对DMD大鼠的分析结果一致。骨骼肌肥大的机制包括蛋白质合成增加、降解减少和卫星细胞供给肌纤维的肌核数量增加[12].据报道,mdx小鼠和金毛肌肉营养不良(GRMD)犬的一些再生肌纤维显示肥厚[4,8,15,16,24,29],其机制之一是在肌纤维坏死发生前的一段时间内,Akt-mTOR通路被强烈激活,导致肌纤维肥大,导致随后的病理严重程度降低[25].由于舌头中肌纤维肥大的机制尚未在任何报道的物种中进行深入分析[28,30.,37],本研究试图阐明DMD大鼠舌肌肌纤维肥大的机制。因此,与WT大鼠相比,参与调节蛋白质合成和降解的信号分子没有显著改变,至少在本研究中检测的6个月大鼠中是如此。然而,这并不一定排除Akt-mTOR通路参与DMD大鼠舌肌纤维肥大的可能性,该通路在较年轻时(6月龄前)的短暂激活仍有可能导致肌纤维肥大。另一方面,虽然没有统计学意义,但每条肌纤维的核数呈增加趋势,这表明卫星细胞可能已经供应了新的肌核。目前的结果支持了这一点,即DMD大鼠舌肌卫星细胞的成肌性在体外相对保存,甚至在9月龄时,与咬肌卫星细胞不同。
本研究的局限性在于尚不清楚DMD大鼠巨舌症是否影响舌功能,也不清楚DMD大鼠进食减少是否与巨舌症有关。此外,在DMD大鼠中看到的食物摄入量减少也有可能是由呼吸问题或心肌病等一般性疲劳引起的。事实上,DMD大鼠的心脏出现了广泛的纤维化[22,33]以及与DMD患者相似的心脏受累分布和进展[32].关于这些问题,有必要通过实验评估DMD大鼠的舌功能,并在未来阐明DMD大鼠摄食减少的确切原因。
结论
我们发现,与咬肌和后肢肌肉不同,DMD大鼠舌肌中很少观察到肌纤维退行性/坏死变化、卫星细胞增殖活性降低以及p16和p19表达增加。此外,大鼠的舌肌水平较高Utrn转录比咬肌强,说明这种代偿性Utrn转录可能保护舌头肌纤维在缺乏营养不良蛋白的情况下不发生变性/坏死变化。阐明DMD大鼠舌肌低晚期营养不良变化的相关机制,将有助于建立DMD的有效治疗方法。
缩写
- 方差分析:
-
方差分析
- CNCC:
-
颅神经嵴细胞
- CSPG4:
-
硫酸软骨素蛋白聚糖4
- CXMD:
-
犬x连锁肌肉萎缩症
- 模式:
-
杜氏肌营养不良症
- DMD老鼠:
-
DMD大鼠模型
- DSHB:
-
发育研究杂交瘤库
- EDTA:
-
乙二胺四乙酸
- eMHC:
-
胚胎肌球蛋白重链
- 他:
-
Hematoxylin-eosin
- 产生HPRT:
-
次黄嘌呤鸟嘌呤phosphoribosyltransferase应承担的
- 合:
-
辣根过氧化物酶
- 美国儿童健康与人类发展研究所:
-
国家儿童健康和人类发展研究所
- 是因为:
-
普通驴血清
- 门店:
-
普通山羊血清
- PBS:
-
磷酸盐
- PFA:
-
多聚甲醛
- 里帕:
-
Radioimmunoprecipitation化验
- sds - page:
-
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
- 嘘:
-
声波刺猬
- 助教:
-
胫骨前
- WT:
-
野生型
- XY:
-
男性WT
- XDmdY:
-
男性模式
参考文献
Ariga M, Nedachi T, Akahori M, Sakamoto H, Ito Y, Hakuno F, Takahashi S.胰岛素样生长因子- i在FRTL-5细胞中被cAMP增强的信号通路。生物化学学报,2000;36 (Pt 2): 409-16。
博丹SC,拉特雷斯E,鲍姆胡特S,赖VK,努涅斯L,克拉克BA,普伊米鲁WT,帕纳罗FJ,娜E,达玛拉扬K,潘ZQ,瓦伦苏拉DM,迪希拉TM,斯蒂特TN,扬科波洛斯GD,格拉斯DJ。骨骼肌萎缩所需的泛素连接酶的鉴定。科学。2001;294:1704-8。
Botteron S, Verdebout CM, Jeannet PY, Kiliaridis S.杜氏肌营养不良的口面功能障碍。《口腔生物学》杂志2009;54:26-31。
葛丽娟,王志强,王志强,等。mdx小鼠骨骼肌肌病:2。收缩特性。中国神经生物学杂志,1988;14(4):369 - 369。
da Costa KVT, Ribeiro CMB, de Carvalho FD, Gonçalves LS, de Almeida OP, de Carvalho Silva LT, Bastos YVP, Ferreira SMS。多发性骨髓瘤相关性淀粉样变患者因大光泽症引起的吞咽困难:一例报告。特殊护理牙医。2018;38:255-8。
Davalli P, Mitic T, Caporali A, Lauriola A, D 'Arca D. ROS,细胞衰老和衰老相关疾病的新分子机制。oxmed Cell longv . 2016;2016:3565127。
德Deconinck AE, Rafael JA, Skinner JA, Brown SC, Potter AC, Metzinger L, Watt DJ, Dickson JG, Tinsley JM, Davies KE。Utrophin-dystrophin-deficient小鼠作为Duchenne muscular dystrophy的模型。细胞。1997;90:717-27。
DiMario JX, Uzman A, Strohman RC。营养不良(MDX)小鼠骨骼肌纤维再生不持久。Dev Biol, 1991; 148:314-21。
段东,高曼思,武田,莫古丽,杜氏肌营养不良症。Nat Rev Dis primer . 2021;7:13。
Duddy W, Duguez S, Johnston H, Cohen TV, Phadke A, gorish - dressman H, Nagaraju K, Gnocchi V, Low S, Partridge T. mdx小鼠的肌肉营养不良是一种严重的肌病,伴有萎缩、肥大和增生。骨骼肌。2015;5:16。
杜蒙NA,本辛格CF, Sincennes MC, Rudnicki MA。卫星细胞和骨骼肌再生。Compr Physiol. 2015; 5:1027-59。
深田SI,伊藤N.肌肉肥厚的调节:参与akt不依赖通路和卫星细胞在肌肉肥厚。Exp Cell Res. 2021;409:112907。
Grady RM, Teng H, Nichol MC, Cunningham JC, Wilkinson RS, Sanes JR.缺乏肌营养不良和营养不良的小鼠的骨骼和心肌病:杜氏肌营养不良的模型。细胞。1997;90:729-38。
郑俊杰,毛俊杰,田贞,王晓明,等。神经嵴细胞中Hedgehog基因信号通路对面部原基发育的调控作用。基因开发2004;18:937-51。
Kornegay JN, Childers MK, Bogan DJ, Bogan JR, Nghiem P, Wang J, Fan Z, Howard JF JR, Schatzberg SJ, Dow JL, Grange RW, Styner MA, Hoffman EP, Wagner KR.肌肉萎缩症中肌肉肥大的悖论。中国临床医学杂志,2012;23:149-72。
Kornegay JN, Cundiff DD, Bogan DJ, Bogan JR,冈村CS。金毛肌肉萎缩症犬的颅缝匠肌出现真正的肥大。神经肌肉失调。2003;13:493-500。
Le Révérend BJ, Edelson LR, Loret C.幼儿咀嚼发育的解剖、功能、生理和行为方面。中国科学(d辑),2014;
Lin C, Fisher AV, Yin Y, Maruyama T, Veith GM, Dhandha M, Huang GJ, Hsu W, Ma L. Wnt-β-Catenin信号在口腔器官形成中的诱导作用。Dev biology, 2011; 36:40 - 50。
马斯普斯特,李毅,普里查德,阮VM, McCreedy DA, Thompson WJ。mdx骨骼肌的终生分析揭示了导致肌纤维损失的进行性病理。科学通报2020;10:17248。
松村浩,张志刚,张志刚,张志刚。mdx小鼠肌肉中抗肌萎缩蛋白相关蛋白与抗肌萎缩蛋白相关蛋白的关系。大自然。1992;360:588 - 91。
元桥,李志刚。肌肉卫星细胞异质性与自我更新。《细胞生物学》2014;2:1。
Nakamura K, Fujii W, Tsuboi M, Tanihata J, Teramoto N, Takeuchi S, Naito K, Yamanouchi K, Nishihara M.用CRISPR/Cas系统生成肌肉萎缩模型大鼠。科学通报2014;4:5635。
韩东,柴勇。舌肌发生的分子和细胞调控机制。J Dent res 2012; 91:528-35。
Pastoret C, Sebille A. Mdx小鼠随着年龄的增长表现出进行性无力和肌肉退化。中华神经科学杂志,1995;29(4):344 - 344。
Peter AK, Crosbie RH。Duchenne和肢带肌营养不良的肥厚性反应与Akt通路的激活有关。Exp Cell res 2006; 312:2580-91。
Rafael JA, Tinsley JM, Potter AC, Deconinck AE, Davies KE。骨骼肌特异性表达的一种营养不良基因拯救了缺乏营养不良蛋白的小鼠。Nat Genet, 1998; 19:79-82。
Randolph ME, Pavlath GK。每块肌肉都有一个肌肉干细胞:卫星细胞生物学在不同肌肉群中的变异性。前沿衰老神经科学。2015;7:190。
Renard D, Humbertclaude V, Labauge P.成人杜氏肌营养不良大舌肌症。神经科学学报2010;110:288。
萨科P,琼斯DA,迪克JR,等。正常和mdx小鼠胫骨前肌的收缩特性和运动诱导损伤的易感性。中国生物医学工程杂志1992;82:227-36。
Shimatsu Y, Yoshimura M, Yuasa K, Urasawa N, Tomohiro M, Nakura M, Tanigawa M, Nakamura A, Takeda S.日本犬x连锁肌肉萎缩症的主要临床和组织病理学特征。中国医学杂志2005;24:145-54。
Spassov A, Gredes T, Gedrange T, Lucke S, Pavlovic D, Kunert-Keil C. mdx小鼠咀嚼肌的组织学改变。《口腔生物学》杂志2010;55:318-24。
Sugihara H, Kimura K, Yamanouchi K, Teramoto N, Okano T, Daimon M, Morita H, Takenaka K, Shiga T, Tanihata J, Aoki Y, Inoue-Nagamura T, Yotsuyanagi H, Komuro I.通过CRISPR/Cas9基因组编辑生成的Duchenne肌营养不良大鼠模型的年龄依赖性超声心动图和病理结果。Int Heart J. 2020; 61:1279-84。
Sugihara H, Teramoto N, Nakamura K, Shiga T, Shirakawa T, Matsuo M, Ogasawara M, Nishino I, Matsuwaki T, Nishihara M, Yamanouchi K.细胞衰老介导的Duchenne肌营养不良加重。科学通报2020;10:16385。
Takeuchi S, Nakano S, Nakamura K, Ozoe A, Chien P, Yoshihara H, Hakuno F, Matsuwaki T, Saeki Y, Takahashi S, Yamanouchi K, Nishihara M.骨骼肌组织中硫酸软骨素蛋白多糖4在成纤维/成脂肪分化中的作用。Exp Cell Res. 2016; 347:367-77。
托雷斯LF,杜臣LW。突变mdx:小鼠的遗传性肌病。神经、肌肉和终板的形态学研究。大脑。1987;110:269 - 99。
van den Engel-Hoek L, de Groot IJ, Sie LT, van Bruggen HW, de Groot SA, Erasmus CE, van Alfen N.咀嚼肌营养不良改变相关的咀嚼问题和Duchenne型肌营养不良。神经肌肉失调。2016;26:354-60。
van den Engel-Hoek L, Erasmus CE, Hendriks JC, Geurts AC, Klein WM, Pillen S, Sie LT, de Swart BJ, de Groot IJ。杜氏肌营养不良患者口腔肌肉逐渐受到影响:吞咽困难治疗的意义。中华神经科学杂志,2013;
Waisman A, Norris AM, Elías Costa M, Kopinke D.骨骼肌中肌纤维的自动无偏分割和量化。科学通报2021;11:11 1793。
Yamanouchi K, Nakamura K, Takeuchi S, Hosoyama T, Matsuwaki T, Nishihara M.骨骼肌祖细胞培养中MyoD抑制诱导自发脂肪生成。中国生物医学工程学报,2015;29(2):374 - 374。
吉冈K,北岛Y,世子D,土屋Y,小野Y。小鼠肌肉再生和萎缩模型的体区特异性。物理学报(Oxf)。2021; 231: e13553。
资金
抗pax7和抗emhc单克隆抗体来自NICHD开发的发育研究杂交瘤库,由爱荷华大学维护。这项工作得到了日本科学促进协会的科学研究资助(B) (20H03161, 19K22359, 16H05041和15K14883 - KY),跨部委的农业,林业和渔业研究与发展计划,日本NARO生物导向技术研究推进机构的“智能生物工业和农业技术”(资助号20350956 - SIT),日本科学促进协会核心到核心项目(资助号JPJSCCA20210007 to SIT)。
作者信息
作者及隶属关系
贡献
KY进行实验,分析数据,准备数据,撰写稿件;YT, MI, RO, HN进行实验;SK制备组织切片并进行实验;JC、FH、SIT、TM、KU编辑稿件。作者们阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
本研究中所进行的所有动物实验均符合东京大学实验动物护理和使用指南,并得到东京大学机构动物护理和使用委员会的批准(P18-125)。所有研究都是按照《赫尔辛基宣言》进行的。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:补充图1。
DMD大鼠舌外肌he染色切片。在3个月和8个月时,在一些金舌鱼肌肉中观察到细胞核集中的再生肌纤维和嗜碱性细胞质。
附加文件2:补充图2。
血管内皮细胞(CD31)和间充质祖细胞(CSPG4)的免疫组化分析。6月龄WT和DMD大鼠舌肌CD31(红色)、CSPG4(红色)和层粘连蛋白(绿色)的代表性免疫组化。核用Hoechst 33258染色(蓝色)。图中数据为CD31-和cspg4阳性区域定量分析。数据用平均值表示+Se (cd31, wt (n=5)和DMD (n= 6);Cspg4, wt (n=3)和DMD (n= 3))。
附加文件3:补充图3。
Western blot检测6个月大时舌肌中Akt-mTOR通路下游的分子。抗4e - bp1抗体检测到两条双条带。上层(p-4E-BP1(高))和下层(p-4E-BP1(低))分别对应于高度磷酸化的4E-BP1和非或低磷酸化的4E-BP1。α-微管蛋白作为内部对照。p-Akt (S473), Akt在Ser位点磷酸化473.p-S6K (T389), S6激酶在Thr位点磷酸化389.p-S6 (S240/244), S6核糖体蛋白Ser位点磷酸化240和爵士244.N是样本数。
附加文件4:补充图4。
卫星细胞的代表性免疫细胞化学。培养第4天,用抗pax7 (A)和抗myod (B)进行免疫染色。核用Hoechst 33258染色。箭头(白色)表示阳性细胞。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
山内K,田中Y,池田M。et al。杜氏肌营养不良大鼠舌肌大舌斑及晚期营养不良改变。骨骼肌12, 24(2022)。https://doi.org/10.1186/s13395-022-00307-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-022-00307-7
关键字
- 杜氏肌营养不良症
- 咬肌
- 舌头
- 巨舌
- 老鼠