摘要
背景
脊髓性肌萎缩症(SMA)是一种主要影响儿童的运动神经元疾病,其特征是减少下运动神经元(MNs)。神经肌肉连接(NMJs)的破坏是SMA的早期病理事件。然而,并不是所有的运动神经元都同样脆弱,一些群体在疾病早期丢失,而另一些在疾病终末期保持完整。彻底了解这种选择性脆弱性的基础将对某些运动神经元种群中禁止病理的因素提供关键的见解,从而有助于确定新的神经保护策略。
方法
为了获得对SMA运动神经元易感性的全面了解,我们在20块肌肉中绘制了NMJ病理Smn2 b / -并将这些数据与其他三种常用小鼠模型的已发表数据进行交叉比较。为了深入了解调节选择性弹性和脆弱性的分子机制,我们分析了已发表的RNA测序数据,这些数据来自两种不同的SMA小鼠模型的差异脆弱运动神经元。
结果
在Smn2 b / -在SMA小鼠模型中,我们发现核心、颈部、后肢近端和前肢近端肌肉中有大量的NMJ损失,远端四肢和头部的去神经性明显减少。与L5相比,T5和T11的运动神经元胞体损失更大。我们随后表明,尽管在每个SMA小鼠模型中都观察到广泛的去神经(台湾模型是个明显的例外),但所有模型都有明显的选择性脆弱性模式。对先前发表的数据集的比较揭示了选择性抗性运动神经元中与疾病相关的新转录物上调,包括参与轴突运输、RNA处理和线粒体生物能学的基因。
结论
我们的研究表明Smn2 b / -小鼠模型显示了一种选择性易损模式,与SMA患者中观察到的区域病理相似。我们发现四种SMA小鼠模型的选择性脆弱性模式存在巨大差异,这在实验设计中是至关重要的。我们还确定了可能有助于保护SMA小鼠模型中某些运动神经元的转录组。
背景
脊髓性肌萎缩症(SMA)是一种主要影响儿童的运动神经元疾病,由存活运动神经元1 (SMN1)基因[1].生存运动神经元(SMN)蛋白水平的降低导致较低运动神经元的进行性丧失和相关骨骼肌的萎缩[1,2,3.].该基因的第二个部分功能副本(称为SMN2)可以以不同的拷贝数存在,是疾病严重程度的重要修饰因子[4,5].因此,SMA可根据发病年龄和预期预后分为4种亚型。最严重和最常见的SMA形式(I型)发病时间为6个月或更早,如果不治疗,在没有显著呼吸支持的情况下,预期寿命为2年。目前已有三种治疗方法被批准用于SMA患者[6,7,8,9,10,11].尽管这些可以给患者带来显著的好处,但即使在症状前进行治疗,仍可能存在影响性运动缺陷[12,13].为了优化所有患者的治疗,我们必须保持势头,了解SMA背后的基本生物学。
SMA的主要临床表现为下运动神经元的丧失。在这里,运动神经元和肌肉之间的突触,神经肌肉连接(NMJs),是早期和重要的病理靶点[14], NMJ损失与躯体细胞死亡途径的开始相一致,但在可量化的运动神经元损失之前[15,16].先前在该病的小鼠模型中报道了NMJs的广泛形态和功能缺陷[14,17,18,19,20.].虽然运动神经元的顺序分解是相对明确的,但显然不是所有的运动神经元都是脆弱的。事实上,人们早就认识到,严重的SMA患者在核心和近端肢体肌肉有更严重的无力,而远端肢体、手、脚和面部的肌肉相对较少[21].事实上,最近一项使用hammer-smith运动功能量表检查肌肉功能的研究发现,肌肉位置是相对虚弱的预测因素,其中与远端肢体肌肉相比,近端肢体肌肉的虚弱程度更严重[22].在3型SMA患者中,易损性模式再次高度一致,三头肌、髂腰肌、大腿内收肌和股四头肌易损性增加[23].
迄今为止所研究的所有SMA小鼠模型均显示所观察到的NMJ损失水平在肌肉间的显著差异[14,20.,24,25,26,27,28,29].这在不同的SMA小鼠模型中都有表现,包括Smn-/-; SMN2(预期寿命6天)[14,24,25),SMNΔ7 /Δ7; SMN2又名台湾人(平均寿命8-10天)[29),Smn-/-SMN2; SMNΔ7 /Δ7又名SMNΔ7(预期寿命13天)[14,20.,28].此外,还有Smn2 b / -小鼠模型,通过突变剪接增强位点在小鼠Smn基因(30.,31].其预期寿命和严重程度因遗传背景而异[26,27,30.,31,32],但在我们手中,它的表型发病时间为10天,预期寿命为18天[15].虽然NMJ病理和选择性易损性在该模型中很明显,但迄今为止只有少数肌肉被描述[15,27].
目前,SMA中运动神经元脆弱性差异的原因尚不清楚,但我们了解其模式并研究其基础越来越重要。事实上,众所周知,早期使用smn依赖疗法可为患者带来最大的益处,随着治疗延迟,观察到疗效的降低[33].我们最近已经证明,神经肌肉连通性的恢复与治疗时间成正比,但也高度依赖于肌肉的相对脆弱性[34].患者的电生理学研究表明,治疗可诱导与运动功能增强有关的主动运动单元数量增加[35].早期的研究结果表明,运动功能的增加与肌肉的相对脆弱性以及运动功能丧失后的时间成正比。因此,在实验模型中分析这种选择性脆弱性至关重要,从而为未来针对最脆弱运动单元的联合疗法的开发提供平台。
差异弹性现象也为研究驱动运动神经元保护的机制提供了机会,这可以揭示疾病的调节剂。这种方法已被用于鉴定肌萎缩性侧索硬化症运动神经元病理修饰因子。在这里,从神经正常的小鼠、大鼠或人的死后组织中分离出对ALS具有不同易感性的运动神经元,并进行全局转录组分析。这导致了一些重要的修饰剂的鉴定,包括IGF-II [36]、GABA和谷氨酸受体[37], mmp-9 [38]和synaptotagmin 13 [39].在SMA中,同样的方法导致了DNA修复转录物的重要鉴定[27]和Pgk1 [40作为潜在的疾病调节剂。在前一项研究中,对野生型和野生型中脆弱或抵抗的运动神经元进行了四向比较Smn2 b / -小鼠促进了与减少相关的转录本的鉴定Smn水平和那些具体涉及电机单元故障的。一项针对野生型和野生型的离散神经元种群在症状前、早期和晚期时间点的转录谱分析的纵向研究SMN∆7小鼠进一步鉴定出潜在的疾病修饰因子,包括Gdf-11 [41].基因本体论和蛋白质网络分析揭示了在耐药眼运动神经元中存在的独特的疾病适应机制,这可能是其保留的原因。这些运动神经元被发现上调与调节神经递质释放、神经元存活和保护氧化应激相关的转录本。该研究揭示了细胞特异性变化,为保护脆弱的运动神经元提供了有希望的目标[41].结合对肌萎缩侧索硬化和肌萎缩侧索硬化中不同脆弱的运动神经元的转录筛选,可以显著细化潜在修饰因子的列表,并导致SNCA的鉴定[42]和STMN1 [42,43作为有前途的神经保护修饰剂。这些发现证明,将选择性弹性与脆弱的运动神经元进行比较,可以发现驱动保护的机制。它还表明,结合来自不同疾病模型的发现,增加了有效识别有前途的疾病修饰因子的可能性。揭示不同模型中选择性脆弱性模式的异同可以为揭示运动神经元抵抗和易感性的机制提供一个新的平台。
在这项研究中,我们对选择性脆弱模式进行了全面的分析Smn2 b / -小鼠模型。我们证明Smn2 b / -小鼠模型表现出独特的选择性易损性模式,其中核心、前肢近端和后肢近端肌肉表现出NMJ损失增加。我们进一步表明,这种外周病理与相关脊髓节段运动神经元损失的增加相关。这种区域脆弱性模式,即近端肌肉比远端肌肉更脆弱,显示出与在患者中观察到的脆弱性模式的相似性[21,22,23].随后,我们收集了先前发表的选择性脆弱肌肉分析结果Smn-/-, SMN2台湾和SMNΔ7并使用7点颜色编码分类工具来比较模型内部和模型之间的选择性脆弱性模式。虽然大多数模型(台湾小鼠模型是个明显的例外)在一系列肌肉中显示出去神经,但它们都表现出独特的选择性脆弱模式。例如,面部运动神经元的NMJs在神经系统中非常脆弱SMNΔ7小鼠模型在完全保护的同时Smn2 b / -小鼠模型。为了进一步识别有可能驱动运动神经元保护的转录本组,我们利用已发表的面部运动神经元RNA-seq数据进行了跨模型比较生物信息学分析和富集分析Smn2 b / -而且SMNΔ7老鼠。我们证明,与细胞外围蛋白质定位和核糖核蛋白复合物生物发生相关的转录本的增加与防止退行性变相关。我们认为这些转录簇可能有助于SMA小鼠模型中运动神经元的保护。
材料与方法
鼠标的维护
Smn2 b / 2 b老鼠[22;C57Bl/6J同源背景]与Smn+ /−(Jackson实验室菌株原010921,现006214,C57Bl/6同源背景)获得Smn2 b / +控制小鼠和Smn2 b / -实验小鼠。Smn+/-; SMN22份; SMNΔ72份(Jackson品系005025,FVB同源背景)小鼠杂交得到Smn-/-; SMN22份; SMNΔ72份(又名SMN∆7老鼠)。所有小鼠在爱丁堡大学动物设施内无病原体条件下保持12小时的光/暗循环。所有程序都按照英国内政部的规定执行。
神经肌肉连接点标记和定量
肌肉立即从最近牺牲的小鼠解剖,并固定在4%多聚甲醛(PFA;所有肌肉固定后进行显微解剖,并在2% Triton X-100 (Sigma;PTB)在室温下在PBS中放置30分钟。在4%牛血清白蛋白(BSA)/1% Triton X-100 PBS中阻断它们30分钟,然后在一抗中孵育一夜(神经丝[NF;2 h3);1:50和突触囊泡蛋白2 [SV2];1:100 from Developmental Studies Hybridoma Bank), 4°C。四甲基罗丹明共轭α-平房毒素(BTX;摘要;在PBS中涂抹60分钟,然后PBS洗涤。 The muscles were incubated in secondary antibody (Alexa Fluor 488 Rabbit anti-Mouse; Jackson ImmunoResearch Laboratories; 1:250) in PBS for 3–4 h in the dark at room temperature and washed with PBS. The muscles were whole-mounted on glass slides (Thermo Fisher) using Mowiol® (Calbiochem) and cover-slipped.
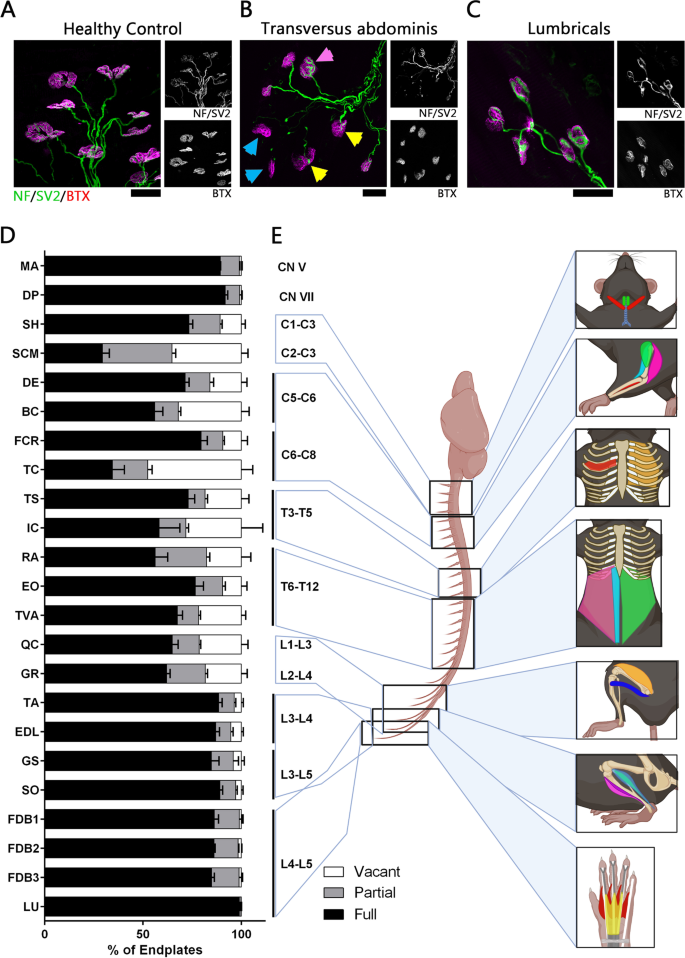
NMJ定量采用标准方案[14,26,27,28,42,43,44,45].使用徕卡倒置荧光显微镜在40倍放大倍率下手动量化NMJ占用,使用滤镜允许绿色通道(NF, SV2)和红色通道(BTX)单独和同时可见。所有的量化都对肌肉的基因型进行盲法。每块肌肉在三个或更多视野中至少有100个终板被量化。使用BTX染色在肌肉上随机选择视场。分析的终板被分为空置、部分占据(突触前末端仅部分覆盖AChR簇)和完全占据(见图)。1例如A)。具有代表性的示例图像是由徕卡SP8共聚焦显微镜在×63倍率下获得的z-堆栈投影。
NMJ损失在颈椎、胸椎和上腰椎脊髓支配的肌肉中更为严重Smn2 b /−P16小鼠模型。一个- - - - - -C代表性共聚焦图像显示对照肌肉中标记有抗NF(绿色)、SV2(绿色)和BTX(洋红色)抗体的NMJs染色(Smn2 b / +;Gracilis),一个脆弱的Smn2 b /−肌肉(横腹肌)和抵抗肌Smn2 b /−肌肉(蚓类)分别。粉红色箭头表示完全占据终板,黄色箭头表示部分神经支配终板,蓝色箭头表示空着终板。比例尺:25μm。D柱状图显示了全终板、部分终板和空终板的定量百分比Smn2 b /−所有被调查的小鼠肌肉。肌肉按其来自颅神经和脊髓节段的神经支配顺序显示,从顶部开始是由颅神经V (CN V)和VII (CN VII)支配的肌肉,其次是由颈脊髓产生的神经支配的肌肉,最后是由腰椎脊髓产生的神经支配的肌肉。提供神经支配所分析肌肉的脊髓节段在各自的横条旁边标明。颈椎、胸椎和腰椎上段脊髓神经支配的肌肉可见高水平的NMJ损失。这种模式表明,NMJ的病理始于脊髓的中心。n= 3在IC和n在所有其他肌肉中=4Smn2 b /−老鼠。误差柱表示平均值±SEM。E从头部肌肉开始,脊髓节段的位置与由所示脊髓节段产生的神经支配的肌肉的解剖位置之间的关系示意图。颜色仅供说明之用
运动神经元标记与量化
立即从最近牺牲的小鼠中解剖脊髓,并在4%多聚甲醛(PFA;电子显微镜科学)在PBS。将它们浸入30%蔗糖的PBS中48小时,然后嵌入50%最佳切割温度化合物(OCT)/15%蔗糖的PBS中。脊髓T5、T11、L5节段10 μM横切面。每收集十分之一节,用Nissl/ChAT标记。
切片在0.3% Triton X-100 PBS中渗透30分钟,在0.3% Triton X-100/4%牛血清白蛋白(BSA) PBS中封闭60分钟。切片在ChAT(山羊抗胆碱乙酰转移酶;默克密理博;1:100)一抗在4°C的封闭溶液中。将载玻片在0.2% Triton X-100 PBS中清洗,并在二抗(AlexaFluor 555 Donkey anti-Goat;生命技术;1:250)在室温下凝固2小时。切片用DAPI (Life Technologies;1:1000)和NeuroTrace®(Nissl;生命技术;1:100)和安装在Mowiol®(Calbiochem)。
运动神经元细胞体的总数通过荧光显微镜在20倍放大倍率下定量,使用徕卡倒置荧光显微镜,带过滤器,允许绿色(Nissl)和红色(ChAT)通道的分离和同时可视化(洋红色绿色显示的示例图像)。所有定量都对切片的基因型进行盲法。每十分之一节定量双侧脊髓腹角chat阳性运动神经元数量。由于切片工件而丢失的值使用小鼠:链式方程的多元归算[46R studio中的软件包。这些值假设为随机缺失(MAR),并使用预测平均匹配(PMM) imputation模型进行imputation。每个缺失的数据点预测出五个不同的值。这五个预测值的平均值作为最后的估算值,用于后续对脊髓各节段运动神经元细胞体总数的统计分析。大约12%的值是估算的。图像用徕卡DM8荧光显微镜在20倍放大下拍摄。
选择性脆弱性模式多模型比较的数据采集和分析
在一系列肌肉中神经肌肉连接病理学的数据来自先前发表的四种SMA小鼠模型的研究。详细介绍NMJ病理的研究Smn-/-; SMN22份(在此称为Smn-/-; SMN2) [14,24,25),SmnΔ7 /Δ7; SMN2又名台湾人[29),SMNΔ7[14,20.,28),Smn2 b / -[27使用小鼠模型。显示完全占用终板百分比的图表从研究中导出到Adobe Photoshop(21.2.0版本)。网格覆盖与每个图形的轴对齐,以便精确测量电机终板满用的平均百分比。
在获得数据后,将结果通过小鼠模型汇总,并根据肌肉在疾病终末期完全占据终板的百分比将其分配到七个分类类别。每个分类类别都被分配了不同的颜色(从绿色,代表突触损失最小的肌肉,到品红,代表大量NMJ损失的肌肉)来表示图形。前六类均包括终板全占比例在10%范围内的肌肉,形成100至41%全占终板的类别。最后一类包括在疾病终末期有40%或更少完全占据终板的所有肌肉。所有图形都是使用GraphPad Prism6创建的。
RNA-seq数据处理与分析
本研究重新分析和交叉比较了先前发表的三个RNA-seq数据集。原始数据Smn2 b / -小鼠及其对照是通过Kothary实验室的友好协议获得的[27]),而原始数据为SMN∆7小鼠及其对照从Gene Expression Omnibus (Hedlund实验室,GEO,登录号GSE115706;https://www.ncbi.nlm.nih.gov/geo/),并于[41].我们的分析比较了不同的脆弱运动神经元从颅核VIISmn2 b / -而且SMN∆7小鼠SMA模型。此外,我们将两种模型得到的CNVII与Smn2 b / -胸椎脊髓(tSC)。对两种模型的症状前时间点数据进行分析(P2 inSMN∆7;P10在Smn2 b / -).
从两组数据中读取的RNA-seq被映射到10毫米小鼠基因组组装。fastq的原始数据Smn2 b / -对数据集进行下采样,以在两个数据集的所有样本中实现相似的测序深度和映射比。使用DESeq2包对两个数据集进行差异基因表达分析(v. 1.30.1) [47].只有实验基因型与对照基因型之间存在log2倍变化差异,差异为1.5,且调整后的基因型差异为1.5p的价值p以≤0.05为分析标准。两种基因都有差异表达基因(DEGs)列表,Smn2 b / -而且SMN∆7得到数据集之间的DEG重叠。重叠的DEGs被丢弃,所有后续的分析都在剩下的DEGs上进行Smn2 b / -CNVII数据集。GO术语的过度表示分析Smn2 b / -DEGs使用clusterProfiler (v. 3.18.1)进行。为了可视化两个数据集样本之间GO术语相关基因的表达谱,使用了z从归一化基因计数中得到的分数被生成。为了检索蛋白质-蛋白质相互作用的网络,我们进行了STRING分析(https://string-db.org/, v. 11.5 [48])的所有degSmn2 b / -样本(使用433个基因作为输入),包括来自数据库和实验证据的相互作用,第一个壳的每个节点的相互作用最多为5个,相互作用得分为0.04的置信度中等。
结果
在Smn中,脊髓中心的突触损失水平较高2 b /−小鼠模型
尽管一些不同的脆弱肌肉已经在Smn2 b / -SMA小鼠模型[31,缺乏对肌肉进行全面的全身分析。因此,我们对位于全身20+肌肉的NMJ病理进行了广泛的分析Smn2 b /−疾病终末期小鼠(P16)。在我们的实验室中,这只小鼠显示出大约P10的运动表型,预期寿命约为18天。
通过定量分析免疫染色肌肉中完全神经支配、部分神经支配和空终板的百分比来分析NMJ病理Smn2 b / -和对照组小鼠P16(图;1A-C,见补充图1有关其他代表性图像)。NMJ病理评估来自不同身体区域的各种肌肉。分析包括两块头部肌肉(二腹肌后肌[DP]和咬肌[MA])、两块颈部肌肉(胸锁乳突肌[SCM]和胸舌骨肌[SH])、两块胸肌(肋间肌[IC]和胸三角肌[TS])、三块腹肌(外斜肌[EO]、腹直肌[RA]和腹横肌[TVA])、四块前肢肌肉(肱二头肌[BC]、三角肌[DE]、肱三头肌[TC]和桡侧腕屈肌[FCR])和八块后肢肌肉(股四头肌[QC]、股细肌[GR]、指长伸肌[EDL]、腓肠肌[GS]、比目鱼肌[SO]、胫骨前肌[TA]、头位于指2、3和4上的指短屈肌[FDB2、FDB3和FDB4]和后肢蚓肌[LU]。我们根据来自脊髓的神经支配水平对所有被研究的肌肉进行排序。1D, E)。对突触损失量的分析显示,颅肌NMJ损失水平较低,91.8%的完全神经支配终板保留(二腹肌后区[DP])。这与已经发表的工作是一致的Smn2 b / -其他头部肌肉上的小鼠在疾病终末期没有显示出可量化的去神经[26,27].颈肌(SCM和SH)和前肢肌(BC、DE、TC和FCR)受颈脊神经支配,NMJ损失较高,完全神经支配的终板水平低至29.3%(胸锁乳突肌[SCM])。受胸椎脊神经支配的肌肉,即胸肌(IC和TS)和腹肌(EO, RA和TVA)的脆弱性也有所增加。由上腰椎脊神经支配的腿部近端肌肉(GR和QC)也有类似数量的易损性,其中62%的终板(股四头肌[QC])仍然完全受神经支配。与近端后肢肌肉相反,受中下腰椎脊神经支配的远端后肢肌肉(TA、EDL、GS和SO)和足部肌肉(FDB2、3,4和LU)没有出现大量突触损失。84.8%(腓肠肌[GS])和98.9%(蚓神经[LU])的神经支配在这些区域保持完整。这些观察显示了一种脆弱模式,与核心、颈部和近端肢体肌肉的易感性增加一致,而远端肢体和面部肌肉的突触损失水平较低。1D, E)。
区域NMJ病理与脊髓运动神经元胞体丢失相关
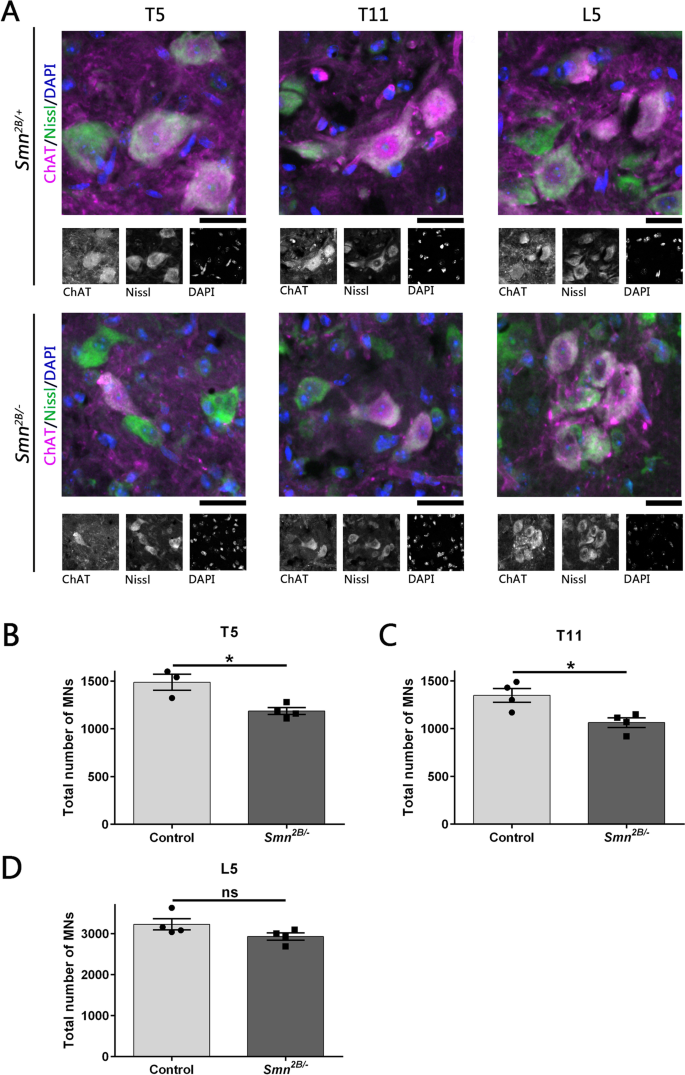
迄今为止的数据表明,由胸脊髓脊神经支配的肌肉比由下腰椎脊神经支配的肌肉更脆弱。接下来,我们研究了NMJ易损性的增加是否与相应的运动神经元损失相关。我们之前已经证明,运动神经元的损失可以检测到Smn2 b /−从P15开始的小鼠模型,在此之前NMJ损失[15].因此,我们在P16小鼠的T5、T11和L5脊髓节段中量化了整个腹角的运动神经元体(图2)。2).我们观察到T5和T11中有明显的运动神经元体缺失(p≤0.05)。L5运动神经元总数差异无统计学意义。这些结果表明,NMJ的损失与运动神经元体的损失有关,并进一步证明,与腰椎低水平相比,胸椎区运动神经元的易损性增加。
大鼠胸椎脊髓段可见明显的运动神经元丧失Smn2 b /−小鼠模型。一个具有代表性的图像显示运动神经元(MNs)标记抗胆碱乙酰转移酶(ChAT;品红色),以及Nissl(绿色)和DAPI(蓝色)染色Smn2 b /−而且Smn2 b / +对照组小鼠胸椎脊髓节段(T5和T11)和腰椎脊髓节段L5的P16。比例尺:50μm。B- - - - - -D柱状图显示脊髓T5, T11和L5节段腹角中定量的MNs总数Smn2 b /−与老鼠相比Smn2 b / +控制。中mn的总数显著减少Smn2 b /−与对照组的小鼠胸椎脊髓段进行比较。然而,腰椎节段的MNs总数无显著差异。未配对学生的tTest (ns= no significance, * .p≤0.05)。n=3,4为控制和Smn2 b /−小鼠分别在T5;n所有其他脊髓节段的两种基因型均为4。误差柱表示平均值±SEM
短信信息中明显的选择性脆弱性模式-/-SMN2,台湾,SMN∆7和SMN2 b /−小鼠模型
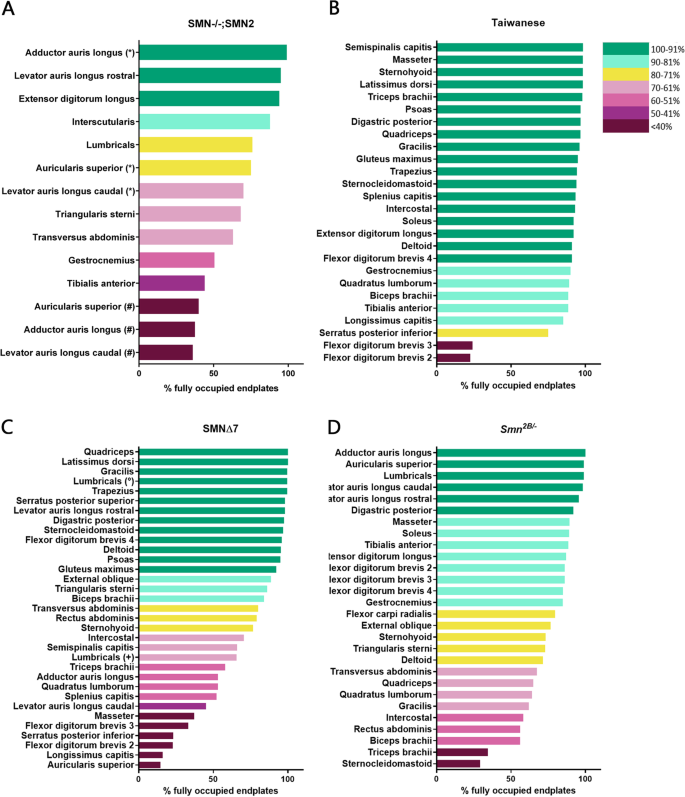
先前的研究利用一系列可用的小鼠模型对SMA小鼠模型中肌肉的相对脆弱性进行分类[14,20.,24,25,26,27,28,29].为了深入了解SMA小鼠模型中易感模式的一致性,我们比较了四种最常用的SMA小鼠模型中选择性脆弱肌肉的模式Smn-/-; SMN2,台湾,SMN∆7而且Smn2 b /−小鼠模型,辅以我们自己的分析Smn2 b / -小鼠模型(图;1),SMN∆7(补充图2) [14,20.,24,25,27,28,29].为了实现这一目标,我们开发了一个7点颜色编码的漏洞分类工具。根据神经完全支配的运动终板的百分比对肌肉进行分类,每种类型都被赋予了从深绿色到深品红的特定颜色,以代表10%的完全占据终板范围(见图中图例)。4).
我们发现,在小鼠模型中,肌肉似乎处于一个光谱上,显示出许多不同程度的脆弱性,而不是在相对脆弱性上显示出双峰分裂(图2)。3.).此外,在大多数模型中,相对脆弱性似乎存在类似的范围。在Smn-/-; SMN2小鼠模型,脆弱性等级范围为>耳长内收肌中99%终板仍充分占据[14]到提耳长肌尾带剩余36%的完全占据终板[25(图。3.A).神经支配终板的百分比SMNΔ7小鼠模型范围从四头肌的100% [20.到15%的上耳区(图;3.C、补充图2).在Smn2 b /−在小鼠模型中,神经支配范围从蚓状肌的99%到胸锁乳突肌的30%(图2)。3.D).在台湾小鼠模型中,易损性的变异性再次遵循类似的范围(头半棘肌神经支配98%,指短屈肌神经支配23% 2)[29];无花果。3.B).然而,值得注意的是,在这个模型中,大多数肌肉相对来说对突触损失具有抵抗力。这些发现表明,所有四种小鼠模型都表现出相似的NMJ损失范围,但台湾模型与其他三种小鼠模型相比,表现出较轻微的NMJ病理。
四种小鼠模型中NMJ损失的比较表明了相似的易损性范围。一个- - - - - -D柱状图显示在先前研究的肌肉中完全占据终板的百分比Smn-/-; SMN2[14,24,25];* = [14,24, # = [25],台湾[16,29),SMN∆7[14,16,20.,28];= (20.];+ = [28),Smn2 b / -[16,27]小鼠模型,分别。每只小鼠模型的肌肉都是按完全占据终板的百分比递减排列的。每块肌肉根据疾病终末期完全占据运动终板的百分比进行分类着色。四种小鼠模型中的每一种在NMJ损失百分比和脆弱性水平方面都表现出很大的可变性。请注意,在所有四种模型中,完全占据终板的百分比范围从几乎100%到仅约20-30%的最低值
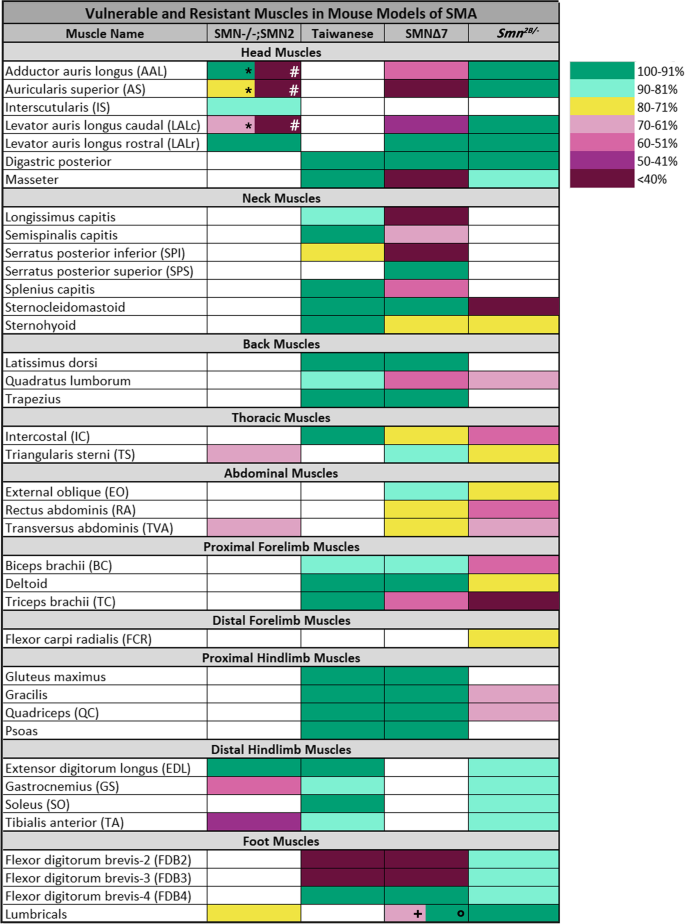
为了更好地理解小鼠模型的易损性模式的异同,我们使用我们的分析和可用的已发表数据来比较特定的肌肉(图2)。4).该表显示了所有先前调查的肌肉Smn-/-; SMN2,台湾,SMN∆7而且Smn2 b /−小鼠模型,按解剖身体区域分类。表中的每一块肌肉都以我们的分类工具所分配的类别的颜色显示,基于其剩余的完全占据的终板数量(图2)。4).
四种小鼠模型中NMJ损失的比较表明了不同的选择性脆弱性模式。颜色梯度图例根据疾病终末期肌肉中完全占据运动终板的百分比描述了NMJ病理的七个分类类别(详情请参阅“方法”部分)。表中显示了被调查的肌肉,根据它们的分类类别,根据完全占据终板的百分比Smn-/-; SMN2[14,24,25],台湾[16,29),SMN∆7[14,16,20.,28),Smn2 b / -[16,27]小鼠模型。该表显示了按身体区域(头部、颈部、背部等)分类的肌肉。请注意,对于某些肌肉,两项独立研究观察到了不同的结果。这发生在AAL, AS和LALc肌肉* = [14,24];# = [25在…里Smn-/-; SMN2模型和LU + = [28°= [20.在…里SMN∆7模型。在Smn-/-; SMN2在小鼠模型中,所有身体区域似乎都受到中度影响,并表现出不同的脆弱程度,其中后肢肌肉受影响最严重。台湾小鼠模型除了fdb2和fdb3外,显示出很少的脆弱性。的脆弱性模式SMN∆7小鼠模型显示,头部、颈部和足部肌肉受影响最大,其次是腹侧核心肌肉(胸腹肌),肢体和背部肌肉受影响最小。的Smn2 b /−小鼠模型表现出局部易损性模式,其中颈部肌肉、核心肌肉(胸腹肌肉)和前后肢近端似乎比头部肌肉、远端肢体和足部肌肉更容易受到影响
按身体区域分析这些数据显示,特定肌肉的脆弱性在小鼠模型之间有很大差异。首先,脆弱性的区域模式,其中核心和近端肢体肌肉的突触损失增加,这在Smn2 b /−老鼠,在其他三种型号中都没有出现。事实上,在台湾小鼠模型中,大多数肌肉显示出100 - 81%的完全神经支配终板。NMJ严重损失的唯一例外是足部肌肉的fdb2和fdb3。在Smn-/-; SMN2而且SMNΔ7在小鼠模型中,许多身体区域都包括脆弱肌肉和抵抗肌肉。在SMN∆7在小鼠模型中,这种脆弱的二分法在某些身体区域的频率特别突出,在颈部肌肉中尤其明显。三块肌肉非常脆弱,两块肌肉受到中度影响,而两块肌肉基本上不受病理影响。为了确认相对易损性的变化不是由于观察者效应,我们量化了肌肉的范围SMNΔ7而且Smn2 b / -(补充图3.).这证实了在小鼠模型中,如长耳、上耳、胸骨三角、腹外斜肌和腹直肌等肌肉中存在不同程度的病理。
这些模型之间的深刻差异可以在看一些模型中个体肌肉差异的例子时得到最好的强调。例如,AS, AAL和LALc,三个颅肌,严重影响SMNΔ7模型和Smn-/-; SMN2小鼠模型,但耐在Smn2 b / -小鼠模型。在台湾模型中,几乎所有的神经支配都保留在TC肌,而在SMN∆7模型中,57.9%的终板保持完全神经支配,仅34.4%的终板保留在Smn2 b /−小鼠模型。TA肌90%完全占据在SMN∆7而且Smn2 b / -小鼠模型中,但有44%是完全占据的Smn - / -; SMN2小鼠模型。在所有模型中,IC肌肉的表现也不同,其中约55%和70%的NMJ仍受神经支配Smn2 b /−模型和SMN∆7在台湾模型中几乎没有突触损失。
为了探索可能影响相对易损性的其他因素,肌肉根据其快速突触(FaSyn)和延迟突触(DeSyn)表型或肌肉纤维类型进行分组(补充图)4).这表明在四个分析模型中都没有相关性。
这些发现表明,在常用的SMA小鼠模型中,选择性脆弱性模式的比较揭示了四种不同的选择性脆弱性模式。这一发现在小鼠模型之间的脆弱性模式的深刻差异在实验设计中是非常重要的。它也可以作为一种工具,更好地理解在不同的SMA小鼠模型中驱动选择性脆弱性的机制。需要进一步的工作来揭示这些疾病小鼠模型中NMJ和运动神经元易损性的机制。
对差异脆弱运动神经元的转录分析揭示了可能有助于运动神经元保护的转录组
为了研究可能导致选择性易损性对比模式的分子差异,我们对差异易损性运动神经元进行了跨模型转录分析。我们专注于面部运动神经元,因为它们的神经支配在大脑中大部分保持完整Smn2 b /−模型,而在SMNΔ7>40%的神经支配丧失(图;4).因此,我们推断在面部运动神经元中发生的独特的转录变化Smn2 b / -老鼠可以提供保护。
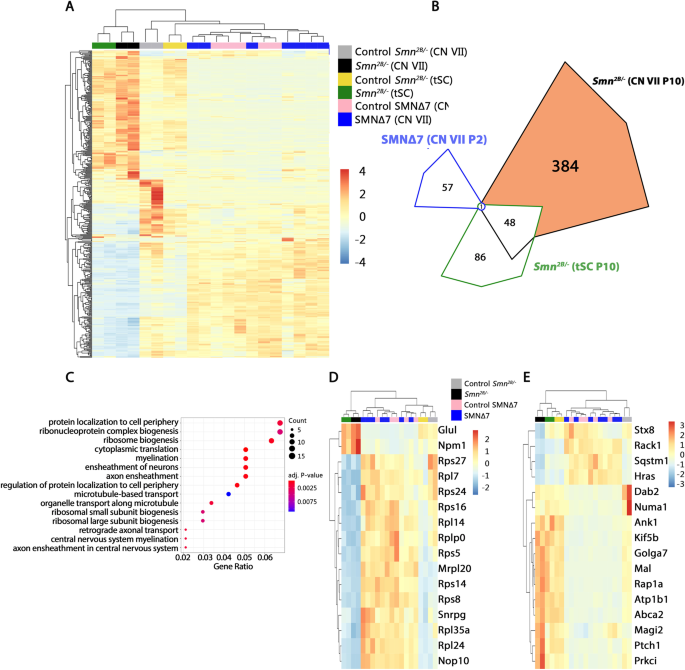
在之前的研究中,我们分别对面部运动神经元进行了转录分析Smn2 b / -小鼠atP10或SMNΔ7在P2, P5和P10的小鼠中进行比较[27,41].在这里,我们交叉比较了症状前可比较的时间点的数据集(P10在临床Smn2 b / -和P2SMN∆7小鼠模型),并编制了耐药CNVII运动神经元中的deg列表Smn2 b / -模型(无花果。5一个)。
转录分析显示与rRNA加工、囊泡运输和神经元发育相关的基因富集。一个CNVII中运动神经元间433个deg的表达热图Smn2 b / -.胸椎脊髓的相对表达水平Smn2 b / -CNVII在SMN∆7并将其与各自的控件进行了比较。表达式值归一化并以均值为中心。B维恩图显示了在所有三个运动神经元组中重叠识别的deg的数量。基因本体分析仅在CNVII运动神经元中发现的变化Smn2 b / -小鼠(384个DEGs)。CCNVII中384个差异表达基因生物学功能的基因本体(GO)术语分析Smn2 b / -与对照组小鼠的CNVII进行比较。图中圆点的大小反映了GO术语中包含的基因的数量。圆点的颜色表示调整后的重要性p价值。具有分层聚类的热图DGO术语“核糖核蛋白复合物生物发生”中包含的16个基因;E与GO术语集群相关的16个基因“蛋白质定位到细胞外围”。在两个热图中,Z分数是计算和绘制的,而不仅仅是规范化的表达式值。注意,在两个热图中Smn2 b / -CNVII与对照组相比,样本发生了变化,而两者之间没有差异SMN∆7以及他们的控制
利用耐药CNVII的deg进行了层次聚类Smn2 b / -模型显示,在这个模型和SMNΔ7模型(无花果。5一个)。
然后,我们编译了384个deg组,这些deg是唯一的Smn2 b / -CNVII数据集,通过删除任何转录本,也改变了Smn2 b / -脆弱的tSC运动神经元(48个转录本)或SMNΔ7CNVII运动神经元(1个转录本)与各自的对照组相比(图。5B).解释失调的生物过程Smn2 b / -面部运动神经元,我们使用了384个独特的deg,并进行了基因本体(GO)术语富集分析(图2)。5A)。我们确定了许多GO术语,包括“蛋白质定位到细胞外围”[GO:1904375]和“核糖核蛋白复合物生物发生”[GO:0022613](图2)。5D, E)。“核糖核蛋白复合物生物发生”GO术语集群包括16个转录本,并有一个调整p的价值p= 0.004。在这里,基因与细胞信号、rRNA加工和成熟以及核糖体成分和生物发生相关(图。5D). GO术语集群“蛋白质定位到细胞外围”包括16个差异表达的转录本,并有一个调整p的价值p= 0.002。该簇中的基因与囊泡运输、微管动力学和神经元发育相关(图2)。5E)。
为了可视化这些网络和其他异常转录本之间的相互作用,我们使用STRING数据库从所有的DEGs中检索蛋白质-蛋白质相互作用的网络Smn2 b / -CNVIII样品P10(图;6).核糖体蛋白来自小亚基(石头剪刀蛋白质)和大亚基(Rpl蛋白质)形成密集的网络,与GO项分析一致。这个网络中的大多数基因有助于核糖体的生物发生,包括Rps5, Rps16, Rpl24而且Rps14.其他基因比如Rps27, Rps24而且Snrpg有助于前rRNA和rRNA的加工和成熟。在囊泡运输中起作用的deg中,我们发现了对神经元发育和神经突生长很重要的基因(Magi2, Kif5b而且Rap1a)和微管动力学(Numa1, Kif5b而且Prkci).此外,网络也包括Sqstm1这与额颞叶痴呆和肌萎缩性侧索硬化症有关。最后,Snrpg作为SMN剪接体组装的组成部分,在RNA剪接中起作用。总之,我们确定了几个在面部运动神经元中被特异性激活的转录程序Smn2 b / -动物和可能有助于保护运动神经元在这个模型。
讨论
本研究的发现为SMA小鼠模型的选择性脆弱性模式提供了新的见解,并揭示了可能有助于运动神经元保护的转录本组。在这项研究中,我们进行了全面的全身分析的选择性脆弱性模式,目前在Smn2 b / -在疾病终末期的小鼠模型和显示Smn2 b / -模型表现出NMJ损失的区域格局。比较四种SMA小鼠模型的脆弱性模式,揭示了模型之间选择性脆弱性模式的巨大差异。最后,我们发现与核糖体生物能学、囊泡运输和神经元发育相关的转录本的增加与保护运动神经元不变性相关。
四种最常用的SMA小鼠模型中差异易损性的影响因素
神经肌肉病理学Smn2 b / -小鼠模型表现出独特的区域脆弱性模式。这种区域易损性模式是先前在SMA患者中记录的一个特征,患者表现为核心肌肉、腿部近端和手臂近端肌肉的易损性增加和早期无力[21,22,23].由面神经支配的肌肉和下肢远端有一个共同的保留。我们还观察到,与远端肢体相比,近端肢体的脆弱性增加,在患者中观察到核心和颈部肌肉的脆弱性增加[21,22].患者脆弱性模式的综合研究将变得越来越相关,特别是如果我们看到相对脆弱性与治疗疗效之间的预测相关性[34].从解剖材料中阐明选择性脆弱性的模式不是最佳的,因为运动神经元损失的时间顺序无法被识别。由于临床干预和护理,人类尸检材料往往反映出比小鼠在“终末期”更晚的疾病阶段,这可能是患者运动神经元损失比小鼠更严重的原因之一。无论如何,根据目前可用的数据,SMA患者脆弱性的区域模式与疾病之间的相关性Smn2 b / -小鼠模型是有趣的,并可能支持使用该小鼠模型在鉴定潜在临床相关性的保护性疾病修饰剂。
神经突触损失的分析Smn2 b / -本文所建立的小鼠模型显示颈神经、胸椎神经和上腰椎脊神经支配的肌肉比颅神经和下腰椎脊神经支配的肌肉更脆弱。这一身体区域选择性脆弱的原因尚不清楚。虽然运动单元类型已被证明是ALS选择性脆弱性的关键调节因素[49,50],这里的纤维类型与相对易损性之间没有相关性,这与之前的研究一致SMN∆7小鼠模型[20.].事实上,在四种小鼠模型中,肌肉纤维类型与相对脆弱性无关。此外,还有人认为,非mjs在发展和稳定方面的细分是选择性脆弱性的一个促成因素[14,51].根据肌肉获得成熟NMJs组织的速度的内在不同特征,可以将肌肉细分为快速突触(FaSyn)和延迟突触(DeSyn)肌肉[51].在SMA小鼠模型的头部肌肉中,FaSyn肌肉比DeSyn肌肉更脆弱[14].我们的研究排除了肌肉纤维类型或突触率作为运动神经元脆弱性的关键因素。这与之前发表的数据是一致的SMN∆7小鼠模型,其中一些FaSyn肌肉也被鉴定为抵抗病理[20.].最后,有人提出,脊髓内运动神经元的位置可能决定了它们在SMA中的易损性,其中位于内侧的,支配轴向和近端肢体肌肉的运动神经元比位于内侧的,支配远端肢体肌肉的运动神经元更脆弱[52,53].为了支持这一点,在SMNΔ7模型中,L1(支配腿近端神经)的感觉运动障碍程度高于L5(腿远端神经)[52].运动神经元大小的分析SMNΔ7与前肢远端和膈肌运动神经元相比,小鼠前肢近端运动神经元也有选择性萎缩[53].目前的研究表明,类似的模式也存在于Smn2 b / -模型中,肌肉易损性在轴向肌、前肢近端肌和后肢近端肌最为明显。尽管这种模式在其他小鼠的SMA模型中没有得到证实,但在肌肉位置和相对易损性之间似乎有一种有趣的相关性Smn2 b / -SMA小鼠模型和SMA患者。通常认为近端运动单位比最远端运动单位大。因此,人们很容易推测,增加的电机单元尺寸会导致脆弱性。这一观点在之前的一项关于选择性脆弱性的研究中被忽视了Smn-/-; SMN2小鼠模型[25].然而,由于运动单元大小与相对易损性之间的相关性仅在少数肌肉上进行,这些肌肉都具有相对较小的运动单元,并且不包括任何轴向或近端肢体肌肉,因此应该重新考虑这一观点。
SMA小鼠模型之间易损模式的显著差异
我们比较了四种最常用的SMA小鼠模型的NMJ病理,并表明每个模型都显示出不同的选择性脆弱性模式。这与之前的一篇报道一致,该报道比较了三种小鼠模型中胫骨前肌(TA)和腰方肌(QL)中的NMJ病理[16].虽然TA始终不那么脆弱,但QL的去神经水平在模型之间从0到55%不等。所有被研究的小鼠模型都有一个共同的突变Smn模拟人类疾病表型的基因[31,54,55,56].尽管它们在同一基因中有共同的突变,但在不同模型之间观察到的肌肉脆弱模式之间存在巨大差异,其原因尚不清楚。因此,比较这些不同的SMA小鼠模型及其选择性脆弱性的不同模式,为进一步了解驱动SMA运动神经元病理的机制提供了宝贵的机会。虽然小鼠品系在这些模型之间确实有所不同,但它不能解释差异的全部程度。事实上,台湾模式与中国模式有着相同的背景Smn-/-; SMN2而且SMNΔ7但它们的NMJ损失模式却截然不同。这与先前的报道一致,即小鼠品系的差异不能解释在小鼠模型之间观察到的表型严重程度或运动神经元损失程度的差异[16].一种可能的解释是相对的Smn水平,台湾人的Smn水平高于美国人SMNΔ7模型。但是,由于Smn水平之间是相似的Smn2 b / -和台湾小鼠,这不能完全解释差异,需要进一步的工作来辨别为什么运动神经元病理在该小鼠模型中不那么严重。
先前的工作已经确定了SMA小鼠模型之间的重要差异。在台湾小鼠模型中,运动神经元损失相对较轻,这与我们的研究结果一致(图2)。3.而且4) [16,25].先前已经注意到模型之间的其他差异,包括脊髓的选择性脆弱区域和P53通路激活[16].目前的工作支持了模型之间的这些重要差异,并强调了考虑所选模型和实验设计对结论的影响的必要性。
在可能的解释,以说明在不同的模式的脆弱性Smn2 b / -与其他模型相比,小鼠是产后年龄。以前的研究表明,出生后的年龄会影响轴突变性的途径,不同的肌肉成熟的速度也不同[44,45,57].在出生后的第一个月,神经肌肉系统经历了与出生后成熟相关的动态分子和结构变化,包括发育突触的消除和剩余连接的巩固和成熟。在此期间,创伤性或缺氧损伤后突触变性的速度加快[44,45].损伤后的退化加速归因于出生后线粒体的变化,在出生后第一个月,线粒体在肌肉和外周轴突中逐渐富集[57,58].有趣的是,生物能量状态也被认为是SMA小鼠模型中选择性脆弱性的调节因子[40].神经组织动力学的发育调控可能在不同脆弱性模式的形成中起重要作用。如果我们考虑这些多重发展过程规则,再加上所有模型都有不同的发病年龄,它们就提出了一个可能的假设,即为什么选择性脆弱性的模式在模型之间差异如此之大。研究来自不同SMA小鼠模型的不同运动单元的突触、轴突和细胞体中的线粒体是如何变化的,可能会揭示SMA小鼠模型之间脆弱性模式差异的原因。
运动神经元保护的潜在重要分子途径
通过对运动神经元易损性进行跨模型转录分析,我们发现某些组转录本是候选保护性修饰物。我们的分析揭示了与GO术语“核糖核蛋白复合物生物发生”相关的转录本的富集。该簇中的转录本作为小亚基和大亚基核糖体蛋白质的一部分,有助于核糖体的生物发生,以及前rna和rRNA的加工和成熟,以及翻译装置的调节。由于SMN及其相关蛋白在mrna前剪接和翻译调节中都有牵连[59,60,61,62],这很容易让人推测,这些通路调节的变化可以解释为什么这部分神经元对SMN水平的降低更有抵抗力。为了进一步研究这方面,转录组学应该与蛋白质组学相结合,以描述蛋白平衡的变化,这些变化可能抵消SMN丢失的不利影响。
我们还证明了与GO术语“蛋白质定位到细胞外围”相关的转录本的富集。该簇中的转录本有助于与囊泡运输、微管动力学和神经元发育有关的细胞通路。Rap1a, Prkci, magii, Hras,Numa1都是拉而且Rap1信号通路。Ras信号通路将信号从细胞外环境转导到细胞核,激活细胞生长、分裂和分化的特定基因。的Rap1信号通路控制细胞过程,如细胞迁移,细胞增殖和细胞存活。magic2, Kif5b, Sqstm1而且Rap1a与神经元发育和神经突生长相关,其中一些先前已涉及神经退行性疾病的发病机制。例如,Kif5b是参与顺行轴突运输的一种轴突运动蛋白。它是各种神经退行性疾病信号通路的一部分,包括亨廷顿氏病、帕金森病和渐冻症。驱动蛋白家族的另一成员(Kif5a)导致肌萎缩性侧索硬化症发病机制中的细胞骨架缺陷[63].研究还表明,与渐冻症小鼠模型相关的基因突变会干扰运动蛋白成员,并促进轴突运输缺陷,最终导致运动神经元死亡[64].我们建议Kif5b和其他运动蛋白成员也有可能有助于其他运动神经元疾病的发病机制,如SMA。此外,如上所述,其中一些转录本对轴突功能很重要。由于SMN在轴突中具有关键功能,而SMA是一种轴突病,因此可以调节其中几个基因作为SMN缺失的补偿以维持轴突功能[65,66,67,68,69].
我们分析的另一组丰富的文本是Sqstm1.Sqstm1进一步与线粒体自噬有关,通过自噬过程去除受损的线粒体。的Sqstm1基因编码p62,基因突变Sqstm1这种基因在渐冻症和相关的额颞叶痴呆中都有报道。p62的缺乏与复合物I线粒体呼吸受到抑制有关,这是由于电子传递链的缺陷[70].在动物模型中沉默或敲除p62可导致线粒体功能障碍[71,72,73].综上所述,这些发现表明Sqstm1基因与能量代谢的病理生理事件密切相关。由于生物能量学状态先前被发现与运动神经元脆弱性有关[40],我们建议提高Sqstm1可能是SMA运动神经元病理的保护性修饰剂。在体内增加Sqstm1和其他潜在修饰剂的表达将进一步了解它们的神经保护特性。
结论
综上所述,上述数据代表了对四种SMA小鼠模型的选择性脆弱性模式的详细分析。选择性脆弱性模式在所有4种小鼠模型中都不同,区域模式在Smn2 b / -显示出与SMA患者区域模式相似的小鼠。基于这些发现,我们确定了运动神经元的群体是不同的脆弱Smn2 b / -而且SMN∆7小鼠SMA模型。我们发现,已知在缺陷运动神经元中被扰动的与细胞功能相关的转录本,如RNA加工、轴突运输和生物能状态,在选择性抗性神经元中受到不同的调控。这些新颖的见解揭示了有希望的靶点,在脊髓性肌萎缩的运动神经元保护的背景下进行进一步研究将是有趣的。
数据和材料的可用性
的SMN∆7支持本文结论的小鼠模型RNA-seq数据集可在Gene Expression Omnibus (GEO,登录号GSE115706)中获得。的Smn2 b / -支持本文结论的小鼠模型RNA-seq数据集可根据合理要求从通信作者(LMM)获得。
缩写
- 肌萎缩性侧索硬化症:
-
肌萎缩性侧索硬化症
- AAL:
-
耳长内收肌
- 为:
-
耳上
- 公元前:
-
肱二头肌
- BTX:
-
α金环蛇毒素
- CN七:
-
颅神经第七核
- 德:
-
三角肌
- DeSyn:
-
延迟突触
- 度:
-
差异表达基因
- DP:
-
二腹肌后
- 联盟:
-
指长伸肌
- EO:
-
外斜
- FaSyn:
-
快突触
- 货代:
-
桡侧腕屈肌
- 身上:
-
指短屈肌
- 走:
-
基因本体论
- 格:
-
股薄肌
- g:
-
腓肠肌
- 集成电路:
-
肋间的
- LALc:
-
尾长耳提肌
- LALr:
-
提耳长吻侧肌
- 鲁侍萍
-
蚓状肌
- 马:
-
咬肌
- 米歇尔。内格罗蓬特:
-
运动神经元
- 尼克-弗瑞:
-
神经丝
- NMJ:
-
神经肌肉接头
- 质量控制:
-
股四头肌
- 类风湿性关节炎:
-
腹直肌
- 供应链管理:
-
胸锁乳突肌
- 承宪:
-
胸骨舌骨的
- SMA:
-
脊髓性肌萎缩
- SMN:
-
生存运动神经元蛋白
- SMN1:
-
生存运动神经元1基因
- 所以:
-
比目鱼肌
- 助教:
-
胫骨前
- TC:
-
三头肌brachii
- TS:
-
Triangularis sterni
- 流域的开发:
-
腹横
参考文献
列斐伏尔S, Bürglen L,雷波列S,克莱蒙特O,波列P,维奥列L,等。脊髓肌萎缩决定基因的鉴定和特征。细胞。1995;80:155 - 65。
罗德里格斯NR,欧文N,塔尔博特K,伊格内修斯J,杜博维茨V,戴维斯KE。常染色体隐性脊髓性肌萎缩症患者5q13存活运动神经元基因缺失。Hum Mol Genet, 1995; 4:631-4。
Monani你。脊髓性肌肉萎缩:缺乏一种普遍存在的蛋白质;一种运动神经元特异性疾病神经元。2005;48:885 - 95。
Velasco E, Valero C, Valero A, Moreno F, Hernández-Chico C.西班牙脊髓性肌萎缩症(SMA)家族中SMN和NAIP基因的分子分析及cBCD541拷贝数与SMA表型的相关性。胡姆·摩尔·热内。1996;5:257-63。
McAndrew PE, Parsons DW, Simard LR, Rochette C, Ray PN, Mendell JR,等。通过分析SMNT和SMNC基因拷贝数来鉴定近端脊髓性肌萎缩症携带者和患者。胡姆·热内。1997;60:1411-22。
霍伊SM。Nusinersen对5q脊髓性肌萎缩的研究进展。CNS药物。2018;32:689-96。
帕塔利瑞,牟勇,李晓杰。AAV9载体:脊髓性肌萎缩基因治疗的新模式。Gene Ther, 2019; 26:287-95。
Dhillon S. Risdiplam:第一次批准。药。2020;80:1853-8。
李志强,李志强,陈建平,等。Risdiplam是一种选择性存活的运动神经元-2 (SMN2)基因剪接修饰剂,用于治疗脊髓性肌萎缩(SMA)。中华医学杂志2018;61:6501-17。
芬克尔RS, Chiriboga CA, Vajsar J, Day JW, Montes J, Vivo DCD,等。nusinersen治疗婴儿起病性脊髓性肌萎缩:一项2期、开放标签、剂量递增研究《柳叶刀》杂志。2016;388:3017-26。
Pechmann A, Langer T, Schorling D, Stein S, Vogt S, Schara U,等。德国扩大准入计划中接受nusinersen治疗的1型SMA儿童的评估神经肌肉杂志2018;5:135-43。
Strauss KA, Farrar MA, Muntoni F, Saito K, Mendell JR, Servais L,等。Onasemnogene abparvovec用于有2份SMN2拷贝的有脊髓性肌萎缩1型风险的症状前婴儿:III期SPR1NT试验2022; 28:1-9。
陈志伟,陈志伟,陈志伟,等。反义寡核苷酸nusinersen治疗脊髓性肌萎缩。Orthop Rev. 2021;13:24934。
穆雷LM,康利LH,汤姆森D,帕金森N,塔尔博特K,吉灵沃特TH。脊髓性肌萎缩小鼠模型中神经肌肉交界处运动神经元的选择性脆弱和突触前和突触后病理的解离。Hum Mol Genet, 2008; 17:949-62。
考特尼NL,鼹鼠AJ,汤姆逊AK,默里LM。在脊髓性肌萎缩的小鼠模型中,降低P53水平可以改善神经肌肉连接损失而不影响运动神经元病理。细胞死亡,2019;10:515。
Buettner JM, Sime Longang JK, Gerstner F, Apel KS, Blanco-Redondo B, Sowoidnich L,等。中枢突触病是脊髓性肌萎缩小鼠模型中最保守的运动回路病理特征。iScience。2021; 24:103376。
李志刚,李志刚,李志刚,李志刚,等。减少的SMN蛋白损害脊髓性肌萎缩小鼠模型中神经肌肉连接的成熟。Hum Mol Genet, 2008; 17:2552-69。
孔琳,王旭,崔dw, Polley M, Burnett BG, Bosch-Marcé M,等。脊髓性肌萎缩小鼠突触囊泡释放受损和神经肌肉连接不成熟。神经科学杂志2009;29:842-51。
达克斯,M赫鲁,L彼德罗菲塔,A卡萨诺瓦,Calderó J,埃斯克达JE。严重脊髓性肌萎缩小鼠神经肌肉连接组织缺陷和出生后肌生成。中华神经病学杂志,2011;30(4):344 - 344。
凌家凯,吉布斯RM,冯志,高志平。脊髓性肌萎缩小鼠模型中临床相关肌肉的严重神经肌肉失神经。Hum Mol Genet, 2012; 21:185-95。
Dubowitz V.非常严重的脊髓性肌肉萎缩(SMA 0型):一种扩大的临床表型。中华儿科神经杂志1999;3:49-51。
Wadman RI, Wijngaarde CA, Stam M, Bartels B, Otto LA, Lemmink HH,等。在180例脊髓性肌萎缩1c-4型患者的横断面队列中,肌肉力量和运动功能贯穿一生。中华神经病学杂志,2018;25:12 - 8。
Deymeer F, Serdaroglu P, Parman Y, Poda M. SMA IIIb的自然史:肌肉力量以可预测的顺序和幅度下降。神经学。2008;71:644-9。
穆雷LM,李S, Bäumer D, Parson SH, Talbot K, Gillingwater TH。严重脊髓性肌萎缩小鼠模型中较低运动神经元连通性的症状前发展。Hum Mol Genet, 2010; 19:420-33。
汤姆逊SR, Nahon JE, Mutsaers CA,汤姆逊D, Hamilton G, Parson SH,等。运动神经元的形态特征并不能决定它们在严重脊髓性肌萎缩的小鼠模型中对变性的相对易感性。PLoS ONE。2012; 7: e52605。
穆瑞敏,李志强,李志强,等。Smn(2B/-)脊髓性肌萎缩小鼠模型中神经肌肉连接处重塑缺陷的研究。神经生物学杂志,2013;49:57-67。
穆雷LM, Beauvais A, Gibeault S, Courtney NL, Kothary R.脊髓性肌萎缩(Smn (2b/-))小鼠模型症状前阶段差异脆弱运动神经元转录谱。神经病理学报2015;3:55。
Comley LH, Nijssen J, Frost-Nylen J, Hedlund E.肌萎缩性侧索硬化症和脊髓性肌萎缩症的跨疾病比较显示选择性易损保守,但神经肌肉连接病理学差异。中华神经外科杂志,2016;
林天龙,陈天华,徐艳艳,程艳华,庄伯涛,钟永杰。morpholino反义寡核苷酸可逆转台湾重度SMA小鼠的选择性神经肌肉去神经。公共科学图书馆综合[互联网]。2016;[引2019年11月27日];可以从:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4849667/.
Hammond SM, Gogliotti RG, Rao V, Beauvais A, Kothary R, DiDonato CJ。模拟SMN2剪接的小鼠生存运动神经元等位基因,在发育早期可诱导挽救胚胎致死率,但不晚于发育。PLOS ONE。公共图书馆。科学。2010;5:e15887。
Bowerman M, Murray LM, Beauvais A, Pinheiro B, Kothary R.小鼠中关键的smn阈值决定了与独特的神经肌肉连接病理学相关的中间性脊髓性肌萎缩表型的发生。神经肌肉失调NMD。2012; 22:263 - 76。
刘志强,李志强,李志强,等。遗传背景对脊髓性肌萎缩症小鼠模型表型的影响。Hum Mol Genet. 2016; 25:4494-506。
郭文华,李志强,李志强,李志强。时间是运动神经元的治疗窗口及其与脊髓性肌萎缩的关系。《Mol神经生物学》2018;55:6307-18。
Comley LH, Kline RA, Thomson AK, Woschitz V, Landeros EV, Osman EY,等。小鼠脊髓性肌萎缩模型Smn修复后的运动单位恢复。Hum Mol Genet. 2022;12:ddac097。
李志强,李志强,李志强,等。nusinersen治疗症状性脊髓性肌萎缩的儿童运动单位改变。中华神经外科杂志,2020;
Hedlund E, Karlsson M, Osborn T, Ludwig W, Isacson O.不同脆弱性的体细胞运动神经元群体的整体基因表达谱识别退化和保护的分子和途径。大脑。2010;133:2313-30。
张志刚,李志刚,李志刚,等。解开神经退行性变的选择性易感性之谜:ALS中抵抗退行性变的运动神经元显示出独特的基因表达特征,并降低对兴奋性毒性的易感性。神经病理学报(Berl)。2013; 125:95 - 109。
Kaplan A, Spiller KJ, Towne C, Kanning KC, Choe GT, Geber A,等。神经元基质金属蛋白酶-9是选择性神经退行性变的决定因素。神经元。2014;81:333-48。
Nizzardo M, Taiana M, Rizzo F, Aguila Benitez J, Nijssen J, Allodi I,等。Synaptotagmin 13在运动神经元疾病中具有神经保护作用。神经病理学报(Berl)。2020; 139:837-53。
Boyd PJ, Tu W-Y, Shorrock HK, Groen EJN, Carter RN, Powis RA,等。生物能量状态调节脊髓性肌萎缩斑马鱼模型中运动神经元易损性和发病机制。PLOS Genet, 2017;13:e1006744。
Nichterwitz S, Nijssen J, Storvall H, Schweingruber C, Comley LH, Allodi I,等。llc -seq揭示了抵抗神经元的独特转录适应机制,并确定了脊髓性肌萎缩的保护途径。基因组Res. 2020;[引2021年5月17日];可以从:https://genome.cshlp.org/content/early/2020/08/12/gr.265017.120.
Kline RA, Kaifer KA, Osman EY, Carella F, Tiberi A, Ross J,等。对不同脆弱运动神经元的独立筛选的比较揭示α -突触核蛋白是运动神经元疾病的常见修饰因子。PLoS Genet, 2017;13:e1006680。
Villalón E, Kline RA, Smith CE, Lorson ZC, Osman EY, O 'Day S,等。aav9 - statthmin1基因的传递改善了脊髓性肌萎缩中间小鼠模型的疾病表型。Hum Mol Genet, 2019; 28:3742-54。
Murray LM, Comley LH, Gillingwater TH, Parson SH.神经肌肉连接对损伤的反应是发育调节的。王晓明,2011;25:1306-13。
Mole AJ, Bell S, Thomson AK, Dissanayake KN, Ribchester RR, Murray LM。神经损伤后的突触退缩受小鼠出生后成熟度、肌肉特异性特性和潜在病理的影响。J阿纳特,2020;[引2020年6月15日];n/a。可以从:https://onlinelibrary.wiley.com/doi/abs/10.1111/joa.13187.
王志刚,王志刚,王志刚。基于链式方程的多变量归一化方法研究。中国科学(自然科学版),2011;
Love MI, Huber W, Anders S.用DESeq2调节RNA-seq数据的折叠变化和分散估计。基因组生物学,2014;15:550。
许志强,李志强,李志强,等。2017年的STRING数据库:质量控制的蛋白质-蛋白质关联网络,广泛可访问。核酸研究,2017;45:D362-8。
潘淑娟,王志强,王志强,王志强,等。CNTF对运动神经元疾病的选择性脆弱和剪枝的影响。神经科学。2006;9:408-19。
张志刚,张志刚,张志刚。肌萎缩性侧索硬化症患者运动神经元易损性及抵抗的研究进展。神经病理学报(Berl)。2017; 133:863 - 85。
Pun S, Sigrist M, Santos AF, Ruegg MA, Sanes JR, Jessell TM,等。不同骨骼肌中神经肌肉连接处组装和维持的内在区别。神经元。爱思唯尔。2002;34:357 - 70。
刘伟,李志刚,刘志刚,李志刚,等。脊髓性肌萎缩小鼠模型中感觉-运动连接的早期功能障碍。神经元。2011;69:453 - 67。
d 'Errico P, Boido M, Piras A, Valsecchi V, De Amicis E, Locatelli d,等。delta7 SMA小鼠脊髓和皮层运动神经元亚群的选择性易损性。PLoS ONE。2013;8.[引2019年9月9日];可以从:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3855775/.
谢丽敏,张建国,钟永杰,吴明华,王宁,蔡超,等。脊髓性肌萎缩的小鼠模型。Nat Genet, 2000; 24:66-70。
Monani UR, Sendtner M, Coovert DD, Parsons DW, Andreassi C, Le TT,等。人类着丝点存活运动神经元基因(SMN2)挽救了Smn - / -小鼠的胚胎致命性,并导致小鼠脊髓性肌萎缩。Hum Mol Genet, 2000;9:33 - 9。
张海林,李志强,张志强,李志强,等。SMNΔ7是着丝粒存活运动神经元(SMN2)基因的主要产物,可延长脊髓性肌萎缩小鼠的存活时间,并与全长SMN有关。胡姆·摩尔·热内。2005;14:845-57。
Kline RA, Dissanayake KN, Hurtado ML, Martínez NW, Ahl A, Mole AJ,等。线粒体生物能学的改变是导致新生小鼠沃勒氏变性延迟的原因。神经生物学杂志2019;130:104496。
杨淑娟,杨志刚,杨志刚,王志刚。肌肉线粒体网蛋白质组成与发育过程的关系。中国生物医学工程学报。2019;57:27 07 - 27。
Lauria F, Bernabò P, Tebaldi T, Groen EJN, Perenthaler E, Maniscalco F,等。smn引物核糖体调节脊髓性肌萎缩相关转录物的翻译。中国生物医学工程学报。2020;22:1239-51。
Sanchez G, Dury AY, Murray LM, Biondi O, Tadesse H, El Fatimy R,等。生存运动神经元蛋白作为翻译调节因子的新功能。Hum Mol Genet, 2013; 22:668-84。
Martinez-Salas E, Embarc-Buh A, Francisco-Velilla R. Gemin5的新兴角色:从snRNPs组装到翻译控制。国际分子生物学杂志2020;21:E3868。
Singh RN, Howell MD, Ottesen EW, Singh NN。生存运动神经元蛋白的多种作用。中国生物工程学报,2017;19(2):366 - 366。
李志强,李志强,李志强,等。全基因组分析确定KIF5A是一种新的ALS基因。神经元。2018;97:1268 - 1283. - e6。
石萍,Ström A-L, Gal J,朱华。als相关SOD1突变体对dynein和kif5介导的轴突逆行和顺行转运的影响。生物化学学报,2010;18(2):529 - 529。
Fallini C, Bassell GJ, Rossoll W.脊髓性肌萎缩:SMN在轴突mRNA调节中的作用。Brain res 2012; 1462:81-92。
Fallini C, Zhang H, Su Y, Silani V, Singer RH, Rossoll W,等。运动神经元(SMN)存活蛋白与mRNA结合蛋白HuD相互作用,并调节poly(A) mRNA在初级运动神经元轴突中的定位。中华神经科学杂志,2011;
唐晓燕,孙晓燕,孙晓燕,孙晓燕,等。Smn和hnRNP R在小鼠运动神经元轴突末端的突触前定位。PLOS ONE。公共图书馆。科学。2014;9:e110846。
Pletto D, Capra S, Finardi A, Colciaghi F, Nobili P, Battaglia GS,等。原代海马培养中a-SMN和FL-SMN沉默后轴突生长和神经元分化缺陷。PLOS ONE。公共图书馆。科学。2018;13:e0199105。
Pagliardini S, Giavazzi A, Setola V, Lizier C, Di Luca M, DeBiasi S,等。发育中的大鼠脊髓中存活运动神经元(SMN)蛋白的亚细胞定位和轴突转运。Hum Mol Genet, 2000; 9:47-56。
Bartolome F, Esteras N, Martin-Requero A, Boutoleau-Bretonniere C, Vercelletto M, Gabelle A,等。致病性p62/SQSTM1突变通过限制线粒体底物而损害能量代谢。科学通报2017;7:1666。
李,李志强,李志强,等。线粒体内Sqstm1/p62对氧化倾向蛋白的筛选。生物化学学报。2011;413:122-7。
Seibenhener ML, Du Y, Diaz-Meco M-T, mocat J, Wooten MC, Wooten MW。隔离体1/p62在线粒体动力学、导入和基因组完整性中的作用生物化学学报。2013;1833:452-9。
de Castro IP, Costa AC, Celardo I, Tufi R, Dinsdale D, Loh SHY,等。果蝇ref(2) P是pink1突变体中帕金森介导的线粒体功能障碍抑制所必需的。细胞死亡,2013;4:e873。
确认
我们要感谢Murray和Hedlund实验室的所有成员,特别是Alannah Mole在小鼠繁殖、维护和组织解剖方面的帮助。
资金
这项工作由肌肉萎缩症协会资助(资助号417757;到LMM), Tenovus Scotland (E15/4),由Wellcome Trust资助的爱丁堡大学战略支持研究所(IS3-R2.23;to LMM),治愈SMA(批准号MUR2021;到LMM)、瑞典研究委员会(Vetenskapsrådet;2020 - 01049;到EH)和瑞典大脑基金会(Hjärnfonden;fo2021 - 0145;E.H)。大众是英国医学研究委员会的奖学金获得者。出于开放获取的目的,作者已对本次提交产生的任何作者接受手稿版本应用了创作共用署名(CC BY)许可.
道德声明
伦理批准并同意参与
所有适用的机构和国家动物护理和使用指南都得到了遵守。所有动物实验都是按照爱丁堡大学和英国内政部制定的指导方针进行的。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:补充图1。
来自Smn2B/-小鼠的代表性图像。来自肌肉的共聚焦图像显示,来自对照组(Smn2B/+)和Smn2B/-小鼠的NMJs标记有抗NF(绿色)、SV2(绿色)和BTX(红色)的抗体,来自头部和颈部(A,C)、胸腹区域(D,F)、前肢(G,I)和后肢(J,N)的肌肉。示意图图像(B, E, H, K- M)显示肌肉的位置,颜色连接到特定肌肉的共聚焦图像。比例尺= 25um。
附加文件2:补充图2。
SMN∆7小鼠模型在P12时颅、胸腹肌突触缺失的分析。(A)背侧观察小鼠的颅肌解剖位置示意图(耳长内收肌[AAL]和耳上肌[AS])。(B)小鼠仰卧位胸肌解剖位置示意图(胸骨三角肌[TS])。(C)小鼠仰卧位腹肌解剖位置示意图(外斜肌[EO]和腹直肌[RA])。(D-F)柱状图显示SMN∆7小鼠满终板、部分终板和空终板百分比的量化情况,分别与对照组颅骨肌肉(AAL和AS)、胸肌(TS)和腹肌(EO和RA)进行比较。注意,所有的颅肌均显示空置运动终板显著增加,完全占用终板显著减少,而胸肌或腹肌均未显示空置终板显著增加。带Sidak校正的双侧方差分析(ns=无显著性,*p≤0.05,* *p≤0.01,* * *p≤0.001,****p≤0.0001)。n对照组为3只,SMN为7只。误差柱表示平均值±SEM。
附加文件3:补充图3。
比较SMN∆7小鼠模型和Smn2B/−小鼠模型在三个不同身体区域肌肉中的突触损失水平。(A-C)柱状图显示了分别在颅骨肌肉(长耳内收肌和上耳肌)、胸肌(胸三角肌)和腹肌(腹外斜肌和腹直肌)中,与Smn2B/−小鼠相比,SMN∆7小鼠满终板、部分终板和空终板的定量百分比。请注意,与Smn2B/−颅骨肌肉相比,所有SMN∆7脑肌的空置运动终板显著增加,满用终板显著减少,而Smn2B/−胸肌和腹肌明显比SMN∆7小鼠更脆弱。显著性水平表示在比较SMN∆7与Smn2B/−小鼠时,满终板、部分终板和空终板之间存在统计学差异。带Sidak校正的双侧方差分析(ns=无显著性,*p≤0.05,* *p≤0.01,* * *p≤0.001,****p≤0.0001)。nSMN =3∆7只小鼠,nSmn2B/−小鼠=4-5。误差柱表示平均值±SEM。
附加文件4:补充图4。
四种SMA小鼠模型的内在肌肉特性比较。根据疾病终末期肌肉中完全占据运动终板的百分比,颜色梯度图例描述了神经肌肉连接病理学的七个分类类别(更多细节见方法部分)。表中显示了根据Smn -/-;SMN2中完全占据终板百分比的分类类别着色的研究肌肉(Murray等人,2008;Murray等人,2010;Thomson等人,2012),台湾(Lin等人,2016),SMN∆7 (Murray等人,2008;Ling等,2012;Comley et al., 2016)和Smn2B/- (Murray et al., 2015)小鼠模型。(A)表中显示了按延迟突触(DeSyn)或快速突触(FaSyn)分类的肌肉。注意,对于LALc肌,在两个独立的研究中观察到不同的结果(* = (Murray et al., 2008);# = (Thomson et al., 2012)。 (B) The table displays the muscles categorised by muscle fibre type (fast-twitch, mixed fibre types and slow-twitch). Note that for the AS, AAL, LALc and lumbrical muscles, different results were observed in two independent studies (* = (Murray et al., 2008); # = (Thomson et al., 2012); + = (Comley et al., 2016); ° = (Ling et al., 2012)).
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
沃西茨,V,梅,我,赫德伦德,E。et al。SMA小鼠模型显示出神经元脆弱性和弹性的不同模式。骨骼肌12, 22(2022)。https://doi.org/10.1186/s13395-022-00305-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-022-00305-9
关键字
- 脊髓性肌萎缩
- 小鼠模型
- 有选择性的脆弱性
- 神经肌肉接头
- NMJ
- 运动神经元
- 变性
- 转录分析
- 基因本体论