实验动物
雄性P53 KO小鼠,6 ~ 8周龄,每只体重22 ~ 25 g,购自模式生物中心(中国上海)。雄性C57 BL/6小鼠,6 ~ 8周龄,体重22 ~ 25 g,购于中国浙江维特河实验动物科技有限公司。将小鼠置于标准笼子中,室温23°C,相对湿度50%,12小时:12小时明暗循环。qPCR、western和流式细胞术,每实验组4只。组织学上,每实验组6只。为了抑制ROS或INOS,假手术小鼠给予生理盐水(对照组)。在其他实验中,接受假手术的小鼠作为对照。为了抑制ROS,去神经小鼠给予L-NAC (Den+抗ROS组)。为了抑制INOS,去神经小鼠给予1400W (Den+抗INOS组)。两组小鼠均麻醉后行单侧坐骨神经横断术[26]。深度麻醉后,切除每只小鼠右后腿0.5 cm长的坐骨神经;将两神经末梢埋于肌肉中,采用4-0可吸收缝合线缝合切口。在去神经支配后的特定时间点,将小鼠随机分为实验组进行分析。
湿重
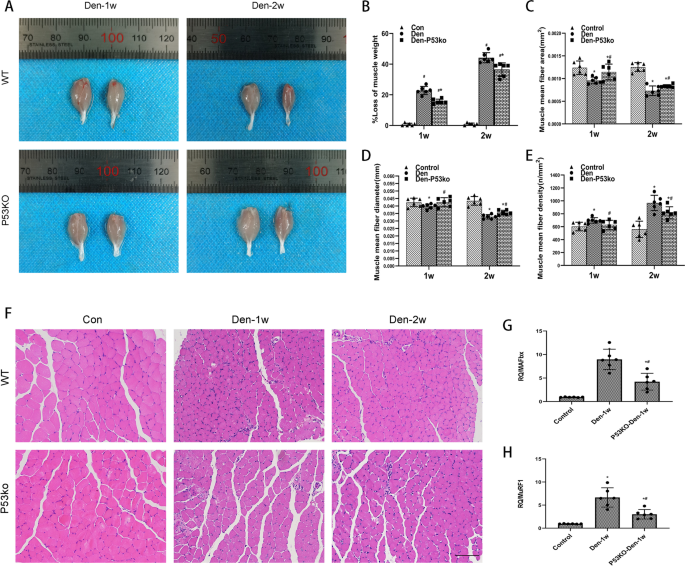
去神经后第7天和第14天,小鼠和对照组麻醉,分别取左、右后腿腓肠肌,用生理盐水洗涤,称重。肌重损失比定义为对侧重量减去神经损伤侧肌肉重量除以对侧重量。肌肉样品保存在4%多聚甲醛中,保存温度为- 80°C,待使用。
实时定量PCR (qPCR)
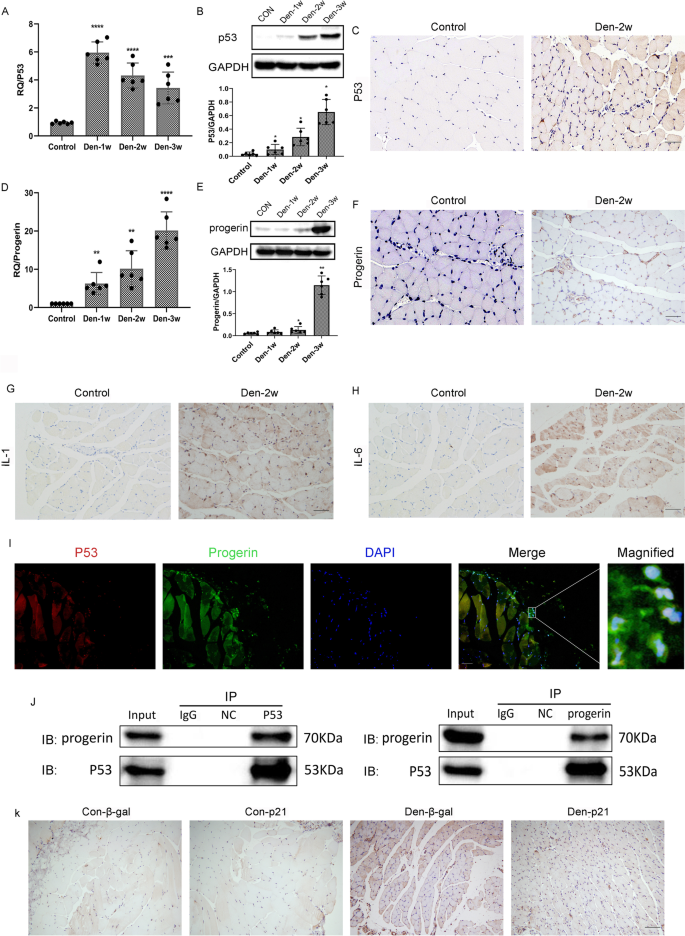
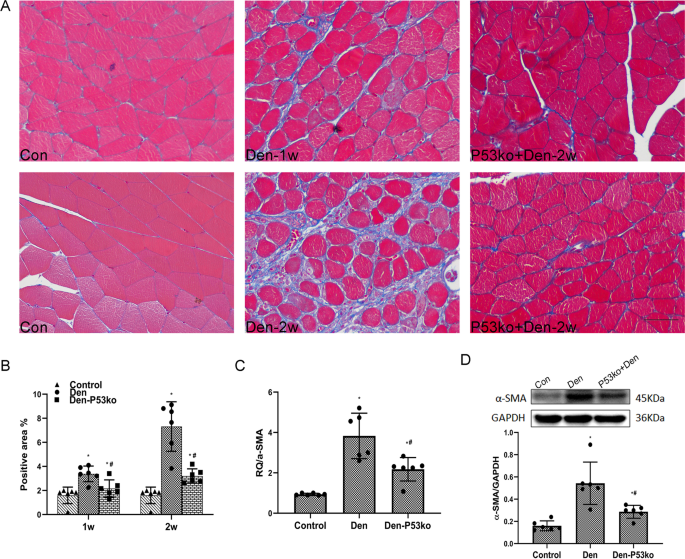
使用RNeasy试剂盒(Qiagen, Valencia, CA, USA)从腓肠肌中提取总RNA。采用带oligo dT引物的第一链cDNA合成试剂盒(Invitrogen, Carlsbad, CA, USA)合成cDNA,并用于实时荧光定量PCR (qPCR) (MJ Research, Waltham, MA, USA)。热循环条件为:94°C 5 min, 94°C 30 s, 55°C 45 s, 72°C 1 min, 72°C 5 min,循环35次。通过循环阈值(Ct)计算靶基因的相对表达量。iNOS、α-SMA、progerin、P53表达归一化至GAPDH水平。引物序列如下:iNOS: R, 5 ' GACCTGATGTTGCCATTGT 3 ', F, 5 ' TTG ACG CTC GGA ACT GTA g3 ';α-SMA: R, 5 ' CAC AGC CTG AAT AGC CAC ATA c3 ', F, 5 ' CCT GAA GAG CAT CCG ACA c3 ', progerin: R, 5 ' CTC TCG CTG CTT CCC GTT at3 ', F, 5 ' TGG ATG CTG AGA ACA GGC TAC a3 ', P53:R, 5 ' ACT CGG AGG GCT TCA CTT 3 ', F, 5 ' CAG GAG ACA TTT TCA GGC TTA t3 '。
Western blot分析
冷冻腓肠肌样品在含有1 mM苯基甲基磺酰氟和蛋白酶抑制剂鸡尾酒(罗氏应用科学)的放射免疫沉淀测定缓冲液中均质。裂解液在12000 × g(4°C)下离心20 min,上清液中蛋白水平用比优时(Beyotime)比优时(bicinchoninic acid assay kit)测定。通过SDS-PAGE (Beyotime)分离蛋白质,并将其转移到聚二氟乙烯膜(Beyotime)上,该膜在室温下用5%脱脂干牛奶在tris缓冲盐水中阻断,然后与一抗孵育:小鼠抗早孕蛋白(1:200;Santa Cruz Biotechnology, Sc-81611, USA),兔抗α- sma抗体(1:1000;亲和生物科学,AF1032,美国),兔抗p53 (1:1000;Abcam, Ab32532, UK)和抗乙酰型p53 (1:1000;Abcam, Ab183544, UK)和兔抗inos抗体(1:1000;亲和生物科学,AF0199,美国)。清洗三次后,与合适的二抗(Abcam)在室温下孵育1小时。使用增强化学发光检测试剂和x射线胶片观察蛋白质。
免疫组织化学
采用免疫组化方法检测大鼠腓肠肌中P53和progerin的表达。切片用二甲苯脱蜡,用乙醇再水合,抗原提取在0.01 m柠檬酸缓冲液(pH, 6.0)中高压锅中进行,然后自然冷却至室温。切片在0.3%双氧水中室温孵育10分钟;用山羊血清在室温下阻断切片15 min,然后与小鼠抗早孕素(1:50;Santa Cruz Biotechnology, Sc-81611, USA)和兔抗p53 (1:100;Abcam, Ab32532,英国)。然后用辣根过氧化物酶偶联的山羊抗兔IgG抗体(ab克隆,33301ES60,中国武汉)在室温下处理30分钟。免疫检测采用二氨基联苯胺溶液,根据制造商的说明。清洗后,切片反染色,脱水,然后用中性胶密封胶覆盖。
免疫荧光
为了鉴定去神经支配肌肉中的p53和progerin蛋白,我们进行了双重免疫染色。将多聚甲醛固定的失神经肌肉用一抗和二抗孵育,随后用DAPI涂敷。一抗包括小鼠抗progerin (1:25;Cruz Biotechnology, Sc-81611, USA)和兔抗p53 (1:20 00;Abcam, Ab32532,英国)。荧光显微镜(1 × 71, Olympus, Japan)观察阳性细胞数,ImageJ软件定量。
细胞制备和流式细胞术
腓肠肌单细胞悬液的制备
用磷酸盐缓冲盐水(PBS)冲洗腓肠肌组织,置于6厘米培养皿中,切成小块(2-4毫米)。将1 mg/mL的DNAse I与1640培养基混合,加入5 mL到组织中。将组织块溶液加入到gentleMACS C管中,并加入5 μl ii型胶原酶。将组织块与酶液一起放入gentmacs C管中,将该管安装在gentmacs组织处理机的机壳内,并插入加热模块。使用37C-mr-SMDK-1程序进行解离;程序完成后,取出C管并短暂离心使组织碎片成球。用70 μm滤镜过滤重悬细胞,将得到的细胞悬液收集于50 ml的试管中。滤网用10 ml RPMI 1640培养基漂洗,重悬细胞的漂洗培养基离心5分钟,丢弃上清。然后对重悬细胞进行计数和染色。
外周血单核细胞悬浮液的制备
将小鼠红细胞裂解液加入50 μl抗凝血剂。将混合物稀释至1ml (biolgend,编号420301),室温避光孵育15分钟。然后将裂解液在4℃、350 rpm下离心5分钟,观察样品是否存在红细胞。如果观察到红细胞,在室温下避光加入1ml红细胞裂解液,4℃离心5min。然后在重悬的细胞中加入3ml PBS, 4℃离心5min。最后重悬细胞,计数染色。
ROS检测
为了检测ROS,将3ml PBS加入到1ml单细胞悬液中(3×10)6细胞)使细胞重悬。细胞在4℃350 rpm下离心5 min,丢弃上清。然后,在细胞颗粒中加入1 ml无血清培养基,以1:1000稀释2′,7′-二氯二氢双乙酸荧光素(DCFH-DA)溶液,最终浓度为10 μmol/L。样品在37°C下孵育30分钟,每3-5分钟翻转一次试管,使探针与细胞保持接触。然后将细胞离心,用无血清细胞培养基清洗3次,在4℃350 rpm下离心,充分去除未进入细胞的DCFH-DA。然后加入200 μl无血清培养基重悬细胞。流式细胞术检测细胞,使用FlowJo软件分析数据。
ROS抑制
静脉注射乙酰半胱氨酸(L-NAC) (MCE, China)或溶剂对照组(生理盐水),剂量为1.1 mmol/kg/d [27],并在去神经支配后连续注射14天。
伊诺抑制
腹腔注射iNOS抑制剂1400W (MCE, China)或溶剂对照组(生理盐水)(200 μg/只)[28]去神经支配前1天注射,去神经支配后连续注射14天。
苏木精-伊红(HE)和马松三色染色
小鼠腓肠肌样品用4%多聚甲醛固定,石蜡包埋。取5 μm厚的样品切片,用苏木精-伊红(HE)染色(Beyotime, Shanghai, China)和马松三色染色(Beyotime)染色,观察组织病理变化。采用Image-Pro Plus 6.0软件(National Institutes of Health, Bethesda, MD, USA),对每只小鼠在每组实验条件下随机捕获的6张图像进行盲法分析,测定肌纤维的平均面积、直径和密度。
统计分析
所有数据均以平均值±SEM表示。采用双样本法评估组间差异t测试,Mann-WhitneyU测试,或χ2测试。进行单因素或双因素方差分析,然后进行Bonferroni事后检验进行组间比较。采用Friedman检验评估不同时间点的差异。采用SPSS v17.0软件(SPSS Inc., Chicago, IL, USA)进行统计分析。P值< 0.05认为有统计学意义。