- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
脊髓性肌萎缩小鼠骨骼肌中Tweak和Fn14的调节异常gydF4y2Ba
骨骼肌gydF4y2Ba体积gydF4y2Ba12gydF4y2Ba,文章号:gydF4y2Ba18gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
脊髓性肌萎缩(SMA)是一种由生存运动神经元(SMN)蛋白缺失引起的儿童神经肌肉疾病。SMA的特征是脊髓运动神经元的选择性死亡,导致进行性肌肉萎缩。SMA骨骼肌损失是去神经诱导的肌肉萎缩和固有肌肉病理的结合。阐明所涉及的途径对于确定有助于和维持肌肉病理的关键分子是至关重要的。肿瘤坏死因子样细胞凋亡弱诱导剂(TWEAK)/TNF受体超家族成员成纤维细胞生长因子诱导14 (Fn14)通路已被证明在成人去神经诱导的肌肉萎缩以及肌肉增殖、分化和代谢的调节中发挥关键作用。然而,目前尚不清楚这一途径在高度动态和发育中的肌肉中是否重要。gydF4y2Ba
方法gydF4y2Ba
因此,我们研究了TWEAK/Fn14通路在SMA肌肉病理中的潜在作用,使用了严重的台湾患者gydF4y2BaSmngydF4y2Ba−gydF4y2Ba/gydF4y2Ba−gydF4y2Ba;gydF4y2BaSMN2gydF4y2Ba不那么严重的gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2BaSMA小鼠,在出生后的前三周经历了渐进性的神经肌肉衰退。我们还使用了断奶前野生型(WT)动物去神经和肌肉损伤的实验模型,以及sirna介导的C2C12肌肉细胞的敲除来进行额外的机制研究。gydF4y2Ba
结果gydF4y2Ba
在这里,我们报道了在两种SMA小鼠模型的骨骼肌疾病进展过程中,Tweak、Fn14和先前提出的下游效应物的表达明显失调。此外,sirna介导gydF4y2BaSmngydF4y2BaC2C12成肌细胞的敲除表明Smn和TWEAK/Fn14通路之间存在遗传相互作用。进一步分析SMA,gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba小鼠发现调节异常的肌病、肌生成和葡萄糖代谢通路是一种常见的骨骼肌特征,这为支持TWEAK/Fn14通路和Smn之间的关系提供了进一步的证据。最后,给药TWEAK/Fn14激动剂Fc-TWEAK改善了两种SMA小鼠模型的疾病表型。gydF4y2Ba
结论gydF4y2Ba
我们的研究为促进SMA肌肉病理的潜在分子参与者以及肌肉发育过程中TWEAK/Fn14通路可能的差异反应提供了机制见解。gydF4y2Ba
背景gydF4y2Ba
神经肌肉疾病脊髓性肌肉萎缩症(SMA)是婴儿死亡的主要遗传原因[gydF4y2Ba1gydF4y2Ba].SMA是由gydF4y2Ba存活运动神经元1gydF4y2Ba(gydF4y2BaSMN1gydF4y2Ba)基因[gydF4y2Ba2gydF4y2Ba].SMA发病机制的主要病理组成部分是脊髓α运动神经元的选择性丧失和肌肉萎缩[gydF4y2Ba3.gydF4y2Ba].骨骼肌病理是SMA疾病表现和进展的明显因素,由去神经诱导的肌肉萎缩引起[gydF4y2Ba4gydF4y2Ba]和内在缺陷[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].由于骨骼肌是人体最大的胰岛素敏感组织,参与葡萄糖的利用[gydF4y2Ba7gydF4y2Ba],肌肉代谢也受SMA影响就不足为奇了。在SMA 1型、2型和3型患者中确实有代谢障碍的报道[gydF4y2Ba8gydF4y2Ba].更好地了解有助于SMA肌肉生理病理的特定分子效应因子,可以为SMA肌肉病理提供机制见解,并有助于旨在改善患者肌肉健康的治疗努力[gydF4y2Ba9gydF4y2Ba].gydF4y2Ba
在慢性损伤和肌肉疾病中起关键作用的一种途径是肿瘤坏死因子样凋亡弱诱导剂(TWEAK)及其主要信号受体,TNF受体超家族成员成纤维细胞生长因子诱导14 (Fn14) [gydF4y2Ba10gydF4y2Ba].TWEAK作为2型跨膜蛋白广泛表达和合成,但也可通过蛋白水解过程裂解并作为可溶性细胞因子分泌[gydF4y2Ba10gydF4y2Ba].TWEAK/Fn14通路在骨骼肌中的作用是相互矛盾的,因为它已被证明对肌肉健康和功能既有有益的影响,也有有害的影响[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].事实上,病理上高水平的TWEAK激活典型核因子κ -活化B细胞轻链增强子(NF-κB)通路,促进成肌细胞增殖,从而抑制肌肉生成和肌肉修复和再生的早期阶段[gydF4y2Ba13gydF4y2Ba].相反,较低生理浓度的TWEAK激活非典型NF-κB通路,促进成肌细胞融合和肌生成[gydF4y2Ba11gydF4y2Ba].跨膜蛋白Fn14通常处于休眠状态,或在正常健康肌肉中低水平存在[gydF4y2Ba14gydF4y2Ba].萎缩诱导条件(例如铸造和手术去神经)刺激Fn14的表达,导致TWEAK/Fn14通路的慢性激活和持续的骨骼肌萎缩[gydF4y2Ba15gydF4y2Ba].我们还证明了神经退行性成人疾病肌萎缩性侧索硬化症(ALS)小鼠模型骨骼肌中Tweak/Fn14通路的活性增加,其特征是进行性和慢性去神经诱导的肌肉萎缩[gydF4y2Ba16gydF4y2Ba].此外,多种报道的TWEAK/Fn14通路下游效应因子在肌肉代谢调节中发挥关键作用,如过氧化物酶体增殖物激活受体- γ辅激活因子1α (PGC-1α)、葡萄糖转运蛋白4 (Glut-4)、肌源转录因子2d (Mef2d)、己糖激酶II (HKII)和Krüppel-like因子15 (Klf15) [gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].gydF4y2Ba
尽管TWEAK/Fn14通路被认为在骨骼肌健康调节和代谢中都有作用,但这两者在SMA中都有影响[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba21gydF4y2Ba],这一途径尚未在SMA的背景下进行研究。此外,所有关于这一途径的研究都是在成年小鼠身上进行的,因此从未在肌肉发育的早期阶段进行过探索。因此,我们研究了TWEAK和Fn14在SMA和出生后骨骼肌发育早期阶段的潜在作用。我们报告两者水平显著下降gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba在两种不同的SMA小鼠模型(gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba) [gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].我们还观察到表达异常gydF4y2BaPGC-1αgydF4y2Ba,gydF4y2BaGlut-4gydF4y2Ba,gydF4y2BaMef2dgydF4y2Ba而且gydF4y2BaHKIIgydF4y2Ba,此前提出了TWEAK/Fn14信号通路的代谢下游效应[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba24gydF4y2Ba],在这些SMA小鼠的骨骼肌中。此外,更深入的分析显示,在SMA骨骼肌中,调节肌病、肌生成和葡萄糖代谢途径的异常表达基因部分重叠,gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba这进一步支持了在肌肉发育过程中TWEAK/Fn14通路和SMN之间潜在的共享功能。最后,给药Fc-TWEAK,一种TWEAK/Fn14信号通路激动剂,改善了两种SMA小鼠模型的疾病表型。我们的研究为促进SMA骨骼肌病理的潜在分子效应提供了额外的机制见解,并提示了TWEAK/Fn14通路在出生后肌肉发育早期阶段的作用。gydF4y2Ba
方法gydF4y2Ba
动物和动物程序gydF4y2Ba
野生型小鼠FVB/N和C57BL/6J及重度gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba小鼠模型(FVB;Tg(SMN2)2Hung/J) [gydF4y2Ba22gydF4y2Ba]是从杰克逊实验室获得的。的gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba小鼠模型[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba25gydF4y2Ba由林赛·m·默里博士(爱丁堡大学)慷慨提供。gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba[gydF4y2Ba26gydF4y2Ba),gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba小鼠模型[gydF4y2Ba27gydF4y2Ba都是由琳达·c·伯克利(Biogen)慷慨提供的。gydF4y2Ba
SmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba老鼠是通过育种产生的gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba老鼠gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2 / SMN2gydF4y2Ba先前所述的老鼠[gydF4y2Ba28gydF4y2Ba].gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba2 b / +gydF4y2Ba老鼠是通过育种产生的gydF4y2BaSmngydF4y2Ba2 b / 2 bgydF4y2Ba而且gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba先前所述的老鼠[gydF4y2Ba23gydF4y2Ba].gydF4y2Ba
活体动物实验程序由牛津大学伦理委员会和英国内政部(当前项目许可证PDFEDC6F0,以前的项目许可证30/2907)根据1986年《动物(科学程序)法》授权和批准,Keele大学动物福利伦理审查机构和英国内政部(项目许可证P99AB3B95)根据1986年《动物(科学程序)法》批准。渥太华大学动物保护委员会根据加拿大动物保护委员会和德国动物福利法授权的程序,并得到下萨克森州消费者保护和食品安全办公室(LAVES,参考编号15/1774和19/3309)的批准。gydF4y2Ba
Fc-TWEAK采用0.1 cc无菌胰岛素注射器皮下注射,剂量为7.9 μg、15.8 μg、31.6 μg,每天、每隔一天、每4天注射20 μl。小鼠Fc- tweak,一种与小鼠IgG2a Fc区域的融合蛋白,以及Ig同位素控制由Linda C. Burkly (Biogen)提供[gydF4y2Ba26gydF4y2Ba].gydF4y2Ba
在生存研究中,每天对小鼠进行称重和监测,并在达到规定的人道终点时扑杀小鼠。gydF4y2Ba
在所有实验中,窝仔在出生时被随机分配,并使用由雌雄组成的整个窝仔。根据对SMA小鼠的类似研究确定样本量。gydF4y2Ba
为了减少使用的老鼠总数,快速抽动gydF4y2Ba胫骨前gydF4y2Ba(TA)和来自同一只小鼠的三头肌可互换用于各自的分子和组织学分析。gydF4y2Ba
坐骨神经挤压和切断gydF4y2Ba
对于神经挤压和切割实验,出生后第7天(P)野生型(WT) FVB/N小鼠用2%异氟醚/氧麻醉,然后将其中一只大腿外侧剃毛,并在股骨外侧皮肤上做一个1cm的切口。用钝剪子切开肌肉层,定位坐骨神经,用镊子压碎神经15 s。对于神经切割,取下约2毫米的神经切片,并在×12.8的手术显微镜下确认横断。用手术胶封闭皮肤切口,让动物在温暖的毯子上恢复。在P14收获同侧和对侧TA肌,并在4%多聚甲醛(PFA)中固定24小时用于组织学分析或快速冷冻用于分子分析。gydF4y2Ba
心脏毒素注射gydF4y2Ba
心脏毒素γ (Cytotoxin I, Latoxan, L8102, Portes les Valence)溶于0.9%生理盐水中,于P10时注入WT FVB/N小鼠左TA肌,每小鼠总体重4 μl/g 10 μM溶液。右侧TA注射等量0.9%生理盐水。注射过程中,小鼠用2%异氟醚/氧麻醉,所有注射均使用无菌0.3 cc胰岛素注射器进行。6天后收获TA肌肉,在4%的PFA中固定24小时用于组织学分析或快速冷冻用于分子分析。gydF4y2Ba
骨骼肌层粘连蛋白染色gydF4y2Ba
TA肌固定于PFA过夜。将组织切片(13 μm),在封闭缓冲液(0.3% Triton-X, 20%胎牛血清(FBS)和20%正常山羊血清,PBS)中孵育2小时。阻断后,在阻断缓冲液中用大鼠抗层粘连蛋白(1:1000,Sigma L0663)在4℃下对组织进行过夜染色。第二天,将组织在PBS中清洗,并使用山羊-抗大鼠IgG 488二抗(1:500,Invitrogen a -11006)检测1小时。将PBS清洗后的组织装入fluorommount - g (Southern Biotech)。图像用DM IRB显微镜(徕卡)和20倍物镜拍摄。每组3-5只小鼠盲法定量分析,每只小鼠5节。使用Fiji测量TA肌段指定区域内的肌纤维面积(ImageJ) [gydF4y2Ba29gydF4y2Ba].gydF4y2Ba
骨骼肌苏木精和伊红染色gydF4y2Ba
TA肌固定于4% PFA中,并嵌入石蜡块中。染色时,将肌肉切片(13 μm),在二甲苯中脱蜡,然后在100%乙醇中固定。在水中漂洗后,样品在苏木精(Fisher)中染色3分钟,在水中漂洗,在0.02% HCl 70%乙醇溶液中浸泡40次,然后再次在水中漂洗。切片随后在1%伊红溶液(BDH)中染色1分钟,乙醇脱水,二甲苯清除,并用fluorommount - g (Southern Biotech)安装。gydF4y2Ba
图像用DM IRB显微镜(徕卡)和20倍物镜拍摄。每组3-5只小鼠盲法定量分析,每只小鼠5节。使用Fiji测量TA肌段指定区域内的肌纤维面积(ImageJ) [gydF4y2Ba29gydF4y2Ba].gydF4y2Ba
细胞培养gydF4y2Ba
C2C12成肌细胞[gydF4y2Ba30.gydF4y2Ba]和NSC-34神经元样细胞[gydF4y2Ba31gydF4y2Ba]在由Dulbecco 's Modified Eagle 's media (DMEM)添加10% FBS和1%盘尼西林/链霉素(all Life Technologies)组成的培养基中维持。细胞在37°C和5% CO中培养gydF4y2Ba2gydF4y2Ba.C2C12成肌细胞在含2%马血清的DMEM中分化7天,形成多核肌管。细胞定期检测支原体,保持无支原体。gydF4y2Ba
体外siRNA敲除gydF4y2Ba
对于小干扰RNA (siRNA)转染,将C2C12成肌细胞以50%的汇合度接种到12孔板上,并在2ml DMEM中培养过夜。转染siRNA前用PBS清洗细胞,每个siRNA 100 pmol (gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba,gydF4y2BaSmngydF4y2Ba将10 μl Lipofectamine RNAi/MAX (Invitrogen)溶解于OptiMEM溶液(Gibco)的复合物中加入细胞3小时。然后将转染混合物替换为不含sirna的DMEM 1天,或替换为不含sirna的分化培养基混合物7天。gydF4y2Ba
qPCRgydF4y2Ba
RNA从组织和细胞中提取,使用Qiagen公司的RNeasy试剂盒,或Bioline公司的isolation II RNA Mini试剂盒,或使用TRIzol试剂(Life Technologies公司)按照制造商说明使用硫氰酸胍-酸-苯酚-氯仿提取。在相似的实验中采用相同的RNA提取方法,在相同的实验中,样品之间使用相同的RNA量。根据制造商的说明,使用高容量cDNA Kit (Life Technologies)或qPCRBIO cDNA Synthesis Kit (PBCR Biosystems)制备cDNA。同样的逆转录方法被用于类似的实验。cDNA模板在StepOnePlus Real-Time PCR Thermocycler (Life Technologies)上用Applied Biosystems的SYBR Green Mastermix或qPCRBIO SyGreen Blue Mix Hi-ROX (PCR Biosystems)进行扩增。同样的放大方法用于类似的实验。qPCR数据使用StepOne Software v2.3 (Applied Biosystems)进行分析。qPCR所用引物均来自IDT,引物序列均为自行设计或自制(补充表)gydF4y2Ba1gydF4y2Ba).相对基因表达量采用Pfaffl方法量化[gydF4y2Ba32gydF4y2Ba],采用LinRegPCR软件计算引物效率。我们将所有测试基因在小鼠组织和细胞中的相对表达量归一化gydF4y2BaRNA聚合酶II多肽JgydF4y2Ba(gydF4y2BaPolJgydF4y2Ba) [gydF4y2Ba33gydF4y2Ba].对于所有qPCR图,实验组的归一化表达量与参照组进行比较,将该组每个参照样本的归一化表达量乘以对应于1/(该参照实验组所有样本的平均值)的值,将其归一化表达量设置为1。然后用该值乘以所有实验组中每个样本的归一化相对表达式。gydF4y2Ba
PCR数组gydF4y2Ba
RNA提取使用RNeasy®Microarray Tissue Kit (Qiagen)。用RT生成cDNAgydF4y2Ba2gydF4y2Ba第一股套件(Qiagen)。采用RT进行qpcrgydF4y2Ba2gydF4y2BaProfiler™PCR阵列小鼠骨骼肌:肌发生和肌病小鼠(PAMM-099Z, SABiosciences)和RTgydF4y2Ba2gydF4y2BaProfiler™PCR阵列小鼠葡萄糖代谢(PAMM-006Z SABiosciences)。数据采用RT Profiler PCR Array data Analysis (version 3.5)进行分析,mRNA表达归一化至所有样本中表达最稳定的两个基因。我们使用公开的数据库STRING(版本11.5)对不同表达基因进行网络和富集分析[gydF4y2Ba34gydF4y2Ba].最低要求的互动得分设置为0.4,中等信度。gydF4y2Ba
免疫印迹gydF4y2Ba
西部片在Fig。gydF4y2Ba1gydF4y2Ba,新鲜制备的放射免疫沉淀(RIPA)缓冲液用于均质组织和细胞,包括50 mM Tris pH 8.8, 150 mM NaCl, 1% NP-40, 0.5%脱氧胆酸钠,0.1% SDS和完全的微型蛋白酶抑制剂(Roche)。用Bradford法测定等量的总蛋白。蛋白质样品首先用含有5% β-巯基乙醇(Sigma)的Laemmli样品缓冲液(Bio-Rad, Hemel Hempstead, UK) 1:1稀释,并在100°C下加热10分钟。接下来,样品装入新鲜制作的1.5 mm 12%聚丙烯酰胺分离和5%堆叠凝胶上,在运行缓冲液中在120 V下进行电泳~1.5 h。随后,在含有20%甲醇的转移缓冲液中,通过120 V电印迹60分钟,将蛋白质从凝胶转移到聚偏氟乙烯膜(默克Millipore)上。然后膜在Odyssey Blocking Buffer (Licor)中孵育2小时。用一抗(P105/p50, 1:1000, Abcam ab32360;Actin, 1:1000, Abcam ab3280)在Odyssey Blocking Buffer和0.1% Tween-20。第二天,PBS洗膜3次10分钟后,用二抗(山羊抗兔IgG 680RD, 1:1000, LI-COR 926-68071;山羊抗小鼠IgG 800CW, 1:1000 LI-COR, 926-32210)。最后,膜在PBS中洗涤三次10分钟,并在LI-COR Odyssey CLx红外成像系统(LI-COR)上扫描700 nm和800 nm通道,每个通道2.5分钟。 The background was subtracted, and signal of protein of interest was divided by signal of the housekeeping protein.
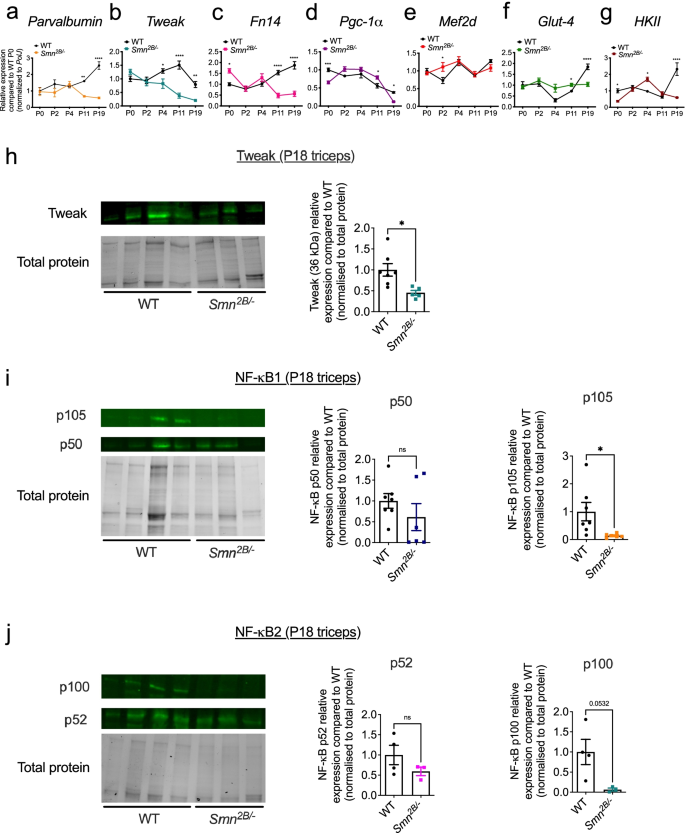
微调和Fn14在骨骼肌中的异常表达gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2BaSMA老鼠。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaggydF4y2BaqPCR分析gydF4y2Ba小清蛋白gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),gydF4y2Ba调整gydF4y2Ba(gydF4y2BabgydF4y2Ba),gydF4y2BaFn14gydF4y2Ba(gydF4y2BacgydF4y2Ba),gydF4y2BaPgc-1αgydF4y2Ba(gydF4y2BadgydF4y2Ba),gydF4y2BaMef2dgydF4y2Ba(gydF4y2BaegydF4y2Ba),gydF4y2BaGlut-4gydF4y2Ba(gydF4y2BafgydF4y2Ba),gydF4y2BaHKIIgydF4y2Ba(gydF4y2BaggydF4y2Ba)在三头肌、腓肠肌gydF4y2Ba年代gydF4y2Ba从出生后(P) 0(出生)、P2(症状前)、P5(症状早期)、P7(症状晚期)和P19(终末期)开始测量TA和股四头肌。gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba野生型(WT)小鼠。归一化相对表达式与WT P0比较。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3-4只,双向方差分析,基因型间Sidak多重比较检验,*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001, ****gydF4y2BapgydF4y2Ba< 0.0001。gydF4y2BahgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba症状前TA中NF-κB p50/actin蛋白水平的定量(P2) (gydF4y2BahgydF4y2Ba)及晚期症状(P7) (gydF4y2Ba我gydF4y2Ba)gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba小鼠和年龄匹配的WT动物。图像是具有代表性的免疫印迹。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3-4只,不配对gydF4y2BatgydF4y2Ba-test, ns,不显著(gydF4y2BahgydF4y2Ba),gydF4y2BapgydF4y2Ba= 0.0215 (gydF4y2Ba我gydF4y2Ba).gydF4y2BajgydF4y2Ba症状晚期股四头肌中NF-κB p50/actin和p105/actin蛋白水平的定量分析(P7)gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba小鼠和年龄匹配的WT动物。图像是具有代表性的免疫印迹。数据为均值±SEM,gydF4y2BangydF4y2Ba=每个实验组3-4只动物,双向方差分析,未校正Fisher’s LSD, ****gydF4y2BapgydF4y2Ba< 0.0001, ns,不显著。gydF4y2BakgydF4y2BaqPCR分析gydF4y2BaNF -κB-inducing激酶gydF4y2Ba(gydF4y2Ba尼克gydF4y2Ba)在症状晚期P7的TA肌中gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba和年龄匹配的WT动物。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3-4只,不配对gydF4y2BatgydF4y2Ba以及,gydF4y2BapgydF4y2Ba= 0.0094gydF4y2Ba
对于所有其他人物的西部片,遵循同样的步骤,但有以下关键区别。使用Bio-Rad TGX无染色凝胶,凝胶在转移前在ChemiDoc Bio-Rad成像仪上成像,以量化用于归一化的总蛋白。主要抗体为NF-κB2 p100/p52 (Cell Signaling, no.;, NF-κB1 p105/p50(细胞信号通路,no. 2);12540, 1:100),和Tweak (Abcam, ab37170, 1:1000)。二抗为山羊抗兔IgG二抗Dylight 800 (Invitrogen, SA5-100036, 1:10000)。使用Bio-Rad Image Lab软件进行定量。gydF4y2Ba
统计分析gydF4y2Ba
所有的统计分析都是用最新的GraphPad Prism软件完成的。在适当的时候,一个学生的未配对的两条尾巴gydF4y2BatgydF4y2Ba-test、单因素方差分析或双因素方差分析。所使用的事后分析在图图例中指定。异常值是通过Grubbs测试确定的。Kaplan-Meier生存分析采用log-rank检验,生存曲线在gydF4y2BapgydF4y2Ba< 0.05。gydF4y2Ba
结果gydF4y2Ba
在两种SMA小鼠模型中,Tweak和Fn14均表达异常gydF4y2Ba
我们首先研究了台湾重度骨骼肌中Tweak和Fn14的表达gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba小鼠模型[gydF4y2Ba22gydF4y2Ba],使用报告有神经肌肉连接处(NMJ)去神经易损性差异的肌肉(易损性:肱三头肌>腓肠肌> TA >股四头肌)[gydF4y2Ba35gydF4y2Ba].肌肉取自于gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba和WT小鼠在疾病进展过程中的几个时间点:出生(产后(P) 0,症状前(P2),症状早期(P5),症状晚期(P7)和终末期(P10))。该SMA小鼠模型在疾病进展期间的肌肉病理已被充分记录[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].gydF4y2Ba
我们评估了的表达gydF4y2Ba小清蛋白gydF4y2Ba,高亲和CagydF4y2Ba2 +gydF4y2Ba-结合蛋白,它在去神经的肌肉中被下调[gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba以及SMA患者骨骼肌肌肉萎缩的标志gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba老鼠(gydF4y2Ba40gydF4y2Ba].我们观察到的表达显著降低gydF4y2Ba小清蛋白gydF4y2Ba疾病进展过程中的mRNA(图;gydF4y2Ba1gydF4y2Baa) SMA小鼠与WT动物相比,进一步证实parvalbumin为agydF4y2Ba善意的gydF4y2BaSMA肌肉萎缩的标记物[gydF4y2Ba40gydF4y2Ba].此外,我们注意到gydF4y2Ba小清蛋白gydF4y2Ba两个最脆弱的肌肉(三头肌和腓肠肌)在较早的时间点表达下调[gydF4y2Ba35gydF4y2Ba]与WT动物相比(图;gydF4y2Ba1gydF4y2Ba一个)。gydF4y2Ba
接下来我们计算表达式gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba并观察到显著降低的水平gydF4y2Ba调整gydF4y2Ba肌肉中的mRNAgydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba除了在股四头肌(图。gydF4y2Ba1gydF4y2Bab).同样,我们发现gydF4y2BaFn14gydF4y2Ba所有肌肉中的mRNAgydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba小鼠在疾病进展(图;gydF4y2Ba1gydF4y2Bac)与WT动物相比。有趣的是,表达的降低gydF4y2BaFn14gydF4y2Ba在新生动物去神经和萎缩的肌肉中,不同于以往的成人报道,去神经诱导的萎缩刺激其表达[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].gydF4y2Ba
如上所述,有报道称TWEAK/Fn14通路对代谢效应因子Klf15、Pgc-1α、Mef2d、Glut-4和HKII的表达有负面影响[gydF4y2Ba18gydF4y2Ba].鉴于我们之前已经发表了一个和谐的增加表达gydF4y2BaKlf15gydF4y2Ba在疾病发展过程中对SMA小鼠骨骼肌的影响[gydF4y2Ba41gydF4y2Ba],我们接下来评估了被Tweak和Fn14调节的额外代谢靶点是否在预测的方向上出现了类似的失调。我们确实观察到gydF4y2BaPgc-1αgydF4y2Ba,gydF4y2BaMef2dgydF4y2Ba,gydF4y2BaGlut-4gydF4y2Ba而且gydF4y2BaHKIIgydF4y2Ba的肌肉明显上调gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba与WT动物相比,症状时间点(P5-P10)的小鼠(图;gydF4y2Ba1gydF4y2BaD-g),显示出与两者相反的模式gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Bac) [gydF4y2Ba18gydF4y2Ba].值得注意的是,我们还发现在大多数肌肉中,mRNA水平gydF4y2BaPgc-1αgydF4y2Ba,gydF4y2BaMef2dgydF4y2Ba,gydF4y2BaGlut4gydF4y2Ba而且gydF4y2BaHKIIgydF4y2Ba症状前明显减少gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba小鼠(P0-P5)与WT动物相比(图;gydF4y2Ba1gydF4y2BaD-g),独立于gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Bac)。gydF4y2Ba
也有报道称TWEAK和Fn14影响骨骼肌中的典型和非典型NF-κB通路[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].在症状前(P2) TA肌肉中,我们观察到NF-κB1 (p50)的表达没有显著差异,这是典型NF-κB通路的组成部分gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba小鼠和WT动物(图;gydF4y2Ba1gydF4y2BaH),与正常值一致gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba水平(无花果。gydF4y2Ba1gydF4y2Bac)。相反,症状TA肌中NF-κB1 (p50)表达明显降低gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba与WT动物相比,小鼠P7(图;gydF4y2Ba1gydF4y2BaI),符合降低的水平gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Bab).这些发现在P7股四头肌中得到验证,在P7股四头肌中NF-κB1 (p50)水平也显著降低gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba与WT动物相比(图;gydF4y2Ba1gydF4y2Baj).我们发现p105nf -κB1成分无显著差异。值得注意的是,对于所有NF-κB1 p50/105 western蛋白,p105成分总是更难检测到,有时甚至无法检测到,例如P7 TAs。我们还研究了NF-κB诱导激酶(NIK)的表达,该激酶参与了非典型的NF-κB激活途径[gydF4y2Ba44gydF4y2Ba].我们观察到gydF4y2Ba尼克gydF4y2BaP7gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba与WT动物相比(图;gydF4y2Ba1gydF4y2Bak),提示SMA小鼠骨骼肌中Tweak和Fn14活性失调可能同时影响NF-κB信号通路,而NF-κB信号通路在肌肉健康和代谢中起着关键的调节作用[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].gydF4y2Ba
最后,我们评估了轻度骨骼肌中Tweak和Fn14的表达gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2BaSMA小鼠模型[gydF4y2Ba23gydF4y2Ba].TA肌肉取自gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2BaP0(出生期)、P2(症状早期)、P4(症状晚期)、P11(症状早期)和P19(终末期)小鼠和年龄匹配的WT动物。类似于gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba在这种SMA小鼠模型中,疾病进展期间的肌肉病理已被充分记录[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].我们发现的表达显著降低gydF4y2Ba小清蛋白gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Ba一个),gydF4y2Ba调整gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Bab)和gydF4y2BaFn14gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2BaC)在肌肉中gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba小鼠在疾病进展期间与WT动物相比,类似于在更严重时观察到的情况gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2BaSMA小鼠模型(图;gydF4y2Ba1gydF4y2Baa - c)。我们之前报道过异常表达增高gydF4y2BaKlf15gydF4y2Ba在TA肌中gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba疾病进展期间的小鼠[gydF4y2Ba41gydF4y2Ba].然而,gydF4y2BaPgc-1αgydF4y2Ba表达仅在P11处增加(图11)。gydF4y2Ba2gydF4y2Bad),gydF4y2BaMef2dgydF4y2Ba仅在P2处(图;gydF4y2Ba2gydF4y2Bae),gydF4y2BaGlut-4gydF4y2Ba仅在P11(图;gydF4y2Ba2gydF4y2Baf),而gydF4y2BaHKIIgydF4y2Ba在P0和P19显著降低,在P4显著升高(图4)。gydF4y2Ba2gydF4y2Bag),这表明Tweak和Fn14活性对这些代谢效应因子的负面影响可能取决于疾病严重程度、年龄和/或遗传菌株。调整P18肱三头肌的下调gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba小鼠经western验证(图;gydF4y2Ba2gydF4y2Bah).此外,与gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba小鼠骨骼肌NF-κB1 p50表达水平无显著差异,但NF-κB1 p105表达水平显著降低gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba与WT动物相比(图;gydF4y2Ba2gydF4y2Bai).对于NF-κB2通路,我们发现无论是p52还是p100成分都没有显著差异(图5)。gydF4y2Ba2gydF4y2Baj).因此,我们的研究结果表明,NF-κB1和2通路在两种SMA小鼠模型的骨骼肌中具有不同的表达谱,这可能是由于这些成分的不同表达和/或加工以及非tweak /Fn14通路所致。gydF4y2Ba
微调和Fn14在骨骼肌中的异常表达gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2BaSMA老鼠。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaggydF4y2BaqPCR分析gydF4y2Ba小清蛋白gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),gydF4y2Ba调整gydF4y2Ba(gydF4y2BabgydF4y2Ba),gydF4y2BaFn14gydF4y2Ba(gydF4y2BacgydF4y2Ba),gydF4y2BaPgc-1αgydF4y2Ba(gydF4y2BadgydF4y2Ba),gydF4y2BaMef2dgydF4y2Ba(gydF4y2BaegydF4y2Ba),gydF4y2BaGlut-4gydF4y2Ba(gydF4y2BafgydF4y2Ba),gydF4y2BaHKIIgydF4y2Ba(gydF4y2BaggydF4y2Ba)从P0(出生),P2(症状前),P4(症状前),P11(症状早期)和P19(终末期)gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba和WT小鼠。归一化相对表达式与WT P0比较。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3-4只,双向方差分析,基因型间Sidak多重比较检验,*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001, ****gydF4y2BapgydF4y2Ba< 0.0001。gydF4y2BahgydF4y2Ba症状晚期三头肌调整蛋白水平归一化至总蛋白的定量(P18)gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba小鼠和年龄匹配的WT动物。图像是具有代表性的免疫印迹。数据为均值±SEM,gydF4y2BangydF4y2Ba每实验组= 6-7只,不配对gydF4y2BatgydF4y2Ba以及,gydF4y2BapgydF4y2Ba= 0.014。gydF4y2Ba我gydF4y2Ba症状晚期三头肌NF-κB1 p50和p105蛋白归一化至总蛋白水平的定量(P18)gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba小鼠和年龄匹配的WT动物。图像是具有代表性的免疫印迹。数据为均值±SEM,gydF4y2BangydF4y2Ba每实验组= 6-7只,不配对gydF4y2BatgydF4y2Ba以及,gydF4y2BansgydF4y2Ba,不显著(p50),gydF4y2BapgydF4y2Ba= 0.0354 (p105)。gydF4y2BajgydF4y2Ba症状晚期三头肌中NF-κB2 p52和p100蛋白归一化至总蛋白水平的定量(P18)gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba小鼠和年龄匹配的WT动物。图像是具有代表性的免疫印迹。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3-4只,不配对gydF4y2BatgydF4y2BaTest, ns,不显著(p52),gydF4y2BapgydF4y2Ba= 0.0532 (p100)gydF4y2Ba
为了确定SMA肌肉中Tweak、Fn14和先前报道的代谢效应因子的表达异常是否与疾病状态无关,我们研究了gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba,gydF4y2BaPgc-1αgydF4y2Ba,gydF4y2BaMef2dgydF4y2Ba,gydF4y2BaGlut-4gydF4y2Ba,gydF4y2BaHKIIgydF4y2Ba而且gydF4y2BaKlf15gydF4y2Ba在P7 WT的三头肌中gydF4y2BaSmngydF4y2Ba2 b / 2 bgydF4y2Ba而且gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba小鼠(补充图;gydF4y2Ba1gydF4y2Ba),在该时间点,已观察到有重大的变化gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba老鼠。gydF4y2BaSmngydF4y2Ba2 b / 2 bgydF4y2Ba而且gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba与WT动物相比,小鼠分别表达约70%和50%的全长功能Smn蛋白,并且不显示典型的SMA表型[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].虽然我们发现了一些差分表达式的实例(gydF4y2BaGlut-4gydF4y2Ba:gydF4y2BaSmngydF4y2Ba2 b / 2 bgydF4y2BavsgydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba,gydF4y2BaHKIIgydF4y2Ba:gydF4y2BaSmngydF4y2Ba2 b / 2 bgydF4y2BavsgydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba而且gydF4y2BaKlf15gydF4y2Ba: WT vsgydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba)时,非病理性Smn水平(WT vsgydF4y2BaSmngydF4y2Ba2 b / 2 bgydF4y2BavsgydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba)和与Tweak/Fn14通路相关的分子成分的表达(补充图。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
因此,我们证明了在两种SMA小鼠模型中,Tweak、Fn14和相关的代谢效应因子在进行性肌肉萎缩过程中出现失调,这很可能是由于Smn消耗的病理水平所致。gydF4y2Ba
在肌肉发育的早期阶段,去神经不影响Tweak和Fn14gydF4y2Ba
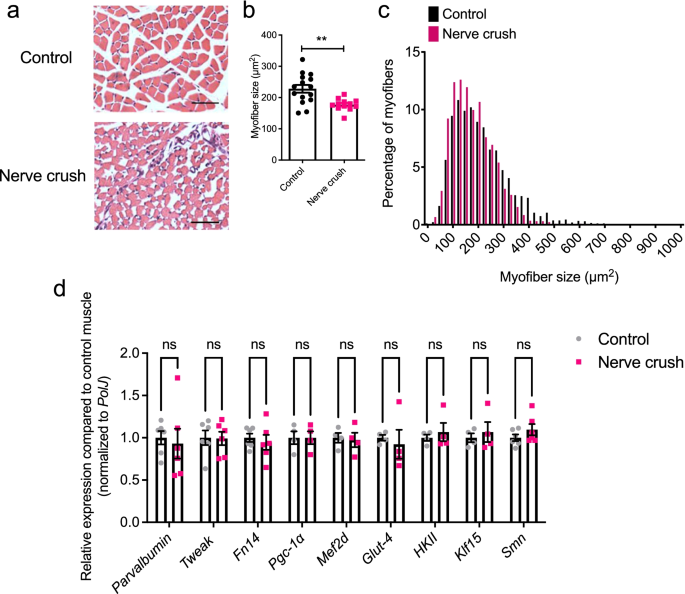
由于SMA肌肉病理是由内在缺陷和去神经诱导事件定义的,我们开始确定其中哪些可能影响SMA肌肉中Tweak和Fn14的调节异常。我们首先通过进行神经挤压实验来解决去神经成分,在该实验中,P7 WT小鼠的坐骨神经被挤压,并在P14 [gydF4y2Ba46gydF4y2Ba].值得注意的是,只有一个后肢的坐骨神经被压碎,而另一个对照后肢完好无损。TA肌肉肌纤维面积的定量显示,与对照组后肢相比,神经挤压肌的肌纤维大小显著减小(图2)。gydF4y2Ba3.gydF4y2Baa - c)。gydF4y2Ba
在断奶前小鼠去神经(神经挤压)肌肉中,Tweak和Fn14没有失调。在出生后第7天(p7) WT FVB/N小鼠进行坐骨神经挤压,并在P14时收获同侧(神经挤压)和对侧(对照)TA肌肉。gydF4y2Ba一个gydF4y2Ba对照和神经挤压TA肌苏木精和伊红染色的代表性图像。比例尺,100 μm。gydF4y2BabgydF4y2Ba对照肌纤维区和神经挤压TA肌。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3-6只,不配对gydF4y2BatgydF4y2Ba以及,gydF4y2BapgydF4y2Ba= 0.0020。gydF4y2BacgydF4y2Ba对照和神经挤压TA肌肌纤维大小分布。gydF4y2BadgydF4y2BaqPCR分析gydF4y2Ba小清蛋白gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba,gydF4y2BaPgc-1αgydF4y2Ba,gydF4y2BaMef2dgydF4y2Ba,gydF4y2BaGlut-4gydF4y2Ba,gydF4y2BaHKIIgydF4y2Ba,gydF4y2BaKlf15gydF4y2Ba,gydF4y2BaSmngydF4y2Ba控制和神经挤压TA肌。将每个基因的归一化相对表达量与对照肌肉进行比较。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组4-6只动物,双向方差分析,未校正Fisher’s LSD, ns,不显著gydF4y2Ba
表达分析进一步显示,mRNA水平无明显变化gydF4y2Ba小清蛋白gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba,gydF4y2BaPGC-1αgydF4y2Ba,gydF4y2BaMefd2gydF4y2Ba,gydF4y2BaGlut-4gydF4y2Ba而且gydF4y2BaHKIIgydF4y2Ba与对照TA肌相比,去神经的肌肉中有明显的变化(图2)。gydF4y2Ba3.gydF4y2Bad).有趣的是,虽然先前有报道称成人肌肉去神经会导致Fn14表达的急剧增加[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba],这在我们断奶前小鼠的去神经肌肉中没有发生,这表明这种反应与年龄和/或发育调节因素有关。的表达gydF4y2BaKlf15gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba同样观察到神经挤压肌和对照肌之间没有显著差异(图2)。gydF4y2Ba3.gydF4y2Bad).为了确保我们的结果不受神经挤压后肌肉神经再生的影响,我们通过进行神经切割来重复实验。我们观察到,在断奶前小鼠中完全去TAs神经并没有显著影响mRNA的表达gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba,gydF4y2BaPGC-1αgydF4y2Ba,gydF4y2BaMefd2gydF4y2Ba,gydF4y2BaGlut-4gydF4y2Ba,gydF4y2BaHKIIgydF4y2Ba而且gydF4y2BaKlf15gydF4y2Ba与未受伤对照组后肢相比(补充图。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
总的来说,这些结果表明,在疾病进展过程中,SMA肌肉中parvalbumin、Tweak、Fn14和拟议的代谢效应物的调节异常很可能不是去神经依赖性的。gydF4y2Ba
内在肌肉损伤在肌肉发育早期影响Tweak和Fn14gydF4y2Ba
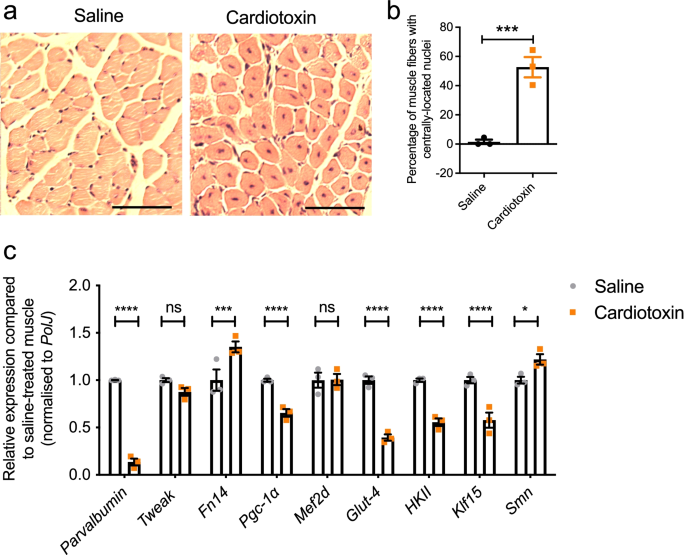
接下来,我们调查了削弱内在肌肉完整性会对Tweak和Fn14产生什么影响。为此,我们使用心脏毒素诱导肌纤维坏死。P10 WT小鼠左TA注射心脏毒素,右TA注射等量0.9%生理盐水作为对照。TAs在6天后收获,此时肌肉仍处于不成熟和再生模式[gydF4y2Ba47gydF4y2Ba].事实上,对位于中心位置的细胞核的分析显示,与盐碱处理的TAs相比,心脏毒素处理的肌肉再生肌纤维的百分比显著增加。gydF4y2Ba4gydF4y2Baa - b)。gydF4y2Ba
在断奶前小鼠心脏毒素诱导的肌肉坏死中,Tweak和Fn14异常调节。在出生后第10天(P)左TA肌注射心脏毒素。右TA肌注射等量0.9%生理盐水。6 d后取TA肌。gydF4y2Ba一个gydF4y2Ba代表性图像苏木精和伊红染色的盐水和心脏毒素注射TA肌肉的横截面。比例尺,100 μm。gydF4y2BabgydF4y2Ba生理盐水和心脏毒素注射TA肌中细胞核位于中心的肌纤维百分比。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3只,不配对gydF4y2BatgydF4y2Ba——测试,gydF4y2BapgydF4y2Ba= 0.0020。gydF4y2BacgydF4y2BaqPCR分析gydF4y2Ba小清蛋白gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba,gydF4y2BaPgc-1αgydF4y2Ba,gydF4y2BaMef2dgydF4y2Ba,gydF4y2BaGlut-4gydF4y2Ba,gydF4y2BaHKIIgydF4y2Ba,gydF4y2BaKlf15gydF4y2Ba,gydF4y2BaSmngydF4y2Ba在盐水和心脏毒素注射的TA肌肉中。将每个基因的归一化相对表达量与盐水处理过的肌肉进行比较。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3只,双向方差分析,未校正Fisher’s LSD, ns,不显著,*gydF4y2BapgydF4y2Ba< 0.05, ***gydF4y2BapgydF4y2Ba< 0.001, ****gydF4y2BapgydF4y2Ba< 0.0001gydF4y2Ba
然后我们进行分子分析,观察到萎缩标志gydF4y2Ba小清蛋白gydF4y2Ba与盐水处理的TA肌肉相比,心脏毒素处理的TA肌肉明显下调(图2)。gydF4y2Ba4gydF4y2Bac)。gydF4y2BaFn14gydF4y2Ba心肌毒素损伤后mRNA表达显著增加(图;gydF4y2Ba4gydF4y2Bac),根据先前的研究,肌肉损伤条件激活Fn14 [gydF4y2Ba15gydF4y2Ba].相反,gydF4y2BaPgc-1αgydF4y2Ba,gydF4y2BaGlut-4gydF4y2Ba,gydF4y2BaHKIIgydF4y2Ba而且gydF4y2BaKlf15gydF4y2BamRNA水平明显下调(图;gydF4y2Ba4gydF4y2Bac),支持他们之前报道的对活动Tweak和Fn14的负面反应[gydF4y2Ba18gydF4y2Ba].有趣的是,gydF4y2Ba调整gydF4y2BamRNA表达保持不变(图;gydF4y2Ba4gydF4y2BaC),与之前关于成人肌肉心脏毒素损伤后上调的报道相反[gydF4y2Ba48gydF4y2Ba],表明骨骼肌在早期发育阶段有不同的反应。值得注意的是,gydF4y2BaSmngydF4y2Ba与盐水处理的TA肌肉相比,再生肌肉中的表达显著增加(图2)。gydF4y2Ba4gydF4y2Bac),可能是由于SMN在肌肉纤维再生过程中的作用[gydF4y2Ba49gydF4y2Ba].gydF4y2Ba
总之,这些结果表明,断奶前小鼠的固有肌肉损伤诱导了Tweak、Fn14和先前报道的代谢效应物的失调。然而,与SMA肌肉观察到的变化方向相反(图2)。gydF4y2Ba1gydF4y2BaB),可能是由于心脏毒素损伤后发生的坏死和再生事件[gydF4y2Ba50gydF4y2Ba],这些物质在SMA小鼠的肌肉中并不常见。gydF4y2Ba
肌肉中Smn、Tweak和Fn14之间的遗传相互作用gydF4y2Ba
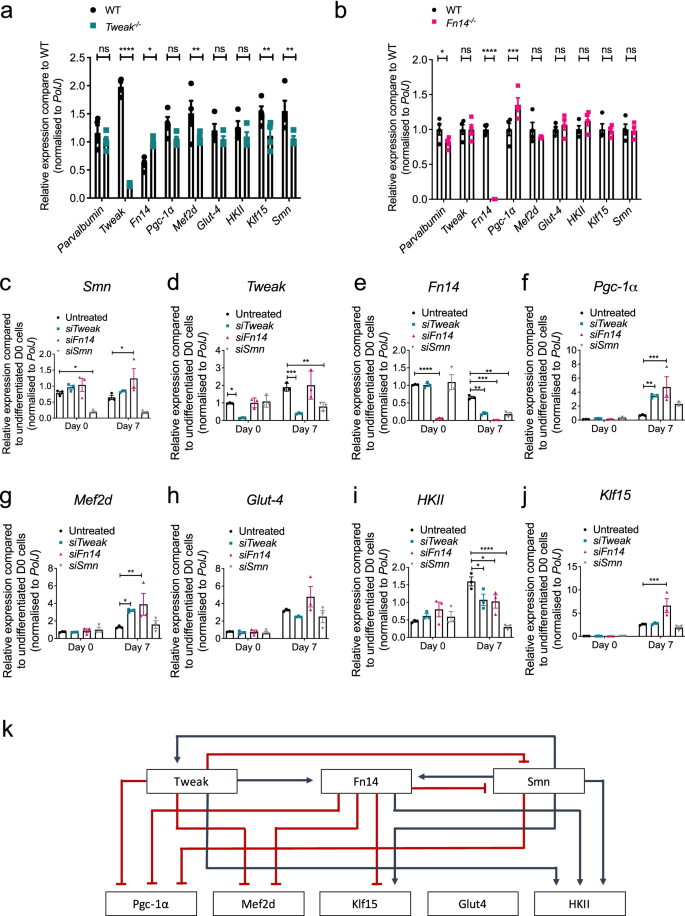
我们接下来想进一步了解的潜在关系表达异常gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba,gydF4y2BaSmngydF4y2Ba对SMA小鼠骨骼肌的影响为此,我们通过对P7肱三头肌进行分子分析,评估了Tweak和Fn14损耗在肌肉发育早期阶段的影响gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba和WT小鼠。在gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba小鼠,我们观察到的表达明显增加gydF4y2BaFn14gydF4y2Ba与此同时,表达显著降低gydF4y2BaKlf15gydF4y2Ba与WT动物相比(图;gydF4y2Ba5gydF4y2Baa).值得注意的是,我们发现gydF4y2BaSmngydF4y2Ba在gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba对比WT小鼠的肱三头肌(图;gydF4y2Ba5gydF4y2Baa),表明Tweak和Smn水平之间存在直接或间接的正向相互作用。对他们来说,gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba小鼠表现出明显的下调gydF4y2Ba小清蛋白gydF4y2Ba以及显著的上调gydF4y2BaPgc-1αgydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Bab).这些分析进一步支持先前报道的Fn14对Pgc-1α和Klf15表达的负面影响,以及在年轻人中缺乏明显的病理肌肉表型gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba老鼠(gydF4y2Ba15gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].gydF4y2Ba
SmngydF4y2Ba,gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba损耗影响彼此的表达。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BabgydF4y2BaqPCR分析gydF4y2Ba小清蛋白gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba,gydF4y2BaPgc-1αgydF4y2Ba,gydF4y2BaMef2dgydF4y2Ba,gydF4y2BaGlut-4gydF4y2Ba,gydF4y2BaHKIIgydF4y2Ba,gydF4y2BaKlf15gydF4y2Ba,gydF4y2BaSmngydF4y2Ba在出生后的第一天(P) 7gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba(gydF4y2BabgydF4y2Ba老鼠)。将每个基因的归一化相对表达量与WT进行比较。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组4只动物,双向方差分析,未校正Fisher’s LSD,gydF4y2BansgydF4y2Ba,不显著,*gydF4y2BapgydF4y2Ba< 0.05, ***gydF4y2BapgydF4y2Ba< 0.001, ****gydF4y2BapgydF4y2Ba< 0.0001。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2BajgydF4y2BaqPCR分析gydF4y2BaSmngydF4y2Ba(gydF4y2BacgydF4y2Ba),gydF4y2Ba调整gydF4y2Ba(gydF4y2BadgydF4y2Ba),gydF4y2BaFn14gydF4y2Ba(gydF4y2BaegydF4y2Ba),gydF4y2BaPgc-1αgydF4y2Ba(gydF4y2BafgydF4y2Ba),gydF4y2BaMef2dgydF4y2Ba(gydF4y2BaggydF4y2Ba),gydF4y2BaGlut-4gydF4y2Ba(gydF4y2BahgydF4y2Ba),gydF4y2BaHKIIgydF4y2Ba(gydF4y2Ba我gydF4y2Ba),gydF4y2BaKlf15gydF4y2Ba(gydF4y2BajgydF4y2Ba)在sirna介导的gydF4y2Ba调整gydF4y2Ba- - - - - -,gydF4y2BaFn14gydF4y2Ba- - - - - -,gydF4y2BaSmngydF4y2Ba-耗尽和控制增殖(第0天)和分化(第7天)C2C12细胞。第1天实验组归一化相对表达量与第1天实验组比较,第7天实验组归一化相对表达量与第7天实验组比较。数据为均值±SEM,gydF4y2BangydF4y2Ba每实验组= 3,双因素方差分析,Dunnett多重比较检验,*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001, ****gydF4y2BapgydF4y2Ba< 0.0001。gydF4y2BakgydF4y2Ba提出了Smn与Tweak/Fn14信号通路之间的关系模型。红线代表抑制,蓝线代表激活gydF4y2Ba
为了进一步解析肌源性分化过程中Smn、Tweak和Fn14之间的关系,我们进行了sirna介导的敲除gydF4y2BaSmngydF4y2Ba,gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba并评估了在未分化(第0天)和分化(第7天)细胞中对Tweak、Fn14和先前报道的代谢效应物表达的影响。降低的水平gydF4y2BaSmngydF4y2Ba,gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba在增殖细胞和分化细胞中均显著维持gydF4y2BasiSmngydF4y2Ba,gydF4y2BasiTweakgydF4y2Ba,gydF4y2BasiFn14gydF4y2Ba,分别(图;gydF4y2Ba5gydF4y2Ba一部)。我们观察到一种相互作用gydF4y2BaSmngydF4y2Ba,gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba特别是在分化的c2c12中,因此gydF4y2BaSmngydF4y2Ba表达显著上调gydF4y2BaFn14gydF4y2Ba-耗尽的D7细胞(图;gydF4y2Ba5gydF4y2Bac),gydF4y2Ba调整gydF4y2Ba表达明显降低gydF4y2BaSmngydF4y2Ba-耗尽的D7细胞(图;gydF4y2Ba5gydF4y2Bad)和gydF4y2BaFn14gydF4y2Ba水平显著降低gydF4y2Ba调整gydF4y2Ba- - -gydF4y2BaSmngydF4y2Ba-耗尽的D7细胞(图;gydF4y2Ba5gydF4y2Bae).同样,sirna介导的敲除gydF4y2BaSmngydF4y2Ba,gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba对代谢效应的影响仅在分化的c2c12中明显。gydF4y2Ba5gydF4y2Baf j)。的确,两者都击倒了gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba导致显著上调gydF4y2BaPgc-1αgydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Baf)和gydF4y2BaMef2dgydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Bag)。gydF4y2BaGlut-4gydF4y2Ba表达不受耗尽的影响gydF4y2BaSmngydF4y2Ba,gydF4y2Ba调整gydF4y2Ba,或gydF4y2BaFn14gydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Bah),gydF4y2BaHKIIgydF4y2Ba三种基因敲除后,mRNA水平显著降低(图。gydF4y2Ba5gydF4y2Ba我)。最后,gydF4y2BaKlf15gydF4y2Ba在sirna介导的基因敲除中表达显著增加gydF4y2BaFn14gydF4y2Ba(图。gydF4y2Ba5gydF4y2Baj).的上调gydF4y2BaPgc-1αgydF4y2Ba,gydF4y2BaMef2dgydF4y2Ba而且gydF4y2BaKlf15gydF4y2Ba在gydF4y2Ba调整gydF4y2Ba——和/或gydF4y2BaFn14gydF4y2Ba-耗尽分化的C2C12细胞与之前报道的这些基因在Tweak和Fn14活跃时下调,而在未变化时下调一致gydF4y2BaGlut-4gydF4y2Ba和表达下调gydF4y2BaHKIIgydF4y2Ba水平没有[gydF4y2Ba52gydF4y2Ba].gydF4y2Ba
因此,使用体内和体外模型,我们为两者之间的潜在相互作用提供了证据gydF4y2BaSmngydF4y2Ba,gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba以及对先前提出的下游代谢效应物的后续影响(图。gydF4y2Ba5gydF4y2Bak)。我们的研究结果表明,疾病进展过程中SMA肌肉中Tweak和Fn14的异常表达可能是由于肌肉特异性条件与骨骼肌早期发育阶段Smn、Tweak和Fn14表达减少的分子影响(个体和组合)之间的动态相互作用。gydF4y2Ba
SMA中肌病、肌生成基因和糖代谢基因的重叠,Fn14gydF4y2Ba−gydF4y2Ba/gydF4y2Ba−gydF4y2Ba和调整gydF4y2Ba−gydF4y2Ba/gydF4y2Ba−gydF4y2Ba老鼠gydF4y2Ba
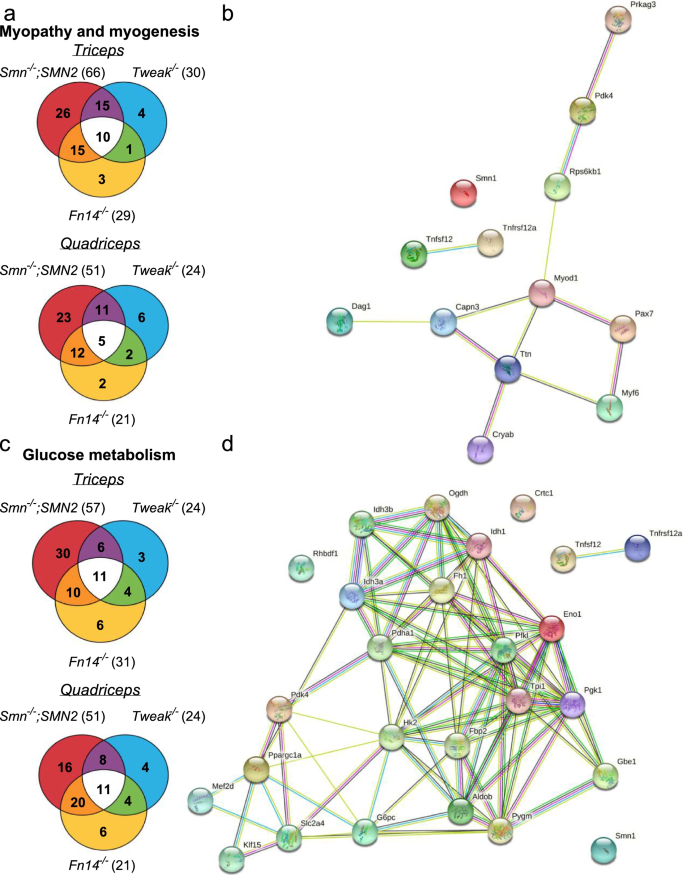
为了进一步解读Smn、Tweak和Fn14缺失对SMA肌肉病理的潜在贡献,我们使用了市上可用的小鼠肌病和肌生成qPCR阵列(SABiosciences),该阵列测量了已知显示和/或调节肌病和肌生成的84个基因亚群的表达水平。我们使用P7中的三头肌(脆弱)和股四头肌(抵抗)gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba老鼠。WT FVB/N小鼠与SMA动物比较,WT C57BL/6小鼠与SMA动物比较gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba以解释由于遗传菌株造成的差异。不出所料,我们在三头肌中观察到大量明显失调的肌病和肌生成基因gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba相比于抵抗力更强的四头肌,其中一些与异常表达的基因子集重叠gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba老鼠和gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba老鼠(图。gydF4y2Ba6gydF4y2Ba一、表gydF4y2Ba1gydF4y2Ba,补充文件gydF4y2Ba1gydF4y2Ba).我们还使用了公开可用的数据库STRING [gydF4y2Ba34gydF4y2Ba对三头肌和股四头肌中共享的差异表达基因进行网络和富集分析(表gydF4y2Ba1gydF4y2Ba),这表明任何失调基因与Smn、Fn14或Tweak之间都不存在已知的蛋白-蛋白相互作用(图。gydF4y2Ba6gydF4y2Bab).有趣的是,中央连接器gydF4y2BaMyod1gydF4y2Ba而且gydF4y2BaMyf6gydF4y2Ba在gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba老鼠和gydF4y2BaPax7gydF4y2Ba在所有三个实验组的三头肌中都被下调(表gydF4y2Ba1gydF4y2Ba).Myod1和Myf6是关键的肌源性调节因子(mrf),通常在骨骼肌损伤后上调[gydF4y2Ba53gydF4y2Ba].Pax7是卫星细胞(常驻骨骼肌干细胞)的典型标记物[gydF4y2Ba53gydF4y2Ba], Pax7活性降低导致卫星细胞周期阻滞和骨骼肌MRFs调节异常[gydF4y2Ba54gydF4y2Ba].此外,gydF4y2Ba肌gydF4y2Ba(gydF4y2BaTtngydF4y2Ba)在所有三种小鼠模型的股四头肌中都被下调,并在肌肉收缩和力量产生中发挥主要作用,突出表现为titin突变导致一系列骨骼肌疾病和表型[gydF4y2Ba55gydF4y2Ba].gydF4y2Ba
在骨骼肌中涉及肌病、肌生成和葡萄糖代谢的失调基因之间的重叠gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba老鼠。gydF4y2Ba一个gydF4y2Ba维恩图显示了参与肌病和肌生成的基因的重叠,这些基因在同一方向上明显失调(要么上调要么下调,gydF4y2BapgydF4y2Ba从出生后第7天开始,肱三头肌和股四头肌的含量均< 0.05)gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba小鼠到年龄和遗传菌株匹配野生型(WT)小鼠。gydF4y2BabgydF4y2BaP7型三头肌和/或四头肌肌病和肌生成基因显著失调重叠的网络和富集分析gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba小鼠使用STRING软件。Smn (Smn1)、TWEAK (Tnfsf12)和Fn14 (Tnfrsf12a)被纳入分析。彩色节点表示查询蛋白和交互器的第一层。填满的节点表示某些3D结构是已知的或预测的。节点之间的连接彩色线表示已知的相互作用(绿松石色:来自策展数据库,洋红色:实验确定),预测的相互作用(绿色:基因邻域,红色:基因融合,深蓝色:基因共现)或其他相互作用(黄色:文本挖掘,黑色:共表达,浅蓝色:蛋白质同源)。gydF4y2BacgydF4y2Ba维恩图显示了与葡萄糖代谢相关的基因重叠,这些基因在同一方向上明显失调(要么上调要么下调,gydF4y2BapgydF4y2Ba< 0.05)的三头肌和股四头肌gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba年龄和遗传菌株匹配的WT小鼠。gydF4y2BadgydF4y2BaP7型三头肌和/或四头肌肌病和肌生成基因显著失调重叠的网络和富集分析gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba小鼠使用STRING软件。Smn (Smn1)、TWEAK (Tnfsf12)、Fn14 (Tnfrsf12a)、HKII (Hk2)、Glut4 (Slc2a4)、Pgc-1α (Ppargc1a)、Klf15和Mef2d均纳入分析。彩色节点表示查询蛋白和交互器的第一层。填满的节点表示某些3D结构是已知的或预测的。节点之间的连接彩色线表示已知的相互作用(绿松石色:来自策展数据库,洋红色:实验确定),预测的相互作用(绿色:基因邻域,红色:基因融合,深蓝色:基因共现)或其他相互作用(黄色:文本挖掘,黑色:共表达,浅蓝色:蛋白质同源)gydF4y2Ba
其次,由于SMN、TWEAK和Fn14与糖代谢异常有关[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba56gydF4y2Ba],我们使用市售qPCR阵列(SABiosciences)进行了类似的基因表达分析,其中包含已知显示和/或调节葡萄糖代谢的84个基因子集。我们在三头肌和股四头肌中发现了相似数量的失调基因gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba小鼠,其中一些与那些差异表达的重叠gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba而且gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba老鼠(图。gydF4y2Ba6gydF4y2Bac,表gydF4y2Ba2gydF4y2Ba,补充文件gydF4y2Ba2gydF4y2Ba).STRING网络与富集分析[gydF4y2Ba34gydF4y2Ba]揭示了任何失调基因与Smn、Fn14或Tweak之间都不存在已知的蛋白-蛋白相互作用。gydF4y2Ba6gydF4y2Bad).进一步分析P7的三头肌和股四头肌中葡萄糖代谢基因组成的京都基因与基因组百科(KEGG)通路在同一方向上显著失调gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba而且gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba小鼠以及本项目研究的TWEAK/Fn14通路的下游效应物(Pgc-1α, Mef2d, Glut4, Klf15和HKII)揭示了葡萄糖代谢的许多方面,如胰岛素信号和糖酵解在Smn-, TWEAK -和Fn14缺失小鼠中调控异常(表2)gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
因此,我们显示了在SMA、Tweak- depletion和Fn14- depletion骨骼肌中调节肌生成、肌病和葡萄糖代谢的异常表达基因的共同模式,这表明Smn、Tweak和Fn14可能对SMA肌肉的肌肉病理和代谢缺陷起协同作用。gydF4y2Ba
Fc-TWEAK激动剂的管理改善了两个SMA小鼠模型的疾病表型子集gydF4y2Ba
最后,我们评估了增加Tweak活性对SMA小鼠疾病进展和肌肉病理的影响。gydF4y2Ba
值得注意的是gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba2 b / +gydF4y2Ba就寿命和繁殖能力而言,小鼠是健康的一窝伴侣,但它们的Smn水平降低,这本身已被证明会影响某些表型特征(例如,尾巴和耳朵坏死、代谢、基因表达)。因此,与之前的研究相似[gydF4y2Ba41gydF4y2Ba],在相同基因型的未处理和处理动物之间进行比较,使我们能够确定在不添加潜在复合因子的情况下,影响是否为sma依赖和/或-独立的。gydF4y2Ba
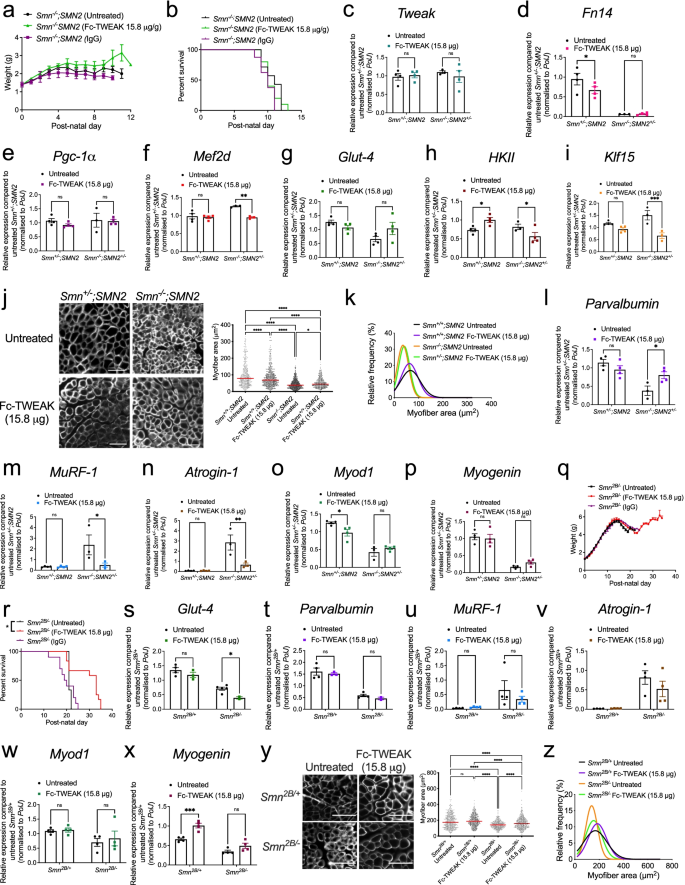
首先,gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba小鼠和健康的同窝小鼠每天皮下注射Fc- tweak (15.8 μg),这是一种与小鼠IgG2a Fc区域融合的蛋白[gydF4y2Ba26gydF4y2Ba],从出生开始。我们发现Fc-TWEAK对小鼠的体重和存活率没有显著影响gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba小鼠与未处理对照组和ig处理对照组比较(图;gydF4y2Ba7gydF4y2Baa - b)。另外,低剂量(7.9 μg)和高剂量(23和31.6 μg)也被证明对体重和存活率有负面影响(补充图)。gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
通过Fc-TWEAK增加Tweak活性可以改善两种SMA小鼠模型的疾病表型。gydF4y2Ba一个gydF4y2Ba未经处理的日重量gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2BaSMA小鼠和gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba每天皮下注射Fc-TWEAK(从P0开始)或IgG对照组(15.8 μg)。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组7-10只,双向方差分析,Sidak多重比较检验。gydF4y2BabgydF4y2Ba未处理的生存曲线gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2BaSMA小鼠和gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba每天皮下注射Fc-TWEAK或IgG对照组(15.8 μg)。数据用Kaplan-Meier生存曲线表示,gydF4y2BangydF4y2Ba=每实验组7-10只动物,log-rank (Mantel-Cox)。gydF4y2BacgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba.qPCR分析gydF4y2Ba调整gydF4y2Ba(gydF4y2BacgydF4y2Ba),gydF4y2BaFn14gydF4y2Ba(gydF4y2BadgydF4y2Ba),gydF4y2BaPgc-1αgydF4y2Ba(gydF4y2BaegydF4y2Ba),gydF4y2BaMef2dgydF4y2Ba(gydF4y2BafgydF4y2Ba),gydF4y2BaGlut-4gydF4y2Ba(gydF4y2BaggydF4y2Ba),gydF4y2BaHKIIgydF4y2Ba(gydF4y2BahgydF4y2Ba),gydF4y2BaKlf15gydF4y2Ba(gydF4y2Ba我gydF4y2Ba(P) 7未处理组和fc - tweak处理组(15.8 μg)gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2BaSMA和gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba健康的同胞。fc - tweak处理的归一化相对表达式gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba将小鼠与未治疗的小鼠进行比较gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba小鼠,以及fc - tweak处理的归一化相对表达gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba将小鼠与未治疗的小鼠进行比较gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba老鼠。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3-4只动物,双向方差分析,基因型间未校正Fisher’s LSD, *gydF4y2BapgydF4y2Ba< 0.05, ***gydF4y2BapgydF4y2Ba< 0.001。gydF4y2BajgydF4y2Bap7 -未处理组和fc - tweak (15.8 μg)处理组TA肌层蛋白染色的代表性图像gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2BaSMA和gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba健康窝仔(比例尺= 100 μm)和肌纤维面积定量。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3-4只动物(每实验组> 550条肌纤维),单因素方差分析,Tukey 's多重比较检验,*gydF4y2BapgydF4y2Ba< 0.05, ****gydF4y2BapgydF4y2Ba< 0.0001。gydF4y2BakgydF4y2Bap7未处理组和fc - tweak处理组(15.8 μg) TA肌肌纤维大小的相对频率分布gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2BaSMA和gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba健康的同胞。gydF4y2BalgydF4y2Ba- - - - - -gydF4y2BapgydF4y2BaqPCR分析gydF4y2Ba小清蛋白gydF4y2Ba(gydF4y2BalgydF4y2Ba),gydF4y2BaMuRF-1gydF4y2Ba(gydF4y2Ba米gydF4y2Ba),gydF4y2Baatrogin-1gydF4y2Ba(gydF4y2BangydF4y2Ba),gydF4y2BaMyod1gydF4y2Ba(gydF4y2BaogydF4y2Ba),gydF4y2BamyogeningydF4y2Ba(gydF4y2BapgydF4y2Ba)对p7未处理和fc - tweak处理后三头肌的影响(15.8 μg)gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2BaSMA和gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba健康的同胞。fc - tweak处理的归一化相对表达式gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba将小鼠与未治疗的小鼠进行比较gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba小鼠,以及fc - tweak处理的归一化相对表达gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba将小鼠与未治疗的小鼠进行比较gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba老鼠。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3-4只动物,双向方差分析,基因型间未校正Fisher’s LSD, *gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01。gydF4y2Ba问gydF4y2Ba未经处理的日重量gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2BaSMA小鼠和gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba每4天皮下注射Fc-TWEAK或IgG对照组(15.8 μg)(从P0开始)。数据为均值±SEM,gydF4y2BangydF4y2Ba每实验组= 9-12只动物,双向方差分析,Sidak多重比较检验。gydF4y2BargydF4y2Ba未处理的生存曲线gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2BaSMA小鼠和gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba每4天皮下注射Fc-TWEAK或IgG对照组(15.8 μg)(从P0开始)。数据是Kaplan-Meier生存曲线,gydF4y2BangydF4y2Ba=每实验组9-12只,log-rank (Mantel-Cox),gydF4y2BapgydF4y2Ba= 0.0162。gydF4y2Ba年代gydF4y2Ba- - - - - -gydF4y2BaxgydF4y2Ba.qPCR分析gydF4y2BaGlut-4gydF4y2Ba(gydF4y2Ba年代gydF4y2Ba),gydF4y2Ba小清蛋白gydF4y2Ba(gydF4y2BatgydF4y2Ba),gydF4y2BaMuRF-1gydF4y2Ba(gydF4y2BaugydF4y2Ba),gydF4y2Baatrogin-1gydF4y2Ba(gydF4y2BavgydF4y2Ba),gydF4y2BaMyod1gydF4y2Ba(gydF4y2BawgydF4y2Ba),gydF4y2BamyogeningydF4y2Ba(gydF4y2BaxgydF4y2Ba)在P15未处理和fc - tweak处理后(15.8 μg)gydF4y2BaSmngydF4y2Ba2 b / +gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba小鼠(从P0开始每4天)。fc - tweak处理的归一化相对表达式gydF4y2BaSmngydF4y2Ba2 b / +gydF4y2Ba将小鼠与未治疗的小鼠进行比较gydF4y2BaSmngydF4y2Ba2 b / +gydF4y2Ba小鼠,以及fc - tweak处理的归一化相对表达gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba将小鼠与未治疗的小鼠进行比较gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba老鼠。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3-4只动物,双向方差分析,基因型间未校正Fisher’s LSD, *gydF4y2BapgydF4y2Ba< 0.05, ***gydF4y2BapgydF4y2Ba< 0.001, ns,不显著。gydF4y2BaygydF4y2BaP16未处理组和fc - twist处理组(从P0开始每4天15.8 μg) TA肌肉层胶蛋白染色横切面的代表性图像gydF4y2BaSmngydF4y2Ba2 b / +gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba小鼠(比例尺= 50 μm)及肌纤维面积定量。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3-7只动物(每实验组> 400条肌纤维),单因素方差分析,Tukey 's多重比较检验,*gydF4y2BapgydF4y2Ba< 0.05, ****gydF4y2BapgydF4y2Ba< 0.0001。gydF4y2BazgydF4y2BaP16未处理组和fc - pinch处理组(从P0开始每4天15.8 μg) TA肌肌纤维大小的相对频率分布gydF4y2BaSmngydF4y2Ba2 b / +gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba老鼠gydF4y2Ba
p7未处理和fc - tweak处理的三头肌(15.8 μg)gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2BaSMA小鼠和gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba对健康窝仔进行进一步处理,进行Tweak/Fn14通路的分子分析。我们观察到Fc-TWEAK给药不影响的表达gydF4y2Ba调整gydF4y2Ba(无花果。gydF4y2Ba7gydF4y2Bac)或gydF4y2BaFn14gydF4y2Ba(无花果。gydF4y2Ba7gydF4y2BaD,两者都不是。gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba也不gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba将小鼠与未处理的动物进行比较。同样地,Fc-TWEAK没有引起gydF4y2BaPgc-1αgydF4y2Ba表达式(无花果。gydF4y2Ba7gydF4y2Bae).我们确实观察到gydF4y2BaMef2dgydF4y2Ba在fc - tweak处理过的肌肉中gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2BaSMA小鼠与未治疗动物的比较(图;gydF4y2Ba7gydF4y2Baf)。gydF4y2BaGlut-4gydF4y2Ba两组mRNA表达均保持不变gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Bafc - tweak处理小鼠(图;gydF4y2Ba7gydF4y2Bag)。gydF4y2BaHKIIgydF4y2Ba在fc - tweak处理后的肌肉中显著上调gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba; SMN2gydF4y2Ba而fc - tweak处理组则显著下调gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2BaSMA小鼠与未治疗组比较(图;gydF4y2Ba7gydF4y2Bah)。gydF4y2BaKlf15gydF4y2Ba在fc - tweak处理后显著下调gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2BaSMA小鼠仅与未治疗的SMA动物进行比较。gydF4y2Ba7gydF4y2Bai). Tweak、Fn14和先前报道的下游代谢效应物的表达没有明显变化,可能是由于最后一次Fc-TWEAK注射和组织收获之间有24小时的时间间隔,这可能导致错过转录特征受到显著影响的关键时间点。gydF4y2Ba
虽然我们没有捕捉到Fc-TWEAK给药的短期分子效应,但对TA肌肉中肌纤维面积的定量分析显示,每日Fc-TWEAK治疗可显著增加P7骨骼肌中的肌纤维面积gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba与未处理的SMA动物相比(图;gydF4y2Ba7gydF4y2Baj - k)。此外,萎缩标志物的表达gydF4y2Ba小清蛋白gydF4y2Ba,gydF4y2BaMuRF-1gydF4y2Ba而且gydF4y2Baatrogin-1gydF4y2Ba[gydF4y2Ba57gydF4y2Ba]也恢复到正常水平,因此gydF4y2Ba小清蛋白gydF4y2Ba表达显著增加(图;gydF4y2Ba7gydF4y2Bal),而gydF4y2BaMuRF-1gydF4y2Ba而且gydF4y2Baatrogin-1gydF4y2Ba表达明显下调(图;gydF4y2Ba7gydF4y2Bam-n)在fc - tweak处理的三头肌gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba与未治疗的SMA小鼠相比,进一步支持肌肉健康的改善。然而,我们没有检测到mrf的变化gydF4y2BaMyod1gydF4y2Ba而且gydF4y2BamyogeningydF4y2Ba[gydF4y2Ba53gydF4y2Ba(图。gydF4y2Ba7gydF4y2Bao-p)。gydF4y2Ba
我们接下来评估Fc-TWEAK在gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba这些小鼠通常对smn非依赖性治疗策略更敏感[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba].由于这些小鼠的治疗周期较长(20天),并且在每日注射的小鼠中观察到毒性(> 10天)gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba2 b / +gydF4y2Ba小鼠从出生开始,每4天皮下注射Fc-TWEAK和对照组IgG (15.8 μg)。IgG和Fc-TWEAK对小鼠体重无显著影响gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba与未处理的SMA动物相比(图;gydF4y2Ba7gydF4y2Baq).然而,Fc-TWEAK显著提高了gydF4y2BaSmngydF4y2Ba2 bgydF4y2Ba/−gydF4y2Ba小鼠与未加igg处理和未加igg处理的小鼠比较(图;gydF4y2Ba7gydF4y2Bar).的mRNA水平的分子分析gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba先前报道的P15动物三头肌分子效应物仅显示Fc-TWEAK对的表达有显著影响gydF4y2BaGlut-4gydF4y2Ba在fc - tweak处理中,它被下调gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba与未处理的小鼠相比(图;gydF4y2Ba7gydF4y2Bas).与上述相似,Fc-TWEAK对P15动物中Tweak、Fn14和先前报道的代谢效应物表达的有限影响可能是由于Fc-TWEAK最后一次注射与组织收获之间有72小时的时间间隔。选择这种实验范式是为了遵循最佳给药方案,并在不太接近疾病终末期的症状时间点进行分子分析。然而,为了确定在Fc-TWEAK注射和组织收获之间的较短时间间隔内是否可以捕捉到分子变化,并确定在表达100% Smn的WT组织中对Fc-TWEAK的反应是否不同,我们处理了WT和gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba从出生到P16,每4天用Fc-TWEAK (15.8 μg)注射一次,注射后3h收获骨骼肌。而gydF4y2BaFn14gydF4y2Ba在WT和SMA小鼠的三头肌中,mRNA的表达保持不变(补充图。gydF4y2Ba4gydF4y2Baa),我们发现其他代谢效应因子的差异表达模式被认为是受Tweak和Fn14的影响。事实上,在Fc-TWEAK注射之后,gydF4y2Ba调整gydF4y2BamRNA在WT动物中显著升高,在gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba小鼠(补充图;gydF4y2Ba4gydF4y2Bab)。gydF4y2BaPGC-1agydF4y2Ba而且gydF4y2BaMef2dgydF4y2Ba在WT动物中没有变化,而在gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba小鼠(补充图;gydF4y2Ba4gydF4y2Bac - d),而gydF4y2BaGlut-4gydF4y2Ba,gydF4y2BaHKIIgydF4y2Ba而且gydF4y2BaKlf15gydF4y2Ba在WT动物中显著增加,在gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba动物(补充图)gydF4y2Ba4gydF4y2Baeg)。类似地,我们观察到fc - tweak处理的WT动物中NF-κB2 p100成分与未处理对照组相比有特异性下降(所有其他成分不变),而fc - tweak处理的动物中NF-κB2 p100成分显著上调gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba与未处理的小鼠相比(补充图;gydF4y2Ba4gydF4y2Bah)。gydF4y2Ba
在fc - tweak治疗组观察到肌肉健康参数的改善gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba我们在SMA小鼠中进行了类似的研究gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba老鼠。与更严重的小鼠模型相反,我们没有发现任何显著变化的表达水平gydF4y2Ba小清蛋白gydF4y2Ba,gydF4y2BaMuRF-1gydF4y2Ba,gydF4y2Baatrogin-1gydF4y2Ba而且gydF4y2Bamyod1gydF4y2Ba在既不gydF4y2BaSmngydF4y2Ba2 b / +gydF4y2Ba或gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Bafc - tweak处理的动物(图;gydF4y2Ba7gydF4y2Ba线性调频)。我们确实观察到gydF4y2BamyogeningydF4y2Ba仅fc - tweak处理的健康窝仔的mRNA表达(图2)。gydF4y2Ba7gydF4y2Bax).这些结果表明Fc-TWEAK对与肌肉健康相关的分子标记的影响可能取决于年龄、疾病严重程度和/或遗传菌株。尽管Fc-TWEAK对肌肉萎缩和健康标志物没有影响,但TA肌肉肌纤维面积的量化显示Fc-TWEAK治疗后肌肉尺寸显著增加gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba与未处理的SMA动物相比(图;gydF4y2Ba7gydF4y2Ba- z)。gydF4y2Ba
虽然MuRF-1和atrogin1是很好的萎缩标记物[gydF4y2Ba57gydF4y2Ba],其表达在骨骼肌中已有较好的特征gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba在疾病进展过程中不同时间点的小鼠[gydF4y2Ba61gydF4y2Ba],也有证据表明它们可以由Tweak/Fn14信号级联诱导[gydF4y2Ba24gydF4y2Ba].因此,我们研究了它们在P7的股四头肌和三头肌中的水平gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba小鼠(补充图;gydF4y2Ba5gydF4y2Ba)并找到它gydF4y2Baatrogin-1gydF4y2Ba与WT动物相比,水平没有变化(补充图。gydF4y2Ba5gydF4y2Ba一个),gydF4y2BaMuRF-1gydF4y2Ba肌肉的水平明显下降gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba与之前报道的Tweak/Fn14活性与MuRF-1表达呈正相关(补充图。gydF4y2Ba5gydF4y2Bab) (gydF4y2Ba24gydF4y2Ba].这些结果表明,降低的水平gydF4y2BaMuRF-1gydF4y2Ba在fc - tweak治疗的SMA小鼠骨骼肌中观察到的最可能与改善肌肉健康有关。此外,Fc-TWEAK对基因表达的差异影响gydF4y2BaMuRF-1gydF4y2Ba而且gydF4y2Baatrogin-1gydF4y2Ba在gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba很可能是由于先前报道的不同的调节过程导致了两种模型中的肌肉萎缩[gydF4y2Ba61gydF4y2Ba].gydF4y2Ba
综上所述,我们的研究结果表明,促进SMA小鼠的Tweak活性有可能改善体重、存活率和肌肉病理,这表明恢复SMA肌肉中的Tweak和Fn14信号通路可能会带来持续的治疗益处。gydF4y2Ba
讨论gydF4y2Ba
SMA运动神经元死亡与肌肉病理相互影响。的确,尽管运动神经元的丧失显著地促进了肌肉萎缩,但也有证据表明,SMA骨骼肌的肌肉内源性异常可能是由SMN缺乏直接或间接引起的[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba].在本研究中,我们试图通过研究TWEAK和Fn14在SMA肌肉萎缩中的作用,来探讨导致SMA肌肉病理的肌肉内在异常的潜在机制。据我们所知,这是第一个在SMA和肌肉发育早期阶段评估TWEAK和Fn14通路的研究。gydF4y2Ba
值得注意的是,表达减少gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba在疾病进展过程中,两种不同的SMA小鼠模型的骨骼肌中出现了明显的变化,这与先前关于成人肌肉萎缩实验模型中TWEAK/Fn14活性增加的报道相反[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba],表明TWEAK和Fn14在骨骼肌发育和成人期可能有不同的作用。的确,gydF4y2Ba调整gydF4y2Ba与90日龄的动物相比,30日龄WT小鼠骨骼肌中的mRNA表达显著降低,表明存在年龄依赖性调控[gydF4y2Ba16gydF4y2Ba].此外,我们观察到断奶前小鼠骨骼肌中TWEAK、Fn14和先前提出的代谢效应因子的失调似乎受到固有肌肉损伤的影响,而不是去神经支配,这与先前在成人肌肉去神经支配实验模型中报道的结果相反[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba],进一步表明Tweak和Fn14在骨骼肌中有不同的发育作用。考虑到来自年轻小鼠的肌肉比来自老年小鼠的肌肉更能抵抗手术诱导的去神经支配[gydF4y2Ba67gydF4y2Ba], TWEAK和Fn14可能导致肌肉对病理性损伤的年龄依赖性差异。因此,TWEAK/Fn14信号通路在肌肉病理中的作用可能更加微妙,并受到多种因素的综合影响,如绝对水平、激活的下游信号级联(如典型与非典型NF-κB信号通路)、肌肉发育阶段、肌肉萎缩状态(如慢性与急性)和肌肉病理的主要起源(如去神经与内在损伤)[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].gydF4y2Ba
我们研究的另一个关键观察结果是Tweak、Fn14和Smn及其下游肌肉信号级联之间的潜在相互作用和/或重叠。此前已有研究表明,一旦Tweak与Fn14结合,该复合物将激活多个NF-κB分子效应物,包括TRAF6和IKK [gydF4y2Ba68gydF4y2Ba].有趣的是,SMN已被报道可阻止TRAF6和IKK的激活,从而负向调节肌肉萎缩诱导的典型NF-κB通路[gydF4y2Ba69gydF4y2Ba].因此,这些研究表明TWEAK、Fn14和Smn在肌肉中的作用趋同,我们的研究结果进一步支持了这一点。事实上,我们发现这是独立的gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba而且gydF4y2BaSmngydF4y2Ba在分化的C2C12细胞和小鼠肌肉中相互影响。此外,SMA中肌生成障碍、肌病和葡萄糖代谢基因存在重叠,gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba而且gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba老鼠。值得注意的是,在年轻的gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba−/gydF4y2Ba−gydF4y2Ba这支持了先前关于Fn14在肌肉发生过程中独立于tweak的作用的报道[gydF4y2Ba70gydF4y2Ba].因此,这些结果表明,SMA肌肉中TWEAK和Fn14的异常表达可能是肌肉萎缩和SMN表达减少共同作用的结果。然而,Smn损耗很可能需要达到病理水平,因为我们没有观察到非sma低形骨骼肌中Tweak/Fn14信号通路的明显变化gydF4y2BaSmngydF4y2Ba2 b / 2 bgydF4y2Ba而且gydF4y2BaSmngydF4y2Ba+ /−gydF4y2Ba老鼠。进行全基因组RNA测序研究也有助于阐明由TWEAK、Fn14和SMN调节的共享基因和通路的程度。事实上,虽然我们专注于先前报道和提出的代谢效应因子和NF-κB通路的子集,但已知与Tweak、Fn14和Smn有功能相互作用的其他典型通路,如MAPK信号通路,也可能在肌肉健康中发挥趋同作用[gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba].gydF4y2Ba
此外,我们在发育小鼠中的结果支持先前报道的代谢因子Pgc-1α、Mef2d、Glut-4、Klf15和HKII在成人肌肉中的负调控[gydF4y2Ba18gydF4y2Ba].对特定糖代谢基因子集的进一步分析表明,这些基因中约有20%在同一方向上失调gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba和SMA小鼠。我们对这些共同的失调代谢基因进行KEGG分析,进一步支持了TWEAK、Fn14和SMN参与葡萄糖代谢调节的潜在关系和作用。事实上,AMPK信号通路,被发现异常调节在gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba和SMA,是骨骼肌功能和代谢的主要调节因子[gydF4y2Ba73gydF4y2Ba].有趣的是,之前的一项研究gydF4y2BaSMNΔ7gydF4y2BaSMA小鼠进一步表明,AMPK激动剂AICAR的慢性治疗可预防骨骼肌病理[gydF4y2Ba74gydF4y2Ba].此外,AMPK直接磷酸化PGC-1α [gydF4y2Ba75gydF4y2Ba],这也是失调的gydF4y2BaSmngydF4y2Ba- - - - - -,gydF4y2Ba调整gydF4y2Ba- - -gydF4y2BaFn14gydF4y2Ba-耗尽模型[gydF4y2Ba66gydF4y2Ba,gydF4y2Ba76gydF4y2Ba].我们还发现,糖酵解和丙酮酸代谢途径,最终产生ATP,在SMA中也失调,gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba而且gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba老鼠。有趣的是,siRNA-mediatedgydF4y2BaSmngydF4y2Ba在NSC-34细胞中,敲低显示ATP产量显著下降[gydF4y2Ba77gydF4y2Ba].ATP也降低gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba小鼠和Smn变形斑马鱼[gydF4y2Ba78gydF4y2Ba].这些结果可以解释SMA患者的线粒体功能障碍[gydF4y2Ba5gydF4y2Ba].因此,我们的研究加强了代谢功能障碍导致SMA肌肉病理的概念,并提出了与TWEAK/Fn14通路的潜在机制联系。gydF4y2Ba
然而,重要的是要注意,虽然我们的发现支持的想法,异常的表达gydF4y2BaPgc-1αgydF4y2Ba,gydF4y2BaMef2dgydF4y2Ba,gydF4y2BaGlut-4gydF4y2Ba,gydF4y2BaKlf15gydF4y2Ba而且gydF4y2BaHKIIgydF4y2Ba是由于表达的失调gydF4y2Ba调整gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba在SMA肌肉中,需要进一步的机制洞察,以充分了解在发育后肌肉中通过TWEAK/Fn14信号通路对这些关键代谢效应因子的转录调控程度。事实上,他们的差异失调gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba,gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba,gydF4y2Ba调整gydF4y2Ba−−/gydF4y2Ba而且gydF4y2BaFn14gydF4y2Ba−−/gydF4y2Ba肌肉以及Fc-Tweak注射对其表达水平的不同影响表明,额外的调节机制可能有助于我们的观察。gydF4y2Ba
我们的研究结果还证实,并非所有骨骼肌在SMA中都受到同样的影响。的确,我们观察到SMA骨骼肌萎缩标志gydF4y2Ba小清蛋白gydF4y2Ba在脆弱的三头肌和腓肠肌中,与抵抗力较强的TA肌和股四头肌相比,在较早的时间点显著下降。值得注意的是,我们还发现在更脆弱的三头肌中,20%的肌肉发生和肌病相关基因被失调gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba与抵抗性股四头肌相比。相反,SMA三头肌和股四头肌中糖代谢异常基因数量无显著差异。先前的研究报道,肌肉易损性与NMJ去神经的关系比与位置或纤维类型的组成更密切[gydF4y2Ba35gydF4y2Ba].我们的结果进一步表明,在脆弱的SMA肌肉中,去神经事件对肌生成和肌病的影响比对葡萄糖代谢的影响更显著。gydF4y2Ba
最后,在两只SMA小鼠模型中通过Fc-TWEAK调节Tweak活动,得到了有趣的观察结果。首先,Fc-TWEAK的施用特别增加了轻度小鼠的寿命gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba小鼠模型,而在严重时不影响疾病进展gydF4y2BaSmngydF4y2Ba−−/gydF4y2Ba; SMN2gydF4y2Ba老鼠。这与之前的研究是一致的,包括我们的研究,表明gydF4y2BaSmngydF4y2Ba2 b /−gydF4y2Ba小鼠对非smn干预反应更强,可能是由于它们的无症状期较长,因此适应性较强[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba,gydF4y2Ba79gydF4y2Ba].在分子水平上,我们发现Fc-TWEAK对蛋白的表达有不同的影响gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba以及先前提出的代谢效应子在SMA小鼠和健康窝仔中的时间依赖性方式,可能反映了该途径的疾病状态依赖性调节机制。重要的是,的表达gydF4y2BaMef2dgydF4y2Ba,gydF4y2BaHKIIgydF4y2Ba而且gydF4y2BaKlf15gydF4y2Ba在fc - Tweak处理的SMA小鼠中显著下调,支持了小鼠中Tweak活性的增加以及随后异常表达的Tweak/Fn14效应物恢复到正常水平。如上所述,Fc-TWEAK给药和组织收集之间的时间可能限制了我们对Fc-TWEAK对Tweak/Fn14信号级联作用的分析。此外,我们将重点放在先前报道的代谢效应物的特定子集上(gydF4y2BaPgc-1αgydF4y2Ba,gydF4y2BaMef2dgydF4y2Ba,gydF4y2BaGlut-4gydF4y2Ba,gydF4y2BaKlf15gydF4y2Ba而且gydF4y2BaHKIIgydF4y2Ba)可能也导致我们无法完整地了解Fc-TWEAK对分子的影响。事实上,Fc-TWEAK可能影响了与肌发生、肌病和葡萄糖代谢PCR阵列等鉴定的共享异常表达基因的表达gydF4y2BaPax7gydF4y2Ba而且gydF4y2Ba肌gydF4y2Ba以及上述通路(如MAPK和AMPK)。然而,Fc-TWEAK确实改善了SMA小鼠的肌肉病理,肌肉健康和肌纤维大小的分子标记的部分恢复证明了这一点。这些结果支持TWEAK/Fn14通路在维持骨骼肌健康和稳态中的作用[gydF4y2Ba12gydF4y2Ba].然而,值得注意的是,TWEAK/Fn14通路参与了许多其他组织和病理,如肿瘤发展和转移,心脏相关疾病[gydF4y2Ba80gydF4y2Ba]、肾损伤、脑缺血[gydF4y2Ba81gydF4y2Ba,gydF4y2Ba82gydF4y2Ba]和自身免疫性疾病[gydF4y2Ba83gydF4y2Ba,gydF4y2Ba84gydF4y2Ba],这可能影响了系统性给药Fc-TWEAK对SMA小鼠肌肉健康和疾病进展的整体影响。gydF4y2Ba
结论gydF4y2Ba
总之,我们的结果提示了TWEAK/Fn14通路在SMA肌肉肌病和葡萄糖代谢紊乱中的潜在作用和贡献。此外,我们的研究结合了以前在成人模型中的工作[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba],提出肌肉中TWEAK/Fn14信号通路的失调似乎依赖于肌肉病理的起源(例如去神经与内在)和骨骼肌的发育阶段(例如新生儿、青少年、成人、老年),进一步强调了该通路的差异和冲突活动。因此,未来的研究应旨在进一步了解Tweak/Fn14通路在SMA肌肉中的相关性,并确定其在整个生命过程中维持肌肉稳态的一般作用。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在本研究过程中产生或分析的所有数据均包含在本文或补充信息中。gydF4y2Ba
缩写gydF4y2Ba
- 肌萎缩性侧索硬化症:gydF4y2Ba
-
肌萎缩性侧索硬化症gydF4y2Ba
- 方差分析:gydF4y2Ba
-
方差分析gydF4y2Ba
- 互补脱氧核糖核酸:gydF4y2Ba
-
互补的脱氧核糖核酸gydF4y2Ba
- 度:gydF4y2Ba
-
不同表达的基因gydF4y2Ba
- DMEM:gydF4y2Ba
-
杜尔贝科的改良鹰的媒体gydF4y2Ba
- 的边后卫:gydF4y2Ba
-
胎牛血清gydF4y2Ba
- 罗斯福:gydF4y2Ba
-
错误发现率gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- ):gydF4y2Ba
-
苏木精和伊红gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因与基因组百科全书gydF4y2Ba
- 信使rna:gydF4y2Ba
-
信使核糖核酸gydF4y2Ba
- NF -κB:gydF4y2Ba
-
核因子kappa-活化B细胞的轻链增强剂gydF4y2Ba
- NMJ:gydF4y2Ba
-
神经肌肉接头gydF4y2Ba
- 病人:gydF4y2Ba
-
产后一天gydF4y2Ba
- pgydF4y2Ba:gydF4y2Ba
-
概率值gydF4y2Ba
- PBS:gydF4y2Ba
-
磷酸盐gydF4y2Ba
- 聚合酶链反应:gydF4y2Ba
-
聚合酶链反应gydF4y2Ba
- PFA:gydF4y2Ba
-
多聚甲醛gydF4y2Ba
- qPCR:gydF4y2Ba
-
定量聚合酶链反应gydF4y2Ba
- 里帕:gydF4y2Ba
-
RadioimmunoprecipitationgydF4y2Ba
- RNA:gydF4y2Ba
-
核糖核酸gydF4y2Ba
- RNAi:gydF4y2Ba
-
RNA干扰gydF4y2Ba
- RT-qPCR:gydF4y2Ba
-
逆转录定量PCRgydF4y2Ba
- 扫描电镜:gydF4y2Ba
-
均值的标准误差gydF4y2Ba
- 核:gydF4y2Ba
-
小干扰RNAgydF4y2Ba
- SMA:gydF4y2Ba
-
脊髓性肌萎缩gydF4y2Ba
- 字符串:gydF4y2Ba
-
检索相互作用的基因/蛋白质的搜索工具gydF4y2Ba
- 助教:gydF4y2Ba
-
胫骨前gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
参考文献gydF4y2Ba
Miniño AM,徐杰,Kochanek KD。《国家生命统计报告》第59卷第2期(2010年12月9日);2008.gydF4y2Ba
列斐伏尔S, Bürglen L,雷波列S,克莱蒙特O,波列P,维奥列L,等。脊髓肌萎缩决定基因的鉴定和特征。细胞。1995;80:155 - 65。gydF4y2Ba
杜学文,孙文杰。儿童脊髓性肌萎缩的神经生物学研究。神经生物学杂志1996;3:97-110。gydF4y2Ba
swowboda KJ, Prior TW, Scott CB, McNaught TP, Wride MC, Reyna SP,等。SMA去神经的自然史:与年龄、SMN2拷贝数和功能的关系。安。神经。2005;57:704-12。gydF4y2Ba
Ripolone M, Ronchi D, Violano R, Vallejo D, fagolari G, Barca E,等。脊髓性肌萎缩损伤的肌肉线粒体生物发生和肌肉生成。美国国立卫生研究院公共获取。2015;72:666-75gydF4y2Ba
Shafey D, Côté PD, Kothary R.低胚性Smn敲低C2C12成肌细胞显示成肌细胞融合和肌管形态的内在缺陷。文献出版社,2005;311:49-61gydF4y2Ba
王志刚,王志刚,王志刚。代谢综合征与骨骼肌代谢的关系。安医学。2006;38:389-402。gydF4y2Ba
李志强,李志强,李志强。脊髓性肌萎缩症代谢功能障碍的研究进展。国际分子化学杂志,2021;gydF4y2Ba
张志刚,张志刚,张志刚。运动神经元疾病中骨骼肌缺损的研究进展。前沿物理。2013;4:356前沿媒体SA。gydF4y2Ba
Carmona Arana JA, Seher A, Neumann M, Lang I, Siegmund D, Wajant H. TNF受体相关因子1是可溶性TWEAK的主要靶点。前沿免疫。2014;5:63gydF4y2Ba
Enwere EK, Lacasse EC, Adam NJ, Korneluk RG。TWEAK-Fn14-cIAP1-NF-κB信号轴在肌肉生成和肌肉稳态调节中的作用前沿免疫2014;5:34。gydF4y2Ba
帕斯科AL,约翰斯顿AJ,墨菲RM。TWEAK-Fn14信号通路在骨骼肌萎缩和再生中的争议。中国生物医学工程学报,2015;26(4):366 - 366。gydF4y2Bahttps://doi.org/10.1007/s00018-020-03495-xgydF4y2Ba.gydF4y2Ba
Merritt EK, Thalacker-Mercer A, Cross JM, Windham ST, Thomas SJ, Bamman MM.非烧伤人骨骼肌严重烧伤后atrogene和TWEAK家族成员表达增加。J烧伤护理Res Off Publ Am烧伤协会2013;34:e297-304。gydF4y2Ba
Meighan-Mantha RL, Hsu DK,郭勇,Brown SA,冯立林,Peifley KA,等。丝裂原诱导的Fn14基因编码I型跨膜蛋白,调节成纤维细胞的粘附和迁移。中国生物化学杂志,1999;gydF4y2Ba
米塔尔A, Bhatnagar S, Kumar A, lachi - triilieff E, wters S, Li H,等。TWEAK-Fn14系统是小鼠去神经诱导骨骼肌萎缩的关键调节因子。中国生物医学工程学报(英文版)。2010;gydF4y2Ba
鲍尔曼M,萨尔萨克C, Coque E, Eiselt É, Deschaumes RG, Brodovitch A,等。Tweak调节肌萎缩性侧索硬化症小鼠模型中的星形胶质细胞增生、微胶质细胞增生和骨骼肌萎缩。胡姆·摩尔·热奈。2015;24:3440-56。gydF4y2Ba
PGC-1共激活因子和骨骼肌在健康和疾病中的适应性。Curr Opin Genet Dev. 2008; 18:426-34。gydF4y2Ba
Sato S, Ogura Y, Tajrishi MM, Kumar A.骨骼肌中TWEAK水平升高促进内脏肥胖,胰岛素抵抗和代谢功能障碍。中国生物医学工程学报。2015;29:988-1002。gydF4y2Ba
Roberts DJ, Miyamoto S.己糖激酶II集成能量代谢和细胞保护:Akting线粒体和TORCing自噬。细胞死亡差异。2015;22:248-57。gydF4y2Ba
范玲,谢pn, Sweet DR, Jain MK. Krüppel-like因子15:BCAA代谢和昼夜蛋白节律性的调节因子。Pharmacol res 2018; 130:123-6。gydF4y2Ba
Wood MJA, Talbot K, Bowerman M.脊髓性肌萎缩:反义寡核苷酸疗法打开了一扇通往综合治疗景观的大门。《中国科学》2017;26:R151-9。gydF4y2Ba
谢丽敏,张建国,钟玉军,吴明明,王乃明,蔡超,等。脊髓性肌萎缩的小鼠模型。Nat Genet, 2000; 24:66-70。gydF4y2Ba
Bowerman M, Murray LM, Beauvais A, Pinheiro B, Kothary R.小鼠中关键的smn阈值决定了与独特的神经肌肉连接病理学相关的中间性脊髓性肌萎缩表型的发生。神经肌肉失调NMD。2012; 22:263 - 76。gydF4y2Ba
Sato S, Ogura Y, Kumar A. TWEAK/Fn14信号轴介导骨骼肌萎缩和代谢功能障碍。前沿免疫2014;5:18。gydF4y2Ba
刘志强,李志强,李志强,等。遗传背景对脊髓性肌萎缩症小鼠模型表型的影响。Hum Mol Genet. 2016; 25:4494-506。gydF4y2Ba
Campbell S, Burkly LC, Gao H-X, Berman JW, Su L, Browning B,等。TWEAK/Fn14相互作用对肾小球系膜细胞的促炎作用。中华免疫杂志,1950;2006(6):889 - 898。gydF4y2Ba
Jakubowski A, Ambrose C, Parr M, Lincecum JM, Wang MZ,郑涛,等。TWEAK诱导肝祖细胞增殖。中国临床投资杂志,2005;gydF4y2Ba
李志强,李志强,李志强,等。SAHA改善了两种脊髓性肌萎缩小鼠模型的SMA表型。胡姆·摩尔·热奈,2010;19:1492-506。gydF4y2Ba
张志刚,张志刚,张志刚,等。斐济:生物图像分析的开源平台。自然出版集团,2012;9:676-82gydF4y2Ba
黄志伟,张志伟,张志伟,等。小鼠营养不良肌源性细胞的连续传代和分化。自然出版集团。1977;270:725-7gydF4y2Ba
Cashman NR, Durham HD, blush ztajn JK, Oda K, Tabira T, Shaw IT,等。成神经细胞瘤×脊髓(NSC)杂交细胞系类似于发育中的运动神经元。Dev Dyn. 1992; 194:209-21。gydF4y2Ba
Pfaffl兆瓦。一种新的实时RT-PCR相对定量数学模型。核酸决议2001;29:45e-45牛津大学出版社。gydF4y2Ba
radoniic A, Thulke S, Mackay IM, Landt O, Siegert W, Nitsche A.实时荧光定量PCR的参考基因选择指南。生物化学与生物物理学报,2004;13:856 - 62。gydF4y2Ba
许志强,李志强,李志强,等。2017年的STRING数据库:质量控制的蛋白质-蛋白质关联网络,广泛可访问。核酸研究,2017;45:D362-8。gydF4y2Ba
凌kky, Gibbs RM,冯智,Ko C-PC-P。脊髓性肌萎缩小鼠模型中临床相关肌肉的严重神经肌肉失神经。Hum Mol Genet, 2012; 21:185-95。gydF4y2Ba
Boyer JG, Murray LM, Scott K, De Repentigny Y, Renaud J-M, Kothary R.脊髓性肌萎缩小鼠模型的早发性肌无力和肌肉蛋白破坏。《骨骼肌》2013;3:24。gydF4y2Ba
Boyer JG, Deguise M-O, Murray LM, Yazdani A, De Repentigny Y, Boudreau-Larivière C,等。肌源性程序失调是脊髓性肌萎缩的发病机制之一。胡姆·摩尔·热内特。2014;23:4249-59。gydF4y2Ba
李文敏,李志强,李志强。失神经骨骼肌中小白蛋白免疫组化的研究。神经病理学杂志1994;20:495-500。gydF4y2Ba
Müntener M, Berchtold MW, Heizmann CW。交叉神经移植和去神经支配的肌肉中的小白蛋白。肌肉神经。1985;8:132-7。gydF4y2Ba
Mutsaers CA, Wishart TM, Lamont DJ, Riessland M, Schreml J, Comley LH,等。脊髓性肌萎缩骨骼肌可逆分子病理学研究。Hum Mol Genet, 2011; 20:4334-44。gydF4y2Ba
Walter LM, Deguise M-O, Meijboom KE, Betts CA, Ahlskog N, van Westering TLE,等。针对glucocorticoid-Krüppel-like因子15支链氨基酸信号通路的干预措施改善脊髓性肌萎缩小鼠的疾病表型。EBioMedicine。2018; 31:226-42。gydF4y2Ba
Li H, Mittal A, Paul PK, Kumar M, Srivastava DS, Tyagi SC,等。肿瘤坏死因子相关的弱凋亡诱导因子通过激活核因子-κ b诱导激酶和p38丝裂原活化蛋白激酶,增加骨骼肌中基质金属蛋白酶9 (MMP-9)的产生。中国生物医学工程学报。2009;gydF4y2Ba
Varfolomeev E, Goncharov T, Maecker H, Zobel K, Kömüves LG, Deshayes K,等。细胞凋亡抑制因子是TNF受体家族成员激活NF-κB和MAPK的全局调节因子。科学通报。2012;5:ra22。gydF4y2Ba
李勇,姜杰,傅利民,叶杰,柯瓦连科,等。鉴定一种细胞蛋白(FIP-3)作为NF-B活性的调节剂和一种腺病毒抑制肿瘤坏死因子诱导的凋亡的靶点。国家科学研究院,1999;96:1042-7。gydF4y2Ba
Bowerman M, Michalski J-P, Beauvais A, Murray LM, DeRepentigny Y, Kothary R.与典型脊髓性肌萎缩神经肌肉病理学无关的smn缺失小鼠胰腺发育和糖代谢缺陷。Hum Mol Genet. 2014; 23:3432-44。gydF4y2Ba
马吉尔CK,佟a,川村D,林林A, Hunter DA, Parsadanian A,等。坐骨神经挤压伤后胫骨前神经的再生:转基因小鼠的共聚焦显微镜研究。《神经科学》2007;207:64-74gydF4y2Ba
闫震,崔松,刘旭,张敏,Schageman JJ,李世永,等。小鼠骨骼肌再生的高度协调基因调控。美国生物化学与分子生物学学会。2003;278:8826-36。gydF4y2Ba
Mittal A, Bhatnagar S, Kumar A, Paul PK, Kuang S, Kumar A. TWEAK基因消融促进小鼠骨骼肌再生和损伤后生长。Am J Pathol. 2010; 177:1732-42。gydF4y2Ba
卡瑞亚,奥比斯,加龙,阿凯,塞拉,岩田,等。在神经肌肉连接处成熟过程中对生存增强运动神经元蛋白的需求。《临床投资杂志》,2014;gydF4y2Ba
盖瑞,安东尼·ML,盖瑞·DJ。心脏毒素所致损伤与骨骼肌再生。入:编辑Kyba M。骨骼肌再生小鼠方法Protoc。纽约:施普林格;2016.p . 61 - 71。[引2020年5月28日]。gydF4y2Bahttps://doi.org/10.1007/978-1-4939-3810-0_6gydF4y2Ba.gydF4y2Ba
王敏,王志强,王志强,等。TWEAK通过其受体Fn14,是间充质祖细胞和骨骼肌再生的一种新型调节剂。Embo j . 2006; 25:5826-39。gydF4y2Ba
Shuichi Sato YOMMTAK, Sato S, Ogura Y, Tajrishi MM, Kumar A.骨骼肌中TWEAK水平升高促进内脏肥胖,胰岛素抵抗和代谢功能障碍。FASEB J Off Publ Fed Am Soc Exp Biol。美国社会联合会。《生物工程学报》2015;29:988-1002。gydF4y2Ba
H殷,F Price, MA Rudnicki。卫星细胞和肌肉干细胞生态位。Physiol Rev. 2013; 93:23-67。gydF4y2Ba
冯马尔赞J,琼斯AE,帕克斯RJ,鲁德尼克MA。Pax7对成人骨骼肌卫星细胞的正常功能至关重要。中国科学院学报(自然科学版),2013;gydF4y2Ba
王晓明,王晓明,王晓明,王晓明,等。肌肽突变在神经肌肉疾病中的作用。神经肌肉杂志2016;3:293-308 IOS出版社。gydF4y2Ba
Bowerman M, Swoboda KJ, Michalski J-P, Wang ggs, Reeks C, Beauvais A,等。脊髓性肌萎缩的糖代谢与胰腺缺陷。安神经。2012;72:256-68。gydF4y2Ba
李志强,李志强,李志强,等。骨骼肌萎缩所需的泛素连接酶的鉴定。科学,2001;294:1704-8美国科学促进会。gydF4y2Ba
鲍曼M,博韦A, Anderson CL, Kothary R. rho激酶失活延长了中度SMA小鼠模型的生存期。Hum Mol Genet, 2010; 19:1468-78。gydF4y2Ba
Kaifer KA, Villalón E, Osman EY, Glascock JJ, Arnold LL, Cornelison DDW,等。在脊髓性肌萎缩的小鼠模型中,Plastin-3延长了生存期并降低了严重程度。2017;2:e89970。gydF4y2Ba
Osman EY, Rietz A, Kline RA, Cherry JJ, Hodgetts KJ, Lorson CL,等。一种新型药物样化合物的腹腔内递送改善了重度和中度脊髓性肌萎缩小鼠模型的疾病严重程度。科学通报2019;9:1633。gydF4y2Ba
Deguise M-O, Boyer JG, McFall ER, Yazdani A, De Repentigny Y, Kothary R.脊髓性肌萎缩小鼠模型肌肉萎缩通路的差异诱导。科学通报2016;6:28846。gydF4y2Ba
Martínez-Hernández R, Soler-Botija C, Also E, Alias L, Caselles L, Gich I,等。脊髓性肌萎缩肌管的发育模式表明产前肌肉成熟延迟。神经病理学杂志,2009;68:474-81牛津大学出版社。gydF4y2Ba
Martínez-Hernández R, Bernal S,别名L, Tizzano EF。肌肉受累的早期标记物异常支持脊髓性肌萎缩的肌生成延迟。神经病理学杂志,2014;73:559-67牛津大学出版社。gydF4y2Ba
Rajendra TK, Gonsalvez GB, Walker MP, Shpargel KB, Salz HK, Matera AG。脊髓性肌萎缩果蝇模型揭示了SMN在横纹肌中的功能。中国生物医学工程学报,2007;gydF4y2Ba
刘浩,彭浩,向华,郭林,陈锐,赵松,等。TWEAK/Fn14通过内皮细胞AMPK/PGC-1α/MnSOD信号通路促进氧化应激。17:1998-2004 Spandidos出版物。gydF4y2Ba
印度语SM, Mishra V, Bhatnagar S, Tajrishi MM, Ogura Y, Yan Z,等。骨骼肌萎缩过程中TWEAK-Fn14系统和PGC-1α的调节回路中国生物医学工程学报。2014;28:1398-411。gydF4y2Ba
Murray LM, Comley LH, Gillingwater TH, Parson SH.神经肌肉连接对损伤的反应是发育调节的。王晓明,2011;25:1306-13。gydF4y2Ba
Kumar A, Bhatnagar S, Paul PK. TWEAK和TRAF6调节骨骼肌萎缩。Curr Opin clinalnutr Metab Care. 2012; 15:233-9 NIH公共访问。gydF4y2Ba
金凯,崔永杰。SMN1是traf6介导的NF-κB信号通路的新型抑制剂。生物物理学报,2017;1864:760-70gydF4y2Ba
Dogra C, Hall SL, Wedhas N, Linkhart TA, Kumar A.成纤维细胞生长因子诱导14 (Fn14)是肌源性调节因子表达和成肌细胞向肌管分化所必需的。Fn14在肌生成过程中独立于tweak功能的证据。中国生物化学杂志,2007;gydF4y2Ba
Li H, Mittal A, Paul PK, Kumar M, Srivastava DS, Tyagi SC,等。肿瘤坏死因子相关的细胞凋亡弱诱导剂通过激活核因子kapab诱导激酶和p38丝裂原激活蛋白激酶增强骨骼肌中基质金属蛋白酶9 (MMP-9)的产生:MMP-9在肌病中的潜在作用。中国生物医学工程学报。2009;gydF4y2Ba
Farooq F, Balabanian S, Liu X, Holcik M, MacKenzie A. p38丝裂原活化蛋白激酶通过RNA结合蛋白HuR稳定SMN mRNA。Hum Mol Genet, 2009; 18:4035-45。gydF4y2Ba
J øbsted R, Hingst JR, Fentz J, Foretz M, Sanz M- n, Pehmøller C,等。AMPK在骨骼肌功能和代谢中的作用。FASEB J Off Publ Fed Am Soc Exp biology, 2018; 32:1741-77。gydF4y2Ba
Cerveró C, Montull N, Tarabal O, Piedrafita L, Esquerda JE, Calderó J. AMPK激动剂AICAR的慢性治疗可预防骨骼肌病理,但未能改善严重脊髓性肌萎缩小鼠模型的临床结果。神经医生J Am Soc Exp神经医生。2016;13:198-216施普林格。gydF4y2Ba
伊尔彻一世,柳比西奇五世,科万AF,胡德DA。骨骼肌细胞中amp激活蛋白激酶调节的PGC-1α启动子的激活。露西亚·A,编辑。科学通报。2008;3:e3614。gydF4y2Ba
吴雪峰,王志强,王志强,等。运动诱导下脊髓性肌萎缩样小鼠骨骼肌运动神经元表达的研究。《物理学报》2019;597:4757-78。gydF4y2Ba
李志强,李志强,李志强,李志强,等。脊髓性肌萎缩神经细胞模型中的线粒体功能障碍。中华神经科学杂志,2009;37(3):344 - 344。gydF4y2Ba
Boyd PJ, Tu W-Y, Shorrock HK, Groen EJN, Carter RN, Powis RA,等。生物能量状态调节脊髓性肌萎缩斑马鱼模型中运动神经元易损性和发病机制。编辑Cox GA。公共科学图书馆。2017;13:e1006744。gydF4y2Ba
Bowerman M, Murray LM, Boyer JG, Anderson CL, Kothary R. Fasudil改善脊髓性肌萎缩小鼠模型的生存率和促进骨骼肌发育。BMC医学2012;10:24。gydF4y2Ba
Jain M, Jakubowski A,崔玲,史俊,苏玲,Bauer M,等。肿瘤坏死因子样细胞凋亡弱诱导因子(TWEAK)在心功能障碍和心力衰竭发展中的新作用。循环。2009;119:2058 - 68。gydF4y2Ba
张志刚,张志刚,张志刚,等。细胞因子TWEAK及其受体Fn14在缺血性中风中的诱导作用中华神经科学杂志(英文版);2008;gydF4y2Ba
王文杰,吴峰,王文杰,王文杰,等。肿瘤坏死因子样凋亡弱诱导剂和成纤维细胞生长因子诱导14介导脑缺血诱导的多聚(adp -核糖)聚合酶-1激活和神经元死亡。神经科学。2010;171:1256 - 64。gydF4y2Ba
山名J,莫兰EF,马纳布T, Sunahori K,高杉K,牧野H,等。在类风湿性关节炎成纤维细胞滑膜细胞中通过TWEAK-Fn14相互作用抑制tnf诱导的IL-6。中国生物医学工程杂志,2012;gydF4y2Ba
El-shehaby A, Darweesh H, El-Khatib M, Momtaz M, Marzouk S, El-Shaarawy N,等。尿生物标志物、肿瘤坏死因子样细胞凋亡弱诱导因子(TWEAK)、骨保护素(OPG)、单核细胞趋化蛋白-1 (MCP-1)和IL-8与狼疮性肾炎的相关性中华临床免疫杂志,2011;31(2):348 - 356。gydF4y2Ba
确认gydF4y2Ba
我们要感谢牛津大学BMS设施和基尔大学BSU设施的工作人员。gydF4y2Ba
资金gydF4y2Ba
KEM由MDUK和SMA信托(现在的SMA UK)资助。MB由SMA信托基金会(现为SMA UK)和爱尔兰肌肉萎缩症/MRCG-HRB (MRCG-2016-21)资助。SK获得了ERASMUS赠款的支持。个人电脑得到了德国Muskelstiftung的财政支持。RK由加拿大卫生研究所和肌肉萎缩症协会(美国)资助。ERS由MDUK奖学金(18GRO-PS48-0114)资助。EM由医学科学院资助(SBF006/1162)gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
概念化,MB;方法学、KEM、ERS和MB;验证、KEM和M;形式化分析,KEM, RS, EM, EM, SK, MB;KEM、ERS、EM、MDA、B、SK、IT、IB、GH、NA、MB;写作-初稿准备,KEM和MB;写作-审查和编辑,KEM, ERS, EM, EM, DA, BE, SK, IT, IB, GH, NA, PC, KED, RK, MJAW, MB;可视化、KEM、ERS、EM、MB;监督、PC、KED、RK、MJAW、MB;项目管理,MB; funding acquisition, RK, MJAW, and MB. The authors read and approved the final manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
活体动物实验程序由牛津大学伦理委员会和英国内政部(当前项目许可证PDFEDC6F0,以前的项目许可证30/2907)根据1986年《动物(科学程序)法》授权和批准,Keele大学动物福利伦理审查机构和英国内政部(项目许可证P99AB3B95)根据1986年《动物(科学程序)法》批准。渥太华大学动物保护委员会根据加拿大动物保护委员会和德国动物福利法授权的程序,并得到下萨克森州消费者保护和食品安全办公室(LAVES,参考编号15/1774和19/3309)的批准。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:补充图1。gydF4y2Ba
非sma低形态smn缺失小鼠骨骼肌中Tweak和Fn14无明显异常。qPCR分析gydF4y2Ba调整gydF4y2Ba(一),gydF4y2BaFn14gydF4y2Ba(b),gydF4y2BaPgc-1αgydF4y2Ba(c),gydF4y2BaMef2dgydF4y2Ba(d),gydF4y2Ba过剩,gydF4y2Ba4 (e),gydF4y2BaHKIIgydF4y2Ba(f)和gydF4y2BaKlf15gydF4y2Ba(g)产后(P) 7野生型(WT)的三头肌,gydF4y2BaSmngydF4y2Ba2 b / 2 bgydF4y2Ba而且gydF4y2BaSmngydF4y2Ba+/-gydF4y2Ba老鼠。归一化相对表达式与WT比较。数据为均数±SEM,gydF4y2BangydF4y2Ba=每实验组4-5只,单因素方差分析,Tukey 's多重比较检验,*gydF4y2BapgydF4y2Ba< 0.05, ns =不显著。gydF4y2Ba补充图2。gydF4y2Ba在断奶前小鼠的去神经(神经切断)肌肉中,Tweak和Fn14没有失调。在出生后第7天(p7) WT FVB/N小鼠进行坐骨神经切断,并在P14时收获同侧(神经切断)和对侧(对照)TA肌肉。qPCR分析gydF4y2Ba调整gydF4y2Ba,gydF4y2BaFn14gydF4y2Ba,gydF4y2BaPgc-1αgydF4y2Ba,gydF4y2BaMef2dgydF4y2Ba,gydF4y2BaGlut-4gydF4y2Ba,gydF4y2BaHKIIgydF4y2Ba而且gydF4y2BaKlf15gydF4y2Ba控制和神经切断TA肌。将每个基因的归一化相对表达量与对照肌肉进行比较。数据为均值±SEM,gydF4y2BangydF4y2Ba每实验组= 7-11只动物,双向方差分析,未校正Fisher’s LSD, ns =不显著。gydF4y2Ba补充图3。gydF4y2Ba不同Fc-TWEAK剂量对疾病进展的影响gydF4y2BaSmngydF4y2Ba-/-gydF4y2Ba; SMN2gydF4y2BaSMA老鼠。gydF4y2BaSmngydF4y2Ba-/-gydF4y2Ba; SMN2gydF4y2Ba小鼠接受每日皮下注射增加剂量的Fc-TWEAK(7.9, 15。23.7 μg和31.6 μg)。a.未处理的日重量gydF4y2BaSmngydF4y2Ba-/-gydF4y2Ba; SMN2gydF4y2BaSMA小鼠和gydF4y2BaSmngydF4y2Ba-/-gydF4y2Ba; SMN2gydF4y2Ba每天皮下注射Fc-TWEAK(7.9、15.8、23.7和31.6 μg)(从P0开始)的小鼠。数据为均值±SEM,gydF4y2BangydF4y2Ba每实验组= 5-10只动物,双向方差分析,Sidak多重比较检验。b.未处理的生存曲线gydF4y2BaSmngydF4y2Ba-/-gydF4y2Ba; SMN2gydF4y2BaSMA小鼠和gydF4y2BaSmngydF4y2Ba-/-gydF4y2Ba; SMN2gydF4y2Ba每天皮下注射Fc-TWEAK(7.9、15.8、23.7和31.6 μg)(从P0开始)的小鼠。数据以Kaplan-Meier生存曲线表示,gydF4y2BangydF4y2Ba=每实验组5-10只动物,Log-rank (mantle - cox)。gydF4y2Ba补充图4。gydF4y2BaFc-TWEAK在野生型和野生型骨骼肌中的差异作用gydF4y2BaSmngydF4y2Ba2 b / -gydF4y2Ba老鼠。WT和gydF4y2BaSmngydF4y2Ba2 b / -gydF4y2BaSMA小鼠每4天皮下注射Fc-TWEAK (15.8 μg)(从出生日(p0)至P16),注射后3小时取骨骼肌。g。qPCR分析gydF4y2BaFn14gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),gydF4y2Ba调整gydF4y2Ba(gydF4y2BabgydF4y2Ba),gydF4y2BaPgc-1αgydF4y2Ba(gydF4y2BacgydF4y2Ba),gydF4y2BaMef2dgydF4y2Ba(gydF4y2BadgydF4y2Ba),gydF4y2BaGlut-4gydF4y2Ba(gydF4y2BaegydF4y2Ba),gydF4y2BaHKIIgydF4y2Ba(gydF4y2BafgydF4y2Ba),gydF4y2BaKlf15gydF4y2Ba(gydF4y2BaggydF4y2Ba)在未处理和fc - tweak处理的三头肌中gydF4y2BaSmngydF4y2Ba2 b / -gydF4y2Ba老鼠。将fc - tweak处理的WT小鼠的归一化相对表达量与未处理的WT小鼠进行比较,并将fc - tweak处理的归一化相对表达量进行比较gydF4y2BaSmngydF4y2Ba2 b / -gydF4y2Ba将小鼠与未治疗的小鼠进行比较gydF4y2BaSmngydF4y2Ba2 b / -gydF4y2Ba老鼠。数据为均值±SEM,gydF4y2BangydF4y2Ba=每实验组3-5只动物,双向方差分析,未校正Fisher’s LSD, *gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001, ****gydF4y2BapgydF4y2Ba< 0.0001, ns =不显著。gydF4y2BahgydF4y2Ba.症状晚期股四头肌NF-κB2 p100蛋白归一化至总蛋白水平的定量研究(P18)gydF4y2BaSmngydF4y2Ba2 b / -gydF4y2Ba小鼠和年龄匹配的WT动物。图像是具有代表性的免疫印迹。数据为均值±SEM,gydF4y2BangydF4y2Ba= 3-5只/实验组gydF4y2Ba,gydF4y2Ba未配对gydF4y2BatgydF4y2Ba测试中,gydF4y2BapgydF4y2Ba= 0.0005 (wt),gydF4y2BapgydF4y2Ba= 0.0494。gydF4y2Ba补充图5。gydF4y2Ba减少gydF4y2BaMuRF-1gydF4y2BaP7在骨骼肌中的表达gydF4y2BaFn14gydF4y2Ba-/-gydF4y2Ba老鼠。qPCR分析gydF4y2BaAtrogin-1gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),gydF4y2BaMuRF-1gydF4y2Ba(gydF4y2BabgydF4y2Ba)的股四头肌和三头肌(P) 7野生型(WT)和gydF4y2BaFn14gydF4y2Ba-/-gydF4y2Ba老鼠。归一化相对表达式与WT比较。数据为均数±SEM,gydF4y2BangydF4y2Ba=每实验组4只,不配对gydF4y2BatgydF4y2Ba测试中,gydF4y2Bap =gydF4y2Ba0.0164 (gydF4y2BaMuRF-1gydF4y2Ba股四头肌),gydF4y2BapgydF4y2Ba= 0.0283 (gydF4y2BaMuRF-1gydF4y2Ba肱三头肌),ns =不显著。gydF4y2Ba
附加文件2:补充表1。gydF4y2Ba
用于实时定量PCR的小鼠引物。gydF4y2Ba
补充文件3:补充文件1。gydF4y2Ba
出生后第7天三头肌和四头肌肌病及肌生基因表达的变化gydF4y2BaSmngydF4y2Ba-/-gydF4y2Ba; SMN2gydF4y2Ba(SMA),gydF4y2Ba调整gydF4y2Ba-/-gydF4y2Ba(调整KO)和gydF4y2BaFn14gydF4y2Ba-/-gydF4y2Ba;(Fn14 KO)与年龄和遗传菌株匹配的野生型动物相比。gydF4y2Ba
补充文件4:补充文件2。gydF4y2Ba
出生后第7天三头肌和四头肌糖代谢基因表达的变化gydF4y2BaSmngydF4y2Ba-/-gydF4y2Ba; SMN2gydF4y2Ba(SMA),gydF4y2Ba调整gydF4y2Ba-/-gydF4y2Ba(调整KO)和gydF4y2BaFn14gydF4y2Ba-/-gydF4y2Ba;(Fn14 KO)与年龄和遗传菌株匹配的野生型动物相比。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
梅杰布姆,k.e.,萨顿,e.r.,麦卡良,E。gydF4y2Baet al。gydF4y2Ba脊髓性肌萎缩小鼠骨骼肌中Tweak和Fn14的调节异常。gydF4y2Ba骨骼肌gydF4y2Ba12gydF4y2Ba, 18(2022)。https://doi.org/10.1186/s13395-022-00301-zgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13395-022-00301-zgydF4y2Ba
关键字gydF4y2Ba
- 脊髓性肌萎缩gydF4y2Ba
- 存活运动神经元gydF4y2Ba
- SmngydF4y2Ba
- 调整gydF4y2Ba
- Fn14gydF4y2Ba
- 葡萄糖代谢gydF4y2Ba
- 骨骼肌gydF4y2Ba
- 萎缩gydF4y2Ba
- 去神经gydF4y2Ba