摘要
骨骼肌干细胞在肌肉生长和再生中起着核心作用。它们以静止细胞的形式存在于静止的肌肉中,在对损伤做出反应时,它们会短暂地放大和融合以产生新的肌纤维或自我更新以补充干细胞库。Notch是调控所有这些过程的关键信号通路。尽管胚胎肌小体、成体肌膜/基底膜间期和再生肌肉之间在解剖结构和细胞生态位上存在重大差异,Notch信号传导已经进化到支持肌肉细胞的特定环境要求。在这篇综述中,我们讨论了Notch信号因子和其他修饰伙伴在肌肉干细胞生命周期中起作用的不同方式,以建立自适应动态网络。
背景
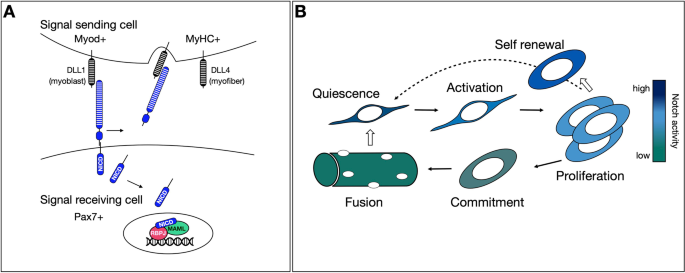
除了囊胚的形态发生和三个胚层(外胚层、内胚层和中胚层)的建立之外[1, Notch信号几乎参与了迄今为止所研究的所有组织的形成,并且毫不奇怪,它已成为干细胞功能的主要调节因子。Notch是一种高度保守的跨膜质质受体,介导细胞间的通讯。与小鼠Notch受体(哺乳动物中的Notch-1, -2, -3 -4)类似,其配体(哺乳动物中的Delta-like (DLL) -1, -4和Jagged (JAG)-1, -2)也是跨膜蛋白,因此通路的激活需要物理细胞间相互作用(请注意独联体受体/配体相互作用主要是抑制性的[2,3.]而分泌的、裂解的配体在体内似乎没有活性[4,5])。Notch是为数不多的质膜受体之一,与白细胞共同抗原相关受体酪氨酸磷酸酶(LAR)、淀粉样前体蛋白和受体酪氨酸激酶受体ERBB4一起作为细胞表面受体和转录因子[6,7].在配体触发的膜内蛋白水解之后,Notch (NICD)的细胞内结构域被切割并易位到细胞核中,在那里它作为转录辅激活物[8,9].在那里NICD与CSL形成复合物(脊椎动物为RBPJ,苍蝇为Su(H),蛔虫为Lag-1)并稳定与DNA的结合以诱导基因表达[10,11,12(图。1一个)。
肌源性进展和自我更新中的Notch信号通路。一个小鼠肌肉细胞Notch信号通路的基本方案。该受体在干细胞/祖细胞(信号接收细胞)上表达较高,而DLL配体在已形成的成肌细胞和成熟肌纤维(信号发送细胞)上表达较高。配体-受体相互作用触发膜内蛋白水解和Notch (NICD)胞内结构域的释放。NICD然后转位到细胞核中,在那里它与它的主要下游效应物和DNA结合转录因子RBPJ以及协激活因子策划样(MAML)家族成员形成复合物。三蛋白NICD转录复合物招募额外的辅激活子和组蛋白修饰子来激活转录,这里不简单说明。B在MuSC激活和肌生成过程中,Notch信号活性下调。静止的MuSCs具有较高的Notch活性(颜色键为深蓝色),这维持了Pax7,抑制Myod而且Myogenin表达式。在MuSC激活后,Notch活性立即迅速下降,细胞表达MYOD,加速s期进入。在增殖阶段,高Notch活性仅限于某些细胞,这些细胞保持未分化并自我更新以补充卫星细胞池(虚线箭头)。Notch激活主要由含配体的分化成肌细胞触发(方块箭头指示Notch信号方向)。成熟肌纤维中Notch活性不显著(色键中绿色),是静息肌中配体的主要来源,并通过直接细胞-细胞相互作用维持MuSC的静止(块箭头)。
肌肉干细胞(MuSCs)依赖于Notch信号活动,从它们在胚胎中的出现到它们在成人组织中的驻留,无论是在静息状态还是再生状态。胚胎期和成体musc有几个共同特征,包括表达配对框同源结构域转录因子PAX7,并执行一个几乎难以区分的肌源性程序,涉及特定肌肉调节因子的顺序表达[13].然而,成体MuSCs和胚胎MuSCs之间的一个显著区别是其细胞生态位的解剖结构,在成体MuSCs中,细胞生态位严格由肌纤维和基底层定义,但在生长肌肉中高度无序。另一个明显的区别是Pax7的增殖+而在成人组织中,MuSCs处于有丝分裂静止状态。无论MuSC的发育阶段如何,Notch信号通路已被证明对于这两种不同的MuSC状态都是不可或缺的。Notch信号缺失的胚胎和成年musc都发生异位分化,导致musc和祖细胞耗竭,而在生长组织中,Notch信号突变导致肌肉减少症[14,15,16,17,18,19,20.,21].在互惠实验中,过度表达组成性激活的NICD,末端肌源性分化被阻断,导致肌肉质量损失;一种类似于途径废除的表型[22,23,24,25].在表1我们总结了Notch信号小鼠模型,已报道的肌肉表型。值得注意的是,Notch信号在肌肉干细胞稳态和再生中的作用在其他脊椎动物中是保守的,包括斑马鱼[41和小鸡[42,43].
实际上,Notch信号在骨骼肌中的一个主要功能是通过保护其未分化状态来维持上游的创始人细胞群,而不管它们的循环状态如何。1B)最近的研究已经阐明了做法Notch通路成员,提供了其抗酸生成活性的机制解释,它们与其他信号分子的相互作用以及异种细胞类型之间的相互作用。在这篇综述中,我们将提供Notch信号因子和其他修饰伙伴在musc的建立、维护和自我更新过程中如何运作的最新观点。
缺口的核心抗生津活性被解码
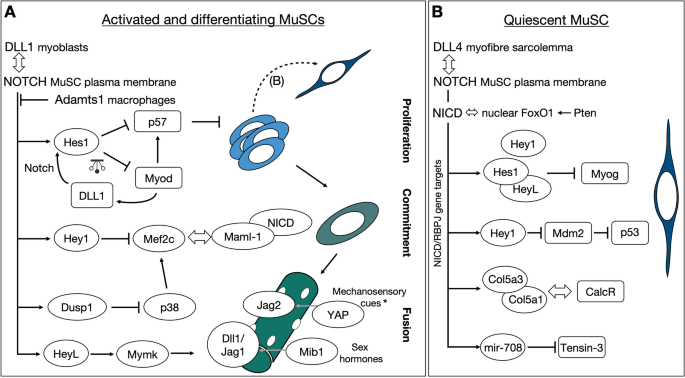
Notch信号对分化的抑制主要是由该通路的特征良好且高度保守的直接靶标驱动的,即Hes/Hey家族的基本螺旋-环-螺旋转录抑制因子。在小鼠骨骼肌细胞中,其中Notch激活的最强应答者(按转录折叠诱导顺序)是HeyL,Hey1,Hes1[16,23,44],而在人类成肌细胞中HES1似乎是最容易被诱导的11,45].然而,过度表达HeyL或Hes1在永生化肌源性细胞系C2C12中单独存在并不足以阻断肌生成[46].它是HEY1抑制因子,通过被招募到的启动子Myogenin和肌细胞增强因子2C (Mef2C)基因,其产物对肌肉分化至关重要[44].令人惊讶的是,Hey1种系敲除小鼠未表现出MuSCs异常[16].同样,在胚胎日,成人后肢肌肉中的musc数量轻度减少或不受影响(E) 17.5HeyL种系敲除小鼠[16].双报警了Hey1 / HeyL另一方面,小鼠表现出严重的再生缺陷,由于减少MuSC数量,导致增加Myod而且Myogenin表达式[16].最近,研究表明HEYL与HES1形成异二聚体配合物,并协同作用以更高的亲和力与HEYL结合Myogenin启动子(33(图。2A).始终如一地去除HeyL在Hes1空单元格(Pax3Cre;Hes1液氧/液氧;/ HeyL−−)会加剧MuSC缺乏症Pax3Cre;Hes1液氧/液氧单个突变肌肉[34].
小鼠肌肉干细胞中的Notch信号网络。一个在增殖细胞中,增强子竞争和负自调节建立了一个振荡系统(钟摆符号),包括相互调节的转录因子和配体。NICD激活复合物和分化因子Mef2c之间也发生了转录共激活因子Mastermind-like 1的竞争,而Mef2c受notch -控制的以p38为目标的Dusp1激酶的控制。Notch信号也通过抑制成肌细胞融合的膜激活因子Myomaker (Mymk)的表达来保护细胞不发生自发融合。配体在生长纤维上的呈现受到外部信号的刺激,包括机械应激(胎鸡纤维)和循环性激素(青春期和肌肉再生)。维持静止的因素(图;2B)重复自我更新。双头箭头表示蛋白质相互作用;钟摆符号表示振荡;虚线箭头表示自我更新;*在鸡胚胎中证实了YAP/Jag2链接。BNotch信号通过参与不同的目标和交互作用来维持静止和激活的musc。静止的MuSC表达Notch-1, -2和-3,在小鼠中,主要配体是来自肌纤维的Dll4。不同的NICD/RBPJ直接转录靶点执行不同的功能:Hes/Hey抑制因子阻止分化因子的表达,V型胶原链编码基因直接促进静态生态位的构建,微rna mir-708通过靶向参与细胞迁移的分子锚定MuSCs
在不同HES/HEY蛋白之间观察到的冗余在肌肉肥大的情况下是不保守的。在过度负荷诱导的肥厚后,大多数musc被激活,但与再生肌肉和经典激活相比,显示出一些不同的特征HeyL,不像Hey1,激活时不会下调。事实上,HeyL是诱导肥大过程中musc增殖所必需的,与肌肉再生相反[47].
Notch信号似乎在肌肉细胞中进化出了几种安全锁定机制,以防止异位分化的发生,并加强过渡状态的调节。除了直接的转录抑制Mef2C通过HEY1,发现了一种精细的平衡机制,即必需的转录NICD辅激活子,Mastermind-like 1 (mml -1)被MEF2C蛋白结合和隔离[48].Notch在C2C12细胞中诱导表达Dusp1,一种双特异性MAPK磷酸酶,可阻断MAPK家族成员p38的活性[49].这阻止了p38磷酸化并激活MEF2C和E47,而MEF2C和E47通常会驱动肌生成并促进MYOD/E47的关联[49,50].HEYL在成肌细胞融合中的一个意想不到的功能最近被发现,解开了Notch系统的另一个安全锁。由于Notch抑制促进早期分化,因此对融合的直接调控一直被忽视。通过分析小鸡胚胎肌发生,Esteves和同事发现Notch抑制增加了TMEM8C的表达,TMEM8C是小鸡融合主基因的同源基因Myomaker.具体来说,HEYL被发现可以结合并抑制TMEM8C的调控区域,从而阻碍成肌细胞融合[51(图。2一个)。
在受体水平上,使用他莫西芬诱导的musc特异性敲除小鼠Notch1而且Notch2,结果表明,成年卫星细胞群的大小在年略有减少Notch2-cKO,在中没有显著影响Notch1-cKO,但几乎完全消耗了双倍Notch1 / Notch2敲除小鼠[28].NOTCH 1和2在肌肉再生过程中的功能冗余后来被中和抗体证实[52].生殖系Notch3然而,敲除小鼠的musc数量异常高,与其他Notch受体相比,这表明其具有拮抗功能[29].一些报道比较了NOTCH1和NOTCH3在不同环境下的功能,并得出结论,这些Notch旁基在干细胞中显示出不同的作用。在斑马鱼皮层的神经干细胞中,Notch3保持静止,与Notch1(斑马鱼中的Notch1b)的作用形成鲜明对比,Notch1阻止激活的祖细胞分化[53].在小鼠musc中也观察到类似的功能二分法Notch3敲除导致静止的musc增加,并加速孤立肌纤维上被激活的musc增殖[29].目前尚不清楚NOTCH3如何机制地拮抗Notch信号。在肌肉细胞中,一种假说检验了NOTCH3诱导的可能性Nrarp通过减弱nicd介导的转录,作为Notch信号的负反馈调节器[54].在肌肉生长和再生过程中,NOTCH3的缺失可能导致Notch信号的过度刺激Nrarp这可能部分解释了PAX7细胞数量的增加,从而导致肌肉增生Notch3KO小鼠。尽管有这些假设,进一步的研究使用有条件的musc靶向缺失Notch3将需要获得关于该位点在MuSC生长和稳态中的作用的更精确的信息。
生长肌肉和静息肌肉中缺口配体的动态和来源
小鼠躯干中musc的起源可以追溯到真皮切开组的中胚层细胞[55],在小鼠胚胎期左右形成的一种瞬时上皮结构(E) 9。肌肉建立者细胞最初由转录因子PAX3标记,后来由PAX3和PAX7标记[56,57,58].它们在真皮切开术中的出现似乎不需要Notch信号,因为它们在Notch突变胚胎中不受影响[19,20.].与哺乳动物的中枢神经系统一样,Notch信号对于维持神经干细胞的生长至关重要,但与神经干细胞的生成无关。59].这与Notch受体-1、-2和-3以及配体的表达模式一致Jag2而且Dll-1在胚胎musc中,它被排除在皮肤形成组[RNA]之外原位杂交(19];)]。Notch配体的表达被限制在下面的肌切面上,那里是分化的肌肉细胞所在的地方,也是Notch活性至关重要的地方。在Dll-1而且Rbpj(Pax3Cre;Rbpj液氧/液氧而且Pax7CreERT2;Rbpj液氧/液氧)突变小鼠胚胎中,已观察到严重的肌肉萎缩,这是由于肌分裂中自我更新的MuSC群体的早熟分化[19,20.];我们未发表的数据)。值得注意的是,观察到在DLL1活性全面降低的胚胎中的肌肉表型类似于Rbpj缺失的MuSCs,强烈提示在胚胎肌发生中流行的Notch配体是DLL1。
类似的场景,同样的演员,似乎在成人肌肉的再生过程中上演。使用副特异性拮抗抗体,研究表明,在心脏毒素诱导的损伤后4天阻断DLL1会导致严重的自我更新缺陷。相反,在再生过程中使用抗dll4, -JAG1或-JAG2,不会产生再生表型[52].这两项研究的数据是全面的,并且已经确定在胚胎肌发生和成人肌肉再生过程中,必需的Notch配体是DLL1,其功能不被DLL4或JAG-1/2补偿。然而,在这两项研究中,细胞被不分青红皂白地定位,从而阻止了对实际信号发送细胞类型的精确定位。事实上,胚胎肌生成和成人肌肉再生都涉及广泛的细胞迁移和不同细胞类型的musc混合[60,61].间充质细胞、结缔组织成纤维细胞、内皮细胞(ECs)和再生组织中的炎症细胞都构成了潜在的Notch信号激活剂。这个复杂的细胞系统被基因解剖使用Pax7CreERT2;Dll1液氧/ fl牛老鼠(31].这种突变不影响静止的musc,使用α-DLL1中和抗体观察到,激活随之发生[52].然而,在再生后期,细胞过早分化,导致PAX7减少+增加MYOG+细胞在4 dpi,甚至更少的PAX7+7 dpi和21 dpi时的细胞[31].重要的是,这种表型在分离的肌纤维上得到了概括Pax7CreERT2;Dll1液氧/ fl牛老鼠。自Dll-1在musc中特异突变,而不是在肌纤维中,这些结果明确地表明,由成肌细胞产生的DLL1以经典的横向抑制方式维持musc,正如作者评论的那样[31].虽然musc -成肌细胞受体和配体之间的相互作用似乎是主要的,但它不是唯一观察到的。Notch/DLL1在异种细胞类型之间相互作用的一个独特的例子已经在发育中的小鸡胚胎肌发生过程中被发现。在这个系统中,Notch被DLL1在皮肤切开术的上轴唇肌细胞亚群中短暂激活+祖细胞迁移神经嵴细胞[62].
然而,成人静息肌的细胞排列与生长中的(胚胎和再生的)肌肉有显著的不同,Notch因子也是如此。在静息肌中,musc位于基底膜和肌纤维之间,是已知的唯一物理接触的细胞。因此,基于Notch信号的性质,肌纤维是Notch配体来源的最强候选者。然而,由于musc与人类和小鼠肌肉中的毛细血管密切相关,ec作为配体的替代来源引起了特别的关注[63,64].在最近的一项研究中,基因表达数据集的硅分析得出了这样的假设:来自ECs的DLL4通过基底层与musc上的NOTCH1和NOTCH3相互作用,使后者处于静止状态[64].然而,需要体内实验证据来证实这一有趣的理论。到目前为止,还没有发现MuSCs和ECs之间有明显的物理接触,这是Notch信号穿过基膜的先决条件,并且还没有发现可溶性的Notch配体在体内存在或具有活性。
尽管有替代来源的建议,但一些研究指出,肌纤维是配体的主要和必要来源。在胎鸡肌发生过程中,MuSCs中的Notch激活是通过肌肉收缩实现的,肌肉收缩迫使机械感觉转录因子YAP的肌核定位,从而表达Notch配体JAG2 [65].在小鼠中,一项有趣的研究表明,循环性激素通过调节E3泛素连接酶Mindbomb 1 (Mib1)的活性,增强了青春期新形成的肌纤维膜中DLL1和JAG1配体的呈现。27(图。2A).有趣的是,睾丸切除术抑制性激素显著减少了自我更新的静止PAX7的数量+但对肌肉内稳态肌肉中静止MuSC的维持没有影响。一种可能的解释是,性激素只在新鲜肌管中影响Mib1,而不是在成人肌纤维中。或者,性激素可能调节Notch配体在其他类型的细胞中的呈现,这些细胞仅在生长和再生过程中与MuSC接触,而在静息肌肉中不接触。第三种解释可能是其他配体在维持静止的musc中占主导地位。事实上,现在已经确定DLL4在新形成的肌管和成熟的肌纤维中表达[32,66,67]依赖于mib1的方式,它是维持静止的musc所必需的。使用原代细胞培养模型的原始研究[66],后来在体内使用条件证实Dll-4肌纤维中的柔丝缺失(可由他莫昔芬诱导)保险公司克莱莫;Dll4floxflox老鼠)[32].连续7天注射他莫西芬30天后,PAX7的总数减少了50%+音乐在Dll-4cKO纤维与对照组比较。剩余的musc是否最终在稍后的时间点耗尽,或者它们是否由于替代配体或部分重组效率而存在,仍有待证明。
MuSC自我更新过程中的振荡信号传播
上面讨论的结果似乎“解决了”肌肉干细胞中notch配体调节的问题。我们知道在干细胞中有高水平的Notch受体和活性,MuSCs表现出Notch1, Notch2和Notch3受体,并且有高水平的Notch受体Hey1,HeyL,Hes1,并且该干细胞库随着细胞分化和表达MYOD诱导而减少Dll-1[31,68,69].这种受体/配体调节机制是高度保守的,并用于其他类型的细胞,如放射状神经胶质细胞、苍蝇感觉器官受体和肠道干细胞等[70,71,72].然而,Notch信号与肌源性承诺之间的相互作用已被证明比以前认为的更加动态。Lahmann等人的优雅工作证明了HES1驱动振荡Myod通过与上游调控和启动子序列结合表达Myod轨迹(34].在这种情况下,振荡MYOD不是作为分化因子,而是实际上维持细胞处于增殖状态。一致地,消融Hes1导致不规律Myod振荡并驱使细胞分化。随后,张和同事详细阐述了这些发现和相关的振荡Dll-1活动Hes1表达式,说明了振荡动力学Dll-1对于维持musc自我更新和分化之间的适当平衡至关重要[31].在过载诱导的肥大的背景下研究这种振荡网络将是有趣的,其中大多数musc进入细胞周期,但似乎不表达Myod[47].此外,在增殖和分化之间保持平衡的另一个因素是细胞周期抑制剂p57。HES1/HEY1抑制剂和MYOD激活剂之间的拮抗结合p57增强子被证明可确保musc的持续增殖[73].值得注意的是,在胚胎肌生成体中建立的p57调控机制可能在再生肌中被保守,其中p57与分化的MYOG相连+细胞(74(图。2一个)。
Notch调节无脊椎动物的肌肉生成
在蛔虫中秀丽隐杆线虫肌细胞产生于两个卵裂球,AB和主要是P1,这是受精卵第一次分裂的结果。横纹肌和非横纹肌都构成了这种动物的肌肉组织,但被称为横纹肌的斜横纹肌的功能相当于脊椎动物的骨骼肌[75,76].成人秀丽隐杆线虫有95个体壁肌肉细胞,其中81个是胚胎期的,其余14个是后胚胎期的。尽管它们的细胞祖先不同,Notch信号是胚胎和胚胎后肌肉细胞规范的一个不可或缺的组成部分[77].一个dditional studies onlin-12而且glp-1(两个Notch受体同源体秀丽隐杆线虫)双突变胚胎发现肛门抑制肌和至少一个肠道肌肉的缺失。14块体壁肌肉中有6块位于背部,其余8块位于腹侧。在腹侧细胞,损失Lin-12/Notch信号导致腹侧到背侧的命运转换[78]因为这一途径通常会促进腹侧性成肌细胞的命运[79].因此很明显,在秀丽隐杆线虫Notch在肌肉发育的不同阶段和谱系中起作用。
在果蝇在胚胎中,Notch/ delta介导的侧抑制限制了脯神经基因的表达鳞片致死在一个精确的细胞中成为肌源性祖细胞[80].因此,Notch功能的早期丧失导致中胚层肌肉祖细胞增生[81].在胚胎发生中期(第12阶段),成体肌肉前体(amp)通过Notch信号拮抗剂的不对称分离从肌肉祖细胞中出现麻木了[82].通过靶基因的表达评估,Notch信号在胚胎amp中始终是活跃的增强分裂m6[80].与脊椎动物的肌发生相反,AMPs在胚胎期和幼虫期的大部分时间是静止的,并在二龄幼虫阶段进入细胞周期,以确保成体肌肉的生长和胸部飞行肌肉子集的再生。在胚胎静止AMPs中靶向表达NICD不会改变它们的数量,但在AMPs增殖的三龄幼虫中,它会诱导更高数量的AMPs [83].在小鼠中观察到一个表面上相反的观察结果,在肌肉祖细胞中持续的Notch信号(Myf5Cre镍镉)在胚胎发生过程中增加musc的数量,而在成体中,NICD过表达对静态池的大小没有影响[23,84].然而,考虑到两种生物之间的显著发育差异,Notch似乎在细胞状态方面具有进化保守的作用,以促进祖细胞增殖和维持静止的干细胞。
在musc中运行的Notch修饰器
骨骼肌细胞中与Notch信号相关的一种蛋白质是MEGF10,引起了人们的关注,其突变会导致一种罕见的隐性先天性肌病,如后面讨论的[85].在静息肌中,该多表皮生长因子重复重复跨膜蛋白在静止肌细胞中特异性表达,并在增殖肌细胞中保持表达,但在终分化肌纤维中不表达[86].拆除Megf10与musc中的Notch功能缺失表型非常相似,包括异位肌原蛋白表达和早熟分化[86].此外,组织培养过表达系统显示MEGF10和NOTCH1的胞内结构域之间存在结合,但内源性蛋白之间的实际物理和功能相互作用尚不清楚[87].
维持MuSC的另一个关键因素是双特异性脂质和蛋白磷酸酶PTEN。这种肿瘤抑制基因的有条件缺失会导致静态MuSCs的逐渐缺失,类似于Notch通路效应子的缺失Rbpj.从力学上看,Pten缺失增加AKT磷酸化,诱导FOXO1的细胞质易位和Notch信号的抑制,因为FOXO1结合核NICD并作为共激活剂[37].forkhead box O家族转录因子的另一个成员FOXO3已被报道以一种假设的notch相关方式调节MuSC的自我更新,而不是静止[40].有趣的是,Pten-null MuSCs自发退出静止状态,并在s期进入的情况下进行终末分化,但绕过增殖。这类似于,但又不同于Rbpj未达到s相而自发分化的cKO musc [14,18].值得注意的是,果蝇AMPs PTEN与Notch信号形成拮抗关系。在那里,胰岛素信号通路触发Notch激活以驱动amp的增殖[88].因此,由于PTEN是胰岛素/PI3K信号的负调控因子,PTEN在amp表型中的过表达Notch-RNAi过表达[88].
值得一提的Notch修饰子是基本的螺旋-环-螺旋转录因子STRA13。虽然对骨骼肌的发育是不可缺少的,Stra13KO小鼠表现出强烈的再生缺陷(小的变性肌纤维和纤维化增加)和Notch活性升高。培养中过表达实验表明STRA13与NOTCH1的胞内结构域发生物理相互作用,拮抗其与RBPJ的结合[89].此外,旁分泌信号的一个有趣案例来自表达金属蛋白酶ADAMTS1的间质巨噬细胞[90].外结构域脱落金属蛋白酶,如ADAM10和ADAM17,对Notch受体激活(细胞外结构域的蛋白水解S2切割)至关重要。有条件删除Adam10由于musc的丢失而导致严重的再生缺陷[39].相反,巨噬细胞中过表达的ADAMTS1被发现在再生过程中拮抗musc中的Notch信号,可能是通过干扰NOTCH1的S2切割[90].
甲基转移酶METTL3在RNA翻译水平上施加额外的Notch通路调控[38].METTL3催化n6 -甲基ladenosine RNA修饰,这是翻译后最丰富的mRNA修饰,对mRNA稳定性、剪接和翻译有很强的影响。通过对C2C12细胞进行MeRIP-Seq(甲基化RNA免疫沉淀和测序),作者鉴定出许多METTL3靶点,包括Notch通路成分JAG1、NOTCH2、RBPJ和MAML1。有趣的是,研究表明METTL3在翻译水平调控这些转录物,而对转录没有影响。小鼠条件性缺失Mettl3flox等位基因在MuSCs中显示再生缺陷,增殖的PAX7细胞减少。另一方面,在静止突变的musc中没有观察到缺陷,这种表型与METTL3作为几个Notch成分激动剂的作用不一致[14,18].
Notch信号对musc的调控也与它们的微环境密切相关。在衰老过程中,在缺乏足够的生态位支持的情况下,被激活的musc容易受到细胞死亡的影响,这一事实与Notch信号传导机制有关。有趣的是,研究表明Notch靶标HEY1直接结合到蛋白启动子中的一致E-box序列Mdm2抑制其表达,从而稳定p53,防止MuSC死亡[91(图。2B).此外,通过直接转录控制,Notch已被证明可以控制MuSC对小生境的粘附及其细胞外基质(ECM)的组成。NICD/RBPJ转录复合物结合并诱导microRNA-708的调控元件,microRNA-708在静止细胞中高表达,在激活细胞中急剧下调[11,36,92].功能研究表明,miR-708通过靶向局灶粘附相关蛋白Tensin3的转录本,拮抗细胞迁移,从而调节静止和自我更新[36(图。2B).因此,本研究表明,迁移机制的动态调节是Notch信号调节MuSC静止和向激活过渡的另一种手段。此外,利用小鼠遗传模型,研究表明,在发育过程中,Notch通路通过直接控制细胞粘附和ECM蛋白的表达,对MuSC生态位的定殖至关重要[26].随后,这些观察被扩展到成人内稳态组织。在那里,发现NICD/RBPJ转录复合体诱导基因编码V型胶原(COLV)三聚体复合体。在这种情况下,Notch通过MuSC控制COLV的产生,建立了一个细胞自主调节系统,其中COLV结合并激活同样由MuSC产生的g蛋白偶联受体CalcR(降钙素受体)。2B) (35].因此,Notch通过拮抗分化、维持振荡网络、增强锚定和塑造微环境来调节musc。
Notch调节异常和肌病
在以骨骼肌无力和肌肉张力缺乏为特征的先天性肌病中,已经发现了几种基因突变。鉴于Notch信号在肌生成中的核心作用,这一途径成员的突变与各种肌病有关并不奇怪。所鉴定的基因是Notch信号的修饰子或Notch受体的配体,但在四个Notch旁基中的任何一个编码位点中都没有发现突变。同样值得考虑的是,由于Notch作用于干细胞和祖细胞,而不是分化的肌纤维,Notch链接的肌病可能起源于调节异常的musc,这是一组最近被定义为卫星细胞病的肌病[93].
一项对4例常染色体隐性肢带肌营养不良(LGMD)患者的研究指出了错义突变D233EPOGLUT-1导致Notch信号降低,作为疾病表现的主要原因[94].对果蝇的研究表明o -糖基转移酶-1基因POGLUT-1通过在含有特定保守序列的EGF重复序列上添加o -葡萄糖来促进Notch信号通路,如在NOTCH1的胞外结构域中发现的[95].确诊的患者POGLUT-1 mRNA和蛋白水平正常。然而,使用纯化的D233E人POGLUT-1进行的体外研究发现,小鼠对5种不同EGF重复序列的酶活性降低Notch1.此外,肌肉切片的免疫组化和使用D233E原代成肌细胞的研究发现,与健康对照组相比,MuSCs、增生成肌细胞和融合显著减少。同一组的后续研究在LGMD患者中发现了额外的POGLUT-1突变,证实了POGLUT-1在LGMD子集中的主导作用[96].此外,对γ分泌酶抑制剂处理的C2C12小鼠细胞的实验显示,糖基化α -营养不良聚糖减少,这是LGMD的一个共同特征,进一步支持异常Notch信号通路是这些LGMD病例的主要原因的观点[96].
一种罕见的隐性先天性严重肌病,被描述为早发型肌病、反射性反应、呼吸窘迫和吞咽困难(EMARDD)MEGF10轨迹(97].在一名患者的SNP图谱中发现了10个bp的重复MEGF10导致移码突变并预测出零等位基因的外显子。进一步的研究发现了类似的废话MEGF10以前被描述为脊髓性肌萎缩伴呼吸窘迫(SMARD)病例的其他患者的突变。在接下来的几年里,几项独立研究证明了MEGF10在其他具有典型EMARDD或较轻微表型的EMARDD患者中的作用,这些患者的特征是类似的移码突变[85,98,99].建议链接为Megf10Notch信号可能参与了这种近期出现的肌病。
对肌肉疾病患者的其他研究表明,Notch信号通路的缺失可能是由于Notch配体突变导致肌肉疾病的原因。在最近的一项研究中,受影响的个体携带有基因的纯合或杂合变异JAG2.生物信息学工具预测这些突变可能对蛋白质具有破坏性,但功能数据缺失[One hundred.].一个实验装置,病人的JAG2点突变可以从Notch靶点激活的角度进行探索,这将是有意义的。
Notch信号参与肌肉疾病发病的证据在犬金毛肌营养不良症(GRMD)的研究中得到了进一步的提供。GRMD犬的特点是完全没有肌萎缩蛋白,并提供了严重的杜氏肌营养不良症(DMD)的临床前模型。然而,已经发现了两种独特的GRMD狗,它们只受到肌萎缩蛋白缺乏的轻微影响[101].广泛的全基因组研究显示,在启动子区域的SNPJag1这创造了一个新的肌原蛋白结合位点。体外荧光素酶测定使用变异序列显示特异性结合肌原蛋白,而Jag1转染该载体后,过表达肌原蛋白的HEK293T细胞表达量显著增加。的过度表达Jag1在sapje斑马鱼营养不良模型揭示了类似WT斑马鱼的纤维组织。增殖实验显示,携带该SNP的犬类MuSCs在体外保持了强大的增殖能力,与WT犬的MuSCs相当,与严重感染GRMD的MuSCs形成对比。值得注意的是Dll-1,Jag1在musc中高表达,并随着分化而降低。目前尚不清楚这种Notch配体的异位表达如何挽救DMD表型。正如作者推测的那样,JAG1很可能是再生过程的主要中介,而再生过程被营养不良蛋白缺乏的肌肉所破坏。
毫无疑问,在MuSC领域的大量研究表明Notch是MuSC发育和再生的关键角色,其在肌肉疾病中的新兴作用可能会导致新的治疗靶点的发现。
结论:notch是一种多功能信令网络
Notch信号通路中的受体、配体及其修饰物已被广泛研究,而对下游靶点的研究主要局限于Hes/ hey介导的肌源性因子抑制。因此,Notch信号在MuSC维持中的主要作用是拮抗分化。这种功能在不同发育起源的肌肉(躯干和头部肌肉)中被很好地保存,并且对于两种相反的细胞状态是必不可少的:增殖(自我更新)和有丝分裂静止。在静息肌中,承载受体的静止MuSCs直接与无细胞基板和承载配体的肌纤维接触,确保了定向Notch信号的紧密系统。在这种情况下,Notch已经进化到控制MuSC锚定和ECM生态位的建立。值得注意的是,这些由Notch控制的平行通路并不是多余的,因为其中任何一条的失活都会独立导致从静止状态中退出,并导致MuSC池的减少(对抗miR-708的抗体[36];Hey1 / HeyL双淘汰赛[16),Col5a1[35]或CalcR剔除[102])。综上所述,如本文所述,近年来,转录靶点和修饰子的范围显著扩大,引入了Notch调控的新功能,从而构成了一个复杂的交织网络,而不是单一的线性通路。
数据和材料的可用性
不适用。
缩写
- 政治:
-
白细胞共同抗原相关受体酪氨酸磷酸酶
- AMP:
-
成肌前体
- 应用:
-
淀粉样前体蛋白
- 秀丽隐杆线虫:
-
秀丽隐杆线虫
- cKO:
-
条件敲除
- COLV:
-
V型胶原
- CSL:
-
CBF1,无毛抑制因子,Lag-1
- Dll1:
-
Delta-like-1
- 模式:
-
杜氏肌营养不良症
- dpi:
-
天post-injury
- E-box:
-
Enhancer-box
- 电子商务:
-
内皮细胞
- ECM:
-
细胞外基质
- EMARDD:
-
早发性,肌病,反射障碍,呼吸窘迫和吞咽困难
- GRMD:
-
金毛猎犬肌肉萎缩症
- HEK293T:
-
人胚胎肾293t
- 柯:
-
敲除
- LGMD:
-
四肢肌萎缩症
- MAML-1:
-
Mastermind-like 1
- MYOG:
-
Myogenin
- Mef2C:
-
肌细胞增强因子2C
- MeRIP-Seq:
-
甲基化RNA免疫沉淀和测序
- Mib1:
-
Mindbomb 1
- mir - 708:
-
微rna - 708
- 音乐:
-
肌肉干细胞
- Mymk:
-
Myomaker
- 镍镉:
-
Notch细胞内结构域
- RBPJ:
-
免疫球蛋白kappa J区重组信号结合蛋白
- SMARD:
-
脊髓性肌肉萎缩伴呼吸窘迫
- SNP:
-
单核苷酸多态性
- 苏(H):
-
无毛蛋白抑制因子
- WT:
-
野生型
参考文献
Souilhol C,等。rbp - jkpa依赖的notch信号通路在小鼠早期胚胎发育中是不可或缺的。分子生物学杂志,2006;26(13):4769-74。https://doi.org/10.1128/MCB.00319-06.
李志刚,李志刚。顺式抑制在notch信号通路中的作用机制及意义。动物学报。2011;21(1):R40-7。https://doi.org/10.1016/j.cub.2010.10.034.
Nandagopal N, Santat LA, Elowitz MB. notch信号通路中的顺式激活。Elife。2019;8。https://doi.org/10.7554/eLife.37880.
Mishra-Gorur K,等。通过蛋白水解过程降低Delta。中国生物医学工程学报,2002;29(2):326 - 326。https://doi.org/10.1083/jcb.200203117.
Varnum-Finney B等。notch配体Delta-1的固定是诱导notch信号的必要条件。中国生物医学工程学报,2000;29(4):344 - 344。
刘毅,等。膜结合转录因子的核运输途径。小区通信信号。2018;16(1):12。https://doi.org/10.1186/s12964-018-0224-3.
Sardi SP,等。早老素依赖的ErbB4核信号在发育中的大脑中调节天体发生的时间。细胞。2006;127(1):185 - 97。https://doi.org/10.1016/j.cell.2006.07.037.
Schroeter EH, Kisslinger JA, Kopan R. Notch-1信号通路需要配体诱导的细胞内结构域蛋白水解释放。大自然。1998;393(6683):382 - 6。https://doi.org/10.1038/30756.
斯特鲁尔G,菲茨杰拉德K,格林沃尔德I.内在活性的Lin-12和notch细胞内结构域在体内。细胞。1993;74(2):331 - 45。
无毛蛋白抑制因子参与notch受体信号通路。细胞。1994;79(2):273 - 82。
Castel D,等。RBPJ的动态结合由notch信号状态决定。基因开发,2013;27(9):1059-71。https://doi.org/10.1101/gad.211912.112.
Krejci A, Bray S. Notch激活刺激Su(H)/CSL与目标增强子的瞬时和选择性结合。基因开发,2007;21(11):1322-7。https://doi.org/10.1101/gad.424607.
Relaix F,等。骨骼肌干细胞的研究进展。网络学报。2021;12(1):692。https://doi.org/10.1038/s41467-020-20760-6.
Bjornson CR,等。Notch信号在成体肌肉干细胞中维持静止是必要的。中国生物医学工程杂志,2012;30(2):232-42。https://doi.org/10.1002/stem.773.
布拉克AS,等。在肌肉干细胞中,从notch信号到Wnt信号的短暂转换对于正常的成人肌肉生成是必要的。细胞干细胞。2008;2(1):50-9。https://doi.org/10.1016/j.stem.2007.10.006.
深田S,等。Hesr1和Hesr3对于产生未分化的静止卫星细胞和维持卫星细胞数量至关重要。发展。2011;138(21):4609 - 19所示。https://doi.org/10.1242/dev.067165.
Kuang S,等。肌肉中卫星干细胞的不对称自我更新和承诺。细胞。2007;129(5):999 - 1010。https://doi.org/10.1016/j.cell.2007.03.044.
Mourikis P,等。notch信号在维持静止骨骼肌干细胞状态中的关键要求。中国生物医学工程杂志,2012;30(2):243-52。https://doi.org/10.1002/stem.775.
Schuster-Gossler K, Cordes R, Gossler A.过早的肌原性分化和祖细胞耗竭导致Delta1突变体严重的肌肉萎缩。中国科学院学报(自然科学版),2007;26(2):337 - 344。https://doi.org/10.1073/pnas.0608281104.
Vasyutina E,等。RBP-J (Rbpsuh)是维持肌肉祖细胞和生成卫星细胞所必需的。中国科学院学报(自然科学版),2007;26(3):344 - 344。https://doi.org/10.1073/pnas.0610647104.
林S,等。简要报告:阻断肌肉干细胞中的notch信号会导致肌营养不良表型和肌肉再生受损。中国生物医学工程杂志。2013;31(4):823-8。https://doi.org/10.1002/stem.1319.
Kopan R, Nye JS, Weintraub H.小鼠notch的细胞内结构域:指向MyoD的基本螺旋-环-螺旋区域的肌生成的组成性激活抑制因子。发展。1994;120(9):2385 - 96。
Mourikis P,等。细胞自主notch活性维持骨骼肌干细胞的时间规范潜力。发展。2012;139(24):4536 - 48。https://doi.org/10.1242/dev.084756.
肖伯C,等。Notch信号通路通过cbf1独立通路抑制肌肉细胞分化。发展。1996;122(12):3765 - 73。
孙东,李海霞,李晓霞。δ 1样脱落在肌肉细胞自我更新和分化中的作用。中国生物医学工程学报(英文版);2008;21(p22): 287 - 287。https://doi.org/10.1242/jcs.035493.
Brohl D,等。骨骼肌祖细胞对卫星细胞生态位的定植依赖于notch信号。生物工程学报。2012;23(3):469-81。https://doi.org/10.1016/j.devcel.2012.07.014.
Kim JH,等。性激素建立了成人肌肉干细胞的储备库。细胞生物学杂志,2016;18(9):930-40。https://doi.org/10.1038/ncb3401.
Fujimaki S,等。Notch1和Notch2在肌肉卫星细胞的静止和激活状态下协调调节干细胞功能。中国生物医学工程学报。2018;36(2):278-85。https://doi.org/10.1002/stem.2743.
Notch3 null突变小鼠通过重复肌肉再生引起肌肉增生。干细胞。2010;28(12):2205-16。https://doi.org/10.1002/stem.547.
文Y,等。构形notch激活上调Pax7,促进骨骼肌卫星细胞的自我更新。分子生物学杂志,2012;32(12):2300-11。https://doi.org/10.1128/MCB.06753-11.
张勇,等。Delta-like1的振荡调节肌肉干细胞分化和维持之间的平衡。网络通信。2021;12(1):1318。https://doi.org/10.1038/s41467-021-21631-4.
Eliazer, S., X. Sun,和Brack a.s., delta样4在多核生态位细胞内保持肌肉干细胞多样性的空间异质性。bioRxiv, 2020https://doi.org/10.1101/2020.10.20.347484.
野口YT等。Hey1和HeyL在肌肉干细胞中的细胞自主和冗余作用:HeyL需要Hes1结合不同的DNA位点。发展。2019;146(4)。https://doi.org/10.1242/dev.163618.
拉赫曼一世等人。MyoD和Hes1蛋白的振荡调节激活肌肉干细胞的维持。基因工程学报,2019;33(9-10):524-35。https://doi.org/10.1101/gad.322818.118.
巴格达迪MB,等。缺口胶原V-CALCR的相互信号传导将肌肉干细胞保留在它们的小生境中。大自然。2018;557(7707):714 - 8。https://doi.org/10.1038/s41586-018-0144-9.
巴格达迪MB,等。notch诱导的miR-708拮抗卫星细胞迁移并保持静止。细胞干细胞,2018;23(6):859-868 e5。https://doi.org/10.1016/j.stem.2018.09.017.
Yue F,等。Pten对于成人肌肉干细胞的平静和维持是必要的。Nat Commun. 2017;8:14328。https://doi.org/10.1038/ncomms14328.
梁毅,等。mettl3介导的m(6)a甲基化通过notch信号通路调控肌肉干细胞和肌肉再生。干细胞杂志2021;2021:9955691。https://doi.org/10.1155/2021/9955691.
Mizuno S,等。一种分解素和金属蛋白酶10 (ADAM10)是维持肌肉卫星细胞池不可缺少的。中国生物医学工程学报,2015;29(4):344 - 344。https://doi.org/10.1074/jbc.M115.653477.
Gopinath SD,等。FOXO3促进成人肌肉干细胞在自我更新过程中的静止。干细胞研究,2014;2(4):414-26。https://doi.org/10.1016/j.stemcr.2014.02.002.
苏尔坦·沙,戴尔·C,奈特·RD. Notch信号调节硬骨鱼肌肉干细胞的稳态和再生。前端细胞发育生物学。2021;9:726281。https://doi.org/10.3389/fcell.2021.726281.
Delfini MC,等。Delta - 1激活notch抑制肌肉分化,但不影响Myf5和Pax3在鸡肢体肌生成中的表达。发展。2000;127(23):5213 - 24。
Hirsinger E, et al。Notch信号在有丝分裂后的鸟类肌源性细胞中起控制MyoD激活的作用。发展。2001;128(1):107 - 16。
notch效应子Hey1与肌生成靶基因联合抑制肌生成。中国生物医学工程学报,2010;29(2):339 - 339。https://doi.org/10.1074/jbc.M109.046441.
酒井,等。Notch配体在体外调节肌肉茎状状态,但不足以保持再生能力。PLoS One. 2017;12(5):e0177516。https://doi.org/10.1371/journal.pone.0177516.
Buas MF, Kabak S, Kadesch T. notch抑制肌生成:多种途径的证据。中国生物医学工程学报。2009;29(1):344 - 344。https://doi.org/10.1002/jcp.21571.
福田等。HeyL的持续表达对过度负荷肌肉中肌肉干细胞的增殖至关重要。Elife。2019;8。https://doi.org/10.7554/eLife.48284.
沈H,等。notch共激活因子MAML1是mef2c介导转录的新型共激活因子,是正常肌生成所必需的。基因开发,2006;20(6):675-88。https://doi.org/10.1101/gad.1383706.
Notch信号通路通过在肌发生过程中诱导MKP-1抑制p38 MAPK活性。中国生物化学杂志,2007;82(5):3058-65。https://doi.org/10.1074/jbc.M607630200.
Lluis F等人。p38 MAPK磷酸化E47促进MyoD/E47关联和肌肉特异性基因转录。中国生物医学工程学报。2005;24(5):974-84。https://doi.org/10.1038/sj.emboj.7600528.
Esteves de Lima J,等。tmem8c介导的融合在胎儿肌发生过程中受NOTCH信号的调控。发展。2022;149(2)。https://doi.org/10.1242/dev.199928.
Yartseva V,等。卫星细胞的异质性提示DELTA1/NOTCH2信号通路参与自我更新。Cell rep 2020;30(5): 1491-1503 e6。https://doi.org/10.1016/j.celrep.2019.12.100.
Alunni A,等。Notch3信号通路可阻断细胞周期进入,并限制成人姑息腺中的神经干细胞扩增。发展。2013;140(16):3335 - 47岁。https://doi.org/10.1242/dev.095018.
Lamar E,等人。narp是notch信号通路的一种新型胞内成分。基因工程学报2001;15(15):1885-99。https://doi.org/10.1101/gad.908101.
格罗斯J,等。胚胎肌肉祖细胞和卫星细胞的一种共同的体细胞起源。大自然。2005;435(7044):954 - 8。https://doi.org/10.1038/nature03572.
Relaix F,等。骨骼肌祖细胞Pax3/ pax7依赖群体。大自然。2005;435(7044):948 - 53年。
Kassar-Duchossoy L,等。Pax3/Pax7标志着发育过程中原始肌源性细胞的新群体。基因开发,2005;19(12):1426-31。https://doi.org/10.1101/gad.345505.
Ben-Yair R, Kalcheim C.对鸟类皮肤切开切片的谱系分析揭示了同时存在真皮和肌肉祖细胞命运的单细胞。发展。2005;132(4):689 - 701。https://doi.org/10.1242/dev.01617.
Hitoshi S,等。Notch通路分子对于哺乳动物神经干细胞的维持是必不可少的,但不是生成。基因开发,2002;16(7):846-58。https://doi.org/10.1101/gad.975202.
Nassari S, Duprez D, fourier - thibault C.非肌源性对肌肉发育和稳态的贡献:结缔组织的作用。前沿细胞发展生物学。2017;5:22。https://doi.org/10.3389/fcell.2017.00022.
张志刚,张志刚。骨骼肌干细胞的研究进展。NPJ再生医学2018;3:24。https://doi.org/10.1038/s41536-018-0062-3.
Rios AC等人。神经嵴通过NOTCH的瞬时激活调节肌生成。大自然。2011;473(7348):532 - 5。https://doi.org/10.1038/nature09970.
Christov C等人。肌肉卫星细胞和内皮细胞:亲密的邻居和特殊的伙伴。Mol生物细胞,2007;18(4):1397-409。https://doi.org/10.1091/mbc.E06-08-0693.
Verma M,等。肌肉卫星细胞与血管生态位的交叉信号通过VEGF和notch信号保持平静。细胞干细胞,2018;23(4):530-543 e9。https://doi.org/10.1016/j.stem.2018.09.007.
Esteves de Lima J,等。在胎儿肌发生过程中,肌肉收缩是通过YAP和NOTCH来维持肌肉祖细胞池的必要条件。Elife。2016;5。https://doi.org/10.7554/eLife.15593.
低S,等等。Delta-like 4激活notch 3调节骨骼肌干细胞的自我更新。中国生物医学工程学报。2018;36(3):458-66。https://doi.org/10.1002/stem.2757.
Kann AP, Krauss RS.全贴装骨骼肌纤维及其相关干细胞的多重RNAscope和免疫荧光。发展。2019;146(20)。https://doi.org/10.1242/dev.179259.
Wittenberger T,等人。MyoD刺激delta-1转录并触发爪蟾原肠动物的notch信号。中国科学d辑。1999;18(7):1915-22。https://doi.org/10.1093/emboj/18.7.1915.
张海辉,尚锐,毕平。notch信号与肌生成的反馈调控与MyoD-Dll1轴的连接。公共科学学报,2021;17(8):e1009729。https://doi.org/10.1371/journal.pgen.1009729.
董哲,等。系内定向notch信号通路调节不对称分裂径向胶质细胞的自我更新和分化。神经元。2012;74(1):65 - 78。https://doi.org/10.1016/j.neuron.2012.01.031.
Fre S,等。Notch信号控制肠内未成熟祖细胞的命运。大自然。2005;435(7044):964 - 8。https://doi.org/10.1038/nature03589.
Sprinzak D等人。notch和Delta之间的顺式相互作用产生互斥的信号状态。自然。2010;465(7294):86 - 90。https://doi.org/10.1038/nature08959.
Zalc A,等。notch信号下游Hes/hey和肌肉调节因子对p57kip2的拮抗调控可调控骨骼肌生长阻滞。发展。2014;141(14):2780 - 90。https://doi.org/10.1242/dev.110155.
Mademtzoglou D,等。细胞周期抑制剂Cdkn1c的细胞定位控制成人骨骼肌干细胞的生长阻滞。Elife。2018;7。https://doi.org/10.7554/eLife.33337.
刘军,刘军。线虫胚胎和胚胎后发育过程中体肌的规范。中国生物医学工程学报。2012;1(2):203-14。https://doi.org/10.1002/wdev.15.
莫尔曼,D.G.和A.火,肌肉:结构、功能和发育,在秀丽隐杆线虫II, nd等,编辑。1997:冷泉港(纽约)。
Mickey KM,等。四细胞期秀丽隐杆线虫胚胎的诱导相互作用涉及APX-1在信号细胞中的表达。发展。1996;122(6):1791 - 8。
Greenwald IS, Sternberg PW, Horvitz HR。lin-12位点在秀丽隐杆线虫中指定细胞命运。34细胞。1983;(2):435 - 44。
秀丽隐杆线虫胚胎后中胚层的背侧模式需要LIN-12/notch和tgf - β信号。中国生物医学工程学报。2008;36(1):339 - 344。https://doi.org/10.1016/j.ydbio.2007.10.027.
Figeac N,等。肌肉干细胞和模型系统的研究。计算机科学进展。2007;36(12):3332-42。https://doi.org/10.1002/dvdy.21345.
李志刚,李志刚。notch在果蝇肌肉发生中的多重作用。中国生物医学工程学报。1998;21(1):66-77。https://doi.org/10.1006/dbio.1998.8944.
Ruiz Gomez M, Bate M.果蝇肌源性谱系的分离需要麻木。发展。1997;124(23):4857 - 66。
在果蝇中,胰岛素依赖的非典型notch激活:notch诱导肌肉干细胞增殖的故事。Adv Exp医学生物学2020;1227:31 - 44。https://doi.org/10.1007/978-3-030-36422-9_9.
Pasut A,等。Notch信号通路挽救缺乏Pax7的卫星细胞的损失,促进棕色脂肪分化。Cell Rep. 2016;16(2): 333-43。https://doi.org/10.1016/j.celrep.2016.06.001.
Boyden SE,等。卫星细胞基因MEGF10的突变导致隐性先天性肌病和小核。神经遗传学。2012;13(2):115 - 24。https://doi.org/10.1007/s10048-012-0315-z.
Holterman CE,等。Megf10调节卫星细胞肌生成程序的进展。中国生物医学工程学报,2007;29(5):529 - 529。https://doi.org/10.1083/jcb.200709083.
Saha M,等。MEGF10缺失对成肌细胞功能和Notch1相互作用的影响。中国生物医学工程学报。2017;26(15):2984-3000。https://doi.org/10.1093/hmg/ddx189.
Aradhya R,等。肌肉生态位驱动的胰岛素-缺口- myc级联重新激活果蝇休眠的成年肌肉前体。Elife。2015;4。https://doi.org/10.7554/eLife.08497.
孙H,等。Stra13通过拮抗notch信号通路调节卫星细胞激活。中国生物医学工程学报,2007;29(4):344 - 344。https://doi.org/10.1083/jcb.200609007.
Du H,等。巨噬细胞释放的ADAMTS1促进肌肉干细胞的激活。地理学报。2017;8(1):669。https://doi.org/10.1038/s41467-017-00522-7.
刘玲,等。受损的notch信号导致衰老肌肉干细胞p53活性下降和有丝分裂灾难。细胞干细胞,2018;23(4):544-556 e4。https://doi.org/10.1016/j.stem.2018.08.019.
Castel D,等。小rna测序鉴定骨骼肌谱系进展过程中动态microRNA失序。科学通报2018;8(1):4208。https://doi.org/10.1038/s41598-018-21991-w.
王志强,王志强,王志强,等。肌肉营养不良症和肌病中卫星细胞病变的研究。Exp Cell Res. 2022;411(1):112906。https://doi.org/10.1016/j.yexcr.2021.112906.
Servian-Morilla E,等。POGLUT1突变导致肌营养不良,notch信号通路减少,卫星细胞丢失。中国生物医学杂志,2016;8(11):1289-309。https://doi.org/10.15252/emmm.201505815.
Acar M,等。Rumi是修饰notch的CAP10结构域糖基转移酶,是notch信号通路所必需的。细胞。2008;132(2):247 - 58。https://doi.org/10.1016/j.cell.2007.12.016.
Servian-Morilla E,等。POGLUT1双等位基因突变引起肌病,伴有卫星细胞减少,α -糖基化不良和独特的放射学模式。神经病理学杂志,2020;139(3):565-82。https://doi.org/10.1007/s00401-019-02117-6.
Logan CV,等。卫星细胞肌生成调节因子MEGF10的突变可导致早发性肌病、反射性反应、呼吸窘迫和吞咽困难(EMARDD)。中国科学,2011;43(12):1189-92。https://doi.org/10.1038/ng.995.
Pierson TM,等。新的SNP阵列分析和外显子组测序检测到MEGF10的纯合外显子7缺失导致早发型肌病、反射性反应、呼吸窘迫和吞咽困难(EMARDD)。神经肌肉失调。2013;23(6):483-8。https://doi.org/10.1016/j.nmd.2013.01.013.
高山K,等。日本多重表皮生长因子10 (MEGF10)肌病与新突变:表型-基因型相关。神经肌肉失调。2016;26(9):604-9。https://doi.org/10.1016/j.nmd.2016.06.005.
Coppens S,等。一种与JAG2的致病性变异相关的肌肉萎缩症。中国科学院学报(自然科学版),2011;https://doi.org/10.1016/j.ajhg.2021.03.020.
维埃拉NM,等。Jagged 1挽救了杜氏肌营养不良表型。细胞。2015;163(5):1204 - 13所示。https://doi.org/10.1016/j.cell.2015.10.049.
山口M,等。降钙素受体信号通路抑制肌肉干细胞逃离静止状态和生态位。中国科学通报2015;13(2):302-14。https://doi.org/10.1016/j.celrep.2015.08.083.
确认
我们感谢同事和资助机构对我们工作的支持。我们也感谢Erica Kimber对手稿的彻底校对。
资金
F.R.实验室由协会Française contre les Myopathies (AFM)通过TRANSLAMUSCLE (PROJECT 22946), Labex REVIVE (ANR-10-LABX-73), Fondation pour la Recherche Médicale (FRM;授予DEQ20130326526),国家研究机构(ANR)授予Senomuscle (ANR-21- ce13 -0006-02), MyoStemVasc (ANR-17- ce14 -0018-01), Myolinc (ANR- r17062kk)给F.R, muscleXTRA (ANR-19- ce13 -0010-01)和Myo-Fibrosis (ANR-19- ce14 -0008-03)给pm
作者信息
作者及隶属关系
贡献
s.g.、f.r.和P.M.撰写并编辑了这篇评论。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Gioftsidi, S., Relaix, F. & Mourikis, P.肌肉干细胞发育、稳态和疾病期间的Notch信号网络。骨骼肌12, 9(2022)。https://doi.org/10.1186/s13395-022-00293-w
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-022-00293-w
关键字
- 肌细胞生成
- Notch信号
- 肌肉干细胞
- 肌肉疾病