- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
生长分化因子11通过stat3依赖机制诱导肺动脉高压骨骼肌萎缩gydF4y2Ba
骨骼肌gydF4y2Ba体积gydF4y2Ba12gydF4y2Ba,文章号:gydF4y2Ba10gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
骨骼肌萎缩是肺动脉高压(PAH)的临床显著表型特征,增加死亡风险。生长分化因子11 (Growth differentiation factor 11, GDF11)在PAH发病过程中起核心作用,在其他情况下对骨骼肌生长有抑制作用。但GDF11是否参与PAH骨骼肌萎缩的发病机制尚不清楚。我们发现PAH后患者血清GDF11水平升高。在mct处理的PAH模型中,骨骼肌萎缩伴随着循环GDF11水平和局部分解代谢标志物(Fbx32, Trim63, Foxo1和蛋白酶活性)的增加。在体外,GDF11激活STAT3的磷酸化。在体外和体内,用Stattic拮抗STAT3,可以部分逆转gdf11介导的肌肉萎缩中的STAT3/socs3和iNOS/NO蛋白水解途径。我们的研究结果表明,GDF11有助于肌肉萎缩,抑制其下游分子STAT3显示出有希望作为一种治疗干预措施,通过它可以直接预防PAH中的肌肉萎缩。gydF4y2Ba
简介gydF4y2Ba
尽管随着靶向治疗的出现,发病率和死亡率有所改善,但大多数PAH患者仍有症状。持续性运动不耐受也显著降低了他们的生活质量[gydF4y2Ba1gydF4y2Ba].虽然运动不耐受传统上被认为是由心功能障碍引起的,但以前的一些研究表明,骨骼肌功能障碍也可能是PAH患者运动受限的原因[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].肺部康复可提高运动能力[gydF4y2Ba4gydF4y2Ba];然而,有必要开发可能改善患者预后的合成代谢药物。gydF4y2Ba
骨骼肌萎缩是蛋白质合成与分解失衡的表现[gydF4y2Ba5gydF4y2Ba].与对照组大鼠相比,在实验性的单野花碱(MCT)诱导的大鼠PAH中,骨骼肌的形态和功能变化与运动能力受损有关,包括肌纤维截面积(CSA)变小,收缩功能下降和促萎缩泛素连接酶(Fbx32, Trim63)上调,这些酶有助于蛋白水解[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].在mct诱导的PAH模型中,蛋白质水解的局部标记物,如肌肉生长抑制素(MSTN)和蛋白酶活性也增加[gydF4y2Ba8gydF4y2Ba].此外,Fbx32和Trim63在PAH患者的股四头肌中过表达,而胰岛素样生长因子1 (IGF-1)通路和激酶B (AKT)参与蛋白质合成下调[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].gydF4y2Ba
转化生长因子β (TGFβ)家族中的几种分解代谢肌因子,包括MSTN、生长分化因子11 (GDF11)和生长分化因子15 (GDF15),与肌肉萎缩有关[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba],即使是多环芳烃患者[gydF4y2Ba12gydF4y2Ba].TGFβ蛋白参与多环芳烃的发病机制[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].最近,Yu等人。[gydF4y2Ba15gydF4y2Ba]提供了重要的见解,即GDF11在肺动脉内皮区被激活,并参与肺动脉内皮细胞(PAEC)增殖和血管生成。gydF4y2Ba
除了食欲下降外,较高的GDF11水平还会导致骨骼肌减少,这与前面提到的GDF11是Alk的一种比MSTN更有效的配体(MSTN是一种有效的肌肉抑制细胞因子)相一致[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].Schafer等人报道,当在主动脉瓣狭窄的老年患者中观察到高GDF11水平时,衰弱和既往心脏疾病的患病率增加[gydF4y2Ba18gydF4y2Ba].这一发现使得研究人类体内高GDF11水平是否足以导致肌肉萎缩等任何虚弱症状变得有趣起来。gydF4y2Ba
骨骼肌中GDF11的下游信号通路尚不明确。此外,GDF11或与GDF11密切相关的MSTN也涉及多个潜在靶点,包括NFκB、STAT3、ERK和Smad通路[gydF4y2Ba19gydF4y2Ba- - - - - -gydF4y2Ba21gydF4y2Ba].识别和靶向GDF11在肌肉中的下游信号通路具有重要意义,这是开发针对PAH患者甚至其他情况下肌肉萎缩的靶向药物的潜在方法。gydF4y2Ba
因此,在目前的研究中,我们的目标是确定PAH患者和mct诱导的PAH模型中的全身或局部GDF11水平,以确定GDF11在肌肉中作用的关键信号通路,以期开发新的治疗方法。gydF4y2Ba
材料与方法gydF4y2Ba
试剂和抗体gydF4y2Ba
针对p-STAT3 (Tyr705)(#9145)、STAT3(#9139)、p-Smad2 (Ser465/467)/Smad3 (Ser423/425)(#8828)和Smad2/3(#8685)的抗体购买自Cell Signaling Technology (Beverly, MA);抗GDF11 (sc-81952)和SOCS3 (sc-51699)的抗体购自Santa Cruz Biotechnology (Santa Cruz, CA);抗Fbx32 (ab168372)、CD31 (ab28364)和小麦胚芽凝集素(ab178444)抗体购自Abcam (Cambridge, MA);重组GDF11蛋白(1958-GD)购自R&D Systems (Minneapolis, MN);抗Trim63 (55456-1-AP)、泛素(10201-2-AP)、iNOS (18985-1-AP)和GAPDH (HRP-60004)抗体购自ProteinTech组(Rosemont, IL);抗FoxO1抗体(BS1746)购自bioworld公司(Bloomington, MN)。Crotaline (C2401)购自Sigma-Aldrich(圣路易斯,密苏里州)。静态(S7024)从Selleck (TX,美国)购买。人GDF11酶联免疫吸附测定试剂盒(QC-GDF11-Hu)、大鼠GDF11- ra和小鼠GDF11酶联免疫吸附测定试剂盒(QC-GDF11-Mu)购自上海QCHENG BIO。人MSTN酶联免疫吸附测定试剂盒(E-EL-H1437c)和人激活素A酶联免疫吸附测定试剂盒(E-EL-H0003c)购自Elabscience生物科技(武汉)有限公司。 MG-132 was purchased from Tocris Bioscience (Minneapolis, MN).
人类的研究gydF4y2Ba
由复旦大学中山医院批准(批准文号:B2018-184R)。我们从中山医院招募了8例PAH患者(年龄51-82岁,女性25%),取血清进行循环GDF11、MSTN和激活素a的分析,年龄/性别匹配的献血者作为健康对照。gydF4y2Ba
细胞培养gydF4y2Ba
C2C12细胞(中国科学院上海分院细胞库)在Dulbecco 's Modified Eagle培养基(DMEM, Gibco, MA, USA)中培养,培养基中添加10%胎牛血清(FBS, Bioind, Israel) + 1%青霉素/链霉素(Gibco, MA, USA)。为了诱导肌管形成,将C2C12细胞培养至100%合流,然后将培养基换成含有2%马血清的DMEM (Gibco, MA, USA),持续5天。通过Image-J软件测量长纤维的平均纤维宽度来确定肌管大小。在每个实验的每个条件下,在20个随机选择的区域测量肌管。gydF4y2Ba
小鼠PAECs分离并在含有8%胎牛血清的内皮细胞培养基(Sciencell, USA)中培养,如前所述[gydF4y2Ba22gydF4y2Ba].所有细胞在37°C、5% CO中培养gydF4y2Ba2gydF4y2Ba95%的相对湿度。肌管在静止(5 μM)或MG-132 (10 μM)、siGDF11或对照siRNA (pLKO.1)存在或不存在的情况下,用对照或GDF11 (0 ~ 100ng/mL)处理。将PAECs培养至30-50%合流,然后使用Lipofectamine 2000 (Invitrogen, CA, USA)转染siRNA (GDF11或对照)。转染6小时后,细胞在含血清的培养基中培养48小时,进行蛋白敲除。所有siRNA由GenePharma(中国上海)合成。gydF4y2Ba
条件培养基gydF4y2Ba
PAECs(5×10gydF4y2Ba6gydF4y2Ba细胞)在10毫米培养皿中培养至80%合流。然后,细胞在缺氧(1% OgydF4y2Ba2gydF4y2Ba)或常氧作用24 h。随后收集PAECs上清液作为条件培养基(CM), 450×离心gydF4y2BaggydF4y2Ba5分钟,4°C;用新鲜分化培养基稀释CM。肌管用稀释后的CM处理48 h。gydF4y2Ba
动物gydF4y2Ba
实验规程经复旦大学中山医院动物护理与治疗伦理委员会批准,按照美国国立卫生研究院《实验动物护理与使用指南》进行。成年雄性sd - dawley大鼠,6-7周龄,购自中国上海JSJ实验动物有限公司。大鼠多环芳烃模型建立如前所述[gydF4y2Ba23gydF4y2Ba].简单地说,大鼠接受MCT皮下注射(40 mg/kg)或对照。gydF4y2Ba
在STAT3抑制研究中,36只大鼠经MCT或对照处理。14天后,8只MCT大鼠和8只对照组大鼠每天腹腔注射静静(1.25 mg/kg,溶解于10% DMSO/90% PBS中),连续注射14天。其余大鼠用稀释剂(10% DMSO/90% PBS)处理14天。每天测量体重。从静置处理开始,对每个笼的摄食量进行监测。gydF4y2Ba
在超声心动图和有创性右心室(RV)压力测量血流动力学评估后不久,所有大鼠于第4周被人道处死[gydF4y2Ba24gydF4y2Ba].然后确定肌肉的重量。随后,对比目鱼、指长伸肌、胫骨前肌和腓肠肌进行解剖、称量,快速冷冻于液氮中,并在80°C保存以供进一步分析。gydF4y2Ba
免疫组化和免疫荧光染色gydF4y2Ba
肺组织切片和腓肠肌切片用石蜡包埋。用驴血清阻断切片,肺组织用GDF11抗体或CD31抗体孵育,腓肠肌用小麦胚芽凝集素(WGA)在4℃孵育过夜。在Olympus BX53F立式显微镜上用40×物镜拍摄图像。用Image-J软件分析每组至少250根肌纤维的CSA。gydF4y2Ba
Western blot和ELISAgydF4y2Ba
将来自组织和肌管的样本加热到95°C 10分钟。然后,将不同浓度的样本装入SDS-PAGE凝胶中,并通过特定抗体检测蛋白质。在Tanon-5500成像系统(中国上海)上检测到印迹。用ImageJ软件通过密度法测量条带的强度。gydF4y2Ba
按照制造商的说明,使用ELISA试剂盒检测人、大鼠或来自PAEC上清的CM血清中的GDF11、MSTN或激活素A。gydF4y2Ba
荧光素酶报告试验gydF4y2Ba
肌管转染荧光素酶报告质粒(NF-Κb, STAT3, Smad, ERK)和Lipofectamine 2000。荧光素酶活性用荧光素酶测定试剂盒(Promega, Madison, WI)按照制造商说明进行测定。gydF4y2Ba
一氧化氮(NO)检测gydF4y2Ba
介质中NO的检测采用上文所述的Griess试剂[gydF4y2Ba25gydF4y2Ba].在543 nm处用微孔板阅读器测量OD值。gydF4y2Ba
统计分析gydF4y2Ba
数据以均数±SEM表示。学生的gydF4y2BatgydF4y2Ba在比较连续变量时使用检验,然后使用方差分析和适当的事后检验进行多次比较。使用Prism 6 (GraphPad Software Inc)软件进行统计分析。gydF4y2BaPgydF4y2Ba值小于0.05为显著性(*,gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;* * *,gydF4y2BapgydF4y2Ba< 0.001;NS表示不显著,贯穿全文)。gydF4y2Ba
结果gydF4y2Ba
PAH患者血清GDF11浓度升高gydF4y2Ba
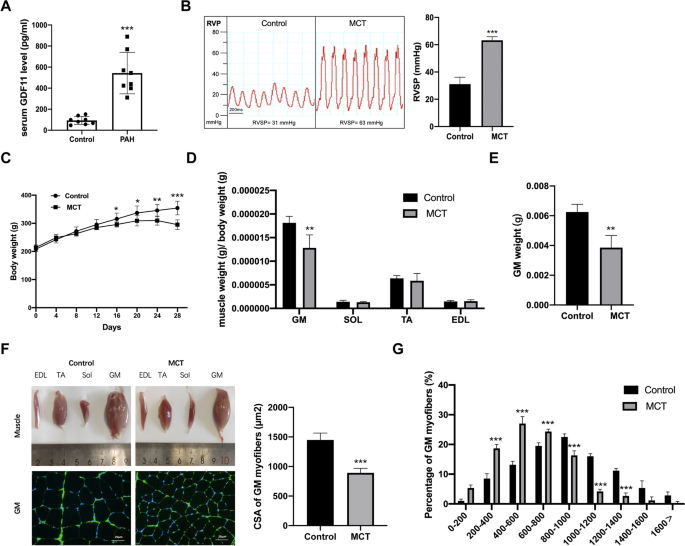
如图所示。gydF4y2Ba1gydF4y2BaA, PAH患者血清GDF11浓度(543.1±197.2 pg/ml)明显高于健康对照组(92.9±37.8 pg/ml)。我们还检测了与GDF11密切相关的分子MSTN和Activin A的血清浓度,并转导了SMAD2/3的激活和下游转录反应[gydF4y2Ba14gydF4y2Ba].虽然MSTN和Activin A在PAH患者中表达较高,但只有循环GDF11水平在PAH患者中升高最显著。因此,我们推测GDF11可能在PAH患者中起关键作用。gydF4y2Ba
mct诱导的多环芳烃引起体重减轻和肌肉萎缩。gydF4y2Ba一个gydF4y2Ba多环芳烃患者的循环GDF11水平及健康控制(gydF4y2BangydF4y2Ba= 8)。gydF4y2BaBgydF4y2Bamct处理后4周大鼠RVSP,gydF4y2BaCgydF4y2Ba体重,以及gydF4y2BaDgydF4y2Ba腓肠肌、比目鱼肌、胫前肌、指长伸肌重量归一化/体重(BW)。gydF4y2BaEgydF4y2Ba腓肠肌的重量gydF4y2BaFgydF4y2Ba测定EDL、TA、Sol、GM的代表性图像,以及每组约250条肌纤维的横截面积。比例尺为25 μm。gydF4y2BaGgydF4y2Ba肌纤维横截面积的分布。gydF4y2BangydF4y2Ba= 8只/组。数据以平均值±SEM表示。相对于车辆控制,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001gydF4y2Ba
MCT诱导PAH大鼠模型骨骼肌萎缩表型gydF4y2Ba
所有MCT大鼠均出现PAH, RVSP升高(图2)。gydF4y2Ba1gydF4y2BaB).注射MCT后4周观察到MCT大鼠体重下降(减少17%;无花果。gydF4y2Ba1gydF4y2BaC)。虽然MCT大鼠胫骨前肌(TA)、腓肠肌(GM)和比目鱼肌(SOL)出现肌肉损失,但只有GM萎缩指数(肌肉重量/总重量)降低,同时CSA显著降低(图。gydF4y2Ba1gydF4y2Bad)。因此,进一步的研究仅限于转基因。gydF4y2Ba
MCT大鼠血清和肺中GDF11水平累积gydF4y2Ba
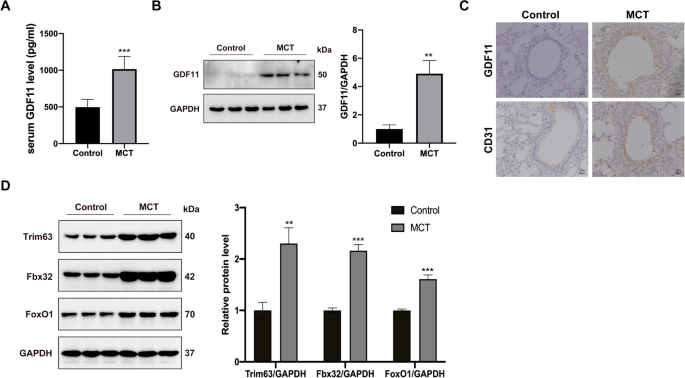
与对照组相比,MCT大鼠血清GDF11水平升高。gydF4y2Ba2gydF4y2BaA).与对照组相比,MCT大鼠肺部的GDF11蛋白水平也显著升高(图。gydF4y2Ba2gydF4y2BaB).在MCT模型中,GDF11免疫组化染色显示,与对照组相比,MCT处理大鼠肺动脉中GDF11的表达增加,且集中在内皮细胞中(图。gydF4y2Ba2gydF4y2BaC)。此外,与对照组相比,转基因MCT大鼠泛素-蛋白酶体通路中的重要因子Trim63、Fbx32和Foxo1的蛋白水平显著升高(图。gydF4y2Ba2gydF4y2BaD)。gydF4y2Ba
MCT大鼠血清和肺中GDF11水平累积。gydF4y2Ba一个gydF4y2Ba采用ELISA法测定大鼠血清中GDF11含量。gydF4y2BaBgydF4y2BaWestern blot检测GDF11在肺组织中的表达,GAPDH作为负荷对照。gydF4y2BaCgydF4y2Ba具有代表性的肺切片免疫组化显示大鼠肺动脉GDF11或CD31染色,标尺为20 μm。gydF4y2BaDgydF4y2BaWestern blot检测trim63、fbx32和foxo1蛋白表达水平,密度法测定蛋白表达水平。数据以平均值±SEM表示。相对于车辆控制,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001,gydF4y2BangydF4y2Ba= 8只/组gydF4y2Ba
多环芳烃衍生的GDF11体外模型足以引起肌管萎缩gydF4y2Ba
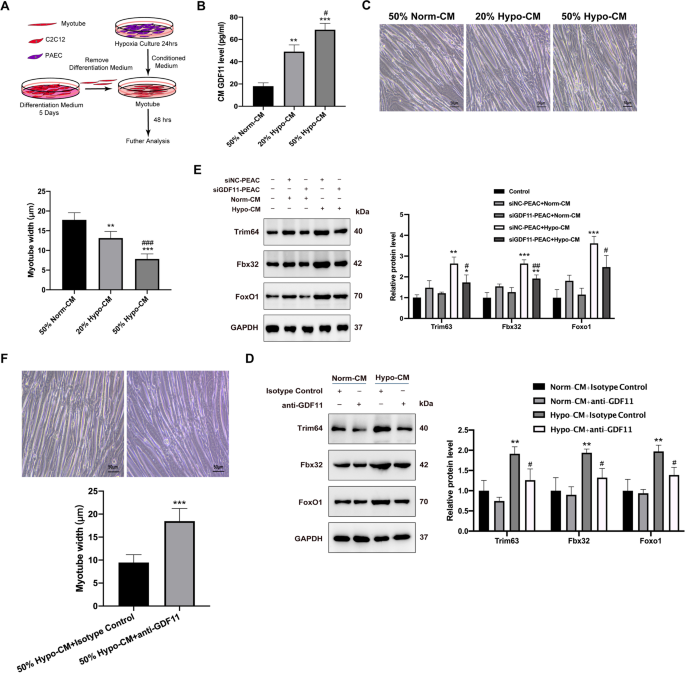
为了探索PAH中导致肌肉萎缩的信号通路,我们使用了paec诱导的肌管萎缩模型。肌管由C2C12分化而来。我们从缺氧培养24h的PAEC中收集CM。肌管经hypoc - cm(20%, 50%)处理48小时后固定,测量肌管直径(图2)。gydF4y2Ba3.gydF4y2BaA). hypocm引起肌管直径减小,同时伴有hypocm中GDF11水平升高(图。gydF4y2Ba3.gydF4y2BaB, C)。gydF4y2Ba
GDF11参与了PAEC致CM所致肌管萎缩。gydF4y2Ba一个gydF4y2Ba通过PAEC缺氧培养生成CM的示意图,然后用CM刺激肌管48小时。gydF4y2BaBgydF4y2BaGDF11在50% Norm-CM、20%或50% hypocm中的浓度(pg/mL)。gydF4y2BaCgydF4y2Bac2c12源性肌管经50% Norm-CM、20%或50% Hypo-CM来自PAEC处理后的亮场图像,以及面板中所示条件下的肌管直径。比例尺为50 μm。gydF4y2BaDgydF4y2Ba肌管分别转染GDF11 siRNA或NC siRNA和50% Norm-CM或50% hypocm。用免疫印迹法检测蛋白质水平。gydF4y2BaEgydF4y2Ba用50% hypocm处理的肌管亮场图像,GDF11抗体或同型对照,以及面板中所示条件下的肌管直径。比例尺为50μm。gydF4y2BaFgydF4y2Batrim63, fbx32和foxo1的免疫印迹,使用50% Norm-CM或50% hypoc - cm处理的肌管裂解物,GDF11抗体或同型对照;用密度法定量蛋白表达水平。数值以平均值±SEM表示。相对于车辆控制,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001;与低cm对照,gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba# #gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2Ba# # #gydF4y2BaPgydF4y2Ba< 0.001;gydF4y2BangydF4y2Ba= 3gydF4y2Ba
为了验证Trim63、Fbx32和Foxo1是否是肌管中GDF11的下游靶点,我们用特异性siRNA沉默了GDF11。我们发现GDF11的缺失下调了Trim63、Fbx32和Foxo1在hypocm处理的肌管中的表达。gydF4y2Ba3.gydF4y2BaD)。gydF4y2Ba
接下来,根据抗GDF11(中和型GDF11抗体)或同型对照,测量肌管直径。值得注意的是,抗gdf11能显著缓解50% hypocm诱导的肌管萎缩(图2)。gydF4y2Ba3.gydF4y2BaE)。此外,经处理的肌管的Western印迹显示,抗gdf11对蛋白水解的抑制表现为Trim63、Fbx32和Foxo1水平的降低(图。gydF4y2Ba3.gydF4y2BaF).这些结果表明,PAH体外模型释放的GDF11可引起明显的肌管萎缩。gydF4y2Ba
GDF11通过STAT3、SOCS3和iNOS在体外肌肉萎缩中诱导蛋白水解gydF4y2Ba
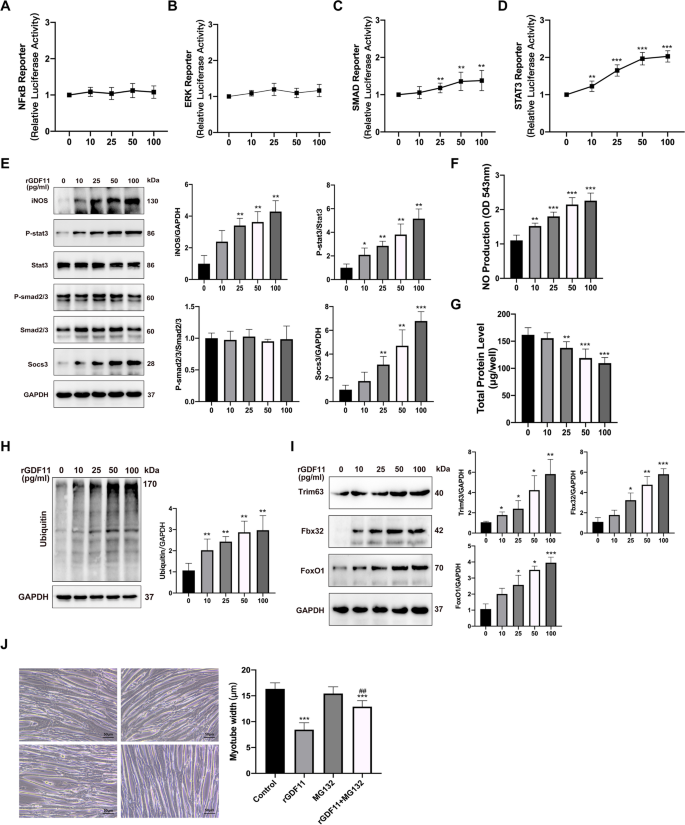
为了进一步研究肌管激活的响应GDF11的细胞内信号通路,我们用NF-κB、ERK、Smad或STAT3依赖性荧光素酶报告质粒转染C2C12。肌管分化后,肌管随后用rGDF11处理48小时。我们选择了这些转录因子作为潜在靶点,并与骨骼肌萎缩有关[gydF4y2Ba19gydF4y2Ba- - - - - -gydF4y2Ba21gydF4y2Ba].NF-κB和erk依赖的报告细胞活性均未因rGDF11处理而改变(图2)。gydF4y2Ba4gydF4y2Ba然而,rGDF11诱导Smad报告基因的激活(图2)。gydF4y2Ba4gydF4y2BaC). rGDF11也以剂量依赖的方式显著增加STAT3报告细胞活性(图。gydF4y2Ba4gydF4y2BaD).基于这些发现,我们接下来测量了用rGDF11处理的肌管中Smad2/3和STAT3的激活情况。rGDF11处理诱导phospho/total STAT3显著增加,且效果呈浓度依赖性,特别是在50和100 ng/ml剂量下(图2)。gydF4y2Ba4gydF4y2BaE)。然而,我们没有发现phospho/total Smad2/3水平显著增加(图2)。gydF4y2Ba4gydF4y2BaE)。gydF4y2Ba
GDF11通过STAT3、SOCS3和iNOS在体外肌肉萎缩中诱导蛋白水解。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaDgydF4y2BarGDF11处理C2C12肌管内NF-κB、ERK、Smad或STAT3依赖性荧光素酶报告细胞,剂量为0 ~ 100 ng/ml。gydF4y2BaEgydF4y2Ba具有代表性的靶蛋白(iNOS,磷酸化和总STAT3,磷酸化和总Smad2/3, socs3)和负荷对照(GAPDH)的Western blot,剂量为0 ~ 100 ng/ml的rGDF11处理48 h。gydF4y2BaFgydF4y2Ba在检测组中描述的肌管上清液中测量NO水平。gydF4y2BaGgydF4y2Bargdf11处理后肌管总蛋白含量。gydF4y2BaHgydF4y2Ba肌管泛素的代表性印迹图。gydF4y2Ba我gydF4y2Ba0 ~ 100 ng/ml剂量rGDF11处理肌管内trim63、fbx32、foxo1蛋白表达。GAPDH作为内部对照。gydF4y2BaJgydF4y2BarGDF11、26S核糖体抑制剂MG-132 (10 μM)处理48 h后肌管的亮场图像;面板中所示的情况下的肌管直径。比例尺为50μm。数据以平均值±SEM表示。相对于车辆控制,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001;与rGDF11对照相比,gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba# #gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2Ba# # #gydF4y2BaPgydF4y2Ba< 0.001;gydF4y2BangydF4y2Ba= 3gydF4y2Ba
我们接下来测量了iNOS和socs3的蛋白质水平,因为在其他条件下,萎缩肌管中STAT3的激活会导致两者的增加[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].在rGDF11处理48小时时,iNOS和socs3的水平显著增加,NO的产生相应增加,与此相对应的是磷酸化/总STAT3的增加(图5)。gydF4y2Ba4gydF4y2BaE, F),表明它们是被GDF11激活的STAT3的潜在靶点。gydF4y2Ba
相应地,我们检测到经rGDF11处理的肌管蛋白含量降低(图。gydF4y2Ba4gydF4y2BaG).泛素-蛋白酶体系统(UPS)和foxo1可通过E3泛素连接酶、Trim63和Fbx32调节肌肉降解[gydF4y2Ba28gydF4y2Ba].在我们的研究中,UPS水平在rGDF11处理48小时后升高,相应的Trim63、Fbx32和Foxo1的表达量呈剂量依赖性增加(图5)。gydF4y2Ba4gydF4y2Ba基于这些发现,我们假设肌管暴露于GDF11激活了与PAH骨骼肌萎缩有关的STAT3通路。gydF4y2Ba
我们开始确定GDF11是否通过蛋白水解作用诱导肌管损耗。在肌管中加入26S蛋白酶体抑制剂MG-132。我们检测到MG-132阻止了gdf11诱导的肌管直径缩小(图。gydF4y2Ba4gydF4y2BaJ).这些结果表明,GDF11通过STAT3、SOCS3和iNOS对萎缩性肌管具有直接的蛋白水解作用。gydF4y2Ba
STAT3抑制可消除GDF11治疗的肌管萎缩gydF4y2Ba
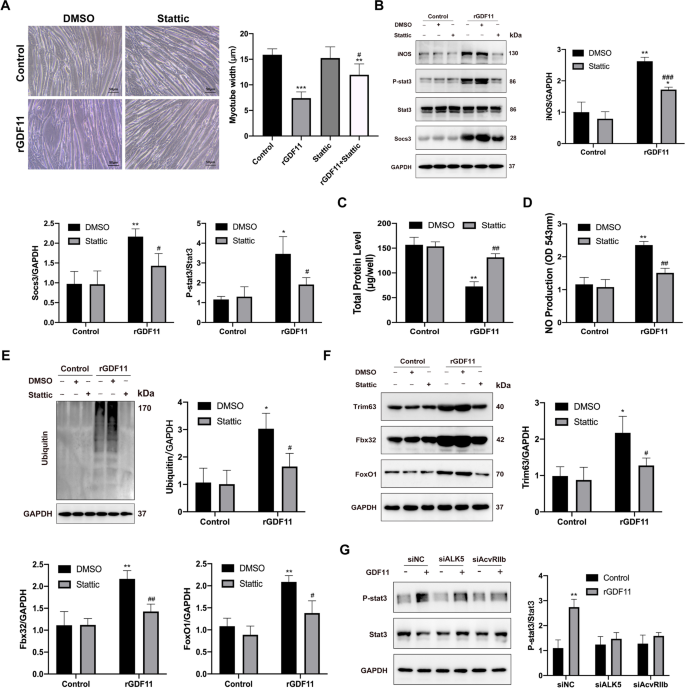
结果显示,STAT3抑制剂Stattic逆转了GDF11诱导的肌管萎缩,通过肌管直径评估(图5)。gydF4y2Ba5gydF4y2BaA).接下来,我们观察到static完全抑制了rGDF11处理后肌管内iNOS和socs3的表达(图。gydF4y2Ba5gydF4y2BaB).我们检测到GDF11对总蛋白水平的抑制被Stattic逆转(图。gydF4y2Ba5gydF4y2BaC).静态处理也依赖性地降低了NO产量和UPS水平(图。gydF4y2Ba5gydF4y2BaD, E)。此外,gdf11诱导的Trim63、Fbx32和Foxo1蛋白的表达被static显著抑制(图。gydF4y2Ba5gydF4y2BaF).这些数据表明static对GDF11引起的肌管萎缩有治疗作用。gydF4y2Ba
用STAT3抑制剂static阻断STAT3激活,可防止GDF11介导的体外萎缩。gydF4y2Ba一个gydF4y2Ba用rGDF11 (50ng/ml)处理肌管的亮场图像,加或不加STAT3抑制剂Stattic 48小时。比例尺= 50 μm。测量并计算纤维宽度(右图)。gydF4y2BaBgydF4y2Ba用rGDF11处理肌管,然后用Stattic处理48小时,用抗iNOS、pY-STAT3、total STAT3、socs3和GAPDH抗体进行Western blot分析。gydF4y2BaCgydF4y2Bargdf11处理的肌管总蛋白含量,使用或不使用STAT3抑制剂静静48小时。gydF4y2BaDgydF4y2Ba在检测组中描述的肌管上清液中测量NO水平。gydF4y2BaEgydF4y2Ba肌管泛素的代表性印迹图。gydF4y2BaFgydF4y2Ba用rGDF11处理肌管内trim63、fbx32和foxo1蛋白的表达,再用static处理48小时。gydF4y2BaGgydF4y2Ba经rGDF11、siALK5或AcvRIIb处理的肌管磷酸化和总STAT3的代表性Western印迹。数据以平均值±SEM表示。相对于车辆控制,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001;与rGDF11对照相比,gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba# #gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2Ba# # #gydF4y2BaPgydF4y2Ba< 0.001;gydF4y2BangydF4y2Ba= 3gydF4y2Ba
典型信号转导始于GDF11与其II型丝氨酸/苏氨酸激酶受体(ACVR2B)结合,然后激活I型丝氨酸/苏氨酸激酶受体(ALK5) [gydF4y2Ba29gydF4y2Ba].结果表明,敲除ALK5和ACVR2B可以抑制STAT3的磷酸化。因此,我们认为GDF11介导了依赖于ACVR2B/ALK5的STAT3信号。gydF4y2Ba
STAT3抑制改善mct治疗大鼠的肌肉萎缩gydF4y2Ba
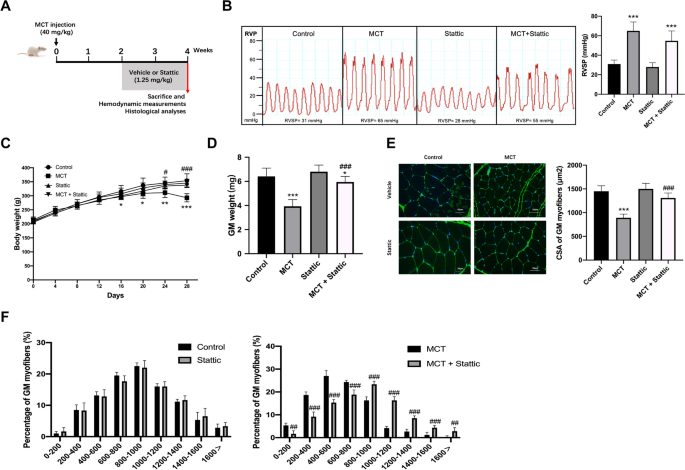
接下来,我们在mct治疗的PAH模型中评估了STAT3抑制的治疗效果。gydF4y2Ba6gydF4y2BaA). STAT3抑制对RVSP无显著影响(图。gydF4y2Ba6gydF4y2BaB)。gydF4y2Ba
STAT3抑制可防止MCT大鼠肌肉萎缩。gydF4y2Ba一个gydF4y2BaSD大鼠于第1天注射MCT或生理盐水,从第14天开始,每天腹腔注射或不注射静定,连续2周。研究了静态对多环芳烃模型主要特征的影响,包括gydF4y2BaBgydF4y2BaRVSP,gydF4y2BaCgydF4y2Ba体重,以及gydF4y2BaDgydF4y2Ba腓肠肌群。gydF4y2BaEgydF4y2Ba腓肠肌横切面,小麦胚芽凝集素染色(蓝色)。比例尺为25μm,gydF4y2BangydF4y2Ba= 3。gydF4y2BaFgydF4y2Ba测定每组约250个肌纤维的横截面积,并确定肌纤维横截面积的分布。数据以平均值±SEM表示。相对于车辆控制,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001;与MCT对照相比,gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba# #gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2Ba# # #gydF4y2BaPgydF4y2Ba< 0.001;gydF4y2BangydF4y2Ba= 8大鼠gydF4y2Ba
此外,静态给药明显改善了肌肉萎缩的主要特征,显著预防了体重的下降,GM体重相应预防了CSA的下降(图。gydF4y2Ba6gydF4y2Ba氟)。gydF4y2Ba
STAT3是一种瘦素信号的调节器,可以影响食物的摄入。然而,在我们的研究中,mct处理的大鼠吃得明显少于对照组(分别为354克和422克)。在MCT和MCT/ static处理的大鼠之间,每只动物的平均摄食量没有差异(分别为354克和357克)。这与上述数据一起表明,STAT3作为GDF-11的下游中介物,对骨骼肌具有促萎缩作用,而这种作用独立于其食欲抑制剂的作用。gydF4y2Ba
STAT3抑制通过抑制蛋白水解改善肌肉损耗gydF4y2Ba
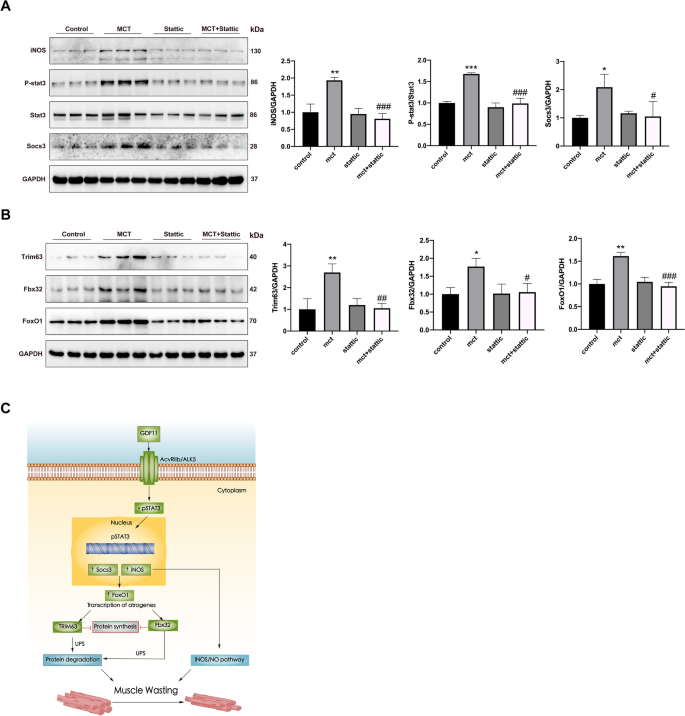
结果显示,static特异性地抑制了mct处理的大鼠GM中STAT3的磷酸化及其下游靶基因iNOS和socs3的表达(图2)。gydF4y2Ba7gydF4y2BaA).与细胞数据一致,western-blot结果显示,静态给药还抑制了mct处理大鼠腓肠肌中Trim63、Fbx32和Foxo1的表达(图。gydF4y2Ba7gydF4y2BaB),进一步证实了抑制STAT3通过抑制蛋白水解改善肌肉消瘦。gydF4y2Ba
STAT3抑制改善PAH模型肌肉萎缩的途径。gydF4y2Ba一个gydF4y2Ba,gydF4y2BaBgydF4y2Bawestern blot检测腓肠肌中指示蛋白的表达。定量条带强度,以总STAT3或GAPDH作为对照。gydF4y2BaCgydF4y2Ba描述STAT3如何促进gdf11诱导的肌肉萎缩的模型。GDF11结合ACVR2B/ALK5,然后通过磷酸化激活STAT3。p-STAT3转位到细胞核后上调iNOS和socs3的表达,导致泛素-蛋白酶体通路和iNOS/NO通路的激活,进而促进肌肉萎缩。数据以平均值±SEM表示。相对于车辆控制,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001;与MCT对照相比,gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba# #gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2Ba# # #gydF4y2BaPgydF4y2Ba< 0.001;gydF4y2BangydF4y2Ba= 3的老鼠gydF4y2Ba
讨论gydF4y2Ba
目前的研究为多环芳烃相关骨骼肌萎缩的分子机制提供了新的见解。我们的发现表明,在mct处理的PAH模型中,骨骼肌萎缩伴随着循环GDF11水平和局部分解代谢标志物(Fbx32, Trim63, Foxo1和蛋白酶活性)的增加。虽然我们的证据支持GDF11中包括STAT3/socs3和iNOS/NO在内的蛋白水解途径可以被STAT3抑制剂静态部分逆转(图2)。gydF4y2Ba7gydF4y2BaC)。gydF4y2Ba
既往研究已证实,作为一种激活素相关的TGF-β蛋白,循环MSTN和GDF11增加,促进了mct相关的分解代谢表型,但TGF-β家族在多环芳烃肌肉萎缩中的作用尚未完全阐明[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].就像衰老一样[gydF4y2Ba30.gydF4y2Ba],以及癌症[gydF4y2Ba31gydF4y2Ba],我们的数据还表明,PAH中的骨骼肌萎缩也可能是由GDF11驱动的表型。在前列腺肿瘤中的研究已经满足了GDF11蛋白从肿瘤到循环再到肌肉的单向运动。此外,抗gdf11抗体已被证明能够阻止荷瘤小鼠的肌肉损失,证实了其内分泌作用[gydF4y2Ba31gydF4y2Ba].我们的研究结果还表明,GDF11通过内分泌方式增强肌肉萎缩表型,肺血管内皮可能是GDF11异常高血清水平的潜在来源。gydF4y2Ba
合成代谢和分解代谢过程的平衡对保持肌肉稳态至关重要,肌肉消瘦使平衡向分解代谢倾斜。肌肉萎缩的部分原因是过度的蛋白质周转,这可归因于蛋白酶体依赖性的蛋白质降解[gydF4y2Ba32gydF4y2Ba].我们发现GDF11在培养的肌管中导致高水平的泛素连接酶Fbx32、Trim63和Foxo1。我们的发现为GDF11通过蛋白质水解导致肌肉萎缩的论点增加了分量。抑制蛋白质降解信号通路是预防肌肉萎缩的有效途径之一,从而抑制过多的分解代谢。gydF4y2Ba
为了研究GDF11诱导蛋白水解的机制,我们探索了GDF11对STAT3、NF-κB、ERK和SMAD磷酸化的影响,这四个关键的蛋白质降解信号通路与骨骼肌萎缩有关[gydF4y2Ba19gydF4y2Ba- - - - - -gydF4y2Ba21gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].结果显示GDF11仅刺激STAT3的磷酸化,这使得我们主要关注STAT3通路进行进一步研究。既往研究发现STAT3的激活可刺激E3泛素连接酶Fbx32和Trim63的表达,导致肌肉萎缩,但STAT3在多环芳烃肌肉萎缩中的作用尚未被广泛分析[gydF4y2Ba34gydF4y2Ba].在我们的研究中,STAT3通路可能在GDF11诱导的肌肉萎缩过程中起着至关重要的作用,它的抑制通过抑制scos3和iNOS,然后减少原蛋白水解基因来拯救GDF11介导的肌肉萎缩。gydF4y2Ba
STAT3对C/EBP、MSTN和IL- 6等几种驱动肌肉萎缩的信号通路很重要[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].旨在阻断这些因素的药物的临床试验取得了有限的成功,这些药物针对的是肌肉[gydF4y2Ba36gydF4y2Ba].在包括骨关节炎在内的各种疾病模型中,static已被用于拮抗STAT3 [gydF4y2Ba37gydF4y2Ba]及乳癌[gydF4y2Ba38gydF4y2Ba].STAT3抑制剂可能比其他药物更适合对抗肌肉萎缩。它们有可能抑制这些协同的肌肉消耗途径[gydF4y2Ba39gydF4y2Ba].gydF4y2Ba
在之前的几项研究中,STAT3抑制已被证明可以改善实验性多环芳烃[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].然而,在我们的研究中,STAT3抑制剂的治疗降低了PAH大鼠模型中的RVSP,但没有明显变化,这可能是由于我们研究中使用的恶病质模型中的严重PAH造成的。虽然我们和其他人的工作表明STAT3是肌肉萎缩的关键中介,但STAT3诱导肌肉萎缩的机制仍然难以捉摸。STAT3作为一种转录因子,已知可以调节靶基因的表达,而这些基因中哪些有助于mct诱导的肌肉萎缩尚不清楚。由细胞因子激活的STAT3刺激SOCSs的表达,SOCSs反过来刺激ups介导的血管紧张素ii诱导的肌肉萎缩中IRS-1的降解,导致胰岛素/IGF-1信号通路的抑制[gydF4y2Ba42gydF4y2Ba].胰岛素/IGF-1信号通路受损与蛋白质降解激活密切相关[gydF4y2Ba42gydF4y2Ba].在这里,我们确定socs3是stat3介导的PAH肌肉萎缩的下游靶点。iNOS作为细胞因子驱动的肌肉萎缩的关键介质,参与IFNγ/ tnf α诱导的肌肉萎缩[gydF4y2Ba26gydF4y2Ba].我们的数据表明,iNOS也参与了由STAT3介导的mct治疗的肌肉萎缩。gydF4y2Ba
我们的发现在PAH之外也有潜在的影响,这增加了更多的证据,表明GDF11及其下游信号分子STAT3可能是一种潜在的治疗干预候选者,旨在改善肌肉质量,甚至在各种情况下提高运动耐受性。gydF4y2Ba
先前的研究表明,与比目鱼相比,GM开始退化更早,萎缩速度更快[gydF4y2Ba43gydF4y2Ba].在我们的研究中,只有GM萎缩指数显著降低。我们测量了肌肉中受体的表达。结果显示,与MCT处理大鼠的其他肌肉相比,MCT处理大鼠的GM中ACVR2B和ALK5的表达明显增加(未显示)。与mct处理的大鼠的其他肌肉相比,GM中的p-STAT3水平有所增加。因此,我们认为可能是GM中ACVR2B/ALK5的表达水平升高,进而导致p-STAT3水平升高。当然,这个问题还需要进一步研究。gydF4y2Ba
本研究存在一定的局限性。首先,不排除GDF11分泌的肺和肌肉以外的其他来源。其次,在整个研究过程中没有进行功能能力测试,这可能会增加我们论点的分量。第三,我们没有调查PAH患者的肌肉样本,这可能会增加我们的证据的分量。未来的研究表明,在多环芳烃动物模型中,较低的GDF11水平与更好的肌肉质量改善有关,这将进一步加强我们的论点。gydF4y2Ba
结论gydF4y2Ba
我们的研究表明,在mct治疗的PAH中,GDF11在肌肉萎缩的发展中起着关键作用。GDF11对肌肉的影响可能是通过激活STAT3蛋白水解介导的。蛋白酶体依赖的蛋白质降解被确定为多环芳烃骨骼肌萎缩的迹象。Socs3和iNOS也参与了由STAT3介导的mct治疗的肌肉萎缩。通过特定的抑制剂抑制STAT3和26S核糖体蛋白单位可以挽救gdf11诱导的萎缩,使STAT3抑制成为预防PAH肌肉萎缩的潜在靶点。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中使用或分析的所有数据集均可根据合理要求从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- 未经中华人民共和国交通部:gydF4y2Ba
-
野百合碱gydF4y2Ba
- 客服人员:gydF4y2Ba
-
横截面积gydF4y2Ba
- igf - 1:gydF4y2Ba
-
胰岛素样生长因子1gydF4y2Ba
- TGFβ:gydF4y2Ba
-
转化生长因子βgydF4y2Ba
- GDF11:gydF4y2Ba
-
生长分化因子11gydF4y2Ba
- GDF15:gydF4y2Ba
-
生长分化因子15gydF4y2Ba
- PAECs:gydF4y2Ba
-
肺动脉内皮细胞gydF4y2Ba
- CM:gydF4y2Ba
-
条件培养基gydF4y2Ba
- 房车:gydF4y2Ba
-
右心室gydF4y2Ba
- 编剧:gydF4y2Ba
-
小麦胚芽凝集素gydF4y2Ba
- 没有:gydF4y2Ba
-
一氧化氮gydF4y2Ba
- 助教:gydF4y2Ba
-
胫骨前gydF4y2Ba
- 通用汽车:gydF4y2Ba
-
腓肠肌肌肉gydF4y2Ba
- 索尔:gydF4y2Ba
-
比目鱼肌gydF4y2Ba
- BW:gydF4y2Ba
-
体重gydF4y2Ba
- 多环芳烃:gydF4y2Ba
-
肺动脉高压gydF4y2Ba
参考文献gydF4y2Ba
麦凯纳SP, Doughty N, Meads DM,等。剑桥肺动脉高压结局回顾(CAMPHOR):肺动脉高压患者健康相关生活质量和生活质量的测量。质量寿命决议2006;15:103-15。gydF4y2Ba
梅耶FJ, Lossnitzer D, Kristen AV,等。特发性肺动脉高压的呼吸肌功能障碍。中国科学院学报(自然科学版),2005;gydF4y2Ba
王晓明,王晓明,王晓明,等。特发性肺动脉高压患者的骨骼肌功能障碍。呼吸医学。2007;101:2366-9。gydF4y2Ba
运动训练和肺动脉高压康复:理论基础和目前的数据评估。中华心脏科杂志2013;33:263-73。gydF4y2Ba
唐娜森,马多克斯,马托里尼,等。COPD的肌肉功能:复杂的相互作用。国际医学杂志,2012;7:523-35。gydF4y2Ba
卡瓦略RF,卡斯坦EP,科埃略CA,等。心力衰竭增加骨骼肌肌纤维类型特异性萎缩的atrogin1和MurF1基因表达。中华药理学杂志,2010;41:81-7。gydF4y2Ba
王志强,王志强,等。实验性心力衰竭中骨骼肌肌纤维和间质细胞的凋亡。中华心血管病杂志,1998;30:349 - 349。gydF4y2Ba
李志强,李志强,等。实验性肺动脉高压骨骼肌萎缩的信号通路。生物化学学报,2015;gydF4y2Ba
王志强,王志强,等。特发性肺动脉高压的骨骼肌功能障碍。中国生物医学工程学报。2014;30(4):344 - 344。gydF4y2Ba
李SJ。肌肉生长抑制素的细胞外调节:肌肉质量的分子变阻器。中国生物医学工程学报,2010;10(2):344 - 344。gydF4y2Ba
Karsenty G, Olson EN。骨和肌肉内分泌功能:器官间交流的意外范式。细胞。2016;164(6):1248 - 56。gydF4y2Ba
张志强,张志强,张志强,等。生长/分化因子15导致肺动脉高压患者tgf β活化激酶1依赖性肌肉萎缩胸腔。2019;74(2):164 - 76。gydF4y2Ba
厄普顿警局,莫雷尔西北。转化生长因子-β-骨形态发生蛋白型信号通路在肺血管稳态和疾病中的作用中国生物医学工程学报,2013;gydF4y2Ba
容丽敏,杨鹏,杨世峰,等。ACTRIIA-Fc在肺动脉高压中重新平衡激活素/GDF与BMP信号。中国生物医学工程学报。2020;12(543):eaaz5660。gydF4y2Ba
杨秀峰,陈旭,郑小东,等。生长分化因子11促进肺动脉内皮细胞异常增殖和血管生成。高血压。2018;71(4):729 - 41。gydF4y2Ba
张晓军,张志强,张志强,等。GDF11的超生理水平可诱导横纹肌萎缩。EMBO Mol. 2017; 9:531-44。gydF4y2Ba
王志强,王志强,王志强,等。GDF8和GDF11效力差异的结构基础。中国生物医学工程学报,2017;15(1):19。gydF4y2Ba
谢福尔MJ,阿特金森EJ,范德邦PM,等。GDF11和肌肉生长抑制素在人类衰老和心血管疾病中的定量研究Cell Metab. 2016; 23:1207-15。gydF4y2Ba
邢慧,廖建民,王永华,等。外源性GDF11减弱非典型TGF-β信号,保护心脏免受急性心肌缺血-再灌注损伤。《中国医学杂志》2019;114(3):20。gydF4y2Ba
梅伟,向刚,李勇,等。GDF11在载脂蛋白E-Null小鼠中保护内皮损伤并减少动脉粥样硬化损伤的形成。生物化学学报,2016;24(11):1926-38。gydF4y2Ba
张磊,潘杰,董勇,等。Stat3的激活将C/EBPδ与肌肉生长抑制素通路联系起来,刺激肌肉量的损失。中国生物医学工程学报。2013;18(3):368-79。gydF4y2Ba
王志强,王志强,王志强,等。促增殖和炎症信号在肺动脉高压中聚集在FoxO1转录因子上。中华外科杂志,2014;20(11):1289-300。gydF4y2Ba
金俊,姜勇,小岛勇,等。MicroRNAs 424和503介导的内皮Apelin-FGF链接在肺动脉高压中被破坏。中华外科杂志,2013;19(1):74-82。gydF4y2Ba
王志强,王志强,王志强,等。miR-208-Mef2轴驱动肺动脉高压右心室功能失代偿Circ res 2015;116(1): 56-69。gydF4y2Ba
王志强,王志强,王志强,等。在肌肉萎缩过程中,NF-kappa b介导的MyoD衰减需要一氧化氮合酶mRNA稳定、HuR蛋白和一氧化氮释放。分子生物学杂志,2005;25(15):6533-45。gydF4y2Ba
马俊峰,桑切斯,霍尔,等。STAT3以NF-κ b依赖和il -6不依赖的方式促进IFNγ/ tnf α诱导的肌肉萎缩。中国生物医学杂志,2017;9(5):622-37。gydF4y2Ba
马什莉F, Chibalin AV, Krook A,等。构成性STAT3磷酸化参与2型糖尿病骨骼肌胰岛素抵抗。糖尿病。2013;62(2):457 - 65。gydF4y2Ba
李文杰,李志强,李志强,等。Foxo转录因子诱导萎缩相关泛素连接酶atrogin1,引起骨骼肌萎缩。细胞。2004;117(3):399 - 412。gydF4y2Ba
德国MA,玻璃DJ。控制骨骼肌质量的信号通路。中国生物化学杂志,2014;49(1):59-68。gydF4y2Ba
张志刚,张志刚,张志刚,等。上生理给药GDF11部分通过上调GDF15诱导恶病质。Cell Rep. 2018;22(6): 1522-30。gydF4y2Ba
潘春华,王志强,王志强,等。前列腺肿瘤来源的GDF11加速雄激素剥夺疗法诱导的肌肉减少症。JCI Insight, 2020;5(6):e127018。gydF4y2Ba
玻璃DJ。介导骨骼肌肥大和萎缩的信号通路。中国生物医学工程学报,2003;5(2):87-90。gydF4y2Ba
李志强,李志强,李志强,等。人胰腺癌和肿瘤相关基质细胞释放的IL-8信号通过CXCR2-ERK1/2轴诱导肌肉萎缩癌症(巴塞尔)。2019; 11(12): 1863。gydF4y2Ba
陈伟强,董杰,董勇,等。抑制Stat3激活抑制caspase-3和泛素-蛋白酶体系统,导致癌症恶病质中肌肉质量的保存。中国生物医学工程学报,2015;29(4):529 - 529。gydF4y2Ba
李志强,李志强,等。阻断IL-6转信号/STAT3轴抑制kras诱导的肺腺癌恶病质。致癌基因。2017;36(21):3059 - 66。gydF4y2Ba
Wagner KR, Fleckenstein JL, Amato AA等人,MYO-029在成人肌肉萎缩症受试者中的i/i期试验。安。努尔。2008;63:561-71。gydF4y2Ba
李丽娟,李丽娟,李丽娟,等。IL-6/Stat3信号通路的全身抑制可预防实验性骨关节炎。中华神经外科杂志,2017;76(4):748-55。gydF4y2Ba
杨sk,文杰,陈松,等。自噬通过EGFR/Stat3和Tgfβ/Smad信号在小鼠模型中差异调节不同的乳腺癌干样细胞癌症决议2016;76(11):3397-410。gydF4y2Ba
Zimmers TA, Fishel ML, Bonetto A. STAT3在癌症恶病质全身炎症中的作用。中国生物医学工程学报,2016;gydF4y2Ba
蔡智,李娟,庄强,等。MiR-125a-5p通过靶向TGF-β1和IL-6/STAT3信号通路改善野百合碱诱导的肺动脉高压。中华药理学杂志,2018;30(4):344 - 344。gydF4y2Ba
王永强,王永强,等。JAK/STAT分子通路在肺动脉高压相关血管重塑中的作用国际分子生物学杂志,2021;22(9):4980。gydF4y2Ba
张龙,狄杰,贺兆勇,等。IL-6和血清淀粉样蛋白A协同介导血管紧张素ii诱导的肌肉萎缩。中国生物医学杂志,2009;20(3):604-12。gydF4y2Ba
藤原,浅井,富山,等。腓肠肌和比目鱼肌厚度的变化与年龄和性别有关。老年临床研究进展。2010;22(1):24-30。gydF4y2Ba
确认gydF4y2Ba
作者感谢中国国家重点研究与发展计划和国家自然科学基金的财政支持。gydF4y2Ba
资金gydF4y2Ba
国家重点研发计划项目(No. 2018YFC1313600)、国家自然科学基金项目(No. 82070094)、国家自然科学基金项目(No. 81900086)。资助者在研究的设计、数据收集、分析、数据解释或撰写手稿中没有任何作用。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
s.l., X.W和S.H.构想了这项研究,并参与了设计和协调,并帮助起草了手稿。G.X.参与了研究的设计,进行了实验,进行了统计分析,并起草了手稿。K.Y.参与了研究的设计,并进行了实验和统计分析。pj进行实验;M.J.和Y.S.编辑并修改了手稿。作者们阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
由复旦大学中山医院批准(批准文号:B2018-184R)。实验规程经复旦大学中山医院动物护理与治疗伦理委员会批准,按照美国国立卫生研究院《实验动物护理与使用指南》进行。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
向,G.,应,K.,蒋,P.。gydF4y2Baet al。gydF4y2Ba生长分化因子11通过stat3依赖机制诱导肺动脉高压骨骼肌萎缩。gydF4y2Ba骨骼肌gydF4y2Ba12gydF4y2Ba, 10(2022)。https://doi.org/10.1186/s13395-022-00292-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13395-022-00292-xgydF4y2Ba
关键字gydF4y2Ba
- 肺动脉高压gydF4y2Ba
- GDF11gydF4y2Ba
- 骨骼肌萎缩gydF4y2Ba
- STAT3gydF4y2Ba