- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
耐力运动可减轻青少年辐照引起的骨骼肌功能衰退和线粒体应激gydF4y2Ba
骨骼肌gydF4y2Ba体积gydF4y2Ba12gydF4y2Ba,文章号:gydF4y2Ba8gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
放射治疗通常用于治疗儿童癌症,可能会对肌肉功能产生不良影响,但其潜在机制尚未完全阐明。我们假设放射治疗后的耐力锻炼可以改善骨骼肌功能。gydF4y2Ba
方法gydF4y2Ba
我们利用小动物辐射研究平台(SARRP)对幼年雄性小鼠进行了临床相关的3×(每隔一天,超过5天)8.2 Gy x射线局部照射,从膝盖照射到右后肢脚垫区。然后将小鼠单独安置在装有上锁或自由旋转的自主跑轮的笼子中1个月。体外肌肉收缩功能,RT-qPCR分析,静息细胞质和肌浆网(SR)储存钙gydF4y2Ba2 +gydF4y2Ba我们对肌肉样本进行了免疫组织化学和生化分析,以评估肌肉病理和自愿轮跑(VWR)的相对治疗效果。gydF4y2Ba
结果gydF4y2Ba
与未辐照的小鼠相比,辐照降低了快收缩指长伸肌(EDL) 27%的肌肉特异性力,而VWR辐照后提高了37%的肌肉特异性力。与未受照射的小鼠相比,放射治疗同样使慢收缩比目鱼肌比力降低了14%,而VWR辐照后比力提高了18%。我们评估细胞内钙gydF4y2Ba2 +gydF4y2Ba调节、氧化应激和线粒体稳态是辐射诱导病理和运动介导抢救的潜在机制。我们发现静息胞质钙显著减少gydF4y2Ba2 +gydF4y2Ba久坐小鼠辐照后的浓度。然而有趣的是,SR CagydF4y2Ba2 +gydF4y2Ba与不运动的小鼠相比,vwr后辐照小鼠的肌纤维中贮藏物质含量增加。我们观察到照射后肌肉的整体蛋白质氧化升高了73%,而VWR使蛋白质亚硝基化降低了35%,线粒体活性氧(ROS)的产生降低了50%。最后,我们发现VWR在转录物和蛋白质水平上显著增加了PGC1α的表达,这与线粒体生物发生的运动依赖性增加一致。gydF4y2Ba
结论gydF4y2Ba
幼年辐照阻碍肌肉发育,打乱正常钙gydF4y2Ba2 +gydF4y2Ba处理,线粒体损伤,氧化和亚硝化应激增加,同时肌肉力量产生的显著缺陷。运动减轻了异常CagydF4y2Ba2 +gydF4y2Ba处理、线粒体稳态、氧化应激和亚硝化应激的增加与辐射后骨骼肌功能的改善相关。gydF4y2Ba
背景gydF4y2Ba
放射治疗是癌症患者的标准治疗,大约50%的患者在治疗期间的某个时间点被使用[gydF4y2Ba1gydF4y2Ba].虽然辐射的细胞毒性作用旨在针对转化的癌细胞,但已观察到脱靶效应可导致肌肉生长和功能受损[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].辐射对青少年癌症患者的破坏性特别大,因为它主要是通过破坏DNA和破坏正常发育所必需的适当的暂时基因表达来起作用的。青少年癌症幸存者会加速衰老,受到辐射的肢体会出现肌肉无力和萎缩,生活质量下降[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].因此,了解辐射破坏骨骼肌正常发育和功能的机制,有助于改善不断增长的癌症幸存者的治疗结果。gydF4y2Ba
电离辐射在细胞水平上有多种影响,最显著的是对DNA、蛋白质和脂质等造成损害,如果不加以解决,可能导致细胞周期停滞和细胞死亡[gydF4y2Ba10gydF4y2Ba].由于相对低效的损伤修复机制,线粒体DNA更容易受到电离辐射诱导的损伤[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].线粒体损伤导致活性氧(ROS)产生增加、线粒体自噬和线粒体功能障碍,导致ATP产生中断和肌肉功能减弱[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].虽然低水平的氧化应激在细胞信号传导中起着重要作用[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba],过度的氧化应激会破坏正常的蛋白质-蛋白质相互作用,改变基因表达,并损害细胞器和膜的完整性[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].此外,幼体照射可显著改变Ca的表达gydF4y2Ba2 +gydF4y2Ba-处理蛋白,导致CagydF4y2Ba2 +gydF4y2Ba依赖于骨骼肌的细胞信号传导过程和兴奋-收缩耦合[gydF4y2Ba4gydF4y2Ba].gydF4y2Ba
另一方面,运动对整体健康有一系列有益的影响,以及对骨骼肌本身的直接适应性反应。运动促进蛋白质翻译,导致受损蛋白质和细胞器的周转增加[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].同样,长时间运动也会增加线粒体含量,部分原因是线粒体生物发生的主要调节因子Pgc1α的上调[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].由于运动对ATP的需求增加,在持续的肌肉活动后,线粒体呼吸的副产物ROS和活性氮(RNS)的产生增加[gydF4y2Ba16gydF4y2Ba].然而,运动同时会上调骨骼肌中的抗氧化反应,以清除过量的ROS/RNS [gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].除了提高抗氧化反应,锻炼还能促进钙质的适应gydF4y2Ba2 +gydF4y2Ba操作机械,以支持有效、重复的肌肉收缩[gydF4y2Ba19gydF4y2Ba].其中一种适应包括改变蛋白质和细胞器的空间定位,以允许更有效的CagydF4y2Ba2 +gydF4y2Ba处理和信号,包括增加线粒体与钙释放单位的联系,改善线粒体钙gydF4y2Ba2 +gydF4y2Ba摄取/功能,增强商店操作CagydF4y2Ba2 +gydF4y2Ba条目(gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].gydF4y2Ba
在这里,我们研究了耐力运动对幼年分块照射小鼠骨骼肌生长和功能的影响。我们进一步证明,1个月的耐力运动减轻了青少年后肢照射后的肌肉功能缺陷。这与钙处理和氧化/亚硝化应激的修正有关。gydF4y2Ba
方法gydF4y2Ba
动物gydF4y2Ba
本研究严格按照美国国立卫生研究院《实验动物护理和使用指南》中的建议进行。所有涉及动物的程序都由罗切斯特大学的机构动物护理和使用委员会(IACUC)批准,称为大学动物资源委员会(UCAR)。所有实验均使用C57BL/6J幼/成年(1 - 3个月,Jackson实验室)雄性小鼠,并按照UCAR协议在8周龄时单独安置。小鼠保持12:12的明暗循环,并自由地提供颗粒饲料和标准饮用水(Hydropac)。gydF4y2Ba
SARRP辐射gydF4y2Ba
所有电离x射线照射均使用小动物辐射研究平台(SARRP, XStrahl)和前面所述的10 × 25毫米可变准直仪进行[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].用汽化异氟醚麻醉小鼠。对4周大的小鼠分别于周一、周三和周五进行8.2 gy辐射的分次照射。从脚垫到胫骨平台的局部放射被传递到右下下肢。gydF4y2Ba
自愿轮跑练习gydF4y2Ba
低调的无线啮齿动物轮毂(ENV-047轮毂,Med Associates, Fairfax, VT, USA)被用于单独安置的小鼠笼中,以跟踪4周内的慢性耐力运动跑步活动,而久坐的对照组动物则被放置在轮毂锁定且无法旋转的笼中。车轮连接到无线中心枢纽,每30秒在车轮管理软件中记录一次跑步活动,车轮分析软件(Med Associates)用于报告每天的总跑步距离(公里/天)数据。白天跑步活动的百分比报告为在每天开灯的12小时内进行的总跑步活动。一旦小鼠从轮子上移开,随后立即进行末端实验。gydF4y2Ba
体外肌肉力生成评估gydF4y2Ba
使用Aurora Scientific (ASI)肌肉收缩系统分析EDL和比目鱼肌肉的肌肉发力能力[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].简单地说,用汽化异氟醚麻醉小鼠,切除胫骨前肌(TA),然后缝合并切除EDL或比目鱼肌的近端和远端肌腱。肌肉被调整到最佳长度(Lo),以不断增加的频率进行电刺激,接受三次150赫兹的热身刺激,然后最终评估发力能力。用动态肌肉控制(Dynamic Muscle Control, DMC)和动态肌肉分析(DMA)软件记录和分析肌肉力量数据。生理横截面积(P-CSA)计算为(肌肉重量[mg])/(1.056 ×(0.44或0.71)×长度[mm]),其中1.056 =肌肉密度[g/cm]gydF4y2Ba3.gydF4y2Ba], 0.44 = EDL角因子,0.71 =比目鱼角因子[gydF4y2Ba26gydF4y2Ba].gydF4y2Ba
RNA提取和RT-qPCRgydF4y2Ba
如前所述,进行RNA分离和RT-qPCR [gydF4y2Ba21gydF4y2Ba].简单地说,腓肠肌被移除,在TRIzol试剂(Life Technologies)中快速冷冻,均质,并根据制造商的协议使用RNeasy Plus Mini Kit (Qiagen)分离RNA。利用qScript cDNA SuperMix (QuantaBio)进行cDNA合成。RT-qPCR在Step One Plus Real-Time PCR仪(Applied Biosystems)上进行,使用SYBR Green FastMix (QuantaBio)。每个实验的转录水平都被标准化到其内部gydF4y2BaGapdhgydF4y2Ba然后将基因表达归一化到对照条件。gydF4y2Ba
在qPCR中,我们使用了以下引物:gydF4y2Ba
Dnm1l正向引物5 ' -TTACGGTTCCCTAAACTTCACG-3 'gydF4y2Ba
Dnm1l反向引物5 ' -GTCACGGGCAACCTTTTACGA-3 'gydF4y2Ba
Fis1正向引物5 ' -TGTCCAAGAGCACGCAATTTG-3 'gydF4y2Ba
Fis1反向引物5 ' -CCTCGCACATACTTTAGAGCCTT-3 'gydF4y2Ba
Mfn1正向引物5 ' -CCTACTGCTCCTTCTAACCCA-3 'gydF4y2Ba
Mfn1反向引物5 ' -AGGGACGCCAATCCTGTGA-3 'gydF4y2Ba
Pgc1α正向引物5 ' -TATGGAGTGACATAGAGTG-3 'gydF4y2Ba
Pgc1α反向引物5 ' -CCACTTCAATCCACCCAGAAAG-3 'gydF4y2Ba
组织切片和免疫染色gydF4y2Ba
取出肌肉,4°C放置在30%蔗糖中过夜,在OCT (Tissue Tek)中嵌入,用干冰冷却的异戊烷快速冷冻,在−80°C保存,以10 μm厚切片。在进行免疫染色之前,将组织切片固定在4% PFA中(肌纤维型切片除外),PBS- t (0.2% Triton-x-100在PBS中)渗透10分钟,并在室温(RT)下用10%正常山羊血清(NGS, Jackson ImmunoResearch)封闭30分钟,然后应用一抗。如果使用小鼠一抗,用3% AffiniPure Fab片段山羊抗小鼠(Jackson ImmunoResearch), 2% NGS在RT下阻断切片1小时。在2% NGS/PBS中,一抗在RT下孵育2小时,或在4℃下过夜,然后二抗在RT下孵育1小时。进行DAPI染色以识别细胞核。所有载玻片均使用Fluoromount-G (SouthernBiotech)安装。在Echo Revolve显微镜上以× 4、× 10和× 20倍倍率成像,并使用ImageJ (NIH)进行分析。样本分析由对实验组不知情的调查人员进行。gydF4y2Ba
单FDB肌纤维分离gydF4y2Ba
所有静息细胞质,SR储存钙gydF4y2Ba2 +gydF4y2Ba, MitoSOX实验使用单个急性游离指短屈肌(FDB)肌纤维进行,如前所述[gydF4y2Ba19gydF4y2Ba].从后肢足垫上解剖FDB肌肉,置于林格氏溶液(145 mM NaCl, 5 mM KCl, 2 mM CaCl)中gydF4y2Ba2gydF4y2Ba, 1mm MgClgydF4y2Ba2gydF4y2Ba(10mm HEPES, pH 7.4),加入1mg /mL胶原酶A (Roche Diagnostics, Indianapolis, IN, USA),同时在37°C下轻轻摇动1小时。然后,FDB肌纤维在玻璃底盘子上通过林格氏溶液中使用三个按顺序增加的玻璃移液器轻轻磨解,然后静置20分钟。仅使用条纹清晰且无明显损伤的健康纤维进行实验。gydF4y2Ba
Ca休息gydF4y2Ba2 +gydF4y2Ba测量gydF4y2Ba
静息游离胞质钙gydF4y2Ba2 +gydF4y2Ba浓度的测定如前所述[gydF4y2Ba19gydF4y2Ba].简单地说,分离的FDB肌纤维用4 μM fura-2 AM (Thermo Fisher, Carlsbad, CA, USA)在林格氏溶液中RT加载30分钟,然后在无染料林格氏溶液中冲洗30分钟。负载光纤被放置在倒置荧光显微镜(尼康仪器)的平台上,并使用基于单色仪的照明系统在340和380 nm处交替激发(每个波长曝光20 ms, 2 × 2 binning),使用高速QE CCD相机(TILL Photonics, Graefelfing,德国)捕获510 nm处的荧光发射。使用TILL视觉软件(TILL Photonics Graefelfing,德国)计算感兴趣的细胞质区域的340/380比值,使用ImageJ分析并转换为静息游离CagydF4y2Ba2 +gydF4y2Ba使用前面描述的呋喃-2校准曲线方法的浓度[gydF4y2Ba27gydF4y2Ba].gydF4y2Ba
总可释放SR CagydF4y2Ba2 +gydF4y2Ba存储内容测量gydF4y2Ba
总钙gydF4y2Ba2 +gydF4y2Ba存储内容的确定如前所述[gydF4y2Ba19gydF4y2Ba].简单地说,FDB肌纤维用5 μM fura-FF AM (AAT Bioquest, Sunnyvale, CA, USA)加载,这是一种低亲和率CAgydF4y2Ba2 +gydF4y2Ba染色30分钟,然后在无染料林格氏中冲洗30分钟。总可释放SR CagydF4y2Ba2 +gydF4y2Ba存储含量由fura-FF比值的峰值变化计算(ΔRatiogydF4y2Ba340/380gydF4y2Ba),申请人须递交香港海关证明书gydF4y2Ba2 +gydF4y2Ba10 μM离子霉素、30 μM环哌酸和100 μM EGTA在Ca溶液中释放鸡尾酒gydF4y2Ba2 +gydF4y2Ba无林格氏溶液。使用Clampfit 10.0 (Molecular Devices, Sunnyvale, CA, USA)计算fura-FF比率的峰值变化。gydF4y2Ba
线粒体ROS产生gydF4y2Ba
使用Lee等人改进的程序评估线粒体ROS的产生。[gydF4y2Ba28gydF4y2Ba].简单地说,单个FDB肌纤维用5 μM MitoSOX Red (Thermo Fisher)在Tyrode 's溶液(121 mM NaCl, 5 mM KCl, 1.8 mM CaCl)中培养gydF4y2Ba2gydF4y2Ba, 500 μM MgClgydF4y2Ba2gydF4y2Ba, 400 μM NaHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 5.5 mM葡萄糖,24 mM NaHCOgydF4y2Ba3.gydF4y2Ba(100 μM EDTA)在RT下孵育10分钟,然后在无染料Tyrode溶液中RT孵育10分钟。负载的肌纤维在488 nm处激发,在605 nm处捕获发射。在无染料孵育10分钟后和拍摄初始图像10分钟后拍照。使用尼康Digital Eclipse C1共聚焦显微镜× 40物镜拍摄图像,并使用EZ-C1软件和ImageJ进行图像分析。10分钟后的荧光变化归一化至原始测量值,并报告为ΔgydF4y2BafgydF4y2Ba/gydF4y2BafgydF4y2Ba0gydF4y2Ba.gydF4y2Ba
Western blot分析gydF4y2Ba
TA和比目鱼肌肉在液氮中快速冷冻,并在−80°C保存,直到准备使用。肌肉在RIPA裂解缓冲液(20mm Tris-HCl pH 7.5, 150 mM NaCl, 1 mM Na)中机械均质gydF4y2Ba2gydF4y2BaEDTA, 1mm EGTA, 1% NP-40, 1%脱氧胆酸钠,1mm NagydF4y2Ba3.gydF4y2Ba签证官gydF4y2Ba4gydF4y2Ba, 10 mM NaF),并补充Halt蛋白酶抑制剂,如制造商推荐的。样品在13000℃离心gydF4y2BaggydF4y2Ba30分钟;保留上清液,然后用Bio-Rad DC法测定蛋白浓度(500-0116)。在12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上分离出10微克总蛋白,并转移到硝化纤维膜上。用0.1% Ponceau S溶液(Sigma-Aldrich, P3504)对膜进行短暂染色,以确保相等的蛋白质负载。用一抗在RT下检测膜2小时,或在4°C下摇晃过夜,用TBS-T (20 mM Tris, 150 mM NaCl, 0.1% Tween 20, pH 7.6, 3%牛血清白蛋白)稀释。应用二抗,在TBS-T中加入5%脱脂干牛奶稀释1小时,室温下摇晃。印迹在LI-COR Odyssey凝胶成像系统上成像,并使用Image Studio Lite (LI-COR Biosciences, Lincoln, NE, USA)使用GAPDH作为每个样品的加载对照来量化条带强度。通过评估整个车道的整体强度,对3-NT和oxyblot数据进行分析。gydF4y2Ba
氧化蛋白的氧化印迹gydF4y2Ba
氧化蛋白通过Oxyblot蛋白氧化试剂盒(Millipore)定量,每个样品使用10 μg肌肉裂解液,遵循制造商的协议。gydF4y2Ba
抗体gydF4y2Ba
使用了以下抗体:大鼠抗层结蛋白-α2 (1:1500, Sigma-Aldrich, L0663), DAPI(1:3000),小鼠抗ba - d5 (MyHC-I, IgG2b, 1:40,发育研究杂交瘤库(DSHB)),小鼠抗sc -71 (MyHC-IIA, IgG1, 1:40, DSHB),小鼠抗bf - f3 (MyHC-IIB, IgM, 1:40, DSHB),兔抗pgc1 α (1:1000, Novus Biologicals),兔抗pmca (1:1000, Cell Signaling, D2Z3B),小鼠抗ncx (1:50 00, Swant, 5F10),小鼠抗mfn1 (1:50 00, Neuromab, 75-162),小鼠抗gapdh(1:5万,赛默飞雪,AM4300),小鼠抗casq1 (1:500, Affinity BioReagents, MA3-913),兔抗pan SERCA (1:100, Santa Cruz, sc-30110),兔抗vdac (1:50, Sigma Aldrich),兔抗dnp (1:150, Sigma Aldrich),小鼠抗3- nt (1:100, Sigma Aldrich, N5538), Alexa Fluor 405偶联山羊抗小鼠IgG2b (1:150, Thermo Fisher, A-21141), Alexa Fluor 488偶联山羊抗小鼠IgM (1:150, Thermo Fisher, A-21042), Alexa Fluor 594偶联山羊抗小鼠IgG1 (1:150, Santa Cruz, sc-30110)赛默飞世尔,A-21125), AlexaFluor 488共轭山羊抗小鼠IgG(1:1500,赛默飞世尔,A-11001), AlexaFluor 488共轭山羊抗兔IgG(1:1500,赛默飞世尔,A-11034), AlexaFluor 647共轭山羊抗大鼠IgG(1:1500,赛默飞世尔,A-21247),山羊抗兔irdy800 (1:10000, LiCor),山羊抗小鼠irdy800 (1:10000, LiCor),山羊抗小鼠irdy700 (1:10000, LiCor)。gydF4y2Ba
统计分析gydF4y2Ba
使用GraphPad Prism 9软件进行统计计算。通过Student 's检验统计学意义gydF4y2BatgydF4y2Ba-韦尔奇修正检验(未配对,双尾,95%置信区间)或方差分析(单向或双向,其次是Tukey多重比较检验),其中gydF4y2BapgydF4y2Ba< 0.05为有统计学意义(*gydF4y2Ba/ #gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2Ba/ # #gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2Ba/ # # #gydF4y2BapgydF4y2Ba< 0.001, ****gydF4y2Ba/ # # # #gydF4y2BapgydF4y2Ba< 0.0001)。误差柱表示为平均值的±标准误差(SEM)。gydF4y2Ba
结果gydF4y2Ba
自主轮跑可减轻少年辐照所致骨骼肌功能衰退gydF4y2Ba
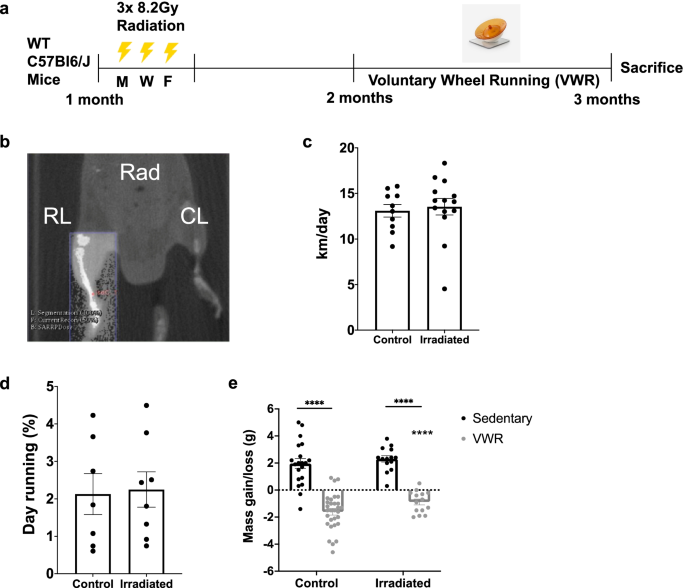
为了评估幼年照射后自主跑步对肌肉功能的影响,4周大的青春期前小鼠的一只后肢在5天内每隔一天接受3次8.2 gy局部辐射(MWF)(图2)。gydF4y2Ba1gydF4y2Bab).治疗后,将小鼠单独圈养,并允许小鼠从8周龄开始进行1个月的自主轮跑(VWR)(图。gydF4y2Ba1gydF4y2Baa).锁住轮子的单室小鼠作为久坐对照组。无论放射治疗如何,在1个月期间,受辐照的幼鼠和未受辐照的小鼠的跑步活动相似(图2)。gydF4y2Ba1gydF4y2Bac).此外,没有观察到跑步活动的昼夜节律模式的差异(图。gydF4y2Ba1gydF4y2Bad).最后,辐照幼鼠和未辐照幼鼠在久坐/VWR条件下分别表现出相似的净体重增加/损失水平(图。gydF4y2Ba1gydF4y2Bae).因此,后肢局部幼年照射不妨碍小鼠参与VWR活动的能力。gydF4y2Ba
尽管辐照,幼鼠在1个月的VWR运动后仍表现出类似的活动和体重变化。gydF4y2Ba一个gydF4y2Ba实验设计对1月龄WT C57Bl6/j小鼠进行3× 8.2 Gy (M, W, F)的幼年分级辐射,然后在2月龄时进行1个月的自主轮跑(VWR)运动。小鼠于3月龄时处死。未受辐射的小鼠和无法接触滚轮的小鼠分别作为辐射和运动对照组。gydF4y2BabgydF4y2Ba小动物辐射研究平台(SARRP)局部x射线照射图像显示区域。gydF4y2BacgydF4y2Ba辐照小鼠和对照未辐照小鼠的跑步活动。每个点代表一只鼠标。gydF4y2BadgydF4y2Ba辐照小鼠和对照未辐照小鼠的日运行百分比。每个点代表一只鼠标。gydF4y2BaegydF4y2BaVWR运动1个月后体重变化(g)。每个点代表一只鼠标。多重比较的双向方差分析****gydF4y2BapgydF4y2Ba< 0.0001。孤立的星号表示运动的方差分析组效应。数据显示为均数±s.e.mgydF4y2Ba
为了检查VWR活性对幼年辐照骨骼肌功能的影响,切除快速收缩的指长伸肌(EDL)和缓慢收缩的比目鱼肌,以评估离体力的产生和收缩动力学(图。gydF4y2Ba2gydF4y2Baa, d,补充图。gydF4y2Ba1gydF4y2Ba).在最大的电刺激下,幼年辐照(Rad RL) EDL和来自久坐小鼠的比目鱼肌肉显示出绝对的缺陷。gydF4y2Ba2gydF4y2Bab)、比力(图;gydF4y2Ba2gydF4y2Bac)与对照组对侧未辐照(Rad CL)肌肉和未辐照(0Gy CTL)久坐小鼠的肌肉进行比较。重要的是,1个月的VWR活动显著减弱了青少年辐射诱导的EDL绝对力缺陷,并恢复了比力能力到控制水平。虽然1个月的VWR活动并没有显著改变Rad RL比目鱼肌的绝对发力能力(图。gydF4y2Ba2gydF4y2Bae),它确实减弱了少年辐照诱导的比力缺陷(图。gydF4y2Ba2gydF4y2Baf).与先前的研究一致,幼年照射导致EDL和比目鱼肌肉质量和单个肌纤维横截面积(CSA)降低(补充图)。gydF4y2Ba2gydF4y2Ba) [gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].然而,VWR活性并没有显著增加Rad RL生肌重量或肌纤维CSA(补充图。gydF4y2Ba2gydF4y2Baa, b).因此,VWR活性减弱了青少年辐射诱导的比力缺陷,与肌肉类型无关,也与肌肉质量或肌纤维大小的任何增加无关。gydF4y2Ba
运动后青少年照射减弱肌肉力量产生能力的缺陷。EDL(左)和比目鱼(右)离体肌肉生理力读数。gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba代表500ms刺激150hz肌肉力(mN)的痕迹。gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba150hz刺激时产生的最大绝对力(mN)。gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba最大比力(mN/mmgydF4y2Ba2gydF4y2Ba)在150赫兹刺激下产生。gydF4y2BangydF4y2Ba= 3-7只小鼠每个条件。多重比较的双向方差分析,*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2Ba/ # #gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2Ba/ # # #gydF4y2BapgydF4y2Ba< 0.001, ****gydF4y2Ba/ # # # #gydF4y2BapgydF4y2Ba< 0.0001。孤立的星号表示运动的ANOVA组效应,孤立的磅号表示辐射的ANOVA组效应。数据显示为平均值±s.e.mgydF4y2Ba
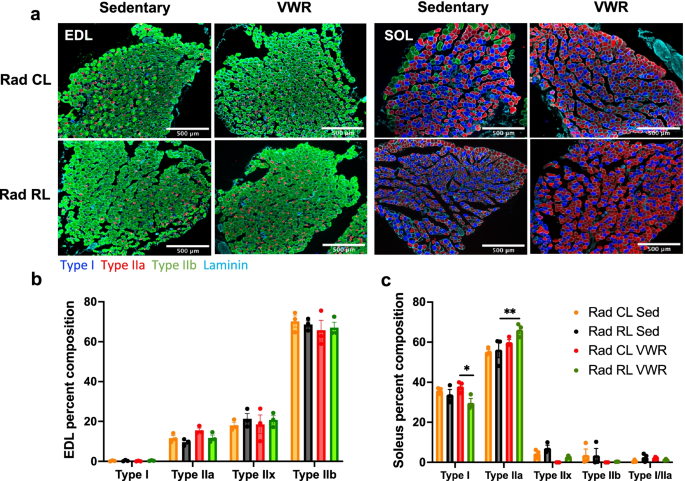
接下来,评估了幼鱼照射和VWR活性对各种肌肉收缩参数的影响。幼年照射导致肌肉冲量(曲线下面积,AUC)和比冲量减少。虽然VWR活性使Rad RL EDL脉冲和比脉冲值恢复到控制水平,但Rad RL比目鱼肌肉中只有比脉冲得到改善(补充图)。gydF4y2Ba1gydF4y2Bac, d, i, j)。与Rad CL和/或0Gy CTL肌肉相比,Rad RL EDL和比目鱼肌肉在刺激时的最大力产生(激活)率显著降低,并且VWR活性在所有条件下对增加肌肉激活率表现出显著的群体效应(补充图。gydF4y2Ba1gydF4y2Bae, k)。幼鱼照射导致EDL和比目鱼肌肉的最大力松弛速率显著降低,而这两种肌肉的最大力松弛速率是由VWR活性所增加的(补充图。gydF4y2Ba1gydF4y2Ba最后,我们评估了EDL肌和比目鱼肌中的肌纤维类型分布(图。gydF4y2Ba3.gydF4y2BaA)确定辐射和运动对纤维型塑性的影响。我们在EDL肌肉中没有发现任何明显的纤维类型转移(图。gydF4y2Ba3.gydF4y2Bab);然而,在VWR后,Rad RL比目鱼肌中观察到从I型肌纤维向IIa型肌纤维的适度(尽管意义重大)转移(图2)。gydF4y2Ba3.gydF4y2Bac)。gydF4y2Ba
青少年辐照锻炼比目鱼肌显示轻微的转移,从I型肌纤维到IIa型。在VWR运动(跑步)或久坐控制1个月后,3个月大的WT辐照小鼠(Rad RL)和未辐照小鼠(Rad CL)的EDL和比目鱼肌肉纤维类型分析。gydF4y2Ba一个gydF4y2Ba肌肉横切面来自久坐(左)和VWR运动(右)、未受辐射的对侧(Rad CL)(上)和受辐射的肢体(Rad RL)(下)肌肉。EDL切片(左)以绿色为主,比目鱼切片(右)以蓝色和红色为主。I型(蓝色)、IIa型(红色)、IIb型(绿色)和层粘连蛋白(蓝绿色)染色切片。IIx型纤维不染色,呈黑色。gydF4y2BabgydF4y2Ba定量的肌肉横截面纤维类型分布gydF4y2Ba一个gydF4y2Ba为gydF4y2BabgydF4y2Ba联盟和gydF4y2BacgydF4y2Ba比目鱼肌的肌肉。gydF4y2BangydF4y2Ba每组3只。多重比较的双向方差分析。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01。比目鱼肌纤维类型数据的变量之间存在显著的相互作用,gydF4y2BapgydF4y2Ba= 0.0006。数据显示为平均值±s.e.mgydF4y2Ba
运动增加钙gydF4y2Ba2 +gydF4y2Ba储存内容在辐照肌肉gydF4y2Ba
在骨骼肌中,钙的调节gydF4y2Ba2 +gydF4y2Ba处理对于兴奋-收缩耦合至关重要,而兴奋-收缩耦合用于驱动肌丝过桥循环和肌肉收缩[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].此外,失调的CagydF4y2Ba2 +gydF4y2Ba搬运与长时间的损伤反应有关,如氧化应激升高,会对肌肉功能产生负面影响[gydF4y2Ba31gydF4y2Ba].我们发现,来自幼年辐照小鼠的肌纤维显示出显著减少静息胞质钙gydF4y2Ba2 +gydF4y2Ba浓度(图。gydF4y2Ba4gydF4y2Baa - c)。重要的是,静息胞浆钙没有显著减少gydF4y2Ba2 +gydF4y2Ba在VWR 1个月后,Rad CL和Rad RL肌纤维之间存在差异。calsequestrin-1 (CASQ1)的表达,是SR的主要CagydF4y2Ba2 +gydF4y2Ba骨骼肌中的结合蛋白,在辐射肌肉中显著减少(图。gydF4y2Ba4gydF4y2Bad, e).我们还观察到肌内质网Ca的表达显著降低gydF4y2Ba2 +gydF4y2Baradrl久坐肌肉中的atp酶(SERCA)泵(补充图)gydF4y2Ba3.gydF4y2Bad, e).但是,1个月的VWR增加了总SR CagydF4y2Ba2 +gydF4y2Ba存储内容(图;gydF4y2Ba4gydF4y2Bad)尽管减少了SERCA表达,但没有引起CASQ1表达的显著变化。总之,这些结果表明,在Rad RL肌肉中观察到的功能下降与正常Ca的中断有关gydF4y2Ba2 +gydF4y2Ba1个月的VWR活动可以通过CagydF4y2Ba2 +gydF4y2Ba处理。gydF4y2Ba
运动增加钙gydF4y2Ba2 +gydF4y2Ba储存内容在辐照肌肉。CagydF4y2Ba2 +gydF4y2Ba在进行1个月的VWR运动(跑步)或久坐控制后,对3个月大的WT小鼠进行辐照(Rad RL)和未辐照(Rad CL)肌肉分析。gydF4y2Ba一个gydF4y2Ba静息胞质钙gydF4y2Ba2 +gydF4y2Ba从装载fura-2的单个FDB肌纤维测量。生物gydF4y2BangydF4y2Ba= 9只小鼠每个条件,技术gydF4y2BangydF4y2Ba值直接显示在图表上,作为每个条件下测量的肌纤维数量。gydF4y2BabgydF4y2Ba单根肌纤维胞质静息钙gydF4y2Ba2 +gydF4y2Ba非辐照对侧的浓度频率分布(Rad CL)和gydF4y2BacgydF4y2Ba辐照(Rad RL) FDB肌纤维。gydF4y2BadgydF4y2BaTA全肌蛋白裂解免疫印迹对未辐照(Rad CL)和辐照(Rad RL)久坐和运动肌肉。gydF4y2BaegydF4y2Bacalsequestrin1蛋白表达的定量研究gydF4y2BadgydF4y2Ba标准化到GAPDH。gydF4y2BaNgydF4y2Ba=每组3只小鼠。gydF4y2BafgydF4y2Ba总SR存储CagydF4y2Ba2 +gydF4y2Ba从静止和运动小鼠中分离的未照射和照射过的单个FDB肌纤维加载fura-FF并灌注ICE耗尽储存液的含量测量。生物gydF4y2BangydF4y2Ba= 4-5只小鼠每个条件,技术gydF4y2BangydF4y2Ba值在图上直接显示为每个条件下测量的肌纤维数量的单个数据点。多重比较的双向方差分析*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2Ba/ # # #gydF4y2BapgydF4y2Ba< 0.001,gydF4y2Ba# # # #gydF4y2BapgydF4y2Ba< 0.0001。孤立的星号表示运动的方差分析组效应。孤立的磅符号表示辐射的方差分析组效应。在静息胞浆钙的分析中,观察到变量之间有显著的相互作用gydF4y2Ba2 +gydF4y2Ba,gydF4y2BapgydF4y2Ba= 0.0375。数据显示为平均值±s.e.mgydF4y2Ba
运动可降低受照射肌肉的亚硝化和线粒体氧化应激gydF4y2Ba
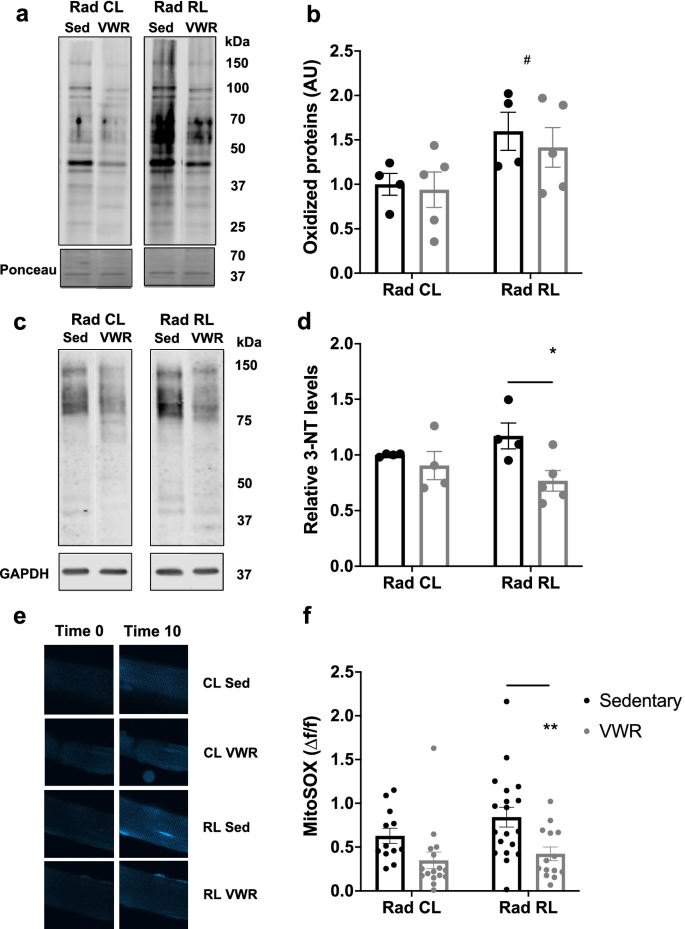
由钙引起的几种肌肉疾病gydF4y2Ba2 +gydF4y2Ba调节失调,包括中枢核心疾病(CCD)和恶性高热(MH),导致氧化应激增加和线粒体功能障碍[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].同样,电离辐射增加骨骼肌中活性氧和氮素(ROS/RNS)的产生,既可急性地通过水解产生,也可慢性地由于受损的细胞器,特别是线粒体产生[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba].此外,运动上调抗氧化途径,以增强重复肌肉收缩产生的ROS的清除,从而保留适当的信号,钙gydF4y2Ba2 +gydF4y2Ba调节,以及整体肌肉功能[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].为此,我们确定了VWR对辐照骨骼肌中增强的ROS/RNS产生和整体氧化/亚硝化应激的影响。对整个比目鱼肌肉裂解物的氧印迹分析显示,幼鱼照射后,整体蛋白质氧化升高,而VWR活性并未加剧(图2)。gydF4y2Ba5gydF4y2Baa, b).为了评估亚硝化应激,我们评估了3-硝基酪氨酸(3-NT)的水平,这是RNS介导的酪氨酸硝化的产物。我们观察到Rad RL久坐肌肉中3-NT水平显著升高,VWR后降低(图2)。gydF4y2Ba5gydF4y2Bac, d).最后,我们使用线粒体ROS传感器MitoSOX Red直接评估对照小鼠和辐照小鼠急性游离指短屈肌(FDB)肌纤维中线粒体ROS的产生率[gydF4y2Ba41gydF4y2Ba].与运动诱导的ROS解毒增加一致,Rad RL小鼠在VWR 1个月后FDB肌纤维中ROS生成的最大速率显著降低(图2)。gydF4y2Ba5gydF4y2Bae, f).这些研究结果表明,运动可以通过降低细胞RNS和线粒体ROS水平的联合作用改善青少年照射后的肌肉功能。gydF4y2Ba
运动可降低受照射肌肉的亚硝化和线粒体氧化应激。gydF4y2Ba一个gydF4y2Ba比目鱼全肌蛋白裂解氧印迹来自未辐照(Rad CL)和辐照(Rad RL)肌肉在久坐和运动小鼠。gydF4y2BabgydF4y2Ba氧化蛋白的定量gydF4y2Ba一个gydF4y2Ba归一化为ponceau染色和未辐照(Rad CL)久坐肌。gydF4y2BaNgydF4y2Ba=每组4-5只小鼠。gydF4y2BacgydF4y2Ba比目鱼全肌蛋白裂解物3-硝基酪氨酸(3-NT)免疫印迹,来自未辐照(Rad CL)和辐照(Rad RL)小鼠的久坐和运动肌肉。gydF4y2BadgydF4y2Ba3-NT水平的定量归一化到GAPDH和非辐照久坐对照组gydF4y2BacgydF4y2Ba免疫印迹。gydF4y2BaNgydF4y2Ba=每组4-5只小鼠。gydF4y2BaegydF4y2Ba在时间0和时间10 (min)时,静止和运动小鼠的未辐照(Rad CL)和辐照(Rad RL)肌肉中加载MitoSOX red的FDB肌纤维图像。gydF4y2BafgydF4y2BaMitoSOX荧光定量研究gydF4y2BaegydF4y2Ba.技术gydF4y2BangydF4y2Ba直接显示在图表上,生物gydF4y2BangydF4y2Ba=每组5只小鼠。多重比较的双向方差分析。*gydF4y2Ba/ #gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01。孤立的星号表示运动的方差分析组效应。孤立的磅符号表示辐射的方差分析组效应。数据显示为平均值±s.e.mgydF4y2Ba
运动使受辐射肌肉的线粒体基因表达谱适应gydF4y2Ba
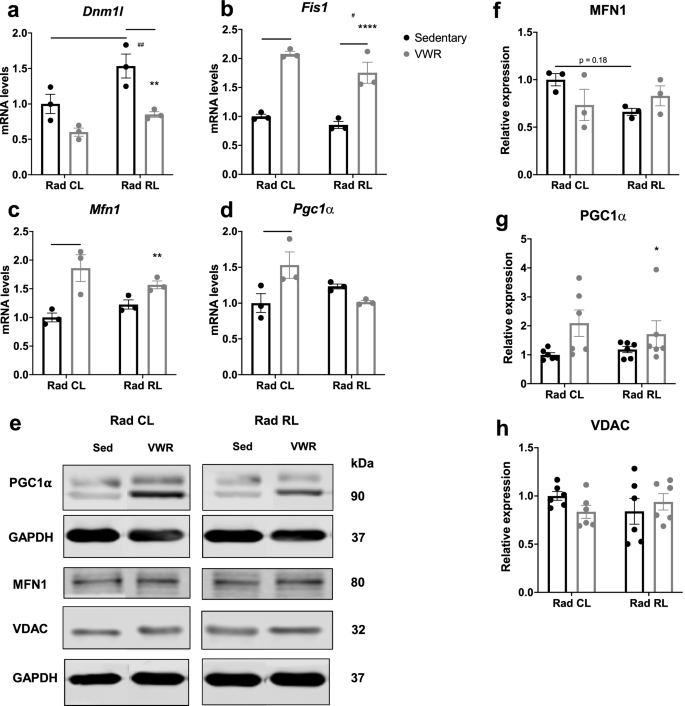
上述发现提出了VWR缓解辐照后线粒体ROS生成增加的机制的问题。如前所述,辐射会导致线粒体损伤,而运动则会诱导适应线粒体动力学并促进线粒体生物发生的信号传导过程[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].我们首先通过评估动力蛋白1的mRNA水平来评估与线粒体裂变和分解相关的信号,如(gydF4y2BaDnm1lgydF4y2Ba)和线粒体裂变1 (gydF4y2BaFis1gydF4y2Ba).我们观察到表达升高gydF4y2BaDnm1lgydF4y2BaRad RL久坐肌的转录本(图;gydF4y2Ba6gydF4y2BaA),以及升高的表达gydF4y2BaFis1gydF4y2BaVWR后小鼠Rad CL和RL肌肉的转录本(图2)。gydF4y2Ba6gydF4y2Bab).为了评估与线粒体融合和生物发生相关的信号,我们量化了mitofusin 1 (gydF4y2BaMfn1gydF4y2Ba)和PPARgamma辅激活因子1- α (gydF4y2BaPgc1αgydF4y2Ba)转录水平。两种转录本仅在VWR后小鼠Rad CL肌肉中显著增加(图2)。gydF4y2Ba6gydF4y2Ba最后,我们评估了MFN1、PGC1α和电压依赖性阴离子通道(VDAC)的蛋白表达水平,以VDAC水平作为线粒体总含量的读数(图。gydF4y2Ba6gydF4y2Ba情况)。而gydF4y2BaMfn1gydF4y2BaVWR 1个月后转录水平升高,但在有或没有1个月的VWR照射后,蛋白质水平没有观察到差异(图2)。gydF4y2Ba6gydF4y2Baf).虽然VDAC表达未见明显变化(图。gydF4y2Ba6gydF4y2Bah), VWR 1个月后PGC1α表达明显升高(图;gydF4y2Ba6gydF4y2Bag).有趣的是,线粒体CagydF4y2Ba2 +gydF4y2Bauniporter (MCU),负责线粒体CagydF4y2Ba2 +gydF4y2Ba肌肉摄取,在VWR后减少(补充图。gydF4y2Ba3.gydF4y2Bad, f). VWR后所观察到的MCU表达减少可能反映了肌肉适应旨在限制氧化应激水平,因为线粒体Ca增加gydF4y2Ba2 +gydF4y2Ba摄取与线粒体ROS生成增加有关[gydF4y2Ba46gydF4y2Ba].综上所述,这些数据与VWR驱动改变的基因表达特征相一致,该特征旨在适应线粒体动力学和生物发生,以减少ROS的产生并改善幼年辐照肌肉的肌肉功能。gydF4y2Ba
运动使受辐射肌肉的线粒体基因表达谱适应。gydF4y2Ba一个gydF4y2Ba照射(Rad RL)和未照射(Rad CL)的3月龄WT小鼠在VWR运动(跑步)或久坐控制1个月后的全肌肉mRNA表达gydF4y2BaDnm1lgydF4y2Ba,gydF4y2BabgydF4y2BaFis1gydF4y2Ba,gydF4y2BacgydF4y2BaMfn1gydF4y2Ba,gydF4y2BadgydF4y2BaPgc1αgydF4y2Ba.mRNA水平报告为相对于的折叠变化gydF4y2BaGapdhgydF4y2Ba并归一化为不受辐射的久坐对照组。gydF4y2BaNgydF4y2Ba每组3只。gydF4y2BaegydF4y2BaTA全肌蛋白裂解免疫印迹检测PGC1α, MFN1和VDAC。量化的gydF4y2BafgydF4y2BaMFN1,gydF4y2BaggydF4y2BaPGC1a,gydF4y2BahgydF4y2Ba从TA裂解物I的免疫印迹中显示,VDAC蛋白水平归一化至GAPDH和未辐照的久坐对照组。gydF4y2BangydF4y2Ba= 3只小鼠,除PGC1α和VDAC外,gydF4y2BangydF4y2Ba= 6。多重比较的双向方差分析。*gydF4y2Ba/ #gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2Ba/ # #gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001, ****gydF4y2BapgydF4y2Ba< 0.0001。孤立的星号表示运动的方差分析组效应。孤立的磅符号表示辐射的方差分析组效应。的分析中观察到变量之间有显著的相互作用gydF4y2BaPgc1αgydF4y2Ba转录水平gydF4y2BadgydF4y2Ba,gydF4y2BapgydF4y2Ba= 0.0113。数据显示为平均值±s.e.mgydF4y2Ba
讨论gydF4y2Ba
在这里,我们评估了运动作为一种潜在的治疗干预措施的可行性,以恢复青少年照射后受损的肌肉功能。根据该领域先前的发现,电离辐射导致肌肉萎缩、祖细胞周期停滞和死亡,以及持续的炎症信号传导[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].我们发现,1个月的VWR锻炼提高了比力产生能力,无论与适应钙相关的肌肉类型如何gydF4y2Ba2 +gydF4y2Ba处理以及减少氧化/亚硝化应激。gydF4y2Ba
兴奋-收缩耦合是横小管膜中的电信号(即动作电位)转换为Ca的过程gydF4y2Ba2 +gydF4y2Ba释放用于驱动肌丝的过桥循环,这是肌肉力量产生的基础[gydF4y2Ba47gydF4y2Ba].钙功能障碍gydF4y2Ba2 +gydF4y2Ba对骨骼肌的处理是多种肌肉疾病的基础,包括MH、CCD和管状聚集肌病(TAM) [gydF4y2Ba29gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].我们实验室之前报道的RNA测序(RNAseq)数据显示,几个关键Ca的表达显著降低gydF4y2Ba2 +gydF4y2Ba处理基因(包括CASQ1、CACNB1、CACNG1和TNNT3) [gydF4y2Ba4gydF4y2Ba].与此一致,我们发现久坐Rad RL小鼠肌肉中CASQ1蛋白表达显著降低。CASQ1聚合使Ca增加gydF4y2Ba2 +gydF4y2BaCASQ1表达的减少可能部分解释了久坐小鼠在Rad RL肌肉中观察到的峰值比力产生的减少。类似地,来自久坐小鼠的Rad RL肌肉中SERCA表达的减少可能有助于观察到的最大收缩松弛速率的降低。静息胞质钙gydF4y2Ba2 +gydF4y2Ba肌肉中的钙含量受到严格的调节控制,以维持适当的蛋白质平衡和肌肉张力,此外还调节大量其他钙gydF4y2Ba2 +gydF4y2Ba依赖细胞过程。我们发现游离静息胞质CagydF4y2Ba2 +gydF4y2Ba降低了久坐小鼠Rad RL肌纤维的浓度。研究了静息钙含量降低的机理gydF4y2Ba2 +gydF4y2Ba浓度不清楚。我们定量了质膜Ca的表达gydF4y2Ba2 +gydF4y2BaATPase (PMCA)泵和NagydF4y2Ba+gydF4y2BacagydF4y2Ba2 +gydF4y2Ba交换剂(NCX)可能是胞质钙还原的潜在机制gydF4y2Ba2 +gydF4y2Ba.然而,PMCA和NCX表达在VWR后都有所增加,这与旨在增强Ca的运动的适应性反应一致gydF4y2Ba2 +gydF4y2Ba流出。增加了细胞内钙的复杂性gydF4y2Ba2 +gydF4y2Ba处理,尽管总SR Ca增加gydF4y2Ba2 +gydF4y2BaVWR后,SERCA表达降低。或者,增强的CagydF4y2Ba2 +gydF4y2BaVWR后观察到的商店含量反映了商店经营Ca的增加gydF4y2Ba2 +gydF4y2BaI带内SR和横小管膜之间的特化连接的运动依赖性重塑(称为“CagydF4y2Ba2 +gydF4y2Ba入职单位”)[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].gydF4y2Ba
CagydF4y2Ba2 +gydF4y2Ba在调节线粒体功能方面也起着关键作用。线粒体钙gydF4y2Ba2 +gydF4y2Ba摄取可使线粒体电位去极化,刺激三羧酸循环的酶,促进ATP的产生[gydF4y2Ba51gydF4y2Ba],而线粒体CagydF4y2Ba2 +gydF4y2Ba可增加ROS的产生,触发线粒体通透性过渡孔的打开,最终导致线粒体肿胀和细胞死亡[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba52gydF4y2Ba].我们发现VWR后1个月MCU表达显著降低,这可能反映了一种旨在限制线粒体Ca的保护机制gydF4y2Ba2 +gydF4y2Ba过量,ROS产生和线粒体肿胀/损伤。这一观察结果支持了先前的工作,即VWR运动促进线粒体与Ca的耦合gydF4y2Ba2 +gydF4y2Ba释放单元(三联征),降低肌肉的氧化应激[gydF4y2Ba22gydF4y2Ba].电离辐射直接促进线粒体DNA损伤,以及线粒体内外膜的结构损伤,从而损害细胞器的完整性[gydF4y2Ba14gydF4y2Ba].这些改变可导致受损线粒体产生更多ROS,使辐射诱导的ROS失衡持续存在[gydF4y2Ba53gydF4y2Ba].ROS/RNS水平升高也能增强CagydF4y2Ba2 +gydF4y2Ba通过增加ryanodine受体SR Ca的开放概率,从SR泄漏gydF4y2Ba2 +gydF4y2Ba释放通道,导致SR Ca的减少gydF4y2Ba2 +gydF4y2Ba内容(gydF4y2Ba48gydF4y2Ba,gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba].我们发现,经过1个月的VWR运动后,受辐射的久坐幼鼠肌纤维中的线粒体比受辐射的小鼠肌纤维中的线粒体产生明显更多的ROS。在整个肌肉中也观察到氧化应激和亚硝化应激的增加,因为在VWR 1个月后,来自受辐射的久坐后肢的肌肉裂解物与来自受辐射小鼠的肌肉相比,显示出氧化和3-NT蛋白水平的增加。gydF4y2Ba
由于运动刺激线粒体生物发生,我们探索了VWR运动对幼年照射后受损的、产生高ros的线粒体的潜在清除的影响[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].通过量化与线粒体裂变(Dnm1l, Fis1)、融合(Mfn1)和生物发生(Pgc1a)相关的转录物和蛋白质水平,我们观察到VWR后辐照小鼠肌肉中与适应线粒体动力学和改善内稳态一致的基因表达特征。另一方面,来自久坐幼年小鼠的辐射肌肉显示出一种基因表达谱,表明在缺乏线粒体生物发生的情况下,更倾向于增加线粒体分解。这些观察结果与我们的观察结果一致,即VWR后小鼠线粒体产生的ROS较少。gydF4y2Ba
值得注意的是,VWR诱发了骨骼肌功能的几种独立适应。然而,这些运动的普遍好处并不减损,而是补充了辐射环境下特别产生的其他好处。这项研究的局限性是不能在同一肌肉群中进行所有分析。由于在VWR运动中涉及足底屈曲的肌肉通常更活跃,因此在VWR运动中仅适度运动的肌肉中评估一些影响时,可能无法检测到。这项研究的另一个局限性是所有的研究都使用了雄性小鼠。雌性小鼠的跑步活动增加[gydF4y2Ba56gydF4y2Ba]和肌肉抗氧化活性[gydF4y2Ba57gydF4y2Ba].因此,雌性小鼠肌肉对1个月VWR的适应性反应可能更大。先前的研究报告称,儿童癌症的女性幸存者不成比例地受到青少年照射的影响,并更频繁地出现肌肉减少症[gydF4y2Ba58gydF4y2Ba].因此,在幼年照射后,雌性可能会经历更大的反应和锻炼的好处。未来的研究需要量化辐射后幼年雌性小鼠耐力锻炼的益处。gydF4y2Ba
结论gydF4y2Ba
虽然1个月的VWR并没有阻止肌肉质量的减少和完全恢复原始力的产生,但辐照小鼠比目鱼和EDL肌肉的比力产生都得到了挽救。这些结果表明,在辐射后耐力训练的补充中加入抗阻力训练或针对其他青少年辐射相关表型(如肌肉干细胞损失、持续性炎症和纤维化)的干预措施[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba]可能有助于刺激肌肉生长和肥厚,从而延缓或可能预防肌肉减少症的发生。本研究证实了CagydF4y2Ba2 +gydF4y2Ba耐力运动后的处理、抗氧化反应和线粒体稳态与幼年照射治疗后骨骼肌功能的改善有关。这些发现支持了转化运动治疗范式的发展,旨在最大限度地提高肌肉功能,改善不断增长的青少年癌症幸存者的生活质量。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中分析的数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- SARRP:gydF4y2Ba
-
小动物辐射研究平台gydF4y2Ba
- VWR:gydF4y2Ba
-
自愿轮跑gydF4y2Ba
- SR:gydF4y2Ba
-
肌浆网gydF4y2Ba
- 联盟:gydF4y2Ba
-
指长伸肌gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- RNS:gydF4y2Ba
-
活性氮gydF4y2Ba
- 客服人员:gydF4y2Ba
-
横截面积gydF4y2Ba
- ATP:gydF4y2Ba
-
三磷酸腺苷gydF4y2Ba
- 助教:gydF4y2Ba
-
胫前肌gydF4y2Ba
- P-CSA:gydF4y2Ba
-
生理横截面积gydF4y2Ba
- 互补脱氧核糖核酸:gydF4y2Ba
-
互补脱氧核糖核酸gydF4y2Ba
- RT-qPCR:gydF4y2Ba
-
逆转录酶定量聚合酶链反应gydF4y2Ba
- GAPDH:gydF4y2Ba
-
Glyceraldehyde-3-phosphate脱氢酶gydF4y2Ba
- Dnm1l:gydF4y2Ba
-
像Dynamin 1gydF4y2Ba
- Fis1:gydF4y2Ba
-
裂变,线粒体gydF4y2Ba
- Mfn1:gydF4y2Ba
-
Mitofusin 1gydF4y2Ba
- Pgc1α:gydF4y2Ba
-
过氧化物酶体增殖物激活受体γ辅激活剂1 αgydF4y2Ba
- RT:gydF4y2Ba
-
室温gydF4y2Ba
- 身上:gydF4y2Ba
-
指短屈肌gydF4y2Ba
- 3 nt:gydF4y2Ba
-
3-NitrotyrosinegydF4y2Ba
- MWF:gydF4y2Ba
-
星期一、星期三和星期五gydF4y2Ba
- Rad RL:gydF4y2Ba
-
被照射的老鼠的四肢gydF4y2Ba
- Rad CL:gydF4y2Ba
-
辐照小鼠,未辐照的对侧肢体gydF4y2Ba
- 0 gy CTL:gydF4y2Ba
-
非辐照鼠标控制gydF4y2Ba
- CASQ1:gydF4y2Ba
-
隐钙素1gydF4y2Ba
- SERCA的:gydF4y2Ba
-
Sarco/内质网钙atp酶gydF4y2Ba
- CCD:gydF4y2Ba
-
中央核疾病gydF4y2Ba
- MH:gydF4y2Ba
-
恶性高热gydF4y2Ba
- 单片机:gydF4y2Ba
-
线粒体钙单转运体gydF4y2Ba
- VDAC:gydF4y2Ba
-
电压依赖性阴离子通道gydF4y2Ba
- TAM:gydF4y2Ba
-
管状聚集肌病gydF4y2Ba
- RNAseq:gydF4y2Ba
-
RNA序列gydF4y2Ba
参考文献gydF4y2Ba
李佳,杨荣荣,杨国强。癌症与放射治疗:当前进展与未来发展方向。9.中华医学杂志2012;gydF4y2Ba
Bachman JF, Chakkalakal JV。在出生后发育过程中肌肉干细胞动力学的洞察。2021年2月。gydF4y2Ba
Paris ND, Kallenbach JG, Bachman JF, Blanc RS, Johnston CJ, Hernady E,等。放化疗损害小儿肿瘤模型肌纤维肥厚性生长。科学通报2020;10(1)。gydF4y2Ba
Bachman JF, Blanc RS, Paris ND, Kallenbach JG, Johnston CJ, Hernady E,等。辐射对青春期前Pax7+骨骼肌干细胞的损伤导致肌纤维大小和核数量的终身缺陷。iScience。2020; 23(11)。gydF4y2Ba
Kallenbach JG, Bachman JF, Paris ND, Blanc RS, O 'Connor T, Furati E,等。儿童放射治疗和肿瘤消除对肌肉特异性功能缺陷和终生纤维化的反应。恶病质肌减少肌。2022。gydF4y2Ba
陈志强,陈志强,陈志强,等。儿童急性淋巴细胞白血病成人幸存者的身体组成、肌肉力量缺陷和活动限制。儿科血癌。2007;49(7)。gydF4y2Ba
Ness KK, Mertens AC, Hudson MM, Wall MM, Leisenring WM, Oeffinger KC,等。儿童癌症长期幸存者的身体表现和日常活动的限制。安实习医学2005;143(9)。gydF4y2Ba
Ness KK, Armstrong GT, Kundu M, Wilson CL, Tchkonia T, Kirkland JL。儿童癌症幸存者的虚弱。癌症。2015;121年。gydF4y2Ba
小儿四肢肉瘤放射治疗的晚期疗效。中华放射医学杂志2004;30(1)。gydF4y2Ba
Gianfaldoni S, Gianfaldoni R, Wollina U, Lotti J, Tchernev G, Lotti T.放射治疗概述:从历史到目前在皮肤病学中的应用。中国医学杂志,2017;5(4)。gydF4y2Ba
Quirós PM, Ramsay AJ, Sala D, Fernández-Vizarra E, Rodríguez F, Peinado JR,等。线粒体蛋白酶OMA1的缺失改变了GTPase OPA1的加工过程,导致小鼠肥胖和产热缺陷。Embo j . 2012;31(9)。gydF4y2Ba
拉提坎JA, Micewicz ED,谢MW, Schaue d。癌症杂志2015;368。gydF4y2Ba
山森T,安井H,山泉M,和田Y,中村Y,中村H,等。在细胞周期检查点的控制下,电离辐射诱导线粒体活性氧产生,同时线粒体电子传递链功能和线粒体含量上调。中国生物医学杂志2012;53(2)。gydF4y2Ba
Kam WWY, Banati RB。电离辐射对线粒体的影响。65.中国生物医学杂志,2013;gydF4y2Ba
Gaschler MM, Stockwell BR。细胞死亡中的脂质过氧化作用。生物化学生物物理学报,2017;482。gydF4y2Ba
费拉罗E, Giammarioli AM, Chiandotto S, Spoletini I, Rosano G.运动诱导的骨骼肌重塑和代谢适应:氧化还原信号和自噬的作用。抗氧化氧化还原信号。2014;21(1)。gydF4y2Ba
汤川O,中泽t。辐射诱导的肝微粒体脂质过氧化和膜结合酶。中华放射生物学杂志,1980;37(5)。gydF4y2Ba
鲁宾逊MM, Dasari S, Konopka AR, Johnson ML, Manjunatha S, Esponda RR,等。增强的蛋白质翻译是改善年轻人和老年人对不同运动训练模式的代谢和身体适应的基础。中国生物医学工程学报。2017;25(3)。gydF4y2Ba
Michelucci A, Boncompagni S, Pietrangelo L, García-Castañeda M, Takano T, Malik S,等。横小管重塑增强骨骼肌中orai1依赖的Ca2+进入。eLife。2019年,8。gydF4y2Ba
Boncompagni S, Rossi AE, Micaroni M, Beznoussenko GV, Polishchuk RS, Dirksen RT,等。线粒体通过发育调节的系留结构与横纹肌中的钙储存联系在一起。Mol Biol Cell, 2009;20(3)。gydF4y2Ba
刘伟,刘志刚,刘志刚,等。青春期前骨骼肌生长需要pax7表达卫星细胞来源的肌核贡献。开发(剑桥)。2018; 145(20)。gydF4y2Ba
Pietrangelo L, Michelucci A, Ambrogini P, Sartini S, Guarnier FA, Fusella A,等。肌肉活动阻止线粒体从老化和废弃引起的ca2 +释放单元中解耦。生物化学学报。2019;663。gydF4y2Ba
鲍尔斯SK,杰克逊MJ。运动诱导的氧化应激:细胞机制和对肌肉力量产生的影响。物理学Rev. 2008;88。gydF4y2Ba
刘伟,Klose A, Forman S, Paris ND,魏- lapierre L, Cortés-Lopéz M,等。成人骨骼肌干细胞的丢失导致与年龄相关的神经肌肉连接变性。eLife。2017; 6。gydF4y2Ba
刘伟,魏拉皮埃尔,柯洛泽A,德克森RT,查卡拉卡尔JV。成人骨骼肌干细胞的诱导耗竭损害神经肌肉连接的再生。eLife。2015; 4 (AUGUST2015)。gydF4y2Ba
胡晓明,王晓明,段东,等。小鼠指长伸肌离体和胫骨前肌原位肌肉功能的评价。J Vis Exp. 2013;(72)。gydF4y2Ba
陈建平,陈建平,陈建平,等。AICAR预防RyR1突变小鼠热致猝死,与AMPK激活无关。中华外科杂志,2012;18(2)。gydF4y2Ba
李cs, Hanna AD, Wang H, Dagnino-Acosta A, Joshi AD, Knoblauch M,等。一种化学伴侣改善了RyR1突变小鼠的肌肉功能。大自然。通信。2017;8。gydF4y2Ba
Michelucci A, García-Castañeda M, Boncompagni S, Dirksen RT. STIM1/ orai1介导的Ca2+进入在骨骼肌生理和疾病中的作用。细胞钙。2018;76。gydF4y2Ba
王志刚,王志刚,王志刚,王志刚。二氢吡啶受体α - 1s和β - 1a亚基在骨骼肌兴奋-收缩耦合中的功能等效性。37.生物学决议2004;gydF4y2Ba
杜勒姆WJ, Aracena-Parks P, Long C, Rossi AE, Goonasekera SA, Boncompagni S,等。RyR1 s -亚硝基化是Y522S RyR1敲入小鼠环境中暑和猝死的基础。细胞。2008;133(1)。gydF4y2Ba
Canato M, Capitanio P, Cancellara L, Leanza L, Raffaello A, Reane DV,等。Y522S-RYR1敲入小鼠线粒体中Ca2 +的过度积累:肌浆网泄漏和氧化还原状态改变之间的联系。10.《前沿物理》2019;gydF4y2Ba
Avila G, Lee EH, Perez CF, Allen PD, Dirksen RT. FKBP12与RyR1结合调节小鼠骨骼肌管的兴奋-收缩耦合。中国生物化学杂志,2003;27(2)。gydF4y2Ba
Boncompagni S, Loy RE, Dirksen RT, Franzini-Armstrong C. 1型ryanodine受体I4895T突变诱导骨骼肌纤维型特异性改变,模拟过早衰老。衰老细胞。2010;9(6)。gydF4y2Ba
de Lisio M, Kaczor JJ, Phan N, Tarnopolsky MA, Boreham DR, Parise G.运动训练增强骨骼肌对辐射诱导氧化应激的反应。肌肉神经。2011;43(1)。gydF4y2Ba
Purbey PK, Scumpia PO, Kim PJ, Tong AJ, Iwamoto KS, McBride WH,等。定义的传感机制和信号通路有助于电离辐射引起的全球炎症基因表达输出。免疫力。2017;47(3)。gydF4y2Ba
Anuranjani BM。Nrf2-ARE通路、MRN复合体、HMGB1和炎症因子的协同作用——在辐射损伤修饰中的意义2.氧化还原生物学,2014;gydF4y2Ba
McBride WH, Schaue D.辐射诱导组织损伤和反应。《病理学》,2020;250。gydF4y2Ba
Nilsson MI, Bourgeois JM, Nederveen JP, Leite MR, Hettinga BP, Bujak AL,等。终身有氧运动可以预防炎症和癌症。公共科学图书馆,2019;14(1)。gydF4y2Ba
Michelucci A, Paolini C, Boncompagni S, Canato M, Reggiani C, Protasi F.剧烈运动引发恶性高热易感小鼠的危及生命的反应。中国科学院学报,2017;31(8)。gydF4y2Ba
Robinson KM, Janes MS, Pehar M, Monette JS, Ross MF, Hagen TM,等。利用乙锭基探针对体内超氧化物进行选择性荧光成像。中国科学院学报(自然科学版)2006;43(4)。gydF4y2Ba
qisar R, Bhaskaran S, van Remmen H.运动与再生过程中肌纤维类型的多样化。游离自由基生物医学。2016;98。gydF4y2Ba
小杰克逊,柯比TJ,弗莱CS,库珀RL,麦卡锡JJ,彼得森CA,等。在成年小鼠中,由于肌肉卫星细胞耗竭而导致的协调性受损与自主跑步性能下降有关。骨骼肌。2015;5(1)。gydF4y2Ba
维尼尔C,卢克扬年科L,巴图A,德勒鲁耶勒S, Pradère JP, le Gonidec S,等。运动蛋白可逆转年龄相关的肌肉减少症。中国医学杂志,2018;24(9)。gydF4y2Ba
王志刚,王志刚,王志刚。小鼠自主轮跑运动模式及其生理效应。中国医学生物学杂志2019;52(1)。gydF4y2Ba
Brookes PS, Yoon Y, Robotham JL, Anders MW, Sheu SS.钙,ATP和ROS:线粒体的爱恨三角关系。美国医学杂志,2004;287。gydF4y2Ba
骨骼肌兴奋-收缩耦合:最新进展和未解问题。12.生物物理学Rev. 2020;gydF4y2Ba
Michelucci A, Liang C, Protasi F, Dirksen RT. Ca2+处理和氧化应激改变是衰老和疾病中线粒体损伤和骨骼肌功能障碍的基础。代谢物。2021;11。gydF4y2Ba
Perez CF, Eltit JM, Lopez JR, Bodnár D, Dulhunty AF, Aditya S,等。DHPR-β1a亚基(CACNB1)一种新的恶性热易感变异的功能和结构特征。中国生物医学工程学报。2018;36(3)。gydF4y2Ba
Boncompagni S, Michelucci A, Pietrangelo L, Dirksen RT, Protasi F.骨骼肌中促进STIM1-Orai1组装的运动依赖性新连接的形成。科学通报2017;7(1)。gydF4y2Ba
罗茜,李志刚。骨骼肌中肌浆网-线粒体共生的双向信号通路。37.运动科学,2009;gydF4y2Ba
Brini M, Carafoli E.质膜Ca2+ atp酶和质膜钠钙交换剂共同调节细胞钙。中国生物医学工程学报。2011;3(2)。gydF4y2Ba
李志强,李志强,李志强。电离辐射诱导代谢氧化应激与细胞损伤的关系。癌症杂志2012;327。gydF4y2Ba
Ivarsson N, Mikael Mattsson C, Cheng AJ, Bruton JD, Ekblom B, Lanner JT,等。骨骼肌纤维中的SR Ca2+泄漏作为细胞内信号来增加抗疲劳能力。J Gen physil . 2019;151(4)。gydF4y2Ba
李志强,李志强,李志强,李志强,等。急性RyR1 Ca2+泄漏增强nadh连接的线粒体呼吸能力。大自然。通信。2021;12(1):7219。gydF4y2Ba
Claghorn GC, Thompson Z, Wi K, Van L, Garland T.咖啡因刺激小鼠自主轮跑,但不增加有氧能力。《生理行为学》2017;170。gydF4y2Ba
Michelucci A, Boncompagni S, Canato M, Reggiani C, Protasi F.雌激素通过减少肌肉氧化应激来保护calsequestrin-1敲除小鼠免于致命的高温发作。《氧化医学细胞》,2017;gydF4y2Ba
麦卡斯兰·K,豪威尔·CR,威尔士·CE,王z,威尔逊·CL,穆德·HL,等。儿童癌症成年幸存者线粒体拷贝数与骨骼肌减少症的关系。中华肿瘤学杂志,2016;21(11)。gydF4y2Ba
确认gydF4y2Ba
我们要感谢Sundeep Malik在Western blots和分析方面的帮助,Linda Groom在MitoSOX协议方面的帮助,以及Lan wee - lapierre在SR Ca方面的帮助gydF4y2Ba2 +gydF4y2Ba测量。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了URMC威尔莫特癌症研究所博士前奖学金拨款(JGK)和NIH拨款R01AG051456 (JVC), R01CA220467 (JVC)和R01AR053349 (RTD)的支持。SARRP通过1S10OD021548-01 (JPW)获得。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
TNO、RTD和JVC构思了这项研究。TNO, JGK, JVC和RTD设计了实验,并为手稿的撰写做出了贡献。TNO、JGK和HMO负责数据收集和分析。TNO、JGK、HMO、RTD、JVC参与数据解释。CJJ、EH、NDP和JFB分别进行了分级照射。TNO进行了自愿轮跑。JGK进行离体肌肉生理。TNO进行RT-qPCR分析、切片、免疫染色;FDB肌纤维分离和随后的静息细胞质和SR储存钙gydF4y2Ba2 +gydF4y2Ba测量和分析;MitoSOX测量和分析;西方印迹和分析。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
所有小鼠实验均按照机构和国家动物实验管理委员会的伦理标准进行。本手稿的作者证明他们遵守的道德准则的作者和发表在gydF4y2Ba骨骼肌杂志gydF4y2Ba.gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1。gydF4y2Ba
生理学方差分析表。gydF4y2Ba
附加文件2。gydF4y2Ba
免疫印迹。gydF4y2Ba
附加文件3:图S1gydF4y2Ba
.运动后青少年照射改善中断的肌肉收缩动力学。EDL(左)和比目鱼(右)gydF4y2Ba体外gydF4y2Ba生理学收缩动力学。a, g) 500ms电刺激的绝对力频率曲线。b, h) 500ms电刺激比力频率曲线,归一化为生理横截面积(P-CSA)。c, i)脉冲(mN*sec)在150Hz下500ms刺激时作为曲线下面积的测量。d, j)比冲(mN*sec/mmgydF4y2Ba2gydF4y2Ba)归一化为P-CSa。e, k)激活速率(mN/秒)测量兴奋肌肉到峰值肌肉收缩的时间。f, l)兴奋刺激停止后到基线时间的弛豫速率(mN/sec)测量。每个条件N = 3-6只小鼠。多重比较的双向方差分析,*/#gydF4y2BapgydF4y2Ba< 0.05, * * / # #gydF4y2BapgydF4y2Ba< 0.01, * * * / # # #gydF4y2BapgydF4y2Ba< 0.001 , ****/####gydF4y2BapgydF4y2Ba< 0.0001。孤立的星号表示运动的方差分析组效应。孤立的磅符号表示辐射的方差分析群效应。数据显示为平均值+/- s.e.m。gydF4y2Ba
附加文件4:图S2gydF4y2Ba
.耐力训练不会增加辐射后的肌肉量。EDL(左)和比目鱼(右)。a) EDL和b)比目鱼肌的原始肌肉质量(mg),来自辐照小鼠对侧(Rad CL)和辐照(Rad RL)四肢,均为运动(跑步)和未运动(久坐)。每个条件下N = 11只小鼠。c, d)瘦肌肉质量(肌肉质量/体重),来自辐照小鼠对侧(Rad CL)和辐照(Rad RL)四肢,均为运动(跑步)和未运动(久坐)。每个条件下N = 11只小鼠。e) EDL的肌纤维横截面积(CSA); f)比目鱼肌。生物n=3只小鼠每个条件,技术gydF4y2BangydF4y2Ba数值直接显示在图表上,作为每个条件下测量的肌纤维数量。多重比较的双向方差分析,*gydF4y2BapgydF4y2Ba< 0.05, * * / # #gydF4y2BapgydF4y2Ba< 0.01, * * * / # # #gydF4y2BapgydF4y2Ba< 0.001 , ****/####gydF4y2BapgydF4y2Ba< 0.0001。孤立的星号表示运动的方差分析组效应。孤立的磅符号表示辐射的方差分析群效应。e)中EDL CSA分析变量间存在显著交互作用,gydF4y2BapgydF4y2Ba= 0.033。数据显示为平均值+/- s.e.m。gydF4y2Ba
附加文件5:图S3gydF4y2Ba
.运动使受辐射的肌肉适应钙的处理。a)未辐照(Rad CL)和辐照(Rad RL)久坐(Sed)和运动(VWR)肌肉的TA全肌肉蛋白裂解免疫印迹。b)从免疫印迹中定量PMCA和c) NCX的蛋白水平a). d) TA全肌肉蛋白裂解免疫印迹未辐照(Rad CL)和辐照(Rad RL)久坐和运动肌肉。e) SERCA和f) MCU蛋白水平的定量。d)所有蛋白水平归一化到GAPDH和未辐照(Rad CL)久坐对照组。除MCU外,各条件n = 3只小鼠,n = 6只。多重比较的双向方差分析。*gydF4y2BapgydF4y2Ba< 0.05, * *gydF4y2BapgydF4y2Ba< 0.01, * * *gydF4y2BapgydF4y2Ba< 0.001。孤立的星号表示运动的方差分析组效应。在d)中SERCA表达分析中,变量间存在显著交互作用。gydF4y2BapgydF4y2Ba= 0.017。数据显示为平均值+/- s.e.m。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
奥康纳,t.n.,卡伦巴赫,j.g.,奥丘奥利,H.M.gydF4y2Baet al。gydF4y2Ba耐力运动可减轻青少年辐照引起的骨骼肌功能衰退和线粒体应激。gydF4y2Ba骨骼肌gydF4y2Ba12gydF4y2Ba, 8(2022)。https://doi.org/10.1186/s13395-022-00291-ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13395-022-00291-ygydF4y2Ba
关键字gydF4y2Ba
- 辐射gydF4y2Ba
- 锻炼gydF4y2Ba
- 肌肉gydF4y2Ba
- 生理学gydF4y2Ba
- 钙处理gydF4y2Ba
- 氧化/ nitrosative压力gydF4y2Ba
- 线粒体gydF4y2Ba